Перейти к:
Результаты хирургического лечения обструктивного тромбоза протеза аортального клапана
https://doi.org/10.15829/1560-4071-2025-6214
EDN: SOYGOS
Аннотация
Цель. Сравнительный анализ результатов хирургического лечения обструктивного тромбоза протеза аортального клапана (АК).
Материал и методы. Проведен ретроспективный анализ медицинских карт больных с диагнозом тромбоз протеза АК за период с 2010 по 2023гг. В послеоперационном периоде у 49 пациентов был диагностирован тромбоз протезированного АК и выполнена повторная операция. Хранение и подсчет всех данных производился в SPSS 26 (2019г) и MS Excel, Word 2016г. Данные выражаются как средние значения, стандартные отклонения или медианы. Одномерный анализ проводился с использованием t-критерия Стьюдента для параметрических данных. Для непараметрических данных критерий Крускала-Уоллиса. Анализ выживаемости проводили с использованием метода Каплана-Мейера.
Результаты. Время искусственного кровообращения и время пережатия аорты при проведении тромбэктомии было достоверно ниже, чем у пациентов с репротезированием (84,5±65,1 мин, 130,6±36,3 мин, P<0,05 и 37,2±14,2 мин, 93,7±23,1 мин, P<0,05, соответственно). Среднее время нахождения в отделении реанимации при тромбэктомии составило 2,68±1,6 дня, при репротезировании 6,8±6,4 дня (P>0,05). В раннем и позднем послеоперационном периоде не выявлено различий в показателях максимального и среднего трансаортального градиентов у пациентов в обеих группах. Госпитальная летальность составила 14,3% (n=7). Операционная летальность составила 4,1% (n=2). Госпитальная летальность была выше в группе тромбэктомии, однако различия не были достоверными. Пятилетняя выживаемость при репротезировании АК составила 82%, в группе тромбэктомии — 70% с учетом госпитальной летальности.
Заключение. Результаты тромбэктомии протеза АК в раннем и позднем периоде сопоставимы с результатами репротезирования АК. Тромбэктомия представляет собой более быстрый и простой хирургический метод восстановления функции искусственного клапана сердца, по сравнению с его репротезированием. Выбор тактики хирургического вмешательства должен основываться на интраоперационной оценке клапана.
Ключевые слова
Для цитирования:
Сурков В.А., Князев Р.С., Давлетбаева А.И., Николаева И.Е., Щелоков М.В. Результаты хирургического лечения обструктивного тромбоза протеза аортального клапана. Российский кардиологический журнал. 2025;30(8):6214. https://doi.org/10.15829/1560-4071-2025-6214. EDN: SOYGOS
For citation:
Surkov V.A., Knyazev R.S., Davletbaeva A.I., Nikolaeva I.e., Shchelokov M.V. Outcomes of surgical treatment of obstructive prosthetic aortic valve thrombosis. Russian Journal of Cardiology. 2025;30(8):6214. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6214. EDN: SOYGOS
Аортальные пороки являются одними из наиболее распространенных среди клапанных заболеваний сердца. Несмотря на развитие реконструктивной хирургии, основным способом лечения аортальных пороков сердца остается протезирование клапана. Согласно отчету НМИЦ ССХ им. А. Н. Бакулева Минздрава России, в 2022г по поводу приобретенных пороков клапанов сердца протезирование клапанов проведено в 9850 случаях, реконструкция клапанов — в 4150 случаях [1].
Однако замена нативного клапана протезом создает возможность возникновения осложнений, которые требуют своевременной диагностики и специфического лечения. Общая частота обнаружения нарушений нормального функционирования протезов сердечных клапанов находится в интервале от 0,4 до 6,0% в год от общего количества выполненных кардиохирургических вмешательств на клапанах [2, 3].
Согласно рекомендациям ESC/EACTS по ведению пациентов с клапанной болезнью сердца 2021г, экстренное протезирование клапана рекомендуется при обструктивном тромбозе протеза у тяжелых пациентов без противопоказаний к хирургическому вмешательству. Также хирургическое вмешательство следует рассматривать в случае большого (>10 мм) необструктивного тромба протеза, который осложнился эмболией или сохраняется, несмотря на оптимальную антикоагуляцию [4, 5].
Тромбоз искусственного клапана является одной из основных причин его дисфункции, а клинические проявления варьируются от случайной визуализации до кардиогенного шока [6-8].
Репротезирование является технически сложной и в большинстве случаев экстренной операцией с высоким риском осложнений и смерти. Еще одним вариантом хирургического лечения является тромбэктомия [9-15]. Однако в современных рекомендациях по лечению тромбоза протезированного клапана информация о месте тромбэктомии в лечении данной тяжелой категории пациентов отсутствует.
Таким образом, представляется актуальным исследование по изучению результатов хирургического лечения тромбоза протеза аортального клапана (АК) методом тромбэктомии.
Цель работы: сравнительный анализ результатов хирургического лечения обструктивного тромбоза протеза АК.
Материал и методы
Проведен ретроспективный анализ медицинских карт больных, пролеченных в отделении кардиохирургии № 2 ГБУЗ РКЦ г. Уфа с диагнозом тромбоз протеза АК за период с 2010 по 2023 гг. В исследовании сравнивались данные дооперационного, интраоперационного и послеоперационного периодов пациентов с репротезированием и тромбэктомией протеза АК.
Статистический анализ. Хранение и подсчет всех данных производился в SPSS и MSExcel, Word 2016г. Данные выражаются как средние значения, стандартные отклонения или медианы, когда это необходимо. Одномерный анализ проводился с использованием t-критерия Стьюдента для параметрических данных. Для непараметрических данных критерий Крускала-Уолеса. Анализ выживаемости проводили с использованием метода Каплана-Мейера.
Исследование было выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации. Протокол исследования был одобрен этическими комитетам. До включения в исследование у всех участников было получено письменное информированное согласие.
Результаты
За период с января 2010г по декабрь 2023г в ГБУЗ РКЦ выполнено 2318 операций по протезированию АК механическим протезом и 352 операции биологическим протезом. Из них в послеоперационном периоде у 49 пациентов был диагностирован тромбоз протезированного АК и выполнена повторная операция: у 29 мужчин и у 20 женщин. 5 (10,2%) больным операция выполнялась трижды, т.к. в отдаленном периоде после тромбэктомии у них развился повторный тромбоз протеза АК (рис. 1).
Возраст пациентов с тромбозом протеза АК составил 24-83 лет (средний возраст 57,4±13,7 лет). В зависимости от тактики хирургического лечения тромбоза аортального протеза пациенты были разделены на две группы: первая группа — пациенты, которым было выполнено репротезирование АК (n=11), вторую группу составили 38 пациентов, которым была проведена тромбэктомия с протеза АК.
Временной интервал от первичной замены клапана до тромбоза протезированного клапана составил 57,3±48,5 мес. По временному промежутку ранний тромбоз (<30 дней после первой замены клапана) случился у 1 пациента (2,04%), поздние тромбозы — у 48 (97,96%) пациентов (табл. 1). Время между возникновением клинических проявлений до диагностики тромбоза АК составило: в первой группе 18,7±9,6 дней, а во второй группе 19,3±14,5 дней, P>0,05, что позволило нам косвенно судить о времени развития тромбоза протеза.
Показанием к первичному протезированию АК в первой группе служили: склеротический порок у 4 пациентов, двустворчатый АК — у 4 пациентов, ревматический порок — у 2 пациентов, инфекционный эндокардит — у 1 пациента. Во второй группе склеротический порок диагностирован у 20 пациентов, двустворчатый АК — у 5 пациентов, ревматический порок — у 8 пациентов, инфекционный эндокардит — у 5 пациентов (рис. 2).
В первой группе при первичной операции одному пациенту совместно с протезированием АК было выполнено протезирование митрального и пластика трикуспидального клапана, одному пациенту — коронарное шунтирование.
Во второй группе одному пациенту первично была выполнена операция Бенталла-Де Боно, одному пациенту, помимо протезирования АК, — миоэктомия по Морроу, одному больному — коррекция дефекта межжелудочковой перегородки, одному пациенту был имплантирован постоянный электрокардиостимулятор, двум пациентам проведено коронарное шунтирование.
При первоначальной замене клапанов использовались протезы отечественного производства Мединж, МИКС, ЛИКС, Роскардикс размерами от 19 мм до 27 мм (табл. 2).
В наше исследование включены пациенты с массивным тромбозом протеза АК, в 26,5% случаев (у 13 из 49 пациентов) тромбозу сопутствовал паннус. Кроме того, у большинства госпитализированных пациентов показатель международного нормализованного отношения (МНО) составил >1,3, что, согласно инструкции по медицинскому применению препарата, является противопоказанием к применению тканевого активатора плазминогена. В связи с вышеизложенным, во всех случаях было принято решение о хирургическом лечении без предварительного тромболизиса. Среднее время между установкой диагноза и хирургическим лечением составило 2-17 (2; 40) ч.
Основными клиническими проявлениями тромбоза протеза АК являлись одышка, которая отмечалась у 100% (11) пациентов первой группы и у 94,7% (36) пациентов второй группы, слабость (81,8% (9) и 65,8% (25) пациентов, соответственно) и синдром стенокардии (36,5% (4) и 34,2% (13) пациентов, соответственно).
Большинство пациентов в первой группе имели 2-3 функциональный класс (ФК) сердечной недостаточности (СН) по Нью-Йоркской ассоциации сердца (NYHA), а во 2 группе — 3-4 ФК. Более тяжелые стадии СН (2А, Б) и более высокий уровень ФК (3-4) чаще встречались в группе тромбэктомии.
При расчете EuroSCORE II пациенты обеих групп имели высокий риск летального исхода: в первой группе он составил 18,19±4,8%, во второй группе 21,9±9,7%, P>0,05.
Также первичными проявлениями тромбоза аортального протеза были: острое нарушение мозгового кровообращения (ОНМК) в бассейне правой задней мозговой артерии в 1 случае, тромбоэмболия в коронарные артерии у 2 пациентов, тромбоэмболия общей бедренной артерии у 2 пациентов. Все пациенты находились во 2 группе.
У 3 пациентов в первой группе и у 2 пациентов из второй группы до первичной замены клапана была постоянная форма фибрилляции предсердий. У одного пациента из группы тромбэктомии до протезирования нативного клапана случилась тромбоэмболия легочной артерии. Наличие в анамнезе факторов рис- ка венозного и артериального тромбозов (фибрилляция предсердий, тромбоэмболия лёгочной артерии, ОНМК), возможно, являлось дополнительным фактором риска тромбоза протеза АК.
Одному больному из первой и одному больному из второй группы до операции был имплантирован постоянный электрокардиостимулятор, после операции — одному больному из первой группы был также имплантирован постоянный электрокардиостимулятор, еще одному пациенту из первой группы был имплантирован кардиовертер-дефибриллятор.
В первой группе ОНМК до повторной операции развилось у 3 пациентов. В двух случаях возник ишемический инсульт, в одном — геморрагический. Во второй группе у 2 пациентов было выявлено ОНМК по ишемическому типу.
Из анамнеза было выяснено, что 15 пациентов по разным причинам прекратили прием варфарина. Причинами чаще служили забывчивость пациентов и опасения о вреде препарата. 12 пациентов принимали препарат, но не достигали целевых значений МНО и своевременно не корректировали дозировку варфарина. 22 пациента принимали варфарин в первоначально назначенной дозе и не контролировали уровень МНО (табл. 3).
В первой группе тромбоз протеза возникал у пациентов, которые регулярно принимали варфарин. Во второй группе пациенты в большей степени не соблюдали режим лечения, что привело к тромбозу. У большинства пациентов обеих групп наблюдалась недостаточная антикоагуляция, что характерно для возникновения тромбоза. Интересно отметить, что пациенты с длительным периодом жизни с искусственным клапаном сердца поступали с недостаточно частым контролем МНО, но при этом осознавали необходимость приема варфарина. Пациенты с небольшим опытом приема препарата сообщали о возможных побочных эффектах и самостоятельно прекращали его прием или забывали принимать, т.е. имели меньшую приверженность к лечению.
Средний уровень МНО при поступлении в стационар составил 1,8±0,68. У 8 человек показатель МНО находился в целевом диапазоне (2,0-3,0), 5 пациентов имели избыточную гипокоагуляцию (МНО >3,0), однако большинство — 36 пациентов, демонстрировали недостижение целевых уровней МНО (МНО <2,0).
Одному пациенту варфарин был временно отменен участковым врачом в связи с избыточно высоким значением МНО, в дальнейшем МНО не контролировалось.
Диагноз тромбоза искусственного клапана сердца был установлен при трансторакальной эхокардиографии у 5 (45,5%) пациентов в первой группе и 15 (39,5%) во второй группе, при чреспищеводной эхокардиографии: у 6 (54,5%) пациентов первой группы и 23 (60,5%) пациентов второй группы. По эхокардиографическим показателям до операции группы не имели значимых отличий (табл. 4).
Повторная срединная стернотомия была использована у 100% пациентов. При репротезировании АК в 10 случаях использовался центральный доступ для искусственного кровообращения (ИК), в 1 случае использовался периферический доступ для ИК.
В группе тромбэктомии в 32 случаях использовался центральный доступ для ИК, в 5 случаях использовался периферический доступ для ИК. После аортотомии и визуализации протеза АК принималось решение о тактике вмешательства. При тромбэктомии проводилось удаление тромбов с клапана, не задевая створок, затем проверка его функции. При репротезировании — иссечение тромбированного клапана и имплантация нового протеза. Паннус протеза встречался в первой группе в 7 случаях, во второй группе в 6 случаях. Первоначально предпринималась попытка выполнения иссечения паннуса, при невозможности достаточного иссечения производилась замена искусственного клапана (табл. 5).
Время ИК и время пережатия аорты при проведении тромбэктомии было достоверно ниже, чем у пациентов с репротезированием (84,5±65,1 мин 130,6±36,3 мин, P<0,05 и 37,2±14,2 мин 93,7±23,1 мин, P<0,05, соответственно), что может способствовать снижению операционного риска, связанного с ИК. Среднее время нахождения в отделении реанимации при тромбэктомии составило 2,68±1,6 дня, при репротезировании 6,8±6,4 дня (P>0,05).
В раннем послеоперационном периоде у 3 пациентов из первой группы и у 16 пациентов из второй группы отмечалось кровотечение, потребовавшее проведения рестернотомии и хирургического гемостаза в 3 и 6 случаях, соответственно (табл. 5).
В раннем послеоперационном периоде длительный период искусственной вентиляции был у 2 пациентов первой группы и у 5 пациентов второй группы. Острое почечное повреждение с необходимостью применения заместительной почечной терапии развилось у 2 пациентов первой группы и у 5 пациентов второй. Также в первой группе у 2 пациентов возникли субдуральные кровоизлияния без дислокационного синдрома. У одного пациента на 5-е сутки после тромбэктомии развился атеротромбоз верхней брыжеечной артерии, выполнена баллонная ангиопластика. У 4 пациентов второй группы развился пароксизм фибрилляции предсердий, купированный медикаментозно. Случаев стернальной инфекции и инфекции подкожной жировой клетчатки не наблюдалось.
В раннем и позднем послеоперационном периоде не отмечалось различий в показателях максимального и среднего трансаортального градиентов у пациентов в обеих группах (табл. 6).
Госпитальная летальность составила 14,3% (n=7). Смерть 1 (9,1%) пациента наступила через 10 дней после репротезирования АК от ОНМК по ишемическому типу, развившемуся в 1-е сутки после операции. 6 (15,7%) пациентов умерли после тромбэктомии. В 5 случаях причиной смерти была острая СН. Одному пациенту был выставлен диагноз новая коронавирусная инфекция, он был переведен в специализированный инфекционный стационар для профильного лечения, где на фоне поражения легких и декомпенсации кровообращения наступила смерть.
Операционная летальность составила 4,1% (2 пациента после тромбэктомии). Один из пациентов был прооперирован в остром периоде ишемического инсульта в бассейне задней мозговой артерии в связи с нарастанием явлений СН. Второй пациент был госпитализирован и экстренно прооперирован на фоне явлений острой левожелудочковой недостаточности. Причиной смерти обоих пациентов явилась острая СН и невозможность отхода от ИК.
Госпитальная летальность была выше в группе тромбэктомии что связано, вероятно, с более тяжелым клиническим состоянием и более выраженной недостаточностью кровообращения у пациентов перед операцией. Однако отличия не достигли критериев достоверности (табл. 7).
Информация о причинах смерти в позднем послеоперационном периоде получена из единой государственной информационной системы в сфере здравоохранения. Пятилетняя выживаемость при репротезировании АК составила 82% с учетом госпитальной летальности. В позднем послеоперационном периоде (2,9 лет) один пациент из первой группы умер в период пандемии новой коронавирусной инфекции от осложнений вирусной пневмонии.
В группе тромбэктомии пятилетняя выживаемость пациентов составила 70%. В позднем послеоперационном периоде одна пациентка скончалась из-за эмболии в правую коронарную артерию и развившегося инфаркта миокарда на фоне ретромбоза АК через 2,4 года после тромбэктомии (рис. 3-5).
Двое пациентов умерли от ОНМК по ишемическому типу в бассейне средней мозговой артерии. Первый пациент умер спустя 2 мес. после тромбэктомии, второй через 5,9 лет. Двое пациентов скончались от декомпенсации хронической СН через год после выполнения тромбэктомии.
Одна пациентка умерла в терапевтическом стационаре от бактериальной пневмонии и, возможно, развившегося сепсиса на фоне ВИЧ инфекции на пятом году после тромбэктомии.
Таблица 1
Клиническая характеристика пациентов
|
Признак |
Репротезирование, n (%) |
Тромбэктомия, n (%) |
P |
|
Количество пациентов |
11 (100%) |
38 (100%) |
|
|
Пол, n (%) |
|||
|
Мужской |
8 (72,7%) |
21 (55,3%) |
P>0,05 |
|
Женский |
3 (27,3%) |
17 (44,7%) |
P>0,05 |
|
Интервал между операциями, мес. |
57,3±48,5 |
||
|
Возраст на момент операции, лет |
57,4±13,7 |
||
|
Давность возникновения тромбоза, дни |
18,7±9,6 |
19,3±14,5 |
P>0,05 |
|
Этиология замены нативного клапана, n (%) |
|||
|
Двустворчатый АК |
4 (36,4%) |
5 (13,2%) |
P<0,05 |
|
Склеротический порок |
4 (36,4%) |
20 (52,6%) |
P<0,05 |
|
Ревматический порок |
2 (18,1%) |
8 (21%) |
P>0,05 |
|
Инфекционный эндокардит |
1 (9,1%) |
5 (13,2%) |
P>0,05 |
|
Фибрилляция предсердий, n (%) |
|||
|
До первичной операции (постоянная форма) |
3 (27,3%) |
2 (5,2%) |
P<0,05 |
|
После первичной операции (пароксизмальная форма) |
0 |
4 (10,5%) |
P>0,05 |
|
Стадия ХСН, n (%) |
|||
|
1 |
2 (18,2%) |
0 |
P<0,05 |
|
2А |
8 (72,7%) |
23 (60,5%) |
P>0,05 |
|
2Б |
1 (9,1%) |
15 (39,5%) |
P<0,05 |
|
3 |
0 |
0 |
|
|
Класс СН (NYHA), n (%) |
|||
|
1 |
0 |
0 |
|
|
2 |
2 (18,2%) |
0 |
P<0,05 |
|
3 |
6 (54,5%) |
25 (65,8%) |
P>0,05 |
|
4 |
3 (27,3%) |
13 (34,2%) |
P>0,05 |
|
Сопутствующая патология, n (%) |
|||
|
Гипертоническая болезнь |
9 (81,8%) |
32 (84,2%) |
P>0,05 |
|
Сахарный диабет 2 типа |
3 (27,3%) |
5 (13,2%) |
P<0,05 |
|
Атеросклероз ветвей дуги аорты |
2 (18,2%) |
7 (18,4%) |
P>0,05 |
|
Варикозная болезнь нижних конечностей |
1 (9,1%) |
6 (15,8%) |
P>0,05 |
|
Эпилепсия |
1 (9,1%) |
0 |
P<0,05 |
|
Хроническая обструктивная болезнь легких |
1 (9,1%) |
4 (10,5%) |
P>0,05 |
|
Тромбоэмболия легочной артерии |
0 |
1 (2,6%) |
P<0,05 |
|
Ожирение |
0 |
7 (18,4%) |
P<0,05 |
Сокращения: АК — аортальный клапан, СН — сердечная недостаточность, ХСН — хроническая сердечная недостаточность, NYHA — Нью-Йоркская ассоциация сердца.
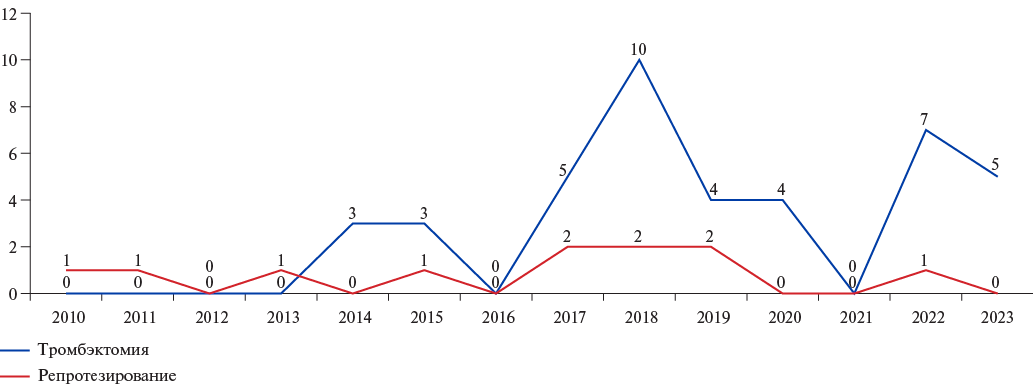
Рис. 1. Количество репротезирований и тромбэктомий протеза АК по годам.
Таблица 2
Клинические симптомы у пациентов с тромбозом аортального протеза
|
Репротезирование, n (%) |
Тромбэктомия, n (%) |
P |
|
|
Одышка |
11 (100%) |
36 (94,7%) |
P>0,05 |
|
Слабость |
9 (81,8%) |
25 (65,8%) |
P>0,05 |
|
Симптом стенокардии |
4 (36,4%) |
13 (34,2%) |
P>0,05 |
|
Учащенное сердцебиение |
1 (9,1%) |
4 (10,5%) |
P>0,05 |
|
Отек легких |
0 |
5 (13,2%) |
P<0,05 |
|
Периферические отеки |
2 (18,2%) |
3 (7,9%) |
P>0,05 |
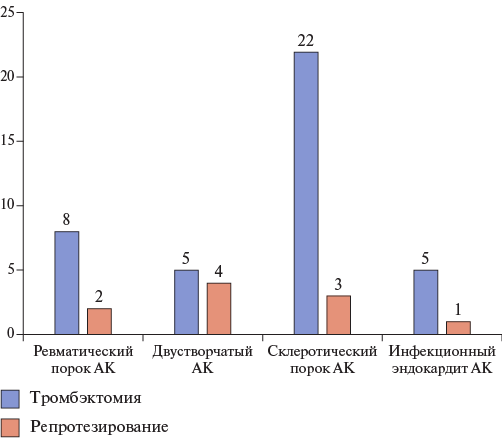
Рис. 2. Этиология порока при первичном протезировании АК.
Сокращение: АК — аортальный клапан.
Таблица 3
Антикоагулянтная терапия
|
Репротезирование, n (%) |
Тромбэктомия, n (%) |
P |
|
|
Исправный прием препарата |
6 (54,5%) |
7 (18,4%) |
P<0,05 |
|
Нарушение антикоагулянтной терапии |
1 (9,1%) |
9 (23,7%) |
P>0,05 |
|
Недостаточный контроль МНО |
3 (27,3%) |
10 (26,3%) |
P>0,05 |
|
Нарушение терапии и контроля |
1 (9,1%) |
12 (31,6%) |
P<0,05 |
|
МНО при поступлении, n (%) |
|||
|
<2 |
36 (73,5%) |
||
|
2-3 |
8 (16,3%) |
||
|
>3 |
5 (10,2%) |
||
Сокращение: МНО — международное нормализованное отношение.
Таблица 4
Дооперационные эхокардиографические данные пациентов
|
Показатель |
Репротезирование |
Тромбэктомия |
Р |
|
КДР ЛЖ, см |
5,76±0,8 |
5,13±0,45 |
P>0,05 |
|
КСР ЛЖ, см |
3,7±0,5 |
3,72±0,7 |
P>0,05 |
|
ФВ, % |
57±4,7 |
52,25±13 |
P>0,05 |
|
ГД АК макс., мм рт.ст. |
98±20,3 |
96,5±14,8 |
P>0,05 |
|
ГД АК ср., мм рт.ст. |
61,3±20,3 |
52,9±9,8 |
P>0,05 |
Сокращения: ГД АК макс. — максимальный градиент давления на АК, ГД АК ср. — средний градиент давления на АК, КДР ЛЖ — конечно-диастолический размер левого желудочка, КСР ЛЖ — конечно-систолический размер левого желудочка, ФВ — фракция выброса левого желудочка.
Таблица 5
Периоперационная характеристика пациентов
|
Репротезирование, n (%) |
Тромбэктомия, n (%) |
P |
|
|
Центральное ИК |
10 (90,9%) |
32 (84,2%) |
P>0,05 |
|
Периферическое ИК |
1 (9,1%) |
5 (13,2%) |
P>0,05 |
|
Доступ рестернотомия |
11 (100%) |
38 (100%) |
P>0,05 |
|
Наличие паннуса |
7 (63,6%) |
6 (15,8%) |
P<0,05 |
|
Время ИК |
130,6±36,3 |
84,5±65,1 |
P<0,05 |
|
Время окклюзии аорты |
93,7±23,1 |
37,2±14,2 |
P<0,05 |
|
Размер удаленного клапана, n (%) |
|||
|
19 мм |
2 (18,2%) |
4 (10,6%) |
P>0,05 |
|
21 мм |
3 (27,3%) |
11 (28,9%) |
P>0,05 |
|
23 мм |
5 (45,4%) |
14 (36,8%) |
P>0,05 |
|
25 мм |
1 (9,1%) |
8 (21,1%) |
P>0,05 |
|
27 мм |
– |
1 (2,6%) |
P<0,05 |
|
Тип клапана, n (%) |
|||
|
Двустворчатый |
6 (54,5%) |
37 (97,4%) |
P<0,05 |
|
Дисковый |
5 (45,5%) |
1 (2,6%) |
P<0,05 |
Сокращение: ИК — искусственное кровообращение.
Таблица 6
Эхокардиографические данные пациентов в раннем и позднем послеоперационном периоде
|
Ранний |
Поздний |
Р |
|||
|
Показатель |
Репротезирование |
Тромбэктомия |
Репротезирование |
Тромбэктомия |
|
|
КДР ЛЖ, см |
5,42±0,5 |
5,29±0,39 |
5,5±0,5 |
5,1±0,4 |
P<0,05 |
|
КСР ЛЖ, см |
3,9±0,6 |
3,75±0,6 |
3,8±0,6 |
3,5±0,5 |
P>0,05 |
|
ФВ, % |
57,8±9,6 |
55,69±8,9 |
57±9 |
58,5±9,4 |
P>0,05 |
|
ГД АК макс., мм рт.ст. |
24,75±6,3 |
25,6±7,5 |
25,3±7,5 |
24,1±7,5 |
P>0,05 |
|
ГД АК ср., мм рт.ст. |
13,9±3,3 |
15±4,3 |
15±4,5 |
13,4±4,5 |
P>0,05 |
Сокращения: ГД АК макс. — максимальный градиент давления на АК, ГД АК ср. — средний градиент давления на АК, КДР ЛЖ — конечно-диастолический размер левого желудочка, КСР ЛЖ — конечно-систолический размер левого желудочка, ФВ — фракция выброса левого желудочка.
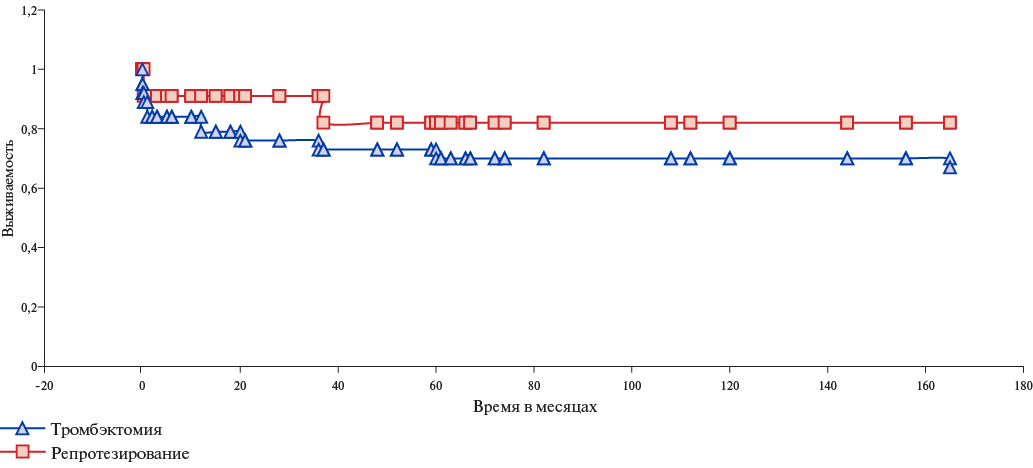
Рис. 3. Кривая выживаемости оперированных пациентов.
Таблица 7
Послеоперационные осложнения
|
Репротезирование, n (%) |
Тромбэктомия, n (%) |
P |
|
|
Кровотечения |
3 (27,3%) |
16 (42,1%) |
P>0,05 |
|
Рестернотомия, гемостаз |
1 (9,1%) |
6 (15,8%) |
P>0,05 |
|
Пароксизм фибрилляции предсердий |
0 |
4 (10,6%) |
P<0,05 |
|
Длительный период искусственной вентиляции легких |
2 (18,2%) |
5 (13,2%) |
P>0,05 |
|
Подключение заместительной почечной терапии |
2 (18,2%) |
5 (13,2%) |
P>0,05 |
|
Мезотромбоз |
0 |
1 (2,6%) |
P<0,05 |
|
Субдуральная гематома |
2 (18,2%) |
0 |
P<0,05 |
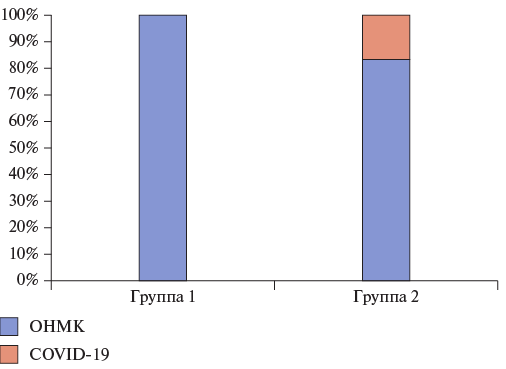
Рис. 4. Причины ранней послеоперационной летальности пациентов с тромбозом протеза АК.
Сокращения: ОНМК — острое нарушение мозгового кровообращения, COVID-19 — новая коронавирусная инфекция.
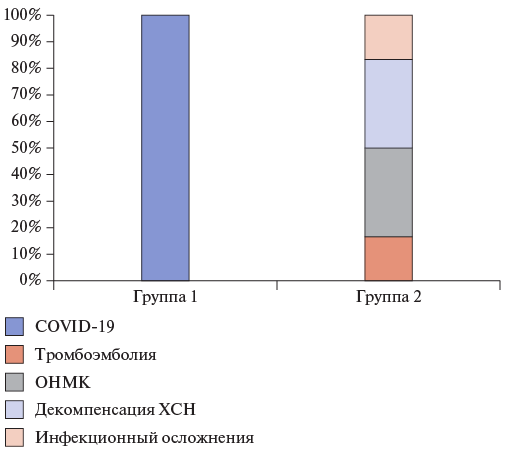
Рис. 5. Причины послеоперационной летальности пациентов с тромбозом протеза АК.
Сокращения: ОНМК — острое нарушение мозгового кровообращения, ХСН — хроническая сердечная недостаточность, COVID-19 — новая коронавирусная инфекция.
Обсуждение
Тромбоз протеза АК представляет собой серьёзное, потенциально смертельное осложнение после замены клапана. Клинические проявления могут сильно различаться — от случайной находки у бессимптомных пациентов до отека легких и смерти.
Тромбирование механического протеза возможно как вскоре после операции, так и в отдаленном периоде. Основным патогенетическим фактором тромбоза является субтерапевтическая антикоагуляция при несоблюдении пациентом предписанного режима антикоагулянтной терапии [9].
Трансторакальная эхокардиография является основным методом диагностики тромбоза протезированного клапана. В некоторых случаях, когда визуализация недостаточна, применяется чреспищеводная эхокардиография.
Основные варианты лечения включают тромболизис, хирургическое удаление тромба и репротезирование клапана, а также консервативную стратегию с использованием антикоагулянтной терапии.
Выбор тактики лечения тромбоза механического протеза клапана сердца требует индивидуального подхода и учитывает несколько факторов, включая локализацию тромба, его размер, клинические проявления и общее состояние пациента [9]. Также важную роль в определении оптимальной стратегии лечения имеет клинический и хирургический опыт конкретных медицинских учреждений.
Действующие рекомендации Европейского общества кардиологов по клапанной болезни сердца 2021г содержат рекомендации класса I для хирургического лечения обструктивного тромбоза механического протеза у пациентов в критическом состоянии без серьезных сопутствующих заболеваний. Тромболизис (с использованием рекомбинантного тканевого активатора плазминогена или стрептокиназы) следует рассматривать при тромбозах протезов правых камер сердца или когда операция имеет очень высокий риск или недоступна [4].
В 2022г опубликованы результаты исследования HATTUSHA, включающего 158 пациентов с обструктивным тромбозом клапанов из 8 центров: 75 пациентам проведена повторная операция по тромбэктомии или замене клапана, 83 пациентам проведена медленная и/или сверхмедленная инфузия тканевого активатора плазминогена. Успешное снятие тромботической обструкции при тромболитической терапии было достигнуто в 90,4% случаях, что также сопровождалось более низкой 3-мес. смертностью (2,4% vs 18,7%), сниженными рисками сильного кровотечения (2,4% vs 9,3%), тромбоэмболии (2,4% vs 5,3%), а также рецидива тромбоза (2,4% vs 6,7%) по сравнению с повторной операцией. В заключении авторы говорят о необходимости проведения крупных рандомизированных исследований, сравнивающих тромболизис и хирургическое лечение у пациентов с тромбозом механических клапанов сердца [9, 16].
Однако хирургическое вмешательство неизбежно в случаях организованных тромбов, при наличии паннуса, а также при противопоказаниях к тромболизису.
Основной хирургической методикой лечения тромбоза механического клапана в настоящее время признано его репротезирование. Эта операция имеет значительные технические сложности и сопровождается длительным ИК. В процессе операции возможны серьезные повреждения окружающих тканей, таких как фиброзное кольцо, межжелудочковая перегородка и параклапанные структуры, что увеличивает риск фатальных кровотечений. Длительное использование аппарата ИК само по себе становится независимым фактором риска послеоперационных осложнений, включая развитие инсульта и респираторных нарушений, которые, в свою очередь, повышают риск летальности [14]. Показатели послеоперационной смертности при хирургическом лечении тромбоза механического клапана сердца колеблются от 4,7 до 17,5% [9].
Альтернативой репротезированию является методика тромбэктомии, однако в доступной литературе имеются немногочисленные публикации в рамках описания случая или серии случаев, а также отсутствуют исследования, сравнивающие две эти хирургические методики [6, 10]. Преимуществом тромбэктомии может быть исключение этапа удаления ранее имплантированного протеза, что сокращает интракардиальный этап операции, а также исключает риски повреждения параклапанных структур сердца.
В связи с вышеизложенным, нам представляется актуальным совершенствование хирургических способов устранения тромбозов клапанов сердца, направленных на минимализацию травматичности и продолжительности повторных вмешательств на сердце, что должно привести к улучшению результатов хирургического лечения данного тяжелого контингента больных.
Ограничениями нашего исследования являлось малое число наблюдений и неоднородность групп, что определяет необходимость продолжения наблюдения.
Заключение
Результаты тромбэктомии протеза АК в раннем и позднем периоде сопоставимы с результатами репротезирования АК. Тромбэктомия представляет собой более быстрый и простой хирургический метод восстановления функции искусственного клапана сердца, по сравнению с его репротезированием. Исходя из нашего опыта, тромбэктомию можно рассматривать как операцию, альтернативную репротезированию для пациентов с высоким хирургическим риском. Выбор тактики хирургического вмешательства должен основываться на интраоперационной оценке состояния клапана.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Бокерия Л. А., Милиевской Е. Б., Прянишникова В. В. Сердечнососудистая хирургия-2022: болезни и врожденные аномалии системы кровообращения. М.: ФГБУ НМИЦ ССХ им. А. Н. Бакулева, 2023. с. 344. ISBN: 978-5-7982-0451-9.
2. Шатов Д. В., Захарьян Е. А. Тромбоз протезов клапанов сердца: эпидемиология, этиология и патогенез. Крымский журнал экспериментальной и клинической медицины. 2017;7:155-9. EDN: ZCPXJP.
3. Aluru JS, Barsouk A, Saginala, K, et al. Valvular Heart Disease Epidemiology. Med. Sci. 2022;10:32. doi:10.3390/medsci10020032.
4. Рекомендации ESC/EACTS по ведению пациентов с клапанной болезнью сердца. Российский кардиологический журнал. 2022;27(7):5160. doi:10.15829/1560-4071-2022-5160.
5. Dürrleman N, Pellerin M, Bouchard D, et al. Prosthetic valve thrombosis: twenty-year experience at the Montreal Heart Institute. J. Thorac. Cardiovasc. Surg. 2004;127(5):1388-92. doi:10.1016/j.jtcvs.2003.12.013.
6. Ostrowski S, Marcinkiewicz A, Kośmider A, et al. Artificial aortic valve dysfunction due to pannus and thrombus — different methods of cardiac surgical management. Kardiochir Torakochirurgia Pol. 2015;12(3):199-203. doi:10.5114/kitp.2015.54453.
7. Gürsoy MO, Kalçık M, Yesin M, et al. A global perspective on mechanical prosthetic heart valve thrombosis: Diagnostic and therapeutic challenges. Anatol. J. Cardiol. 2016;16(12):980-9. doi:10.14744/Anatol.J.Cardiol.2016.7486.
8. Tadesse KD, Gebru M, Tekleab AM. Treatment outcome of patients with prosthetic stuck valves at the Cardiac Center of Ethiopia. PLoS ONE. 2023;18(4): e0284652. doi:10.1371/journal.pone.0284652.
9. Soria Jiménez CE, Papolos AI, Kenigsberg BB, et al. Management of Mechanical Prosthetic Heart Valve Thrombosis: JACC Review Topic of the Week. J. Am. Coll. Cardiol. 2023;81(21):2115-27. doi:10.1016/j.jacc.2023.03.412.
10. Kale SB, Saksena DS, Agnihotri YC, et al. Thrombectomy with disc rotation of medtronic valves. Asian Cardiovasc Thorac. Ann. 2003;11(4):309-13. doi:10.1177/021849230301100408.
11. Musumeci L, Jacques N, Hego A, et al. Prosthetic Aortic Valves: Challenges and Solutions. Front Cardiovasc Med. 2018;5:46. doi:10.3389/fcvm.2018.00046.
12. Лепилин М.А., Богачев-Прокофьев А.В., Жульков М.О. Структурная эволюция механических моделей искусственных клапанов сердца (обзор). Вестник трансплантологии и искусственных органов. 2024;26(1):178-90. doi:10.15825/1995-1191-2024-1-178-190.
13. Ivaniv Y. Echocardiographic evaluation of heart valve prosthetic dysfunction. Heart vessels and transplantation 2018;2(1):10-6. doi:10.24969/hvt.2017.46.
14. Клышников К. Ю., Овчаренко Е. А., Стасев А. Н. Повторное протезирование клапанов сердца: подходы и устройства (обзор литературы). Кардиоваскулярная терапия и профилактика. 2023;22(2):3377. doi:10.15829/1728-8800-2023-3377.
15. Новоселова А. А., Якушин С. С. Тромбоз механического клапана сердца: трудности диагностики на примере клинического случая с летальным исходом. Рациональная Фармакотерапия в Кардиологии. 2020;16(3):399-403. doi:10.20996/1819-6446-2020-06-13.
16. Schaff HV. Progress in Management of Mechanical Valve Thrombosis. J Am Coll Cardiol. 2022;15;79(10):990-2. doi:10.1016/j.jacc.2022.01.008.
Об авторах
В. А. СурковРоссия
Владимир Анатольевич Сурков — д.м.н., зав. отделением кардиохирургии № 2, врач сердечно-сосудистый хирург
Уфа
Р. С. Князев
Россия
Рустем Сергеевич Князев — врач стажер кардиохирургического отделения № 2
Уфа
А. И. Давлетбаева
Россия
Альмира Ильдаровна Давлетбаева — к.м.н., врач кардиолог кардиохирургического отделения № 2
Уфа
И. Е, Николаева
Николаева Ирина Евгеньевна — к.м.н., главный врач
Уфа
М. В. Щелоков
Максим Владимирович Щелоков — врач сердечносо-судистый хирург кардиохирургического отделения № 2
Уфа
Дополнительные файлы
- Погрешности в антикоагулянтной терапии являются основной причиной тромбоза искусственного клапана сердца.
- Результаты тромбэктомии сопоставимы с результатами репротезирования.
- Выполнение тромбэктомии можно рассматривать как операцию выбора у пациентов с высоким хирургическим риском.
Рецензия
Для цитирования:
Сурков В.А., Князев Р.С., Давлетбаева А.И., Николаева И.Е., Щелоков М.В. Результаты хирургического лечения обструктивного тромбоза протеза аортального клапана. Российский кардиологический журнал. 2025;30(8):6214. https://doi.org/10.15829/1560-4071-2025-6214. EDN: SOYGOS
For citation:
Surkov V.A., Knyazev R.S., Davletbaeva A.I., Nikolaeva I.e., Shchelokov M.V. Outcomes of surgical treatment of obstructive prosthetic aortic valve thrombosis. Russian Journal of Cardiology. 2025;30(8):6214. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6214. EDN: SOYGOS

















































