Перейти к:
Роль сцинтиграфии миокарда с 99mTc-пирофосфатом в оценке эффективности терапии тафамидисом на примере серии клинических случаев
https://doi.org/10.15829/1560-4071-2025-6200
EDN: XSICKB
Аннотация
Введение. Последние годы увеличивается число выявленных пациентов с транстиретиновой амилоидной кардиомиопатией. В качестве патогенетической терапии в России зарегистрирован единственный препарат — тафамидис. На сегодняшний день не существует единого протокола в оценке прогрессирования заболевания, а роль сцинтиграфии с фосфатными комплексами в существующих документах не отражена из-за отсутствия убедительной доказательной базы.
Краткое описание. В статье представлена серия клинических примеров пациентов, принимавших терапию тафамидисом не менее 12 мес. На фоне терапии отмечалось отсутствие признаков прогрессирования заболевания, а в некоторых случаях по данным сцинтиграфии миокарда с фосфатными комплексами было отмечено уменьшение степени накопления радиофарм-препарата в миокарде.
Дискуссия. Обсуждена роль сцинтиграфии миокарда с фосфатными комплексами как метода мониторинга эффективности терапии тафамидисом.
Для цитирования:
Шошина А.А., Аншелес А.А., Насонова С.Н., Жиров И.В., Сергиенко В.Б., Терещенко С.Н. Роль сцинтиграфии миокарда с 99mTc-пирофосфатом в оценке эффективности терапии тафамидисом на примере серии клинических случаев. Российский кардиологический журнал. 2025;30(1):6200. https://doi.org/10.15829/1560-4071-2025-6200. EDN: XSICKB
For citation:
Shoshina A.A., Ansheles A.A., Nasonova S.N., Zhirov I.V., Sergienko V.B., Tereshchenko S.N. Role of 99mTc-pyrophosphate myocardial scintigraphy in assessing the efficiency of tafamidis therapy: a case series. Russian Journal of Cardiology. 2025;30(1):6200. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6200. EDN: XSICKB
Введение
Число случаев выявления транстиретиновой амилоидной кардиомиопатии (ATTR-АКМП) за последние годы стремительно увеличивается, однако реальная распространенность заболевания остается достоверно неизвестной в мире и в России.
В 2024г был опубликован ряд работ, посвященных АКМП. По данным Никифоровой Т. В. и др. (2024), среди пациентов в возрасте ≥65 лет с гипертрофией левого желудочка (ЛЖ) (толщина межжелудочковой перегородки (МЖП) ≥14 мм, n=60) АКМП выявлена в 20% случаев (n=12), среди них 5 случаев (8,3%) AL-амилоидоза и 7 случаев (11,7%) ATTR-амилоидоза [1]. Согласно данным Экспертного центра по амилоидозу сердца ФГБУ "НМИЦ кардиологии им. акад. Е. И. Чазова" Минздрава России, среди 152 пациентов с подозрением на АКМП за период 2021-2023гг у 63 пациентов подтвержден диагноз. Среди всех подтвержденных случаев АКМП у 36 (57,1%) пациентов типирован AL-амилоидоз, у 25 (39,7%) — ATTR-амилоидоз, у 2 (3,2%) — AA-амилоидоз с поражением сердца [2].
Среди причин увеличения выявляемости ATTR-АКМП немаловажную роль сыграло появление комплексного протокола неинвазивной диагностики амилоидоза и внедрение в рутинную практику радиоизотопных методов диагностики [3].
Другой причиной повышенного интереса к ATTR-АКМП стала регистрация в России селективного стабилизатора транстиретина — тафамидиса, применение которого может влиять не только на прогноз пациентов, но и улучшать качество жизни. В 2021г были представлены результаты завершившегося исследования ATTR-ACT, в которое был включен 441 пациент, рандомизированный 2:1:2 в группы приема тафамидиса 80 мг, 20 мг и плацебо в течение 30 мес. Прием тафамидиса в обеих группах (80 и 20 мг) приводил к статистически значимому снижению летальности от всех причин и числа госпитализаций по причине сердечно-сосудистых событий в сравнении с плацебо (p=0,003 и p=0,004, соответственно). Помимо этого, в сравнении с плацебо при приеме 80 мг тафамидиса наблюдалось значимое снижение концентрации N-концевого промозгового натрийуретического пептида (NT-proBNP) (-2587,5±570,6 пг/мл, p<0,01), увеличение толерантности к физическим нагрузкам по результатам теста с шестиминутной ходьбой (ТШХ) (75,8±10,7 м, p<0,01), а также улучшение качества жизни по результатам Канзасского опросника для пациентов с кардиомиопатией (13,5±2,2 балла, p<0,01) [4].
Оценка эффективности терапии тафамидисом
ATTR-АКМП — заболевание с крайне высокой степенью летальности. К сожалению, из-за трудностей ранней диагностики и малой осведомленности специалистов диагноз пациентам устанавливается несвоевременно. Поэтому пациентов, получающих патогенетическую терапию тафамидисом, крайне мало. В настоящее время доказательных данных, касающихся мониторинга прогрессирования ATTR-АКМП, недостаточно.
Точкой опоры служит консенсусный документ 2021г по наблюдению пациентов с ATTR-АКМП. В нем установлено, что параметрами, изменяющимися по мере прогрессирования заболевания, являются: 1) число госпитализаций, связанных с сердечно-сосудистыми событиями; 2) функциональный статус (класс сердечной недостаточности, проходимая дистанция согласно ТШХ), 3) качество жизни; 4) лабораторные маркеры (NT-proBNP, высокочувствительный тропонин); 5) стадия АКМП; 6) данные визуализирующих методик исследования (электрокардиография (ЭКГ)/холтеровское мониторирование ЭКГ (ХМ-ЭКГ)/эхокардиография (ЭхоКГ)) [5]. Авторы документа подчеркивают важность сцинтиграфии миокарда (СМ) в ранней диагностике ATTR-АКМП, но, к сожалению, роль СМ с фосфатными комплексами (в частности, с 99mTc-пирофосфатом, PYP) в оценке прогрессирования заболевания не отражена из-за отсутствия убедительной доказательной базы.
Нам представляется интересным продемонстрировать важность радиоизотопных методов диагностики в мониторировании пациентов, получающих патогенетическую терапию тафамидисом на фоне нескольких клинических примеров.
Пример 1. Пациент К., 77 лет
В анамнезе длительная артериальная гипертензия, сахарный диабет II типа. В 2016г в связи с клиникой стенокардии напряжения выполнена коронароангиография (КАГ), выявлен гемодинамически значимый стеноз передней нисходящей артерии с последующим стентированием. С целью снижения рисков сердечно-сосудистых осложнений получал терапию клопидогрелом 75 мг/сут., розувастатином 20 мг/сут. В 2021г зарегистрирован впервые пароксизм фибрилляции предсердий, в связи с чем была инициирована антиаритмическая терапия соталолом в дозе 80 мг/сут. с положительным эффектом, а также антикоагулянтная терапия ривароксабаном 20 мг/сут.
С 2022г появилась одышка при физических нагрузках, в связи с чем в декабре этого же года был госпитализирован в кардиологический стационар. При госпитализации признаков отечного синдрома, явлений декомпенсации хронической сердечной недостаточности (ХСН) не было. На ЭКГ были зарегистрированы нарушения проводимости сердца по типу внутрижелудочковой блокады и атриовентрикулярной блокады I степени. При ЭхоКГ обращало на себя внимание утолщение МЖП и задней стенки (ЗС) ЛЖ до 18 мм, диастолическая дисфункция по рестриктивному типу, фракция выброса (ФВ) ЛЖ 48%, систолическое давление в легочной артерии (СДЛА) 37 мм рт.ст. NT-proBNP 3104 пг/мл. Инициирована терапия сердечной недостаточности — дапаглифлозин 10 мг/сут., эплеренон 25 мг/сут., периндоприл 4 мг/сут.
В связи с подозрением на амилоидоз выполнена биопсия миокарда, выявлены амилоидные накопления. Пациенту проведена СМ с 99mTс-PYP, в результате получены сцинтиграфические признаки высокоинтенсивного захвата радиофармпрепарата (РФП) в миокарде ЛЖ и правого желудочков (ПЖ), grade 3 по шкале Perugini. При молекулярно-генетическом исследовании патогенных или условно-патогенных мутаций в гене TTR не выявлено. На основании проведенного обследования был установлен диагноз ATTR-АКМП, "дикого типа". С июня 2023г начата терапия тафамидисом в дозе 61 мг/сут.
Пациент повторно обследован через 1 год от начала патогенетической терапии ATTR-АКМП. Субъективно отметил улучшение состояния в виде уменьшения одышки, увеличения толерантности к физическим нагрузкам. Клинически появились симптомные эпизоды снижения артериального давления до 60/40 мм рт.ст., что потребовало отмены терапии ингибиторами ангиотензинпревращающего фермента.
За прошедший год госпитализаций по поводу декомпенсации ХСН не было. Функциональный статус без отрицательной динамики — дистанция ТШХ увеличилась (437 м — >501 м), функциональный класс ХСН прежний (2). NT-proBNP значимо снизился до 75,1 пг/мл.
По данным ЭхоКГ без отрицательной динамики — объем полостей сердца, СДЛА, ФВ ЛЖ, толщина МЖП — без изменений. Отмечается уменьшение толщины ЗС ЛЖ (18 мм — >15,5 мм). По данным ХМ-ЭКГ отмечается прогрессирование нарушений ритма сердца — выявлено трепетание предсердий с различным проведением (2:1, 3:1, 4:1, 5:1, 6:1) со средней частотой сердечных сокращений 64 уд./мин, что потребовало отмены терапии соталолом.
Отдельный интерес представляют результаты СМ. На фоне специфической терапии наблюдается положительная динамика в плане уменьшения отношения сердце/контралатеральная сторона (H/Cl) с 1,69 до 1,47 (рис. 1), а также снижение уровня grade по данным однофотонной эмиссионной компьютерной томографии, синхронизированной с компьютерной томографией (ОЭКТ/КТ), до уровня 1-2 (рис. 1).
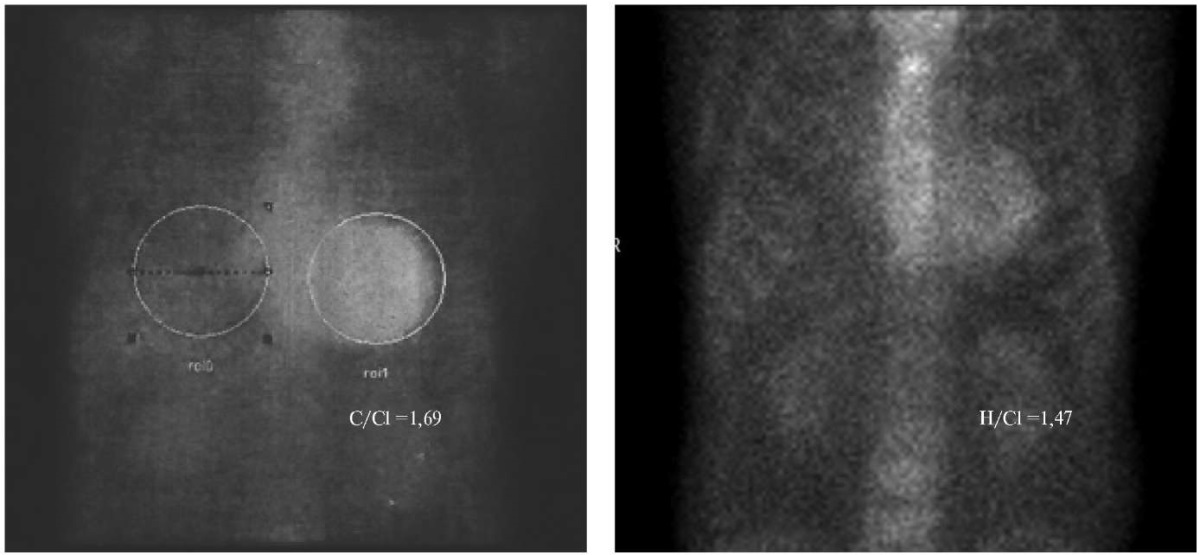
Рис. 1. Данные планарной сцинтиграфии пациента К., исходно и через 12 мес. приема тафамидиса.
Примечание: отмечается уменьшение уровня накопления 99mTс-PYP в миокарде ЛЖ (H/Cl 1,69 — >1,47).
Пример 2. Пациент Ш., 86 лет
Пациент с длительным анамнезом артериальной гипертензии, первичной надпочечниковой недостаточностью. В 2018г выполнена КАГ, выявлено пограничное стенозирование коронарных артерий (стеноз до 70% в устье диагональной артерии, диаметр артерии <2 мм, стеноз до 50% артерии тупого края). По данным ЭхоКГ диагностирован стеноз устья аорты умеренной степени, на тот момент времени показаний к хирургической коррекции порока сердца не было. В 2019г появилась одышка при физических нагрузках.
В 2022г по данным ЭхоКГ диагностирован стеноз устья аорты тяжелой степени (AVA 0,7 см²). В рамках предоперационной подготовки повторно проведена КАГ — исследование без динамики в сравнении с 2018г, показаний к реваскуляризации коронарных артерий не было. В дальнейшем выполнено транскатетерное протезирование аортального клапана. В раннем послеоперационном периоде у пациента развилась блокада левой ножки пучка Гиса, а также острое нарушение мозгового кровообращения в бассейне правой среднемозговой артерии. Проходил курс нейрореабилитации. В целом после операции до весны 2023г чувствовал себя удовлетворительно. С весны 2023г — неоднократные повторные декомпенсации ХСН. В течение длительного времени принимал терапию бисопрололом 2,5 мг/сут., эплереноном 25 мг/сут., торасемидом 20 мг/сут., ацетилсалициловой кислотой 100 мг/сут., розувастатином 20 мг/сут.
При повторном ЭхоКГ исследовании обратила на себя внимание зернистость миокарда, утолщение МЖП до 20 мм, выполнена speckle-tracking ЭхоКГ — выявлен паттерн, характерный для амилоидоза сердца. NT-proBNP 4123 пг/мл. Проведена СМ с 99mTс-PYP — соотношение накопления РФП в миокарде относительно накопления в контралатеральной зоне 1,6, при оценке сцинтиграмм в ОЭКТ/КТ режиме визуализируется выраженное накопление РФП во всем миокарде ЛЖ и ПЖ, grade 3. По данным молекулярно-генетического исследования патогенных и условно-патогенных мутаций в гене TTR выявлено не было. Согласно малоинвазивному алгоритму диагностики в июне 2023г пациенту была диагностирована ATTR-АКМП "дикого типа", показаний для проведения эндомиокардиальной биопсии не было. Начата терапия тафамидисом в дозе 61 мг/сут.
Контрольные обследования проведены через 1 год наблюдения. За прошедший год госпитализаций по поводу декомпенсации ХСН не было. Клинически отмечает улучшение состояния. Зафиксирована бессимптомная ортостатическая гипотензия по данным длительной пассивной ортопробы. Функциональный статус без значимой динамики, проведение ТШХ не представлялось возможным, т. к. активность ограничена патологией опорно-двигательного аппарата (пациент передвигается с дополнительной опорой). Отмечалось снижение уровня NT-proBNP с 4123 пг/мл до 3128 пг/мл. По данным ЭхоКГ без отрицательной динамики — объем полостей сердца, СДЛА, ФВ ЛЖ, толщина МЖП, толщина ЗС ЛЖ — без изменений. По данным ХМ-ЭКГ сохраняется частая наджелудочковая экстрасистолия, внутрижелудочковая блокада, иных нарушений ритма сердца и проводимости не выявлено.
По данным СМ через 12 мес. после приема тафамидиса отмечается положительная динамика в виде незначительного уменьшения интенсивности накопления РФП в миокарде, H/Cl 1,53. При оценке сцинтиграмм в ОЭКТ/КТ режиме визуализируется накопление РФП во всем миокарде ЛЖ и ПЖ, Grade 2-3 (рис. 2, 3).
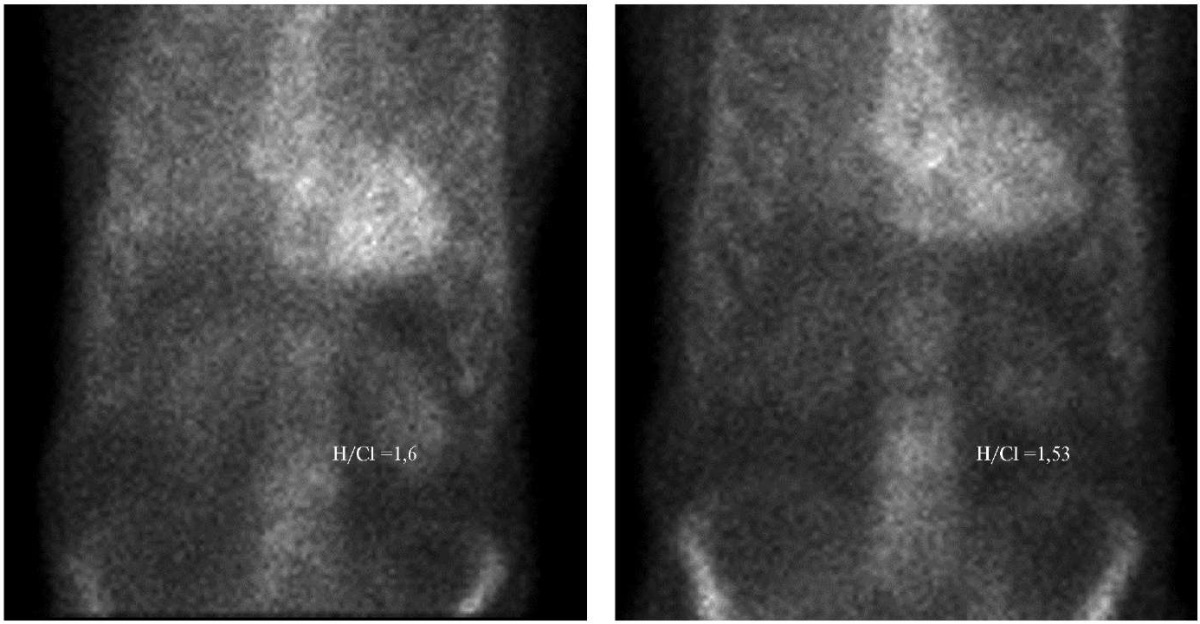
Рис. 2. Данные планарной сцинтиграфии пациента Ш. исходно и через 12 мес. приема тафамидиса.
Примечание: отмечается уменьшение уровня накопления 99mTс-PYP в миокарде ЛЖ (H/Cl 1,6 — >1,53).
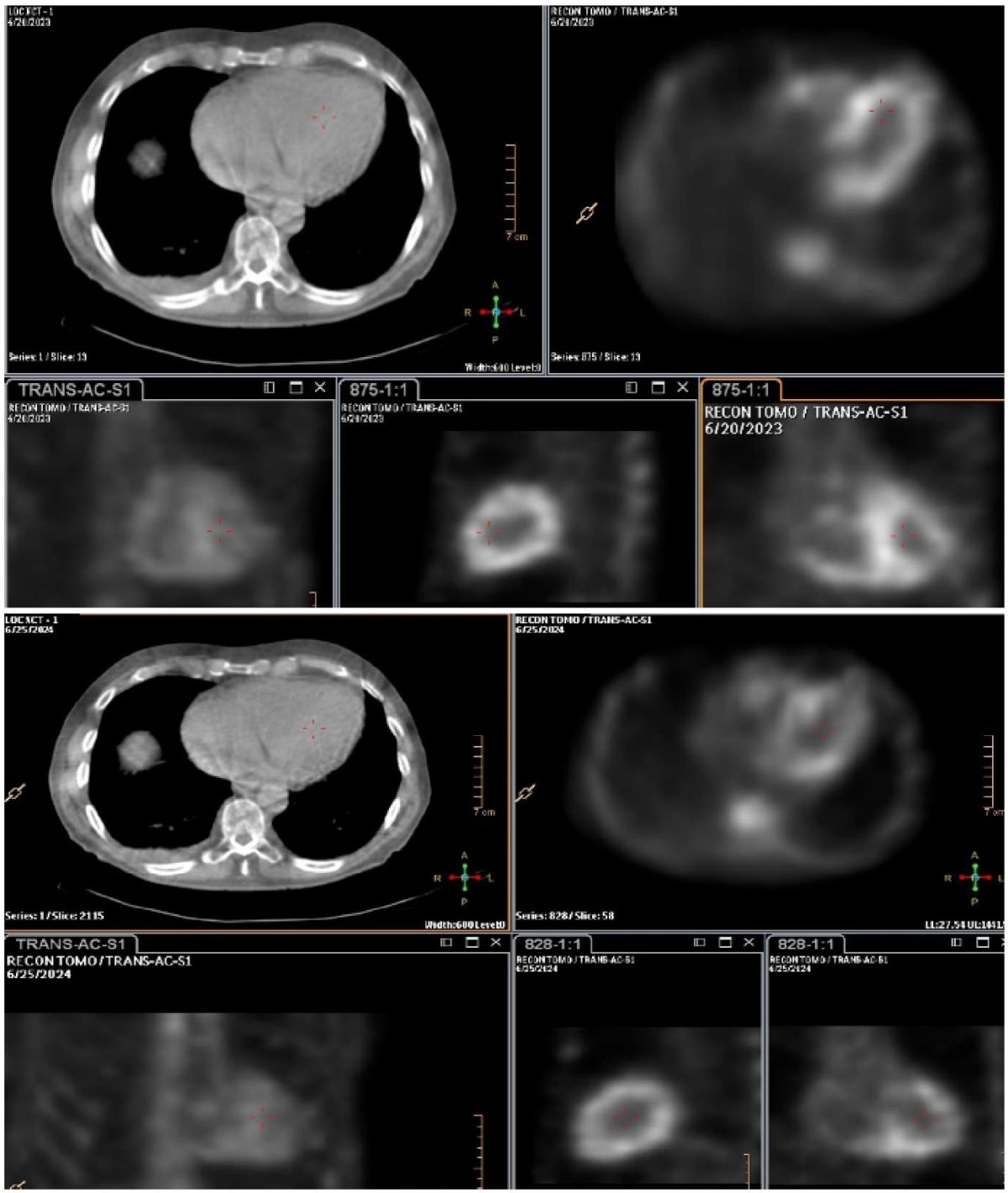
Рис. 3. Данные ОЭКТ/КТ пациента Ш. исходно (Grade 3) и через 12 мес. после приема тафамидиса (Grade 2-3).
Пример 3. Пациент К., 66 лет
В 2013г впервые отметил появление одышки при физических нагрузках, при обследовании зарегистрирован пароксизм фибрилляции предсердий. Рекомендовано проведение радиочастотной аблации, от чего пациент отказался. В 2015г появились отеки нижних конечностей, постепенно стала прогрессировать одышка при физических нагрузках. В 2018г стали беспокоить эпизоды головокружения, появилось ощущение "ватных ног". В 2020г пациент отметил появление частой диареи, на фоне чего потерял в весе около 10-12 кг за 2 года. В 2023г — неоднократные декомпенсации ХСН. Принимал терапию торасемидом 10 мг/сут., спиронолактоном 25 мг/сут., ривароксабаном 20 мг/сут.
При ЭхоКГ выявлено утолщение МЖП и ЗС ЛЖ до 22 мм, ФВ ЛЖ 52%, СДЛА 48 мм рт.ст. NT-proBNP 8998 пг/мл. Выполнена МРТ с контрастированием гадолинием — отмечается трансмуральное и частичное субэндокардиальное диффузное накопление контрастного вещества стенками ЛЖ и ПЖ, характерное для болезней накопления. По данным СМ — соотношение накопления РФП в миокарде относительно накопления в контрлатеральной зоне (H/Cl) — 1,8. При оценке сцинтиграмм в ОЭКТ/КТ режиме визуализируется выраженное накопление РФП во всем миокарде ЛЖ, grade 3. По данным молекулярно-генетического исследования в гене TTR выявлен патогенный вариант p.D58А. Пациенту был установлен диагноз ATTR-АКМП, генетически обусловленный вариант. С марта 2023г была начата терапия тафамидисом 61 мг.
Через 1 год проведены контрольные обследования. За прошедший год госпитализаций по поводу декомпенсации ХСН не было. Субъективно состояние без значимой динамики, сохраняется выраженная одышка при физических нагрузках. Функциональный статус без отрицательной динамики — проходимая дистанция по результатам ТШХ без изменений, малая дистанция обусловлена явлениями полинейропатии (82 м — >100 м). Функциональный класс ХСН прежний (3). NT-proBNP снизился — с 8998 пг/мл до 7133 пг/мл.
По данным ЭхоКГ наблюдается отрицательная динамика в виде прогрессирования утолщения миокарда желудочков (толщины МЖП 2,2 — >2,8 см, ЗС ЛЖ 2,2 — >2,4 см), уменьшения полостей правых камер сердца, усугубления диастолической функции. ФВ ЛЖ 52% — без динамики.
В то же время по данным СМ — соотношение накопления РФП в миокарде относительно накопления в контрлатеральной зоне (H/Cl) — 1,6. При оценке сцинтиграмм в ОЭКТ/КТ режиме визуализируется накопление РФП во всем миокарде ЛЖ, незначительно превышающее уровень накопления в костях скелета, grade 2-3, уменьшение объема плеврального выпота. По сравнению с данными от 2023г — положительная динамика (рис. 4, 5).
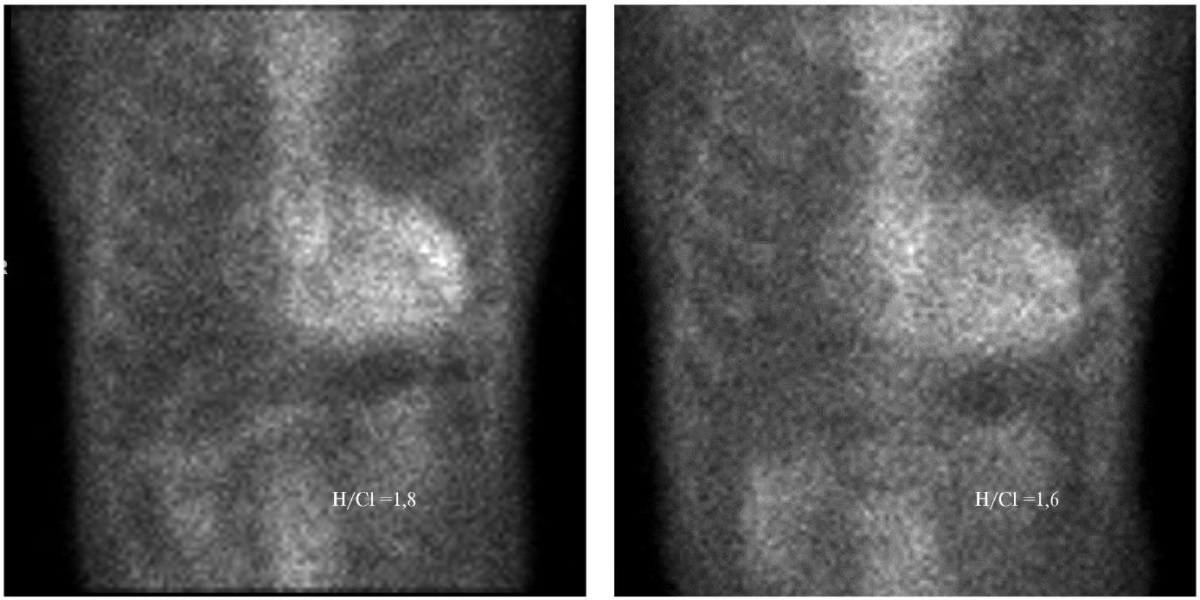
Рис. 4. Данные планарной сцинтиграфии пациента К. исходно и через 12 мес. приема тафамидиса.
Примечание: отмечается уменьшение уровня накопления 99mTс-PYP в миокарде ЛЖ (H/Cl 1,8 — >1,6).
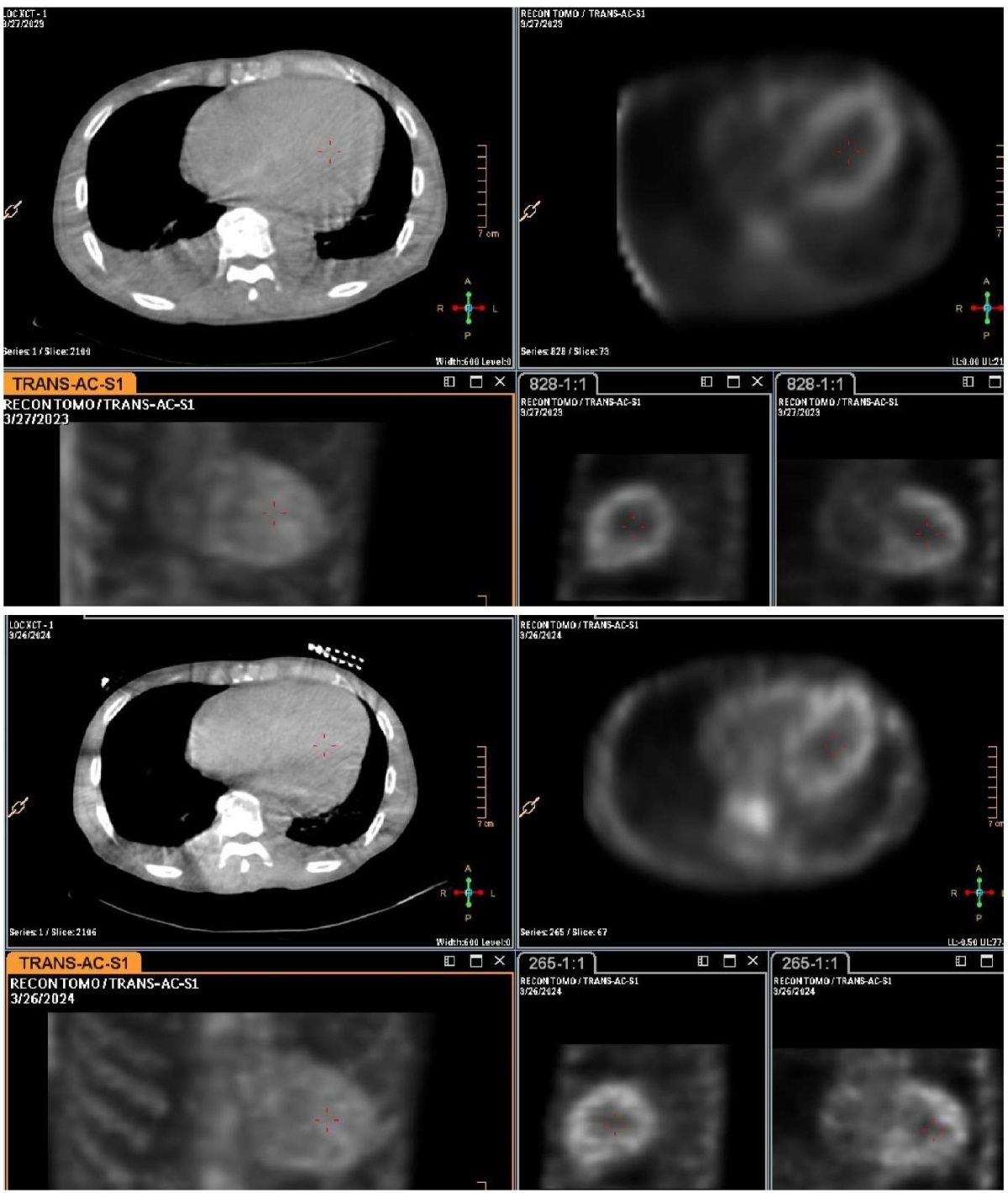
Рис. 5. Данные ОЭКТ/КТ пациента К. исходно (Grade 3) и через 12 мес. после приема тафамидиса (Grade 2-3).
Сводная характеристика клинико-инструментальных данных описанных выше пациентов представлена в таблице 1.
Таблица 1
Динамика показателей пациентов исходно и через 12 мес. приема тафамидиса
|
Параметры |
Пациент 1 |
Пациент 2 |
Пациент 3 |
|||
|
Исходно |
Через 12 мес. приема тафамидиса |
Исходно |
Через 12 мес. приема тафамидиса |
Исходно |
Через 12 мес. приема тафамидиса |
|
|
Число госпитализаций, связанные с сердечно-сосудистыми причинами |
Неоднократные повторные госпитализации |
0 |
Неоднократные повторные госпитализации по поводу декомпенсации ХСН |
0 |
Неоднократные повторные госпитализации по поводу декомпенсации ХСН |
0 |
|
Функциональный класс ХСН |
2 |
2 |
2 |
2 |
3 |
3 |
|
Результаты ТШХ, м |
437 |
501 |
— |
— |
82 |
100 |
|
Качество жизни (KCCQ-QS), баллов |
44 |
31 |
50 |
38 |
74 |
76 |
|
NT-proBNP, пг/мл |
3104 |
75,1 |
4123 |
3128 |
8998 |
7133 |
|
Тропонин, нг/мл |
375 |
107 |
34 |
17,2 |
51,9 |
42 |
|
Данные ЭхоКГ |
||||||
|
ФВ ЛЖ, % |
48 |
60 |
60 |
58 |
52 |
52 |
|
Толщина МЖП, мм |
18 |
18 |
20 |
20 |
22 |
28 |
|
Толщина ЗС ЛЖ, мм |
18 |
15,5 |
18 |
18 |
22 |
22 |
|
СДЛА, мм рт.ст. |
37 |
28 |
42 |
36 |
48 |
46 |
|
КДР, мм |
43 |
43 |
38 |
38 |
44 |
44 |
|
Данные сцинтиграфии миокарда с 99mTс-PYP |
||||||
|
H/Cl |
1,69 |
1,47 |
1,6 |
1,53 |
1,8 |
1,6 |
|
Grade по шкале Perugini |
3 |
1-2 |
3 |
2-3 |
3 |
2-3 |
Сокращения: ЗС — задняя стенка, КДР — конечно-диастолический размер, ЛЖ — левый желудочек, МЖП — межжелудочковая перегородка, СДЛА — систолическое давление в легочной артерии, ТШХ — тест с шестиминутной ходьбой, ФВ — фракция выброса, ХСН — хроническая сердечная недостаточность, ЭхоКГ — эхокардиография, 99mTс-PYP — пирофосфат технеция, H/Cl — соотношение накопления радиофармпрепарата в миокарде относительно накопления в контралатеральной зоне, NT-proBNP — N-концевой промозговой натрийуретический пептид.
Обсуждение
Во всех клинических примерах продемонстрирована разнонаправленная динамика. Отсутствие признаков прогрессирования заболевания и даже положительная динамика в некоторых аспектах является следствием патогенетической терапии тафамидисом [6].
Несмотря на малое количество пациентов, принимающих тафамидис в течение 12 мес., мы можем наблюдать уменьшение эпизодов декомпенсации ХСН в течение срока наблюдения, как минимум отсутствие отрицательной динамики относительно функционального статуса, лабораторных маркеров. Лишь в третьем клиническом примере по данным ЭхоКГ наблюдалась отрицательная динамика в виде усугубления диастолической функции ЛЖ и увеличения степени гипертрофии ЛЖ. По данным литературы встречаются данные о том, что потенциально существует задержка в эффекте терапии в течение 6-12 мес. после начала приема препарата. Особенно это касается пациентов, у которых терапия была начата уже на продвинутой стадии заболевания [5].
Крайне интересным наблюдением в нашем исследовании оказалось уменьшение степени интенсивности захвата РФП миокардом по данным СМ с 99mTс-PYP. Ряд клинических работ демонстрирует уменьшение амилоидной нагрузки при долгосрочном приеме тафамидиса. Так, Odouard Sh, et al. сравнили результаты СМ с 99mTc-HMDP у пациентов, получавших специфическую терапию (n=52), и пациентов без специфической терапии (n=8, включены ретроспективно). Радиоизотопное исследование проводилось при диагностике заболевания и не менее, чем через 1 год после старта терапии. В группе пациентов, получавших тафамидис, степень захвата РФП миокардом значимо уменьшилась на 11% в сравнении с группой пациентов без специфической терапии, у которых наблюдалось увеличение соотношения сердце/средостение (H/M) на 3% (p<0,01) [7]. Однако стоит отметить, что в данной работе СМ проводилась через 10 мин после введения РФП. Кроме того, оцениваемый параметр H/M в клинической практике в диагностике АКМП не применяется.
Еще один клинический случай был опубликован Yu AL, et al. (2023). В это исследования ретроспективно был включен 21 пациент с диагнозом ATTR-АКМП и с верифицированной мутацией Ala97Ser. Пациентам проводилась СМ с 99mTc-PYP исходно и через 1 год терапии тафамидисом. В результате получены данные о значимом уменьшении H/Cl (с 1,63±0,20 до 1,43±0,11; p<0,001). В контрольной группе значимого изменения не выявлено (с 1,68±0,18 до 1,63±0,12; p>0,05) [8].
Механизм этого феномена остается неизвестным, поскольку основной мишенью препарата являются нестабильные молекулы транстиретина и действие тафамидиса не касается ранее отложившихся амилоидных масс. Можно предположить, что в основе механизма лежит прекращение отложения новых депозитов амилоида и, следовательно, снижение острого повреждения миокарда. Возможно, что при условии отсутствия отложения новых депозитов амилоида, происходит естественный процесс активации протеолитической системы. Безусловно, данное предположение носит спекулятивный характер, требует доказательств и новых исследований.
Заключение
СМ является не только важным инструментом ранней диагностики ATTR-АКМП, но и одним из методов мониторинга прогрессирования заболевания. Требуется дальнейшее изучение по этому направлению с большим числом пациентов.
Информированное согласие. У всех пациентов было получено информированное согласие на публикацию анонимизированных данных.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Никифорова Т. В., Чарая К. В., Щекочихин Д. Ю. и др. Первые данные о распространенности транстиретинового амилоидоза при гипертрофии левого желудочка в России. Кардиология. 2024;64(4):54-60. doi:10.18087/cardio.2024.4.n2611.
2. Насонова С. Н., Жиров И. В., Шошина А. А. и др. Экспертный центр по амилоидозу сердца: реалии и перспективы. Терапевтический архив. 2024;96(4):321-9. doi:10.26442/00403660.2024.04.202677.
3. Khor YM, Cuddy SAM, Singh V, et al. 99mTc Bone-Avid Tracer Cardiac Scintigraphy: Role in Noninvasive Diagnosis of Transthyretin Cardiac Amyloidosis. Radiology. 2023; 306(2):e221082. doi:10.1148/radiol.221082.
4. Damy T, Garcia-Pavia P, Hanna M, et al. Efficacy and safety of tafamidis doses in the Tafamidis in Transthyretin Cardiomyopathy Clinical Trial (ATTR-ACT) and long-term extension study. Eur J Heart Fail. 2021;23(2):277-85. doi:10.1002/ejhf.2027.
5. Garcia-Pavia P, Bengel F, Brito D, et al. Expert consensus on the monitoring of transthyretin amyloid cardiomyopathy. Eur J Heart Fail. 2021;23(6):895-905. doi:10.1002/ejhf.2198.
6. Garcia-Pavia P, Aus dem Siepen F, Donal E, et al. Phase 1 Trial of Antibody NI006 for Depletion of Cardiac Transthyretin Amyloid. N Engl J Med. 2023;389(3):239-50. doi:10.1056/NEJMoa2303765.
7. Odouard S, Abulizi M, Kharoubi M, et al. Tafamidis Decreases Cardiac Uptake of 99mTc-HMDP in Transthyretin Cardiac Amyloidosis. JACC Cardiovasc Imaging. 2022;15(12): 2149-51. doi:10.1016/j.jcmg.2022.06.013.
8. Yu AL, Chen YC, Tsai CH, et al. Tafamidis Treatment Decreases 99mTc-Pyrophosphate Uptake in Patients With Hereditary Ala97Ser Transthyretin Amyloid Cardiomyopathy. JACC Cardiovasc Imaging. 2023;16(6):866-7. doi:10.1016/j.jcmg.2022.12.016.
Об авторах
А. А. ШошинаРоссия
Шошина Анастасия Александровна — аспирант отдела заболеваний миокарда и сердечной недостаточности.
Москва
Конфликт интересов:
Нет
А. А. Аншелес
Россия
Аншелес Алексей Аркадьевич — д.м.н., в.н.с. отдела радионуклидной диагностики и позитронно-эмиссионной томографии.
Москва
Конфликт интересов:
Нет
С. Н. Насонова
Россия
Насонова Светлана Николаевна — к.м.н., с.н.с. отдела заболеваний миокарда и сердечной недостаточности.
Москва
Конфликт интересов:
Нет
И. В. Жиров
Россия
Жиров Игорь Витальевич — д.м.н., в.н.с. отдела заболеваний миокарда и сердечной недостаточности.
Москва
Конфликт интересов:
Нет
В. Б. Сергиенко
Россия
Сергиенко Владимир Борисович — д.м.н., профессор, руководитель отдела радионуклидной диагностики и позитронно-эмиссионной томографии.
Москва
Конфликт интересов:
Нет
С. Н. Терещенко
Россия
Терещенко Сергей Николаевич — д.м.н., профессор, руководитель отдела заболеваний миокарда и сердечной недостаточности.
Москва
Конфликт интересов:
Нет
Дополнительные файлы
- Пациентам с транстиретиновой амилоидной кардиомиопатией показан прием селективного стабилизатора транстиретина — тафамидиса.
- На фоне терапии необходим мониторинг в отношении прогрессирования заболевания.
- Серия клинических случаев демонстрирует важность сцинтиграфии миокарда как инструмента в оценке прогрессирования заболевания и демонстрирует ранее не описанный эффект терапии в виде уменьшения степени накопления захвата радиофармпрепарата миокардом.
Рецензия
Для цитирования:
Шошина А.А., Аншелес А.А., Насонова С.Н., Жиров И.В., Сергиенко В.Б., Терещенко С.Н. Роль сцинтиграфии миокарда с 99mTc-пирофосфатом в оценке эффективности терапии тафамидисом на примере серии клинических случаев. Российский кардиологический журнал. 2025;30(1):6200. https://doi.org/10.15829/1560-4071-2025-6200. EDN: XSICKB
For citation:
Shoshina A.A., Ansheles A.A., Nasonova S.N., Zhirov I.V., Sergienko V.B., Tereshchenko S.N. Role of 99mTc-pyrophosphate myocardial scintigraphy in assessing the efficiency of tafamidis therapy: a case series. Russian Journal of Cardiology. 2025;30(1):6200. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6200. EDN: XSICKB
JATS XML

















































