Перейти к:
Особенности микробиома атеросклеротической бляшки у пациентов после каротидной эндартерэктомии
https://doi.org/10.15829/1560-4071-2024-6145
EDN: VENBZB
Аннотация
Цель. Исследовать микробиом биоптатов атеросклеротических бляшек (АСБ) больных, перенесших каротидную эндартерэктомию (КЭА).
Материал и методы. В настоящем исследовании с использованием метода высокопроцессивного секвенирования участка V4 гена 16S рРНК проанализирован профиль микробиоты 76 образцов АСБ, полученных при проведении КЭА. Доля пациентов без рестеноза, включенных в исследование, составила 20%. Медиана наблюдения за пациентами составила 1,9 года (диапазон 1,4-2,25).
Результаты. Таксономический анализ установил, что микробиом АСБ характеризуется большим разнообразием грамотрицательных бактерий, в т.ч. бактерий, широко распространенных в окружающей среде. Бактерии, наиболее представленные в АСБ, относятся к четырем семействам: Caulobacteraceae, Rhizobiaceae, Sphingobacteriaceae и Weeksellaceae. Линейный дискриминантный анализ размера эффекта LefSe выявил значимо более высокую представленность микробного маркера OTU_21, относящегося к семейству Sphingomonadaceae, в микробиоме АСБ у пациентов с рестенозом ≥50% и Cloacibacterium OTU_67, входящего в семейство Weeksellaceae, у пациентов с рестенозом >70%.
Заключение. Полученные данные подчеркивают важность изучения микробиома АСБ и позволяют предположить, что микроорганизмы различного происхождения, включая те, которые ранее не рассматривались как факторы риска, могут играть патогенетическую роль как в атерогенезе, так и в развитии рестеноза.
Ключевые слова
Для цитирования:
Колесова Е.П., Чернявский М.А., Ванюркин А.Г., Верховская Е.В., Зайкова Е.К., Калинина О.В., Ситкин С.И., Маслянский А.Л., Кван В.В., Васильева Е.Ю., Яковлев А.Н., Бабенко А.Ю., Конради А.О., Шляхто Е.В. Особенности микробиома атеросклеротической бляшки у пациентов после каротидной эндартерэктомии. Российский кардиологический журнал. 2024;29(12):6145. https://doi.org/10.15829/1560-4071-2024-6145. EDN: VENBZB
For citation:
Kolesova E.P., Chernyavsky M.A., Vanyurkin A.G., Verkhovskaya E.V., Zaykova E.K., Kalinina O.V., Sitkin S.I., Maslyansky A.L., Kvan V.V., Vasilyeva E.Yu., Yakovlev A.N., Babenko A.Yu., Konradi A.O., Shlyakhto E.V. Features of the atherosclerotic plaque microbiome in patients after carotid endarterectomy. Russian Journal of Cardiology. 2024;29(12):6145. (In Russ.) https://doi.org/10.15829/1560-4071-2024-6145. EDN: VENBZB
Стеноз сонной артерии (ССА) представляет собой клиническое состояние, характеризующееся сужением или окклюзией сонных артерий, главным образом вследствие атеросклероза [1]. Данная патология является одной из ведущих причин ишемического инсульта, который представляет собой серьезную угрозу для здоровья и жизни пациентов.
Согласно оценкам Всемирной организации здравоохранения, на 2019г острые нарушения мозгового кровообращения (ОНМК) занимают второе место среди причин летальности, составляя приблизительно 11% всех случаев смерти 1. Несмотря на то, что за три десятилетия смертность от инсульта, скорректированная по возрасту, уменьшилась более чем на 30%, это заболевание по-прежнему остаётся одной из ключевых проблем в сфере здравоохранения [2]. По данным Росстата, ОНМК являются одной из главных причин смертности в России, в 2 раза превышая количество летальных исходов от инфаркта миокарда (ИМ) 2. Существуют консервативные и хирургические подходы лечения. Консервативные методы включают медикаментозную терапию, направленную на контроль и нормализацию липидного профиля, уровня артериального давления, гликемии, а также профилактику тромбообразования и коррекцию образа жизни. К хирургическим методам относятся ангиопластика и стентирование, а также каротидная эндартерэктомия (КЭА). В настоящее время КЭА является "золотым стандартом" хирургической коррекции ССА и заключается в извлечении атеросклеротических отложений, находящихся на внутренней поверхности сонной артерии. В зависимости от медицинских показаний, особенностей расположения, а также протяженности и структуры атеросклеротической бляшки (АСБ) используются два метода — классическая и эверсионная эндартерэктомия. Хотя КЭА считается высокоэффективной процедурой при ССА, после операции могут возникать различные осложнения. Одной из наиболее часто встречающихся проблем в отдаленном послеоперационном периоде является рестеноз, который, согласно различным источникам, встречается у 6-36% пациентов [3]. Достижения медицинской терапии и профилактики привели к снижению частоты инсультов у пациентов с симптомным и бессимптомным ССА. Однако по-прежнему сохраняется остаточный/резидуальный риск развития сосудистых осложнений, обусловленный влиянием неклассических факторов риска. Одним из таких факторов является роль воспаления и инфекционных агентов.
Инфекционная теория атерогенеза сформировалась в первой половине XIXв и является одной из перспективных областей исследований в современной кардиологии. Согласно этой теории, атеросклероз развивается под воздействием патогенных микроорганизмов, таких как бактерии, вирусы и паразиты. В последние годы наблюдается значительный интерес к взаимодействию иммунной и сердечно-сосудистой систем. В частности, активация иммунной системы под воздействием инфекционных агентов может способствовать развитию атеросклероза. Исследования показывают, что воспалительные процессы в организме, вызванные инфекциями, могут приводить к повреждению эндотелия сосудов и увеличению риска развития АСБ. Одним из ключевых механизмов этого взаимодействия является активация Т и В клеток. Эти клетки могут способствовать выработке цитокинов, которые играют важную роль в иммунном ответе и воспалении. Воспаление, в свою очередь, приводит к повреждению сосудистых стенок и развитию атеросклероза. Кроме того, хроническое воспаление может способствовать накоплению липопротеинов низкой плотности в стенках сосудов, а также увеличению уровня свободных жирных кислот и окислению липидов, что является одним из ключевых факторов развития атеросклероза. Эта взаимосвязь может играть роль и в развитии рестеноза сонных артерий: микробиом АСБ может активировать воспалительный ответ, приводя к ремоделированию артерий и сужению их просвета [4]. Исследования в этой области продолжают расширять наши знания о механизмах атеросклероза и открывают новые, неклассические факторы развития атеросклероза. В частности, в АСБ было найдено значительное количество различных бактерий, среди которых некоторые таксоны совпадают с теми, что встречаются в ротовой полости и кишечнике [5]. Бактерии полости рта, такие как Porphyromonas gingivalis, Aggregatibacter actinomycetemcomitans и Prevotella intermedia, участвующие в развитии пародонтита, были также ассоциированы с атеросклерозом [6]. В АСБ на основе анализа микробного сообщества, по данным секвенирования гена 16S рРНК, были идентифицированы различные бактериальные профили, включая микроорганизмы, характерные для окружающей среды, и некоторые госпитальные патогены [7]. Кроме того, предполагается, что ряд инфекционных агентов, например, Chlamydia pneumoniae, Helicobacter pylori, вирус гепатита С, Pseudomonas aeruginosa и цитомегаловирус, способствуют развитию атеросклероза [8]. Имеется ряд сообщений, свидетельствующих о наличии жизнеспособных микробов, выделенных из АСБ человека. Изучение разнообразия микробиома в образцах АСБ, полученных от пациентов, перенесших КЭА в связи с транзиторной ишемической атакой или инсультом, позволило выявить не только наличие широкого спектра микробных агентов в АСБ, но и различия в таксономических профилях АСБ, полученных от симптомных и бессимптомных пациентов [9]. Однако, несмотря на прогресс в новейших технологиях секвенирования, анализ метагеномов, связанных с хозяином, остается сложной задачей. Безусловно, существуют еще не изученные микробные агенты, которые могут иметь значение в атерогенезе. В современном научном мире активно обсуждаются разные механизмы влияния инфекции на атерогенез (присутствие инфекционного агента в стенке сосуда, опосредованные иммуномодулирующие эффекты). В связи с чем, безусловно, актуальной представляется задача изучения микробиома АСБ у различных категорий пациентов, молекулярных и иммунологических механизмов влияния бактерий и вирусов на атерогенез.
Целью нашей работы было исследование микробиома биоптатов АСБ больных, перенесших КЭА.
Материал и методы
Дизайн исследования. В исследование включены 100 пациентов со стенозирующим атеросклерозом сонных артерий, подвергшихся оперативному вмешательству (КЭА) в отделении сосудистой хирургии ФГБУ "НМИЦ им. В. А. Алмазова" в период с 2021 по 2023 гг.
Всем пациентам было выполнено стандартное обследование в рамках предоперационной подготовки, в т. ч. биохимический и клинический скрининг, компьютерная томографическая ангиография и ультразвуковое дуплексное сканирование (УЗДС) сонных артерий.
После выписки из стационара пациенты находились под диспансерным наблюдением. В срок от 12 до 22 мес. пациентам было выполнено контрольное УЗДС сонных артерий, а также проведен сбор клинической информации по жалобам и наличию отдаленных послеоперационных осложнений. Основные конечные точки: развитие транзиторной ишемической атаки/ОНМК в оперированном сосудистом бассейне, развитие острого ИМ, рецидив неврологической симптоматики, наличие повторных операций на целевом сегменте, смерть пациента. Пациенты-жители Санкт-Петербурга и Ленинградской области были приглашены на очный визит, контакт с иногородними пациентами осуществлялся по телефону, а также по электронной почте. Для дальнейшего анализа были отобраны две группы: пациенты с развившимся послеоперационным рестенозом и контрольная группа — без рестеноза (общее количество — 76 пациентов). В современной литературе под рестенозом понимают повторное сужение артерии в месте, где стеноз был устранен хирургическим путем [10]. Среди отобранных 76 пациентов — 55 мужчин и 21 женщина, средний возраст мужчин составил 67 лет, а женщин — 66,5 лет. Эверсионная КЭА была выполнена у 57,89% участников, тогда как классическая КЭА — у 42,1% больных. Медиана наблюдения составила 1,9 года (диапазон 1,4-2,25). У большинства пациентов были диагностированы мультифокальный атеросклероз и артериальная гипертензия; у трети наблюдались ожирение и сахарный диабет. Более 50% пациентов также имели сопутствующий диагноз ишемической болезни сердца, среди которых треть перенесла острое коронарное событие. Более половины участников были курильщиками, причем курение было более распространено среди мужчин. Женщины чаще страдали от сахарного диабета и заболеваний щитовидной железы. Нестабильная АСБ чаще фиксировалась у женщин. Кальцинированные АСБ были обнаружены у 70% больных с равномерным распределением между мужчинами и женщинами. Все пациенты получали терапию статинами, дезагрегантами и антикоагулянтами при наличии показаний (фибрилляция предсердий, наличие механического протеза клапана сердца). Доля пациентов без рестеноза, включенных в исследование, составила 20% (табл. 1).
Таблица 1
Общая характеристика участников исследования
Показатель | Все | Мужчины | Женщины | p |
Общие сведения и антропометрия | ||||
Возраст на момент эпизода, годы | 67,0 [ 62,0;72.0] | 67,0 [ 61,75;72,5] | 66,5 [ 62,75;69,25] | 0,983 |
ИМТ, кг/м2 | 27,7 [ 17,4;42,5] | 27,36 [ 17,44;38,7] | 28,6 [ 18,12;42,5] | 0,941 |
Ожирение (по критерию ИМТ) | 23 (28%) | 16 (28%) | 7 (29%) | 0,954 |
Курение | 22 (52%) | 15 (65%) | 7 (36%) | 0,0013 |
САД, мм рт.ст. | 136,5 [ 100;210] | 137,4 [ 120;180] | 134,5 [ 100;210] | 0,311 |
ДАД, мм рт.ст. | 80,56 [ 60;110] | 81,2 [ 70;100] | 78,9 [ 60;110] | 0,577 |
Характеристика атеросклероза и сопутствующие заболевания | ||||
Наличие атеросклероза других локализаций | 52 (70%) | 37 (72%) | 15 (65%) | 0,413 |
Наследственность по атеросклерозу | 26 (55%) | 18 (52%) | 8 (61%) | 0,474 |
ОНМК в анамнезе | 24 (30%) | 20 (35%) | 4 (16%) | 0,097 |
ОИМ в анамнезе | 22 (27%) | 14 (25%) | 8 (33%) | 0,400 |
ИБС | 49 (61%) | 34 (60%) | 15 (62%) | 0,888 |
АГ | 78 (97%) | 55 (98%) | 23 (95%) | 0,525 |
СД | 27 (33%) | 15 (26%) | 12 (50%) | 0,0476 |
Заболевание щитовидной железы | 12 (15%) | 4 (7%) | 8 (33%) | 0,0055 |
Сопутствующая терапия | ||||
Статины до и после госпитализации | 76 (100%) | 55 (100%) | 21 (100%) | 1,0 |
Антикоагулянты после госпитализации | 11 (16%) | 8 (19%) | 3 (13%) | 0,054 |
Дезагреганты после госпитализации | 37 (77%) | 22 (73%) | 15 (83%) | 0,832 |
Характеристики стеноза и АСБ до операции | ||||
Стеноз целевой зоны до операции, % | 80,2 [ 50,0;99,0] | 81,5 [ 65,0;99,0] | 80,4 [ 50,0;99,0] | 0,927 |
Протяжённость АСБ, мм | 24,0 [ 19,0;31,25] | 25,0 [ 19,0;33,0] | 22,0 [ 19,5;27,0] | 0,443 |
Кальциноз АСБ | 45 (70%) | 31 (70%) | 14 (70%) | 0,810 |
ЛСК после операции, см/с | 79,45 [ 67,45;120,5] | 80,0 [ 64,0;130,0] | 75,0 [ 69,0;103,5] | 0,481 |
Стабильная АСБ | 28 (43%) | 24 (53%) | 4 (20%) | 0,0189 |
Характеристики рестеноза | ||||
Отсутствие рестеноза | 16 (20%) | 9 (16%) | 7 (30%) | 0,1339 |
Рестеноз 20-50% | 30 (38%) | 19 (34%) | 11 (47%) | 0,2324 |
Рестеноз >50% | 21 (26%) | 21 (38%) | 0 (0%) | 0,0107 |
Рестеноз >70% | 10 (12%) | 10 (18%) | 0 (0%) | 0,1087 |
Сокращения: АГ — артериальная гипертензия, АСБ — атеросклеротическая бляшка, ДАД — диастолическое артериальное давление, ИБС — ишемическая болезнь сердца, ИМТ — индекс массы тела, ЛСК — линейная скорость кровотока, ОИМ — острый инфаркт миокарда, ОНМК — острое нарушение мозгового кровообращения, САД — систолическое артериальное давление, СД — сахарный диабет.
Исследование проводилось в соответствии с Хельсинкской декларацией и одобрено Комитетом по этике НМИЦ им. В. А. Алмазова (№ 4104-21 от 12.04.2021). Все участники подписали информированное согласие.
Исследование выполнено при финансовой поддержке Министерства науки и высшего образования Российской Федерации (Соглашение № 075-15-2022-301 от 20.04.2022).
Критерии включения в исследование:
- Наличие показаний к оперативному лечению: асимптомный стеноз экстракраниального отдела внутренней сонной артерии (ВСА) >60%, симптомный стеноз экстракраниального отдела ВСА 50-99%, стеноз экстракраниального отдела ВСА >50% у пациентов с нестабильной АСБ.
- Планируемое оперативное вмешательство: КЭА.
- Возраст старше 18 лет.
- Подписание информированного согласия.
Критерии невключения/исключения:
- Наличие патологии, лимитирующей наблюдение в отдаленном послеоперационном периоде.
- Тяжелые сопутствующие заболевания с высоким риском для оперативного вмешательства (неконтролируемая артериальная гипертензия, нестабильная стенокардия при отсутствии реваскуляризации миокарда, хроническая сердечная недостаточность III-IV функционального класса по NYHA).
- Предшествующее хирургическое вмешательство на оперируемой ВСА, контралатеральная окклюзия ВСА, высокое расположение каротидной бифуркации.
- Скорость клубочковой фильтрации <30 мл/
мин. - Повышение аланинаминотрансферазы и/или аспартатаминотрансферазы, щелочной фосфатазы более чем в 3 раза выше верхней границы нормы.
- Онкологические и миелопролиферативные заболевания не в стадии ремиссии.
- Злоупотребление психоактивными веществами, алкоголем.
- Беременность или период лактации.
- Отказ от участия в исследовании.
Инструментальные и лабораторные методы. Всем пациентам в рамках предоперационной подготовки проводился сбор жалоб и анамнеза, физикальный осмотр с измерением антропометрических показателей, артериального давления и пульса, лабораторное и инструментальное обследование.
Из обязательных инструментальных исследований было выполнено УЗДС брахиоцефальных артерий с помощью портативной диагностической системы My Sono U6 (Samsung, Корея) по стандартному протоколу. Кроме того, проводилась компьютерная томографическая ангиография сонных артерий на аппарате Somatom Definition Force (Siemens).
Извлеченные во время операции фрагменты АСБ, а также образцы крови всех пациентов были биобанкированы: образцы крови при температуре -80 С, образцы АСБ в жидком азоте. После окончательного формирования групп в извлеченных фрагментах АСБ был проанализирован профиль микробиоты методом высокопроцессивного секвенирования V4 участка 16S рРНК гена бактериального генома.
Методика определения профиля микробиоты АСБ. Анализ профиля микробиоты АСБ выполнен методом высокопроцессивного секвенирования (NGS) на базе Института молекулярной биологии и генетики ФГБУ "НМИЦ им. В. А. Алмазова".
Тотальную ДНК из фрагментов АСБ выделяли с использованием набора HiPure Microbiome DNA Kit (Magen Biotechnology Co., Китай) согласно инструкции производителя. Качество и количество выделенной ДНК оценивали на спектрофотометре NanoDrop 1000 (Thermo Fisher Scientific, США). Библиотеки создавали с использованием набора NEXTflex 16S V4 Amplicon-Seq Kit 2.0 (PerkinElmer Inc., США) согласно инструкции производителя. Секвенирование пула библиотек осуществляли на платформе MiSeq Illumina с набором MiSeq Reagent Kit v2 (250 bp × 2) (Illumina Inc., США).
Первичный контроль качества, полученных прямых и обратных прочтений вариабельного V4 участка гена 16S рРНК бактериального генома, проведён с помощью программ FastQC v0.11.9 3 и MultiQC v1.14 [11]. Фильтрацию данных с низким значением качества, удаление адаптерных последовательностей и праймеров, проводили с помощью программы trimmomatic v0.39 [12] (adapters:2:30:10 SLIDINGWINDOW:4:15 HEADCROP (primer length) MINLEN 75), после чего выполнили повторный анализ качества прочтений. В дальнейшем анализе использовали только прямые прочтения, т. к. объединение прямых и обратных прочтений приводило к большому сокращению числа анализируемых последовательностей. Для получения вариантов последовательностей ампликонов (ASVs) в пакете для R использовали DADA2 v1.26.0 [13], в котором дополнительно выполняли контроль качества, удаление химерных прочтений и прочтений с низким качеством. Для получения операционных таксономических единиц (OTUs) полученные ASVs были кластеризованы с помощью программы mmseq2 v 13.45111 [14] с параметрами 99% и 97% идентичности (identity) и 80% покрытием (coverage). Кластеризация позволила сократить количество ASVs и снизить число ошибок, возникающих в единичных нуклеотидах в процессе секвенирования. Таксономический анализ полученных последовательностей проводили в пакете DADA2 на основе базы данных SILVA v138.1.
Статистический анализ. Для оцениваемых параметров была проверена статистическая гипотеза об отсутствии эквивалентности средних по двустороннему критерию с уровнем значимости 0,05. Категориальные (качественные) данные были описаны с использованием процентных и абсолютных значений. Интервальные (количественные) данные были представлены в виде среднего арифметического и стандартного отклонения (для нормально распределенных данных) или с использованием медианы и межквартильного интервала (для распределений, отличных от нормального). Данные были проверены на нормальность с помощью теста Колмогорова-Смирнова или Шапиро-Уилка. Сравнение между двумя группами интервальных данных производилось с помощью критерия Уилкоксона со знаком ранга. Для категориальных данных сравнения проводились с использованием критерия Макнемара χ2 с поправкой на непрерывность Йейтса, с использованием точного критерия Фишера и критерия ANOVA on Rankings. Для анализа данных с нормальным распределением был использован коэффициент корреляции Пирсона. Для распределений данных, отличных от нормального, использовалась модель линейной регрессии. Все расчеты проводились на платформе Python.
Статистический анализ результатов 16S РНК секвенирования проводили при помощи пакетов R. Пермутационный многомерный дисперсионный анализ бета-разнообразия (PERMANOVA) проводили при помощи пакета vegan v2.6.4, функция adonis2. Для визуальной оценки бета-разнообразия проводили анализ главных координат (PCoA) с помощью взвешенного алгоритма Unifrac (Weighted UniFrac). Альфа-разнообразие и бета-разнообразие сравнивали с помощью пакета phyloseq v1.42.0 [15]. Альфа-разнообразие оценивали по критериям Chao1, Shannon, Simpson. Метод линейного дискриминантного анализа размера эффекта — LEfSe, пакет microbiomeMarker v1.4.0 [16], функция run_lefse, с параметрами по умолчанию (norm = "CPM", taxa_rank = "none", kw_cutoff = 0,05, lda_cutoff = 2), был применён для обнаружения бактериальный маркеров, которые вносят наибольший вклад в разницу между двумя сравниваемыми группами образцов.
Результаты
Исследование профиля микробиоты биоптата АСБ
По результатам анализа данных, полученных в ходе высокопроцессивного секвенирования участка V4 гена 16S рРНК АСБ, извлеченной во время КЭА, наиболее представленными оказались 4 филума: Pseudomonadota (ранее известный как Proteobacteria), Bacteroidota, Actinomycetota (Actinobacteria), Bacillota (Firmicutes) (рис. 1). На уровне семейств чаще всего в образцах обнаруживались следующие: Caulobacteraceae, Rhizobiaceae, Sphingobacteriaceae и Weeksellaceae (рис. 2).
Семейство Caulobacteraceae включает грамотрицательные аэробные или факультативно анаэробные палочковидные подвижные бактерии, не образующие спор. Члены семейства были выделены из пресной воды, почвы, морской воды, растений, организмов животных и человека. Некоторые виды являются патогенами, образуют биопленки [17]. Ранее было показано, что уровни Caulobacteraceae оказались ниже в образцах крови больных острым ИМ по сравнению с контрольной группой, а их присутствие в крови пациентов с ИМ было отрицательно связано с фракцией выброса левого желудочка [18].
На родовом уровне вторым по распространенности был род Mesorhizobium из группы ризобий, относящихся к порядку Hyphomicrobiales (синоним: Rhizobiales) класса Alphaproteobacteria. Ризобии — собирательное название группы клубеньковых бактерий, относящихся к родам Rhizobium и Ensifer (синоним: Sinorhizobium) из семейства Rhizobiaceae, роду Mesorhizobium из семейства Phyllobacteriaceae и роду Bradyrhizobium из семейства Nitrobacteraceae (синоним: Bradyrhizobiaceae). Это грамотрицательные почвенные бактерии, которые вступают в азотфиксирующий симбиоз с бобовыми растениями: такими как клевер, фасоль и соя [19]. Многочисленны в почве и водоёмах, широко используются в качестве бактериальных удобрений. Имеются ограниченные данные о патогенности отдельных представителей семейств Rhizobiaceae (Agrobacterium tumefaciens и Agrobacterium pusense (базоним: Rhizobium pusense)) и Nitrobacteraceae (некоторые виды Afipia) [20]. Полученные нами данные согласуются с данными других исследований. Так, ризобии были выявлены в АСБ пациентов, страдающих ишемической болезнью сердца, причем в одном из исследований порядок Hyphomicrobiales (синоним: Rhizobiales) был даже одним из трех доминирующих таксонов [21].
Третьим по распространенности оказалось семейство Sphingobacteriaceae (типовой род: Sphingobacterium) — это грамотрицательные неспорообразующие палочки, как правило, без жгутиков. Бактерии были выделены из нескольких типов почв и компоста, и в настоящее время известно несколько промышленных применений (в качестве стимуляторов роста растений, биоремедиаторов и производителей некоторых ценных соединений, таких как каротиноиды и противомикробные препараты). Семейство Sphingobacteriaceae принадлежит к филуму Bacteroidota, имеющему представителей практически во всех средах, включая человека, ризосферу, почвы, сточные воды и другие. Среди видов, принадлежащих к роду Sphingobacterium, по крайней мере, два вида — S. multivorum, S. spiritivorum — признаны патогенами и связаны с развитием некоторых заболеваний, в т. ч. муковисцидоза. В настоящее время отсутствуют данные литературы о выявлении Sphingobacteriaceae и Sphingobacterium в АСБ.
Наконец, четвертым по распространенности явилось семейство Weeksellaceae. Флавобактерии этого семейства относятся к группе неферментирующих грамотрицательных бактерий, обладающих множественной лекарственной устойчивостью к широкому спектру антибиотиков, а также способностью к продукции карбапенемаз. Отмечается их широкая распространенность не только в условиях медицинских организаций, но и в окружающей среде (почвенный и водный микробиом). Кроме того, Weeksellaceae выявляются в составе микробиоты полости рта человека. В последние годы все чаще обнаруживаются сообщения об инфекциях, которые связаны с представителями порядка Flavobacteriales, а именно родов Chryseobacterium, Elizabethkingia и Empedobacter семейства Weeksellaceae [22].
Данные о выявлении Weeksellaceae (Flavobacteriales) в АСБ, а также ассоциации с кардиоваскулярными заболеваниями, отсутствуют.
На уровне рода многие представители микробиоты АСБ были дифференцированы только в различные операционные таксономические единицы без принадлежности к определенному роду (рис. 3). Так, наиболее представленной на уровне рода была OTU_1 (operational taxonomic unit, операционная таксономическая единица), принадлежащая к семейству Caulobacteraceae. Вторым по распространенности был род Mesorhizobium, относящийся к семейству Phyllobacteriaceae.
Для определения отличий в медианных значениях таксономических единиц среди разнообразных групп применялся метод Краскела-Уоллиса (табл. 2). Наиболее значимые различия наблюдаются в отношении следующих семейств:
- Группы рестеноза: Dysgonomonadaceae, Nocardioidaceae, Comamonadaceae;
- Стабильность АСБ: Weeksellaceae, Deinococcaceae;
- Кальциноз АСБ: Caulobacteraceae, Rhizobiaceae, Corynebacteriaceae, Lachnospiraceae;
- Протяженность АСБ: Paracoccaceae(ранее известное как Rhodobacteraceae), Chitinophagaceae.
Сравнение альфа и бета-разнообразия профиля микробиоты АСБ пациентов без рестеноза и пациентов со значимым рестенозом >70% не выявило статистически значимых различий. В то же время линейный дискриминантный анализ размера эффекта LefSe выявил 1 микробный маркер OTU_21 (семейство Sphingomonadaceae, порядок Sphingomonadales), представленность которого была значимо выше в группе больных с рестенозом >70% (рис. 4 А-В).
Сравнение альфа и бета-разнообразия профиля микробиоты АСБ пациентов без рестеноза и пациентов с рестенозом ≥50% не выявило статистически значимых различий. Анализ LefSe выявил 1 микробный маркер, представленность которого наиболее значимо различалась в группе больных с рестенозом ≥50%. Им оказался Cloacibacterium OTU_67 (семейство Weeksellaceae, порядок Flavobacteriales) (рис. 5 А-В).
Таким образом, по результатам анализа LefSe нами были выявлены отличительные черты состава микробиома АСБ в группах с различной степенью рестеноза. Так, мы обнаружили микробные маркеры, представленность которых оказалась значимо выше в группе больных с рестенозом >70% (семейство Sphingomonadaceae, порядок Sphingomonadales), и в группе больных с рестенозом ≥50% (Cloacibacterium, семейство Weeksellaceae, порядок Flavobacteriales).
Sphingomonadales — это грамотрицательные бактерии из класса Alphaproteobacteria. Некоторые представители семейства Sphingomonadaceae обычно обитают в средах, подверженных воздействию человека, включая системы водоснабжения и медицинское оборудование. Известно, что многие виды Sphingomonadaceae не являются патогенными для человека или растений [23]. Ранее Sphingomonadales были обнаружены в АСБ пациентов с пародонтитом [21].
Cloacibacterium OTU_67 (Flavobacteriales), скорее всего, филогенетически наиболее близкая к виду Cloacibacterium normanense, относится к грамотрицательным неподвижным факультативным анаэробам, широко распространенным в морской среде и часто встречающимся в водорослях, рыбах, детрите или морских беспозвоночных, а также в активном иле и других частях очистных сооружений. В связи с частым присутствием этих флавобактерий в сточных водах было высказано предположение, что их источником может быть желудочно-кишечный тракт человека. Первоначально обнаруженная в сточных водах Cloacibacterium, тем не менее, довольно часто выявляется в клинических образцах. Так, численность Cloacibacterium в биоптатах слизистой оболочки прямой кишки у пациентов с колоректальными аденомами была повышена по сравнению с контрольной группой [24], бактерия была выявлена в подслизистой основе подвздошной кишки у пациентов с болезнью Крона [25], в биоптатах слизистой оболочки желудка у пациентов с диспепсией (причем повышенная численность Cloacibacterium ассоциировалась с наиболее резистентными штаммами Helicobacter pylori) [26]. Кроме того, Cloacibacterium была обнаружена в тканях опухолей поджелудочной железы [27] и тканях колоректальной аденокарциномы [28], в эндометрии женщин, перенесших гистерэктомию по поводу фибромиомы или гиперплазии эндометрия [29]. Данный микроорганизм также был выявлен в периферической крови у пациентов с миалгическим энцефаломиелитом/синдромом хронической усталости [30], на поверхности кожных покровов космонавтов Международной космической станции [31] и даже в участках головного мозга с признаками нейродегенерации у пациентов с болезнью Альцгеймера (выявлен единственный вид Cloacibacterium normanense) [32]. Ранее Cloacibacterium был выявлен при исследовании образцов АСБ сонных артерий у пациентов с пародонтитом [33].
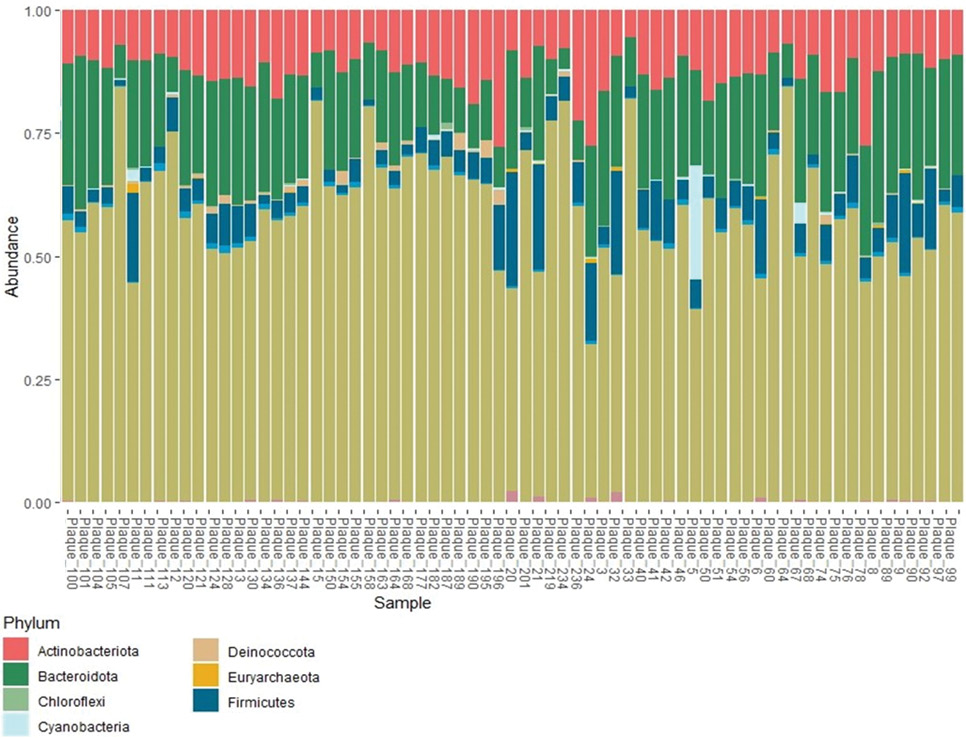
Рис. 1. Таксономическое разнообразие бактерий исследуемых образцов на уровне филумов.
Примечание: цветное изображение доступно в электронной версии журнала.
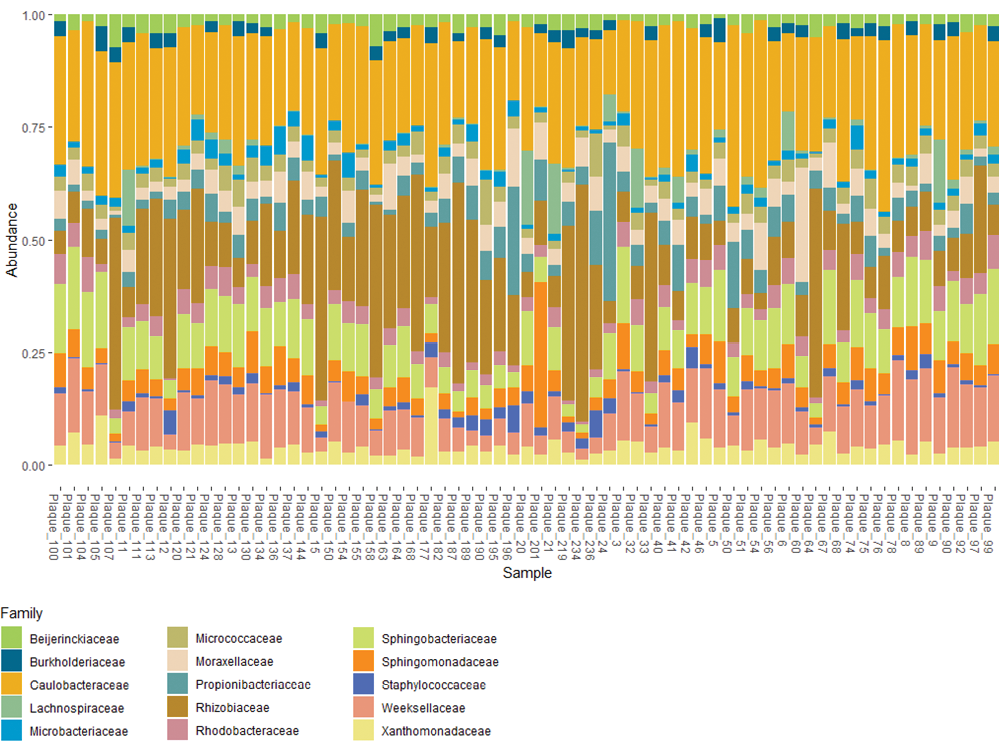
Рис. 2. Таксономическое разнообразие бактерий исследуемых образцов на уровне семейств.
Примечание: цветное изображение доступно в электронной версии журнала.
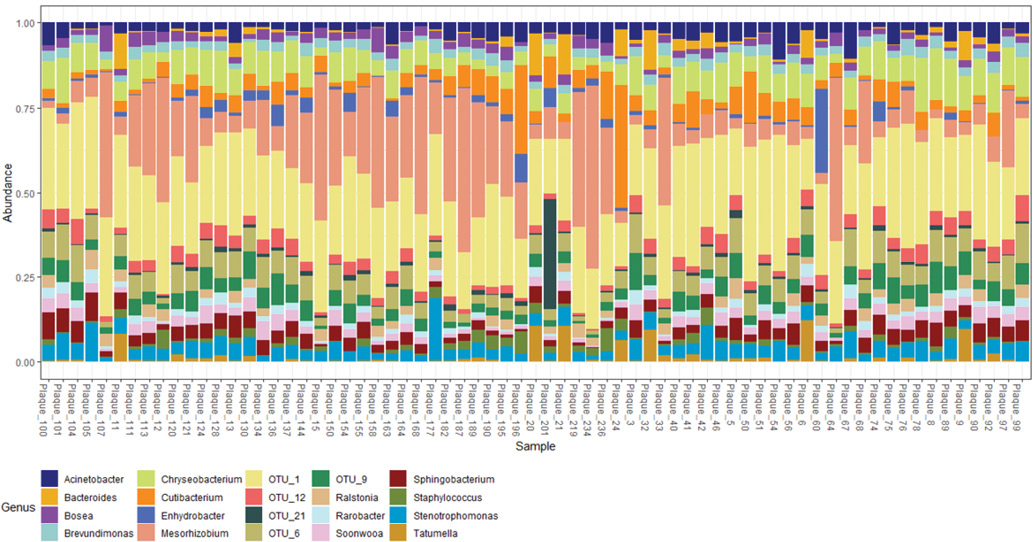
Рис. 3. Таксономическое разнообразие бактерий АСБ на уровне рода.
Примечание: цветное изображение доступно в электронной версии журнала.
Таблица 2
Ассоциации количественного состава микробиоты с отдельными группами
Порядок | Семейство | p value |
Рестеноз >50% vs рестеноз <50% | ||
Bacteroidales | Dysgonomonadaceae | 0,004 |
Propionibacteriales | Nocardioidaceae | 0,010 |
Burkholderiales | Comamonadaceae | 0,017 |
Sphingomonadales | Sphingomonadaceae | 0,020 |
Bacteroidales | Barnesiellaceae | 0,026 |
Oscillospirales | Ruminococcaceae | 0,030 |
Micrococcales | Micrococcaceae | 0,038 |
Bacteroidales | Muribaculaceae | 0,045 |
Стабильность АСБ | ||
Flavobacteriales | Weeksellaceae | 0,019 |
Deinococcales | Deinococcaceae | 0,035 |
Rhizobiales | Xanthobacteraceae | 0,037 |
Rhizobiales | Beijerinckiaceae | 0,042 |
Кальциноз АСБ | ||
Caulobacterales | Caulobacteraceae | 0,002 |
Rhizobiales | Rhizobiaceae | 0,005 |
Corynebacteriales | Corynebacteriaceae | 0,007 |
Lachnospirales | Lachnospiraceae | 0,009 |
Bacteroidales | Rikenellaceae | 0,014 |
Saccharimonadales | Saccharimonadaceae | 0,045 |
Протяженность АСБ | ||
Rhodobacterales | Rhodobacteraceae | 0,006 |
Chitinophagales | Chitinophagaceae | 0,008 |
Micrococcales | Cellulomonadaceae | 0,045 |
Сокращение: АСБ — атеросклеротическая бляшка.
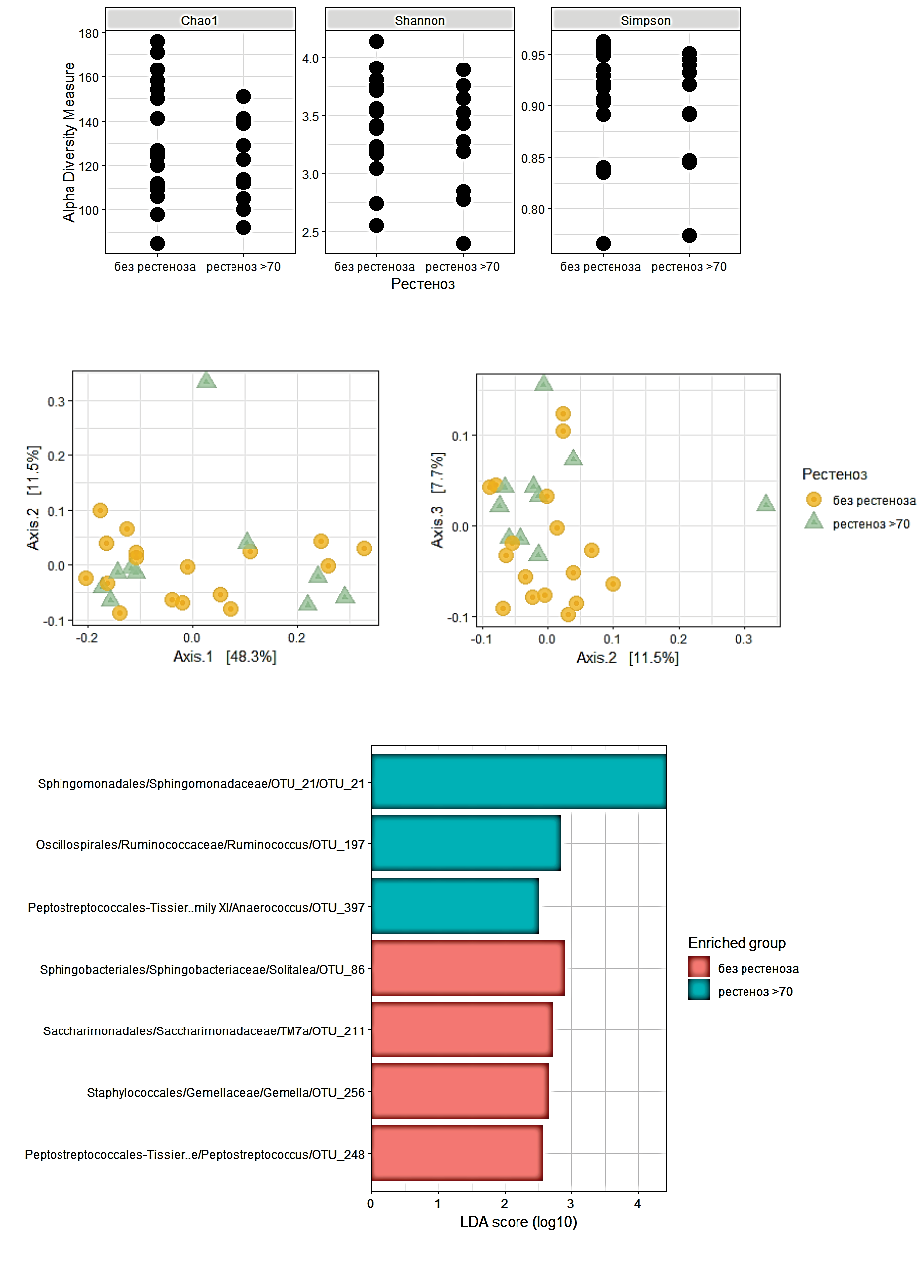
Рис. 4. Альфа-разнообразие (А), бета-разнообразие (Б) и LefSe-анализ (В) представленности бактериальных таксонов в образцах АСБ пациентов без рестеноза по сравнению с таковыми у пациентов со значимым рестенозом >70%.
Примечание: цветное изображение доступно в электронной версии журнала.
Сокращения: LDA score (log10) — значение линейного дискриминантного анализа, представленное десятичным логарифмом, OTU — operational taxonomic unit, операционная таксономическая единица.
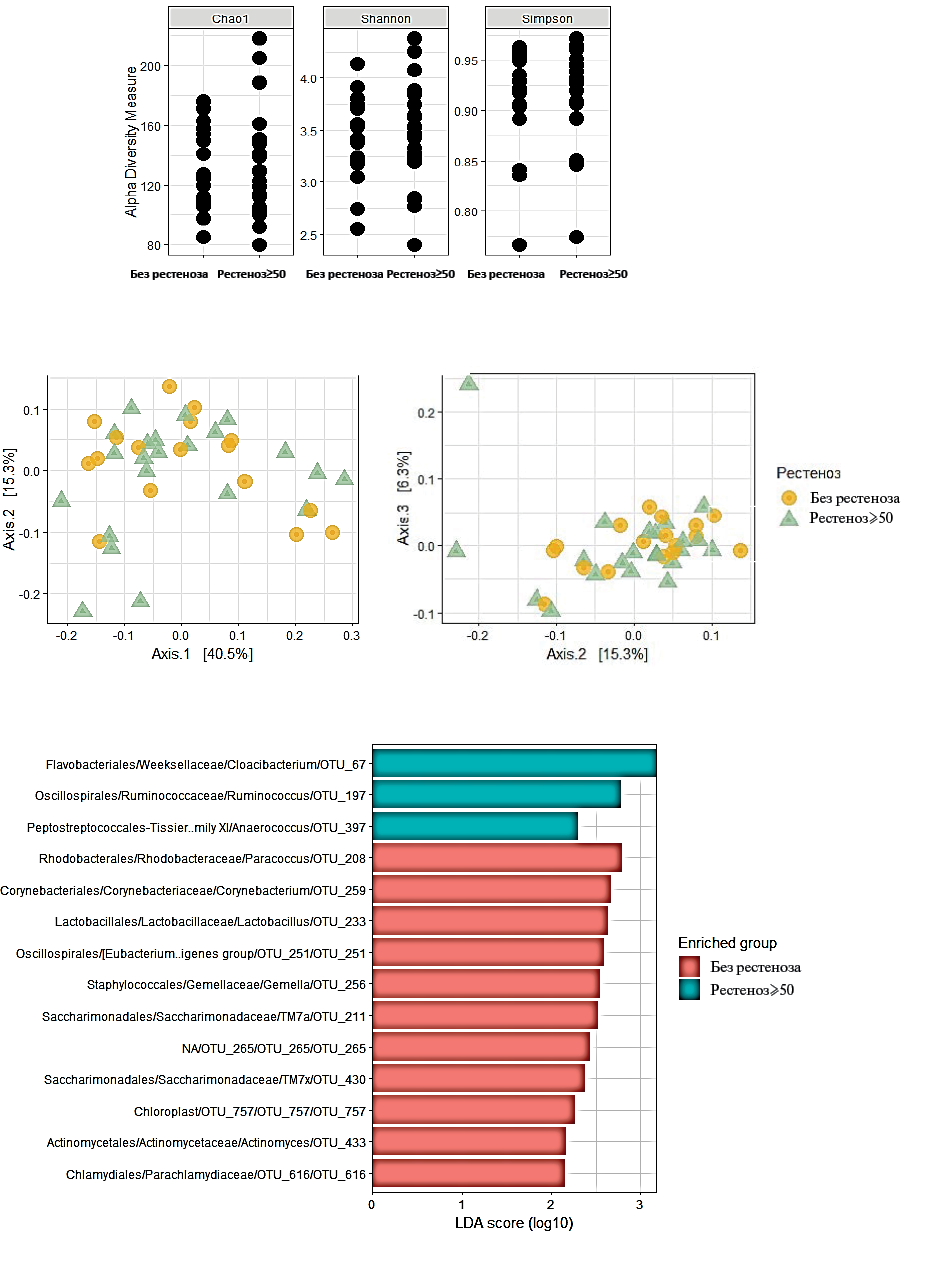
Рис. 5. Альфа-разнообразие (А), бета-разнообразие (Б) и LefSe-анализ (В) представленности бактериальных таксонов в образцах АСБ без рестеноза и с рестенозом >50%.
Примечание: цветное изображение доступно в электронной версии журнала.
Сокращения: LDA score (log10) — значение линейного дискриминантного анализа, представленное десятичным логарифмом, OTU — operational taxonomic unit, операционная таксономическая единица.
Обсуждение
Полученные нами результаты позволяют сделать ряд важных предположений. Во-первых, подтверждается гипотеза о том, что микробиом АСБ играет важную роль в развитии заболевания и его осложнений. Выявление большого количества грамотрицательных бактерий в АСБ, многие из которых являются широко распространенными в окружающей среде, указывает на потенциальную роль внешних факторов в формировании микробиома АСБ. Во-вторых, обнаружение потенциально патогенных бактерий в АСБ свидетельствует о том, что инфекционный компонент может быть вовлечен в патогенез атеросклероза. Эти бактерии могут способствовать воспалению в АСБ, повышая риск ее разрыва и развития тромбоза. Хотя хорошо документировано, что воспаление является важным фактором риска сосудистой патофизиологии, связь бактерий с атеросклерозом четко не установлена, во многом из-за невозможности изолировать живые бактерии из атероматозной ткани. Иммунные механизмы и микробиом АСБ могут играть важную роль в патогенезе атеросклероза и рестеноза сонных артерий. Поэтому понимание иммуномикробных взаимодействий в АСБ может привести к разработке новых методов лечения, направленных на снижение воспаления и стабилизацию АСБ.
Исследование микробиома АСБ открывает новые, дополнительные перспективы в борьбе с этим заболеванием. Безусловно, в дальнейшем необходимо провести более детальное изучение роли каждого из выявленных таксонов бактерий в патогенезе атеросклероза. Особый интерес представляет изучение влияния микробиома АСБ на рестеноз после эндартерэктомии. Для этого необходимо провести более глубокий анализ микробиома АСБ у пациентов с разным типом рестеноза, а также на разных стадиях развития АСБ. Помимо идентификации таксонов бактерий, следует исследовать их метаболические возможности и взаимодействие с иммунной системой хозяина. Важно отметить, что данное исследование является лишь первым шагом в изучении микробиома АСБ. Необходимо провести дополнительные исследования с участием большого количества пациентов, чтобы получить более полную картину о роли микробиома в развитии и прогрессировании атеросклероза и рестеноза.
Новейшие исследования, анализирующие микробиом АСБ у больных с каротидным и коронарным атеросклерозом, проливают свет на роль микроорганизмов в развитии и прогрессировании этого заболевания. Ранее исследования указывали на возможную роль хламидий в развитии атеросклероза. Однако попытки лечения макролидами не увенчались успехом. Полученные нами данные, сопоставляемые с результатами других исследователей, наводят на мысль о том, что в развитии атеросклероза участвуют другие микроорганизмы, идентификация которых требует дальнейшего изучения.
Анализ данных, представленных в таблице 3, показывает, что на уровне филумов (таксоны высокого ранга) наблюдается совпадение в составе микробиома АСБ у разных пациентов, в т. ч. при сравнении полученных нами данных и результатов других исследователей: Pseudomonadota (Proteobacteria), Bacillota (Firmicutes), Bacteroidota (Bacteroidetes), Actinomycetaceae, Chryseobacterium, Rhizobium. Это может свидетельствовать о том, что определенный набор микроорганизмов может быть характерен для АСБ, независимо от ее локализации.
Наше исследование, в котором проводилось сравнение пациентов с рестенозом и без него, выявляет новые аспекты воздействия микробиома.
Гипотеза: микроорганизмы, которые по количеству не имеют значимых различий между группами с рестенозом и без него, могут быть связаны с атеросклерозом как таковым, а микроорганизмы, различающиеся по количественному составу (в соответствии с анализом LefSe), могут оказывать влияние на развитие рестеноза. Это может быть обусловлено тем, что рестеноз, как правило, наблюдается на фоне более выраженного и прогрессирующего атеросклероза. Показательно, что выявленные нами грамотрицательные таксоны, связанные с рестенозом, особенно Sphingomonadales, относящиеся к классу Alphaproteobacteria, характеризуются выраженной липоксигеназной активностью, играющей важную роль в передаче сигналов от бактерий хозяину, а продуцируемые ими гликосфинголипиды являются мощными стимуляторами естественных T-клеток-киллеров (NKT-клеток), продуцирующих провоспалительные цитокины и способствующих атерогенезу [34]. При этом некоторые представители семейства Sphingomonadaceae, например, Sphingomonas sp. JEM-1, могут использовать 7-кетохолестерин, наиболее распространенное производное холестерина в АСБ, играющее важную роль в прогрессировании атеросклероза, в качестве единственного источника углерода и энергии.
Кроме того, примечательно, что в группе пациентов с рестенозом наблюдается тенденция к увеличению альфа-разнообразия бактерий в АСБ.
В кишечнике повышение альфа-разнообразия микробиоты свидетельствует, как правило, о здоровье и балансе экосистемы. Однако в АСБ повышенное микробное разнообразие может быть связано с патологией. Можно предположить, что в АСБ действуют иные механизмы, нежели в кишечнике. Возможно, повышенное разнообразие микроорганизмов в АСБ создает более агрессивную среду, способствующую воспалению и разрушению стенки артерии.
Широкий спектр возбудителей, обнаруживаемых в АСБ, приводит к предположению о многофакторной природе атеросклероза. Нахождение сходных микроорганизмов на уровне филумов побуждает к размышлениям о том, что определенные виды микроорганизмов могут быть в больше степени связаны с развитием и прогрессированием атеросклероза.
Полученные данные подчеркивают важность изучения микробиома АСБ и позволяют предположить, что многие микроорганизмы, включая те, которые ранее не рассматривались как факторы риска, могут играть критическую роль в этом процессе. В будущем предстоит изучить взаимодействие разных видов микроорганизмов между собой, а также их влияние на иммунную систему и клеточные процессы в сосудистой стенке. Безусловно, остаются вопросы, требующие дальнейших исследований: какие конкретно микроорганизмы играют ключевую роль в развитии атеросклероза и рестеноза? Как взаимодействуют микроорганизмы с иммунной системой и каким образом это влияет на прогрессирование заболевания?
Исследования показали наличие ДНК различных микроорганизмов в АСБ. Тем не менее в настоящий момент отсутствуют систематические работы, которые анализировали бы присутствие этих микроорганизмов в организме пациента на разных уровнях. На сегодняшний день имеются лишь исследования, в которых проведен сравнительный анализ состава микробиома АСБ, пародонта и кишечника. Кроме того, до сих пор не проводились исследования, которые бы рассматривали иммунный ответ организма на возбудители, обнаруженные в АСБ. Это создает пробел в понимании взаимодействия между микроорганизмами и иммунной системой в условиях атеросклероза, что подчеркивает необходимость дальнейших исследований в данной области для более глубокого изучения этой проблемы. Таким образом, наличие тех или иных микроорганизмов в АСБ в настоящее время не может быть однозначно интерпретировано. К ограничениям данного исследования следует отнести отсутствие анализа контрольных образцов хирургических материалов и помещений.
Новизна исследования. Получены новые данные о профиле микробиоты АСБ сонных артерий, а также выявлены особенности бактериального состава у пациентов с рестенозом и без рестеноза ВСА после КЭА.
Таблица 3
Обзор исследований микробиома АСБ
Состав микробиома АСБ | Локализация АСБ | Ссылка |
A. actinomycetemcomitans, P. gingivalis, T. forsythia | Коронарные артерии | doi:10.4103/0377-4929.134704 |
Семейства: Streptococcaceae, Actinomycetaceae, Lactobacillaceae, Corynebacteriaceae, Lactobacillaceae, Enterobacteriaceae, Pseudomonadaceae, Bacillaceae, and Oxalobacillaceae Род: Streptococcus, Actinomyces, and Corynebacterium, Neisseria and Haemophilus, Lachnospiraceae and Lautropia, HACEK group (Haemophilus, Cardiobacterium, and Kingella), Granulicatella and Abiotrophia | Коронарные артерии | doi:10.1177/11795468231225852 |
Acinetobacter, Chryseobacterium, Rhizobium, and Staphylococcus | Коронарные артерии | doi:10.1007/s12088-023-01082-9 |
Proteobacteria, Bacteroidetes, Parabacteroides; Escherichia; Christensenella; Bacteroides, Prevotella, Cloacibacterium, Flavobacterium, Rhizobiales | Коронарные артерии | doi:10.1038/s12276-020-00543-1 |
Firmicutes, Proteobacteria, Fusobacteria, Bacteroidetes, Actinobacteria, TM7 | Коронарные артерии | doi:10.4103/ijmm.IJMM_16_370 |
Proteobacteria, Actinobacteria, Bacteroidetes, Firmicutes | Сонные артерии | doi:10.1371/journal.pone.0164836 |
Firmicutes, Bacteroidetes, Actinobacteria, Fuzobacteria, Proteobacteria | Коронарные артерии | s.1011383107 |
Сокращение: АСБ — атеросклеротическая бляшка.
Заключение
Полученные нами данные свидетельствуют о том, что АСБ у пациентов после КЭА колонизированы грамотрицательными бактериями, повсеместно встречающимися в окружающей среде. Некоторые из этих микроорганизмов могут быть патогенными для человека, что потенциально приводит к возможному развитию хронического низкоуровневого системного воспаления, воспалительного процесса в сосудистой стенке и как следствие может способствовать развитию рестеноза. Большинство идентифицированных нами таксонов упоминаются в работах других авторов, которые также обнаруживали их в биоптате АСБ. Однако, несомненно, необходимы дальнейшие исследования, чтобы определить, являются ли эти бактерии просто комменсалами или играют непосредственную роль в развитии атеросклероза и рестеноза.
Отношения и деятельность. Исследование выполнено при финансовой поддержке Министерства науки и высшего образования Российской Федерации (Соглашение № 075-15-2022-301 от 20.04.2022).
1. World Health Organization. The top 10 causes of death. Accessed December 23, 2022. https://www.who.int/news-room/fact-sheets/detail/the-top-10-causesof-death. Дата обращения: 21.09.2024.
2. Число умерших по основным классам причин смерти. Демография. Федеральная служба государственной статистики. https://rosstat.gov.ru/folder/12781.
3. Andrews, S. FastQC: A Quality Control Tool for High Throughput Sequence Data. http://www.bioinformatics.babraham.ac.uk/projects/fastqc/ (2010).
Список литературы
1. Heck D, Jost A. Carotid stenosis, stroke, and carotid artery revascularization. Prog Cardiovasc Dis. 2021;65:49-54. doi:10.1016/j.pcad.2021.03.005.
2. Feigin VL, Stark BA, Johnson CO, et al. Global, regional, and national burden of stroke and its risk factors, 1990-2019: A systematic analysis for the Global Burden of Disease Study 2019. Lancet Neurol. 2021;20(10):1-26. doi:10.1016/S1474-4422(21)00252-0.
3. Aboyans V, Björck M, Brodmann M, et al.; ESC Scientific Document Group. Questions and answers on diagnosis and management of patients with Peripheral Arterial Diseases: a companion document of the 2017 ESC Guidelines for the Diagnosis and Treatment of Peripheral Arterial Diseases, in collaboration with the European Society for Vascular Surgery (ESVS): Endorsed by: the European Stroke Organisation (ESO) The Task Force for the Diagnosis and Treatment of Peripheral Arterial Diseases of the European Society of Cardiology (ESC) and of the European Society for Vascular Surgery (ESVS). Eur Heart J. 2018;39(9):e35-e41. doi:10.1093/eurheartj/ehx499.
4. Zhou F, Hua Y, Ji X, et al. A systemic review into carotid plaque features as predictors of restenosis after carotid endarterectomy. J Vasc Surg. 2021;73(6):2179-88.e4. doi:10.1016/j.jvs.2020.10.084.
5. Rosenfeld ME, Campbell LA. Pathogens and atherosclerosis: update on the potential contribution of multiple infectious organisms to the pathogenesis of atherosclerosis. Thromb Haemost. 2011;106(5):858-67. doi:10.1160/TH11-06-0392.
6. Lanter BB, Sauer K, Davies DG. Bacteria present in carotid arterial plaques are found as biofilm deposits which may contribute to enhanced risk of plaque rupture. mBio. 2014;5(3):e01206-14. doi:10.1128/mBio.01206-14.
7. Ott SJ, El Mokhtari NE, Musfeldt M, et al. Detection of diverse bacterial signatures in atherosclerotic lesions of patients with coronary heart disease. Circulation. 2006; 113(7):929-37. doi:10.1161/CIRCULATIONAHA.105.579979.
8. Fiehn NE, Larsen T, Christiansen N, et al. Identification of periodontal pathogens in atherosclerotic vessels. J Periodontol. 2005;76(5):731-6. doi:10.1902/jop.2005.76.5.731.
9. Mitra S, Drautz-Moses DI, Alhede M, et al. In silico analyses of metagenomes from human atherosclerotic plaque samples. Microbiome. 2015;3:38. doi:10.1186/s40168-015-0100-y.
10. Чернявский М. А., Иртюга О. Б., Янишевский С. Н. и др. Российский консенсус по диагностике и лечению пациентов со стенозом сонных артерий. Российский кардиологический журнал. 2022;27(11):5284. doi:10.15829/1560-4071-2022-5284.
11. Ewels P, Magnusson M, Lundin S, et al. MultiQC: summarize analysis results for multiple tools and samples in a single report. Bioinformatics. 2016;32(19):3047-8. doi:10.1093/bioinformatics/btw354.
12. Bolger AM, Lohse M, Usadel B. Trimmomatic: a flexible trimmer for Illumina sequence data. Bioinformatics. 2014;30(15):2114-20. doi:10.1093/bioinformatics/btu170.
13. Callahan BJ, McMurdie PJ, Rosen MJ, et al. DADA2: High-resolution sample inference from Illumina amplicon data. Nat Methods. 2016;13(7):581-3. doi:10.1038/nmeth.3869.
14. Mirdita M, Steinegger M, Breitwieser F, et al. Fast and sensitive taxonomic assignment to metagenomic contigs. Bioinformatics. 2021;37(18):3029-31. doi:10.1093/bioinformatics/btab184.
15. McMurdie PJ, Holmes S. phyloseq: an R package for reproducible interactive analysis and graphics of microbiome census data. PLoS One. 2013;8(4):e61217. doi:10.1371/journal.pone.0061217.
16. Cao Y, Dong Q, Wang D, et al. microbiomeMarker: an R/Bioconductor package for microbiome marker identification and visualization. Bioinformatics. 2022;38(16):4027-9. doi:10.1093/bioinformatics/btac438.
17. Abraham W-R, Rohde M, Bennasar A. The Family Caulobacteraceae. In: Rosenberg E, DeLong EF, Lory S. The Prokaryotes: Alphaproteobacteria and Betaproteobacteria. 4th ed. Springer. 2014:179-205. ISBN: 978-3-642-30197-1. doi:10.1007/978-3-642-30197-1_259.
18. Amar J, Lelouvier B, Servant F, et al. Blood Microbiota Modification After Myocardial Infarction Depends Upon Low-Density Lipoprotein Cholesterol Levels. J Am Heart Assoc. 2019;8(19):e011797. doi:10.1161/JAHA.118.011797.
19. Colombi E, Perry BJ, Sullivan JT, et al. Comparative analysis of integrative and conjugative mobile genetic elements in the genus Mesorhizobium. Microb Genom. 2021;7(10): 000657. doi:10.1099/mgen.0.000657.
20. Aujoulat F, Marchandin H, Zorgniotti I, et al. Rhizobium pusense is the main human pathogen in the genus Agrobacterium/Rhizobium. Clin Microbiol Infect. 2015;21(5):472. e1-5. doi:10.1016/j.cmi.2014.12.005.
21. Isoshima D, Yamashiro K, Matsunaga K, et al. Microbiome composition comparison in oral and atherosclerotic plaque from patients with and without periodontitis. Odontology. 2021;109(1):239-49. doi:10.1007/s10266-020-00524-w.
22. Зубова К. В. Бактерии порядка Flavobacteriales: экологические особенности и клиническое значение в развитии патологии человека: обзор. Вестник Пермского университета. Сер. Биология. 2023;1:58-64. doi:10.17072/1994-9952-2023-1-58-64.
23. Glaeser SP, Kämpfer P. The Family Sphingomonadaceae. In: Rosenberg E, DeLong EF, Lory S. The Prokaryotes: Alphaproteobacteria and Betaproteobacteria. 4th ed. Springer. 2014:641-707. ISBN: 978-3-642-30197-1. doi:10.1007/978-3-642-30197-1_302.
24. Sanapareddy N, Legge RM, Jovov B, et al. Increased rectal microbial richness is associated with the presence of colorectal adenomas in humans. ISME J. 2012;6(10):1858-68. doi:10.1038/ismej.2012.43.
25. Chiodini RJ, Dowd SE, Chamberlin WM, et al. Microbial Population Differentials between Mucosal and Submucosal Intestinal Tissues in Advanced Crohn's Disease of the Ileum. PLoS One. 2015;10(7):e0134382. doi:10.1371/journal.pone.0134382.
26. Dewayani A, Afrida Fauzia K, Alfaray RI, et al. Gastric microbiome changes in relation with Helicobacter pylori resistance. PLoS One. 2023;18(5):e0284958. doi:10.1371/journal.pone.0284958.
27. Khan S, Banerjee G, Setua S, et al. Metagenomic analysis unveils the microbial landscape of pancreatic tumors. Front Microbiol. 2023;14:1275374. doi:10.3389/fmicb.2023.1275374.
28. Mouradov D, Greenfield P, Li S, et al. Oncomicrobial Community Profiling Identifies Clinicomolecular and Prognostic Subtypes of Colorectal Cancer. Gastroenterology. 2023; 165(1):104-20. doi:10.1053/j.gastro.2023.03.205.
29. Winters AD, Romero R, Gervasi MT, et al. Does the endometrial cavity have a molecular microbial signature? Sci Rep. 2019;9(1):9905. doi:10.1038/s41598-019-46173-0.
30. Ellis JE, Missan DS, Shabilla M, et al. Microbial community profiling of peripheral blood in myalgic encephalomyelitis/chronic fatigue syndrome. Human Microbiome Journal. 2018;9:16-21. doi:10.1016/j.humic.2018.05.003.
31. Tozzo P, Delicati A, Caenazzo L. Skin Microbial Changes during Space Flights: A Systematic Review. Life (Basel). 2022;12(10):1498. doi:10.3390/life12101498.
32. Ko YK, Kim E, Lee EJ, et al. Enrichment of infection-associated bacteria in the low biomass brain bacteriota of Alzheimer's disease patients. PLoS One. 2024;19(2): e0296307. doi:10.1371/journal.pone.0296307.
33. Brun A, Nuzzo A, Prouvost B, et al. Oral microbiota and atherothrombotic carotid plaque vulnerability in periodontitis patients. A cross-sectional study. J Periodontal Res. 2021;56(2):339-50. doi:10.1111/jre.12826.
34. Brochado-Kith O, Rava M, Berenguer J, et al.; Escorial Study Group. Altered blood microbiome in patients with HCV-related Child-Pugh class B cirrhosis. J Infect Public Health. 2024;17(10):102524. doi:10.1016/j.jiph.2024.102524.
Об авторах
Е. П. КолесоваРоссия
К.м.н., в.н.с. НИЛ популяционной генетики НИО генетических рисков и персонифицированной профилактики НЦМУ.
Санкт-Петербург
Конфликт интересов:
Нет
М. А. Чернявский
Россия
Д. м. н., зав. НИО сосудистой и интервенционной хирургии, врач сердечно-сосудистый хирург, доцент кафедры факультетской хирургии с клиникой.
Санкт-Петербург
Конфликт интересов:
Нет
А. Г. Ванюркин
Россия
М. н. с. НИО сосудистой и интервенционной хирургии, врач сердечно-сосудистый хирург.
Санкт-Петербург
Конфликт интересов:
Нет
Е. В. Верховская
Россия
Клинический ординатор.
Санкт-Петербург
Конфликт интересов:
Нет
Е. К. Зайкова
Россия
М. н. с. НИЛ аутоиммунных и аутовоспалительных заболеваний НЦМУ "Центр персонализированной медицины".
Санкт-Петербург
Конфликт интересов:
Нет
О. В. Калинина
Россия
Д. б. н., профессор кафедры лабораторной медицины и генетики, в.н.с. НИЛ аутоиммунных и аутовоспалительных заболеваний НЦМУ "Центр персонализированной медицины".
Санкт-Петербург
Конфликт интересов:
Нет
С. И. Ситкин
Россия
К.м.н., главный ученый секретарь Научного общества гастроэнтерологов России, зав. НИГ эпигенетики и метагеномики Института перинатологии и педиатрии.
Санкт-Петербург
Конфликт интересов:
Нет
А. Л. Маслянский
Россия
Д. м. н., руководитель НИЛ ревматологии и иммунопатологии; профессор.
Санкт-Петербург
Конфликт интересов:
Нет
В. В. Кван
Россия
М. н. с. НИЛ популяционной генетики НИО генетических рисков и персонифицированной профилактики НЦМУ "Центра персонифицированной медицины".
Санкт-Петербург
Конфликт интересов:
Нет
Е. Ю. Васильева
Россия
К. м. н., зав. центральной клинико-диагностической лаборатории.
Санкт-Петербург
Конфликт интересов:
Нет
А. Н. Яковлев
Россия
К.м.н., зав. НИЛ технологий прогнозирования риска развития сердечно-сосудистых осложнений НИО генетических рисков и персонифицированной профилактики НЦМУ, зав. НИЛ острого коронарного синдрома, доцент кафедры "Анестезиологии и реаниматологии".
Санкт-Петербург
Конфликт интересов:
Нет
А. Ю. Бабенко
Россия
Д.м.н., зав. НИО генетических рисков и персонифицированной профилактики, зав. НИЛ предиабета и метаболических нарушений НЦМУ "Центр персонализированной медицины", зав. НИЛ диабетологии, профессор кафедры "Внутренних болезней".
Санкт-Петербург
Конфликт интересов:
Нет
А. О. Конради
Россия
Д.м.н., профессор, академик РАН, зам. генерального директора по научной работе, зав. НИО артериальной гипертензии, зав. кафедрой "Организации управления и экономики здравоохранения ИМО".
Санкт-Петербург
Конфликт интересов:
Нет
Е. В. Шляхто
Россия
Президент Российского кардиологического общества, академик РАН, профессор, д.м.н., генеральный директор.
Санкт-Петербург
Конфликт интересов:
Нет
Дополнительные файлы
- С использованием метода высокопроцессивного секвенирования участка V4 гена 16SрРНК проанализирован профиль микробиоты 76 образцов атеросклеротических бляшек, полученных во время каротидной эндартерэктомии, а также определены таксономические различия между группами пациентов с развившимся послеоперационным рестенозом и без рестеноза.
- Наиболее представленными оказались четыре семейства бактерий: Caulobacteraceae, Rhizobiaceae, Sphingobacteriaceaeи Weeksellaceae.
- Линейный дискриминантный анализ размера эффекта LefSe выявил значимо более высокую представленность микробного маркера OTU_21, относящегося к семейству Sphingomonadaceae, у пациентов с рестенозом ≥50%, а также Cloacibacterium(OTU_67), входящего в семейство Weeksellaceae, у пациентов с рестенозом >70%.
- Выявление большого разнообразия грамотрицательных бактерий в атеросклеротической бляшке, в т. ч. широко распространенных в окружающей среде, указывает на потенциальную роль микроорганизмов различного происхождения как в формировании бляшки, так и в развитии рестеноза.
Рецензия
Для цитирования:
Колесова Е.П., Чернявский М.А., Ванюркин А.Г., Верховская Е.В., Зайкова Е.К., Калинина О.В., Ситкин С.И., Маслянский А.Л., Кван В.В., Васильева Е.Ю., Яковлев А.Н., Бабенко А.Ю., Конради А.О., Шляхто Е.В. Особенности микробиома атеросклеротической бляшки у пациентов после каротидной эндартерэктомии. Российский кардиологический журнал. 2024;29(12):6145. https://doi.org/10.15829/1560-4071-2024-6145. EDN: VENBZB
For citation:
Kolesova E.P., Chernyavsky M.A., Vanyurkin A.G., Verkhovskaya E.V., Zaykova E.K., Kalinina O.V., Sitkin S.I., Maslyansky A.L., Kvan V.V., Vasilyeva E.Yu., Yakovlev A.N., Babenko A.Yu., Konradi A.O., Shlyakhto E.V. Features of the atherosclerotic plaque microbiome in patients after carotid endarterectomy. Russian Journal of Cardiology. 2024;29(12):6145. (In Russ.) https://doi.org/10.15829/1560-4071-2024-6145. EDN: VENBZB
JATS XML

















































