Перейти к:
Стратификация риска внезапной сердечной смерти при дилатационной кардиомиопатии: обзор современного состояния проблемы
https://doi.org/10.15829/1560-4071-2025-6114
EDN: BOSXIO
Аннотация
Дилатационная кардиомиопатия является одной из наиболее распространенных форм кардиомиопатии, характеризующейся дилатацией и систолической дисфункцией левого желудочка. Заболевание сопровождается высоким риском неблагоприятных исходов, включая декомпенсацию хронической сердечной недостаточности и внезапную сердечную смерть (ВСС). Традиционно для выявления кандидатов на имплантацию кардиовертера-дефибриллятора с целью первичной профилактики ВСС использовалось лишь значение фракции выброса левого желудочка ≤35%. Однако с прогрессом в методах медикаментозной терапии хронической сердечной недостаточности, ресинхронизирующей терапии и современных методах визуализации сердца, таких как магнитно-резонансная томография с отсроченным контрастированием, а также генетических исследований, появилась необходимость пересмотра подходов к стратификации риска ВСС. Настоящая работа посвящена обзору современного состояния проблемы — стратификации риска ВСС у пациентов с дилатационной кардиомиопатией. Особое внимание уделяется роли методов МР-визуализации и генетических исследований, которые значительно расширяют возможности оценки риска и позволяют более точно идентифицировать пациентов, нуждающихся в установке кардиовертера-дефибриллятора с целью первичной профилактики ВСС.
Ключевые слова
Для цитирования:
Бердибеков Б.Ш., Булаева Н.И., Александрова С.А., Голухова Е.З. Стратификация риска внезапной сердечной смерти при дилатационной кардиомиопатии: обзор современного состояния проблемы. Российский кардиологический журнал. 2025;30(6S):6114. https://doi.org/10.15829/1560-4071-2025-6114. EDN: BOSXIO
For citation:
Berdibekov B.Sh., Bulaeva N.I., Alexandrova S.A., Golukhova E.Z. Sudden cardiac death risk stratification in dilated cardiomyopathy: a state of the art review. Russian Journal of Cardiology. 2025;30(6S):6114. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6114. EDN: BOSXIO
Дилатационная кардиомиопатия (ДКМП) — одна из наиболее распространенных типов кардиомиопатии, которая характеризуется дилатацией и систолической дисфункцией левого желудочка (ЛЖ), не объяснимых аномальными условиями нагрузки или ишемической болезнью сердца [1]. Актуальность исследования патологии обусловлена ее возрастающей распространенностью (согласно современным данным частота случаев ДКМП в клинической практике может достигать 1:250-500) [2], крайней гетерогенностью этиологии, значительным полиморфизмом клинических проявлений, отсутствием единых подходов к риск-стратификации [1]. Пациенты с установленным диагнозом ДКМП подвержены высокому риску как неблагоприятных событий, связанных с декомпенсацией хронической сердечной недостаточности (ХСН), так и развития жизнеугрожающих желудочковых аритмий (ЖА). Частота внезапной сердечной смерти (ВСС) при ДКМП составляет от 2 до 4% в год [3]. Изобретение и широкое клиническое применение имплантируемых кардиовертеров-дефибрилляторов (ИКД) у пациентов с жизнеугрожающими желудочковыми нарушениями ритма сделало настоящий прорыв в возможностях профилактики ВСС [4]. До недавнего времени в отечественных и международных рекомендациях по сердечной недостаточности (СН) и профилактике ВСС — фракция выброса (ФВ) ЛЖ оставалась единственным показателем для выявления кандидатов для имплантации кардиовертеров-дефибрилляторов (КВД) с целью первичной профилактики ВСС [4][5]. Данные рекомендации прежде всего базировались на рандомизированных клинических исследованиях (РКИ), которые были проведены еще вначале текущего столетия, где было показано, что ФВ ЛЖ <30-35% является основным показанием для профилактической установки КВД. Однако эволюция методов медикаментозной терапии ХСН, а также проведение ресинхронизирующей терапии при наличии блокады левой ножки пучка Гиса, существенно изменило портрет пациентов с СН со сниженной ФВ ЛЖ. Кроме того, развитие методов визуализации сердца, в т. ч. с применением магнитно-резонансной томографии (МРТ) с отсроченным контрастированием, прогресс в методах генетического исследования у пациентов с ДКМП существенно расширили наши возможности в стратификации риска ВСС у данной гетерогенной популяции пациентов [6-8]. Настоящая работа посвящена обзору современного состояния проблемы стратификации риска ВСС у пациентов с ДКМП и роли современных методов МР-визуализации и генетического исследования. Для достижения этой цели в работе будут рассмотрены следующие этапы [9], такие как анализ текущего состояния, историческое развитие подходов к прогнозированию риска и первичной профилактики ВСС, также будущие направления и перспективы стратификации риска ВСС у пациентов с ДКМП.
Современные клинические рекомендации по первичной профилактике ВСС при ДКМП
Первоначальный вопрос, "Где мы сейчас находимся?" — на который следует ответить, приступая к обзору современного состояния проблемы профилактики ВСС. Мы можем отметить лишь основные концепции первичной профилактики ВСС, отраженные в текущих руководствах по профилактике ВСС. До недавнего времени в рекомендациях по СН и профилактике ВСС ФВ ЛЖ оставалась единственным показателем для выявления кандидатов для имплантации КВД с целью первичной профилактики ВСС. Данные рекомендации прежде всего были основаны на исследованиях, проведенных два десятилетия назад (2002-2005гг), когда было доказано, что ФВ ЛЖ <30-35% является основным показанием для профилактической имплантации КВД. Однако развитие методов визуализации сердца, в т. ч. с применением МРТ с отсроченным контрастированием, прогресс в методах генетического исследования у пациентов с ДКМП, накопление данных о прогностической роли методик визуализации сердца и выявление генов, ассоциированных с риском ВСС, привело к изменению концепции первичной профилактики ВСС, что соответственно отразилось в клинических рекомендациях.
Согласно текущим рекомендациям Европейского общества кардиологов (ЕОК) по ВСС от 2022г [10], имплантацию ИКД следует рассматривать у пациентов с ДКМП и симптоматической ХСН (NYHA II-III функционального класса (ФК)) со сниженной ФВ ЛЖ ≤35%, несмотря на оптимальную медикаментозную терапию (ОМТ) свыше 3 мес. (IIa А). В данных рекомендациях впервые с момента появления концепции первичной профилактики ВСС снизился уровень рекомендаций с I на IIa для имплантации КВД с целью первичной профилактики ВСС, основанный на ФВ ЛЖ и ФК СН по NYHA. В руководстве указано, что МРТ сердца с поздним контрастным усилением сигнала гадолинием следует рекомендовать пациентам, страдающим ДКМП, для оценки этиологии и риска ЖА/ВСС (IIa B). Генетическое тестирование, включающее как минимум гены LMNA, PLN, RBM20 и FLNC, рекомендуется пациентам с ДКМП и нарушениями атриовентрикулярной проводимости в возрасте до 50 лет или с семейным анамнезом ДКМП или случаями ВСС у родственника первой степени родства (в возрасте до 50 лет) (I B). Кроме того, появились разделы в отношении роли генетических маркеров и МРТ параметров при определении показаний к имплантации КВД. Так, имплантацию ИКД следует рассматривать у пациентов с ДКМП и подтвержденной патологической мутацией LMNA, если предполагаемый 5-летний риск жизнеугрожающих ЖА ≥10% и при наличии неустойчивой желудочковой тахикардии (НУЖТ) или ФВ ЛЖ <50% или нарушения атриовентрикулярной проводимости (IIa B). Кроме того, имплантацию ИКД следует рассмотреть у пациентов с ДКМП с ФВ ЛЖ <50% и наличием не <2 факторов риска (обморок, позднее накопление гадолиния (late gadolinium enhancement, LGE) по МРТ, индукция устойчивой желудочковой тахикардии (ЖТ), патогенные мутации в генах LMNA, PLN, FLNC и RBM20) (IIa C). Рекомендации ЕОК 2023г по лечению кардиомиопатий представляют собой важнейшую веху в диагностике и ведении группы пациентов с гетерогенными заболеваниями миокарда [1]. В данном документе также отмечено, что при оценке риска ВСС при ДКМП следует учитывать генотип пациента (IIa B). ИКД терапия должна быть рассмотрена у пациентов с ДКМП и генотипом, ассоциированным с высоким риском ВСС, и ФВ ЛЖ >35% при наличии дополнительных факторов риска (табл. 1) (IIa С). Кроме того, ИКД терапия может быть рассмотрена у пациентов с ДКМП и генотипом, ассоциированным с высоким риском ВСС, и ФВ ЛЖ >35% и при отсутствии дополнительных факторов риска (табл. 1) (IIb С). Наконец, ИКД терапия может быть рассмотрена при отсутствии генотипа, связанного с ВСС и ФВ ЛЖ >35% при наличии дополнительных факторов как обморок или LGE по МРТ (IIb С).
Таблица 1
Генотипы высокого риска и ассоциированные с ними предикторы ВСС [1]
|
Ген |
Частота ВСС в год |
Предикторы ВСС |
|
LMNA |
5-10% |
Предполагаемый 5-летний риск жизнеугрожающих ЖА по LMNA risk score (https://lmna-risk-vta.fr) |
|
FLNC (укороченные варианты) |
5-10% |
LGE по МРТ; ФВ ЛЖ <45% |
|
TMEM438 |
5-10% |
Мужской пол; женский пол и любой из следующих факторов: ФВ ЛЖ <45%, НУЖТ, LGE по МРТ сердца, >200 ЖЭ на 24-часовом холтеровском ЭКГ |
|
PLN |
3-5% |
Предполагаемый 5-летний риск жизнеугрожающих ЖА по PLN risk score (https://plnriskcalculator.shinyapps.io/final_shiny) LGE по МРТ ФВ ЛЖ <45% НУЖТ |
|
DSP |
3-5% |
LGE по МРТ ФВ ЛЖ <45% |
|
RBM20 |
3-5% |
LGE по МРТ ФВ ЛЖ <45% |
Сокращения: ВСС — внезапная сердечная смерть, ЖА — желудочковая аритмия, ЖЭ — желудочковая экстрасистолия, МРТ — магнитно-резонансная томография, НУЖТ — неустойчивая желудочковая тахикардия, ФВ ЛЖ — фракция выброса левого желудочка, ЭКГ — электрокардиография, DSP — десмоплакин (desmoplakin), FLNC — филамин C (filamin C), LGE — late gadolinium enhancement, позднее накопление гадолиния, LMNA — ламин A/C (lamin A/C), PLN — фосфоламбан (phospholamban), RMB20 — РНК-связывающий белок 20 (RNA binding motif protein 20).
Таким образом, на данный момент в рекомендациях в отношении стратификации риска ВСС у пациентов с ДКМП наряду с ФВ ЛЖ особая роль принадлежит МРТ сердца с контрастным усилением и генетическому тестированию.
Методология исследования
Стратегия поиска информации для данного раздела обзора была проведена двумя авторами независимо друг от друга в базах данных PubMed (MEDLINE) и Google Scholar. Для поиска исследований в базах данных использовались следующие ключевые слова: ("dilated cardiomyopathy" OR "non-ischaemic dilated cardiomyopathy" OR "idiopathic dilated cardiomyopathy" OR "heart failure") AND ("implantable cardioverter defibrillator" OR "ICD") AND ("sudden cardiac death" OR "ventricular arrhythmias") AND "randomized controlled trial". Учитывая, что первые РКИ по профилактике ВСС с использованием ИКД были начаты в середине 90-х годов прошлого века, в обзор были включены РКИ с использованием ИКД терапии для профилактики ВСС, опубликованные в период с 1990г по настоящее время. Последний поиск данных для включения в данный анализ был проведен в августе 2024г.
Формирование концепции первичной профилактики ВСС
Исторические аспекты формирования концепции первичной профилактики ВСС. Итак, "как мы сюда попали?" — второй важный вопрос, который следует осветить, исходя из цели текущего обзора. Концепция профилактики ВСС с использованием ИКД начала разрабатываться с момента публикаций исследований AVID (1997) [11], CIDS (2000) [12] и CASH (2000) [13], где была убедительно продемонстрирована польза ИКД-терапии у пациентов, переживших внезапную аритмическую смерть или гемодинамически значимые устойчивые ЖТ по сравнению с антиаритмической терапией. В результате этих исследований была разработана стратегия вторичной профилактики ВСС, которая на данный момент не претерпела значительных изменений. Согласно современным рекомендациям, ИКД-терапия показана пациентам с документированной фибрилляцией желудочков или ЖТ с выраженными изменениями гемодинамики, при условии отсутствия преходящих причин их развития и спустя 48 ч после инфаркта миокарда.
Однако основной интерес исследований был направлен на определение пользы ИКД-терапии у больных, имеющих высокий риск развития жизнеугрожающих ЖА, т. е. для первичной профилактики ВСС и ЖТ. Основными критериями отбора в эти исследования явились дисфункция ЛЖ (ФВ ≤30-40%) и ФК ХСН (II-III ФК по NYHA). Следует отметить, что в первоначальных исследованиях наряду с ФВ ЛЖ и ФК ХСН (MADIT (1996) [14], MUSTT (1993) [15], DEFINITE (2004) [16]) имелись аритмические критерии включения пациентов, такие как неустойчивая ЖТ и/или индуцируемая ЖТ во время электрофизиологического исследования. Однако в последующих исследованиях (MADIT-II (2002) [17], SCD-HeFT (2005) [18]) основными критериями включения были только II-III ФК по NYHA и дисфункция ЛЖ (ФВ ЛЖ ≤30-35%). В случае пациентов с ишемической этиологией ХСН польза ИКД-терапии в отношении как снижения ВСС, так и общей смертности была четко установлена в исследованиях MADIT I и MADIT II [19]. У пациентов с неишемической этиологией ХСН изначально все было не так однозначно. Так, первые два рандомизированные контролируемые исследования CAT и AMIOVIRT (2002-2003) были прекращены досрочно, т. к. они не обнаружили различий в эффективности ИКД-терапии над терапией амиодароном в профилактике ВСС у пациентов с ДКМП [20][21]. Основным недостатком вышеуказанных исследований был малый размер выборки, и общий уровень смертности был ниже, чем ожидалось до начала исследования. В третье рандомизированное исследование DEFINITE (2004) [16] были включены 458 пациентов с неишемической кардиомиопатией, ФВ ЛЖ <35% (в среднем 21%) с частыми желудочковыми экстрасистолами или неустойчивой ЖТ. В течение периода наблюдения 29±14 мес. отмечалось значительное снижение риска ВСС (отношение рисков (ОР) 0,20; 95% доверительный интервал (ДИ): 0,06-0,70; p=0,006) в группе ИКД-терапии в дополнение к ОМТ по сравнению с изолированной ОМТ. Однако в отношении основной конечной точки исследования отмечалась лишь тенденция к снижению общей смертности в группе ИКД-терапии по сравнению с контрольной группой (ОР 0,65; 95% ДИ: 0,40-1,06; p=0,08). Таким образом, вышеупомянутые исследования не показали какой-либо реальной пользы в отношении снижения общей смертности ИКД-терапии у пациентов с неишемической СН. Это было показано только в последующем исследовании SCD-HeFT (2005) [18], в которое были включены >2500 пациентов с II-III ФК СН по NYHA и ФВ ЛЖ <35%. Пациенты были рандомизированы на три группы: традиционная медикаментозная терапия СН плюс плацебо (847 пациента), традиционная терапия плюс амиодарон (845 пациента) и традиционная терапия плюс ИКД (829 пациента) [18]. В данное исследование включались пациенты как с ишемической (52%), так и с неишемической (48%) СН со средней ФВ ЛЖ 25%, благоприятный эффект ИКД-терапии был продемонстрирован в обеих группах. За медианный период наблюдения 45,5 мес. произошло 244 смерти (29%) в группе плацебо, 240 (28%) в группе амиодарона и 182 (22%) в группе ИКД. По сравнению с плацебо амиодарон был связан с аналогичным риском смерти (р=0,53), в то время как ИКД-терапия была связана со статистически значимым снижением риска смерти (ОР 0,77; 95% ДИ: 0,62-0,96; р=0,007). Таким образом, на основе вышеуказанных РКИ в 2005-2006гг окончательно сформировались основные концепции первичной профилактики ВСС [4], что отразилось в клинических рекомендациях, где было указано, что ИКД-терапия рекомендована для уменьшения риска ВСС пациентам с дисфункцией ЛЖ (ФВ ЛЖ ≤35%) и СН (II-III ФК по NYHA).
Проблемы первичной профилактики ВСС. Данные регистров продемонстрировали, что в реальной клинической практике у пациентов с имплантированными КВД лишь небольшая доля больных переносят мотивированные срабатывания устройств. Так, по данным реестра ИКД (2015) с участием >2300 пациентов, годовая частота мотивированных срабатываний составила лишь 1,1%, через 30 мес. частота срабатываний составила 2,6% [22]. Таким образом, большинство пациентов с ИКД с целью первичной ВСС так и не получают пользу от данной терапии, в то время как другие лишены возможности спастись от аритмической смерти, поскольку не соответствуют текущим критериям отбора для первичной профилактики ВСС, а если учесть стоимость обеспечения этого профилактического вмешательства, то ситуация кажется еще более плачевной. Логично возникает вопрос, почему мы находимся в этом затруднительном положении?
В настоящее время ФВ ЛЖ остается краеугольным камнем для выявления кандидатов для установки КВД с целью первичной профилактики ВСС как в зарубежных, так и в отечественных рекомендациях по ВСС и СН [10][23]. Данные рекомендации основаны, как уже отмечалось, на исследованиях, проведенных два десятилетия назад, где было показано, что ФВ ЛЖ <30-35% является основным показанием для профилактической имплантации КВД. Однако на данный момент известно, что большинство больных (>70%), перенесших ВСС, имеют ФВ ЛЖ >35%. Так, в исследование Stecker EC, et al. было включено 2093 больных с абортированной ВСС, было показано, что лишь у 20,5% ФВ ЛЖ была ≤35% [24]. Вышеуказанные данные подчеркивают потребность к идентификации больных с ФВ ЛЖ >35% с высоким риском ВСС, поскольку основное бремя ВСС лежит именно в данной подгруппе и не учитываются в рекомендациях по первичной профилактике ВСС.
Публикация результатов исследования DANISH (2016) в очередной раз подтолкнула нас к пониманию несовершенств текущих критериев отбора пациентов для имплантации КВД с целью первичной профилактики ВСС у пациентов с неишемической кардиомиопатией. В данное многоцентровое РКИ [25] было включено 1116 пациентов с систолической ХСН II-III ФК по NYHA (и IV при наличии показаний к сердечной ресинхронизирующей терапии (СРТ)), имеющих ФВ ЛЖ ≤35% и не имеющих ИБС (в 97% подтверждено при коронарографии). Все пациенты получали ОМТ, при этом больным, имеющим показаниями к СРТ, проводилась имплантации СРТ-Д в группе лечения и СРТ в группе контроля. Авторами были получены довольно неожиданные результаты, так не было выявлено никаких различий в частоте первичной конечной точки — смертности от всех причин в группе с ИКД-терапией по сравнению с контрольной группой (21,6% vs 23,4% (ОР 0,87; 95% ДИ: 0,68-1,12; р=0,28)). В то же время ВСС развилась практически в два раза реже в группе ИКД-терапии по сравнению с контрольной группой (4,3% vs 8,2%; (ОР 0,50; 95% ДИ: 0,31-0,82; р=0,005)). Другими словами, хотя ИКД-терапия была ассоциирована с практически двукратным снижением риска ВСС по сравнению с контрольной группой, которым проводилась ОМТ, влияние на общую смертность, которая была основной конечной точкой исследования, не было статистически значимым. Но как мы должны интерпретировать данные выводы?
По мнению McMurray JJV, тот факт, что не было никакой существенной пользы ИКД-терапии в отношении общей смертности в исследовании DANISH, является результатом исходно низкого риска ВСС среди пациентов, включенных в данное исследование [26]. Но чем отличались пациенты датского исследования от пациентов, включенных в исследования SCD-HeFT и DEFINITE, два десятилетия назад, на основе которых были сформированы основные концепции первичной профилактики ВСС у пациентов с не ишемической СН?
В рекомендациях ЕОК (2016) показания к профилактической постановке ИКД у больных с ХСН и сниженной ФВ ЛЖ до недавнего времени имели класс I A для ишемической и I B для не ишемической этиологии [27], а в рекомендациях Американской кардиологической ассоциации по лечению СН (2017) вообще I A вне зависимости от этиологии [28]. Последние, в свою очередь, в рекомендациях ссылаются исключительно к вышеупомянутому исследованию SCD-HeFT [18], тогда как в рекомендациях ЕОК кроме того упоминается исследование DEFINITE [16]. Напомним, что исследование SCD-HeFT [18] включало пациентов в период между 1997 и 2001гг, и в начале исследования только 69% пациентов получали бета-блокаторы (ББ), и только 20% пациентов получали антагонисты минералокортикоидных рецепторов, и, наконец, ни один пациент не получал сопутствующую кардиоресинхронизирующую терапию. В исследовании DEFINITE [16], в которое была включена большая доля пациентов, получавших ББ (85%), опять же, не было пациентов, получавших СРТ. Более низкую частоту случаев ВСС в исследовании DANISH [25], чем в более ранних вышеуказанных исследованиях, можно объяснить тем, что популяция в данном исследовании состояла преимущественно из амбулаторных пациентов, которые находились в стабильном состоянии и получали ОМТ в соответствии с международными рекомендациями. Причем почти каждый пациент получал ББ и ингибиторы ренин-ангиотензин-альдостероновой системы и 60% пациентов получали антагонисты минералокортикоидных рецепторов. К тому же, и в отличие от предыдущих исследований с применением ИКД-терапии, 58% пациентов получили по показаниям СРТ. В совокупности все эти методы лечения снижают риск преждевременной сердечно-сосудистой смертности, в т. ч. существенно и риск ВСС. Все это привело к тому, что смертность, в т. ч. и внезапная, у пациентов, вошедших в данное исследование, была относительно низкой, а как известно у пациентов, имеющих более высокий риск аритмической смерти, более высокая вероятность достижения преимуществ в отношении выживаемости за счет ИКД-терапии. Более того, на фоне риска смерти от всех причин риск ВСС должен доминировать, и лишь в этом случае имплантация КВД будет полезна и эффективна. Так, в том же исследовании DANISH показано значимое снижение смертности в группе ИКД-терапии по сравнению с группой контроля только среди лиц младше 70 лет (ОР 0,78; 95% ДИ: 0,61-0,99; p=0,04), а в подгруппе пациентов >70 лет преимущества ИКД-терапии уже не обнаружено (ОР 0,92; 95% ДИ: 0,67-1,28; p=0,75) [25]. Очевидно, это обусловлено возрастным увеличением смертности от не сердечно-сосудистых причин, и данные пациенты имеют больший риск конкурирующих летальных исходов. Публикация результатов датского исследования [25] является одной из основных причин изменения уровня рекомендаций с I на IIa при имплантации КВД для первичной профилактики у пациентов с неишемической СН в рекомендациях ЕОК (2021) [29].
Современные методы оценки риска ЖА при ДКМП
В течение последнего десятилетия продолжается активный поиск наиболее адекватных предикторов кроме ФВ ЛЖ, указывающих на электрическую нестабильность миокарда и риск развития жизнеугрожающих желудочковых нарушений ритма. В результате исследований были обнаружены ЭКГ предикторы (альтернация Т-волны, электрокардиография высокого разрешения с оценкой поздних желудочковых потенциалов, длительность и дисперсия интервала Q-T, вариабельность и турбулентность ритма сердца), нейрогуморальные маркеры и др. Однако большинство вышеуказанных параметров показали низкую положительную прогностическую ценность, соответственно имеют ограниченную роль в стратификации риска ВСС. Фиброз миокарда является в большинстве случаев основной патофизиологической детерминантой возникновения и поддержания различного рода жизнеугрожающих ЖА [30]. Методы визуализации аритмогенного субстрата являются одним из наиболее перспективных шагов в направлении поиска наиболее адекватного маркера риска аритмических событий. Кроме того, имеющиеся данные свидетельствуют о том, что генотип также является одним из важных факторов [1], определяющих риск ВСС в данной когорте больных, причем у пациентов с вариантами мутации генов наблюдается значительно более высокая частота серьезных аритмических событий независимо от ФВ ЛЖ.
Роль МРТ в стратификации риска ВСС. МРТ с отсроченным контрастированием с использованием контрастных агентов на основе гадолиния — на данный момент является золотым стандартом оценки фиброза миокарда [31]. Современные возможности МРТ и программ постпроцессорной обработки позволяют провести комплексный анализ структур и функций сердца с использованием различных последовательностей, включая МР-киновизуализацию, отсроченное контрастирование миокарда с использованием гадолиния, Т1-картирование [6]. Кроме того, разработаны инструменты для оценки деформации миокарда по данным МР-изображений, с применением так называемой технологии MR feature-tracking [32][33] (рис. 1). В многочисленных исследованиях показано, что само по себе наличие зон LGE в миокарде ЛЖ при МРТ является маркером неблагоприятных сердечных, в т. ч. и аритмических событий. В исследовании Gulati A, et al. (2013) с участием 427 пациентов с ДКМП, после поправки на исходные характеристики включая ФВ ЛЖ, наличие зон накопления гадолиния было независимым предиктором ВСС (ОР 4,61; 95% ДИ: 2,75-7,74, p<0,001) [34]. В недавнем метаанализе с участием 15217 пациентов с периодом наблюдения 3 года, обнаружение зон LGE было ассоциировано с развитием жизнеугрожающих желудочковых аритмических событий (отношение шансов (ОШ) 3,99; 95% ДИ: 3,08-5,16), смертностью от всех причин (ОШ 2,14; 95% ДИ: 1,81-2,52), сердечно-сосудистой смертностью (ОШ 2,83; 95% ДИ: 2,23-3,60) и госпитализации по поводу СН (ОШ 2,53; 95% ДИ: 1,78-3,59) [35]. В настоящий момент в рекомендациях по профилактике ВСС прежде всего именно обнаружение зон отсроченного накопления гадолиния указано как фактор риска ВСС. Однако не только обнаружение зон отсроченного накопления гадолиния, но и их локализация и паттерны накопления могут быть ассоциированы с более высоким риском аритмических событий. Так, в недавнем проведенном исследовании Halliday BP, et al. (2019г), которое включало большую когорту пациентов с ДКМП (n=874 пациентов), имплантировали КВД для первичной профилактики ВСС [36]. Локализация LGE в межжелудочковой перегородке (ОР 3,13; 95% ДИ: 1,68-5,81; p<0,001), а также его локализация как в межжелудочковой перегородке, так и в свободной стенке ЛЖ (ОР 5,82; 95% ДИ: 3,30-10,27; p<0,0001) была ассоциирована с более высокой частотой развития конечной точки в виде ВСС по сравнению с пациентами без LGE. Более того, определенные паттерны накопления LGE также были ассоциированы с риском развития ВСС, а расчетные скорректированные ОР для пациентов с линейной интрамиокардиальной, субэпикардиальной, фокальной и множественными паттернами составили 3,21 (95% ДИ: 1,82-5,66; p<0,001), 5,54 (95% ДИ: 2,18-14,08; p<0,001), 3,16 (95% ДИ: 0,91-10,97; p=0,070) и 5,72 (95% ДИ: 3,06-10,69; p<0,001), соответственно, по сравнению с пациентами без LGE [36]. Наконец, не утихают споры о влиянии степени фиброза ЛЖ на риск развития неблагоприятных событий. Рядом авторов выявлены определенные пороговые значения фиброзных изменений в миокарде, обладающие наиболее сильным неблагоприятным прогностическим эффектом вне зависимости от ФВ ЛЖ [37]. В то же время результаты исследований количественной оценки фиброза ЛЖ для оценки риска ВСС показывают противоречивые данные, одним из основных факторов этого, вероятно, является отсутствие единого стандартного метода количественной оценки LGE. Тем не менее, по данным недавнего систематического обоза и метаанализа Golukhova EZ, et al. 2023, более высокая степень очагового фиброза была независимо ассоциирована с риском смертности от всех причин (ОР 1,07/1% LGE; 95% ДИ: 1,00-1,14; p=0,04), с риском комбинированной аритмической конечной точки (ОР 1,07/1% LGE; 95% ДИ: 1,02-1,012; p=0,004) и MACE (Major adverse cardiovascular events) (ОР 1,04/1% LGE; 95% ДИ: 1,01-1,08; p=0,005) [38]. Следует отметить, что МРТ с контрастным усилением (LGE) имеет ограниченную роль для оценки диффузного фиброза. Т1-картирование — относительно новый подход к неинвазивной количественной оценке диффузного интерстициального фиброза [39]. Данная методика использует последовательность изображений для количественного определения времени релаксации T1 и представление ее в виде цветового изображения. Картирование миокарда с помощью последовательностей MOLLI до и после применения гадолиний-содержащий контрастных веществ позволяет рассчитать внеклеточный объем (ECV) с высокой воспроизводимостью, что хорошо подтверждено гистологическими данными. В недавнем исследовании Cadour F, et al. с участием пациентов с ДКМП показано, что ECV с пороговым значением >32,1% был единственным независимым прогностическим фактором событий, связанных как с СН, так и с ЖА [40]. Кроме того, в данном исследовании нативное время Т1 (Z-score >4,2) также показало себя в качестве независимого предиктора возникновения событий, связанных с ЖА. Благодаря технологии MR feature-tracking появилась возможность также провести оценку деформации миокарда с высокой воспроизводимостью. Исследования показали, что параметры деформации ЛЖ по данным МРТ статистически значимо коррелируют со степенью фиброза миокарда при ДКМП [41]. Кроме того, недавний метаанализ показал, что ухудшение показателей глобальной продольной, циркулярной и радиальной деформации ЛЖ у пациентов с ДКМП было ассоциировано с повышенным риском развития MACE [42]. Однако в текущее время имеются все еще ограниченные данные о прогностической роли методик Т1-картирования и оценки деформации миокарда у пациентов с ДКМП, кроме того, в большинство исследований были включены небольшие выборки с небольшим количеством событий в отдаленном периоде.
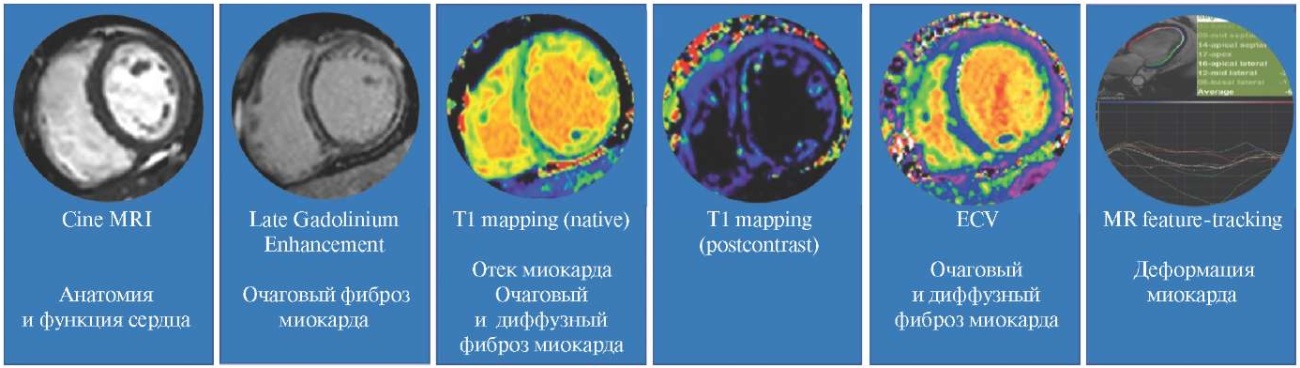
Рис. 1. Современные модальности МРТ сердца при ДКМП.
Примечание: цветное изображение доступно в электронной версии журнала.
Сокращения: Cine MRI — МР-киновизуализация, Late Gadolinium Enhancement — отсроченное накопление гадолиния, ECV — extracellular volume, T1 mapping — Т1-картирование.
Генетические факторы риска ВСС при ДКМП. ДКМП характеризуются выраженной генетической и аллельной гетерогенностью, т. е. множество различных вариантов во многих различных генах могут вызывать один и тот же фенотип. Патогенные варианты, связанные с кардиомиопатиями, часто проявляют неполную и возрастную пенетрантность, а также переменную экспрессивность. Для семейной формы ДКМП характерно аутосомно-доминантное наследование. Аутосомно-рецессивное, Х-сцепленный или митохондриальный типы наследования встречаются значительно реже [7]. При изучении аритмогенных фенотипов ДКМП, а именно их генетической составляющей, наиболее сильную ассоциацию с развитием жизнеугрожающих ЖА продемонстрировали мутации в генах LMNA (ламин A/C), PLN (фосфаламбан), FLNC (филамин C), RBM20 и SCN5A (α-субъединица 5-типа натриевого канала) и др. (табл. 1) [43]. Следует отметить, что ЖА могут предшествовать систолической дисфункции ЛЖ, таким образом, при данных генных мутациях риск ВСС может быть повышен независимо от степени снижения сократительной функции ЛЖ. Ген LMNA (ламин A/C) — наиболее распространенный ген, кодирующий белки ядерной пластинки — ламины A/C (LMNA). Мутации в данном гене встречаются в 5-10% случаев ДКМП с аутосомно-доминантным типом наследования [7][43]. Несмотря на то, что мутации гена LMNA не являются наиболее распространенной причиной развития ДКМП, он является наиболее изученным геном в ряде проспективных исследований с участием больных с ДКМП из-за высокой частоты развития ЖА и ВСС у носителей данных мутаций [43][44]. Фосфоламбан (PLN) — белок, расположенный на мембране саркоплазматического и эндоплазматического ретикулума (SR/ER), который участвует в регуляции обмена кальция в кардиомиоцитах за счет ингибирования SERCA2a (SR Ca²⁺ ATPase). Нарушение обмена Са²⁺ в СР и цитозоле кардиомиоцитов лежит в основе как систолической дисфункции ЛЖ, так и развития ЖА [45]. Для вышеуказанных генотипов высокого риска (например, LMNA (https://lmna-risk-vta.fr)) были разработаны специфичные для гена (или, в случае варианта PLN p.Arg14del, специфичные для варианта (https://plnriskcalculator.shinyapps.io/final_shiny)) калькуляторы оценки предполагаемого 5-летнего риска жизнеугрожающих ЖА, которые учитывают характеристики генотипа и дополнительные фенотипические особенности. Филамин C (FLNC) — один из основных изомеров филаминов наиболее распространенный в кардиомиоцитах. Филамин C играет решающую роль в регуляции клеточной механики, расположении и ориентации Z-диска, миофибрилл. Пациенты с мутациями гена FLNCtv характеризуются выраженным фиброзом, дилатацией и систолической дисфункцией ЛЖ. Кроме того, носители мутаций данного гена подвержены высокому риску ВСС [46]. Варианты мутации гена RBM20 (РНК-связывающий белок 20) могут приводить к особенно тяжелой форме заболевания, часто вызывающей аритмию и прогрессирующую СН, и составляют ~3% случаев семейной ДКМП [43]. Данный ген участвует в регуляции альтернативного сплайсинга и экспрессии титина (тайтин) и других белков, в т. ч. участвующих в обмене кальция (RYR2) и других ионных каналов (например, CACNA1C) [43][47]. Известно, что семейство натриевых каналов состоит из девяти генов (SCN1A-SCN5A, SCN7A-SCN11A). Среди них ген SCN5A, кодирующий α-субъединицу 5-типа натриевого канала, экспрессируется преимущественно в миокарде предсердий и желудочков, пучке Гиса, ветвях пучка Гиса и волокнах Пуркинье. Несмотря на невысокую распространенность случаев ДКМП (~2%), опосредованных мутациями гена SCN5A, развитие ДКМП у данной группы характеризуется возрастной пенетрантностью, а также развитием аритмий, в т. ч. желудочковых, и нарушениями проводимости сердца [48]. Таким образом, с развитием медицинских технологий частота диагностики мутаций генов, ассоциированных с развитием ДКМП, в т. ч. и с развитием жизнеугрожающих ЖА, все увеличивается. Результаты проведенных исследований подтверждают потенциально важную роль молекулярно-генетической диагностики как неотъемлемой части интегральной клинической оценки семейной ДКМП для стратификации риска ВСС.
Будущие направления
Наконец, вопрос "куда мы могли бы пойти дальше?" — важный и сложный вопрос, на который нужно постараться ответить. По мере того, как становятся доступными новые методы оценки структур и функций миокарда с помощью МРТ, а также обнаружение генотипов высокого риска ВСС, требуются дополнительные исследования, чтобы определить, какая комбинация параметров оптимизирует стратификацию риска в этой гетерогенной популяции пациентов по сравнению с традиционными маркерами. Дальнейшая эволюция методик стратификации риска ВСС будет идти, вероятнее всего, в направлении расширения возможностей применения МРТ сердца, в т. ч. оценки диффузного фиброза. Крайне интересным является поиск дополнительных параметров у пациентов с обнаруженным фиброзом ЛЖ (LGE+), в т. ч. и при ФВ ЛЖ >40%, с целью выявить больных с наибольшим риском ВСС. Напротив, требуются исследования с целью выявления пациентов с низким аритмическим риском, как, например, с ФВ ЛЖ <35% и без фиброза (LGE-), при отсутствии генотипов высокого риска. Кроме того, интересно определить прогностическую роль оценки параметров Т1-картирования и параметров деформации ЛЖ при отсутствии обнаружения очагового фиброза ЛЖ (LGE-) по данным МРТ. По мере накопления данных генетических исследований, необходимо создание калькуляторов оценки предполагаемого риска жизнеугрожающих ЖА, которые учитывают характеристики конкретного генотипа и дополнительные фенотипические особенности пациента. Развитие технологий искусственного интеллекта и машинного обучения являются одним из инновационных направлений, в т. ч. при визуализации сердца с помощью МРТ. Так, например, данные методики позволят обеспечить более стандартизованную количественную оценку фиброза, преодолев текущие ограничения, связанные с вариабельностью и воспроизводимостью. Комплексный подход к стратификации риска ВСС позволит создать персонифицированный профиль заболевания пациента на основании оценки клиническо-инструментальных факторов и определения суммарного уровня индивидуального риска неблагоприятных исходов.
Ограничения исследования. Одно из ограничений обзора текущего состояния проблемы стратификации риска ВСС у больных ДКМП заключается в гетерогенности дефиниции фенотипа ДКМП в РКИ, представленных в данной работе. В исследованиях наряду с термином ДКМП используется термин "неишемическая кардиомиопатия", т. е. не исключается включение промежуточных фенотипов (гипокинетические формы без дилатации с систолической дисфункцией), не соответствующие стандартным критериям ДКМП, несмотря на снижение ФВ ЛЖ. Однако следует отметить, что на данный момент целевая группа рекомендаций ЕОК по кардиомиопатиям указала, что показания по первичной профилактике и имплантации ИКД при недилатационной кардиомиопатии ЛЖ должны быть такими же, как и для больных с ДКМП [1]. Кроме того, в данном обзоре представлены лишь наиболее крупные и значимые, на взгляд авторов, работы, посвященные прогностической роли современных методов МР-визуализации и генетического тестирования.
Заключение
Возможность предсказать непредсказуемое событие — вероятность развития ВСС остается вечным неразрешимым вопросом современной аритмологии. С момента появления концепции ВСС проводятся попытки найти надежные прогностические маркеры развития жизнеугрожающих ЖА. Однако риск аритмии для каждого человека является многофакторным и связан с генетическими, приобретенными, анатомическими и патофизиологическими факторами. В настоящее время применение комплексных методов визуализации сердца с помощью МРТ, выявление конкретных генов, ассоциированных с риском развития жизнеугрожающих ЖА существенно расширили наши возможности в стратификации риска ВСС у данной гетерогенной популяции пациентов.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Arbelo E, Protonotarios A, Gimeno JR, et al. 2023 ESC Guidelines for the management of cardiomyopathies. Eur Heart J. 2023;44(37):3503-626. doi:10.1093/eurheartj/ehad194.
2. Reichart D, Magnussen C, Zeller T, Blankenberg S. Dilated cardiomyopathy: from epidemiologic to genetic phenotypes: A translational review of current literature. J Intern Med. 2019;286(4):362-72. doi:10.1111/joim.12944.
3. Goldberger JJ. Sudden cardiac death risk stratification in dilated cardiomyopathy: climbing the pyramid of knowledge. Circ Arrhythm Electrophysiol. 2014;7(6):1006-8. doi:10.1161/CIRCEP.114.002395.
4. Бокерия Л. А., Неминущий Н. М., Постол А. С. Имплантируемые кардиовертеры-дефибрилляторы — основное звено в современной концепции профилактики внезапной сердечной смерти: проблемы и перспективы развития метода. Кардиология. 2018;58(12):76-84. doi:10.18087/cardio.2018.12.10197.
5. Priori SG, Blomström-Lundqvist C, Mazzanti A, et al. 2015 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: The Task Force for the Management of Patients with Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death of the European Society of Cardiology (ESC). Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC). Eur Heart J. 2015;36(41):2793-867. doi:10.1093/eurheartj/ehv316.
6. Jia SQ, Lv SY, Jin YH, et al. Cardiac MRI for clinical dilated cardiomyopathy: Improved diagnostic power via combined T1, T2, and ECV. Radiography (Lond). 2024;30(3):926-31. doi:10.1016/j.radi.2024.04.005.
7. Вайханская Т. Г., Сивицкая Л. Н., Курушко Т. В. и др. Дилатационная кардиомиопатия: новый взгляд на проблему. Российский кардиологический журнал. 2019;(4):35-47. doi:10.15829/1560-4071-2019-4-35-47.
8. Amin RJ, Morris-Rosendahl D, Edwards M, et al. The addition of genetic testing and cardiovascular magnetic resonance to routine clinical data for stratification of etiology in dilated cardiomyopathy. Front Cardiovasc Med. 2022;9:1017119. doi:10.3389/fcvm.2022.1017119.
9. Родионова Ю. В., Ким О. Т. Что такое "Обзор современного состояния проблемы" (State of the Art, SotA)? Кардиоваскулярная терапия и профилактика. 2024;23(4S):3946. doi:10.15829/1728-8800-2024-3946.
10. Wyse DG, Friedman PL, Epstein AE. A Comparison of Antiarrhythmic-Drug Therapy with Implantable Defibrillators in Patients Resuscitated from Near-Fatal Ventricular Arrhythmias. N Engl J Med. 1997;337:1576-84. doi:10.1056/NEJM199711273372202.
11. Connolly SJ, Gent M, Roberts RS, et al. Canadian implantable defibrillator study (CIDS): a randomized trial of the implantable cardioverter defibrillator against amiodarone. Circulation. 2000;101(11):1297-302. doi:10.1161/01.cir.101.11.1297.
12. Kuck KH, Cappato R, Siebels J, Rüppel R. Randomized comparison of antiarrhythmic drug therapy with implantable defibrillators in patients resuscitated from cardiac arrest: the Cardiac Arrest Study Hamburg (CASH). Circulation. 2000;102(7):748-54. doi:10.1161/01.cir.102.7.748.
13. Zeppenfeld K, Tfelt-Hansen J, de Riva M, et al. 2022 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death. Eur Heart J. 2022;43(40):3997-4126. doi:10.1093/eurheartj/ehac262.
14. Moss AJ, Hall WJ, Cannom DS, et al. Improved survival with an implanted defibrillator in patients with coronary disease at high risk for ventricular arrhythmia. Multicenter Automatic Defibrillator Implantation Trial Investigators. N Engl J Med. 1996;335(26): 1933-40. doi:10.1056/NEJM199612263352601.
15. Buxton AE, Fisher JD, Josephson ME, et al. Prevention of sudden death in patients with coronary artery disease: the Multicenter Unsustained Tachycardia Trial (MUSTT). Prog Cardiovasc Dis. 1993;36(3):215-26. doi:10.1016/0033-0620(93)90015-6.
16. Kadish A, Dyer A, Daubert JP, et al. Defibrillators in Non-Ischemic Cardiomyopathy Treatment Evaluation (DEFINITE) Investigators. Prophylactic defibrillator implantation in patients with nonischemic dilated cardiomyopathy. N Engl J Med. 2004;350(21):2151-8. doi:10.1056/NEJMoa033088.
17. Moss AJ, Zareba W, Hall WJ, et al. Multicenter Automatic Defibrillator Implantation Trial II Investigators. Prophylactic implantation of a defibrillator in patients with myocardial infarction and reduced ejection fraction. N Engl J Med. 2002;346(12):877-83. doi:10.1056/NEJMoa013474.
18. Bardy GH, Lee KL, Mark DB, et al. Sudden Cardiac Death in Heart Failure Trial (SCD-HeFT) Investigators. Amiodarone or an implantable cardioverter-defibrillator for congestive heart failure. N Engl J Med. 2005;352(3):225-37. doi:10.1056/NEJMoa043399.
19. Moss AJ. MADIT-I and MADIT-II. J Cardiovasc Electrophysiol. 2003;14(9 Suppl):S96-8. doi:10.1046/j.1540-8167.14.s9.5.x.
20. Strickberger SA, Hummel JD, Bartlett TG, et al. Amiodarone versus implantable cardioverter-defibrillator:randomized trial in patients with nonischemic dilated cardiomyopathy and asymptomatic nonsustained ventricular tachycardia—AMIOVIRT. J Am Coll Cardiol. 2003;41(10):1707-12. doi:10.1016/s0735-1097(03)00297-3.
21. Bänsch D, Antz M, Boczor S, et al. Primary prevention of sudden cardiac death in idiopathic dilated cardiomyopathy: the Cardiomyopathy Trial (CAT). Circulation. 2002;105(12): 1453-8. doi:10.1161/01.cir.0000012350.99718.ad.
22. Sabbag A, Suleiman M, Laish-Farkash A, et al. Contemporary rates of appropriate shock therapy in patients who receive implantable device therapy in a real-world setting: From the Israeli ICD Registry. Heart Rhythm. 2015;12(12):2426-33. doi:10.1016/j.hrthm.2015.08.020.
23. Lebedev DS, Mikhailov EN, Neminuschiy NM, et al. Ventricular arrhythmias. Ventricular tachycardias and sudden cardiac death. 2020 Clinical guidelines. Russian Journal of Cardiology. 2021;26(7):4600. (In Russ.) Лебедев Д. С., Михайлов Е. Н., Неминущий Н. М. и др. Желудочковые нарушения ритма. Желудочковые тахикардии и внезапная сердечная смерть. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(7):4600. doi:10.15829/1560-4071-2021-4600.
24. Stecker EC, Vickers C, Waltz J, et al. Population-based analysis of sudden cardiac death with and without left ventricular systolic dysfunction: two-year findings from the Oregon Sudden Unexpected Death Study. J Am Coll Cardiol. 2006;47(6):1161-6. doi:10.1016/j.jacc.2005.11.045.
25. Køber L, Thune JJ, Nielsen JC, et al. Defibrillator Implantation in Patients with Nonischemic Systolic Heart Failure. N Engl J Med. 2016;375(13):1221-30. doi:10.1056/NEJMoa1608029.
26. McMurray JJ. The ICD in Heart Failure — Time for a Rethink? N Engl J Med. 2016; 375(13):1283-4. doi:10.1056/NEJMe1609826.
27. Ponikowski P, Voors AA, Anker SD, et al. 2016 ESC Guidelines for the Diagnosis and Treatment of Acute and Chronic Heart Failure. Rev Esp Cardiol (Engl Ed). 2016; 69(12):1167. English, Spanish. doi:10.1016/j.rec.2016.11.005.
28. Al-Khatib SM, Stevenson WG, Ackerman MJ, et al. 2017 AHA/ACC/HRS Guideline for Management of Patients With Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death: Executive Summary: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm Society. Circulation. 2018;138(13):e210-e271. doi:10.1161/CIR.0000000000000548.
29. McDonagh TA, Metra M, Adamo M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2021;42(36):3599-726. doi:10.1093/eurheartj/ehab368.
30. Aquaro GD, De Gori C, Faggioni L, et al. Diagnostic and prognostic role of late gadolinium enhancement in cardiomyopathies. Eur Heart J Suppl. 2023;25(Suppl C):C130-C136. doi:10.1093/eurheartjsupp/suad015.
31. Yang W, Xu J, Zhu L, et al. Myocardial Strain Measurements Derived From MR Feature-Tracking: Influence of Sex, Age, Field Strength, and Vendor. JACC Cardiovasc Imaging. 2024;17(4):364-79. doi:10.1016/j.jcmg.2023.05.019.
32. Cojan-Minzat BO, Zlibut A, Agoston-Coldea L. Non-ischemic dilated cardiomyopathy and cardiac fibrosis. Heart Fail Rev. 2021;26(5):1081-101. doi:10.1007/s10741-020-09940-0.
33. Шульженко Л. В., Першуков И. В., Батыралиев Т. А. и др. Клиническая эволюция диффузного фиброза миокарда у пациентов с артериальной гипертензией и сердечной недостаточностью с промежуточной фракцией выброса левого желудочка, получавших олмесартан или сакубитрил / валсартан. Кардиология. 2023;63(12):31-8. doi:10.18087/cardio.2023.12.n2557.
34. Gulati A, Jabbour A, Ismail TF, et al. Association of fibrosis with mortality and sudden cardiac death in patients with nonischemic dilated cardiomyopathy. JAMA. 2013;309(9): 896-908. doi:10.1001/jama.2013.1363.
35. Theerasuwipakorn N, Chokesuwattanaskul R, Phannajit J, et al. Impact of late gadolinium-enhanced cardiac MRI on arrhythmic and mortality outcomes in nonischemic dilated cardiomyopathy: updated systematic review and meta-analysis. Sci Rep. 2023;13(1):13775. doi:10.1038/s41598-023-41087-4.
36. Halliday BP, Baksi AJ, Gulati A, et al. Outcome in Dilated Cardiomyopathy Related to the Extent, Location, and Pattern of Late Gadolinium Enhancement. JACC Cardiovasc Imaging. 2019;12(8 Pt 2):1645-55. doi:10.1016/j.jcmg.2018.07.015.
37. Голухова Е. З., Александрова С. А., Бердибеков Б. Ш. Прогностическая роль количественной оценки миокардиального фиброза по данным магнитно-резонансной томографии с отсроченным контрастированием при неишемических дилатационных кардиомиопатиях: систематический обзор и метаанализ. Российский кардиологический журнал. 2021;26(12):4776. doi:10.15829/1560-4071-2021-4776.
38. Golukhova EZ, Bulaeva NI, Alexandrova SA, et al. The extent of late gadolinium enhancement predicts mortality, sudden death and major adverse cardiovascular events in patients with nonischaemic cardiomyopathy: a systematic review and meta-analysis. Clin Radiol. 2023;78(4):e342-e349. doi:10.1016/j.crad.2022.12.015.
39. Бердибеков Б. Ш., Александрова С. А., Голухова Е. З. Новые возможности оценки субстрата желудочковых аритмий: роль магнитно-резонансной томографии. Креативная кардиология. 2019;13(3):217-28. doi:10.24022/1997-3187-2019-13-3-217-228.
40. Cadour F, Quemeneur M, Biere L, et al. Prognostic value of cardiovascular magnetic resonance T1 mapping and extracellular volume fraction in nonischemic dilated cardiomyopathy. J Cardiovasc Magn Reson. 2023;25(1):7. doi:10.1186/s12968-023-00919-y.
41. Azuma M, Kato S, Kodama S, et al. Relationship between the cardiac magnetic resonance derived extracellular volume fraction and feature tracking myocardial strain in patients with non-ischemic dilated cardiomyopathy. Magn Reson Imaging. 2020;74:14-20. doi:10.1016/j.mri.2020.09.004.
42. Голухова Е. З., Александрова С. А., Булаева Н. И. и др. Прогностическая роль показателей деформации миокарда по данным магнитно-резонансной томографии при неишемических дилатационных кардиомиопатиях: систематический обзор и мета-анализ. Кардиология. 2022;62(10):35-41. doi:10.18087/cardio.2022.10.n2034.
43. Wang S, Zhang Z, He J, et al. Comprehensive review on gene mutations contributing to dilated cardiomyopathy. Front Cardiovasc Med. 2023;10:1296389. doi:10.3389/fcvm.2023.1296389.
44. Вайханская Т. Г., Сивицкая Л. Н., Левданский О. Д. и др. Генетические факторы риска дилатационной кардиомиопатии. Российский кардиологический журнал. 2021;26(10): 4628. doi:10.15829/1560-4071-2021-4628.
45. van Rijsingen IA, van der Zwaag PA, Groeneweg JA, et al. Outcome in phospholamban R14del carriers: results of a large multicentre cohort study. Circ Cardiovasc Genet. 2014;7(4):455-65. doi:10.1161/CIRCGENETICS.113.000374.
46. Celeghin R, Cipriani A, Bariani R, et al. Filamin-C variant-associated cardiomyopathy: A pooled analysis of individual patient data to evaluate the clinical profile and risk of sudden cardiac death. Heart Rhythm. 2022;19(2):235-43. doi:10.1016/j.hrthm.2021.09.029.
47. Parikh VN, Caleshu C, Reuter C, et al. Regional Variation in RBM20 Causes a Highly Penetrant Arrhythmogenic Cardiomyopathy. Circ Heart Fail. 2019;12(3):e005371. doi:10.1161/CIRCHEARTFAILURE.118.005371.
48. Zaklyazminskaya E, Dzemeshkevich S. The role of mutations in the SCN5A gene in cardiomyopathies. Biochim Biophys Acta. 2016;1863(7 Pt B):1799-805. doi:10.1016/j.bbamcr.2016.02.014.
Об авторах
Б. Ш. БердибековРоссия
Бектур Шукурбекович Бердибеков — к. м. н., н. с. отдела координации и сопровождения научно-исследовательской деятельности, врач-кардиолог.
Москва
Конфликт интересов:
нет
Н. И. Булаева
Россия
Наида Ибадулаевна Булаева — к. б. н., врач-кардиолог, руководитель отдела координации и сопровождения научно-исследовательской деятельности, доцент кафедры кардиологии и функциональной диагностики с курсом детской кардиологии.
Москва
Конфликт интересов:
нет
С. А. Александрова
Россия
Светлана Александровна Александрова — к. м. н., с. н. с., доцент кафедры кардиологии и функциональной диагностики с курсом детской кардиологии.
Москва
Конфликт интересов:
нет
Е. З. Голухова
Россия
Елена Зеликовна Голухова — академик РАН, д. м. н., профессор, директор, зав. кафедрой кардиологии и функциональной диагностики с курсом детской кардиологии.
Москва
Конфликт интересов:
нет
Дополнительные файлы
Рецензия
Для цитирования:
Бердибеков Б.Ш., Булаева Н.И., Александрова С.А., Голухова Е.З. Стратификация риска внезапной сердечной смерти при дилатационной кардиомиопатии: обзор современного состояния проблемы. Российский кардиологический журнал. 2025;30(6S):6114. https://doi.org/10.15829/1560-4071-2025-6114. EDN: BOSXIO
For citation:
Berdibekov B.Sh., Bulaeva N.I., Alexandrova S.A., Golukhova E.Z. Sudden cardiac death risk stratification in dilated cardiomyopathy: a state of the art review. Russian Journal of Cardiology. 2025;30(6S):6114. (In Russ.) https://doi.org/10.15829/1560-4071-2025-6114. EDN: BOSXIO
JATS XML

















































