Перейти к:
Влияние активации системной воспалительной реакции на риск развития дисфункции коронарных кондуитов и частоту сердечно-сосудистых осложнений после коронарного шунтирования
https://doi.org/10.15829/15604071-2025-6112
EDN: VPJVMG
Аннотация
Цель. Определить влияние активации системной воспалительной реакции на частоту развития дисфункции коронарных кондуитов и риск сердечнососудистых осложнений после операции коронарного шунтирования, выявить наиболее значимые гуморальные маркеры.
Материал и методы. В исследование включено 84 пациента со стабильной ишемической болезнью сердца, проходивших обследование и хирургическое лечение — изолированное аортокоронарное шунтирование (АКШ). Оценка гуморальных маркеров воспаления проводилась до операции, через 24 ч и на 7 сут. после операции. Контрольная коронарошунтография проводилась интраоперационно и через 1 год после АКШ. Проведен анализ клинико-инструментальных и лабораторных данных в двух группах больных: 1 группа с дисфункцией шунтов (ДШ+) (10 больных) — пациенты, у которых диагностирована дисфункция шунта при контрольной шунтографии через 1 год после операции; 2 группа без дисфункции шунтов (ДШ-) (74 больных) — пациенты, у которых определялась нормальная функция коронарных графтов при контрольной шунтографии через 1 год после АКШ.
Результаты. Дисфункция коронарных кондуитов определена у 10 (12%) пациентов через 1 год после АКШ, которая была обусловлена: в 7 (70%) случаях тромботической окклюзией венозного шунта, в 3 (30%) — гемодинамически значимым стенозом шунта. У этих пациентов зарегистрированы следующие неблагоприятные сердечно-сосудистые события: 2 (20%) случая сердечнососудистой смерти; у 8 (80%) пациентов возврат стенокардии; 4 (40%) пациента перенесли острый инфаркт миокарда; 2 (20%) пациентам потребовалась госпитализация в связи с декомпенсацией хронической сердечной недостаточности; 8 (80%) больным выполнены повторные процедуры реваскуляризации миокарда; у 3 (30%) больных регистрировались жизнеугрожающие нарушения ритма сердца — пароксизмы желудочковой тахикардии. У этих пациентов определялись значимо более высокие уровни высокочувствительного С-реактивного белка (вч-СРБ), фракталкина, IL-1β, неоптерина во всех временных точках тестирования (до операции, через 24 ч и на 7 сут. после АКШ), что указывает на более выраженную активацию механизмов воспаления.
Заключение. Проведенное исследование подтвердило ведущую роль воспаления в запуске и поддержании основных механизмов, определяющих повреждение сосудистой стенки коронарных кондуитов после АКШ, что является основой развития дисфункции шунтов. Это позволяет рассматривать воспаление в качестве самостоятельной причины сосудистого повреждения, а установленные значимые биомаркеры воспаления (вч-СРБ, фракталкин, IL-1β, неоптерин) в качестве предикторов дисфункции шунтов и негативных исходов реваскуляризации миокарда.
Ключевые слова
Для цитирования:
Бузиашвили Ю.И., Кокшенева И.В., Камардинов Д.Х., Тугеева Э.Ф., Шуваев И.П., Ирасханов А.Ш., Голубев Е.П., Ибрагимов Р.М., Бузиашвили В.Ю., Шерстянникова О.М. Влияние активации системной воспалительной реакции на риск развития дисфункции коронарных кондуитов и частоту сердечно-сосудистых осложнений после коронарного шунтирования. Российский кардиологический журнал. 2025;30(4):6112. https://doi.org/10.15829/15604071-2025-6112. EDN: VPJVMG
For citation:
Buziashvili Yu.I., Koksheneva I.V., Kamardinov D.Kh., Tugeeva E.F., Shuvaev I.P., Iraskhanov A.Sh., Golubev E.P., Ibragimov R.M., Buziashvili V.Yu., Sherstyannikova O.M. Impact of systemic inflammatory response activation on the risk of coronary conduit dysfunction and the incidence of cardiovascular events after coronary artery bypass grafting. Russian Journal of Cardiology. 2025;30(4):6112. (In Russ.) https://doi.org/10.15829/15604071-2025-6112. EDN: VPJVMG
Несмотря на большую историю и опыт применения коронарного шунтирования (КШ), значимой проблемой до сегодняшнего дня остается развитие дисфункции коронарных кондуитов, в основе которой лежат три процесса: тромбоз, гиперплазия интимы и атеросклероз [1-3].
Частота развития дисфункции венозных графтов самая высокая в течение первых месяцев после операции. В течение первого месяца после операции развивается нарушение проходимости 10% шунтов, вследствие острого тромбоза. Высокая частота развития дисфункции коронарных шунтов наблюдается и в течение 3-18 мес., в течение этих временных рамок процессы формирования гиперплазии интимы наиболее активны. Через 1 год уже ~15% шунтов не функционирует. Спустя несколько лет после операции на первое место выходит роль атеросклероза в механизмах развития дисфункции шунтов [2][4].
Важную роль в развитии дисфункции шунтов как в раннем, так и в отсроченном послеоперационном периоде играют эндотелиальная дисфункция, воспаление и прокоагулянтный статус. Дисфункция коронарного шунта — результат повреждения сосудистого эндотелия, инициирующего взаимодействие клеток периферической крови с клеточными компонентами сосудистой стенки. Поддержание и прогрессирование этой воспалительной реакции регулируется специфическими сигнальными путями экспрессии цитокинов, хемокинов, молекул адгезии, факторов роста. Множество провоспалительных гуморальных факторов, включая цитокины и молекулы адгезии, были доказаны как важные участники этих процессов [4]. Гипотеза "реагирования на повреждение эндотелия" остается активной областью исследований.
На сегодняшний день известно о взаимосвязи повышенных уровней С-реактивного белка (СРБ) с неблагоприятными результатами реваскуляризации миокарда. Исследование EXCEL (включавшее наблюдение за 999 пациентами после КШ и чрескожного коронарного вмешательства (ЧКВ)) продемонстрировало взаимосвязь между 3-летней совокупной частотой смертности, инфаркта миокарда (ИМ), инсульта и исходным уровнем СРБ — показан устойчивый рост частоты неблагоприятных событий с более высокими уровнями СРБ [5].
Опубликованы данные, свидетельствующие о ценности индексов системного воспаления (которые рассчитываются на основе уровней лейкоцитов и их подтипов) в прогнозировании риска больших неблагоприятных сердечно-сосудистых событий (МАСЕ) после реваскуляризации миокарда [6]. В исследовании Urbanowicz T, et al., 2022 [7], включавшем 538 пациентов, которым выполнялась операция КШ, показано влияние индексов системного воспаления SIRI, SII, AISI, NLR на риск 30-дневной смертности после операции.
В последние десятилетия особый интерес приобрела группа "новых" биомаркеров воспаления (интерлейкина (IL)-1β, IL-6, фракталкина, неоптерина, плацентарного фактора роста) в аспекте их влияния на тяжесть и характер течения атеросклероза и его осложнений. Накопленные данные свидетельствуют, что данные биомаркеры играют важную роль в механизмах атерогенеза, нестабильности атеросклеротической бляшки (АСБ), развитии эндотелиальной дисфункции, тромбообразовании и показывают прогностическую значимость в развитии МАСЕ [8-11].
В то же время в литературе пока отсутствуют крупные исследования, посвященные оценке роли данных маркеров в механизмах дисфункции коронарных шунтов и развитии МАСЕ после КШ. Тогда как раскрытие механизмов и выявление связанных с ними биомаркеров негативных результатов реваскуляризации миокарда открывают возможности для более эффективной стратификации риска и дают новые инструменты для разработки эффективных стратегий лечения.
Цель исследования — определить влияние активации системной воспалительной реакции на частоту развития дисфункции коронарных кондуитов и риск сердечно-сосудистых осложнений после операции КШ, выявить наиболее значимые гуморальные маркеры.
Материал и методы
В исследование включено 84 пациента со стабильной ишемической болезнью сердца (ИБС), проходивших обследование и хирургическое лечение — изолированное КШ в ФГБУ "НМИЦ ССХ им. А. Н. Бакулева" Минздрава России с 2021 по 2022гг.
Исследование было выполнено в соответствии со стандартами клинической диагностики и лечения больных ИБС, направляемых на операцию КШ, в ФГБУ "НМИЦ ССХ им. А. Н. Бакулева". До включения в исследование у всех участников было получено письменное информированное согласие на проведение обследования и лечения.
Проведен анализ клинико-инструментальных и лабораторных данных в двух группах больных:
1 группа (ДШ+) (10 больных) — пациенты, у которых диагностирована дисфункция шунта при контрольной шунтографии в средне-срочном периоде после КШ (через 1 год);
2 группа (ДШ-) (74 больных) — пациенты, у которых определялась нормальная функция коронарных графтов при контрольной шунтографии через 1 год после КШ.
Дизайн исследования. Проспективное исследование включало: подбор когорт пациентов в соответствии с критериями включения и исключения, оценку функциональных показателей, плазменных уровней маркеров воспаление в крови до операции, на 1, 7 сут. после вмешательства.
Критерии включения: изолированная операция КШ (плановое хирургическое вмешательство), многососудистое поражение коронарных артерий. Показаниями к проведению операции являлось: высокий функциональный класс стенокардии (III-IV функционального класса) или наличие прогностически неблагоприятного поражения коронарного русла, техническая возможность выполнения КШ.
Критерии исключения: экстренная или неотложная операция, вмешательства на клапанах и/или аорте, свежий ИМ (<10 дней), нестабильная стенокардия, отказ пациента от участия в исследовании.
Конечные точки исследования: для исследования была выбрана комбинированная конечная точка — МАСЕ, которая включала: "большие кардиальные события" (смерть от кардиальных причин, нефатальный острый ИМ, возврат стенокардии), а также тромбоз или дисфункция шунта по данным контрольной шунтографии через год после операции. Все случаи смерти условлено было расценивать как кардиальные, если не было установлено другой причины.
Клиническая характеристика. По основным демографическим характеристикам (возраст, половой состав) пациенты двух групп не отличались. По частоте встречаемости основных факторов риска атеросклероза и ИБС (табакокурение, ожирение, артериальная гипертензия, сахарный диабет, дислипидемия) не выявлено значимых отличий у пациентов двух анализируемых групп (р>0,05 при сравнении всех показателей) (табл. 1).
При сравнении клинических характеристик течения ИБС у больных двух групп (частота перенесенных ИМ в анамнезе, тяжесть клинических проявлений стенокардии, выполнение предшествующих процедур реваскуляризации миокарда — ЧКВ, наличие атеросклеротического поражения ≥2 сосудистых бассейнов) также не выявлено значимых различий.
Значительная часть пациентов обеих групп имела отягощающую состояние коморбидную патологию (пароксизмальная форма фибрилляции предсердий, острое нарушение мозгового кровообращения в анамнезе, онкологическое заболевание, перенесенная новая коронавирусная инфекция в анамнезе). При этом частота сопутствующей патологии была сходной в обеих группах (р>0,05 при сравнении всех параметров). Таким образом, частота встречаемости сопутствующей соматической патологии, потенциально могущей оказать влияние на активацию хронического воспаления (сахарный диабет, ожирение, онкозаболевания, перенесенная новая коронавирусная инфекция в анамнезе) не отличалась между группами (табл. 1).
Медикаментозная терапия. Все пациенты, согласно действующим клиническим рекомендациям, получали базовую терапию стабильной ИБС, включающую прием дезагрегантов (аспирин), статинов, β-адреноблокаторов, ингибиторов ангиотензинпревращающего фермента или сартанов, антагонистов кальциевых каналов, нитратов и диуретиков по показаниям.
После операции медикаментозная терапия включала: постоянный прием аспирина, клопидогрела в течение 6 мес. после КШ, статинов, β-адреноблокаторов, ингибиторов ангиотензинпревращающего фермента, антагонистов кальциевых каналов, диуретиков, антиаритмических препаратов по показаниям. Контролировались показатели липидограммы с целью достижения целевых значений атерогенных липидов.
Эхокардиографические структурно-функциональные показатели левого желудочка (ЛЖ) до операции значимо не отличались у больных двух групп сравнения. Средние значения конечно-диастолического объема составили 125,6±48,6 мл и 127,4±36,9 мл, в группах ДШ+ и ДШ-, соответственно. Средние значения конечно-систолического объема — 63,1±27,9 мл и 59,7±22,7 мл, в группах ДШ+ и ДШ-, соответственно. Средняя фракция выброса (ФВ) ЛЖ — 51,0±6,6% и 53,2±5,9%, в группах ДШ+ и ДШ-, соответственно.
Характеристика выполненных операций. Полнота реваскуляризации миокарда и количество имплантированных коронарных анастомозов были сходными в обеих группах: в группе ДШ+ — 2,90±0,99, в группе ДШ- — 2,68±0,71 (р=0,39). По количеству использованных артериальных трансплантатов (левая внутренняя грудная артерия, правая внутренняя грудная артерия, лучевая артерия), венозных анастомозов, применению У-графтов и Snake-графтов статистически значимых различий между группами не выявлено (р>0,05 для всех параметров) (табл. 2).
Всем пациентам выполнялась операция КШ на работающем сердце, части пациентов с применением параллельного искусственного кровообращения: в группе ДШ+ — 10 (30%), в группе ДШ- — 23 (33,3%) (р>0,05). Но большинству больных была выполнена операция без использования искусственного кровообращения — МИРМ: в группе ДШ+ — 7 (70%), в группе ДШ- — 66,7% (р>0,05). Частота применения этих методик КШ в двух группах сравнения значимо не различалась (р>0,05).
Среднее время искусственного кровообращения и длительность искусственной вентиляции легких после операции в двух группах также значимо не отличались (р>0,05).
Данные интраоперационной шунтографии. Всем пациентам по окончании основного этапа операции выполнялась интраоперационная шунтография для контроля состояния наложенных коронарных графтов. По данным интраоперационной шунтографии в группе ДШ+ не было выявлено нарушения проходимости наложенных кондуитов. В группе ДШ- у 5 (7%) пациентов отмечался незначимый стеноз (≤50%) в д/3 шунта.
Методом количественного иммуноферментного анализа (ELISA) проводилась оценка концентрации аналитов (IL-1β, IL-6, IL-18, фактора некроза опухолей-α (TNF-α), плацентарного фактора роста, фракталкина, неоптерина) в плазме крови. Оценка маркеров воспаления проводилась: до операции, через 24 ч после КШ и на 7 сут. после операции.
Расчетные индексы системного воспаления. Для оценки воспалительного статуса использовались новые расчетные индексы системного воспаления:
- SIRI (Systemic Inflammation Response Index) — индекс системного воспалительного ответа, который вычислялся по формуле: (количество нейтрофилов × количество моноцитов) / количество лимфоцитов.
- AISI (Aggregate Inflammation Systemic Index) — совокупный индекс системного воспаления, вычислялся по формуле: (количество нейтрофилов × количество моноцитов × количество тромбоцитов) / количество лимфоцитов.
- SII (Systemic Inflammation Index) — индекс системного воспаления, вычислялся по формуле: (количество нейтрофилов × количество тромбоцитов) / количество лимфоцитов.
Статистический анализ. Статистический анализ выполнен с использованием IBM SPSS Statistics v.26 (разработчик — IBM Corporation). Данные представлены в виде M±SD при нормальном распределении значений и как медиана — Me (Q1; Q3) при распределении значений, отличном от нормального. При сравнении средних значений независимых совокупностей в случае нормального распределения данных использовался t-критерий Стьюдента, а при сравнении независимых совокупностей в случаях отсутствия признаков нормального распределения данных использовался U-критерий Манна-Уитни. Номинальные переменные сравнивали с помощью критерия хи-квадрат с поправкой Йейтса или точного критерия Фишера. Ранговая корреляция Спирмена использовалась для изучения связи между различными количественными переменными, распределение которых отличалось от нормального. Значения коэффициента корреляции ρ интерпретировались в соответствии со шкалой Чеддока. Анализ выживаемости пациентов проводился по методу регрессии Кокса, подразумевающему прогнозирование риска наступления события для рассматриваемого объекта и оценку влияния заранее определенных независимых предикторов на этот риск. Риск рассматривался как функция, зависящая от времени.
Таблица 1
Сравнительная клиническая характеристика пациентов до операции в двух группах в зависимости от развития дисфункции коронарных шунтов в средне-срочном периоде
|
Параметры |
ДШ+ (n=10) |
ДШ- (n=74) |
р* |
|
Возраст, полных лет |
62,6±9,9 |
61,5±9,2 |
0,755 |
|
Пол (муж), n (%) |
6 (60%) |
54 (73%) |
0,242 |
|
Факторы риска атеросклероза и ИБС |
|||
|
Индекс массы тела, кг/м2 |
30,5±5,0 |
29,8±4,0 |
0,631 |
|
Ожирение, n (%) |
5 (50%) |
32 (43%) |
0,9 |
|
Курение, n (%) |
4 (40%) |
29 (39%) |
1,00 |
|
Артериальная гипертензия, n (%) |
10 (100%) |
65 (88%) |
0,9 |
|
Сахарный диабет, n (%) |
3 (30%) |
20 (27%) |
0,9 |
|
Дислипидемия, n (%) |
9 (90%) |
56 (76%) |
0,681 |
|
Клиническая характеристика ИБС |
|||
|
ОИМ в анамнезе, n (%) |
3 (30%) |
22 (30%) |
1,00 |
|
Стенокардия: III-IV ФК, n (%) |
6 (60%) |
62 (84%) |
0,53 |
|
Хроническая сердечная недостаточность (NYHA): I-II ФК, n (%) III-IV ФК, n (%) |
5 (50%) 2 (20%) |
14 (19%) 2 (3%) |
0,03 0,02 |
|
Процедуры реваскуляризации (ЧКВ) в анамнезе, n (%) |
5 (35,7%) |
16 (22%) |
0,78 |
|
Мультифокальный атеросклероз, n (%) |
2 (20%) |
17 (23%) |
1,00 |
|
Сопутствующая патология |
|||
|
ОНМК в анамнезе, n (%) |
0 (0,0%) |
3 (4%) |
1,00 |
|
Фибрилляция предсердий, n (%) |
1 (10%) |
2 (2,7%) |
0,337 |
|
COVID-19 в анамнезе, n (%) |
3 (30%) |
31 (42%) |
0,502 |
|
Онкопатология, n (%) |
0 (0,0%) |
6 (8%) |
0,9 |
Примечание: * — для сравнения групп по частоте качественных переменных использовался критерий хи-квадрат Пирсона (χ2).
Сокращения: ДШ+ — пациенты, у которых диагностирована дисфункция шунта через 1 год после КШ, ДШ- — пациенты, у которых определялась нормальная функция коронарных шунтов через 1 год после КШ, ИБС — ишемическая болезнь сердца, ОИМ — острый инфаркт миокарда, ОНМК — острое нарушение мозгового кровообращения, ФК — функциональный класс, ЧКВ — чрескожное коронарное вмешательство, COVID-19 — новая коронавирусная инфекция.
Таблица 2
Характеристика выполненных операций в двух группах
|
Показатель |
ДШ+ (n=10) |
ДШ- (n=74) |
р* |
|
Количество шунтов Артериальные графты: — ЛВГА — ПВГА — Лучевая артерия Венозные графты У-графты Snake-графты Полная артериальная реваскуляризация |
2,90±0,99 10 (100%) 3 (30%) 1 (10%) 14 (140%) 1 (10%) 0 0 |
2,68±0,71 74 (100%) 29 (39%) 15 (20%) 80 (108%) 7 (9%) 8 (11%) 16 (22%) |
0,394 1,0 0,58 0,44 1,0 0,96 0,28 0,1 |
|
Длительность операции, мин Без ИК Время ИК, мин Длительность ИВЛ, часов |
335,0 [ 310-415,0] 7 (70,0%) 80,0 [ 72,5-152,5] 10,0 [ 8,3-16,5] |
350,0 [ 310,0-405,0] 47 (64%) 70,0 [ 65,0-88,5] 8,4 [ 5,9-11,2] |
0,889 0,9 0,468 0,238 |
Примечание: * — для сравнения групп по частоте качественных переменных использовался критерий хи-квадрат Пирсона (χ2).
Сокращения: ДШ+ — пациенты, у которых диагностирована дисфункция шунта через 1 год после КШ, ДШ- — пациенты, у которых определялась нормальная функция коронарных шунтов через 1 год после КШ, ИВЛ — искусственная вентиляция легких, ИК — искусственное кровообращение, ЛВГА — левая внутренняя грудная артерия, ПВГА — правая внутренняя грудная артерия.
Результаты
Динамика гуморальных маркеров воспалительной реакции в раннем послеоперационном периоде
Наблюдалось значимое повышение уровней всех анализируемых гуморальных маркеров воспаления через 24 ч после КШ (p<0,001 для всех маркеров), что свидетельствует об активации различных механизмов системной воспалительной реакции (экспрессии цитокинов и хемокинов, клеточной иммунной системы), связанных с хирургическим вмешательством. К 7 сут. после операции наблюдалось снижение указанных маркеров. Однако уровни ряда маркеров на 7 сут. были статистически значимо выше предоперационного их уровня (высокочувствительного СРБ (вч-СРБ), IL-18, неоптерина и плацентарного фактора роста). Уровни IL-6, IL-1β, TNF-α и фракталкина к 7 сут. после операции снизились и статистически значимо не различались с предоперационными показателями.
Динамика IL-6. Не выявлено статистически значимых различий между группами по концентрации IL-6 в сыворотке как до операции, так и через 24 ч и на 7 сут. после операции (р>0,05 при сравнении между группами во всех временных точках тестирования). Однако отмечено, что уже в дооперационном периоде средние значения IL-6 несколько превышали референсные показатели в группе ДШ+, тогда как в группе ДШ- средние значения IL были в пределах нормальных значений.
Динамика IL-1β. У больных группы ДШ+ определялись значительно более высокие значения концентрации IL-1β во всех временных точках тестирования, в сравнении с группой ДШ-. Отмечена интересная закономерность — до операции уровни IL-1β были в пределах нормальных значений в обеих группах, через 24 ч и на 7 сут. после операции уровни IL были значительно выше референсных показателей в группе ДШ+, тогда как в группе ДШ- не превышали нормативных значений.
Динамика IL-18. Уровни IL-18 до операции существенно не различались у больных двух групп, однако наблюдались значительно более высокие пиковые значения IL через 24 ч после операции в группе ДШ+, на 7 сут. после операции уровни IL снизились в обеих группах, но оставались более высокими в группе ДШ+.
Динамика TNF-α. Уровни TNF-α не отличались значимо у больных двух групп во всех временных точках тестирования (р>0,05 при сравнении между группами во всех временных точках тестирования). Концентрации цитокина в сыворотке не превышали нормативные показатели во всех точках тестирования.
Динамика фракталкина. Установлены значимые различия по концентрациям фракталкина в сыворотке у больных двух анализируемых групп как до операции, так и во всех точках тестирования раннего послеоперационного периода. Более того, у больных группы ДШ+ уровни хемокина превышали референсные значения уже до выполнения операции.
Динамика вч-СРБ. Выявлены значимые различия между двумя группами по уровням вч-СРБ сыворотки во всех точках тестирования. Более того, у больных группы ДШ+ уровни этого маркера воспаления превышали референсные значения уже в дооперационном периоде.
Динамика неоптерина. До выполнения операции уровни неоптерина в группе ДШ+ определялись несколько выше нормативных значений, тогда как в группе ДШ- находились в пределах нормальных значений (но различия не достигали статистической значимости). Через 24 ч после операции наблюдалось значительное повышение уровней маркера в обеих группах, но более выраженное в группе ДШ+, различия между группами стали статистически значимыми. К 7 сут. после операции отмечено снижение уровней неоптерина в обеих группах, но их концентрации в сыворотке оставались выше референсных значений и выше дооперационных показателей.
Динамика плацентарного фактора роста. Не было выявлено существенных различий между группами по уровням плацентарного фактора роста как до операции, так и при тестировании в раннем послеоперационном периоде (р>0,05 при сравнении между группами во всех временных точках тестирования).
Результаты сравнительного анализа представлены в таблице 3.
Оценка функционального статуса и МАСЕ в средне-отдаленном периоде
Через 1 год после операции было проведено контрольное обследование пациентов, включавшее оценку клинического статуса, анализ данных эхокардиографии (ЭхоКГ), стресс-ЭхоКГ с физической нагрузкой на тредмиле и коронаро-шунтографии.
За период наблюдения в группе ДШ+ зарегистрировано 2 (20%) случая внезапной сердечно-сосудистой смерти; у остальных 8 (80%) пациентов данной группы отмечался возврат стенокардии; 4 (40%) пациента перенесли острый ИМ в течение года после операции; 2 (20%) пациентам потребовалась госпитализация в связи с декомпенсацией хронической сердечной недостаточности; 8 (80%) больным выполнены повторные процедуры реваскуляризации миокарда — ЧКВ; у 3 (30%) больных регистрировались жизнеугрожающие нарушения ритма сердца — пароксизмы желудочковой тахикардии. В группе ДШ- данных МАСЕ за период наблюдения не отмечалось (р<0,001 для всех показателей при сравнении между группами) (табл. 4).
Функциональное состояние миокарда и данные стресс-ЭхоКГ в отдаленном периоде
Через год после КШ в группе ДШ+ структурно-функциональные показатели ЛЖ были существенно хуже, чем в группе ДШ- (тогда как до проведения операции эти показатели существенно не различались у больных двух групп). Средние значения ФВ ЛЖ составили в группе ДШ+ 45,2±7,4%, в группе ДШ- 57,0±3,9% (р<0,001). Средние значения конечно-диастолического объема — 140,2±43,9 мл и 116,0±26,2 мл (р=0,122); конечно-систолического объема — 75,4±22,7 мл и 49,6±12,7 мл (р=0,006), в группах ДШ+ и ДШ-, соответственно.
Стресс-ЭхоКГ с тредмил-тестом через год после операции была выполнена 5 больным группы ДШ+ и 68 пациентам группы ДШ-.
У 4 (80%) пациентов группы ДШ+ результат стресс-теста был положительным, у 1 (20%) — отрицательным. В группе ДШ- у 1 (1,5%) пациента результат стресс-теста был положительным, у 67 (98,5%) — отрицательным. Различия между группами по выявлению стресс-индуцированной ишемии миокарда высоко достоверны (р<0,001).
Индекс Дьюка — показатель, отражающий риск МАСЕ в течение года, был значительно хуже у больных группы ДШ+. В группе ДШ+ этот показатель составил -5,5±4,8, что свидетельствовало о высоком риске МАСЕ. В группе ДШ- индекс Дьюка +3,3±1,9 свидетельствовал о низком риске МАСЕ в течение года. Различия между группами достоверны (р=0,018).
Результаты коронарошунтографии в средне-срочном периоде
По результатам контрольной коронарошунтографии, выполненной через 1 год после операции КШ, в группе ДШ+ у 7 (70%) пациентов выявлена тромботическая окклюзия венозного шунта, которой не отмечалось по данным интраоперационной шунтографии, т. е. поздний тромбоз венозного шунта; у 3 (30%) больных — гемодинамически значимый стеноз кондуита (у 1 (10%) — артериального, у 2 (20%) — венозного), который также не определялся при интраоперационной шунтографии (рис. 1, 2).
В группе ДШ- также у 5 (7%) пациентов были выявлены гемодинамически незначимые сужения венозных графтов, не нарушающие функцию шунтов (табл. 5).
Лабораторные показатели через 1 год после КШ
В отдаленном периоде наблюдения (через 1 год после операции КШ) были оценены ряд лабораторных показателей. Показатели клинического анализа крови и лейкоцитарная формула значимо не отличались у больных двух групп.
Отмечены более выраженные нарушения в липидограмме у больных группы ДШ+: уровни общего холестерина и липопротеинов низкой плотности (ЛНП) были значимо выше, а уровни липопротеинов высокой плотности (ЛВП) ниже, что свидетельствовало о недостаточной компенсации нарушений липидного обмена, что, по-видимому, было следствием в т. ч. активации хронического субклинического воспаления.
Показатели гемостаза также свидетельствовали об активации хронического воспаления в группе ДШ+, у больных данной группы был повышен уровень фибриногена и показатель агрегации тромбоцитов, различия между двумя группами были статистически значимы. Параметры азотистого обмена и скорости клубочковой фильтрации между группами не различались (табл. 6).
Динамика индексов системного воспаления
До операции пациенты двух групп значимо различались по трем анализируемым показателям системного воспаления, что свидетельствовало о более выраженной активации воспалительной реакции в группе больных, у которых развилась дисфункция шунта в последующем (табл. 7).
Через 1 год после КШ пациенты двух анализируемых групп также значимо различались по показателям SIRI и AISI, что свидетельствовало о более значимой активации системного воспаления у пациентов с дисфункции коронарных шунтов (табл. 7).
Гуморальные маркеры воспаления — предикторы риска дисфункции коронарных шунтов
Для прогнозирования риска развития дисфункции коронарных шунтов в средне-отдаленные сроки после операции КШ был проведен регрессионный анализ Кокса большого спектра клинических и лабораторных показателей (табл. 8).
Предикторное значение показали уровни гуморальных маркеров воспаления. До операции прогностическое значение имели уровни вч-СРБ (отношение рисков (ОР) =1,43, 95% доверительный интервал (ДИ): 1,23-1,67, р<0,001), IL-1β (ОР =1,19, 95% ДИ: 1,05-1,35, р=0,007), фракталкина (ОР =1,08, 95% ДИ: 1,01-1,14). Через 24 ч после операции предикторное значение показали следующие гуморальные маркеры: вч-СРБ (ОР =1,16, 95% ДИ: 1,06-1,27, р<0,001), IL-1β (ОР =1,06, 95% ДИ: 1,01-1,11, р=0,016), фракталкин (ОР =1,06, 95% ДИ: 1,02-1,18, р=0,009), неоптерин (ОР =1,09, 95% ДИ: 1,01-1,18, р=0,026). На 7 сут. после операции КШ прогностическое значение имели уровни следующих маркеров: IL-1β (ОР =1,18, 95% ДИ: 1,05-1,33, р=0,006) и фракталкина (ОР =1,03, 95% ДИ: 1,003-1,069, р=0,035).
Высокое предикторное значение показали параметры дислипидемии: повышенные уровни ЛНП (ОР =5,05, 95% ДИ: 1,76-14,48, р=0,003), общего холестерина (ОР =4,15, 95% ДИ: 1,46-11,81, р=0,008), снижение уровня ЛВП (ОР =0,001, 95% ДИ: 0,0001-0,819, р=0,044).
Кроме того, предикторное значение на риск развития дисфункции шунтов оказывали повышенные уровни фибриногена (ОР =1,94, 95% ДИ: 1,28-2,93, р=0,002) и креатинина сыворотки крови (ОР =1,02, 95% ДИ: 1,002-1,042, р=0,029) (табл. 8).

Рис. 1. Данные шунтографии интраоперационно и через 5 мес. после КШ.
Примечание: А) Интраоперационная шунтография: нормально функционирующий венозный шунт к ветви тупого края; Б) Шунтография через 5 мес. после операции: дисфункция шунта, резкое сужение просвета шунта за счет выраженной гиперплазии интимы.
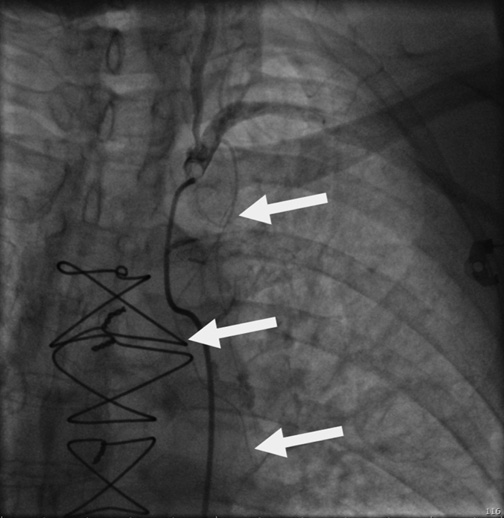
Рис. 2. Шунтография через 1 год после операции.
Примечание: дисфункция шунта, маммарокоронарное шунтирование с шунтированием передней нисходящей ветви, резкое сужение просвета шунта за счет выраженной гиперплазии интимы.
Таблица 3
Динамика гуморальных маркеров воспаления в раннем послеоперационном периоде в зависимости от развития дисфункции коронарных шунтов
|
Параметр |
ДШ+ (n=10) |
ДШ- (n=74) |
р* |
|
IL-6 (до операции), пг/мл |
7,5 [ 5,7-16,9] |
4,3 [ 2,2-9,7] |
0,089 |
|
IL-6 (1 сут.), пг/мл |
16,4 [ 14,8-31,6] |
18,7 [ 13,1-30,0] |
0,081 |
|
IL-6 (7 сут.), пг/мл |
12,1 [ 9,3-21,28] |
9,3 [ 3,4-15,1] |
0,290 |
|
IL-1β (до операции), пг/мл |
7,4 [ 8,1-16,3] |
3,7 [ 2,0-4,9] |
<0,001 |
|
IL-1β (1 сут.), пг/мл |
21,7 [ 19,6-26,7] |
4,6 [ 3,0-7,9] |
0,005 |
|
IL-1β (7 сут.), пг/мл |
16,6 [ 2,4-18,5] |
4,7 [ 2,5-8,0] |
0,367 |
|
вчСРБ (до операции), мг/л |
7,5 [ 4,0-8,0] |
1,0 [ 1,0-3,0] |
<0,001 |
|
вчСРБ (1 сут.), мг/л |
24,0 [ 21,0-36,0] |
18,0 [ 16,0-23,0] |
0,005 |
|
вчСРБ (7 сут.), мг/л |
14,0 [ 9,0-17,0] |
11,0 [ 8,0-14,0] |
0,242 |
|
Неоптерин (до операции), нМоль/л |
11,5 [ 7,8-14,9] |
6,6 [ 8,1-11,9] |
0,236 |
|
Неоптерин (1 сут.), нМоль/л |
21,8 [ 19,4-27,4] |
12,4 [ 9,3-19,0] |
0,025 |
|
Неоптерин (7 сут.), нМоль/л |
11,7 [ 8,0-14,2] |
9,1 [ 7,8-11,7] |
0,600 |
|
IL-18 (до операции), пг/мл |
282,8 [ 263,0-386,8] |
296,2 [ 209,3-401,1] |
0,531 |
|
IL-18 (1 сут.), пг/мл |
631,3 [ 509,2-780,8] |
344,4 [ 286,8-478,6] |
0,001 |
|
IL-18 (7 сут.), пг/мл |
494,7 [ 489,7-573,0] |
369,8 [ 234,2-448,1] |
0,079 |
|
ПФР (до операции), пг/мл |
6,7 [ 6,7-8,7] |
8,6 [ 4,0-14,4] |
0,785 |
|
ПФР (1 сут.), пг/мл |
18,9 [ 15,3-21,4] |
17,6 [ 12,5-22,6] |
0,761 |
|
ПФР (7 сут.), пг/мл |
16,2 [ 12,5-16,8] |
12,4 [ 7,7-16,6] |
0,275 |
|
TNF-α (до операции), пг/мл |
1,2 [ 1,0-1,2] |
0,8 [ 0,3-1,2] |
0,449 |
|
TNF-α (1 сут.), пг/мл |
1,8 [ 1,4-1,9] |
1,1 [ 0,4-1,8] |
0,119 |
|
TNF-α (7 сут.), пг/мл |
1,1 [ 0,8-1,2] |
0,7 [ 0,3-0,9] |
0,183 |
|
Фракталкин (до операции), пг/мл |
26,8 [ 25,9-35,2] |
3,5 [ 2,2-7,2] |
<0,001 |
|
Фракталкин (1 сут.), пг/мл |
52,0 [ 49,4-67,1] |
12,3 [ 8,4-17,4] |
<0,001 |
|
Фракталкин (7 сут.), пг/мл |
31,5 [ 12,9-34,2] |
3,2 [ 2,3-5,0] |
<0,001 |
Примечание: * — для сравнения групп по частоте качественных переменных использовался критерий хи-квадрат Пирсона (χ2).
Сокращения: вчСРБ — высокочувствительный С-реактивный белок, ДШ+ — пациенты, у которых диагностирована дисфункция шунта через 1 год после КШ, ДШ- — пациенты, у которых определялась нормальная функция коронарных шунтов через 1 год после КШ, ПФР — плацентарный фактор роста, IL — интерлейкин, TNF-α — фактор некроза опухоли-α.
Таблица 4
Клинический статус пациентов и частота МАСЕ через 1 год после КШ в двух группах
|
Параметр |
ДШ+ (n=10) |
ДШ- (n=74) |
р* |
|
Возврат стенокардии Нет стенокардии |
8 (80%) 0 |
0 74 (100%) |
|
|
ОИМ за период наблюдения |
4 (40%) |
0 (0,0%) |
<0,001 |
|
Госпитализация с декомпенсацией ХСН |
2 (20%) |
0 (0,0%) |
0,015 |
|
Повторная реваскуляризация миокарда |
8 (80%) |
1 (1,3%) |
<0,001 |
|
Пароксизмы ЖТ |
3 (30%) |
0 (0,0%) |
0,002* |
|
Сердечно-сосудистая смерть |
2 (20%) |
0 (0,0%) |
0,015 |
|
ОНМК за период наблюдения |
0 (0,0%) |
1 (1,3%) |
1,00 |
|
ХБП |
2 (20%) |
1 (1,3%) |
0,041 |
Примечание: * — для сравнения групп по частоте качественных переменных использовался критерий хи-квадрат Пирсона (χ2).
Сокращения: ДШ+ — пациенты, у которых диагностирована дисфункция шунта через 1 год после КШ, ДШ- — пациенты, у которых определялась нормальная функция коронарных шунтов через 1 год после КШ, ЖТ — желудочковая тахикардия, ОИМ — острый инфаркт миокарда, ОНМК — острое нарушение мозгового кровообращения, ХБП — хроническая болезнь почек, ХСН — хроническая сердечная недостаточность.
Таблица 5
Результаты коронарошунтографии в средне-срочном периоде в двух группах
|
Параметр |
ДШ+ (n=10) |
ДШ- (n=74) |
|
Тромбоз венозного шунта (поздний) |
7 (70%) |
0 |
|
Гемодинамически значимый стеноз шунта — артериального (ЛВГА) — венозного |
3 (30%) 1 (10%) 2 (20%) |
0 — — |
|
Гемодинамически незначимый стеноз венозного шунта |
0 |
5 (7%) |
|
Всего больных с дисфункцией шунтов |
10 (100%) |
— |
Сокращения: ДШ+ — пациенты, у которых диагностирована дисфункция шунта через 1 год после КШ, ДШ- — пациенты, у которых определялась нормальная функция коронарных шунтов через 1 год после КШ, ЛВГА — левая внутренняя грудная артерия.
Таблица 6
Лабораторные показатели (через 1 год после КШ) в двух группах, в зависимости от наличия дисфункции шунтов в отдаленном периоде
|
Параметр |
ДШ+ |
ДШ- |
р* |
|
Клинический анализ крови |
|||
|
Гемоглобин, г/л |
125,2±17,2 |
140,5±12,8 |
0,002* |
|
Эритроциты, *1012 на л |
4,3±0,9 |
4,9±0,6 |
0,017 |
|
Тромбоциты, *109 на л |
241,0±55,6 |
255,7±50,2 |
0,418 |
|
Лейкоциты, *109 на л |
9,1±2,0 |
8,2±1,2 |
0,082 |
|
Лимфоциты, % |
27,1±9,1 |
27,8±5,2 |
0,712 |
|
Биохимические показатели |
|||
|
Общий холестерин, мМоль/л |
4,9±0,9 |
4,3±0,8 |
0,034 |
|
ЛНП, мМоль/л |
3,0±0,6 |
2,3±0,6 |
0,004 |
|
ЛВП, мМоль/л |
0,9±0,1 |
1,0±0,1 |
0,030 |
|
ТГ, мМоль/л |
1,5±0,2 |
1,5±0,4 |
0,717 |
|
Общий белок, г/л |
63,8±10,4 |
67,0±7,5 |
0,251 |
|
Мочевина, мМоль/л |
8,2±3,9 |
7,2±1,8 |
0,441 |
|
Креатинин, мкмоль/л |
106,6±46,1 |
89,5±24,1 |
0,276 |
|
Скорость клубочковой фильтрации, мл/мин/1,73 м2 |
74,48±2,55 |
79,46±2,14 |
0,1 |
|
Показатели гемостаза |
|||
|
Фибриноген, г/л |
5,5±1,3 |
4,3±1,1 |
0,003* |
|
Степень агрегации тромбоцитов, % |
55,7±10,9 |
49,4±10,1 |
0,087 |
|
Антитромбин III, % |
109,7±6,9 |
97,4±12,7 |
0,006* |
Примечание: * — для сравнения групп по частоте качественных переменных использовался критерий хи-квадрат Пирсона (χ2).
Сокращения: ДШ+ — пациенты, у которых диагностирована дисфункция шунта через 1 год после КШ, ДШ- — пациенты, у которых определялась нормальная функция коронарных шунтов через 1 год после КШ, ЛВП — липопротеины высокой плотности, ЛНП — липопротеины низкой плотности, ТГ — триглицериды.
Таблица 7
Динамика индексов системного воспаления
|
Показатель |
ДШ+ |
ДШ- |
р* |
|
До операции |
|||
|
SIRI |
1,50±0,35 |
0,89±0,35 |
<0,001 |
|
AISI |
376,3±0,60 |
216,4±0,14 |
0,002 |
|
SII |
531,84±166,6 |
427,55±132,4 |
0,027 |
|
1 год после КШ |
|||
|
SIRI |
1,39±0,37 |
0,93±0,36 |
0,0006 |
|
AISI |
347,8±125,52 |
242,6±108,08 |
0,009 |
|
SII |
510,0±201,74 |
475,0±134,31 |
0,49 |
Примечание: * — для сравнения групп по частоте качественных переменных использовался критерий хи-квадрат Пирсона (χ2).
Сокращения: ДШ+ — пациенты, у которых диагностирована дисфункция шунта через 1 год после КШ, ДШ- — пациенты, у которых определялась нормальная функция коронарных шунтов через 1 год после КШ, КШ — (аорто)коронарное шунтирование, AISI — совокупный индекс системного воспаления (Aggregate Inflammation Systemic Index), SII — индекс системного воспаления (Systemic Inflammation Index), SIRI — индекс системного воспалительного ответа (Systemic Inflammation Response Index).
Таблица 8
Результаты однофакторного регрессионного анализа Кокса факторов риска развития дисфункции шунтов
|
Показатель |
ОР |
95% ДИ |
р |
|
Возраст |
0,99 |
0,93-1,07 |
0,961 |
|
Пол, мужской |
1,06 |
0,33-3,43 |
0,920 |
|
Индекс массы тела |
1,04 |
0,92-1,18 |
0,535 |
|
Инфаркт миокарда в анамнезе |
1,08 |
0,31-3,74 |
0,908 |
|
ЧКВ в анамнезе |
1,13 |
0,37-3,40 |
0,833 |
|
Онкопатология |
0,04 |
0,01-300,6 |
0,487 |
|
Сахарный диабет |
0,71 |
0,19-2,56 |
0,597 |
|
Курение |
0,95 |
0,27-3,36 |
0,933 |
|
КДО ЛЖ |
1,00 |
0,99-1,02 |
0,677 |
|
КСО ЛЖ |
1,01 |
0,99-1,03 |
0,474 |
|
ФВ ЛЖ |
0,96 |
0,88-1,04 |
0,356 |
|
Общий холестерин в отдаленном периоде |
4,15 |
1,46-11,81 |
0,008* |
|
ЛНП в отдаленном периоде |
5,05 |
1,76-14,48 |
0,003* |
|
ЛВП в отдаленном периоде |
0,001 |
0,0001-0,819 |
0,044* |
|
ТГ в отдаленном периоде |
1,85 |
0,49-6,92 |
0,361 |
|
Креатинин в отдаленном периоде |
1,02 |
1,002-1,042 |
0,029* |
|
Фибриноген в отдаленном периоде |
1,94 |
1,28-2,93 |
0,002* |
|
IL-6 (до операции) |
1,08 |
0,98-1,19 |
0,126 |
|
IL-6 (1 сут.) |
1,01 |
0,95-1,06 |
0,870 |
|
IL-6 (7 сут.) |
1,05 |
0,97-1,15 |
0,233 |
|
IL-1β (до операции) |
1,19 |
1,05-1,35 |
0,007* |
|
IL-1β (1 сут.) |
1,06 |
1,01-1,11 |
0,016* |
|
IL-1β (7 сут.) |
1,18 |
1,05-1,33 |
0,006* |
|
СРБ (до операции) |
1,43 |
1,23-1,67 |
<0,001* |
|
СРБ (1 сут.) |
1,16 |
1,06-1,27 |
<0,001* |
|
СРБ (7 сут.) |
1,07 |
0,99-1,19 |
0,222 |
|
Неоптерин (до операции) |
1,11 |
0,93-1,31 |
0,236 |
|
Неоптерин (1 сут.) |
1,09 |
1,01-1,18 |
0,026* |
|
Неоптерин (7 сут.) |
0,98 |
0,82-1,17 |
0,841 |
|
IL-18 (до операции) |
1,002 |
0,99-1,009 |
0,444 |
|
IL-18 (1 сут.) |
1,005 |
1,00-1,01 |
0,072 |
|
IL-18 (7 сут.) |
1,004 |
0,99-1,009 |
0,112 |
|
ПФР (до операции) |
0,99 |
0,83-1,17 |
0,891 |
|
ПФР (1 сут.) |
1,02 |
0,99-1,14 |
0,736 |
|
ПФР (7 сут.) |
1,08 |
0,99-1,22 |
0,246 |
|
TNF-α (до операции) |
1,34 |
0,30-5,89 |
0,700 |
|
TNF-α (1 сут.) |
1,59 |
0,65-3,87 |
0,310 |
|
TNF-α (7 сут.) |
1,20 |
0,40-3,63 |
0,741 |
|
Фракталкин (до операции) |
1,08 |
1,01-1,14 |
0,013* |
|
Фракталкин (1 сут.) |
1,06 |
1,02-1,18 |
0,009* |
|
Фракталкин (7 сут.) |
1,03 |
1,003-1,069 |
0,035* |
Примечание: * — различия показателей статистически значимы (p<0,05).
Сокращения: ДИ — доверительный интервал, КДО — конечно-диастолический объем, КСО — конечно-систолический объем, ЛВП — липопротеины высокой плотности, ЛЖ — левый желудочек, ЛНП — липопротеины низкой плотности, ОР — отношение рисков, ПФР — плацентарный фактор роста, СРБ — С-реактивный белок, ТГ — триглицериды, ФВ — фракция выброса, ЧКВ — чрескожное коронарное вмешательство, IL — интерлейкин, TNF-α — фактор некроза опухоли-α.
Обсуждение
КШ является эффективным и широко используемым методом лечения больных ИБС. Серьезной проблемой остается развитие дисфункции коронарных кондуитов, что ухудшает результаты хирургического лечения и является причиной неблагоприятных клинических исходов [12][13].
Развитие дисфункции коронарных графтов является результатом сложных патофизиологических процессов, которые приводят к частичному или полному нарушению кровотока по шунту. При этом центральными механизмами патофизиологии являются ремоделирование сосудистой стенки и воспаление.
Настоящее исследование было посвящено проверке основной гипотезы — является ли активация системной воспалительной реакции и поддержание ее в последующем после реваскуляризации миокарда одним из факторов, приводящих к развитию дисфункции коронарных кондуитов и в итоге к негативным результатам хирургического лечения.
Раннее развитие дисфункции коронарных кондуитов, которая возникает в течение первого месяца, обусловлено зачастую хирургическими техническими ошибками или тромбозом, чаще всего в месте наложения анастомоза. Известно, что эндотелиальное повреждение является ключевым фактором ранней дисфункции кондуита, поскольку повреждение субэндотелия способствует адгезии тромбоцитов и тромбозу. При выделении большой подкожной вены нарушается vasa vasorum адвентиции, что может вызвать повреждение эндотелия, вследствие гипоксии [2]. Помимо этого, при интраоперационной оценке целостности кондуита растяжением под высоким давлением, также может происходить повреждение эндотелия и инициироваться провоспалительные и прокоагулянтные реакции [14][15].
Развитие дисфункции кондуитов в течение первого года после КШ обусловлено чаще всего прогрессирующим неоинтимальным утолщением, как клеточным, так и внеклеточным. Пусковым фактором является воздействие артериального кровотока на венозный кондуит [16]. Под воздействием артериального кровотока происходит повреждение венозного эндотелия, приводящее в последующем к высвобождению факторов роста и цитокинов, кроме того, к инициации адгезии и активации тромбоцитов и макрофагов. Гладкомышечные клетки мигрируют и гипертрофируются. Мигрирующие гладкомышечные клетки высвобождают внеклеточный матрикс, что способствует неоинтимальному утолщению. Факторы, способствующие пролиферации гладкомышечных клеток, включают: снижение синтеза оксида азота, продуцируемого эндотелием, а также выброс простагландинов и аденозина. Миграция и пролиферация гладкомышечных клеток и фибробластов, а также отложение внеклеточного матрикса способствуют неоинтимальной гиперплазии, которая проникает в просвет и способствует развитию поздней дисфункции шунта [17].
Касательно недостаточности коронарных кондуитов, которая возникает в более поздние сроки, более чем через 1 год после КШ, она вызывается прогрессированием атеросклероза. Как эндотелиальное повреждение, так и неоинтимальная гиперплазия инициируют этот процесс. Считается, что атеросклероз венозного кондуита отличается от нативной атеромы коронарной артерии тем, что он бывает более диффузным и концентрическим, при этом менее кальцинированным [16].
Роль воспаления в механизмах повреждения сосудистого эндотелия и дисфункции коронарных кондуитов
На любом временном этапе формирования дисфункции коронарных кондуитов существует определенная степень локального острого или хронического воспаления в эндотелии, усугубляющего патофизиологические процессы, приводящие к нарушению проходимости шунтов [18, 19].
На начальном этапе повреждение сосудистого эндотелия сопровождается его отслойкой и обнажением основной мембраны, зона деэндотелизации рекрутирует лейкоциты и тромбоциты, которые инфильтрируют интиму. Этот процесс чередуется с острой и хронической активацией лейкоцитов [20]. Процесс гиперплазии интимы шунта усиливается повышенной продукцией факторов роста и цитокинов: IL-1β, IL-6, TNF-α, высвобождаемыми воспалительными клетками.
На более поздней стадии моноциты инфильтрируют слой интимальной гиперплазии и дифференцируются в макрофаги, как это наблюдается в АСБ, и превращаются в пенистые клетки. Хроническая активация воспаления делает этот процесс быстрее, чем в нативных коронарных артериях. Интимальные макрофаги секретируют матриксные металлопротеиназы, происходит миграция сосудистых гладкомышечных клеток в интиму. Наличие гладкомышечных клеток в интимальном слое вызывает дальнейшее воспаление, привлекая дополнительные макрофаги в слой гиперплазированной интимы, тем самым ускоряя атерогенез [16]. Во время этого процесса воспаления повреждается периваскулярная клетчатка, высвобождаются цитокины и рекрутируются лимфатические клетки в адвентицию, которая, в свою очередь, секретирует провоспалительные цитокины, разрушение периваскулярного жира также снижает биодоступность оксида азота, который действует как регулятор сосудистого тонуса и сигнализирует сосудистым гладкомышечным клеткам о необходимости пребывания в сократительном состоянии [19].
По результатам нашего исследования установлено значимое влияние на риск развития дисфункции коронарных шунтов наряду с традиционными биомаркерами воспаления (вч-СРБ), также новых биомаркеров воспалительной реакции: IL-1β, фракталкина, неоптерина.
Однофакторный регрессионный анализ Кокса выявил значимую роль повышенных уровней следующих гуморальных маркеров воспаления как факторов риска развития дисфункции коронарных шунтов в средне-срочном периоде после операции КШ:
— до операции прогностическое значение имели уровни: вч-СРБ, IL-1β, фракталкина;
— через 24 ч после операции: вч-СРБ, IL-1β, фракталкина, неоптерина;
— на 7 сут. после операции КШ: IL-1β, фракталкина.
Установлено предикторное значение параметров липидограммы на риск развития дисфункции коронарных кондуитов: повышение ЛНП, повышение общего холестерина, снижение ЛВП.
Патофизиологическая роль фракталкина в механизмах воспаления и дисфункции коронарных шунтов
Фракталкин (FKN, CX3CL1) — представляет собой структурно и функционально уникальный хемокин, представлен в двух формах: мембраносвязанный фракталкин (FKN) облегчает межклеточную адгезию лейкоцитов к эндотелию, тогда как в растворимой форме (sFKN) он служит мощным хемоаттрактантом для клеток, экспрессирующих его рецептор CX3CR1. В 1997г учёные обнаружили подкласс хемокинов, состоящий всего лишь из 1 представителя, названного фракталкином, или CX3CL1, на сосудистом эндотелии [20].
FKN/CX3CL1 экспрессируется в активированном или стрессовом эндотелии, сосудистых гладкомышечных клетках, клетках скелетных мышц, макрофагах, нейронах, гепатоцитах и адипоцитах. Он связывается с рецептором CX3CR1, служа его эксклюзивным лигандом. Рецептор CX3CR1 экспрессируется на лейкоцитах: моноцитах, макрофагах, Т-клетках CD4, Т-клетках CD8, дендритных клетках, естественных клетках-киллерах, тромбоцитах, гладкомышечных клетках и кардиомиоцитах. Фракталкин оказывает цитотоксическое действие на эндотелий, а также антиапоптозное, пролиферативное воздействие на сосудистые клетки, влияя на стабильность АСБ. Взаимодействие фракталкина и его рецептора CX3CR1 способствует захвату и трансмиграции лейкоцитов в целевой области, что приводит к высвобождению цитотоксических белков и, в конечном итоге, дальнейшему повреждению эндотелия. Интересно, что он также экспрессируется кардиомиоцитами и фиброзной тканью [21, 22].
Специфические сигнальные пути, генерируемые взаимодействием фракталкина с рецептором CX3CR1, до сих пор плохо изучены. Однако известно, что регуляторный путь FKN/CX3CR1 влияет на несколько воспалительных сигнальных путей, среди которых JAK-STAT, Toll-подобный рецептор, MAPK, AKT, NF-B и Wnt/-катенин [23].
Помимо привлечения лейкоцитов фракталкин, экспрессируемый эндотелиальными клетками, также может активировать и дегранулировать тромбоциты, содержащие CX3CR1-соответствующие рецепторы. Эти тромбоциты запускают поверхностную экспрессию P-селектина, который затем прикрепляется к моноцитам, способствуя трансмиграции большего количества моноцитов [24].
Роль фракталкина в развитии атеросклероза хорошо известна. Он играет важную роль на всех стадиях атерогенеза, включая рекрутирование моноцитов при ранних атеросклеротических изменениях, а также способствует миграции гладкомышечных клеток и неоангиогенезу на более поздних стадиях развития атеромы. Фракталкин как хемокин помимо рекрутирования воспалительных клеток, также действует как молекула адгезии, которая облегчает трансмиграцию лейкоцитов и ускоряет миграцию и пролиферацию гладкомышечных клеток. FKN/CX3CL1 функционирует как медиатор ремоделирования тканей и ангиогенеза, вызванного воспалением. Повышенные уровни фракталкина способствуют активации моноцитов и тромбоцитов, ускоряя развитие АСБ и создавая повышенный риск разрыва бляшек. Периваскулярное воспаление может выступать движущей силой в развитии сосудистого ремоделирования. Как было показано, FKN/CX3CL1 и другие хемокины участвуют на каждом этапе процесса сосудистого ремоделирования [18]. Эти сложные взаимодействия могут являться ключевыми, определяя значимую роль фракталкина в механизмах атерогенеза и сосудистого ремоделирования (рис. 3).
Взаимодействие фракталкина с рецептором CX3CR1 усиливает гуморальный иммунный ответ, напрямую связанный с уязвимостью АСБ. В нескольких опубликованных исследованиях рассматривалась значимость sFKN, а также клеток, экспрессирующих рецептор CX3CR1, в контексте разрыва бляшек. Ряд исследований провели сопоставление уровней фракталкина и его рецептора с нестабильностью АСБ, используя методологии интракоронарной визуализации, либо внутрисосудистого ультразвука, либо оптической когерентной томографии для оценки морфологии бляшек [25, 26].
В исследование Li J, et al. (2012) были включены пациенты с нестабильной стенокардией и доказанной нестабильностью АСБ, обусловившей клинический синдром, у этих пациентов обнаружены значительно более высокие уровни фракталкина и мононуклеарных клеток, экспрессирующих рецептор CX3CR1, по сравнению с пациентами со стабильной стенокардией и здоровыми людьми из контрольной группы. Исследование показало, что фракталкин участвует в патогенезе уязвимости бляшек и механизмах разрыва бляшек [27].
Помимо участия в механизмах нестабильности и разрыва АСБ, уровни фракталкина имеют прогностическое значение и повышают риск развития крупных MACE.
Yao K, et al. (2015) выявили положительную корреляцию между уровнем фракталкина через сутки после ЧКВ у больных с острым ИМ и уровнем тропонина на 7 день после процедуры. Уровни фракталкина также оказались обратно пропорциональны ФВ ЛЖ, оцененной через 1 мес. Это исследование также установило, что фракталкин является независимым предиктором крупных MACE, при этом более высокий уровень фракталкина через 1 сут. после ЧКВ определял повышенный риск MACE в течение 1 года наблюдения [28].
В целом имеющиеся данные позволяют говорить, что фракталкин участвует в патогенезе атеросклероза, нестабильности и разрыва АСБ, а также посредством цитотоксического действия на эндотелий и механизмы сосудистого ремоделирования играет важную роль в патогенезе дисфункции коронарных кондуитов после КШ. Это открывает перспективы для разработки методов стратификации риска с использованием фракталкина, он может служить прогностическим фактором, диагностическим биомаркером.
Более того, некоторые аспекты биологии фракталкина делают его очень привлекательной целью для фармакотерапии. Блокировка пути CX3CL1/CX3CR1 может привести к снижению риска дисфункции коронарных кондуитов и связанных с ней крупных МАСЕ, что требует дальнейшего углубленного изучения. Текущие клинические испытания, такие как FRACTAL, скоро начнут проливать свет на терапевтический потенциал ингибирования фракталкина [21].
Патофизиологическая роль IL-1β в механизмах воспаления, атерогенеза и дисфункции коронарных шунтов
IL-1β — один из главных воспалительных цитокинов, участвующих в атеротромбозе. Семейство IL-1 имеет три основных лиганда: в качестве агонистов IL-1α, IL-1β и внутренний антагонист — IL-1Ra. Система IL-1/IL-1Ra способствует хроническому воспалительному процессу.
Известно, что IL-1 индуцирует прокоагулянтную активность, а также адгезию моноцитов и лейкоцитов к сосудистой стенке. Эндотоксин и фактор некроза опухолей могут индуцировать экспрессию гена IL-1 в сосудистых эндотелиальных и гладкомышечных клетках. АСБ содержат как IL-1, так и IL-1Ra [29].
На протяжении многих лет семейство IL-1 изучалось в связи с регуляцией митогенеза эндотелиальных и гладкомышечных клеток, тромбогенной реакции эндотелиальных клеток, адгезии лейкоцитов, метаболизма липопротеинов, продукции внеклеточного матрикса и сосудистой проницаемости.
Биологические эффекты данного IL также связаны с образованием и разрывом АСБ различными путями: стимуляцией сосудистых гладкомышечных клеток посредством повышения регуляции фактора роста-β (TGF-β), подавлением пролиферации эндотелиальных клеток, экспрессией эндотелиальными клетками молекул адгезии и модификацией эндотелия, что впоследствии благоприятствует тромбозу (рис. 4) [30].
Клинические исследования подтверждают эти концепции. Опубликованы наблюдения, что у больных с коронарным атеросклерозом уровни IL-1 выше, чем у пациентов с нормальными коронарными артериями [31].
Кроме того, уровни IL-1β коррелируют с выработкой других медиаторов воспаления, таких как циклооксигеназа-2, что приводит к образованию простагландинов. Синтез IL-6 и матриксных металлопротеиназ также опосредуется IL-1β, что приводит к повышению уровней белков острой фазы (СРБ, фибриногена), играющих роль в атерогенезе [32].
В исследовании CANTOS было доказано, что IL-1β играет важную роль в развитии атеротромбоза, и была предложена терапия для его подавления в виде каникинумаба [33].
Таким образом, накопленные данные свидетельствуют, что IL-1β, играя важную роль в механизмах атерогенеза, нестабильности АСБ, активации сосудистых гладкомышечных клеток, развитии эндотелиальной дисфункции, тромбообразовании, участвует и в механизмах развития дисфункции коронарных шунтов [34-36].
Патофизиологическая роль неоптерина в механизмах воспаления, атерогенеза и дисфункции коронарных шунтов
В последние десятилетия особый интерес приобрела группа "новых" биомаркеров. Неоптерин — член семейства птеридинов, является индикатором активации макрофагов. Ранее опубликованные исследования показали, что неоптерин является важным звеном патофизиологии атеросклероза и его значимым биомаркером [37].
Неоптерин является воспалительным фактором, синтезируемым и высвобождаемым моноцитами/макрофагами в ответ на стимуляцию γ-интерфероном и отражает клеточный иммунный ответ. Значимую роль макрофагов и неоптерина в раннем атерогенезе подчеркивают недавние открытия. Это ключевой этап развития атеросклероза, в этом контексте взаимосвязь между неоптерином и атеросклерозом может объясняться активацией макрофагов. При этом важную роль играет окислительный стресс, поскольку неоптерин усиливает образование реактивных частиц кислорода [37, 38].
Считается, что активированные макрофаги в сегментах сосудов, пораженных атеросклерозом, повышают уровни неоптерина, тем самым индуцируя экспрессию молекул адгезии в эндотелиальных клетках. Адгезивные молекулы приводят к усилению адгезии лимфоцитов, тромбоцитов. Кроме того, неоптерин может способствовать росту АСБ и пролиферации сосудистых гладкомышечных клеток (рис. 5) [39].
Первые исследования роли неоптерина в отношении атерогенеза и риска ИМ были опубликованы уже в 1990-х годах. По данным Fuchs D, et al., повышенный уровень неоптерина в сыворотке предсказывает будущие МАСЕ у пациентов со стабильной стенокардией [40]. В дальнейшем многочисленные исследования подтвердили, что повышенные уровни неоптерина способствуют развитию атеросклероза. Несколько исследователей сообщили о связи между неоптерином и прогрессированием или нестабильностью АСБ [41].
Последние два десятилетия неоптерину уделяется все больше внимания в патогенезе сердечно-сосудистых осложнений. Неоптерин является ценным прогностическим маркером для стратификации риска у лиц с ИБС. Неоптерин является маркером риска нестабильной стенокардии, острого ИМ и сердечно-сосудистой смерти [42]. Повышенные уровни неоптерина в сыворотке связаны с рецидивом острого коронарного синдрома и госпитализацией по поводу сердечной недостаточности [43].
Было показано, что нестабильность АСБ и развитие острого коронарного синдрома коррелируют с концентрацией неоптерина. При остром ИМ, как фатальном последствии разрыва бляшки, уровни неоптерина значительно выше по сравнению с пациентами с хронической ИБС и контрольной группой. Авторы пришли к выводу, что уровни неоптерина у пациентов с острым коронарным синдромом были выше, чем у пациентов со стабильной ИБС, уровни неоптерина в сыворотке при ИМ с подъемом сегмента SТ составляли — 11,5±3,2 нмоль/л, а у пациентов с инфарктом без подъема сегмента ST — 9,8±2,9 нмоль/л. Эти наблюдения позволяют сделать вывод, что эта молекула играет роль в нестабильности АСБ [42].
Zouridakis E, et al., выявили, что повышенные концентрации неоптерина связаны с более быстрым прогрессированием ИБС у пациентов со стабильной стенокардией. Эти данные указывают на то, что неоптерин может быть маркером агрессивности течения атеросклеротического процесса [44].
В научной литературе ведутся дискуссии относительно возможной связи между уровнем неоптерина и тяжестью коронарного атеросклероза. По данным Kember I, et al. [32], концентрации неоптерина в сыворотке положительно коррелируют с уровнями ЛНП и мочевины в сыворотке и отрицательно коррелируют с лактатом, что также указывает на связь между уровнями неоптерина и атеросклерозом.
Кроме того, было установлено, что уровень неоптерина повышен у больных с сахарным диабетом и ожирением. У пациентов с диабетом также подтверждено, что неоптерин является независимым предиктором ИБС и фатального исхода [45].
Текущие данные свидетельствуют о том, что диагностическая эффективность тестирования на неоптерин сопоставима с эффективностью хорошо известных биомаркеров, таких как уровни СРБ и холестерина в плазме. Сегодня неоптерин рассматривается как маркер прогрессирования ИБС и как новая "терапевтическая мишень" при атеросклерозе и связанных с ним заболеваниях.
По-видимому, посредством биологических эффектов, участвующих в механизмах воспаления, атерогенеза, неоптерин участвует и в механизмах развития дисфункции шунтов после КШ.
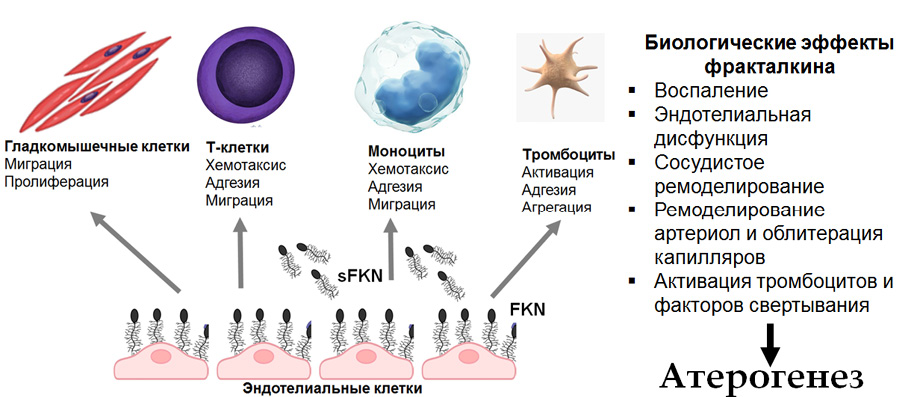
Рис. 3. Роль фракталкина в механизмах атерогенеза и сосудистого ремоделирования.
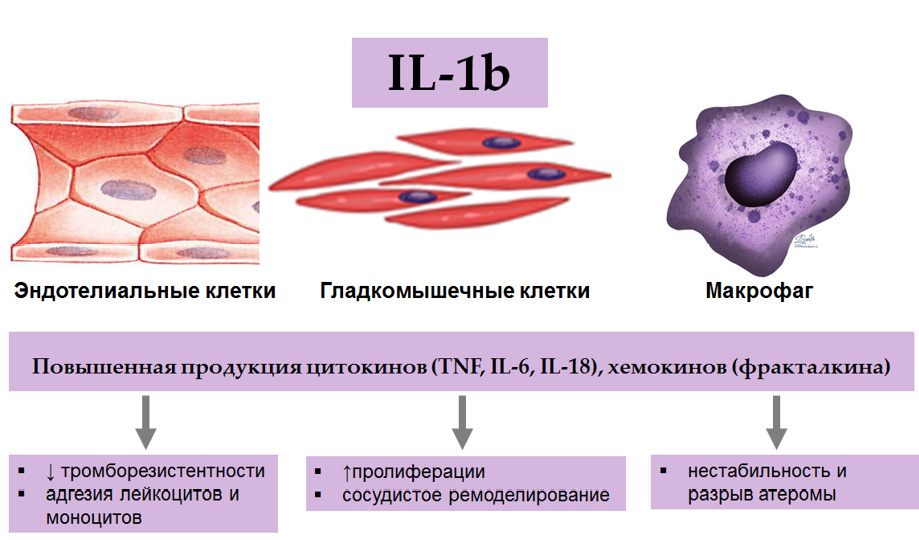
Рис. 4. Биологические эффекты IL-1β.
Примечание: IL-1β действует на многие типы клеток, в т. ч. на те, которые участвуют в атерогенезе, такие как сосудистый эндотелий, сосудистые гладкомышечные клетки и макрофаги. Посредством чего IL-1β участвует в механизмах атерогенеза, нестабильности атеросклеротической бляшки, активации сосудистых гладкомышечных клеток, пролиферации эндотелия, развитии эндотелиальной дисфункции, сосудистом ремоделировании и тромбообразовании.
Сокращения: IL — интерлейкин, TNF — фактор некроза опухоли.
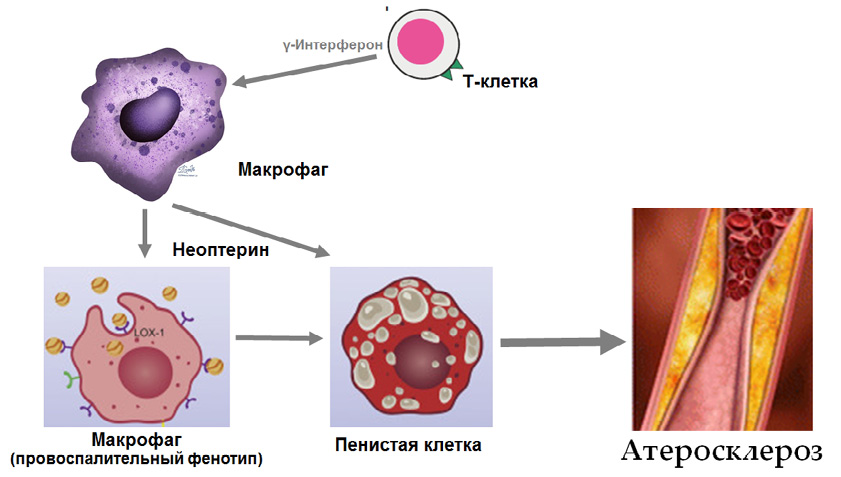
Рис. 5. Биологический путь образования неоптерина и его участие в механизмах атерогенеза.
Примечание: во время клеточного иммунного ответа активированные Т-лимфоциты высвобождают интерферон-γ, который стимулирует в макрофагах производство неоптерина. Активированные макрофаги повышают уровни неоптерина, индуцируют экспрессию молекул адгезии в эндотелиальных клетках. Адгезивные молекулы приводят к усилению адгезии лимфоцитов, тромбоцитов. Неоптерин способствует пролиферации сосудистых гладкомышечных клеток и росту атеросклеротических бляшек.
Заключение
Проведенное исследование подтвердило ведущую роль воспаления в запуске и поддержании основных механизмов, определяющих повреждение сосудистой стенки коронарных кондуитов после КШ, что является основой развития дисфункции шунтов. Это позволяет рассматривать воспаление в качестве самостоятельной причины сосудистого повреждения, а установленные значимые биомаркеры воспаления (вч-СРБ, фракталкин, IL-1β, неоптерин) в качестве предикторов дисфункции шунтов и негативных исходов реваскуляризации миокарда. Кроме того, предикторное значение показали параметры дислипидемии — недостижение целевых значений атерогенных липидов.
Биомаркеры воспалительной реакции играют важную роль в патогенезе дисфункции коронарных шунтов и развитии МАСЕ после операции КШ. В перспективе разработка терапевтических подходов, направленных на блокаду (CX3CL1/CX3CR1, IL-1β, неоптерина), может стать новой стратегией профилактики и лечения МАСЕ у больных ИБС, в т. ч. после КШ.
Учитывая все это, воспалительный процесс, по-видимому, станет следующей "терапевтической мишенью" в будущем. А оценка воспалительного статуса станет обязательной у пациентов перед реваскуляризацией миокарда.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Бокерия Л.А., Авалиани В.М., Буторин С.П. Венозные трансплантаты и их состоятельность в ближайшем и отдаленном периодах после аортокоронарного шунтирования. Бюллетень НЦССХ им. АН Бакулева РАМН. Сердечно-сосудистые заболевания. 2013;14(5):38-48.
2. De Vries MR, Simons KH, Jukema JW, et al. Vein graft failure: from pathophysiology to clinical outcomes. Nature Reviews Cardiology. 2016;13(8):451-70. doi:10.1038/nrcardio.2016.76.
3. Кубова М.Ч., Булаева Н. И., Рузина Е.В., Голухова Е.З. Факторы риска развития тромбоза шунтов у больных ишемической болезнью сердца в отдаленные сроки после операции коронарного шунтирования. Креативная кардиология. 2021; 15(2):180. doi:10.24022/1997-3187-2021-15-2-180-193.
4. Baganha F, de Jong A, Jukema JW, et al. The role of immunomodulation in vein graft remodeling and failure. Journal of Cardiovascular Translational Research. 2021;14:100-9. doi:10.1007/s12265-020-10001-y.
5. Kosmidou I, Redfors B, Chen S, et al. C-reactive protein and prognosis after percutaneous coronary intervention and bypass graft surgery for left main coronary artery disease: analysis from the EXCEL trial. American heart journal. 2019;210:49-57. doi:10.1016/j.ahj.2018.12.013.
6. Шварц В.А., Талибова С.М., Сокольская М.А. и др. Ассоциация новых биомаркеров системного воспаления с развитием атеросклероза и его выраженностью. Российский кардиологический журнал. 2024;29(8):6025. doi:10.15829/1560-4071-2024-6025.
7. Urbanowicz T, Olasińska-Wiśniewska A, Gładki M, Jemielity M.The Significance of Simple Inflammatory Markers in Off Pump Surgery-Review, Rev. Cardiovasc. Med, 2022;23(12):400. doi:10.31083/j.rcm2312400.
8. Katkenov N, Mukhatayev Z, Kozhakhmetov S, et al. Systematic Review on the Role of IL-6 and IL-1beta in Cardiovascular Diseases. Cardiovasc. Dev. Dis. 2024;11(7):206. doi:10.3390/jcdd11070206.
9. Bonaventura A, Moroni F, Golino M, et al. IL-1 blockade in cardiovascular disease: an appraisal of the evidence across different inflammatory paradigms. Cardiol Angiol. 2024;72(5):477-88. doi:10.23736/S2724-5683.23.06390-1.
10. Potere N, Bonaventura A, Abbate A. Novel Therapeutics and Upcoming Clinical Trials Targeting Inflammation in Cardiovascular Diseases. Arterioscler. Thromb. Vasc. Biol. 2024;44(12):2371-95. doi:10.1161/ATVBAHA.124.319980.
11. Attiq A, Afzal S, Ahmad W, Kandeel M. Hegemony of inflammation in atherosclerosis and coronary artery disease. Eur. J.Pharmacol. 2024;5(966):176338. doi:10.1016/j.ejphar.2024.176338.
12. Бокерия Л.А., Пурсанов М.Г., Петросян К.В. и др. Интраоперационная шунтография: оптимальный метод оценки проходимости коронарных шунтов и дальнейшего улучшения результатов хирургической реваскуляризации миокарда. Грудная и сердечно-сосудистая хирургия. 2018;60(3):233-41. doi:10.24022/0236-2791-2018-60-3233-241.
13. Сигаев И. Ю., Керен М. А., Шония З. Д. Возможности ультразвуковой флоуметрии в сочетании с эпикардиальным ультразвуковым сканированием для комплексной оценки функционального состояния кондуитов при операциях коронарного шунтирования. Грудная и сердечно-сосудистая хирургия. 2021;63(2):133-9. doi:10.24022/0236-2791-2021-63-2-133-139.
14. Xenogiannis I, Zenati M, Bhatt DL, et al. Saphenous vein graft failure: from pathophysiology to prevention and treatment strategies. Circulation. 2021;144(9):728-45. doi:10.1161/CIRCULATIONAHA.120.052163.
15. Kršek A, Batičic L, urko-Cofek BC, et al. Insights into the Molecular Mechanism of Endothelial Glycocalyx Dysfunction during Heart Surgery. Curr. Issues Mol. Biol. 2024;46: 3794-809. doi:10.3390/cimb46050236.
16. Guida GA, Angelini GD. Pathophysiology and mechanisms of saphenous vein graft failure. Brazilian journal of cardiovascular surgery. 2022;37(spe1):32-7. doi:10.21470/1678-9741-2022-0133.
17. Wadey K, Lopes J, Bendeck M, George S.Role of smooth muscle cells in coronary artery bypass grafting failure. Cardiovascular research. 2018;114(4):601-10. doi:10.1093/cvr/cvy021.
18. Ирасханов А.Ш., Бузиашвили Ю.И., Кокшенева И.В. и др. Значение медиаторов воспалительной реакции в механизмах атерогенеза и их влияние на результаты реваскуляризации миокарда у больных ишемической болезнью сердца. Креативная кардиология. 2023;17(3):330-40. doi:10.24022/1997-3187-2023-17-3-330-340.
19. Aydın C, Engin M. The value of inflammation indexes in predicting patency of saphenous vein grafts in patients with coronary artery bypass graft surgery. Cureus. 2021;13(7). doi:10.7759%2Fcureus.16646.
20. Bazan JF, Bacon KB, Hardiman G, et al. A new class of membrane-bound chemokine with a CX3C motif. Nature. 1997;385(6617):640-4. doi:10.1038/385640a0.
21. Loh SX, Ekinci Y, Spray L, et al. Fractalkine signalling (CX3CL1/CX3CR1 axis) as an emerging target in coronary artery disease. Journal of Clinical Medicine, 2023;12(14): 4821. doi:10.3390/jcm12144821.
22. Szukiewicz D. CX3CL1 (Fractalkine)-CX3CR1 Axis in Inflammation-Induced Angiogenesis and Tumorigenesis. International journal of molecular sciences. 2024;25(9):4679. doi:10.3390/ijms25094679.
23. Zhuang Q, Ou J, Zhang S, Ming Y. Crosstalk between the CX3CL1/CX3CR1 axis and inflammatory signaling pathways in tissue injury. Current Protein and Peptide Science. 2019;20(8):844-54. doi:10.2174/1389203720666190305165722.
24. Flierl U, Bauersachs J, Schäfer A. Modulation of platelet and monocyte function by the chemokine fractalkine (CX3CL1) in cardiovascular disease. European Journal of Clinical Investigation. 2015;45(6):624-33. doi:10.1111/eci.12443.
25. Stangret A, Sadowski KA, Jabłoński K, et al. Chemokine Fractalkine and Non-Obstructive Coronary Artery Disease — Is There a Link? International Journal of Molecular Sciences. 2024;25(7):3885. doi:10.3390/ijms25073885.
26. Boag SE, Das R, Shmeleva EV, et al. T lymphocytes and fractalkine contribute to myocardial ischemia/reperfusion injury in patients. The Journal of clinical investigation. 2015;125(8):3063-76. doi:10.1172/JCI80055.
27. Li J, Guo Y, Luan X, et al. Independent roles of monocyte chemoattractant protein-1, regulated on activation, normal T-cell expressed and secreted and fractalkine in the vulnerability of coronary atherosclerotic plaques. Circulation Journal. 2012;76(9): 2167-73. doi:10.1253/circj.cj-11-1457.
28. Yao K, Zhang S, Lu H, et al. Changes in fractalkine in patients with ST-elevation myocardial infarction. Coronary Artery Disease. 2015;26(6):516-20. doi:10.1097/MCA.00000000000000273.
29. Mai W, Liao Y. Targeting IL-1β in the Treatment of Atherosclerosis. Frontiers in immunology. 2020;11:589654. doi:10.3389/fimmu.2020.589654.
30. Catană MG, Popențiu IA, Văleanu M, et al. IL-1 Beta — A Biomarker for Ischemic Stroke Prognosis and Atherosclerotic Lesions of the Internal Carotid Artery. Medicina. 2023; 59(10):1790. doi:10.3390/medicina59101790.
31. Olofsson Peder S, Yuri S, Ken J, et al. A functional interleukin-1 receptor antagonist polymorphism influences atherosclerosis development — the interleukin-1β: interleukin-1 receptor antagonist balance in atherosclerosis. Circulation Journal. 2009;73(8): 1531-6. doi:10.1253/circj.cj-08-1150.
32. Kidder E, Pea M, Cheng S, et al. The interleukin-1 receptor type-1 in disturbed flowinduced endothelial mesenchymal activation. Frontiers in Cardiovascular Medicine. 2023;10:1190460. doi:10.3389/fcvm.2023.1190460.
33. Libby P. Interleukin-1 beta as a target for atherosclerosis therapy: biological basis of CANTOS and beyond. Journal of the American College of Cardiology. 2017;70(18): 2278-89. doi:10.1016/j.jacc.2017.09.028.
34. Mohammadnia N, Opstal TSJ, El Messaoudi S, et al. An Update on Inflammation in Atherosclerosis: How to Effectively Treat Residual Risk. Clin. Ther. 2023;45(11):1055-9. doi:10.1016/j.clinthera.2023.08.016.
35. Gusev E, Sarapultsev A. Atherosclerosis and Inflammation: Insights from the Theory of General Pathological Processes. Int. J.Mol. Sci. 2023;24:7910. doi:10.3390/ijms24097910.
36. Kotlyarov S.Immune Function of Endothelial Cells: Evolutionary Aspects, Molecular Biology and Role in Atherogenesis. Int. J.Mol. Sci. 2022;23(17):9770. doi:10.3390/ijms23179770.
37. Wan RH, Yuan Y, Hao W, et al. Relationship between serum neopterin level and peripheral arterial plaque in patients with type 2 diabetes. Diabetes, Metabolic Syndrome and Obesity. 2021;2871-8. doi:10.2147/DMSO.S315986.
38. Ünüvar S, Tanrıverdi Z, Aslanhan H. Potential prognostic role of immune system activation marker neopterin in patients with type 2 diabetes. Journal of Medical Biochemistry. 2018;37(4):465. doi:10.2478%2Fjomb-2018-0004.
39. De Rosa S, Cirillo P, Pacileo M, et al. Neopterin: from forgotten biomarker to leading actor in cardiovascular pathophysiology. Current vascular pharmacology. 2011;9(2):188-99. doi:10.2174/157016111794519372.
40. Fuchs D, Avanzas P, Arroyo-Espliguero R, et al. The role of neopterin in atherogenesis and cardiovascular risk assessment. Current medicinal chemistry. 2009;16(35):4644-53. doi:10.2174/092986709789878247.
41. Bjørnestad EØ, Borsholm RA, Svingen GF, et al. Neopterin as an effect modifier of the cardiovascular risk predicted by Total homocysteine: A prospective 2‐cohort study. Journal of the American heart association. 2017;6(11):e006500. doi:10.1161/JAHA.117.006500.
42. Kember I, Sanajou S, Kilicarslan B, et al. Evaluation of neopterin levels and kynurenine pathway in patients with acute coronary syndrome. Acute and Critical Care. 2023;38(3):325. doi:10.4266%2Facc.2023.00024.
43. Nazer B, Ray KK, Sloan S, et al. Prognostic utility of neopterin and risk of heart failure hospitalization after an acute coronary syndrome. European heart journal. 2011;32(11):1390-7. doi:10.1093/eurheartj/ehr032.
44. Zouridakis E, Avanzas P, Arroyo-Espliguero R, et al. Markers of inflammation and rapid coronary artery disease progression in patients with stable angina pectoris. Circulation. 2004;110(13):1747-53. doi:10.1161/01.CIR.0000142664.18739.92.
45. Vengen IT, Dale AC, Wiseth R, et al. Neopterin predicts the risk for fatal ischemic heart disease in type 2 diabetes mellitus: long-term follow-up of the HUNT 1 study. Atherosclerosis. 2009;207(1):239-44. doi:10.1016/j.atherosclerosis.2009.04.003.
Об авторах
Ю. И. БузиашвилиРоссия
Д.м.н., профессор, академик РАН, руководитель клинико-диагностического отделения
Москва
И. В. Кокшенева
Россия
Кокшенева Инна Валериевна — д.м.н., с.н.с. клинико-диагностического отделения
Москва
Д. Х. Камардинов
Россия
Д.м.н., врач- кардиолог клинико-диагностического отделения
Москва
Э. Ф. Тугеева
Россия
Д.м.н., старший научный сотрудник клинико-диагностического отделения
Москва
И. П. Шуваев
Россия
Д.м.н., врач- кардиолог клинико-диагностического отделения
Москва
А. Ш. Ирасханов
Россия
Аспирант клинико-диагностического отделения
Москва
Е. П. Голубев
Россия
Канд. мед. наук, старший научный сотрудник клинико-диагностического отделения
Москва
Р. М. Ибрагимов
Россия
Канд. мед. наук, младший научный сотрудник клинико-диагностического отделения
Москва
В. Ю. Бузиашвили
Россия
Канд. мед. наук, младший научный сотрудник клинико-диагностического отделения
Москва
О. М. Шерстянникова
Россия
К.м.н., научный сотрудник клинико-диагностического отделения
Москва
Дополнительные файлы
- Воспаление играет ведущую роль в запуске и поддержании основных механизмов, определяющих повреждение сосудистой стенки коронарных кондуитов после коронарного шунтирования (КШ), что является основой развития дисфункции шунтов.
- Анализ динамики гуморальных маркеров воспалительной реакции после операции показал, что в группе больных с дисфункцией шунтов (ДШ+) наблюдались значимо более высокие уровни С-реактивного белка, фракталкина, IL-1β, неоптерина во всех временных точках тестирования (до операции, через 24 ч и на 7 сут. после КШ).
- В перспективе разработка терапевтических подходов, направленных на блокаду CX3CL1/CX3CR1, IL-1β, неоптерина, может стать новой стратегией профилактики и лечения неблагоприятных сердечно-сосудистых событий у больных ишемической болезнью сердца, в т. ч. после КШ.
Рецензия
Для цитирования:
Бузиашвили Ю.И., Кокшенева И.В., Камардинов Д.Х., Тугеева Э.Ф., Шуваев И.П., Ирасханов А.Ш., Голубев Е.П., Ибрагимов Р.М., Бузиашвили В.Ю., Шерстянникова О.М. Влияние активации системной воспалительной реакции на риск развития дисфункции коронарных кондуитов и частоту сердечно-сосудистых осложнений после коронарного шунтирования. Российский кардиологический журнал. 2025;30(4):6112. https://doi.org/10.15829/15604071-2025-6112. EDN: VPJVMG
For citation:
Buziashvili Yu.I., Koksheneva I.V., Kamardinov D.Kh., Tugeeva E.F., Shuvaev I.P., Iraskhanov A.Sh., Golubev E.P., Ibragimov R.M., Buziashvili V.Yu., Sherstyannikova O.M. Impact of systemic inflammatory response activation on the risk of coronary conduit dysfunction and the incidence of cardiovascular events after coronary artery bypass grafting. Russian Journal of Cardiology. 2025;30(4):6112. (In Russ.) https://doi.org/10.15829/15604071-2025-6112. EDN: VPJVMG

















































