Перейти к:
Подострый и хронический постковидный миокардит: диагностика, клинические варианты, подходы к лечению
https://doi.org/10.15829/1560-4071-2024-6089
EDN: EYNACD
Аннотация
Цель. Изучить механизмы и клинические формы подострого и хронического миокардита после инфекции SARS-CoV-2 с применением морфологического и вирусологического исследований, разработать подходы к его лечению.
Материал и методы. В исследование включено 89 больных, перенесших подтвержденную новую коронавирусную инфекцию (COVID-19, COronaVIrus Disease 2019). Диагноз постковидного миокардита установлен на основании данных биопсии миокарда и/или магнитно-резонансной томографии (МРТ) сердца в сочетании с анамнезом, повышением титров антикардиальных антител (АкАт) и другими критериями. Средний срок обращения после инфекции составил 8,0 [4; 17,5] мес., средний срок наблюдения 7,0 [6,0; 13,5] мес. Выполнялись электрокардиография, Холтеровское мониторирование электрокардиограммы, эхокардиография, МРТ сердца (n=60), определение уровня АкАт, биопсия миокарда (n=38), исследование аутопсийного материала (n=1).
Результаты. У всех пациентов отмечена связь появления или обострения кардиальных симптомов с COVID-19. Выделены клинические варианты постковидного миокардита: аритмический (n=24) с впервые возникшими нарушениями ритма и/или проводимости сердца (НРС) при нормальной сократимости миокарда; декомпенсированный (n=65) с впервые выявленной сердечной недостаточностью, в их числе выделен вариант, развившийся на фоне первичных (генетических) кардиомиопатий и амилоидоза (n=10). Спектр НРС при аритмическом варианте варьировал от потенциально жизнеугрожающих нарушений ритма и проводимости: устойчивой желудочковой тахикардия, атриовентрикулярной блокады II-III степени до нечастой наджелудочковой экстрасистолии. При декомпенсированном варианте морфологически наиболее часто выявлялся лимфоцитарный миокардит, в более редких случаях — эозинофильный и гигантоклеточный, ассоциированные с более плохим прогнозом. Отмечено одновременное развитие небактериального тромбоэндокардита, инфекционного эндокардита с формированием клапанных пороков сердца. В 10 случаях миокардит сочетался с первичными кардиомиопатиями, AL-амилоидозом. Подходы к лечению включали в себя назначение антиаритмической, кардиотропной, иммуносупрессивной терапии (глюкокортикостероиды в дозе 16-32 мг/сут. у 68,5% больных, гидроксихлорохин 200-400 мг/сут. у 33,7%). При аритмической форме полное подавление аритмии достигнуто в 25% случаев, частичное в 58,3%, в одном случае имплантирован кардиостимулятор. У больных с декомпенсированным вариантом миокардита кортикостероиды оказались эффективны независимо от наличия генома/белков вируса в миокарде.
Заключение. COVID-19 может индуцировать подострый и хронический миокардит с развитием изолированных НРС или тяжелой сердечной недостаточности.
Ключевые слова
Для цитирования:
Савина П.О., Благова О.В., Айнетдинова Д.Х., Седов А.В., Павленко Е.В., Лутохина Ю.А., Коган Е.А. Подострый и хронический постковидный миокардит: диагностика, клинические варианты, подходы к лечению. Российский кардиологический журнал. 2024;29(11):6089. https://doi.org/10.15829/1560-4071-2024-6089. EDN: EYNACD
For citation:
Savina P.O., Blagova O.V., Ainetdinova D.Kh., Sedov A.V., Pavlenko E.V., Lutokhina Yu.A., Kogan E.A. Subacute and chronic post-COVID myocarditis: diagnostics, clinical variants, treatment approaches. Russian Journal of Cardiology. 2024;29(11):6089. (In Russ.) https://doi.org/10.15829/1560-4071-2024-6089. EDN: EYNACD
В декабре 2019г в китайском городе Ухань впервые была выявлена новая коронавирусная инфекция (COVID-19, COronaVIrus Disease 2019) — острая респираторная инфекция, вызываемая коронавирусом SARS-CoV-2 (Severe acute respiratory syndrome-related coronavirus 2). Заболевание отличает многообразие проявлений от бессимптомных и стертых форм до развернутой клинической картины вплоть до полиорганной недостаточности и смерти. Вместе с тем в мае 2023г глава Всемирной организации здравоохранения Т. А. Гебреисус объявил, что COVID-19 больше не является чрезвычайной ситуацией в области здравоохранения, подчеркнув, что несмотря на "тенденцию к снижению заболеваемости", бремя COVID-19 сохраняет за собой статус пандемии. Чем длительнее и масштабнее вирус циркулирует в популяции, тем более актуальным представляется вопрос не только острого вирус-опосредованного поражения органов и систем, но и отдаленных последствий COVID-19.
Предполагается, что в механизме острого повреждения миокарда, вызванного SARS-CoV-2, одну из ключевых ролей играет ангиотензинпревращающий фермент, который экспрессируется не только в легких, но и в сердечно-сосудистой системе, в частности, в сердце. Другие предполагаемые механизмы повреждения миокарда включают: цитокиновый шторм; тяжелую гипоксемию, обусловленную респираторной дисфункцией; микроваскулярное повреждение сердца, приводящее к развитию коронарного тромбоза, ангиоспазму; эндотелит сосудов сердца. Сообщения об острых SARS-CoV-2-ассоциированных миокардитах появились уже в первые месяцы пандемии [1]. Однако в описанных в литературе случаях диагностика миокардита основывалась главным образом на клинической симптоматике, связи с текущей инфекцией, повышении уровней маркеров повреждения миокарда и сердечной недостаточности (СН), данных электрокардиографии (ЭКГ), эхокардиографии (ЭхоКГ) и, лишь в редких случаях, данных магнитно-резонансной томографии (МРТ) сердца. "Золотым стандартом" диагностики миокардита по-прежнему остается биопсия миокарда с последующим морфологическим и иммуногистохимическим исследованием (ИГХ) [2][3]. За более чем четырехлетний опыт пандемии сведения о прижизненных и посмертных морфологических исследованиях миокарда, персистенции вируса в миокарде в рамках затяжного SARS-CoV-2-ассоциированного миокардита до сих пор представлены единичными наблюдениями.
Первые данные морфологического исследования миокарда в эпоху пандемии COVID-19 базировались преимущественно на основании исследований аутопсийного материала, а также на моделях активно индуцированного экспериментального аутоиммунного миокардита у крыс. На таких моделях впервые показано, что даже низкая вирусная нагрузка SARS-CoV-2 может повреждать кардиомиоциты, что приводит к высвобождению сердечного миозина и активации резидентных антигенпрезентирующих клеток (тучные клетки, макрофаги), и в итоге к запуску воспаления [4].
Первые данные прижизненной эндомиокардиальной биопсии (ЭМБ) при остром SARS-CoV-2-ассоциированном миокардите были опубликованы в апреле 2020г в Милане и продемонстрировали развитие острого SARS-CoV-2-ассоциированного миокардита, протекающего под маской синдрома такоцубо [5]. Способность COVID-19-ассоциированного миокардита мимикрировать под различные сердечно-сосудистые заболевания описана и в клиническом случае инфарктоподобного миокардита (подтвержденного при МРТ), развивавшегося с картиной боли в груди, подъемом сегмента ST на ЭКГ и многократным повышением тропонина при интактных коронарных артериях [6].
Важным является разнообразие вариантов течения миокардита: от острого, с давностью симптомов до месяца и различной степенью их выраженности (от малозаметных до катастрофических) и подострого миокардита (давность симптомов от месяца до полугода) до хронического, который также может иметь яркое начало.
Одно из самых масштабных исследований, посвященное оценке риска развития миокардита в исходе перенесенной COVID-19 и отдаленных рисков его развития, опубликовано в Италии в конце 2022г. Данные были получены путем поиска в Medline и Scopus по всем исследованиям, опубликованным в любое время до 1 сентября 2022г и сообщающим о долгосрочном риске возникновения миокардита у выживших после COVID-19. В анализ были включены 20875843 пациента. Из них 1245167 человек перенесли COVID-19 (и выжили). За средний период наблюдения в 9,5 мес. миокардит развился у 0,21 из 1000 пациентов, выживших после заражения COVID-19, по сравнению с 0,09 из 1000 контрольных субъектов [7].
Отдаленные последствия поражения сердца были отражены и в ретроспективном когортном исследовании в Великобритании. Из 718365 пациентов с COVID-19 у 35820 (5,0%) развился миокардит, а у 10706 (1,5%) — перикардит [8].
Рекомендации по лечению миокардитов 2013г исключают назначение иммуносупрессивной терапии (ИСТ) вируспозитивным больным, в отношении острых (в т. ч. фульминантных) миокардитов. Мнения о целесообразности стероидной терапии расходятся, однако при коронавирусном миокардите терапия стероидами обычно не вызывает опасений, ее эффективность обусловлена высокой воспалительной активностью и способностью коронавируса индуцировать спектр аутоиммунных реакций, в т. ч. затяжных [9].
В одном из недавних исследований авторы с осторожностью заявляют, что, хотя кортикостероиды часто используются при определенных формах миокардита (например, эозинофильном, гигантоклеточном, вторичном по отношению к системным заболеваниям миокардите), в отношении SARS-CoV-2-ассоциированного миокардита эта практика основана на эмпирических данных и необходимы рандомизированные клинические исследования для разработки оптимального лечения [10].
Целью исследования является изучение механизмов и клинических форм подострого и хронического миокардита после инфекции SARS-CoV-2 с применением морфологического и вирусологического исследований и разработка подходов к его лечению.
Материал и методы
В одноцентровое когортное проспективное исследование включено 89 больных, средний возраст 47,6±13,5 лет, от 18 до 80 лет, 38 (42,7%) женщин и 51 (57,3%) мужчина. Исследование проводилось на базе кардиологического отделения Факультетской терапевтической клиники им. В. Н. Виноградова Первого МГМУ им. И. М. Сеченова.
Критериями включения были лабораторно и/или инструментально подтвержденная перенесенная не менее 2 мес. назад COVID-19, связь кардиальных симптомов (нарушения ритма и проводимости, СН) с перенесенной инфекцией, наличие по крайней мере двух Lake-Louise критериев миокардита (2018г) по данным МРТ с контрастированием гадолинием и/или наличие далласских критериев миокардита, дополненных иммуногистохимическими критериями, по данным ЭМБ.
Критериями исключения были миокардит, верифицированный до COVID-19 с помощью МРТ сердца и/или ЭМБ, предшествующая ИСТ, ишемическая болезнь сердца с гемодинамически значимыми стенозами коронарных артерий (>70%), инфаркт миокарда в анамнезе, системные заболевания соединительной ткани, операции на сердце давностью <2 мес.
Всем пациентам выполнялось стандартное инструментальное обследование: регистрация ЭКГ при поступлении и в динамике, трансторакальная ЭхоКГ, суточное мониторирование ЭКГ. МРТ сердца с внутривенным контрастированием гадолинием (НЦССХ им. А. Н. Бакулева; УКБ № 1 Первого МГМУ им. И. М. Сеченова) выполнена 59 пациентам. Для исключения коронарного атеросклероза, структурной патологии сердца по показаниям выполнялись мультиспиральная компьютерная томография (МСКТ) сердца с внутривенным контрастированием (n=7). Коронароангиография (КАГ) выполнялась 35 больным с факторами риска ишемической болезни сердца и при наличии характерных жалоб. Одному пациенту 35 лет показания к КАГ определены в связи с впервые зарегистрированной при ЭКГ полной блокадой левой ножки пучка Гиса (ПБЛНПГ).
В 42,7% случаев (n=38) проводилось морфологическое исследование миокарда. Анализ материала выполнялся на кафедре патологической анатомии им. акад. А. И. Струкова Первого МГМУ имени И. М. Сеченова, включал в себя стандартное гистологическое исследование в световом микроскопе с окраской гематоксилином-эозином и пикрофуксином по Ван Гизону, дополнительную окраску конго-рот на амилоид с исследованием препаратов в поляризующем свете. Проводилось также ИГХ с антителами к CD3, CD20, CD45, CD68, а также к белкам коронавируса (спайк- и нуклеокапсидный белок). Дополнительно проводилось исследование миокарда методом полимеразной цепной реакции (ПЦР) на ДНК парвовируса В19, вирусов герпеса 1, 2, 6, 8 типов, герпеса зостер, вируса Эпштейна-Барр, цитомегаловируса, аденовирусов (ООО "ДНК технология"), а также РНК SARS-Cov-2 в 14 случаях (ФГБНУ "ЦНИИ туберкулеза"). В большинстве случаев материал был получен путем выполнения ЭМБ правого желудочка. В четырех случаях исследовался материал, полученный интраоперационно (включая гистологическое исследование стенки брюшной аорты у пациента с аортитом). В двух случаях проводилось исследование аутопсийного материала (у одной из умерших больных при жизни была выполнена ЭМБ).
Дополнительно всем пациентам проводилось исследование крови на уровень антикардиальных антител (АкАт): антитела к антигенам ядер кардиомиоцитов (специфический антинуклеарный фактор (АНФ)), эндотелия, гладкой мускулатуры, волокон проводящей системы сердца. У 9 пациентов проведены ПЦР крови на ДНК вирусов герпетической группы, парвовируса В19 (ЦМД НИИ эпидемиологии; лаборатория "ДНК-технология").
Статистический анализ проведен с помощью программы IBM SPSS Statistics 23. Количественные признаки при их нормальном распределении представлены как М±δ (среднее ± одно стандартное отклонение), в виде медианы с указанием 1-го и 3-го квартилей в случае ненормального распределения. Нормальность распределения проверялась с помощью теста Колмогорова-Смирнова, достоверность различий — с помощью критериев Стьюдента, Манна-Уитни, Уилкоксона. Для сравнения частот (номинальных данных) в сравниваемых группах использовалось построение таблиц сопряжённости c определением точного критерия Фишера. Различия считались статистически значимыми при р<0,05.
Все пациенты подписывали информированное добровольное согласие на исследование, одобренное Локальным этическим комитетом Сеченовского университета (протокол № 22-21 от 09.12.2021).
Результаты
Характеристика пациентов и основные лабораторно-инструментальные параметры представлены в таблице 1.
Таблица 1
Характеристика пациентов с постковидным миокардитом
|
Параметр |
Значение |
|
Количество пациентов |
89 |
|
Пол (мужской/женский) |
51/38 |
|
Возраст, лет |
47,6±13,5 |
|
Перенесенная COVID-19, легкая форма |
67 (75,3%) |
|
Перенесенная COVID-19, среднетяжелая форма (с пневмонией) |
22 (24,7%) |
|
Срок возникновения симптомов после COVID-19, мес. |
8,0 [ 4; 17,5] |
|
Вакцинация до COVID-19 |
8 (8,9%) |
|
Вакцинация после COVID-19 |
18 (20,2%) |
|
Лейкоциты, *10⁹ |
6,9 [ 5,4; 7,9] |
|
Гемоглобин, г/л |
143,8±17,4 |
|
С-реактивный белок, мг/л |
5,2 [ 1,0; 5,8] |
|
СОЭ, мм/ч |
11,0 [ 5,0; 14,0] |
|
Выявление специфического АНФ |
73 (65%) |
|
Повышение АкАт в ≥3 раза |
89 (100%) |
|
Толщина ЗСЛЖ, мм |
9,0 [ 8,0; 10,0] |
|
Толщина МЖП, мм |
10,0 [ 8,0; 11,0] |
|
КДР ЛЖ, см |
5,8±1,0 |
|
КДО ЛЖ, мл |
143,0 [ 87,5; 193,5] |
|
КСО ЛЖ, мл |
85,6 [ 36,6; 137,3] |
|
ФВ ЛЖ, % |
35,5 [ 27,0; 55,0] |
|
Размер ЛП, см |
4,3 [ 3,7; 4,7] |
|
Объем ЛП, мл |
76,5 [ 51,0; 103,8] |
|
Объем ПП, мл |
59,0 [ 40,5; 82,0] |
|
Размер ПЖ, см |
3,2±0,6 |
|
СДЛА, мм рт.ст. |
31,0 [ 24,8; 44,3] |
|
МР, степень |
1 [ 1; 1,5] |
Сокращения: АНФ — антинуклеарный фактор, АкАт — антикардиальные антитела, ЗСЛЖ — задняя стенка левого желудочка, КДО — конечно-диастолический объем, КДР — конечно-диастолический размер, КСО — конечно-систолический объем, ЛЖ — левый желудочек, ЛП — левое предсердие, МЖП — межжелудочковая перегородка, МР — митральная регургитация, ПЖ — правый желудочек, ПП — правое предсердие, СДЛА — систолическое давление в легочной артерии, СОЭ — скорость оседания эритроцитов, ССЗ — сердечно-сосудистые заболевания, ФВ — фракция выброса, COVID-19 (COronaVIrus Disease 2019) — новая коронавирусная инфекция.
Диагноз постковидного миокардита устанавливался на основании анамнестических, клинико-эпидемиологических, лабораторных и инструментальных данных.
У всех пациентов перенесенная COVID-19 была подтверждена лабораторными методами исследования (во время течения инфекции или ретроспективно): у 29,2% пациентов (n=26) определением РНК SARS-CoV-2 в материале назофарингеального мазка методом ПЦР во время болезни, у 8 пациентов — повышением специфических иммуноглобулинов класса М (IgM) к SARS-CoV-2 во время болезни, последующим появлением и сохранением специфических IgG (сероконверсией) у 78 (87,6%) больных. Признаки двусторонней полисегментарной пневмонии при МСКТ органов грудной клетки выявлены у 24,7% пациентов (n=22).
У всех пациентов отмечена связь появления или обострения кардиальных симптомов с COVID-19. Выделены следующие клинические варианты постковидного миокардита: аритмический (n=24) с впервые возникшими нарушениями ритма и/или проводимости сердца при нормальной сократимости миокарда; декомпенсированный (n=65) с впервые выявленной СН, в их числе выделен вариант, развившийся на фоне первичных (генетических) кардиомиопатий и амилоидоза (n=10). Первичные кардиомиопатии были представлены некомпактным миокардом левого желудочка (ЛЖ) в двух случаях, рестриктивной кардиомиопатией, дилатационной кардиомиопатией у двух больных, гемохроматозом с поражением сердца, болезнью Данона. При молекулярно-генетическом исследовании выявлены мутации генов LAMP2, MyBPC3, LMNA, сочетание мутации генов MYH7 и MyBPC3. AL-амилоидоз диагностирован у троих больных (рис. 1).
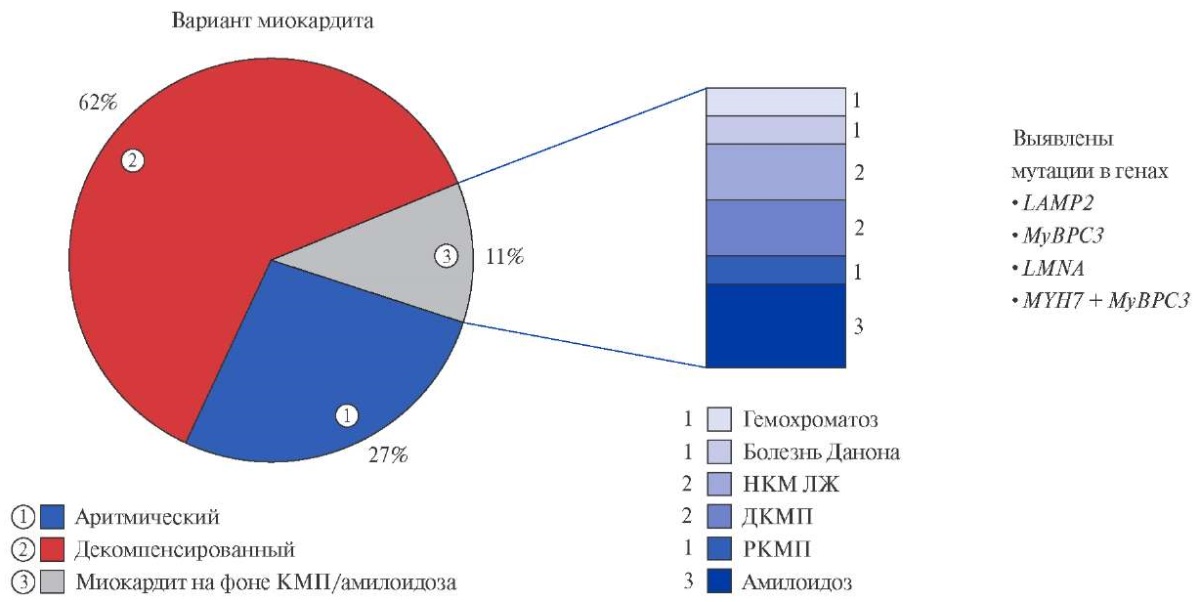
Рис. 1. Варианты постковидного миокардита.
Сокращения: ДКМП — дилатационная кардиомиопатия, КМП — кардиомиопатия, НКМ ЛЖ — некомпактный миокард левого желудочка, РКМП — рестриктивная кардиомиопатия.
Аритмический вариант постковидного миокардита
До перенесенной COVID-19 анамнестически нарушений ритма и проводимости не было ни у кого. Срок возникновения аритмий после COVID-19 составил 7,5 [ 3,3; 19,6] (от 2 до 34 мес.).
При ЭКГ обращали на себя внимание признаки недостаточного нарастания амплитуды зубца R в грудных отведениях V1-V3, феномен ранней реполяризации желудочков.
При ЭхоКГ не выявлено структурной патологии (табл. 2).
Таблица 2
Сравнительная клиническая характеристика больных с аритмическим и декомпенсированным вариантами постковидного миокардита
|
Параметр |
Аритмический вариант |
Декомпенсированный вариант, включая пациентов с КМП |
Р |
|
Количество пациентов |
24 |
65 |
|
|
Возраст, лет |
43,5±15,9 |
49,1±15,2 |
нд |
|
Пол (мужской/женский) |
16/8 |
22/43 |
нд |
|
Перенесенная COVID-19, среднетяжелая форма (с пневмонией) |
7 |
15 |
нд |
|
Выявление специфического АНФ |
15 |
50 |
нд |
|
Титры специфического АНФ |
1:80 [ 0; 1:320] |
1:40 [ 0; 1:320] |
нд |
|
Титры АтЭ |
1:160 [ 1:40; 1:320] |
1:80 [ 0; 1:320] |
0,025 |
|
Титры АтКМЦ |
1:80 [ 1:40; 1:160] |
1:80 [ 1:40; 1:320] |
нд |
|
Титры АтГМ |
1:80 [ 1:40; 1:160] |
1:80 [ 1:40; 1:320] |
нд |
|
Титры АтВПС |
1:160 [ 1:80; 1:120] |
1:160 [ 1:40; 1:320] |
нд |
|
КДО ЛЖ, мл |
87,5±21,6 |
170,7±67,1 |
<0,001 |
|
КДР ЛЖ, см |
4,7±0,4 |
6,07±0,9 |
<0,001 |
|
ФВ ЛЖ, % |
58,3±6,2 |
32,6±10,1 |
<0,001 |
|
Размер ЛП, см |
3,5±0,6 |
4,7±1,0 |
0,012 |
|
Объем ЛП, мл |
45,7±13,4 |
96,3±35,9 |
<0,001 |
|
Размер ПЖ, см |
2,6±0,5 |
3,4±0,5 |
<0,001 |
|
Объем ПП, мл |
40,4±11,9 |
73,7±35,3 |
0,048 |
|
СДЛА, мм рт.ст. |
24,5±5,1 |
38,4±11,6 |
0,027 |
|
Толщина МЖП, см |
8 [ 7; 12] |
10 [ 6; 18] |
0,01 |
Сокращения: АНФ — антинуклеарный фактор, АтВПС — антитела к антигена волокон проводящей системы сердца, АтГМ — антитела к антигенам гладкой мускулатуры, АтКМЦ — антитела к антигенам кардиомиоцитов, АтЭ — антитела к антигенам эндотелия, ЗСЛЖ — задняя стенка левого желудочка, КДО — конечно-диастолический объем, КДР — конечно-диастолический размер, КМП — кардиомиопатия, КСО — конечно-систолический объем, ЛЖ — левый желудочек, ЛП — левое предсердие, МЖП — межжелудочковая перегородка, МР — митральная регургитация, ПЖ — правый желудочек, ПП — правое предсердие, СДЛА — систолическое давление в легочной артерии, СОЭ — скорость оседания эритроцитов, ФВ — фракция выброса, COVID-19 (COronaVIrus Disease 2019) — новая коронавирусная инфекция.
При МРТ сердца у всех обследованных больных выявлены признаки диффузного или локального интрамиокардиального/субэпикардиального отсроченного накопления гадолиния в миокарде, увеличения времени релаксации миокарда в режиме Т2, признаки гиперемии, у одного пациента — дилатация обоих предсердий, в одном случае — небольшое увеличение индексированного объема ЛЖ без признаков снижения сократимости, еще в одном случае — признаки отека миокарда (рис. 2). У двух пациентов выявлены признаки повышенной трабекулярности миокарда ЛЖ, не достигающей критериев некомпактного миокарда.
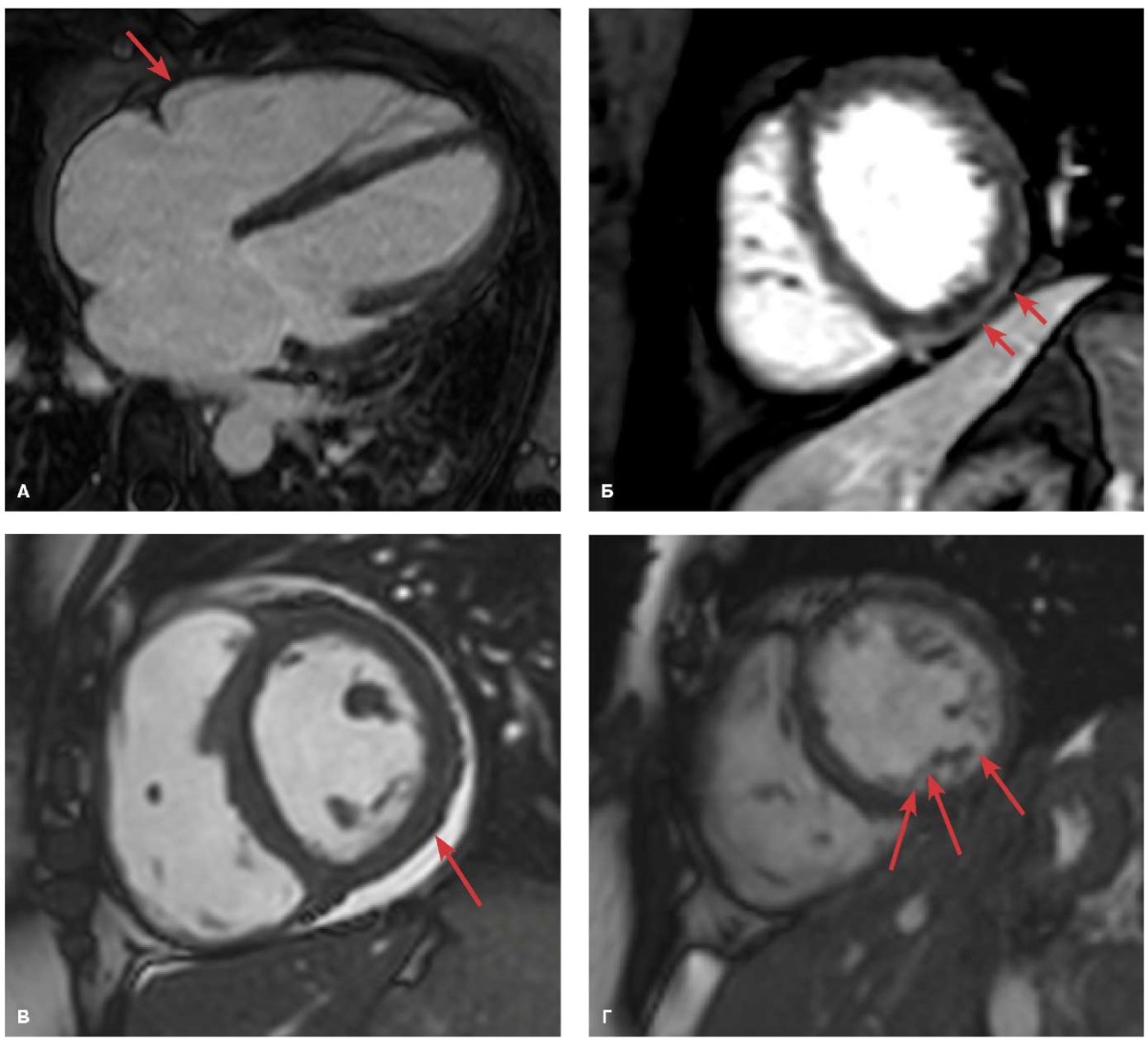
Рис. 2. Данные МРТ сердца у больных с постковидным миокардитом.
Примечание: А. Отек миокарда. Последовательность кино-МРТ. Четырехкамерная длинная ось левого желудочка; Б. Субэпикардиальное отсроченное накопление гадолиния. Последовательность Inversion Recovery. Короткая ось левого желудочка; В. Выпот в полости перикарда. Последовательность Inversion Recovery. Короткая ось левого желудочка; Г. Признаки повышенной трабекулярности миокарда левого желудочка. Субэпикардиальное накопление гадолиния по задне-боковому сегменту левого желудочка. Последовательность Inversion Recovery. Короткая ось левого желудочка.
У всех больных отмечено повышение АкАт в 3 и более раза, у 65,2% (n=15) выявлен специфический АНФ в различных титрах, отсутствующий в норме и отражающий высокую иммунологическую активность миокардита (рис. 3).
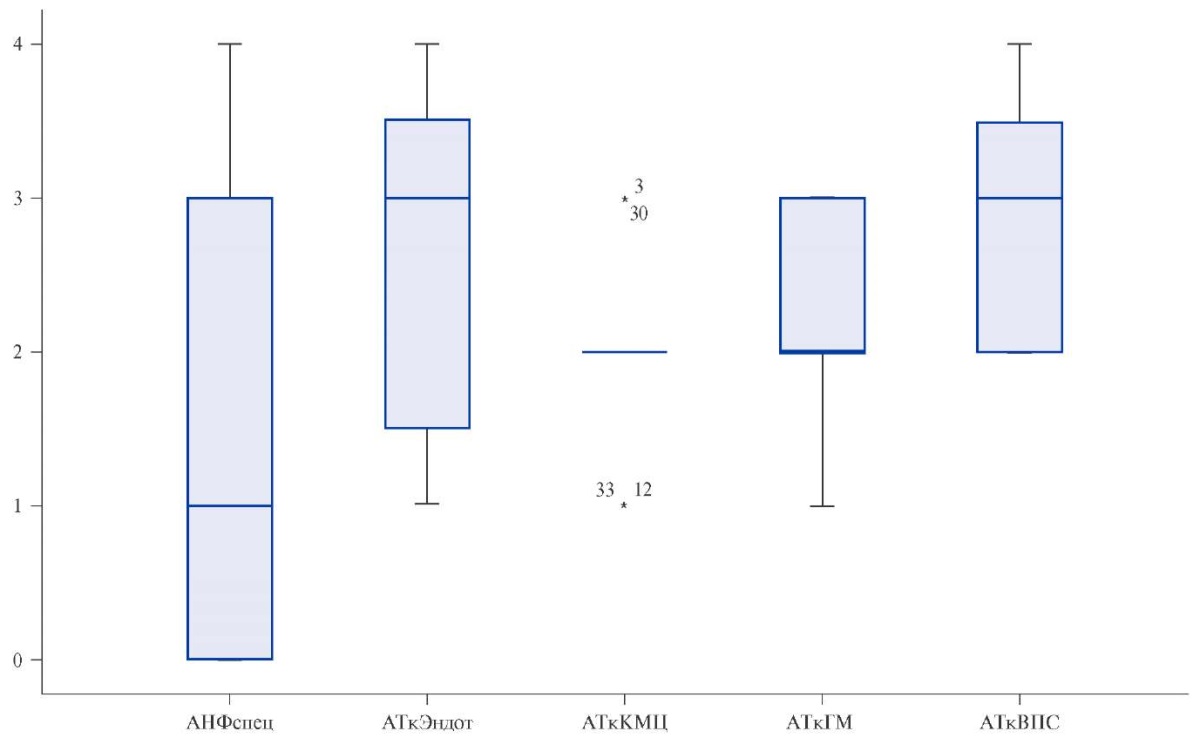
Рис. 3. Титры АкАт у больных с аритмическим вариантом постковидного миокардита.
Примечание: 1:40 (норма для всех видов антител, кроме отсутствующего в норме АНФ), 2 — 1:80, 3 — 1:160, 4 — 1:320.
Сокращения: АНФспец — специфический антинуклеарный фактор, АтВПС — антитела к антигенам волокон проводящей системы сердца, АТкГМ — антитела к антигенам гладкой мускулатуры, АТкКМЦ — антитела к антигенам кардиомиоцитов, АТкЭндот — антитела к антигенам эндотелия.
Структура аритмий (рис. 4) была представлена как изолированными нарушениями ритма сердца (НРС), так и их сочетанием.
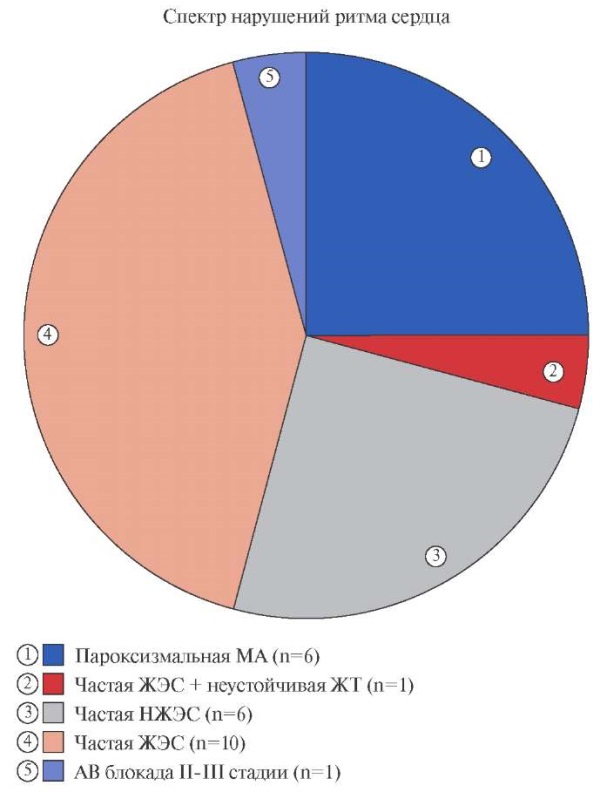
Рис. 4. Структура нарушений ритма и проводимости у больных с аритмическим вариантом постковидного миокардита (общее число случаев n=24).
Сокращения: АВ — атриовентрикулярная, ЖТ — желудочковая тахикардия, ЖЭС — желудочковая экстрасистолия, МА — мерцательная аритмия, НЖЭС — наджелудочковая экстрасистолия.
Подходы к терапии включали в себя назначение антиаритмической терапии (ААТ) и ИСТ (табл. 3). Большинство пациентов (75%, n=18) получали ААТ препаратами IC класса — пропафеноном, этацизином, лаппаконитина гидробромидом (в т. ч. в сочетании с соталолом у 3 больных). 3 пациента получали амиодарон в связи с неэффективностью ААТ препаратами других классов. У 2 пациентов с частой наджелудочковой экстрасистолией (НЖЭС) проводилась терапия бета-блокаторами.
Таблица 3
Подходы к лечению постковидного миокардита
|
Клинический вариант |
Аритмический |
Декомпенсированный, включая пациентов с первичными КМП и амилоидозом |
p |
|
Метилпреднизолон |
15 |
46 |
<0,001 |
|
Доза метилпреднизолона, мг/сут. |
16 [ 8; 16] |
24 [ 16; 24] |
<0,001 |
|
Гидроксихлорохин, 200 мг/сут. |
20 |
10 |
нд |
|
НОАК, варфарин |
5 |
34 |
нд |
|
иАПФ/АРА |
7/2 |
9/6 |
нд |
|
Бета-блокаторы |
18 |
56 |
нд |
|
Сакубитрил/валсартан |
0 |
46 |
<0,001 |
|
Антагонисты минералокортикоидных рецепторов |
3 |
54 |
<0,001 |
|
Ингибиторы натрий-глюкозного котранспортера 2 типа |
0 |
39 |
<0,001 |
|
Петлевые диуретики |
1 |
53 |
<0,001 |
|
Амиодарон |
5 |
30 |
0,03 |
|
Соталол |
4 |
2 |
0,046 |
|
Антиаритмические препараты 1С класса |
16 |
1 |
<0,001 |
Сокращения: АРА — антагонисты рецепторов ангиотензина, иАПФ — ингибиторы ангиотензинпревращающего фермента, КМП — кардиомиопатия, НОАК — новые оральные антикоагулянты.
При контрольном суточном мониторировании ЭКГ доказан регресс НРС. У 12 пациентов (50%) с частой НЖЭС и желудочковой экстрасистолии (ЖЭС) отмечено снижение частоты эктопии на ≥75%. У 2 пациентов (8,3%) — снижение частоты эктопии на 50%. У 3 пациенток (12,5%) с исходно зарегистрированными 36 тыс., 22 тыс. и 16 тыс. желудочковых экстрасистол в сутки достигнуто полное подавление эктопии. У 3 пациентов (12,5%) с пароксизмальной формой мерцательной аритмии (МА) удалось добиться стойкого удержания синусового ритма на фоне приема антиаритмических препаратов 1С класса и амиодарона. В одном случае имплантирован электрокардиостимулятор.
Кроме того, больным с высокой иммунологической активностью миокардита проводилась ИСТ метилпреднизолоном 8-16 мг/сут., с умеренной — мягкая ИСТ гидроксихлорохином 200 мг/сут., в ряде случаев — их сочетанием. Критериями отмены ИСТ являлись подавление как иммунологической активности миокардита, так и регресс НРС при контрольных суточных мониторированиях ЭКГ. Сроки проведения терапии варьировали от 4 до 24 мес. Предпосылками к пролонгированию ИСТ являлось в первую очередь сохранение высокой иммунологической активности миокардита по данным исследования уровня АкАт.
При контроле титров АкАТ (n=10; средний срок наблюдения 6 [ 4; 10] мес.) отмечено их снижение. Снижение титра специфического АНФ было близким к статистически достоверному (p=0,057).
По прошествии 4-6 мес. попытка отмены ААТ была предпринята у 6 пациентов с экстрасистолией, при этом у пятерых она оказалась оправданной, возобновлений перебоев в работе сердца не отмечено. У одной пациентки с частой ЖЭС (до 16 тыс. в сут.) с полным подавлением эктопии на фоне приема этацизина в сочетании с бета-блокаторами, отмечено возобновление аритмии (>4 тыс. ЖЭС в сут.) после отмены ААТ. Остальные пациенты продолжили прием ААТ.
Интервенционное лечение аритмий выполнялось 4 пациентам. 1 пациентке до включения в исследование проводилась безуспешная попытка радиочастотной аблации основания ушка правого предсердия, в дальнейшем была продолжена терапия пропафеноном. У одной пациентки 2 попытки радиочастотной изоляции устьев легочных вен по поводу МА оказались неэффективными, в исходе развился парез правого купола диафрагмы. Принято решение о продолжении приема амиодарона для удержания синусового ритма. Еще двоим пациентам на фоне подавления активности миокардита успешно выполнена радиочастотная катетерная аблация по поводу МА и частой мономорфной ЖЭС.
Декомпенсированный вариант постковидного миокардита
Пациенты с декомпенсированным вариантом миокардита поступили в клинику в связи с застойной хронической СН II-IV функционального класса, которая у 43% больных носила характер бивентрикулярной. Тяжелое течение COVID-19 ретроспективно отмечено лишь у нескольких больных — дыхательная недостаточность, потребовавшая кислородотерапии, развилась у 6 больных. Троим пациентам понадобились наблюдение и лечение в условиях отделения реанимации и интенсивной терапии.
До включения в исследование 17 человек страдали артериальной гипертензией, у 11 человек был сахарный диабет 2 типа. Один пациент перенес острое нарушение мозгового кровообращения (кардиоэмболический подтип). У двух пациентов выявлен двустворчатый аортальный клапан. Три пациента страдали бронхиальной астмой. У двоих имелся хронический вирусный гепатит С, по поводу чего в дальнейшем была начата противовирусная терапия по месту жительства.
На ЭКГ наиболее часто выявлялись снижение вольтажа комплексов QRS, признаки гипертрофии ЛЖ, отрицательные зубцы Т. НРС были представлены МА в 34,3% случаев. ПБЛНПГ зарегистрирована у 5 больных, в т. ч. у 1 пациента с вероятным SARS-CoV-2-ассоциированным коронариитом.
При ЭхоКГ выявлены систолическая дисфункция, дилатация камер сердца, повышение систолического давления в легочной артерии (табл. 2).
При исследовании титров АкАт доказана высокая иммунологическая активность миокардита. В 67,7% случаев выявлен специфический АНФ (рис. 5), в подгруппе больных с первичными кардиомиопатиями, включая пациентов с амилоидозом, АНФ определялся у всех.
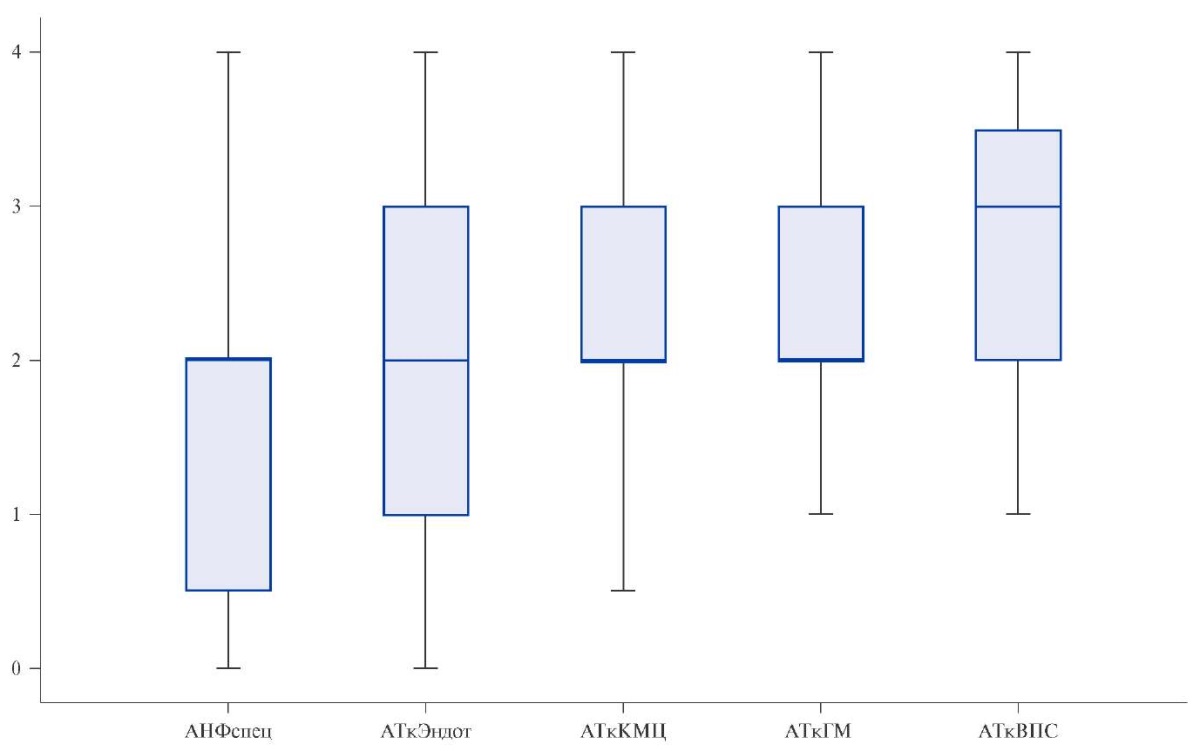
Рис. 5. Титры АкАт у пациентов с декомпенсированным вариантом постковидного миокардита в целом.
Примечание: 1:40 (норма для всех видов антител, кроме отсутствующего в норме АНФ), 2 — 1:80, 3 — 1:160, 4 — 1:320.
Сокращения: АНФспец — специфический антинуклеарный фактор, АтВПС — антитела к антигенам волокон проводящей системы сердца, АТкГМ — антитела к антигенам гладкой мускулатуры, АТкКМЦ — антитела к антигенам кардиомиоцитов, АТкЭндот — антитела к антигенам эндотелия.
При морфологическом исследовании, наряду с лимфоцитарным миокардитом (86,8% биопсий) отмечена относительно высокая частота наиболее тяжелых и редких форм миокардита — эозинофильного (в 10,5% случаев, n=4) и фатального гигантоклеточного в одном случае (рис. 6).
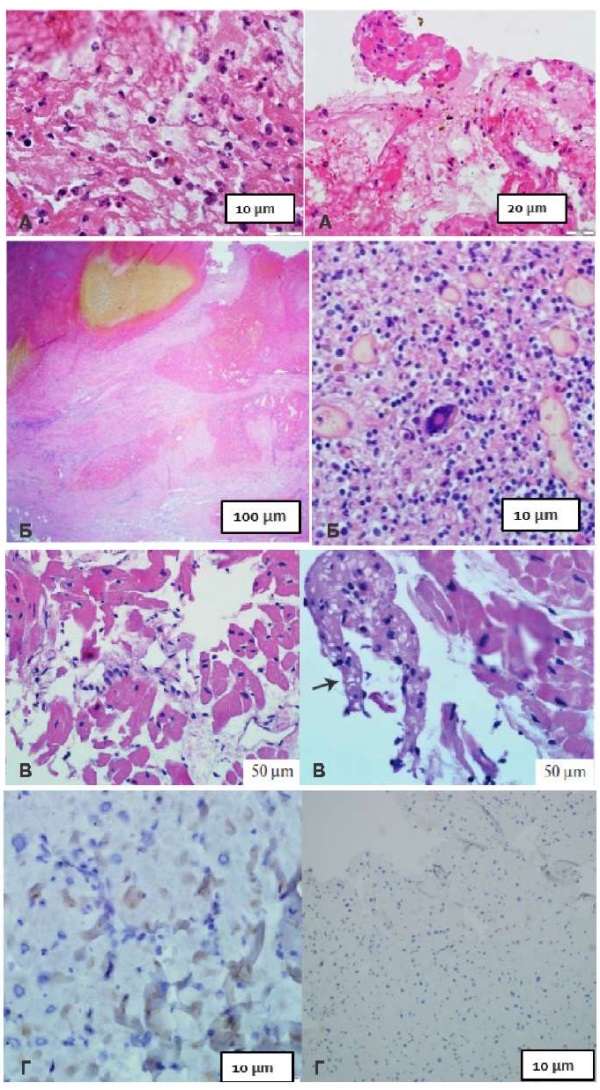
Рис. 6. Данные морфологического исследования миокарда у больных с декомпенсированным вариантом постковидного миокардита (эндомиокардиальные биоптаты правого желудочка).
Примечание: А. Окраска гематоксилин-эозином. Эозинофильный миокардит; Б. Окраска гематоксилин-эозином. Гигантоклеточный миокардит; В. Окраска гематоксилин-эозином. Лимфоцитарный миокардит; Г. ИГХ-исследование. Положительная реакция на нуклеокапсидный белок SARS-Cov-2 в клетках инфильтрата, отдельных кардиомиоцитах и периваскулярно.
Цветное изображение доступно в электронной версии журнала.
Методом ПЦР РНК SARS-CoV-2 выявлена в миокарде у 85,7% обследованных больных (n=12), максимальный срок персистенции вируса после острой инфекции составил 18 мес. Спайк- и нуклеокапсидный протеины SARS-CoV-2 методом ИГХ выявлены у всех больных (рис. 6).
Характерно было одновременное с миокардитом развитие эндокардита (рис. 7). У 5 больных (в 13,1%) выявлены морфологические признаки небактериального тромбоэндокардита. В одном случае отмечено развитие подострого инфекционного эндокардита, еще в четырех случаях — менее яркого клинически эндокардита без четких критериев инфекционного (иммунного?) с формированием вследствие этого необратимых клапанных пороков сердца (митральной недостаточности в 2 случаях, аортальной — у 3 больных).

Рис. 7. Инфекционный эндокардит двустворчатого аортального клапана.
Примечание: А. ЭхоК Г. Вегетация на створке двустворчатого аортального клапана; Б. Интраоперационный биоптат эндокарда удаленного аортального клапана — диффузная нейтрофильная инфильтрация; В. Интраоперационный биоптат миокарда левого предсердия — лимфоцитарная инфильтрация.
Цветное изображение доступно в электронной версии журнала.
В одном случае миокардит сопровождался IgG4- и ANCA-отрицательным аортитом с формированием прогрессирующей аневризмы аорты, что потребовало оперативного лечения.
В одном случае у молодого пациента 35 лет с впервые зарегистрированной ПБЛНПГ, глобальной систолической дисфункцией с падением фракции выброса до 33% в сочетании с зонами нарушения локальной сократимости при ЭхоКГ, клинической картиной СН диагностирован активный лимфоцитарный миокардит в сочетании с гемодинамически значимым стенозом передней межжелудочковой артерии. На фоне комплексной терапии (кардиотропная терапия, ИСТ метилпреднизолоном 24 мг/сут., реваскуляризация) отмечены исчезновение ПБЛНПГ и нормализация глобальной и локальной систолической функций миокарда. При МСКТ сердца не получено данных за рубцовое поражение, что позволило расценить преходящую систолическую дисфункцию как следствие инфарктоподобного варианта миокардита; выявлено диффузное утолщение стенок коронарных артерий, в наибольшей степени соответствующее картине коронариита.
Постковидный миокардит у пациентов с первичными кардиомиопатиями и амилоидозом
В отдельную подгруппу выделены пациенты с миокардитом, развившимся на фоне первичных (генетических) кардиомиопатий и амилоидоза. Включены 10 пациентов (7 мужчин и 3 женщины), средний возраст составил 48,4±11,8 лет (от 31 до 67 лет). Ранее диагноз кардиомиопатии либо не подозревался ввиду отсутствия клинических проявлений до присоединения миокардита, либо был ошибочным/не верифицированным. COVID-19 была подтверждена у всех больных положительным результатом ПЦР-теста во время болезни (n=5) и/или сероконверсией. Средний срок от момента заболевания COVID-19 до диагностики миокардита составил 8,5 [ 5,5; 11,5] мес. Шестерым больным была выполнена МРТ. Интерпретировать данные МРТ, включая природу отсроченного накопления гадолиния, в контексте имеющихся паттернов кардиомиопатий, было сложно. Тем не менее у всех пациентов наблюдалось субэпикардиальное отсроченное накопление гадолиния, признаков отека не наблюдалось ни в одном случае. Отмечались также перикардиальный выпот, повышение объема внеклеточной жидкости и признаки гиперемии миокарда в различных сочетаниях.
В 6 случаях диагноз активного лимфоцитарного миокардита верифицирован морфологически (5 ЭМБ и одна интраоперационная биопсия). РНК коронавируса была обнаружена методом ПЦР у 3 пациентов, а наличие белков коронавируса в миокарде было подтверждено методом ИГХ у всех пациентов. В одном случае (59-летний мужчина с некомпактным миокардом ЛЖ) в миокарде также была обнаружена ДНК парвовируса В19.
Подходы к лечению включали в себя назначение стандартной кардиотропной и ААТ (табл. 3).
Проводилась ИСТ метилпреднизолоном в средних и высоких дозах. Причем в группе больных с декомпенсированным вариантом постковидного миокардита достоверно чаще использовались антагонисты рецепторов неприлизина, антагонисты минералокортикоидных рецепторов, ингибиторы натрий-глюкозного котранспортера 2 типа, петлевые диуретики, амиодарон. Пациенту с генетически верифицированной дилатационной кардиомиопатией имплантировано устройство сердечной ресинхронизирующей терапии (CRT-D).
При контроле титров АкАТ (n=15; средний срок наблюдения 6 [ 4; 10]) отмечено статистически достоверное снижение титра антител кардиомиоцитов (р<0,05).
ЭхоКГ в динамике выполнена в 46 случаях. При среднем сроке наблюдения в 10 [ 6; 15,3] мес. отмечены статистически достоверные улучшения основных структурно-функциональных показателей (рис. 8).
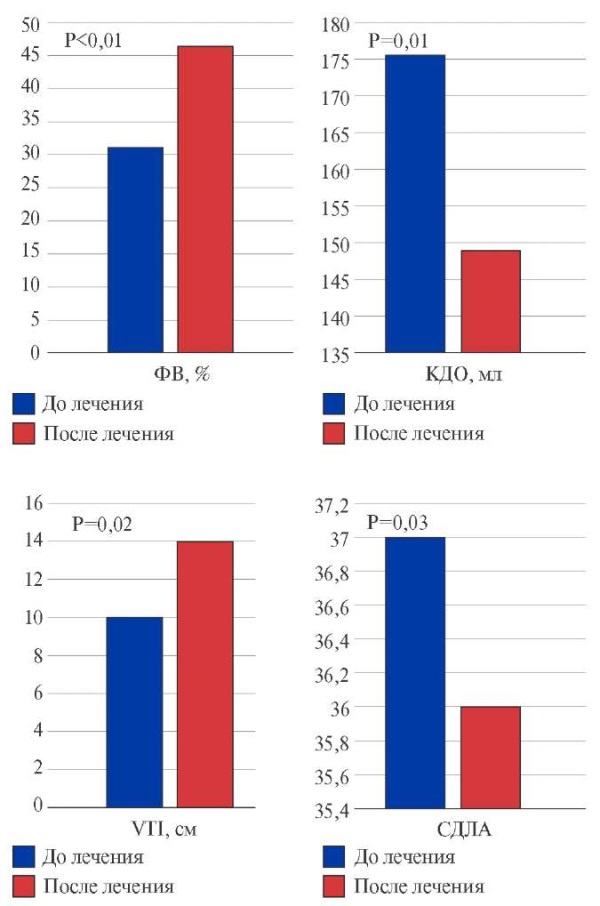
Рис. 8. Динамика структурно-функциональных параметров сердца у больных с декомпенсированным вариантом постковидного миокардита в результате фоне комплексной терапии.
Сокращения: КДО — конечно-диастолический объем, СДЛА — систолическое давление в легочной артерии, ФВ — фракция выброса, VTI — интеграл линейной скорости потока (velocity time integral).
Летальность составила 6,7% (6 пациентов с декомпенсированной формой постковидного миокардита, включая 1 пациентку с гигантоклеточным миокардитом, 2 пациентов с AL-амилоидозом). В одном случае пациенту с лимфоцитарным миокардитом проведена успешная трансплантация сердца.
Обсуждение
В настоящем исследовании представлено 89 случаев постковидного миокардита, развившегося в среднем спустя 8 мес. после COVID-19. Преобладание в клинической картине изолированных нарушений ритма и проводимости в отсутствие систолической дисфункции миокарда позволило выделить аритмический вариант постковидного миокардита. В большинстве случаев симптомные нарушения ритма, возникшие после инфекции, являлись поводом для обращения к врачу. Спектр аритмий варьировал от потенциально жизнеугрожающих нарушений ритма и проводимости (устойчивая желудочковая тахикардия, атриовентрикулярная блокада II-III степени) до нечастой НЖЭС. Не выявлено достоверного влияния степени тяжести перенесенной COVID-19 и характера НРС.
До сих пор в литературе имеется недостаточно сведений об аритмиях как о проявлении миокардита, ассоциированного с COVID-19. Не вызывает сомнений высокая частота развития НРС во время острой COVID-19. Факторы риска аритмии у пациентов с COVID-19 могут включать гипоксию; дисбаланс электролитов; острое повреждение миокарда вследствие поражения коронарных артерий, острого респираторного дистресс-синдрома и сепсиса; также лекарственных взаимодействий, например, с препаратами, влияющими на интервал QT.
В октябре 2021г Всемирная организация здравоохранения ввела новый термин — постковидный синдром ("long-COVID", "post-acute COVID-19 syndrome"). Он определяется как синдром, развивающийся через 3 мес. после COVID-19 с симптомами, которые продолжаются не менее 2 мес. и не могут быть объяснены другим диагнозом. Точный механизм развития этого синдрома неясен. Высказаны предположения о недостаточном иммунном ответе на инфекцию, длительной воспалительной реакции, о расстройстве адаптации и повторном заражении SARS-CoV-2 в качестве возможных механизмов развития постковидного синдрома. Симптомы могут включать в себя утомляемость, миалгии, расстройства сна, сердцебиение, затяжной кашель, одышку, субфебрилитет. Вместе с тем порой "неспецифические" симптомы могут скрывать под собой развитие отдаленных осложнений инфекции [11]. Это подчеркивает необходимость тщательного обследования пациентов с жалобами на приступы сердцебиения, перебои в работе сердца или необъяснимые эпизоды потери сознания.
В 2023г описан случай развития неустойчивой желудочковой тахикардии у 17-летнего пациента с верифицированным лабораторно (повышение уровня тропонина) и при МРТ миокардитом, ассоциированным с вакцинацией мРНК-вакциной против COVID-19, в отсутствие убедительных данных о перенесенной ранее инфекции. Трансторакальная ЭхоКГ не выявила структурной патологии сердца, что позволяет расценить состояние как аритмический вариант миокардита, ассоциированного с вакцинацией [12].
Описан случай аутопсийного исследования миокарда у 69-летнего мужчины с рефрактерным кардиогенным шоком [13]. ПЦР мазков из носоглотки и образцов бронхоальвеолярного лаважа РНК SARS-CoV-2 дали отрицательные результаты. При аутопсии выявлен незначительный коронарный атеросклероз. Морфологическое исследование миокарда выявило наличие интенсивной мультифокальной воспалительной инфильтрации в желудочках и в межжелудочковой перегородке. При ИГХ анализе антител к нуклеокапсидному белку SARS-CoV-2 в клетках миокарда, выявлен положительный их титр. При ПЦР-исследовании выявлена РНК SARS-CoV-2, что впервые показало присутствие вирусного генома в миокарде.
В отечественном исследовании 77 аутопсийных образцов миокарда умерших от тяжелой COVID-19 выявлено, что основным морфологическим проявлением инфекции в миокарде является эндотелит с дисплазией и активацией эндотелиоцитов, приводящий к кровоизлияниям, тромбозу артерий и некрозам [14]. Это нашло отражение и в нашем исследовании — доказана высокая частота развития тромбоэндокардита.
Морфологически верифицированные случаи со сроком развития более одного месяца после острой инфекции до сих пор практически не описаны, тем более отсутствуют серии наблюдений, регистры больных с верифицированным постковидным миокардитом, попытки их активного лечения.
Описан клинический случай проведения ЭМБ ЛЖ у ранее здоровой 59-летней пациентки с симптомами выраженной одышки спустя 4 нед. после развития легочных симптомов. В анализах крови наблюдалось повышение уровней кардиоспецифических маркеров. В биоптатах обнаружен геном SARS-CoV-2, иммуногистохимический анализ подтвердил выраженное интрамиокардиальное воспаление в отсутствие признаков некроза. При гистологическом исследовании выявлены гипертрофированные кардиомиоциты. При повторной ЭМБ через 3 нед. отмечены снижение инфильтрации воспалительными клетками, исчезновение вирусного генома, что в совокупности с клиническим улучшением подтвердило регресс миокардита [15]. В нашем исследовании доказана более длительная персистенция вируса в миокарде — вплоть до 18 мес.
Лечение миокардита, помимо стандартной кардиотропной терапии, базируется на ИСТ глюкокортикостероидами. При коронавирусном миокардите терапия стероидами обычно не вызывает опасений, ее эффективность обусловлена высокой воспалительной активностью и способностью коронавируса индуцировать спектр аутоиммунных реакций, в т. ч. затяжных. Нами опубликованы первые данные об эффективности монотерапии кортикостероидами в лечении морфологически верифицированного постковидного миокардита с систолической дисфункцией, в т. ч. при обнаружении РНК в миокарде [16]. В настоящем исследовании эти данные получили подтверждение в более многочисленной когорте больных, причем до назначения ИСТ применение ААТ и/или стандартной кардиотропной терапии хронической СН достаточного эффекта не имело.
В наиболее тяжелых случаях миокардит требует трансплантации сердца. Из более чем 6 тыс. пациентов в возрасте старше 18 лет, перенесших трансплантацию сердца с июля 2020г по май 2022г в базе данных United Network for Organ Sharing (США), у 12 (0,2%) пациентов был постковидный миокардит [17]. При этом однолетняя выживаемость без отторжения трансплантата составила 100% среди пациентов с COVID-19-ассоциированным миокардитом и 88,5% среди пациентов, перенесших трансплантацию сердца по другим причинам. Несмотря на сравнительно небольшой объем выборки, в нашем исследовании отмечен один случай успешной трансплантации сердца у пациента с активным лимфоцитарным миокардитом и падением фракции выброса до 19%. Это доказывает возможность развития крайне тяжелых вариантов SARS-CoV-2-ассоциированных миокардитов, когда возможности медикаментозных и немедикаментозных мер коррекции сердечной деятельности оказываются неэффективными.
В то же время исследования последних лет показали эффективность и безопасность терапии кортикостероидами при обнаружении парвовирусного генома в миокарде при ЭМБ [18][19]. Данные об успешном использовании гидроксихлорохина в лечении постковидного миокардита ограничены небольшими исследованиями.
Заключение
Инфекция SARS-CoV-2 может приводить к развитию не только острого, но и подострого/хронического миокардита, клинические проявления которого развиваются в среднем через 8 мес. (от 1 мес. до 3 лет) после острой COVID-19. Постковидный миокардит проявляется в двух основных клинических формах — аритмической с изолированными политопными нарушениями ритма и/или проводимости сердца и декомпенсированной с систолической дисфункцией с дилатацией камер или без нее и высокой частотой правожелудочковой недостаточности.
В качестве основных механизмов постковидного миокардита следует рассматривать длительную персистенцию вируса в миокарде в сочетании с высокой аутоиммунной активностью. Постковидный миокардит может сочетаться с первичными (в т. ч. генетическими детерминированными) кардиомиопатиями, с AL-амилоидозом, значительно ухудшая их течение.
Морфологически наиболее часто выявлялся лимфоцитарный миокардит, однако частота неблагоприятных морфологических вариантов (эозинофильного и гигантоклеточного) также была высока и составила 10,5% и 2,6% случаев, соответственно. Отмечено и одновременное развитие небактериального тромбоэндокардита, инфекционного эндокардита с формированием клапанных пороков сердца.
Подходы к лечению постковидного миокардита включали в себя назначение ИСТ (глюкокортикостероиды в дозе 16-32 мг/сут. у 68,5% больных, гидроксихлорохин 200-400 мг/сут. у 33,7%). При аритмической форме постковидного миокардита полное подавление аритмии достигнуто в 25% случаев, частичное в 58,3%, в одном случае имплантирован кардиостимулятор. У больных с декомпенсированным вариантом миокардита кортикостероиды оказались эффективны независимо от наличия генома/белков вируса в миокарде: средняя фракция выброса увеличилась до 47 [ 38,5%; 53%], p<0,01, достоверно уменьшились размеры левых камер, давление в легочной артерии, степень регургитации на клапанах.
Частота неблагоприятных исходов оказалась достаточно высока и составила 6,7%.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Çınar T, Hayıroğlu Mİ, Çiçek V, et al. COVID-19 and acute myocarditis: current literature review and diagnostic challenges. Rev Assoc Med Bras. 2020;66:48-54. doi:10.1590/1806-9282.66.S2.48.
2. Galeone A, Bernabei A, Pesarini G, et al. Ten-Year Experience with Endomyocardial Biopsy after Orthotopic Heart Transplantation: Comparison between Trans-Jugular and Trans-Femoral Approach. J Cardiovasc Dev Dis. 2024;11(4):115. doi:10.3390/jcdd11040115.
3. Благова О. В., Сулимов В. А., Недоступ А. В. и др. Опыт проведения биопсии миокарда в терапевтической клинике: отбор пациентов, Непосредственные результаты, значение в выборе тактики лечения. Российский кардиологический журнал. 2015;(5):82-92. doi:10.15829/1560-4071-2015-5-82-92.
4. Fairweather D, Beetler DJ, Di Florio DN, et al. COVID-19, Myocarditis and Pericarditis. Circ Res. 2023;12;132(10):1302-19. doi:10.1161/CIRCRESAHA.123.321878.
5. Sala S, Peretto G, Gramegna M, et al. Acute myocarditis presenting as a reverse Tako-Tsubo syndrome in a patient with SARS-CoV-2 respiratory infection. Eur Heart J. 2020;41(19):1861-2. doi:10.1093/eurheartj/ehaa286.
6. Sassone B, Muser D, Bruno A, et al. Concealed SARS-CoV-2 interstitial pneumonia unmasked by infarct-like acute myocarditis. Eur Heart J Case Rep. 2020;4(FI1):1-2. doi:10.1093/ehjcr/ytaa158.
7. Zuin M, Rigatelli G, Bilato C, et al. One-Year Risk of Myocarditis After COVID-19 Infection: A Systematic Review and Meta-analysis. Can J Cardiol. 2023;39(6):839-44. doi:10.1016/j.cjca.2022.12.003.
8. Buckley BJR, Harrison SL, Fazio-Eynullayeva E, et al. Prevalence and clinical outcomes of myocarditis and pericarditis in 718,365 COVID-19 patients. Eur J Clin Invest. 2021;51(11):e13679. doi:10.1111/eci.13679.
9. Blagova O, Lutokhina Y, Savina P, et al. Corticosteroids are effective in the treatment of viruspositive post-COVID myoendocarditis with high autoimmune activity. Clin Cardiol. 2023;46(3):352-4. doi:10.1002/clc.23978.
10. Ammirati E, Moslehi JJ. Diagnosis and Treatment of Acute Myocarditis: A Review. JAMA. 2023;329(13):1098-113. doi:10.1001/jama.2023.3371.
11. Al-Jahdhami I, Al-Naamani K, Al-Mawali A. The Post-acute COVID-19 Syndrome (Long COVID). Oman Med J. 2021;36(1):e220. doi:10.5001/omj.2021.91.
12. Sheth SP, Gandhi R. Ventricular Arrhythmia and COVID-19 Vaccine-associated Myocarditis. Pediatr Infect Dis J. 2023;42(4):e112-e113. doi:10.1097/INF.0000000000003833.
13. Gauchotte G, Venard V, Segondy M, et al. SARS-Cov-2 fulminant myocarditis: an autopsy and histopathological case study. Int J Legal Med. 2021;135(2):577-81. doi:10.1007/s00414-020-02500-z.
14. Митрофанова Л. Б., Макаров И. А., Рунов А. Л. и др. Клинико-морфологическое и молекулярно-биологическое исследование миокарда у пациентов с COVID-19. Российский кардиологический журнал. 2022;27(7):4810. doi:10.15829/1560-4071-2022-4810.
15. Pietsch H, Escher F, Aleshcheva G, et al. Proof of SARS-CoV-2 genomes in endomyocardial biopsy with latency after acute infection. Int J Infect Dis. 2021;102:70-2. doi:10.1016/j.ijid.2020.10.012.
16. Благова О. В., Айнетдинова Д. Х., Коган Е. А. и др. Инфекционный и небактериальный тромбоэндокардит у больных с постковидным вирусно-иммунным миокардитом. Российский кардиологический журнал. 2022;27(9):4827. doi:10.15829/1560-4071-2022-4827.
17. Gill G, Roach A, Rowe G, et al. Heart transplantation for COVID-19 myopathy in the United States. J Heart Lung Transplant. 2023;42(4):447-50. doi:10.1016/j.healun.2022.09.020.
18. Blagova O, Lutokhina Y, Kogan E, et al. Chronic biopsy proven post-COVID myoendocarditis with SARS-Cov-2 persistence and high level of antiheart antibodies. Clin Cardiol. 2022;45(9):952-9. doi:10.1002/clc.23886.
19. Mele D, Flamigni F, Rapezzi C, et al. Myocarditis in COVID-19 patients: current problems. Intern Emerg Med. 2021;16(5):1123-9. doi:10.1007/s11739-021-02635-w.
Об авторах
П. О. СавинаРоссия
Савина Полина Олеговна — аспирант кафедры факультетской терапии № 1 института клинической медицины им. Н.В. Склифосовского.
Москва
Конфликт интересов:
Нет
О. В. Благова
Россия
Благова Ольга Владимировна — д. м. н., профессор кафедры факультетской терапии № 1 института клинической медицины им. Н.В. Склифосовского.
Москва
Конфликт интересов:
Нет
Д. Х. Айнетдинова
Россия
Айнетдинова Диляра Харисовна — к.м.н., врач отделения кардиологии № 2 Факультетской терапевтической клиники им. В.Н. Виноградова Университетской клинической больницы № 1.
Москва
Конфликт интересов:
Нет
А. В. Седов
Россия
Седов Алексей Всеволодович — к.м.н., врач отделения кардиологии № 2 Факультетской терапевтической клиники им. В.Н. Виноградова Университетской клинической больницы № 1.
Москва
Конфликт интересов:
Нет
Е. В. Павленко
Россия
Павленко Екатерина Вадимовна — к.м.н., ассистент кафедры факультетской терапии № 1 института клинической медицины им. Н.В. Склифосовского.
Москва
Конфликт интересов:
Нет
Ю. А. Лутохина
Россия
Лутохина Юлия Александровна — д.м.н., доцент кафедры факультетской терапии № 1 института клинической медицины им. Н.В. Склифосовского.
Москва
Конфликт интересов:
Нет
Е. А. Коган
Россия
Коган Евгения Алтаровна — д.м.н., профессор, зав. кафедрой патологической анатомии им. акад. А.И. Струкова института клинической медицины им. Н.В. Склифосовского.
Москва
Конфликт интересов:
Нет
Дополнительные файлы
- Новая коронавирусная инфекция (COVID-19) может приводить к развитию подострого/хронического постковидного миокардита, клинические проявления которого развиваются в среднем через 8 мес. (от 1 мес. до 3 лет) после острой COVID-19.
- Подходы к диагностике, помимо стандартного обследования, включают в себя исследование титров антикардиальных антител, биопсию с применением вирусологического и иммуногистохимического методов исследования.
- Доказана эффективность и безопасность иммуносупрессивной терапии глюкокортикостероидами и/или гидроксихлорохином.
Рецензия
Для цитирования:
Савина П.О., Благова О.В., Айнетдинова Д.Х., Седов А.В., Павленко Е.В., Лутохина Ю.А., Коган Е.А. Подострый и хронический постковидный миокардит: диагностика, клинические варианты, подходы к лечению. Российский кардиологический журнал. 2024;29(11):6089. https://doi.org/10.15829/1560-4071-2024-6089. EDN: EYNACD
For citation:
Savina P.O., Blagova O.V., Ainetdinova D.Kh., Sedov A.V., Pavlenko E.V., Lutokhina Yu.A., Kogan E.A. Subacute and chronic post-COVID myocarditis: diagnostics, clinical variants, treatment approaches. Russian Journal of Cardiology. 2024;29(11):6089. (In Russ.) https://doi.org/10.15829/1560-4071-2024-6089. EDN: EYNACD
JATS XML

















































