Перейти к:
Отдаленные результаты транскатетерной имплантации аортального клапана: одноцентровое обсервационное исследование
https://doi.org/10.15829/1560-4071-2024-6007
EDN: JOUOSO
Аннотация
Цель. Оценить отдаленные исходы транскатетерной имплантации аортального клапана, включая общую выживаемость, свободу от смерти от сердечно-сосудистых причин, имплантации постоянного электрокардиостимулятора и репротезирования.
Материал и методы. В ретроспективное обсервационное исследование были включены 535 пациентов, перенесших процедуру транскатетерной имплантации аортального клапана в период с апреля 2015г по январь 2024г. Из анализа были исключены пациенты, перенесшие транскатетерную имплантацию аортального клапана по поводу умеренного стеноза или выраженной недостаточности аортального клапана (35 пациентов). Таким образом, в итоговый анализ было включено 500 пациентов. Лица мужского пола составили 40,8%. Большинство пациентов имели промежуточный хирургический риск по шкале EuroSCORE II (5,2%), а также низкий хирургический риск по шкале STS-PROM (2,9%). Медиана периода наблюдения составила 2,2 (0,6;4,1) года.
Результаты. Общая выживаемость пациентов составила 94%, 88%, 86% и 58% через 1, 3, 5 и 8 лет, соответственно. Свобода от сердечно-сосудистой смерти составила 97%, 90%, 78% и 61% через 1, 3, 5 и 8 лет, соответственно. Кумулятивная свобода от имплантации постоянного электрокардиостимулятора за весь период наблюдения составила 89,4%, репротезирования — 98,8%. Факторами, влияющими на частоту смерти от всех причин в отдаленном периоде, были мужской пол, курение, онкопатология и индексированная масса миокарда левого желудочка. Eдинственным независимым предиктором сердечно-сосудистой смерти было значение хирургического риска STS-PROM.
Заключение. Наш опыт демонстрирует удовлетворительные отдаленные результаты транскатетерной имплантации аортального клапана у пациентов с выраженным аортальным стенозом в отношении общей выживаемости, сердечно-сосудистой смерти, имплантации постоянного электрокардиостимулятора и репротезирования. Независимыми предикторами смерти от всех причин были мужской пол, курение, онкопатология и индексированная масса миокарда левого желудочка. Единственным независимым предиктором сердечно-сосудистой смерти в отдаленном периоде был хирургический риск по шкале STS-PROM.
Ключевые слова
Для цитирования:
Баранов А.А., Бадоян А.Г., Хелимский Д.А., Цыденова А.Ю., Зайнобидинов Ш.Ш., Бобошко В.А., Крестьянинов О.В. Отдаленные результаты транскатетерной имплантации аортального клапана: одноцентровое обсервационное исследование. Российский кардиологический журнал. 2024;29(12):6007. https://doi.org/10.15829/1560-4071-2024-6007. EDN: JOUOSO
For citation:
Baranov A.A., Badoyan A.G., Khelimsky D.A., Tsydenova A.Yu., Zainobidinov Sh.Sh., Boboshko V.A., Krestyaninov O.V. Long-term outcomes of transcatheter aortic valve implantation: a single-center observational study. Russian Journal of Cardiology. 2024;29(12):6007. (In Russ.) https://doi.org/10.15829/1560-4071-2024-6007. EDN: JOUOSO
В 2002г французский кардиолог Ален Крибье выполнил первую в мире транскатетерную имплантацию аортального клапана (ТИАК) [1]. С тех пор достигнуты значительные успехи в развитии технологии ТИАК как малоинвазивного метода лечения неоперабельных пациентов с выраженным аортальным стенозом (АС) [2-4]. Эти достижения во многом обусловлены усовершенствованием транскатетерных биопротезов, систем их доставки, а также оптимизацией отбора больных и стремительным накоплением хирургического опыта. Появление убедительных данных об эффективности ТИАК у пациентов промежуточного и низкого хирургических рисков позволило расширить показания к ТИАК для значительной части больных [5-7]. Учитывая тенденцию к распространению транскатетерных технологий на более молодую популяцию пациентов, проблема среднесрочных и отдаленных результатов ТИАК приобретает первостепенное значение. Хотя в мировой литературе имеется достаточное число публикаций, посвященных данной проблеме, сведения отечественной литературы на сегодняшний день крайне ограниченны. Целью данного исследования была оценка отдаленных исходов у пациентов, перенесших процедуру ТИАК.
Материал и методы
В данное ретроспективное обсервационное исследование были включены 500 пациентов, перенесших процедуру ТИАК по поводу дегенеративного стеноза аортального клапана (АК) в период с апреля 2015г по январь 2024г. Распределение объемов вмешательств по годам представлено на рисунке 1. Выбор стратегии лечения пациентов обсуждался многопрофильной кардиологической командой, в которую входили врачи по рентгенэндоваскулярным диагностике и лечению, сердечно-сосудистые хирурги, кардиологи, кардиоанестезиологи. Хирургический риск оценивали с помощью шкалы Европейской системы оценки риска сердечной хирургии (англ. European System for Cardiac Operative Risk Evaluation (EuroSCORE) II) и шкалы прогнозируемого риска летального исхода (англ. Predicted Risk of Mortality, PROM) Общества торакальных хирургов (англ. Society of Thoracic Surgeons, STS) (STS-PROM) [8][9]. Для оценки состояния коронарных артерий всем пациентам перед процедурой ТИАК была выполнена селективная коронарография. Во всех случаях использовался трансфеморальный сосудистый доступ. Ангиографический контроль позиционирования биопротеза осуществляли через лучевую артерию с применением диагностического катетера PigTail.
Во время процедуры у пациентов использовалась умеренная седация (фентанил 2-3 мкг/кг, пропофол 5-50 мкг/кг/мин или дексмедетомидин 0,2-0,7 мкг/кг/ч) в сочетании с локальным обезболиванием области хирургического доступа. Инвазивный мониторинг гемодинамики осуществлялся через катетер, установленный в лучевую артерию. Для достижения целевых значений активированного времени свертывания крови (>250) использовалось болюсное введение нефракционированного гепарина в дозе 70-100 ед./кг. В случае потребности в инактивации гепарина, при отсутствии противопоказаний, вводился протамин в дозе 50-100 мг. Временную электрокардиостимуляцию осуществляли за счет позиционирования временного электрода в полости правого желудочка либо посредством проводника, расположенного в полости левого желудочка (ЛЖ). Сверхчастая стимуляция сердца проводилась с помощью устройства (Medtronic 5388 Dual Chamber Pacemaker Monitor) в режиме желудочковой стимуляции (VVI) с частотой 190-200 уд./мин. Тип и размер транскатетерного биопротеза определяли по данным предоперационной мультиспиральной компьютерной томографии. Применялись как саморасширяемые транскатетерные биопротезы (CoreValve, Evolute R (Medtronic Inc., США), Acurate, AcurateNeo2 (Boston Scientific, США)), так и баллонорасширяемый биопротез MyVal (Meril Life Sciences, Индия). Решение о постдилатации имплантированного биопротеза принимали по результатам интраоперационной ангиографии и эхокардиографии.
Непосредственные клинические исходы определяли в соответствии с Консорциумом академических исследователей пороков сердца 3-го пересмотра (Valve Academic Research Consortium (VARC-3)) [10]. Медиана периода наблюдения составила 2,2 (0,6;4,1) года. Первичной конечной точкой являлась свобода от смерти от всех причин в отдаленном периоде. Вторичные конечные точки включали свободу от смерти от сердечно-сосудистых причин, репротезирования АК и имплантации постоянного электрокардиостимулятора (ЭКС).
Статистический анализ. Cтатистическая обработка данных выполнялась с применением пакета программ IBM SPSS Statistics 25 (США) и пакета R 3.5.0 (Австрия). Количественные данные представлены в виде среднего значения ± среднеквадратическое отклонение для переменных с нормальным распределением и в виде медианы и межквартильного интервала — 25-го и 75-го процентилей для переменных с ненормальным распределением. Качественные переменные были представлены в виде абсолютного количества и доли в процентах от общего. Выполнена проверка всех количественных переменных на соответствие нормальному распределению с помощью критерия Колмогорова-Смирнова. Для определения предикторов смерти в отдаленном периоде проводили многофакторный регрессионный анализ Кокса, в который в качестве независимых переменных (непрерывных и дихотомических категориальных) включали все параметры, которые потенциально могли быть связаны с конечной точкой. Время до события было оценено с использованием метода Каплана-Мейера, а различия между группами — с помощью теста лог-ранга критерия Мантеля-Кокса. Различия считали статистически значимыми при p<0,05. Исследование было одобрено локальным этическим комитетом в ФГБУ "НМИЦ им. акад. Е. Н. Мешалкина" и соответствует принципам Хельсинкской декларации.
Результаты
Предоперационная характеристика пациентов представлена в таблице 1. Средний возраст включенных в исследование больных составил 75,5±7,2 лет. Лица мужского пола составили 40,8%. Большинство пациентов имели промежуточный хирургический риск по шкале EuroSCORE II (5,2%), а также низкий хирургический риск по шкале STS-PROM (2,9%). Динамика возраста и хирургического риска пролеченных пациентов по годам представлена на рисунке 2.
Инструментальная характеристика включенных больных представлена в таблице 2. Средний градиент давления на АК составил 53,4±15,5 мм рт.ст., фракция выброса ЛЖ — 57,4±12,3%. Большая часть больных (63,8%) имели выраженную степень кальцификации створок АК, 7,6% — двухстворчатую анатомию.
Процедурные и госпитальные результаты представлены в таблице 3. В 45,8% случаев использовались биопротезы нового поколения (Evolute R, Acurate Neo2, MyVal). Частота процедурного успеха, согласно VARC-3 критериям, составила 93% с госпитальной летальностью 2,2%.
Медиана периода наблюдения составила 2,2 (0,6;4,1) года. Общая выживаемость пациентов составила 94% (1 год), 88% (3 года), 86% (5 лет) и 58% (8 лет) (рис. 3 А). Свобода от сердечно-сосудистой смерти составила 97% (1 год), 90% (3 года), 78% (5 лет) и 61% (8 лет) (рис. 3 Б). Кумулятивная свобода от имплантации постоянного ЭКС за весь период наблюдения составила 89,4% (рис. 3 В), репротезирования — 98,8% (рис. 3 Г).
После исключения случаев с госпитальной летальностью, в результате многофакторного регрессионного анализа независимыми предикторами смерти от всех причин в отдаленном периоде были мужской пол (отношение рисков (ОР) 13,2, 95% доверительный интервал (ДИ): 3,52-49,50, p<0,01), курение (ОР 0,08, 95% ДИ: 0,01-0,95, p=0,04), онкопатология (ОР 5,96, 95% ДИ: 1,94-18,4, p<0,01) и индексированная масса миокарда ЛЖ (ОР 1,01, 95% ДИ: 1,00-1,02, p=0,03). В свою очередь, единственным независимым предиктором сердечно-сосудистой смерти было значение хирургического риска STS-PROM (ОР 1,35, 95% ДИ: 1,02-1,79, p=0,04) (табл. 4).

Рис. 1. Распределение объемов вмешательств по годам.
Таблица 1
Предоперационная характеристика пациентов
Показатель | Значение (n=500) |
Мужской пол, n (%) | 204 (40,8%) |
Возраст, лет | 75,5±7,2 |
ИМТ, кг/м2 | 30,3±6,2 |
III-IV функциональный класс СН по NYHA, n (%) | 416 (83,2) |
Сахарный диабет, n (%) | 156 (31,2) |
Артериальная гипертензия, n (%) | 470 (94,0) |
Курение, n (%) | 41 (8,2) |
Дислипидемия, n (%) | 237 (47,4) |
Анемия, n (%) | 107 (21,4) |
Фибрилляция предсердий, n (%) | 138 (37,6) |
Гемодиализ, n (%) | 6 (1,2) |
ИМ в анамнезе, n (%) | 119 (23,8) |
Инсульт в анамнезе, n (%) | 47 (9,4) |
Заболевание периферических артерий, n (%) | 137 (27,4) |
Хронические заболевания легких, n (%) | 55 (11,0) |
Онкопатология в анамнезе, n (%) | 72 (14,4) |
Стеноз коронарных артерий >50%, n (%) | 101 (20,2) |
ЧКВ в анамнезе, n (%) | 206 (41,2) |
АКШ в анамнезе, n (%) | 48 (9,6) |
Имплантация постоянного ЭКС в анамнезе, n (%) | 39 (7,8) |
Протезирование АК в анамнезе, n (%) | 5 (1,0) |
Баллонная вальвулопластика АК в анамнезе, n (%) | 28 (5,6) |
СКФ, мл/мин/1,73 м2 | 67,7±16,4 |
EuroSCORE II, % | 5,2 (2,6;8,8) |
STS-PROM, % | 2,9 (2,1;4,2) |
Сокращения: АК — аортальный клапан, АКШ — аортокоронарное шунтирование, ИМ — инфаркт миокарда, ИМТ — индекс массы тела, СКФ — скорость клубочковой фильтрации, СН — сердечная недостаточность, ЧКВ — чрескожное коронарное вмешательство, ЭКС — электрокардиостимулятор.
Таблица 2
Инструментальная характеристика пациентов
Параметр | Значение (n=500) | |
Эхокардиографические данные | ||
Пиковый градиент давления АК, мм рт.ст. | 90,0±24,0 | |
Средний градиент давления АК, мм рт.ст. | 53,4±15,5 | |
Площадь отверстия АК, мм2 | 0,8 (0,7;1,0) | |
Индексированная площадь отверстия АК, мм2/м2 | 0,3 (0,2;0,4) | |
Аортальная регургитация 2-3 степени, n (%) | 80 (16,0) | |
Митральная регургитация 2-3 степени, n (%) | 154 (30,8) | |
Трикуспидальная регургитация 2-3 степени, n (%) | 75 (15,0) | |
Фракция выброса ЛЖ, % | 57,4±12,3 | |
Индексированная ММЛЖ, г/м2 | 169,8±47,4 | |
Систолическое давление в ЛА, мм рт.ст. | 41,9±12,3 | |
Данные мультиспиральной компьютерной томографии | ||
Средний диаметр фиброзного кольца АК, мм | 24,1±2,4 | |
Периметр фиброзного кольца АК, мм | 75,8 (70,8;81,0) | |
Высота отхождения устья ствола ЛКА, мм | 13,8±3,2 | |
Высота отхождения устья ПКА, мм | 16,6±3,5 | |
Степень кальцификации АК, n (%) | Незначительная | 87 (17,4) |
Умеренная | 94 (18,8) | |
Выраженная | 319 (63,8) | |
Кальциноз ВОЛЖ, n (%) | 46 (9,2) | |
Угол корня аорты, | 48,4±8,0 | |
Двухстворчатый АК, n (%) | 38 (7,6) | |
Тип 0 двухстворчатого АК, n (%) | 4 (0,8) | |
Кальциноз в месте сосудистого доступа, n (%) | 75 (15,0) | |
Длина мембранозной перегородки, мм | 6,4 (5,5;7,7) | |
Электрокардиографические данные | ||
Полная блокада ПНПГ, n (%) | 35 (7,0) | |
Неполная блокада ПНПГ, n (%) | 33 (6,6) | |
Полная блокада ЛНПГ, n (%) | 38 (7,6) | |
Блокада передней ветви ЛНПГ, n (%) | 58 (11,6) | |
Удлинение интервала PQ >200 мс, n (%) | 42 (8,4) | |
Сокращения: АК — аортальный клапан, ВОЛЖ — выходной отдел левого желудочка, ЛА — легочная артерия, ЛЖ — левый желудочек, ЛКА — левая коронарная артерия, ЛНПГ — левая ножка пучка Гиса, ММЛЖ — масса миокарда левого желудочка, ПКА — правая коронарная артерия, ПНПГ — правая ножка пучка Гиса.
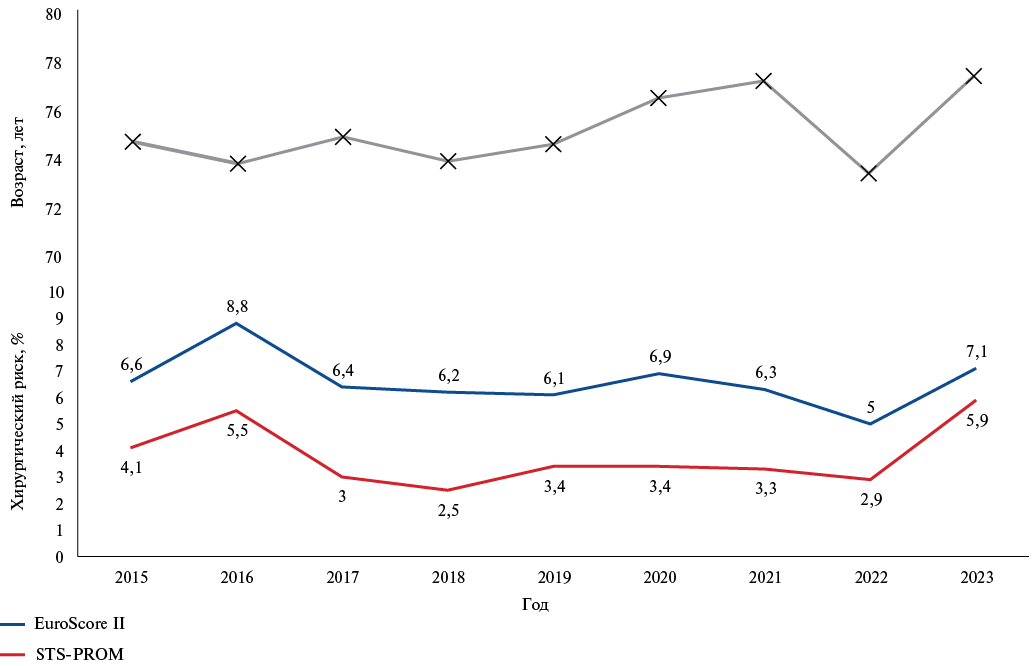
Рис. 2. Динамика возраста и хирургического риска пролеченных пациентов по годам.
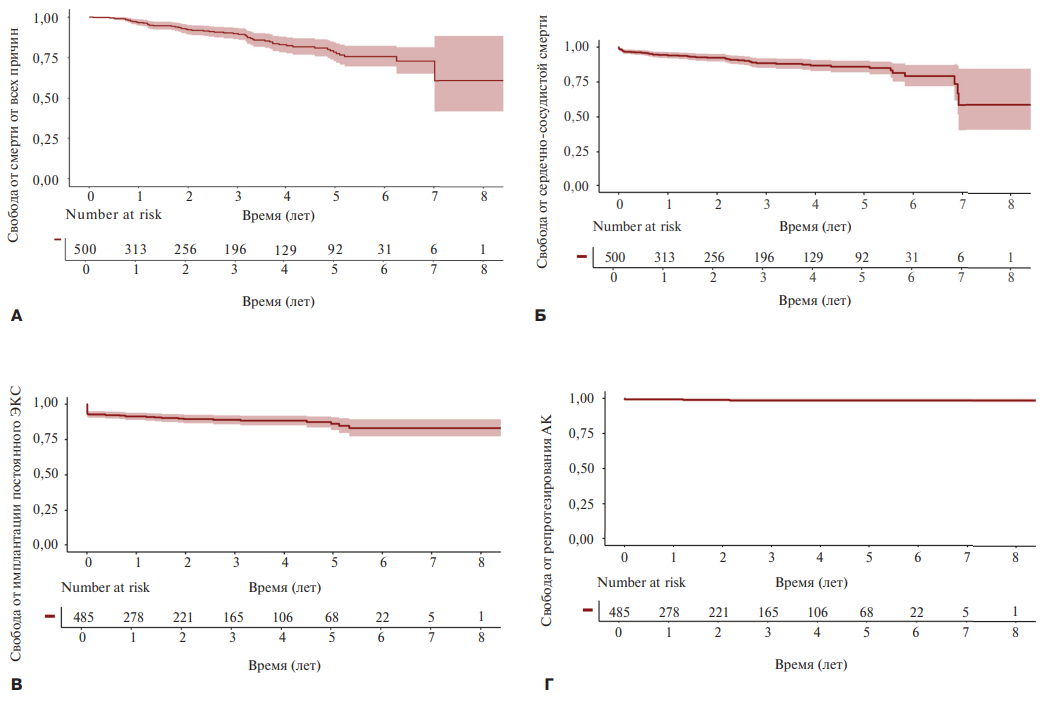
Рис. 3. Кривые Каплана-Мейера для основных конечных точек.
Примечание: А — свобода от смерти от всех причин; Б — свобода от смерти от сердечно-сосудистых причин; В — свобода от имплантации постоянного ЭКС; Г — свобода от репротезирования.
Сокращения: АК — аортальный клапан, ЭКС — электрокардиостимулятор.
Таблица 3
Процедурные и госпитальные результаты
Параметр | Значение (n=500) | |
Тип биопротеза, n (%) | CoreValve | 172 (34,4) |
Evolute R | 152 (30,4) | |
AcurateNeo | 99 (19,8) | |
AcurateNeo2 | 59 (11,8) | |
MyVal | 18 (3,6) | |
Предилатация, n (%) | 388 (77,6) | |
Постдилатация, n (%) | 276 (55,2) | |
Электрокардиостимуляция через проводник в ЛЖ, n (%) | 68 (13,6) | |
Глубина имплантации, мм | 4,9 (3,3;6,3) | |
Длина мембранозной перегородки — глубина имплантации, мм | 1,6 (-0,1;3,5) | |
Использование устройств для закрытия сосудистого доступа, n (%) | 472 (94,4) | |
ТИАК + ЧТКА со стентированием КА, n (%) | 24 (4,8) | |
Время флюороскопии, мин | 21,2±17,6 | |
Объем контрастного вещества, мл | 200 (150;250) | |
Процедурный неуспех, n (%) | 35 (7,0) | |
Процедурная смертность, n (%) | 8 (1,6) | |
Средний градиент давления АК >20 мм рт.ст., n (%) | 2 (1,0) | |
Парапротезная регургитация 2-3 степени, n (%) | 14 (2,8) | |
Неоптимальное положение протеза в ФК АК, n (%) | 15 (3,0) | |
Госпитальная смертность, n (%) | 11 (2,2) | |
Инсульт/ТИА, n (%) | 16 (3,2) | |
Гемоперикард, n (%) | 13 (2,6) | |
Имплантация постоянного ЭКС, n (%) | 37 (7,4) | |
Большое сосудистое осложнение, связанное с доступом, n (%) | 17 (3,4) | |
Впервые возникшая полная блокада ЛНПГ, n (%) | 79 (15,8) | |
Количество дней после операции до выписки, дней | 9,7±6,2 | |
Сокращения: АК — аортальный клапан, КА — коронарные артерии, ЛЖ — левый желудочек, ЛНПГ — левая ножка пучка Гиса, ТИА — транзиторная ишемическая атака, ТИАК — транскатетерная имплантация аортального клапана, ФК — фиброзное кольцо, ЧТКА — чрескожная транслюминальная коронарная ангиопластика, ЭКС — электрокардиостимулятор.
Таблица 4
Многофакторный регрессионный анализ предикторов смерти в отдаленном периоде
Фактор | Смерть от всех причин | Сердечно-сосудистая смертность | ||
ОР (95% ДИ) | p | ОР (95% ДИ) | p | |
Мужской пол | 13,2 (3,52-49,50) | <0,01 | 1,21 (0,33-4,36) | 0,80 |
Возраст | 1,07 (0,98-1,16) | 0,13 | 1,03 (0,93-1,13) | 0,60 |
ИМТ | 1,03 (0,95-1,12) | 0,50 | 1,02 (0,92-1,12) | 0,80 |
СД | 0,38 (0,12-1,22) | 0,10 | 0,80 (0,26-2,46) | 0,70 |
АГ | 0,40 (0,06-2,88) | 0,40 | 0,54 (0,04-6,92) | 0,60 |
Курение | 0,08 (0,01-0,95) | 0,04 | 0,47 (0,08-2,83) | 0,40 |
Дислипидемия | 0,69 (0,25-1,88) | 0,50 | 0,80 (0,29-2,18) | 0,70 |
Анемия | 0,27 (0,07-1,02) | 0,05 | 0,53 (0,14-1,97) | 0,30 |
ФП | 2,21 (0,73-6,72) | 0,20 | 1,45 (0,44-4,84) | 0,50 |
СКФ | 0,98 (0,95-1,01) | 0,30 | 0,97 (0,94-1,01) | 0,12 |
ПИКС | 1,35 (0,49-3,73) | 0,60 | 0,50 (0,12-2,14) | 0,40 |
Инсульт в анамнезе | 0,42 (0,07-2,63) | 0,40 | 0,85 (0,37-3,66) | 0,35 |
Хронические заболевания легких | 2,21 (0,47-10,5) | 0,30 | 0,44 (0,07-2,61) | 0,40 |
Онкопатология | 5,96 (1,94-18,4) | <0,01 | 0,34 (0,03-4,13) | 0,40 |
ЧКВ в анамнезе | 0,73 (0,22-2,40) | 0,60 | 2,93 (0,65-13,3) | 0,20 |
АКШ в анамнезе | 0,45 (0,10-1,95) | 0,30 | 0,24 (0,41-2,25) | 0,35 |
EuroSCORE II | 0,86 (0,72-1,02) | 0,08 | 0,91 (0,75-1,12) | 0,40 |
STS-PROM | 1,22 (0,84-1,76) | 0,30 | 1,35 (1,02-1,79) | 0,04 |
ФВ ЛЖ | 1,03 (0,98-1,08) | 0,30 | 0,96 (0,91-1,02) | 0,20 |
ИММЛЖ | 1,01 (1,00-1,02) | 0,03 | 1,00 (0,99-1,02) | 0,50 |
Двухстворчатый АК | 1,23 (0,21-7,25) | 0,80 | 0,55 (0,04-6,79) | 0,60 |
Впервые возникшая ПБЛНПГ | 0,28 (0,07-1,10) | 0,07 | 1,77 (0,44-7,15) | 0,40 |
Сокращения: АГ — артериальная гипертензия, АК — аортальный клапан, АКШ — аортокоронарное шунтирование, ДИ — доверительный интервал, ИММЛЖ — индексированная масса миокарда левого желудочка, ИМТ — индекс массы тела, ЛЖ — левый желудочек, ОР — отношение рисков, ПБЛНПГ — полная блокада левой ножки пучка Гиса, ПИКС — постинфарктный кардиосклероз, ЧКВ — чрескожное коронарное вмешательство, СД — сахарный диабет, СКФ — скорость клубочковой фильтрации, ФВ — фракция выброса, ФП — фибрилляция предсердий.
Обсуждение
С момента внедрения процедуры ТИАК в современную клиническую практику достигнуты значительные успехи в развитии данной технологии как малоинвазивного метода лечения неоперабельных пациентов с выраженным АС.
Основные результаты представленного исследования следующие: 1) С момента выполнения первой процедуры ТИАК в нашем центре (2015г) отмечается тенденция к лечению пациентов промежуточного и низкого хирургического рисков; 2) Общая выживаемость пациентов составила 94%, 88%, 86% и 58% через 1, 3, 5 и 8 лет, соответственно. Свобода от сердечно-сосудистой смерти составила 97%, 90%, 78% и 61% через 1, 3, 5 и 8 лет, соответственно. За средний период наблюдения в 2,2 года кумулятивная свобода от имплантации постоянного ЭКС составила 89,4%, репротезирования — 98,8%; 3) Независимыми предикторами смерти от всех причин были мужской пол, курение, онкопатология и индексированная масса миокарда ЛЖ. Единственным независимым предиктором сердечно-сосудистой смерти в отдаленном периоде был хирургический риск по шкале STS-PROM.
Результаты данного одноцентрового ретроспективного исследования отражают современную клиническую практику ТИАК в крупном отечественном центре.
В рекомендациях ESC/EACTS по клапанным порокам сердца от 2012г ТИАК рекомендовалась только пациентам с выраженным симптоматическим АС, имеющим противопоказания к открытому кардиохирургическому вмешательству или лицам, которые имели высокий хирургический риск с предполагаемым риском ранней смертности >10% [11]. В рекомендациях AHA/ACC 2014г по клапанным порокам сердца уже можно отметить более низкое пороговое значение — 8% [12]. Действующие европейские клинические рекомендации 2021г рекомендуют хирургическое протезирование АК пациентам с EuroSCORE II/STS-PROM <4% и ТИАК — пациентам с EuroSCORE II/STS-PROM >8% [13]. Стоит отметить, что тенденция к лечению пациентов низкого и промежуточного хирургических рисков прослеживается в нашем центре с момента внедрения процедуры ТИАК в 2015г. Учитывая относительно стабильную динамику среднего возраста и хирургического риска пролеченных больных (рис. 1), можно предположить, что основным фактором, определяющим выбор метода лечения АС в пользу ТИАК, является именно возраст, а величина хирургического риска в нашей клинической практике, вероятно, несколько переоценивается. Частота процедурного успеха, процедурных и госпитальных осложнений (включая смертность, инсульт, имплантацию постоянного ЭКС) также согласуется с данными крупных регистровых исследований, посвященных ТИАК [14-16]. Несмотря на сопоставимую частоту больших сердечно-сосудистых осложнений, в нашей практике мы наблюдаем более длительное послеоперационное пребывание пациентов в стационаре, которое составило 9,7±6,2 дней.
Общая выживаемость пациентов в представленном исследовании составила 94%, 88%, 86% и 58% через 1, 3, 5 и 8 лет, соответственно, свобода от сердечно-сосудистой смерти — 97%, 90%, 78% и 61% через 1, 3, 5 и 8 лет, соответственно. Полученные результаты в целом соотносятся с данными мировой литературы. Ruparelia N, et al. представили результаты ТИАК у 829 пациентов с медианой наблюдения 1,6 лет. Свобода от сердечно-сосудистой смерти через 5 лет наблюдения составила 78,9% с общей выживаемостью 53% [14]. Стоит отметить, что популяция пациентов в данном регистре имела более высокий хирургический риск (Logistic EuroSCORE 22,7±16,8) и средний возраст (82,6±8,2 лет) в сравнении с представленным нами исследованием. Кроме того, процедура ТИАК включала в себя применение только биопротезов первого поколения. Данные Японского регистра ТИАК под руководством Hiroshi Kurazumi (n=171, биопротезы различных поколений) продемонстрировали несколько худшие результаты в отношении 5-летней выживаемости (48,9%) и сопоставимые результаты в отношении свободы от сердечно-сосудистой смерти (88%) [17]. Большая часть больных, аналогично нашим данным, была представлена лицами промежуточного хирургического риска (EuroSCORE II 4,9±4,2%), однако все также имели значительно больший возраст 85,1±5,2 лет.
Накопление хирургического опыта, активное внедрение пациент-ориентированных методик имплантации транскатетерных биопротезов, а также оптимизация послеоперационного ведения больных позволили достичь оптимальных результатов в отношении частоты нарушений атриовентрикулярной и внутрижелудочковой проводимости после ТИАК. Частота имплантации постоянного ЭКС на госпитальном этапе составила 7,4%, кумулятивная свобода от имплантации постоянного ЭКС в отдаленном периоде — 89,4%. Полученные данные превосходят результаты большинства одноцентровых регистров, в которых потребность в имплантации постоянного ЭКС после ТИАК на госпитальном этапе составляет ~13,4% [18].
После исключения случаев с госпитальной летальностью в результате многофакторного регрессионного анализа независимыми предикторами смерти от всех причин в отдаленном периоде были мужской пол, курение, онкопатология и индексированная масса миокарда ЛЖ. Отрицательная прогностическая роль мужского пола и онкопатологии в отношении отдаленной выживаемости пациентов после ТИАК была отмечена ранее в ряде крупных регистров [19-21]. Гипертрофия миокарда ЛЖ является классической адаптивной реакцией на перегрузку, вызванную АС, и независимо связана с неблагоприятными сердечно-сосудистыми событиями и смертностью у данной группы пациентов. Однако данные относительно влияния исходной гипертрофии миокарда ЛЖ на прогноз пациентов после ТИАК являются достаточно противоречивыми. В ряде исследований сообщалось, что гипертрофия ЛЖ у пациентов, перенесших ТИАК, ассоциируется с более высокими показателями как внутрибольничной, так и отдаленной летальности [22][23], тогда как в других работах подобной взаимосвязи выявлено не было [24].
На сегодняшний день имеется ряд инструментов для стратификации риска и прогнозирования клинических исходов у пациентов, направляемых на кардиохирургические вмешательства (EuroSCORE II, STS-PROM). Данные шкалы являются общепринятыми и валидизированы на большом количестве пациентов. Несмотря на то, что шкала STS-PROM изначально была внедрена с целью прогнозирования внутригоспитальной летальности, данный показатель в настоящем исследовании продемонстрировал прогностическую роль в отношении сердечно-сосудистой смерти и в отдаленном периоде (ОР 1,35, 95% ДИ: 1,02-1,79, p=0,04).
Ограничения исследования. Настоящее исследование имеет ряд важных ограничений. Во-первых, это ретроспективное обсервационное исследование, которое включило опыт только одного центра с относительно небольшиям объемом выборки, что может привести к систематическим ошибкам. Многоцентровый дизайн исследования мог бы дать более надежные результаты. Во-вторых, большая часть пациентов были отобраны кардиологической командой на основании множества субъективных факторов, а технические аспекты вмешательства (выбор типа биопротеза, необходимость вальвулодилатации, постдилатации и т. д.) определялись оперирующим хирургом. Также стоит отметить, что исследование включало пациентов, оперированных в разные периоды развития технологии ТИАК в нашем центре (с 2015 по 2023гг) с применением различных поколений биопротезов, что также могло повлиять на однородность выборки и отдаленные результаты.
Заключение
Наш опыт демонстрирует удовлетворительные отдаленные результаты ТИАК у пациентов с выраженным АС в отношении общей выживаемости, сердечно-сосудистой смерти, имплантации постоянного ЭКС и репротезирования. Независимыми предикторами смерти от всех причин были мужской пол, курение, онкопатология и индексированная масса миокарда ЛЖ. Единственным независимым предиктором сердечно-сосудистой смерти в отдаленном периоде был хирургический риск по шкале STS-PROM.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Cribier A, Eltchaninoff H, Bash A, et al. Percutaneous transcatheter implantation of an aortic valve prosthesis for calcific aortic stenosis: first human case description. Circulation. 2002;106(24):3006-8. doi:10.1161/01.cir.0000047200.36165.b8.
2. Smith CR, Leon MB, Mack MJ, et al. PARTNER Trial Investigators. Transcatheter versus surgical aortic-valve replacement in high-risk patients. N Engl J Med. 2011;364(23):2187-98. doi:10.1056/NEJMoa1103510.
3. Gleason TG, Reardon MJ, Popma JJ, et al. 5-year outcomes of self-expanding transcatheter versus surgical aortic valve replacement in high-risk patients. J Am Coll Cardiol. 2018;72(22):2687-96. doi:10.1016/j.jacc.2018.08.2146.
4. Баранов А. А., Крестьянинов О. В., Бадоян А. Г. и др. Непосредственные результаты транскатетерной имплантации аортального клапана при горизонтально ориентированном корне аорты. Патология кровообращения и кардиохирургия. 2023;27(2):54-65. doi:10.21688/1681-3472-2023-2-54-65.
5. Mack MJ, Leon MB, Thourani VH, et al. PARTNER 3 Investigators. Transcatheter Aortic-Valve Replacement in Low-Risk Patients at Five Years. N Engl J Med. 2023;389(21): 1949-60. doi:10.1056/NEJMoa2307447.
6. Forrest JK, Deeb GM, Yakubov SJ, et al. Evolut Low Risk Trial Investigators. 4-Year Outcomes of Patients With Aortic Stenosis in the Evolut Low Risk Trial. J Am Coll Cardiol. 2023;82(22):2163-5. doi:10.1016/j.jacc.2023.09.813.
7. Thyregod HGH, Jørgensen TH, Ihlemann N, et al. Transcatheter or surgical aortic valve implantation: 10-year outcomes of the NOTION trial. Eur Heart J. 2024;45(13):1116-24. doi:10.1093/eurheartj/ehae043.
8. Nashef SAM, Roques F, Sharples LD, et al. EuroSCORE II. Eur J Cardiothorac Surg. 2012; 41(4):734-44. doi:10.1093/ejcts/ezs043.
9. Shahian DM, O'Brien SM, Filardo G, et al. Society of Thoracic Surgeons Quality Measurement Task Force. The Society of Thoracic Surgeons 2008 cardiac surgery risk models: Part 1 — coronary artery bypass grafting surgery. Ann Thorac Surg. 2009;88(1 Suppl): S2-S22. doi:10.1016/j.athoracsur.2009.05.053.
10. Généreux P, Piazza N, Alu MC, et al. Valve Academic Research Consortium 3: updated endpoint definitions for aortic valve clinical research. Eur Heart J. 2021;42(19):1825-57. doi:10.1093/eurheartj/ehaa799.
11. Guidelines on the management of valvular heart disease (version 2012): the Joint Task Force on the Management of Valvular Heart Disease of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J. 2012;33:2451-96. doi:10.1093/eurheartj/ehs109.
12. Nishimura RA, Otto CM, Bonow RO, et al. 2014 AHA/ACC Guideline for the management of patients with valvular heart disease: executive summary. Circulation. 2014;129:2440-92. doi:10.1161/CIR.0000000000000029.
13. Vahanian A, Beyersdorf F, Praz F, et al. 2021 ESC/EACTS Guidelines for the management of valvular heart disease: developed by the Task Force for the management of valvular heart disease of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J. 2022;43:561-632. doi:10.1093/eurheartj/ehab395.
14. Ruparelia N, Latib A, Buzzatti N, et al. Long-Term Outcomes After Transcatheter Aortic Valve Implantation from a Single High-Volume Center (The Milan Experience). Am J Cardiol. 2016;117(5):813-9. doi:10.1016/j.amjcard.2015.12.014.
15. Giordano A, Mas-Peiro S, Fichtlscherer S, et al. Long-term outcomes following transcatheter aortic valve implantation with the Portico self-expanding valve. Clin Res Cardiol. 2024;113(1):86-93. doi:10.1007/s00392-023-02252-x.
16. Demal TJ, Weimann J, Ojeda FM, et al. Temporal changes of patient characteristics over 12 years in a single-center transcatheter aortic valve implantation cohort. Clin Res Cardiol. 2023;112(5):691-701. doi:10.1007/s00392-023-02166-8.
17. Kurazumi H, Suzuki R, Shirasawa B, et al. Early and Long-Term Outcomes of Transcatheter Aortic Valve Replacement for Selected Nonagenarians in Japan. Circ J. 2022;86(11): 1748-55. doi:10.1253/circj.CJ-21-0949.
18. Chakos A, Wilson-Smith A, Arora S, et al. Long term outcomes of transcatheter aortic valve implantation (TAVI): a systematic review of 5-year survival and beyond. Ann Cardiothorac Surg. 2017;6(5):432-43. doi:10.21037/acs.2017.09.10.
19. Maeda K, Kumamaru H, Kohsaka S, et al. A Risk Model for 1-Year Mortality After Transcatheter Aortic Valve Replacement From the J-TVT Registry. JACC Asia. 2022; 2(5):635-44. doi:10.1016/j.jacasi.2022.06.002.
20. Thogata H, Garikipati S, Reddy SS, et al. Long-Term Prognosis and Predictors of Mortality in Patients Undergoing Transcatheter Aortic Valve Replacement: A Retrospective Analysis. Cureus. 2023;15(8):e44432. doi:10.7759/cureus.44432.
21. Yamamoto M, Otsuka T, Shimura T, et al. Clinical risk model for predicting 1-year mortality after transcatheter aortic valve replacement. Catheter Cardiovasc Interv. 2021; 97(4):E544-E551. doi:10.1002/ccd.29130.
22. Duncan AI, Lowe BS, Garcia MJ, et al. Influence of concentric left ventricular remodeling on early mortality after aortic valve replacement. Ann Thorac Surg. 2008;85(6):2030-9. doi:10.1016/j.athoracsur.2008.02.075.
23. Ito N, Zen K, Takahara M, et al. Left ventricular hypertrophy as a predictor of cardiovascular outcomes after transcatheter aortic valve replacement. ESC Heart Fail. 2023;10(2): 1336-46. doi:10.1002/ehf2.14305.
24. Varshney AS, Manandhar P, Vemulapalli S, et al. Left Ventricular Hypertrophy Does Not Affect 1-Year Clinical Outcomes in Patients Undergoing Transcatheter Aortic Valve Replacement. JACC Cardiovasc Interv. 2019;12(4):373-82. doi:10.1016/j.jcin.2018.11.013.
Об авторах
А. А. БарановРоссия
Врач по рентгенэндоваскулярным диагностике и лечению, н.с.
Новосибирск
Конфликт интересов:
Нет
А. Г. Бадоян
Россия
К.м.н., врач по рентгенэндоваскулярным диагностике и лечению, н.с.
Новосибирск
Конфликт интересов:
Нет
Д. А. Хелимский
Россия
К.м.н., врач по рентгенэндоваскулярным диагностике и лечению, н.с.
Новосибирск
Конфликт интересов:
Нет
А. Ю. Цыденова
Россия
Врач по рентгенэндоваскулярным диагностике и лечению, н.с.; ассистент кафедры сердечно-сосудистой хирургии.
Новосибирск
Конфликт интересов:
Нет
Ш. Ш. Зайнобидинов
Россия
Врач по рентгенэндоваскулярным диагностике и лечению.
Новосибирск
Конфликт интересов:
Нет
В. А. Бобошко
Россия
К.м.н., зав. отделением анестезиологии-реанимации, врач-анестезиолог-реаниматолог.
Новосибирск
Конфликт интересов:
Нет
О. В. Крестьянинов
Россия
Д.м.н., руководитель научно-исследовательского отдела эндоваскулярной хирургии, врач по рентгенэндоваскулярным диагностике и лечению; профессор кафедры сердечно-сосудистой хирургии.
Новосибирск
Конфликт интересов:
Нет
Дополнительные файлы
- Накопление хирургического опыта, активное внедрение пациент-ориентированных методик имплантации транскатетерных биопротезов аортального клапана, а также оптимизация послеоперационного ведения больных, позволили достичь высоких показателей технического успеха процедуры транскатетерной имплантации аортального клапана.
- Представленный отечественный опыт транскатетерной имплантации аортального клапана по поводу выраженного аортального стеноза у 500 пациентов демонстрирует оптимальные отдаленные результаты в отношении общей выживаемости, сердечно-сосудистой смерти, имплантации постоянного электрокардиостимулятора и репротезирования.
Рецензия
Для цитирования:
Баранов А.А., Бадоян А.Г., Хелимский Д.А., Цыденова А.Ю., Зайнобидинов Ш.Ш., Бобошко В.А., Крестьянинов О.В. Отдаленные результаты транскатетерной имплантации аортального клапана: одноцентровое обсервационное исследование. Российский кардиологический журнал. 2024;29(12):6007. https://doi.org/10.15829/1560-4071-2024-6007. EDN: JOUOSO
For citation:
Baranov A.A., Badoyan A.G., Khelimsky D.A., Tsydenova A.Yu., Zainobidinov Sh.Sh., Boboshko V.A., Krestyaninov O.V. Long-term outcomes of transcatheter aortic valve implantation: a single-center observational study. Russian Journal of Cardiology. 2024;29(12):6007. (In Russ.) https://doi.org/10.15829/1560-4071-2024-6007. EDN: JOUOSO
JATS XML

















































