Перейти к:
Значение пропротеиновой конвертазы субтилизин-кексинового типа 9 и маркеров воспаления в диагностике каротидного атеросклероза у мужчин с артериальной гипертензией
https://doi.org/10.15829/1560-4071-2024-5939
EDN: GSYDBH
Аннотация
Пропротеин-конвертаза субтилизин/кексин тип 9 (PCSK9) участвует в липидном обмене, оказывает местное и системное действие в иммунорегуляции и в атерогенезе у пациентов с артериальной гипертензией.
Цель. Персонификация стратификации сердечно-сосудистого риска (ССР) с учетом диагностического значения PCSK9 и маркеров воспаления у мужчин с артериальной гипертензией и каротидным атеросклерозом.
Материал и методы. Включены в научную работу 162 человека мужского пола, с гипертонической болезнью I-III стадии, различного ССР. Всем пациентам проведено: общеклинические обследования со сбором жалоб и анамнеза, физикальное обследование с антропометрией. Лабораторно: клинический анализ крови осуществлялся с определением лейкоцитарной формулы и скоростью оседания эритроцитов. Биохимические показатели: фибриноген, С-реактивный белок (СРБ), общий холестерин, холестерин липопротеинов низкой плотности, триглицериды, глюкоза крови, креатинин сыворотки крови. Скорость клубочковой фильтрации и тест на микроальбуминурию. Иммуноферментным методом определены PCSK9, интерлейкины (IL)-8, 10 сыворотки крови. В комплекс исследований включены инструментальные исследования: суточный мониторинг артериального давления, исследование брахиоцефальных артерий с определением толщины комплекса интима-медиа (ТКИМ) и степени стеноза каротидных артерий. Пациенты разделены по уровню PCSK9 на 3 группы.
Результаты. Анализ традиционных факторов ССР и цитокинового статуса по IL-8 и IL-10 у пациентов показал обратную связь возраста и IL-8 (r=-0,230; р=0,036), IL-8/IL-10 (r=-0,309; р=0,005); наследственности и IL-8/IL-10 (r=-0,423; р=0,001). Взаимосвязи факторов ССР и PCSK9: анализ всего массива данных выявил прямую взаимосвязь возраста мужчин (r=0,220, p=0,032), систолического и диастолического артериального давления (r=0,230, p=0,033; r=0,260, p=0,015) и PCSK9; обратные взаимосвязи PCSK9 с наследственностью (r=-0,286, p=0,011). Индикаторы воспаления: СРБ и скорость оседания эритроцитов были взаимосвязаны с уровнем IL-10, что ассоциируется с активацией противовоспалительной активности (r=0,78; р=0,02; r=0,78; р=0,02, соответственно). Цитокиновый дисбаланс IL-8/IL-10 был наиболее выражен у пациентов с суточным профилем систолического артериального давления "night-peaker" (р=0,02). У пациентов c утолщением ТКИМ и атеросклеротическими бляшками отмечался статистически значимо самый высокий уровень PCSK9 (р=0,006). Уровень IL-8 был статистически значимо выше с неизмененным ТКИМ (р=0,01).
Заключение. У пациентов с высоким уровнем PCSK9 отмечаются тесные взаимосвязи факторов риска артериальной гипертензии и цитокинового дисбаланса. Степень выраженности атеросклероза брахиоцефальных артерий статистически значимо зависит от повышения уровня PCSK9 (р=0,006) и маркеров воспаления (IL-10) (р=0,044).
Для цитирования:
Вуколова Ю.Ю., Губарева Е.Ю., Губарева И.В., Германова О.А., Киселева Г.И. Значение пропротеиновой конвертазы субтилизин-кексинового типа 9 и маркеров воспаления в диагностике каротидного атеросклероза у мужчин с артериальной гипертензией. Российский кардиологический журнал. 2024;29(8):5939. https://doi.org/10.15829/1560-4071-2024-5939. EDN: GSYDBH
For citation:
Vukolova Yu.Yu., Gubareva E.Yu., Gubareva I.V., Germanova O.A., Kiseleva G.I. Value of proprotein convertase subtilisin/kexin type 9 and inflammatory markers in the diagnosis of carotid atherosclerosis in hypertensive men. Russian Journal of Cardiology. 2024;29(8):5939. (In Russ.) https://doi.org/10.15829/1560-4071-2024-5939. EDN: GSYDBH
Сердечно-сосудистый риск (ССР) связан не только с повышенным уровнем артериального давления (АД), но и с гиперхолестеринемией и, соответственно, с атеросклеротическими осложнениями. В мире 1,76 млрд человек живут с гиперхолестеринемией 1. Гендерное распределение в российской популяции по гиперхолестеринемии — 56,3% случаев у мужчин и 58,4% женщин, по гиперлипопротеинемии — 13,2% и 15,2%, соответственно, по данным ЭССЕ-РФ [1].
Исследование Multiple Risk Factor Intervention Trial подтвердило связь между артериальной гипертензией (АГ) и атеросклеротическим поражением различных сосудистых бассейнов [2].
Атерогенез подразумевает различные патофизиологические пути, и новые данные дают понимание, что пропротеин-конвертаза субтилизин-кексинового типа 9 (PCSK9) вовлечен в патогенез различных сосудистых заболеваний. Научные изыскания показывают опосредованную роль PCSK9 в регуляции липидного обмена секретируемого белка, оказывая местное и системное действие в иммунорегуляции, как убедительно продемонстрировали Ricci C, et al. PCSK9 влияет на макрофаги и усиление экспрессии провоспалительных интерлейкинов (IL). В свою очередь, как экспериментальные, так и клинические данные подтверждают концепцию о том, что системное воспаление вызывает увеличение экспрессии PCSK9 [3][4]. Понимание роли PCSK9 в наличии каротидного атеросклероза у пациентов с АГ с точки зрения его взаимосвязи с маркерами воспаления ограниченно и все еще требуются испытания для выяснения диагностического и прогностического значения PCSK9, в т. ч. у пациентов с АГ.
Цель исследования: персонификация стратификации ССР с учетом диагностического значения PCSK9 и маркеров воспаления у мужчин с АГ и каротидным атеросклерозом.
Материал и методы
Испытание проведено на кафедре внутренних болезней ФГБОУ ВО "СамГМУ" МЗ РФ на базе кардиологического отделения № 1 с центром АГ ЧУЗ "КБ "РЖД-Медицина". Для однородности выборки все обследуемые были мужского пола. Включены в научную работу 162 человека.
Критериями включения в эксперимент являлись мужской пол, диагноз гипертонической болезни I-III стадии (по классификации ESC 2018г) различного ССР с достигнутым целевым уровнем АД; возраст 30-65 лет, наличие письменного согласия пациента на участие в исследовании.
Критерии невключения: вторичная АГ; острое нарушение мозгового кровообращения и перенесенный инфаркт миокарда в течение 6 мес. перед обследованием; хроническая сердечная недостаточность II-III стадии, функциональный класс по NYHA III-IV; нарушение ритма сердца (фибрилляция предсердий), сахарный диабет 1 типа; семейная гиперхолестеринемия; аутоиммунные заболевания; хронический гепатит, цирроз печени; хроническая болезнь почек (С3б-С5); отказ пациента от участия. Всем пациентам проведены общеклинические обследования со сбором жалоб и анамнеза, физикальное обследование с антропометрией. Клинический анализ крови осуществлялся с определением лейкоцитарной формулы и скоростью оседания эритроцитов (СОЭ по Вестергрену, мм/ч). Проведено определение биохимических показателей крови: фибриногена (г/л), С-реактивного белка (СРБ, мг/л), общего холестерина (ОХС, ммоль/л), липопротеина низкой плотности (ЛНП, ммоль/л), триглицеридов (ммоль/л), глюкозы крови (ммоль/л), креатинина сыворотки крови (мкмоль/л). Скорость клубочковой фильтрации (мл/мин/1,73 м2) рассчитана по формуле CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration, 2009). Диагностика гипертонической нефропатии проводилась с помощью теста на микроальбуминурию (мг/г).
Иммуноферментным методом определены PCSK9 (нг/мл), IL-8, IL-10 сыворотки крови (пг/мл). В комплекс исследований включены инструментальные методы: суточный мониторинг АД (СМАД) и исследование брахиоцефальных артерий (БЦА) с определением толщины комплекса интима-медиа (ТКИМ) и степени стеноза каротидных артерий на аппарате "Philips EN Visor". При разделении пациентов по уровню PCSK9 на 3 группы предварительно вычислили процентили (33 и 66): 33 процентиль — 287,90 нг/мл; 66 процентиль — 480,00 нг/мл.
1 группа (n=53) медиана уровня PCSK9 — 208,26 (50,60); min — 108; max — 280 нг/мл;
2 группа (n=47) медиана уровня PCSK9 — 392,13 (60,37); min — 290; max — 470 нг/мл;
3 группа (n=62) медиана уровня PCSK9 — 641,61 (130,19); min — 480; max — 860 нг/мл.
Сбор и хранение данных осуществляли в пакете Microsoft Excel. Для статистического анализа использовали специализированное программное обеспечение: SPSS 21 (лицензия № 20130626-3).
Научная работа была выполнена в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации. Протокол исследования был одобрен Комитетом по биоэтике при ФГБОУ ВО "СамГМУ" МЗ РФ. До включения в эксперимент у всех участников было получено письменное информированное согласие.
Результаты
Группы пациентов были сопоставимы по сопутствующим заболеваниям и по получаемой терапии (р>0,05). Пациенты с сахарным диабетом 2 типа получали сахароснижающую терапию и достигли целевых значений гликированного гемоглобина. В таблице 1 представлена характеристика пациентов.
Данные обследованных пациентов в зависимости от уровня PCSK9 были сопоставимы по уровню IL-8, IL-10 (р≥0,05) и представлены в таблице 2.
Мы изучили взаимосвязи факторов ССР и PCSK9: анализ всего массива данных выявил прямую взаимосвязь возраста мужчин (r=0,220, p=0,032), систолическое АД (САД) (r=0,230, p=0,033), диастолическое АД (ДАД) (r=0,260, p=0,015) и PCSK9; обратные взаимосвязи PCSK9 с наследственностью (r=-0,286, p=0,011). Наследственность и курение также определили свой вклад в инициацию воспаления — выявлены прямые взаимосвязи с СРБ и уровнем фибриногена (r=0,30; р=0,04; r=0,36; р=0,01). При оценке процесса неспецифического воспаления мы выявили обратные взаимосвязи нейтрофильно-лимфоцитарного отношения (НЛО) с ОХС и ЛНП (r=-0,55; р=0,0001; r=-0,47; р=0,001, соответственно).
Анализ традиционных факторов ССР и цитокинового статуса по IL-8 и IL-10 у обследуемых мужчин показал обратную связь возраста и IL-8 (r=-0,230; р=0,036), IL-8/IL-10 (r=-0,309; р=0,005); наследственности и IL-8/IL-10 (r=-0,423; р=0,001). Индикаторы воспаления, такие как СРБ и СОЭ, были взаимосвязаны с уровнем IL-10, что ассоциируется с активацией противовоспалительной активности (r=0,78; р=0,02; r=0,78; р=0,02, соответственно).
Мы изучили распределение уровня лабораторных маркеров (IL-8, IL-10) в зависимости от ССР обследуемых (рис. 1) и установили, что уровень PCSK9 статистически значимо повышался с ростом ССР. С изменением ССР изменялся и цитокиновый дисбаланс: IL-8 преобладал у пациентов с высоким ССР, IL-10 — с очень высоким ССР.
Анализ результатов СМАД обследуемых показал, что САД, ДАД, пульсовое АД в дневное время статистически незначимо отличались во всех группах (р>0,05). В 3 группе показатели САД и ДАД во время бодрствования и сна, индекс времени САД и ДАД — максимальные. Показатели СМАД пациентов не различались в зависимости от статуса курения, длительности АГ, индекса массы тела и степени ожирения.
ДАД во время сна и степень снижения ДАД статистически значимо выше у обследуемых 3 группы в сравнении с 1 группой (рис. 2). НЛО ассоциировано с уровнем САД в ночное время (r=0,42; р=0,02) и снижением ДАД в ночное время (r=-0,39; р=0,03). Ночное снижение ДАД и САД взаимосвязаны с уровнем СРБ (r=0,42; р=0,02; r=0,56; р=0,01, соответственно), уровень фибриногена ассоциирован со степенью снижения САД в ночное время (r=0,66; р=0,01). Обнаруженные связи маркеров неспецифического воспаления и результатов СМАД, возможно, отражают эндотелиальную дисфункцию в развитии АГ и атерогенеза.
У пациентов 3 группы неизмененный суточный профиль ДАД определялся чаще (p<0,05) на 28,3% и 22,2%, чем у пациентов других групп.
Цитокиновый дисбаланс IL-8/IL-10 был наиболее выражен у пациентов с суточным профилем САД "night-peaker" (р=0,02): IL-10 был наибольшим, снижен уровень IL-8 в сравнении с пациентами с другим суточным профилем САД (рис. 3), что свидетельствует об участии иммунологических механизмов в формировании данного хронотипа АГ.
Установление наличия атеросклеротической бляшки (АСБ), опосредованной АГ, согласно ESC по ведению больных с АГ 2018 и 2021гг [5], рекомендуется для оценки поражения органов.
В нашем эксперименте ТКИМ обследуемых групп статистически значимо не отличалась и составляла, соответственно: 1 группа — 1,2 (0,33) мм; 2 группа — 1,22 (0,28) мм; 3 группа — 1,19 (0,22) мм. Корреляционный анализ данных выявил взаимосвязи ТКИМ с возрастом (r=0,763; р=0,0001); с длительностью АГ (r=0,377; р=0,002); с уровнем глюкозы крови (r=0,240; р=0,049); Вариабельность ДАД (r=-0,657; р=0,039) и скорость клубочковой фильтрации (r=-0,432; р=0,001) обратно взаимосвязаны с ТКИМ. Для PCSK9 мы не обнаружили корреляции с ТКИМ.
Анализируя характер изменений ТКИМ в 1 группе, мы выявили, что БЦА не изменены в 28,3% (15/53) случаев, ТКИМ утолщена в 20,75% (11/53); АСБ обнаружены в 50,9% (27/53) случаев. Во 2 группе — БЦА не изменены в 17,4% (8/47) случаев, утолщение ТКИМ — 30,4% (14/47); АСБ — 52,2% (24/47). В 3 группе — БЦА не изменены в 9,7% (6/62) случаев, утолщение ТКИМ — 37,1% (23/62); наличие АСБ — 53,2% (33/62 случаев, их них 9,1% (6/62) — со стенозом >50%) (рис. 4). То есть более высокий уровень PCSK9 может быть ассоциирован с более распространенным и тяжелым поражением БЦА.
Мы изучили особенности уровня PCSK9 и IL в зависимости от типа изменений ТКИМ. У пациентов c утолщением ТКИМ и АСБ отмечался статистически значимо самый высокий уровень PCSK9 (р=0,006). Уровень IL-8 был статистически значимо выше у пациентов с неизмененным ТКИМ (р=0,01), а уровень IL-10 статистически выше у пациентов с АСБ (р=0,4).
При внутригрупповом анализе выявлено: во 2 группе пациентов с нормальной ТКИМ статистически значимо увеличен IL-8 в сравнении с пациентами с утолщением ТКИМ и АСБ (р=0,04); в 3 группе у пациентов с утолщением ТКИМ уровень IL-10 статистически значимо ниже в сравнении с пациентами с наличием АСБ в БЦА (р=0,04), (табл. 3).
У пациентов с АСБ >50% были самые высокие показатели ночного снижения ДАД и пульсовое АД (рис. 5).
Мы использовали многофакторный анализ при математическом моделировании для подтверждения роли PCSK9 и факторов воспаления в наличии каротидного атеросклероза у пациентов с АГ. При изучении всех параметров рассчитаны тесты по предсказуемой ценности положительного результата (пациенты с АГ с высоким риском каротидного атеросклероза) и предсказуемой ценности отрицательного результата (пациенты с АГ с низким риском каротидного атеросклероза). Переменные, вошедшие в модель: PCSK9, IL-8, ЛНП. Апробация данного способа прогнозирования проведена у 162 пациентов, в возрасте от 25 до 65 лет, с установленным диагнозом гипертоническая болезнь. Чувствительность (Se) — 75%; специфичность (Sp) — 71% представлено в виде ROC-кривой; отношение шансов 1,63 (95% доверительный интервал: 1,01-2,61); AUC — 0,79. На основе математической модели разработана программа и калькулятор "Прогнозирование каротидного и коронарного атеросклероза у пациентов с артериальной гипертонией" (Свидетельство о государственной регистрации программы для ЭВМ № 2020617886 от 15.07.2020).
Таблица 1
Характеристика групп обследованных
Параметры Группы | 1 группа (n=53) | 2 группа (n=47) | 3 группа (n=62) | p-значение, |
Возраст, годы (М (SD)) | 47,81 (12,18) | 49,08 (8,87) | 50,09 (8,13) | 0,46 |
Табакокурение (в прошлом или настоящем), k/N (%) | 28 (52,8%) | 22 (46,8%) | 28 (46,7%) | 0,77 |
Отягощенная наследственность по АГ, k/N | 19 | 18 | 15 | 0,22 |
Стаж АГ, годы (М (SD)) | 5,17 (4,82) | 6,31 (4,11) | 5,08 (3,51) | 0,41 |
ССР, k/N Средний Высокий Очень высокий | 26 (49,1%) 5 (9,4%) 22 (41,5%) | 27 (57,4%) 6 (12,8%) 14 (29,8%) | 35 (56,5%) 8 (12,9%) 19 (30,6%) | 0,71 |
Стадии АГ, k/N (%) I II III | 12 (22,6%) 17 (32,1%) 24 (45,3%) | 5 (10,6%) 27 (57,4%) 15 (31,9%) | 8 (12,9%) 32 (51,6%) 22 (35,5%) | 0,09 |
САД, мм рт.ст., (М (SD)) | 126,54 (14,47) | 126,65 (11,21) | 130,4 (8,41) | 0,16 |
ДАД, мм рт.ст., (М (SD)) | 77,11 (8,6)* | 79,97 (7,63) | 82,77 (7,1)* | 0,001 р1-2=0,08 р2-3=0,06 р1-3=0,003 |
ПАД, мм рт.ст., (М (SD)) | 49,2 (10,9) | 46,5 (9,4) | 47,3 (8,8) | 0,35 |
ИМТ, кг/м2 (М (SD)) | 26,87 (3,45) | 27,86 (3,87) | 27,78 (4,37) | 0,35 |
ХС общий, ммоль/л, (М (SD)) | 4,93 (0,9) | 5,11 (1,1) | 5,25 (1,06) | 0,30 |
ХС-ЛНП, ммоль/л, (М (SD)) | 3,24 (0,92) | 3,46 (0,98) | 3,54 (1,06) | 0,21 |
ТГ, ммоль/л (М (SD)) | 1,61 (0,85)* | 1,57 (1,01) | 1,31 (0,07)* | р1-2=0,8 р2-3=0,1 р1-3=0,02 |
Глюкоза, ммоль/л (М (SD)) | 5,49 (0,84) | 5,56 (1,33) | 5,44 (0,71) | 0,82 |
МАУ (М (SD)), мг/г | 32,08 (18,92) | 27,32 (15,37) | 33,35 (19,5) | 0,47 |
СКФ (М (SD)), мл/мин/1,73 м2 | 93,43 (16,93) | 89,82 (15,8) | 93,93 (14,84) | 0,36 |
Примечание: * — статистически значимые различия между группами.
Сокращения: АГ — артериальная гипертензия, ДАД — диастолическое артериальное давление, ИМТ — индекс массы тела, МАУ — микроальбуминурия, ПАД — пульсовое артериальное давление, САД — систолическое артериальное давление, СКФ — скорость клубочковой фильтрации, ССР — сердечно-сосудистый риск, ТГ — триглицериды, ХС — холестерин, ХС-ЛНП — холестерин липопротеинов низкой плоскости, k/N — абсолютное количество при указании процентного содержания.
Таблица 2
Уровень PCSK9 и маркеров воспаления в изучаемых группах
Параметры Группы | 1 группа (n=53), | 2 группа (n=47), | 3 группа (n=62), | р-значение, |
PCSK9, нг/мл | 207,0 (170,0;250,0)* | 400,0 (330,0;440,0)* | 620,0 (520,0;760,0)* | р1-2=0,0001 р2-3=0,0001 р1-3=0,0001 |
Лейкоциты, 109/л | 6,46 (6,0;7,0) | 7,0 (6,0;8,9) | 6,5 (5,5;8,5) | р=0,1 |
Нейтрофилы, % | 53,8 (51,2;57,0) | 52,5 (50,0;61,9) | 54,3 (49,7;59,8) | р=0,5 |
Лимфоциты, % | 33,6 (31,6;34,9) | 33,5 (27,7;39,9) | 33,3 (30,5;37,8) | р=0,2 |
НЛО | 1,58 (1,48;1,75) | 1,56 (1,27;1,96) | 1,59 (1,27;1,96) | р=0,6 |
СРБ, мг/л | 1,2 (0,85;5,3) | 1,7 (0,6;2,9) | 1,45 (0,8;2,8) | р=0,1 |
Фибриноген, г/л | 3,5 (3,1;3,9)* | 3,4 (2,4;3,7) | 2,8 (2,4;3,3)* | р1-2=0,6 р1-3=0,02 р2-3=0,1 |
СОЭ, мм/ч | 7,0 (3,0;12,0) | 7,0 (4,0;13,0) | 8,0 (5,0;13,0) | р=0,4 |
IL-8, пг/мл | 3,64 (2,45;4,95) | 4,20 (2,80;5,75) | 3,5 (2,60;4,0) | р=0,1 |
IL-10, пг/мл | 3,35 (2,35;4,86) | 3,20 (1,75;4,40) | 4,4 (3,65;6,50) | р=0,3 |
Отношение IL-8/IL-10 | 0,93 (0,54;1,61) | 1,2* (0,57;1,96) | 0,6* (0,46;0,96) | р1-2=0,07 р2-3=0,04 р1-3=0,2 |
Примечание: * — статистически значимые различия между группами.
Сокращения: НЛО — нейтрофильно-лимфоцитарное отношение, СОЭ — скорость оседания эритроцитов, СРБ — С реактивный белок, IL-8, -10 — интерлейкины -8, -10, PCSK9 — пропротеин-конвертаза субтилизин/кексин тип 9.
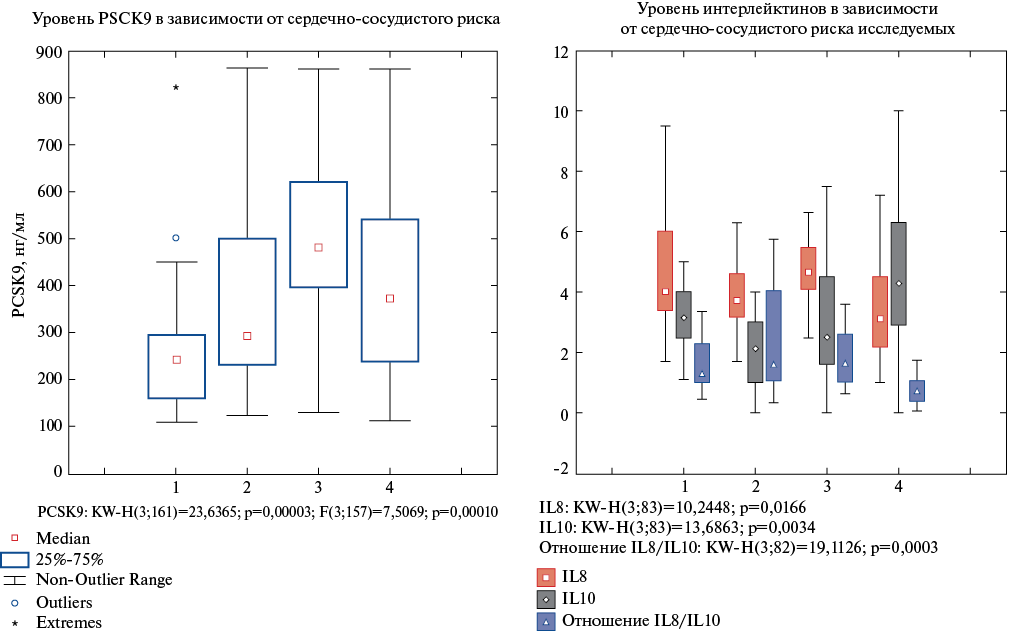
Рис. 1. Уровни PCSK9 и IL-8, IL-10 в зависимости от ССР у пациентов с АГ, где 1 — низкий риск, 2 — средний риск, 3 — высокий риск, 4 — очень высокий риск.
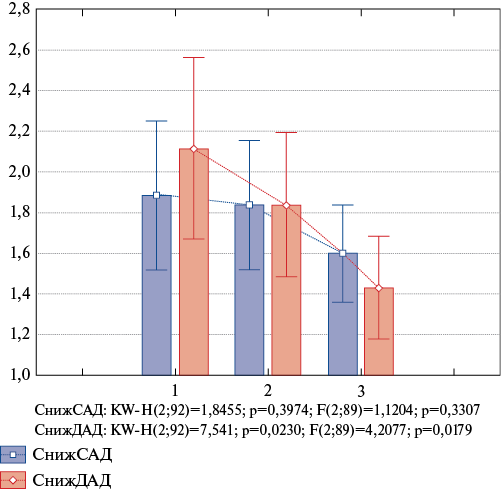
Рис. 2. Показатели степени снижения САД и ДАД (мм рт.ст.) в исследуемых группах.
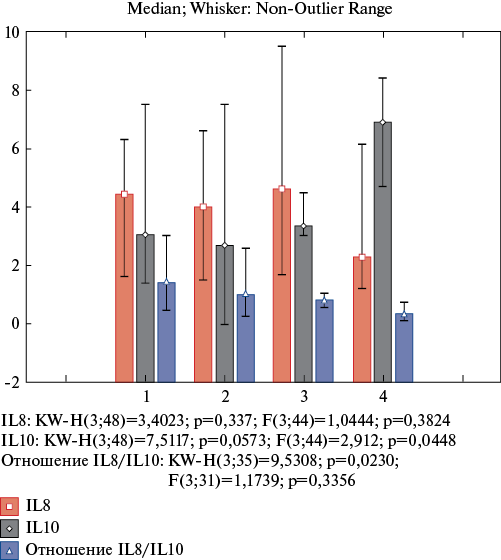
Рис. 3. Уровень цитокинового статуса (пг/мл) в зависимости от типа суточного профиля САД (мм рт.ст.), где 1 — dipper; 2 — non-dipper; 3 — over-dipper; 4 — night-peaker.
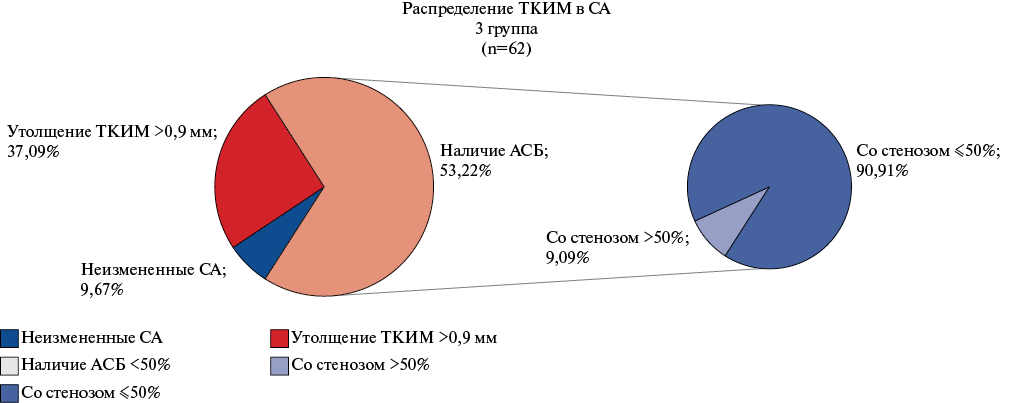
Рис. 4. Распределение изменения ТКИМ в зависимости от PCSK9 в 1-3 группах.
Сокращения: АСБ — атеросклеротическая бляшка, СА — сонные артерии, ТКИМ — толщина комплекса интима-медиа.
Таблица 3
Показатели PCSK9 (нг/мл), IL-8, -10 (пг/мл) в зависимости от изменений ТКИМ (мм) в изучаемых группах
Лабораторные параметры по группам/состояние БЦА | Норма ТКИМ (A) | Утолщение ТКИМ (B) | Наличие АСБ в БЦА (C) | p-значение t-test | |
1 группа, n=53 | PCSK9 нг/мл, Me (Q1; Q3) | 200 (160;240) | 207 (180;250) | 238 (170;260) | рA-B=0,5 рA-C=0,4 рB-C=0,9 |
IL-8 пг/мл, Me (Q1; Q3) | 3,65 (3,20;4,60) | 5,5 (2,35;6,2) | 3,37 (2,2;4,5) | рA-B=0,1 рA-C=0,7 рB-C=0,4 | |
IL-10 пг/мл, Me (Q1; Q3) | 2,80 (2,0;4,0) | 4,3 (2,7;7,5) | 3,4 (2,3;5,0) | рA-B=0,1 рA-C=0,3 рB-C=0,9 | |
IL-8/IL-10, Me (Q1; Q3) | 1,14 (0,9;1,61) | 0,78 (0,54;1,2) | 0,87 (0,5;1,5) | рA-B=0,7 рA-C=0,8 рB-C=0,8 | |
2 группа, n=47 | PCSK9 нг/мл, Me (Q1; Q3) | 360 (290;455) | 420 (375;420) | 400 (312;460) | рA-B=0,5 рA-C=0,9 рB-C=0,4 |
IL-8 пг/мл, Me (Q1; Q3) | 7,6 (4,75;19,25)* | 4,7 (4,2;6,3) | 3,0 (2,2;5,5)* | рA-B=0,1 рA-C=0,04 рB-C=0,7 | |
IL-10 пг/мл, Me (Q1; Q3) | 2,07 (1,06;3,16) | 2,6 (2,1;4,0) | 3,65 (2,1;6,3) | рA-B=0,1 рA-C=0,9 рB-C=0,3 | |
IL-8/IL-10, Me (Q1; Q3) | 9,6 (9,6;9,6) | 1,06 (0,81;1,3) | 1,11 (0,4;2,1) | рA-B=0,06 рA-C=0,06 рB-C=0,9 | |
3 группа, n=62 | PCSK9 нг/мл, Me (Q1; Q3) | 660 (540;820) | 620 (500;740) | 820 (520;860) | рA-B=0,9 рA-C=0,05 рB-C=0,05 |
IL-8 пг/мл, Me (Q1; Q3) | 4,0 (4,0;4,0) | 3,4 (3,4;3,4) | 3,5 (2,6;4,0) | рA-B=0,6 рA-C=0,6 рB-C=0,9 | |
IL-10 пг/мл, Me (Q1; Q3) | 4,0 (4,0;4,0) | 0,1 (0;1,0)* | 5,4 (4,4;6,5)* | рA-B=0,9 рA-C=0,8 рB-C=0,04 | |
Примечание: * — статистически значимые различия между группами.
Сокращения: АСБ — атеросклеротические бляшки, БЦА — брахиоцефальные артерии, ТКИМ — толщина комплекса интима-медиа, IL-8, -10 — интерлейкины -8, -10, PCSK9 — пропротеин-конвертаза субтилизин/кексин тип 9.
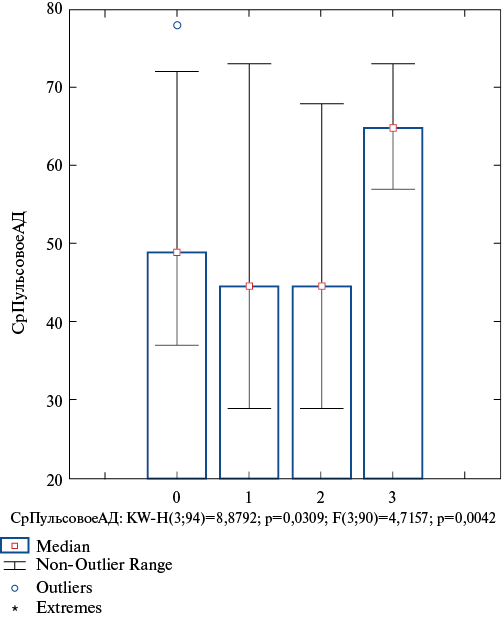
Рис. 5. Показатели снижения среднего пульсового АД (мм) с различными типами изменения ТКИМ (мм), где 0 — нет увеличения ТКИМ; 1 — утолщение ТКИМ; 2 — наличие АСБ <50%; 3 — наличие АСБ >50%.
Обсуждение
В нашем испытании мужчины с АГ были распределены на 3 группы по уровню PCSK9. Как известно, PCSK9 играет важную роль в деградации рецепторов ЛНП, тем самым повышая уровень ЛНП и, соответственно, увеличивая ССР. Несмотря на сопоставимость уровней ОХС и ЛНП обследуемых пациентов (р>0,05), значения их в группах превышали целевые и оценивались как фактор риска у пациентов с АГ.
Наши данные не противоречат результатам Mayne IJ, et al. (2013) [6]. В дополнение, Рагино Ю. И. и др. определили, что более высокий уровень PCSK9 соответствует высокому уровню как ОХС, так и ЛНП [7][8].
Пропротеин, по данным исследователей, представлен в широком диапазоне физиологических функций, а именно, в липидном, углеводном обменах, в инициации и регуляции воспаления, в виде влияния на уровень АД, участия в канцерогенезе, нейрокогнитивной дисфункции и неблагоприятных сердечно-сосудистых осложнениях [9]. Влияние факторов риска и связь с маркерами воспаления, хронотипом АД пациентов, каротидным и коронарным атеросклерозом и PCSK9 в российской популяции исследованы недостаточно широко. В результате анализа факторов риска обследуемых с АГ, мы получили доказательства их взаимосвязи с PCSK9. Среди пациентов 1 группы выявлен самый высокий процент курильщиков, в 3 группе — наименьший (р=0,03). По данным Бенимецкой К. С. и др. (2019), содержание PCSK9 выше у пациентов со статусом курения, чем в выборке некурящих (r=0,115; p=0,01) [10]. В нашем исследовании таких данных не получено. Наш результат показал, что группы пациентов статистически не значимо отличались по возрасту (р=0,09), отягощенной наследственности и уровню САД, однако ДАД было статистически значимо выше в 3 группе, в сравнении с 1 группой. При проведении корреляционного анализа нами была получена прямая слабая связь между САД (r=0,230, p=0,033), ДАД (r=0,260, p=0,015) и PCSK9. ДАД было наибольшим в группе с высоким уровнем PCSK9. По данным Рагино Ю. И. и др. (2017), в российской популяции взаимосвязи между PCSK9 и уровнями CАД и ДАД не выявлено, но ассоциация с наличием гипертонии убедительно показана [7]. Таким образом, артериальная гипертония является важным и независимым предиктором повышения концентрации PCSK9.
Мы изучили распределение уровня лабораторных маркеров в зависимости от ССР обследуемых пациентов и установили, что уровень PCSK9 статистически значимо повышался с ростом ССР (рис. 1).
Повышенный ССР при АГ реализуется посредством разнообразных патофизиологических влияний. Воздействие на эпителиальные натриевые каналы регулирует АД посредством PCSK9. Регуляция пропротеином эпителиальных натриевых каналов и рецепторов ЛНП одинакова, но риск АГ повышается при увеличении почечной абсорбции Na+ и объема циркулирующей крови при снижении экспрессии PCSK9. Повышение функции PCSK9 приводит к деградации рецептора ЛНП и увеличению ЛНП, т. е. регуляция происходит посредством разных сайтов связывания, но результат влияния на ССР противоположный [11]. Таким образом, благоприятно снижение функции PCSK9, предотвращая влияние на липидный обмен и ССР и, напротив, не благоприятно в отношении влияния на рост АД. Противоречивость в полученных исследованиях и объясняет актуальность и интерес к изучению связи АД и PCSK9.
Мы изучили данные, полученные при мониторировании АД у пациентов с различным уровнем PCSK9, т. к. суточный профиль АД вносит существенный вклад в развитие и прогрессирование ассоциированного с АГ поражения органов и ассоциированных клинических состояний и, анализируя актуальную информацию в научной литературе, не обнаружили работ с анализом показателей СМАД и уровнем PCSK9 [10][12][13].
Наш эксперимент выявил, что у пациентов с более высокими показателями PCSK9 степень ночного снижения ДАД более выражена, в сравнении с группой с "низкими" значениями PCSK9, чаще регистрировался нормальный суточный профиль САД и ДАД. Однако при распределении изучаемых лабораторных маркеров по типу изменений суточного профиля АД, мы обнаружили, что уровень PCSK9 и IL-8 не различался в зависимости от типа суточного профиля АД. Уровень IL-10 был наибольшим у пациентов с суточным профилем САД "night-peaker" и наиболее выражен цитокиновый дисбаланс IL-8/IL-10. По данным Chen Y, et al. (2018), у пациентов с гипертонией "non-dipper" был повышен индекс массы левого желудочка, более высокая распространенность эксцентрической и концентрической гипертрофии левого желудочка, более выраженные нарушения диастолической и систолической функции левого желудочка и жесткость периферических артерий, в сравнении с "dipper" гипертонией [14]. Рассинхронизация суточного профиля и обмена веществ в организме способствует развитию сердечно-сосудистых заболеваний, в т. ч. атеросклероза и тромбоза. Суточный профиль АД участвует в контроле воспалительных процессов и метаболизма, что может влиять на атерогенез и атеротромбоз [13][15].
Процесс системного воспаления в совокупности с эндотелиальной дисфункцией является важнейшим патогенетическим механизмом у пациентов с АГ. Каскад воспалительных реакций, протекающих в стенке сосуда с провоспалительным и прооксидантным действием, увеличивает ССР. Маркеры системного неспецифического воспаления (НЛО, СОЭ, СРБ, фибриноген), провоспалительный IL-8 имеют определенную предикторную ценность. IL-8 непосредственно участвует в активации нейтрофилов, хемотаксисе Т-лимфоцитов, ангиогенезе. В нашем исследовании у пациентов в зависимости от уровня PCSK9 уровни лейкоцитов, нейтрофилов, лимфоцитов, НЛО, а также фибриноген, СРБ и СОЭ статистически значимо не отличались. Отношение IL-8/IL-10, отражающее цитокиновый дисбаланс, было максимальным у пациентов 2 группы и статистически значимо выше в сравнении с пациентами 3 группы с максимальным уровнем PCSK9.
Мы провели анализ взаимосвязи уровня PCSK9, маркеров воспаления и изменений артерий каротидного бассейна и выявили, что степень выраженности атеросклероза БЦА статистически значимо зависит от уровня PCSK9 (р=0,006). Уровень IL-8 был статистически значимо выше у пациентов с неизмененным ТКИМ, а уровень IL-10 статистически незначимо выше у пациентов с АСБ. Индикаторы воспаления, такие как СРБ и СОЭ, были взаимосвязаны с уровнем IL-10, что ассоциируется с активацией противовоспалительной активности (r=0,78; р=0,02; r=0,78; р=0,02, соответственно). Эти явления объясняются неспецифическим воспалительным процессом в интиме сосудов и ростом показателей IL-8, которые, в свою очередь, повышают адгезию клеток в атерогенезе, что подтверждено прямой корреляционной связью. Вместе с повышенной экспрессией провоспалительного IL-8 отмечается и высокая концентрация противовоспалительного IL-10, что обусловливает защитный механизм, ограничивающий как зону некроза, так и активность воспаления при ассоциированных состояниях [16].
Корреляционный анализ полученных нами данных выявил взаимосвязи ТКИМ с IL-8 (r=-0,257; р=0,019) и соотношением IL-8/IL-10 (r=-0,380; р=0,003). Изучив особенности уровня PCSK9 и IL в зависимости от типа изменений ТКИМ, у пациентов c утолщением ТКИМ и АСБ отмечался статистически значимо самый высокий уровень PCSK9. Уровень IL-8 был статистически значимо выше у пациентов с неизмененным ТКИМ, а уровень IL-10 статистически незначимо выше у пациентов с утолщением ТКИМ и АСБ. Во 2 группе у пациентов с нормальной ТКИМ был статистически значимо увеличен IL-8 в сравнении с пациентами с утолщением ТКИМ и АСБ (р=0,04). В 3 группе у пациентов с утолщением ТКИМ уровень IL-10 статистически значимо ниже в сравнении с пациентами с наличием АСБ (р=0,04). Напротив, Toth S, et al. (2017) установили, что плазменные уровни PCSK9 достоверно коррелируют с ТКИМ, скоростью пульсовой волны и индексом жесткости [17].
Заключение
Факторы ССР ассоциированы с воспалением (IL-8) и цитокиновым дисбалансом (IL-8/IL-10). У пациентов с высоким уровнем PCSK9 отмечаются более тесные взаимосвязи факторов риска АГ и цитокинового дисбаланса.
Тип суточного профиля АД (р>0,05) не влияет на уровень PCSK9. Цитокиновый дисбаланс (уменьшение соотношения IL-8/IL-10 (р=0,023) за счет усиления вклада противовоспалительного IL-10 (р=0,044)) характеризует суточный профиль САД "night-peaker".
Степень выраженности атеросклероза БЦА статистически значимо зависит от повышения уровня PCSK9 (р=0,006). Уровень провоспалительного IL-8 был статистически значимо выше у пациентов с неизмененной ТКИМ, а уровень противовоспалительного IL-10 статистически незначимо выше у пациентов с утолщением ТКИМ и АСБ.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
1 World Health Organization. Global Health Observatory (GHO) data. — URL: http://www.who.int/qho/risk factors/cholesterol text/en/. — Accessed May 23, 2019.
Список литературы
1. Конради А. О., Алиева А. С. Артериальная гипертензия и дислипидемия. параллельный контроль двух факторов риска — роль комбинаций препаратов. Артериальная гипертензия. 2021;27(3):376-83. doi:10.18705/1607-419X-2021-27-3-376-383.
2. Миронова О. И., Исаев Г. О., Бердышева М. В. и др. Современные методы оценки физиологической значимости коронарных поражений: обзор. Тер Арх. 2023;95(4):341-46. doi:10.26442/00403660.2023.04.202169.
3. Аверкова А. О. PCSK9: Регуляция Биологической активности и связь с обменом жиров и углеводов. Клиническая практика. 2017;3(31):70-5. doi:10.17816/clinpract8370-75.
4. Ricci C, Ruscica M, Camera M, et al. PCSK9 induces a pro-inflammatory response in macrophages. Sci Rep. 2018;2;8(1):2267. doi:10.1038/s41598-018-20425-x.
5. Рекомендации ESC по профилактике сердечно-сосудистых заболеваний в клинической практике. Российский кардиологический журнал. 2022;27(7):5155. doi:10.15829/1560-4071-2022-5155.
6. Mayne IJ, Ooi TC, Raymond A, et al. Differential effects of PCSK9 loss of function variants on serum lipid and PCSK9 levels in Caucasian and African Canadian populations. Lipids Health Dis. 2013;12:70-4.
7. Рагино Ю. И., Астракова К. С., Шахтшнейдер Е. В. и др. Уровень пропротеиновой конвертазы субтилизин-кексинового 9-го типа (PCSK9) в крови у мужчин разных популяционных подгрупп и его связь с неблагоприятным отдаленным прогнозом. Кардиология. 2017;57(4):72-6.
8. Liu J, Fan F, Luo X, et al. Association between circulating concentrations of proprotein convertase subtilisin/Kexin type 9 and cardiovascular events in cardiovascular disease: a systematic review and meta-analysis. Front Cardiovasc Med. 2021;8:758956. doi:10.3389/fcvm.2021.758956.
9. Seida NG, Prat AA, Pirillo AA, et al. New strategies for targeting proprotein convertase subtilisin kexin 9: beyond monoclonal antibodies. Cardiovasc Res. 2019;115(3):510-8. doi:10.1093/cvr/cvz003.
10. Бенимецкая К. С., Ячменева М. П., Астраков С. В. и др. Связь пропротеин конвертазы субтилизин/кексин 9 типа (PCSK9) с уровнем артериального давления и статусом курения. Инновационная медицина Кубани. 2019;1(13):20-7.
11. Puteri MU, Azmi NU, Kato M, et al. PCSK9 promotes cardiovascular disease: recent evidence linking it to platelet activation-induced myocardial infarction. Life (Basel). 2022;12(2):190. doi:10.3390/life12020190.
12. Katafuchi E, Nakayama M, Tanaka S, et al. Comparison of Prognostic Values of Daytime and Night-Time Systolic Blood Pressures on Renal Outcomes in Patients with Chronic Kidney Disease. Circ. J. 2017;81(10):1454-62. doi:10.1253/circj.CJ-17-0063.
13. Kolias A, Ntineri A, Stergiou GS. Association of night time home blood pressure. J. Hypertens. 2017;35(3):442-52. doi:10.1097/HJH.0000000000001189.
14. Chen Y, Liu JH, Zhen Z, et al. As Potential Therapeutic Target for Atherosclerosis and Thrombosis assessment of left ventricular function and peripheral vascular arterial stiffness in patients with dipper and non-dipper hypertension. J. Investig. Med. 2018;66(2):319-24. doi:10.1136/jim-2017-000513.
15. Man AWC, Li H, Xia N. Circadian Rhythm: Potential Therapeutic Target for Atherosclerosis and Thrombosis. Int. J. Mol. Sci. 2021;22(2):676. doi:10.3390/ijms22020676.
16. Наумов А. В., Прокофьева Т. В., Полунина О. С. и др. Провоспалительные цитокины у больных острым инфарктом миокарда на фоне хронической обструктивной болезни легких. Медицинский вестник Юга России. 2020;11(3):40-7. doi:10.21886/2219-8075-2020-11-3-40-47.
17. Toth S, Fedacko J, Pekarova T, et al. Elevated Circulating PCSK9 Concentrations Predict Subclinical Atherosclerotic Changes in Low Risk Obese and Non-Obese Patients. Cardiol. Ther. 2017:6(2);281-9. doi:10.1007/s40119-017-0092-8.
Об авторах
Ю. Ю. ВуколоваРоссия
Вуколова Юлия Юрьевна — ассистент кафедры внутренних болезней, ведущий специалист МНОЦ кардиоваскулярной патологии и кардиовизуализации.
Самара
Конфликт интересов:
Нет
Е. Ю. Губарева
Россия
Губарева Екатерина Юрьевна — к. м. н., доцент кафедры факультетской терапии.
Самара
Конфликт интересов:
Нет
И. В. Губарева
Россия
Губарева Ирина Валерьевна — д. м. н., доцент, зав. кафедрой внутренних болезней.
Самара
Конфликт интересов:
Нет
О. А. Германова
Россия
Германова Ольга Андреевна — к. м. н., доцент, директор МНОЦ кардиоваскулярной патологии и кардиовизуализации.
Самара
Конфликт интересов:
Нет
Г. И. Киселева
Россия
Киселева Галина Ивановна — к. м. н., доцент кафедры внутренних болезней.
Самара
Конфликт интересов:
Нет
Дополнительные файлы
Что известно о предмете исследования?
- Пропротеин-конвертаза субтилизин/кексин тип 9 (PCSK9) участвует в регуляции липидного обмена, воздействуя на рецепторы липопротеина низкой плотности.
- PCSK9 усиливает экспрессию интерлейкинов, модулируя воспалительные механизмы при атеросклерозе.
Что нового?
- PCSK9 и маркеры воспаления (интерлейкины -8, -10) взаимосвязаны с сердечно-сосудистым риском и ассоциированы с каротидным атеросклерозом.
Возможный вклад в клиническую практику
- Персонифицированный подход с учетом уровней биомаркеров для прогнозирования сердечно-сосудистого риска у пациентов с артериальной гипертензией.
Рецензия
Для цитирования:
Вуколова Ю.Ю., Губарева Е.Ю., Губарева И.В., Германова О.А., Киселева Г.И. Значение пропротеиновой конвертазы субтилизин-кексинового типа 9 и маркеров воспаления в диагностике каротидного атеросклероза у мужчин с артериальной гипертензией. Российский кардиологический журнал. 2024;29(8):5939. https://doi.org/10.15829/1560-4071-2024-5939. EDN: GSYDBH
For citation:
Vukolova Yu.Yu., Gubareva E.Yu., Gubareva I.V., Germanova O.A., Kiseleva G.I. Value of proprotein convertase subtilisin/kexin type 9 and inflammatory markers in the diagnosis of carotid atherosclerosis in hypertensive men. Russian Journal of Cardiology. 2024;29(8):5939. (In Russ.) https://doi.org/10.15829/1560-4071-2024-5939. EDN: GSYDBH
JATS XML

















































