Перейти к:
Изменение липидного спектра у пациентов с острым лейкозом после патогенетической терапии
https://doi.org/10.15829/1560-4071-2025-5910
EDN: DNYXTF
Аннотация
Цель. Изучить динамику изменений липидного спектра у пациентов с острым лейкозом, получивших патогенетическую терапию.
Материал и методы. В исследование включено 13 пациентов с диагнозом острый лейкоз, которым проводилась патогенетическая терапия, включающая схемы полихимиотерапии и аллогенной трансплантации гемопоэтических клеток. Медиана возраста составила 40 лет. Всем пациентам исследуемой группы проводилась оценка липидного спектра, а также проводилась оценка функции печени и почек в момент установления диагноза, окончания курсов полихимиотерапии, а также после проведения аллогенной трансплантации гемопоэтических стволовых клеток.
Результаты. Показатели общего холестерина, триглицеридов, липопротеины очень низкой плотности и липопротеины низкой плотности в исследуемых группах статистически значимо изменяются в динамике на разных этапах лечения. Значения общего холестерина имеют более высокий риск повышения у пациентов с острым лейкозом на этапах окончания полихимиотерапии и после проведения аллогенной трансплантации гемопоэтических стволовых клеток по сравнению с дебютом заболевания. У пациентов с острым лейкозом достоверно чаще отмечено повышение уровня общего холестерина и триглицеридов к этапу окончания полихимиотерапии и после проведения аллогенной трансплантации гемопоэтических стволовых клеток.
Обсуждение. Повышение сердечно-сосудистого риска у пациентов с острыми лейкозами, получающих патогенетическую терапию, включающую аллогенную трансплантацию гемопоэтических стволовых клеток, связано с высокой токсичностью проводимых противоопухолевых схем, а также является следствием неопластического процесса. Гиполипидемия в дебюте заболевания острым лейкозом связана в первую очередь с повышенным потреблением их неопластическими клетками. Нарушение функции печени и снижение скорости клубочковой фильтрации на этапах лечения острым лейкозом в большей степени ассоциируется с высокотоксичными схемами проводимой противоопухолевой терапии.
Заключение. У пациентов с острым лейкозом на разных этапах патогенетического лечения, включающего полихимиотерапию и аллогенную трансплантацию гемопоэтических стволовых клеток, развитие нарушений липидного обмена является патогенетической основой для формирования сердечнососудистых осложнений.
Ключевые слова
Для цитирования:
Праскурничий Е.А., Дзидзария В.О., Китаева Ю.С. Изменение липидного спектра у пациентов с острым лейкозом после патогенетической терапии. Российский кардиологический журнал. 2025;30(4):5910. https://doi.org/10.15829/1560-4071-2025-5910. EDN: DNYXTF
For citation:
Praskurnichy E.A., Dzidzaria V.О., Kitaeva Yu.S. Lipid profile changes in patients with acute leukemia after pathogenetic therapy. Russian Journal of Cardiology. 2025;30(4):5910. (In Russ.) https://doi.org/10.15829/1560-4071-2025-5910. EDN: DNYXTF
Поздние сердечно-сосудистые осложнения (ССО) происходят у пациентов с острыми лейкозами (ОЛ), как правило, через несколько лет после успешного завершения патогенетической терапии, включающей применение цитостатических препаратов и аллогенной трансплантации гемопоэтических стволовых клеток (аллоТГСК).
Как известно, наиболее частыми осложнениями от проводимой патогенетической терапии являются те, которые в первую очередь зависят от кумулятивной дозы, количества и способа введения химиотерапевтических препаратов [1]. Нарушение липидного статуса сопровождает многие заболевания, в т. ч. ОЛ. Дислипидемии при ОЛ характеризуются повышением общего холестерина, липопротеинов низкой плотности (ЛНП), что выступает в качестве патогенетической основы атеросклеротического процесса [1].
Системные нарушения липидного статуса у пациентов с ОЛ происходят как правило за счет снижения липопротеинов высокой плотности (ЛВП) сыворотки крови. При этом повышение содержания липидов отмечается в тканях, окружающих опухолевые клетки [2]. Данные механизмы связаны в первую очередь с увеличенной абсорбцией холестерина из циркуляции, стимуляцией эндогенного его синтеза, а также с ограничением выброса избыточного холестерина из опухолевых клеток. Однако метаболизм липидов в опухоли ускорен, что связано с повышенной частотой деления опухолевых клеток и обусловлено синтезом липидных компонентов цитоплазматической мембраны [2]. Повышение уровней атерогенных фракций холестерина в данных условиях ассоциируется с повышением ССО.
При этом несмотря на возраст пациентов c ОЛ, они находятся в группе риска развития сердечно-сосудистых заболеваний (ССЗ), что может быть обусловлено различными факторами, в т. ч. развитием дислипидемии. У пациентов с ОЛ на фоне патогенетической терапии при оценке сердечно-сосудистого риска (ССР) необходимо учитывать не только классические факторы риска (пол, возраст, отягощенную наследственность, образ жизни, сопутствующие заболевания), но и возможность развития атеросклероза на фоне нарушения метаболических процессов в организме. Методы профилактики ССО в данной группе пациентов должны учитывать особенности измененного метаболизма у них на фоне влияния лекарственных веществ, необходимо своевременное определение развития факторов риска и проведение мер по их предупреждению.
Как известно из многочисленных исследований, выживаемость после проведения аллоТГСК пациентам с ОЛ выше, чем при применении стандартных схем полихимиотерапии (ПХТ) [3]. При этом осложнения, развивающиеся у данной категории лиц, получивших дополнительно к стандартной противоопухолевой терапии аллоТГСК, в посттрансплантационном периоде оказывают существенное влияние на продолжительность и качество жизни пациентов [3]. При этом в настоящее время мало работ, изучающих влияние комплексного противоопухолевого лечения, включающего аллоТГСК, на липидный профиль. Проведение исследований важно для выявления потенциальной взаимосвязи гиперлипидемии и летального исхода в будущем у пациентов с ОЛ, получивших стандартные схемы ПХТ и аллоТГСК, что необходимо для обоснования целесообразности ранних диагностических и профилактических мероприятий.
Поскольку выживаемость пациентов с ОЛ увеличивается, вопрос развития поздних ССО остается весьма актуальным. Кардиометаболические нарушения у данной категории пациентов являются важной проблемой в течение и после проведения терапии ОЛ.
Цель: изучить динамику изменений липидного спектра у пациентов с ОЛ, получивших патогенетическую терапию.
Материал и методы
В исследование включено 13 пациентов, которые наблюдались с момента установления диагноза до завершения патогенетической терапии, включающей схемы ПХТ и аллоТГСК. Диагноз ОЛ установлен на основании клинико-лабораторных данных: степени выраженности цитопении и инфильтрации костного мозга опухолевыми клетками. Верификация варианта ОЛ проводилась с помощью иммунофенотипического, цитогенетического и молекулярно-генетического исследования костного мозга.
В исследование включались пациенты с ОЛ, имеющие показания к проведению аллоТГСК в дебюте заболевания, старше 18 лет. Лица, не достигшие клинико-гематологической ремиссии на этапах ПХТ и не получившие аллоТГСК, из исследования исключались.
Все участники исследования не получали липидснижающей терапии на всех этапах патогенетической терапии, а также дали письменное информированное согласие на участие в исследовании, одобренном на заседании локального этического комитета (протокол № 157 от 18.01.2023).
Как показано в таблице 1, в исследуемую группу вошли 6 мужчин (46%) и 7 женщин (54%). Медиана возраста на момент дебюта заболевания составила 40 лет. Все пациенты получали стандартные схемы ПХТ, а также перенесли аллоТГСК. Источником трансплантата у всех исследуемых пациентов являлись периферические стволовые клетки крови. Большинство больных в качестве профилактики острой реакции трансплантат против хозяина (РТПХ) получили схемы с циклофосфамидом на +3 и +4 сут., такролимусом и микофенолата мофетилом — с +5 сут. В качестве режима кондиционирования все пациенты получили бусульфан-содержащие схемы. Медиана наблюдения после завершения патогенетической терапии составила 15 мес. (от 6 мес. до 48 мес.).
Сопутствующие заболевания пациентов с ОЛ, получивших патогенетическую терапию, включающую аллоТГСК, представлены в таблице 2.
Как видно из таблицы 2, в исследуемой группе 4 пациента (31%) были с артериальной гипертензией и 5 пациентов (38%) — с ожирением. Такие нозологические формы, как сахарный диабет 2 типа и атеросклероз периферических артерий, встречаются в единичном количестве. Хроническая РТПХ отмечена у 13 пациентов (100%), из которых распространенная форма у 7 пациентов (54%), локальные формы — у 6 пациентов (46%).
Всем пациентам исследуемой группы проводилась оценка липидного спектра, а также проводилась оценка функции печени и почек в момент установления диагноза, окончания курсов ПХТ, а также после проведения аллоТГСК. Исследование липидного профиля выполнялось на биохимическом анализаторе ILab Taurus (Instrumentation Laboratory S.P.A., Италия). Определялся уровень общего холестерина, ЛНП, ЛВП, триглицеридов (ТГ), холестерина не-ЛВП, коэффициент атерогенности. Всем участникам исследования проведен забор биохимического анализа крови с оценкой показателей аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы, щелочной фосфатазы (ЩФ), гамма-глютамилтранспептидазы, креатинина. Произведен расчет скорости клубочковой фильтрации (СКФ) по формуле CKD-EPI [4].
Проведено измерение антропометрических данных пациентов с расчётом индекса массы тела (ИМТ). Расчет ИМТ проводился по формуле Кетле, ИМТ=m (кг)/(h(м))2 [5].
Для расчета статистической значимости взаимосвязи между выявленными данными применялся коэффициент ранговой корреляции Спирмена (rS). Статистически значимыми считались показатели при p≤0,05.
Протокол исследования одобрен локальным этическим комитетом. До включения в исследование у всех участников было получено письменное информированное согласие.
Таблица 1
Характеристика пациентов исследуемой группы
|
Параметры |
Группа |
|
Количество пациентов |
13 |
|
Пол Мужской Женский |
6 (46%) 7 (54%) |
|
Медиана возраста, лет |
40 |
|
ОЛЛ ОМЛ |
6 (46%) 7 (54%) |
|
Рост, см |
169 [ 151; 196] |
|
Вес, кг |
73 [ 46; 124] |
|
ИМТ, кг/м2 |
25,6 [ 17,79; 37,11] |
|
Срок от момента дебюта заболевания до аллоТГСК, мес. |
10 [ 4; 21] |
|
HLA-совместимая: Родственная Неродственная Гаплодентичная |
3 (23%) 4 (31%) 6 (46%) |
|
Режим кондиционирования: Бусульфан + флюдарабин 8 Бусульфан + флюдарабин 10 Бусульфан + флюдарабин 12 |
3 4 6 |
|
Профилактика острой РТПХ: Циклоспорин А + метотрексат Такролимус + циклофосфан (Д+3, +4) + микофенолата мофетил |
2 11 |
|
Источник трансплантата: Периферические стволовые клетки крови |
100% |
Сокращения: аллоТГСК — аллогенная трансплантации гемопоэтических стволовых клеток, ИМТ — индекс массы тела, ОЛЛ — острый лимфобластный лейкоз, ОМЛ — острый миелобластный лейкоз, РТПХ — реакция трансплантат против хозяина.
Таблица 2
Характеристика сопутствующих заболеваний в исследуемой группе
|
Сопутствующие заболевания/осложнения |
Количество выявленных случаев |
|
Артериальная гипертензия |
4 (31%) |
|
Сахарный диабет 2 типа |
1 (8%) |
|
Атеросклероз периферических артерий и коронарных артерий |
1 (8%) |
|
Хроническая болезнь почек |
2 (15%) |
|
Ожирение |
5 (38%) |
|
Хроническое РТПХ: Кожи Легкие Кишечник Печень Мышцы и суставы Нервная ткань |
10 (77%) 3 (23%) 2 (15%) 7 (54%) 1 (8%) 2 (15%) |
Сокращение: РТПХ — реакция трансплантат против хозяина.
Результаты
Рассмотрим влияние проводимой противоопухолевой терапии на изучаемые параметры липидного спектра у пациентов с ОЛ в зависимости от этапа лечения. Динамика изменений показателей липидограммы в изучаемой группе показана в таблице 3.
Как показано в таблице 3, значения общего холестерина, ТГ, липопротеины очень низкой плотности (ЛОНП) и ЛНП в исследуемых группах статистически значимо изменяются в динамике на разных этапах лечения. При этом по параметрам ЛВП, не-ЛВП и коэффициента атерогенности у пациентов с ОЛ не выявлено значимых отличий с момента дебюта заболевания до окончания ПХТ и после аллоТГСК. Таким образом, пациенты с ОЛ на этапе окончания ПХТ и после проведения аллоТГСК имели более высокий риск повышения таких показателей липидограммы, как общий холестерин, ТГ, ЛОНП и ЛНП, по сравнению этапом дебюта заболевания.
Проведено сравнение показателей липидного спектра у пациентов с ОЛ с момента дебюта заболевания до окончания ПХТ и проведения аллоТГСК, что представлено в таблице 4.
Как показано в таблице 4, значения общего холестерина выше у пациентов с ОЛ на этапах окончания ПХТ и после проведения аллоТГСК по сравнению с дебютом заболевания. При сопоставлении показателей ТГ выявлено значимое повышение уровня с момента дебюта заболевания до окончания ПХТ и после проведения аллоТГСК, причем различий в динамике данного параметра не отмечено. При этом не выявлены достоверные различия показателей ЛВП, не-ЛВП и ЛНП у пациентов от дебюта заболевания до завершения противоопухолевой терапии, включающей проведения аллоТГСК. Таким образом, у пациентов с ОЛ достоверно чаще отмечено повышение уровня общего холестерина и ТГ к моменту окончания ПХТ и после проведения аллоТГСК.
Следовательно, у пациентов с ОЛ на этапах окончания ПХТ и после проведения аллоТГСК происходят изменения в липидном спектре, характеризующиеся повышением общего холестерина за счет увеличения ЛНП и снижения ЛВП, а также повышением уровня ТГ, что обусловлено, вероятно, проводимой патогенетической терапией, включающей цитостатические препараты, и влиянием ее на функциональное состояние ткани печени.
Как известно, все цитостатические препараты метаболизируются в ткани печени и выводятся почками. Повреждающее действие химиотерапевтических лекарственных средств обусловлено накоплением их в ткани печени к моменту окончания ПХТ и после проведения аллоТГСК. При этом токсическое воздействие цитостатических препаратов приводит к повреждению ткани почек, в результате влияния их на паренхиму почек (канальцы и клубочки почек) [6].
Нами проведен корреляционный анализ между показателями липидного спектра и биохимическими показателями оценки функции печени и СКФ у пациентов с ОЛ на разных этапах лечения (рис. 1).
Как видно из рисунка 1, выявлена корреляционная связь между уровнем АЛТ, ЩФ и показателями ЛНП, не-ЛВП и общим холестерином у пациентов с ОЛ на этапах с дебюта заболевания и после проведения аллоТГСК: RЛНП-ЩФ=0,587, Rне-ЛВП-ЩФ=0,669, Rне-ЛВП-АЛТ=0,575, Rобщий холестерин-ЩФ=0,523 (|R|>0,5). У пациентов с ОЛ отмечена корреляционная зависимость параметров ТГ и ЛОНП с показателем СКФ в динамике на разных этапах лечения: RЛОНП-СФК=-0,613, RТГ-СКФ=-0,567. Иными словами, у пациентов с ОЛ в период с дебюта заболевания до окончания патогенетической терапии, включающей аллоТГСК, происходит изменение показателей липидного спектра в зависимости от уровня значений ЩФ и АЛТ, а также показателя СКФ.
Таким образом, у пациентов с впервые выявленным ОЛ до момента окончания патогенетической терапии, включающей цитостатические препараты и проведение аллоТГСК, состояние липидного обмена подвергается изменениям, характеризующимся повышением общего холестерина, ТГ и ЛНП, а также снижением ЛВП. Выявленные изменения, вероятно, связаны с токсическим влиянием химиотерапевтических лекарственных средств на морфофункциональные состояния ткани печени и почек.
Таблица 3
Динамика параметров липидного спектра у пациентов с ОЛ на разных этапах терапии
|
Параметр |
Дебют ОЛ |
После ПХТ |
После ПХТ и аллоТГСК |
p |
|
1 |
2 |
3 |
||
|
Количество пациентов |
13 |
13 |
13 |
— |
|
Общий холестерин: Норма Повышение |
12 (92%) 1 (8%) |
6 (46%) 7 (54%) |
5 (38%) 8 (62%) |
p1-2=0,003 p1-3=0,003 p2-3=1,000 |
|
Триглицериды: Норма Повышение |
13 (100%) 0 (0%) |
6 (46%) 7 (54%) |
7 (54%) 6 (46%) |
p1-2=0,003 p1-3=0,003 p2-3=1,000 |
|
ЛВП: Норма Снижение |
10 (77%) 3 (23%) |
7 (54%) 6 (46%) |
8 (62%) 5 (38%) |
p1-2=0,273 p1-3=0,273 p2-3=1,000 |
|
КА: Норма Повышение |
8 (62%) 5 (38%) |
4 (31%) 9 (69%) |
5 (38%) 8 (62%) |
p1-2=0,219 p1-3=0,219 p2-3=1,000 |
|
не-ЛВП: Норма Повышение |
8 (62%) 5 (38%) |
3 (23%) 10 (77%) |
10 (77%) 3 (23%) |
p1-2=0,165 p1-3=0,096 p2-3=0,435 |
|
ЛОНП: Норма Повышение |
13 (100%) 0 (0%) |
9 (69%) 4 (31%) |
10 (77%) 3 (23%) |
p1-2=0,040 p1-3=0,040 p2-3=1,000 |
|
ЛНП: Норма Повышение |
13 (100%) 0 (0%) |
9 (69%) 4 (31%) |
8 (62%) 5 (38%) |
p1-2=0,018 p1-3=0,018 p2-3=1,000 |
Примечание: p1-2 — отражает различия между 1 и 2 группами, p2-3 — отражает различия между 2 и 3 группами, p1-3 — отражает различия между 1 и 3 группами.
Сокращения: аллоТГСК — аллогенная трансплантации гемопоэтических стволовых клеток, КА — коэффициент атерогенности, ЛВП — липопротеины высокой плотности, ЛНП — липопротеины низкой плотности, ЛОНП — липопротеины очень низкой плотности, ОЛ — острый лейкоз, ПХТ — полихимиотерапия, не-ЛВП — не липопротеины высокой плотности.
Таблица 4
Параметры липидного спектра у пациентов с ОЛ на разных этапах терапии
|
Параметр |
Дебют ОЛ |
После ПХТ |
После ПХТ и аллоТГСК |
p |
|
1 |
2 |
3 |
||
|
Количество пациентов |
13 |
13 |
13 |
— |
|
Общий холестерин |
4,6 [ 4,1; 5,1] |
5,4 [ 4,7; 6,3] |
5,5 [ 5,0; 6,3] |
p1-2=0,031 p1-3=0,016 p2-3=1,000 |
|
Триглицериды |
1,2 [ 0,86; 1,5] |
1,86 [ 1,02; 1,49] |
1,38 [ 1,07; 2,23] |
p1-2=0,016 p1-3=0,031 p2-3=1,000 |
|
ЛВП |
1,28 [ 1,2; 1,4] |
1,38 [ 1,02; 1,49] |
1,38 [ 1,04; 1,55] |
p1-2=0,508 p1-3=0,727 p2-3=1,000 |
|
Коэффициент атерогенности |
2,7 [ 2,3; 3,3] |
3,2 [ 2,9; 3,5] |
3,1 [ 2,6; 3,4] |
p1-2=0,219 p1-3=0,453 p2-3=1,000 |
|
не-ЛВП |
3,26 [ 2,1; 3,8] |
4,09 [ 3,25; 4,62] |
4,41 [ 3,63; 4,75] |
p1-2=0,125 p1-3=0,052 p2-3=1,000 |
|
ЛОНП |
0,58 [ 0,4; 0,78] |
0,86 [ 0,49; 1,07] |
0,63 [ 0,49; 1,03] |
p1-2=0,125 p1-3=0,250 p2-3=1,000 |
|
ЛНП |
3,4 [ 2,68; 3,56] |
2,89 [ 2,71; 4,06] |
3,13 [ 2,77; 4,13] |
p1-2=0,125 p1-3=0,062 p2-3=1,000 |
Примечание: p1-2 — отражает различия между 1 и 2 группами, p2-3 — отражает различия между 2 и 3 группами, p1-3 — отражает различия между 1 и 3 группами.
Сокращения: аллоТГСК — аллогенная трансплантации гемопоэтических стволовых клеток, КА — коэффициент атерогенности, ЛВП — липопротеины высокой плотности, ЛНП — липопротеины низкой плотности, ЛОНП — липопротеины очень низкой плотности, ОЛ — острый лейкоз, ПХТ — полихимиотерапия, не-ЛВП — не липопротеины высокой плотности.
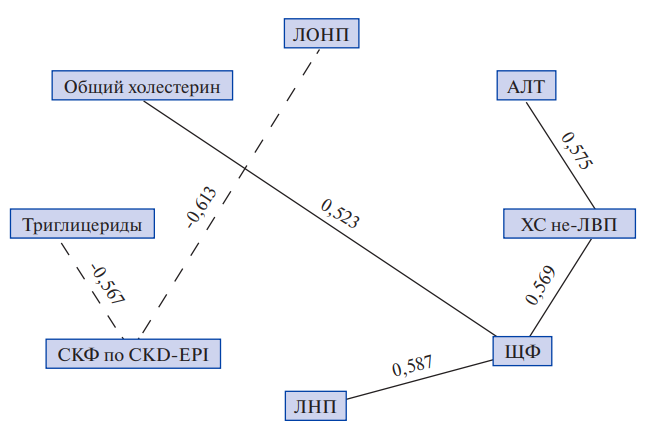
Рис. 1. Корреляционная связь между показателями липидного спектра и биохимическими показателями оценки функции печени.
Сокращения: АЛТ — аланинаминотрансфераза, ЛНП — липопротеины низкой плотности, ЛОНП — липопротеины очень низкой плотности, СКФ — скорость клубочковой фильтрации, ХС не-ЛВП — холестерин не липопротеинов высокой плотности, ЩФ — щелочная фосфатаза.
Обсуждение
Повышение ССР у пациентов с ОЛ, получающих патогенетическую терапию, включающую цитостатические препараты и аллоТГСК, связано с высокой токсичностью проводимых противоопухолевых схем, а также является следствием неопластического процесса.
По данным нашей работы, пациенты с впервые диагностированным ОЛ имеют сопоставимые с возрастными изменениями показатели липидограммы; рисков, имеющих атерогенную направленность, не выявлено. Изменение липидного профиля у данной категории пациентов со снижением общего холестерина, ТГ, ЛНП связано с повышенной пролиферацией опухолевых клеток и активным включением ими липидов. Повышение уровня общего холестерина в сыворотке крови не выявлено, но отмечено его повышение в лимфоцитах. Следовательно, низкие показатели общего холестерина у пациентов с впервые диагностированным ОЛ связаны с ростом неопластического процесса и могут оцениваться как маркер прогноза опухолевой активности клеток [3]. Метаболические процессы в опухолевых клетках всегда ускорены, что связано с высокой скоростью деления неопластических клеток. При достижении клинико-гематологического ответа показатели липидограммы, как правило, нормализуются.
У пациентов с ОЛ, получивших курсы ПХТ в индукционном режиме, наблюдается повышение показателей липидограммы (общий холестерин, ТГ, ЛНП). Тяжелая гиперлипидемия при проведении индукционных курсов цитостатической терапии является транзиторной и доброкачественной [3]. Следовательно, у пациентов с ОЛ на этапе окончания индукционной терапии значимо чаще уровень общего холестерина и ТГ выше, чем на этапе установления диагноза.
Повышение показателей липидограммы у пациентов с ОЛ после аллоТГСК может возникнуть в результате развития РТПХ. Однако в нашей работе значимых различий показателей липидов крови между этапами применения ПХТ и аллоТГСК не отмечено, при этом у 7 пациентов (53%) после аллоТГСК наблюдается хроническая РТПХ с поражением печени различной степени выраженности. Таким образом, при сравнении показателей липидного профиля у пациентов с ОЛ в дебюте заболевания, после окончания курсов ПХТ и аллоТГСК наблюдается значительно чаще повышение общего холестерина, ЛНП и показателя не-ЛВП, а также тенденция к снижению показателей ЛВП, что, вероятно, связано с высокотоксичными схемами применяемого лечения.
Анемия при ОЛ, формирующаяся в момент дебюта заболевания и в период проведения курсов ПХТ, сопровождается тканевой гипоксией и проявляется дисфункцией печени, что приводит к нарушению ее синтетической функции. Нарушение образования липидов в печени сопряжено со снижением концентрации их в сыворотке крови. Последнее объясняет наличие корреляции между показателями липидного спектра и биохимическими данными, характеризующими функционирование печени [7].
Известно, что среди препаратов, используемых в лечении пациентов с лейкозами, изменения липидного спектра могут индуцировать глюкокортикостероиды, которые увеличивают уровень ТГ, ЛОНП и снижение ЛВП, и ингибиторы кальциневрина, повышающие уровень ЛНП [7]. Глюкокортикостероиды, используемые для профилактики хронической РТПХ, влияют на липидный обмен, увеличивая их выработку в гепатоцитах путем активной экспрессии синтазы жирных кислот, а также способствуют превращению преадипоцитов в зрелые адипоциты, приводя к гиперплазии жировой ткани [7].
Об участии снижения функции почек в процессах атерогенеза свидетельствуют корреляционные связи, выявленные между уровнем липидов и СКФ. В работе Mondal E, et al. (2021) определяется повышение уровня ТГ и снижение ЛВП у пациентов с хронической болезнью почек (ХБП) [8]. При ОЛ поражение ткани почек может диагностироваться в дебюте заболевания и быть результатом инфильтрации их опухолевыми клетками. Однако по немногочисленным литературным публикациям примерно в 45% случаев ОЛ определяется поражение почечной ткани лейкозными клетками [9]. При этом нефропатия чаще протекает бессимптомно, а почечная недостаточность в первую очередь связана с дисбалансом электролитов и ацидозом [8][9].
Повышение уровня липидов при ХБП на фоне уремии может быть обусловлено нарушением активности триглицеридлипазы печени и липазы, в результате имеет место изменение катаболизма ТГ [10]. Так, при снижении СКФ было отмечено усиленное окисление ЛВП, что проявляется снижением его уровня [10].
Анализируя данные нашего исследования, можно констатировать, что гиполипидемия в дебюте заболевания ОЛ связана в первую очередь с повышенным потреблением их неопластическими клетками. Нарушение функции печени и снижение СКФ на этапах лечения ОЛ в большей степени ассоциируется с высокотоксичными схемами проводимой противоопухолевой терапии.
К одному из факторов, влияющих на липидный обмен при патогенетическом лечении ОЛ, относится повреждающее влияние химиотерапевтических лекарственных средств на ткань печени. При этом повреждение печени может осуществляться путем прямого влияния цитостатических препаратов и их метаболитов на гепатоциты, усугубляя токсическое повреждающее действие на ткань. Отмечено, что повышение активности печеночных ферментов, снижение метаболизма лекарственных средств — способствует замедленному выведению их из организма и увеличению времени их неблагоприятного воздействия на печеночную ткань [10].
У пациентов с ОЛ в современных схемах патогенетической терапии, цитостатические препараты, могут оказывать повреждающее действие на ткань почек, приводя к острому или хроническому повреждению. Высокие дозы химиотерапевтических препаратов влияют на почечную ткань, посредством прямого токсического влияния цитостатических препаратов, повреждая проксимальные канальцы, реже — дистальные канальцы и клубочки. У пациентов с ОЛ, получивших аллоТГСК, вероятно развитие повреждающего действия по типу острого тубулярного некроза, изолированной тубулопатии, кристаллической нефропатии, а также острых и хронических интерстициальных нефритов [6]. Как известно, повреждение почечных канальцев приводит к снижению СКФ с последующим развитием ХБП, повышением ТГ и снижением ЛВП [8].
Появление современных методов лечения ОЛ положительно отражается на прогнозе для жизни этих пациентов, однако применение высоких доз цитостатических препаратов отрицательно сказывается на метаболических процессах и может приводить к возникновению различных осложнений, в т. ч. ССО. При этом важно отметить, что ССР у пациентов с ОЛ, перенесших аллоТГСК, недооценен, и это связано с тем, что крупные исследования в данной области не проводились.
Можно сделать вывод, что, несмотря на достаточно молодой возраст пациентов, они относятся к группе риска развития ССЗ, что может быть обусловлено различными факторами, в т. ч. развитием дислипидемии. У пациентов с ОЛ на фоне патогенетической терапии при оценке ССР необходимо учитывать не только классические факторы риска (пол, возраст, отягощенную наследственность, образ жизни, сопутствующие заболевания), но и возможность развития преждевременного атеросклероза на фоне нарушения метаболических процессов в организме. Методы профилактики ССО в данной группе пациентов должны учитывать особенности измененного метаболизма у них на фоне влияния лекарственных веществ, необходимо своевременное определение развития факторов риска и проведение мер по их предупреждению.
Пациенты с ОЛ имеют общеизвестные факторы риска развития ССО, такие как наследственная предрасположенность, хронические заболевания (артериальная гипертензия, сахарный диабет 2 типа, заболевания почек), наличие факта курения в анамнезе. Однако они имеют и дополнительные факторы риска, приводящие к развитию сердечно-сосудистых событий, такие как применение цитостатических препаратов и аллоТГСК. В работе Battiwalla M, et al. (2017) показано, что у пациентов, получивших дополнительно к стандартным курсам ПХТ аллоТГСК, в 7,5% раз повышен риск развития ССО в течение 15 лет [11].
Повышение общего холестерина и его атерогенных фракций более характерно для молодых пациентов с ОЛ, получивших все варианты патогенетической терапии. Развиваются системные нарушения липидного обмена за счет понижения уровня общего холестерина и ЛВП сыворотки крови [12]. Отмечено, что повышение холестерина у пациентов с ОЛ обусловлено в первую очередь высокой скоростью поглощения миелоидными и лимфоидными опухолевыми клетками эфиров холестерина, содержащихся в ЛВП [3]. Данные изменения ассоциируются с рядом механизмов: увеличением абсорбции общего холестерина из циркуляции, стимуляцией его эндогенного синтеза, а также с блокированием его излишнего выброса из клеток при опухолевой трансформации за счет синтеза липидных компонентов цитоплазматической мембраны клеток [3]. Изменение фракций липидов, особенно изменение уровня холестерина, характерно для пациентов с ОЛ [3].
У пациентов с лейкозом определяется снижение ЛВП в сыворотке крови, при этом в некоторых случаях в самой бластной клетке и рядом расположенной здоровой ткани их содержание увеличивается, что, вероятно, связано с повышенным потреблением липидов из крови опухолевыми клетками [3]. Отмечено, что уровень холестерина у пациентов с ОЛ значительно ниже, чем у пациентов с солидными опухолями, этот факт объясняется повышением активности ретикуло-эндотелиальной системы [2][3].
Повреждающее действие химиотерапевтических препаратов на эндотелий сосудов приводит к раннему проявлению атеросклеротических изменений на сосудистой стенке и увеличивает риск развития ССО в позднем посттрансплантационном периоде.
Кардиотоксическое действие цитостатических препаратов у пациентов с ОЛ широко известно, однако вопросы контроля атерогенных нарушений у данного круга лиц изучены недостаточно. Как известно, проведение аллоТГСК в несколько раз повышает риск развития ССО у этих пациентов. При этом нарушения липидного обмена являются одним из факторов риска развития ССЗ, что определяет актуальность внедрения и определения содержания профилактических программ [13].
Заключение
У пациентов с ОЛ на разных этапах патогенетического лечения, включающего ПХТ и аллоТГСК, развитие дислипидемических нарушений является патогенетической основой для формирования ССО. Идентификация нарушений липидного спектра крови у данной категории пациентов позволяет формировать основу для раннего целенаправленного выявления факторов риска ССЗ.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Виценя М.В., Агеев Ф.Т., Гиляров М.Ю. и др. Практические рекомендации по коррекции кардиоваскулярной токсичности противоопухолевой лекарственной терапии. Злокачественные опухоли: Практические рекомендации RUSSCO. 2021;11(3s2-2):78-98. doi:10.18027/2224-5057-2021-11-3s2-41.
2. Владимирова С.Г., Тарасова Л. Н. Липидный обмен у больных онкогематологическими заболеваними. Терапевтический архив. 2016;88(3):116-20. doi:10.17116/terarkh2015883116-120.
3. Bis G, Szlasa W, Sondaj K, et al. Lipid Complications after Hematopoietic Stem Cell Transplantation (HSCT) in Pediatric Patients. Nutrients. 2020;12(9):2500. doi:10.3390/nu12092500.
4. Shahbaz H, Gupta M. Creatinine Clearance. 2023. In: StatPearls Publishing. 2024.
5. Пястолова Н.Б. Индекс Кетле как инструмент оценки физического состояния организма. Физическая культура. Спорт. Туризм. Двигательная рекреация. 2020;4:43-7. doi:10.24411/2500-0365-2020-15406.
6. Смирнов К.А., Добронравов В.А. Острое повреждение почек при трансплантации гемопоэтических стволовых клеток. Нефрология. 2014;6:26-42. doi:10.24884/1561-6274-2014-18-6-66-73.
7. Ниёзова Ш.Х. Гепатотоксический синдром на фоне полихимиотерапии солидных опухолей и современные возможности его коррекции (обзор литературы). Вестник науки и образования. 2019;17:71.
8. Mondal E, Khan MM, Hossain MI, et al. The Pattern of Lipid Profile in Patients with Chronic Kidney Disease. Mymensingh Med J. 2021;30(1):48-55.
9. Nakano T, Tanaka S, Tsuruya K, Kitazono T. Relationship between serum lipid concentrations and impaired renal function in patients with chronic kidney disease: the Fukuoka Kidney Disease Registry Study. Clin Exp Nephrol. 2021;25(4):385-93. doi:10.1007/s10157-020-02000-9.
10. Лебедева Е.Н., Вялкова А.А., Афонина С.Н., Чеснокова С.А. Дислипидемия как патогенетический фактор прогрессирования хронической болезни почек. Нефрология. 2019;23(5):56-64. doi:10.24884/1561-6274-2019-23-5-56-64.
11. Battiwalla M, Tichelli A, Majhail NS. Long-Term Survivorship after Hematopoietic Cell Transplantation: Roadmap for Research and Care. Biol Blood Marrow Transplant. 2017;23(2):184-92. doi:10.1016/j.bbmt.2016.11.004.
12. Liu Y, Ma M, Li L, et al. Association between sensitivity to thyroid hormones and dyslipidemia in patients with coronary heart disease. Endocrine. 2023;79(3):459-68. doi:10.1007/s12020-022-03254-x.
13. Алиева А.С., Реутова О.В., Павлюк Е.И. и др. Реализованные модели и перспективы управления нарушениями липидного обмена. Концепция центров по редким заболеваниям в липидологии. Российский кардиологический журнал. 2021;26(6):4538. doi:10.15829/1560-4071-2021-4538.
Об авторах
Е. А. ПраскурничийРоссия
Д. м. н., профессор, зав. кафедрой терапии
Москва
В. О. Дзидзария
Россия
Дзидзария Вера Отаровна — аспирант кафедры терапии
Москва
Ю. С. Китаева
Россия
К. м. н., ассистент кафедры пропедевтики внутренних болезней
Екатеринбург
Дополнительные файлы
- У пациентов с острыми лейкозами на этапах окончания полихимиотерапии и после проведения аллогенной трансплантации гемопоэтических стволовых клеток происходят изменения в липидном спектре, характеризующиеся повышением общего холестерина за счет увеличения липопротеинов низкой плотности и снижения липопротеинов высокой плотности, а также повышением уровня триглицеридов, что обусловлено, вероятно, проводимой патогенетической терапией, включающей цитостатические препараты, и влиянием ее на функциональное состояние ткани печени.
Рецензия
Для цитирования:
Праскурничий Е.А., Дзидзария В.О., Китаева Ю.С. Изменение липидного спектра у пациентов с острым лейкозом после патогенетической терапии. Российский кардиологический журнал. 2025;30(4):5910. https://doi.org/10.15829/1560-4071-2025-5910. EDN: DNYXTF
For citation:
Praskurnichy E.A., Dzidzaria V.О., Kitaeva Yu.S. Lipid profile changes in patients with acute leukemia after pathogenetic therapy. Russian Journal of Cardiology. 2025;30(4):5910. (In Russ.) https://doi.org/10.15829/1560-4071-2025-5910. EDN: DNYXTF

















































