Перейти к:
Атеросклеротическая нагруженность периферических артерий в диагностике коронарного атеросклероза при ревматоидном артрите
https://doi.org/10.15829/1560-4071-2024-5902
EDN: FJPFWE
Аннотация
Цель. Определить значения параметров атеросклеротической нагруженности (АСН) по данным ультразвукового обследования периферических артерий у больных ревматоидным артритом (РА) с низкой и умеренной степенью активности заболевания в сопоставлении с состоянием коронарных артерий.
Материал и методы. В исследование включено 64 пациента: 43 больных с установленным диагнозом РА и 21 пациент с ишемической болезнью сердца (ИБС) без РА (группа сравнения). Всем больным проводилось клинико-инструментальное обследование на верификацию ишемии миокарда и/или ИБС, согласно национальным рекомендациям 2020г, а также (только больным с РА) ультразвуковое обследование сонных и бедренных артерий с определением параметров АСН.
Результаты. Было показано, что у больных РА в сочетании с ИБС показатели каротидной АСН выше, чем у больных РА без ИБС по количеству каротидных атеросклеротических бляшек (АСБ) 4,0 [4,0; 5,0]/2,0 [1,0; 3,5], проценту максимального стеноза 35,0 [35,0; 45,0]/30,0 [25,0; 35,0] и проценту суммарного стеноза 120,0 [110,0; 152,5]/85,0 [40,0; 110,0]. Наличие ≥3 каротидных АСБ определяет значимое атеросклеротическое поражение коронарных артерий при РА. У больных РА с ИБС сочетание каротидных и феморальных АСБ в 75% случаев ассоциировано со значимым коронарным атеросклерозом. При сравнительном анализе больных РА ИБС+/РА ИБС- по основным факторам сердечно-сосудистого риска, липидным, воспалительным показателям достоверных отличий не получено. При сравнении показателей АСН сонных артерий, выраженности коронарного атеросклероза между больными РА ИБС+ и группы сравнения не выявлено.
Заключение. Определение параметров АСН периферических артерий повышает клиническую значимость ультразвуковых исследований в качестве этапа неинвазивной диагностики ИБС при РА.
Ключевые слова
Для цитирования:
Фомичева О.А., Балахонова Т.В., Погорелова О.А., Трипотень М.И., Шингареева Ф.Ф., Кузякина С.О., Яровая Е.Б., Герасимова Е.В., Попкова Т.В., Карпов Ю.А., Насонов Е.Л. Атеросклеротическая нагруженность периферических артерий в диагностике коронарного атеросклероза при ревматоидном артрите. Российский кардиологический журнал. 2024;29(8):5902. https://doi.org/10.15829/1560-4071-2024-5902. EDN: FJPFWE
For citation:
Fomicheva O.A., Balakhonova T.V., Pogorelova O.A., Tripoten M.I., Shingareeva F.F., Kuzyakina S.O., Yarovaya E.B., Gerasimova E.V., Popkova T.V., Karpov Yu.A., Nassonov E.L. Peripheral plaque burden in the diagnosis of coronary atherosclerosis in rheumatoid arthritis. Russian Journal of Cardiology. 2024;29(8):5902. (In Russ.) https://doi.org/10.15829/1560-4071-2024-5902. EDN: FJPFWE
Развитие сердечно-сосудистых заболеваний (ССЗ), связанных с развитием атеросклероза у пациентов с ревматоидным артритом (РА), обусловлено как влиянием традиционных факторов риска, так и наличием хронического воспаления, инициирующего синтез целого ряда провоспалительных медиаторов (цитокинов, аутоантител, факторов роста, белков острой фазы и т. д.) [1][2]. По данным некоторых исследований атеросклеротическая бляшка (АСБ) в сонной артерии (СА) определяется в 35% случаев при РА, а утолщение комплекса интима-медиа (ТКИМ) артериальной стенки (ТКИМ ≥0,6 мм) выявляется у 86% пациентов РА, что в 3 раза выше, по сравнению с общей популяцией [3]. Необходимость ультразвукового обследования СА при РА отмечена в рекомендациях EULAR 2015/2016гг [4] и в Российских национальных рекомендациях по кардиоваскулярной профилактике 2022г [5], в качестве скринингового метода на наличие бессимптомных АСБ для реклассификации сердечно-сосудистого риска (ССР). Данные другого метаанализа показали, что ультразвуковые параметры АСБ (параметры атеросклеротической нагруженности (АСН), такие как наличие АСБ, процент стеноза, площадь АСБ, объем АСБ, лучше прогнозируют развитие сердечно-сосудистых осложнений (ССО), чем ТКИМ [6]. В проспективном исследовании случай-контроль, проведенном среди здоровых мужчин, включенных в программу Physician's Health Study, было показано, что относительный риск развития атеросклероза нижних конечностей (АНК) значимо возрастал в каждом следующем квартиле исходной концентрации высокочувствительного С-реактивного белка (вчСРБ). У мужчин в четвертом квартиле (вчСРБ >2,1 мг/л) риск развития АНК был в 2 раза выше, чем в первом квартиле (вчСРБ <0,55 мг/л) [7].
Целью нашего исследования явилось определение значения параметров АСН по данным ультразвукового обследования периферических артерий у больных РА c низкой и умеренной степенью активности заболевания в сопоставлении с состоянием коронарных артерий (КА).
Материал и методы
Исследование было выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации. До включения в исследование у всех участников было получено письменное информированное согласие. Протокол исследования одобрен этическими комитетами.
Критериями включения больных РА (с достоверным диагнозом, установленным согласно критериям Американской коллегии ревматологов/Европейской антиревматической лиги (ACR/EULAR) 2010г [8] в ФГБНУ "НИИР им. В. А. Насоновой") были: мужчины и женщины в возрасте от 35 до 65 лет длительностью заболевания >5 лет, низкой и умеренной степенью активности РА, с ишемической болезнью сердца (ИБС) (указание в анамнезе на предшествующий инфаркт миокарда (ИМ)) и/или с клиническим подозрением на ИБС (наличие болевых ощущений в грудной клетке или одышку при физической нагрузке).
В группу сравнения включались пациенты с подтвержденным диагнозом стабильной ИБС и стенозирующим атеросклерозом КА по данным коронароангиографии, не имеющие ревматических заболеваний, сопоставимые по полу и возрасту с основной группой.
В исследование не включались лица старше 65 лет, с перенесенным ИМ сроком до 3 мес., имеющие хроническую сердечную недостаточность III-IV функционального класса по NYHA, клинически значимые пороки сердца, атриовентрикулярные блокады II и III степени и другие жизнеугрожающие аритмии, тяжелые хронические заболевания (онкология, почечная и печеночная недостаточность).
Всем пациентам с РА и в группе сравнения проведена оценка таких факторов риска, как артериальная гипертония, курение, избыточная масса тела, отягощенная наследственность по ССЗ, сахарный диабет (СД), дислипидемия, определена скорость клубочковой фильтрации [9]. Концентрации холестерина (ХС), ХС липопротеидов высокой плотности, ХС липопротеидов низкой плотности, триглицеридов определяли стандартными ферментативными методами, на биохимическом анализаторе "ARCHITECT" фирмы "Abbott" (США). Результаты выражали в ммоль/л.
Активность РА определяли по индексу DAS28 в ФГБНУ "НИИР им. В. А. Насоновой" [8].
Определение концентрации вчСРБ в сыворотке крови выполняли с использованием коммерческого набора вчСРБ-ИФА-БЕСТ (Вектор-Бест, Россия) нефелометрическим способом согласно протоколу производителя. Результат измерения сравнивался со стандартом с известной концентрацией вчСРБ, полученной с использованием международного референсного препарата ECR CRM 470. Измерение проводилось на анализаторе белков крови "Беринг Нефелометр" модели BN Pro Spec (Dade-Behring Marburg GmbH, Германия). Концентрацию вчСРБ выражали в мг/дл.
Определение специфических антител — ревматоидного фактора IgM нефелометрическим методом и антител к циклическому цитруллинированному пептиду методом иммунофлюоресцентного анализа с использованием в качестве антигена синтетических циклических цитруллинированных пептидов второго и третьего поколения всем больным РА проводилось в клинико-диагностическом лабораторном отделении ФГБНУ "НИИР" им. В. А. Насоновой.
В отделе ультразвуковых методов исследований ФГБУ "НМИЦ кардиологии им. акад. Е. И. Чазова" Минздрава России всем больным было проведено ультразвуковое исследование (УЗИ) СА, на УЗ-системе экспертного уровня Philips EPIQ 5 c линейным датчиком Philips IU 22 3-9 MГц (Philips, Нидерланды) по стандартной методике для определения наличия, степени выраженности атеросклеротического процесса. АСБ считали структуру, выступающую в просвет артерии на 0,5 мм, или 50%, по сравнению с величиной ТКИМ прилегающих участков стенки сосуда, или структуру, выступающую в просвет сосуда более чем на 1,5 мм, измеренную как расстояние от границы раздела адвентиция-медиа до границы раздела интима-просвет сосуда [10]. Выраженность стенозирования СА определяли в соответствии с критериями ECST — отношение исходного интерадвентициального диаметра артерии в месте стеноза к диаметру просвета артерии в месте стеноза, выраженное в процентах. Показателями АСН в исследовании явились количество АСБ, максимальный стеноз АСБ (%) и суммарный стеноз АСБ (%). Количество АСБ определяли как суммарное количество всех АСБ в 6 сегментах: на протяжении обеих общих СА, их бифуркаций и проксимальной трети обеих внутренних СА (максимальное количество АСБ — 6). Максимальный стеноз определяли как максимальное значение из значений стенозов, полученных в 6 сегментах у каждого пациента. Суммарный стеноз определялся как сумма стенозов всех АСБ на 6 сегментах [11].
Для определения АСН бедренных артерий (БА) применялась аналогичная методика. Были обследованы 4 сегмента: общая БА и проксимальная треть поверхностной БА на протяжении 1,5 см справа и слева. Количество АСБ определялось как суммарное количество всех АСБ в 4 сегментах. Максимальный % стеноза БА определялся как максимальный показатель из значений стенозов, полученных в 4 сегментах у каждого пациента. Суммарный % стеноза определялся как сумма стенозов в исследуемых 4 сегментах БА, выраженный в %.
Инвазивная коронарография выполнена n=18 больным (РА и ИБС) на аппарате Allura Xper FD-10 (Philips, Нидерланды) по методике Judkins через феморальный и радиальный доступы. В остальных случаях n=46 выполнялась мультиспиральная коронарная томография-ангиография по стандартной методике. Значимым поражением КА считалось стенозирование сосуда >50% [12]. Пациенты c РА и в группе сравнения получали терапию статинами, антиагрегантами, бета-блокаторами, антигипертензивными препаратами в соответствии с клиническими рекомендациями по лечению стабильной стенокардии 2020г [13].
Ввод данных производился в системе Excel пакета MS Office. Статистический анализ проведен в среде анализа данных R 4.2.2. Качественные показатели описаны относительными частотами в процентах. Количественные показатели описаны медианой, первым и третьим квартилем (Медиана [Q1; Q3]). Сравнение непрерывных показателей между группами проведено при помощи критерия Манна-Уитни, дискретных — при помощи точного критерия Фишера. Поправка на множественные сравнения не проводилась. Различия считались значимыми при p<0,05.
Результаты
В течение 2021-2023гг нами обследовано 64 пациента: 43 с установленным диагнозом РА и 21 группы сравнения с ИБС без РА. Клиническая характеристика больных представлена в таблице 1.
Как видно из таблицы 1, группы больных были сопоставимы по возрасту, наличию артериальной гипертонии. В группе РА преобладал женский пол, отягощенная наследственность по ССЗ. Пациенты с РА получали противоревматическую терапию, основную долю которой составили базисные противовоспалительные препараты. В группе сравнения чаще отмечалось наличие перенесенного ИМ, СД и курения. По лабораторным параметрам у больных РА уровень скорости оседания эритроцитов был выше. Гиполипидемическую терапию (статины) больные группы сравнения принимали в 2 раза чаще, чем больные РА. По остальным параметрам достоверных отличий не получено.
УЗИ оценка параметров АСН СА была проведена 64 включенным больным (РА n=43, ИБС n=21), результаты представлены в таблице 2.
По данным сравнительного анализа отмечено, что значения количества АСБ и % суммарного стеноза СА в группе РА были ниже, чем в группе ИБС.
Всем больным РА с ИБС и подозрением на ИБС проводилась верификация ишемии миокарда, согласно национальным клиническим рекомендациям "Стабильная ишемическая болезнь сердца" 2020г [13]. По результатам проведенного обследования были выделены две группы пациентов РА: РА ИБС+ n=19, и РА ИБС- n=24. При проведении сравнительного анализа отмечено превалирование мужского пола и дозы ГК у больных РА ИБС+. По остальным параметрам, представленным в таблице 1, достоверных отличий не получено.
При сравнительном анализе параметров каротидной АСН были получены следующие результаты (табл. 3).
Так, больные группы РА ИБС+ достоверно превосходили больных РА ИБС- по всем исследуемым параметрам АСН СА.
По данным УЗИ-обследования каротидного бассейна у больных РА, выявлено, что АСБ СА выявлялись в 100% случаев у больных РА ИБС+, что сочеталось со значимым атеросклеротическим поражением КА. У пациентов РА ИБС- сочетание наличия АСБ СА и значимого поражения КА отмечено лишь у 3 больных (13,6%). Отличий по указанным параметрам между группами РА ИБС+ и ИБС- не отмечено (табл. 4).
При сопоставлении параметров АСН каротидного бассейна по количеству АСБ от 0-3/≤3 и значимостью поражения КА (более/менее 50%) получены следующие результаты (табл. 5).
Как видно из таблицы 5, количество АСБ СА ≥3 (2,0 vs 4,0), процент максимального стеноза АСБ СА (30,0 vs 40,0) и процент суммарного стеноза (82,5 vs 150,0) были выше у больных РА со значимым атеросклеротическим поражением КА.
Таким образом, значимое поражение КА при РА сочетается с более высокой каротидной АСН и большим количеством АСБ СА (≥3 АСБ).
Исследование БА было проведено только больным РА n=43, были получены следующие результаты (табл. 6).
При сравнительном анализе поражения БА у больных РА в зависимости от наличия/отсутствия ИБС отмечено увеличение % суммарного стеноза БА в группе РА ИБС+ (100,0 vs 50,0), без достижения критериев достоверности.
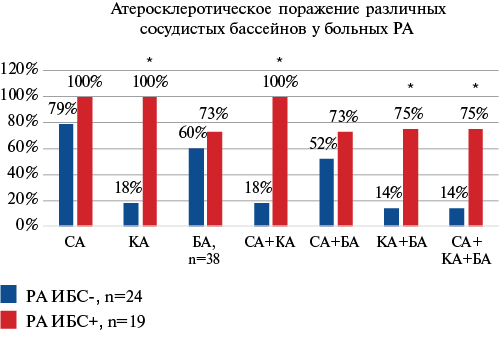
Сравнительная оценка поражения различных сосудистых бассейнов у больных РА ИБС+, РА ИБС- представлена на рисунке 1: у больных РА ИБС+ поражение КА сочетается с наличием АСБ в СА и БА в 75% случаев.
Таблица 1
Клиническая характеристика больных РА и ИБС
Показатели | Все больные РА, n=43 | Группа сравнения, n=21 |
Возраст, лет | 62 [ 61; 64] | 62,5 [ 61; 66] |
Мужчины/женщины, n (%) | 8/35 (18/81%) | 11/10 (52/48)* |
АГ, n (%) | 33 (77%) | 16 (78%) |
Перенесенный ИМ, n (%) | 3 (7%) | 8 (38%)* |
СД, n (%) | 4 (9%) | 7 (33%)* |
Общий ХС, ммоль/л | 4,59 [ 3,9; 5,1] | 4,58 [ 3,9; 6,2] |
ХС ЛВП, ммоль/л | 1,3 [ 1,1; 1,3] | 1,31 [ 0,9; 1,7] |
ХС ЛНП, ммоль/л | 2,35 [ 1,8; 3,14] | 2,34 [ 2,26; 4,0] |
ТГ, ммоль/л | 1,4 [ 0,9; 1,67] | 1,35 [ 1,4; 1,7] |
Отягощенная наследственность по ССЗ, n (%) | 33 (77%) | 9 (43%)* |
Курение, n (%) | 8 (18%) | 10 (48%)* |
Индекс DAS28, баллы | 3,8 [ 3,8; 4,2] | NA |
ИМТ, кг/м2 | 28 [ 26; 32] | 30 [ 28; 34] |
Длительность РА, годы | 12,5 [ 6; 13] | NA |
Позитивность по РФ, n (%) | 34 (79%) | NA |
Позитивность по АЦЦП, n (%) | 31 (72%) | NA |
СОЭ, мм/ч | 12,0 [ 8; 20] | 2,0 [ 2; 15]* |
вчСРБ, мг/дл | 2,7 [ 0,4; 4,8] | 2,2 [ 0,5; 2,1] |
СКФ, мл/мин/1,73 м2 | 89 [ 60; 91] | 81,5 [ 67; 101] |
Доза ГКС, мг/сут. | 2,4±1,4 | NA |
ГИБП, n (%) | 8 (18%) | NA |
БПВП, n (%) | 31 (72%) | NA |
Статины, n (%) | 24 (56%) | 21 (100%)* |
Доза, мг | 19,3±1,56 | 28,5±1,86* |
Примечание: * — p<0,05, ** — p<0,001. Качественные показатели описаны относительными частотами в процентах, количественные данные представлены как среднее ± стандартное отклонение и как медиана [Q1; Q3].
Сокращения: АГ — артериальная гипертония, АЦЦП — антитела к циклическому цитруллинированному пептиду, БПВП — базисные противовоспалительные препараты, вчСРБ — высокочувствительный С-реактивный белок, ГИБП — генноинженерные биологические препараты, ГКС — глюкокортикостероиды, ИМ — инфаркт миокарда, ИМТ — индекс массы тела, ЛВП — липопротеиды высокой плотности, ЛНП — липопротеиды низкой плотности, РА — ревматоидный артрит, РФ — ревматоидный фактор, СД — сахарный диабет, СКФ — скорость клубочковой фильтрации, СОЭ — скорость оседания эритроцитов, ССЗ — сердечно-сосудистые заболевания, ТГ — триглицериды, ХС — холестерин.
Таблица 2
Результаты УЗИ оценки параметров АСН СА у больных РА и ИБС
Признак/группы | РА, n=43 | ИБС, n=21 |
Количество АСБ (0-6) | 3,5 [ 2,0; 4,0] | 4,0 [ 4,0; 5,0]* |
Максимальный стеноз (%) | 35,0 [ 30,0; 40,0] | 40,0 [ 30,0; 46,2] |
Суммарный стеноз СА (%) | 110,0 [ 68,8; 146,2] | 155,0 [ 117,5; 180,0]* |
Примечание: * — p<0,05. Данные представлены как медиана [Q1; Q3].
Сокращения: АСБ — атеросклеротическая бляшка, ИБС — ишемическая болезнь сердца, РА — ревматоидный артрит, СА — сонные артерии.
Таблица 4
Сопоставление данных УЗИ СА и ангиографии КА у больных РА ИБС+, РА ИБС-, ИБС
Локализация АСБ | РА ИБС- | РА ИБС+ | ИБС |
Всего (пациентов) (n) | 24 | 19 | 21 |
СА (n) | 19/24 (79,2%) | 19/19 (100%) | 20/21 (95,2%) |
КА (n) (КА ≥50%) | 4/22 (18,2%)* | 16/16 (100%)** | 15/21 (81,4%) |
СА + КА (n) | 3/22 (13,6%)* | 16/16 (100%)** | 15/21 (71,4%) |
Примечание: * — p<0,05, ** — p<0,001. Данные описаны относительными частотами в процентах. Достоверные отличия получены при сравнении групп РА ИБС- и РА ИБС+.
Сокращения: АСБ — атеросклеротическая бляшка, ИБС — ишемическая болезнь сердца, КА — коронарные артерии, РА — ревматоидный артрит, СА — сонные артерии.
Таблица 5
Параметры АСН СА в зависимости от поражения КА у больных РА
Признак, N=38 | Поражение КА <50%, n=18 | Поражение КА >50%, n=20 |
Количество АСБ (0-3 и более 3) | 2,0 [ 1,0; 3,0] | 4,0 [ 4,0; 5,0]* |
Максимальный стеноз СА (%) | 30,0 [ 25,0; 35,0] | 40,0 [ 35,0; 45,0]* |
Суммарный стеноз СА (%) | 80,0 [ 30,0; 110,0] | 120,0 [ 110,0; 160,0]* |
Примечание: * — p<0,05, ** — p<0,001. Данные представлены как медиана [Q1, Q3].
Сокращения: АСБ — атеросклеротическая бляшка, КА — коронарные артерии, СА — сонные артерии.
Таблица 3
Показатели АСН СА у больных РА ИБС+ и РА ИБС-
Признак/группы | РА ИБС+, n=19 | РА ИБС-, n=24 |
Количество АСБ (0-6) | 4,0 [ 4,0; 5,0] | 2,0 [ 1,0; 3,5]** |
Максимальный стеноз (%) | 35,0 [ 35,0; 45,0] | 30,0 [ 25,0; 35,0]* |
Суммарный стеноз СА (%) | 120,0 [ 110,0; 152,5] | 85,0 [ 40,0; 110,0]* |
Примечание: * — p<0,05, ** — p<0,001. Данные представлены как медиана [Q1; Q3].
Сокращения: АСБ — атеросклеротическая бляшка, ИБС — ишемическая болезнь сердца, РА — ревматоидный артрит, СА — сонные артерии.
Таблица 6
Результаты обследования БА у больных РА
Показатель (пациенты) | РА ИБС- (n=24) | РА ИБС+ (n=19) | Все РА (n=43) |
Количество АСБ БА | 1,0 [ 0,0; 2,0] | 2,0 [ 0,2; 3,8] | 1,0 [ 0,0; 2,0] |
Максимальный стеноз БА, % | 30,0 [ 25,0; 33,8] | 30,0 [ 27,5; 42,5] | 30,0 [ 25,0; 40,0] |
Суммарный стеноз БА, % | 50,0 [ 25,0; 62,5] | 100,0 [ 52,5; 117,5] | 55,0 [ 31,2; 100,0] |
Примечание: * — p<0,05. Данные представлены как медиана [Q1; Q3].
Сокращения: АСБ — атеросклеротическая бляшка, БА — бедренные артерии, ИБС — ишемическая болезнь сердца, РА — ревматоидный артрит.
РА ИБС-, n=24 | РА ИБС+, n=19 | |
СА | 79% | 100% |
КА | 18% | 100% |
БА, n=38 | 60% | 73% |
СА+КА | 18% | 100% |
СА+БА | 52% | 73% |
КА+БА | 14% | 75% |
СА+КА+БА | 14% | 75% |
Рис. 1. Атеросклеротическое поражение различных сосудистых бассейнов у больных РА.
Примечание: * — p<0,05. Данные представлены как медиана [Q1; Q3].
Сокращения: БА — бедренные артерии, ИБС — ишемическая болезнь сердца, КА — коронарные артерии, РА — ревматоидный артрит, СА — сонные артерии.
Обсуждение
Атеросклеротические ССЗ являются основной причиной смертности и заболеваемости при РА. При этом повышенный риск ССЗ возникает даже на ранних стадиях течения РА, являясь возможным его доклиническим проявлением [14][15]. Эти данные согласуются с результатами нашего исследования, где продолжительность РА составила в среднем 12,5 лет, а уровень вчСРБ не отличался у больных РА и группы сравнения. При этом активность заболевания была низкой и умеренной степени, т. к. пациенты с РА длительно получали адекватную противоревматическую терапию, при этом индекс активности заболевания DAS 28 был равен 3,8. Больные РА и ИБС без воспалительных заболеваний не отличались между собой по традиционным факторам риска, однако частота перенесенного ИМ, курения и СД была выше у больных группы сравнения. Проведение активной противовоспалительной терапии может объяснить низкие показатели воспаления и более низкую АСН бассейна СА в исследуемой группе больных РА в целом. Данные других исследований напротив показывают превалирование каротидных АСБ у пациентов с РА в 2-3 раза [16]. Недавно было показано, что у больных РА с низким ССР каротидные АСБ наблюдались чаще, чем в группе контроля (17% vs 8%; p=0,02), а частота АСБ СА не зависела от стадии, активности РА и проводимой терапии [17]. Aubry MC, et al. 2007г изучили особенности коронарных АСБ посмертно в небольшом исследовании, которое показало, что у пациентов с РА было меньше коронарного атеросклероза (меньше АСБ и стенозов), чем в контрольной группе, но большее количество уязвимых АСБ, содержащих более высокое количество воспалительных компонентов в КА [18].
Проспективный анализ 599 пациентов с РА без предшествующих ССЗ подтвердил, что ТКИМ СА и наличие АСБ независимо предсказывали будущий острый коронарный синдром. При этом частота новых случаев острого коронарного синдрома при РА была в 2,3 раза выше при односторонней, и в 4 раза при двусторонней локализации АСБ СА, по сравнению с пациентами без ИМ [19]. У больных ИБС без аутоиммунных заболеваний такая тенденция не прослеживается. Так, по данным Ершовой А. И. и др., было показано, что в группе больных ИБС преобладают лица с 4 АСБ и более, что достоверно выше, чем в контрольной группе пациентов, не отличающихся по факторам ССР от основной. По показателям АСН СА достоверные различия получены не были, в то же время по уровню максимального и суммарного процента стеноза СА различия были близки к достоверным [20]. Данные другого исследования предлагают оценивать не только локализацию, количество АСБ, но и структуру [21] в качестве дополнительного маркера развития ССО.
По данным последних исследований определение параметров АСН обладает большей прогностической ценностью над определением ТКИМ [5]. В работе Störk S, et al. по результатам 4-летнего проспективного наблюдения было показано увеличение относительного риска общей и сердечно-сосудистой смертности с ростом числа каротидных АСБ при РА. Так, при наличии 1-4 АСБ риск общей смертности возрастал почти в 3 раза, при наличии ≥5 АСБ — почти в 5 раз [22]. Результаты нашего исследования показали, что наличие ≥3 каротидных АСБ сочеталось со значимым поражением КА при РА, тем самым определяя более высокий ССР.
При проведении сравнительного анализа параметров АСН СА всех включенных в исследование пациентов (РА и ИБС) количество АСБ, процент максимального и суммарного стеноза были ниже у больных РА по сравнению с больными ИБС. Однако при сравнении больных РА ИБС+ и РА ИБС- выявлены более высокие значения этих показателей АСН у больных РА ИБС+ по сравнению РА ИБС-, без значимого отличия по основным факторам ССР и факторам, связанным с самой болезнью, воспалительным параметрам. Вместе с тем при разделении пациентов РА в зависимости от степени поражения КА (стеноз КА более/менее 50%) АСН была выше у больных РА со значимым, >50%, поражением КА. Кроме того, имеются данные, что у больных РА с подозрением на ИБС или с верифицированной ИБС стенозирование КА диагностируется в 35% случаев [23]. Результаты нашего исследования показали, что количество каротидных АСБ (>3) по данным УЗИ с учетом показателей АСН СА соотносится с наличием значимого коронарного атеросклероза при РА. Следует отметить наличие каротидных АСБ у всех больных РА ИБС+.
К настоящему моменту в литературе работы по изучению АНК при РА немногочисленны. Так, исследование Liang KP, et al. 2006г было ретроспективным когортным, в котором изучалась частота встречаемости АНК у больных РА. Авторы показали, что общая заболеваемость АНК при РА составила 6,27 на 1 тыс. человеко-лет, а скорректированный показатель отношения рисков (ОР) 1,73 (95% доверительный интервал (ДИ): 1,21-1,83). Риск развития АНК в зависимости от пола был выше у женщин (скорректированный ОР 1,80, 95% ДИ: 1,61-2,02), чем у мужчин (скорректированный ОР 1,49, 95% ДИ: 1,21-1,83) [24].
Вместе с тем преимущества оценки параметров АСН АСБ, как СА, так и БА перед измерением ТКИМ показаны в работе Frerix M, et al. 2014г на когорте больных системной красной волчанкой. Отмечено, что у пациентов с выраженной АСН АСБ сонных и феморальных артерий риск развития ССО повышен по сравнению с больными системной красной волчанкой с единственной каротидной или бедренной АСБ (ОР 5,92, 95% ДИ: 1,55-22,67, p=0,009) [25]. Ограничением нашего исследования явилось то, что УЗИ БА было проведено только больным РА, и не проводилось больным в группе сравнения. Результаты нашей работы обнаружили более высокие значения показателя суммарного стеноза АСБ БА в группе РА ИБС+, чем у больных РА без ИБС, однако отличия были недостоверны. Вместе с тем наличие АСБ БА в 75% сочеталось со значимым поражением КА.
Ограничения исследования. Количество больных n=64 в исследовании считалось нами достаточным для статистической обработки результатов и подтверждения гипотезы. Для обоснования размера выборки был проведен анализ мощности исследования. Уровень значимости принят α=0,05, мощность 1β=0,8. Расчет проводился на основе Z-статистики с учетом математического ожидания и стандартного отклонения данных. Исследование пионерское, других данных в российской и зарубежной литературе нет. По нашему мнению, результаты исследования требуют дальнейшего изучения.
Заключение
При РА в сочетании с ИБС показатели каротидной АСН выше, чем у больных РА без ИБС. Наличие ≥3 АСБ СА определяет значимое атеросклеротическое поражение КА при РА. У больных РА с ИБС сочетание каротидных и феморальных АСБ в 75% случаев ассоциировано со значимым атеросклерозом КА. Определение параметров АСН периферических артерий повышает клиническую значимость УЗИ в качестве этапа не инвазивной диагностики ИБС при РА, что поможет персонализировать оценку ССР при аутоиммунных воспалительных заболеваниях.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Arida A, Zampeli E, Konstantonis G, et al. Rheumatoid arthritis is sufficient to cause atheromatosis but not arterial stiffness or hypertrophy in the absence of classical cardiovascular risk factors. Clin Rheumatology. 2015;34(5):853-9. doi:10.1007/s10067-015-2914-1.
2. Насонов Е. Л., Попкова Т. В., Новикова Д. С. Сердечно-сосудистая патология при ревматических заболеваниях. Терапевтический архив. 2016;88(5):4-12. doi:10.17116/terarkh20168854-12.
3. Pope JE, Nevskaya T, Barra L, et al. Carotid Artery Atherosclerosis in Patients with Active Rheumatoid Arthritis: Predictors of Plaque Occurrence and Progression Over 24 Weeks. Open Rheumatol J. 2016;10:49-59. doi:10.2174/1874312901610010049.
4. Agca R, Heslinga SC, Rollefstad S, et al. EULAR recommendations for cardiovascular disease risk management in patients with rheumatoid arthritis and other forms of inflammatory joint disorders: 2015/2016 update. Ann Rheum Dis. 2017;76(1):17-28. doi:10.1136/annrheumdis-2016-209775.
5. Бойцов С. А., Погосова Н. В., Аншелес А. А. и др. Кардиоваскулярная профилактика 2022. Российские национальные рекомендации. Российский кардиологический журнал. 2023;28(5):5452. doi:10.15829/1560-4071-2023-5452.
6. Inaba Y, Chen JA, Bergmann SR. Carotid plaque, compared with carotid intima-media thickness, more accurately predicts coronary artery disease events: a metaanalysis. Atherosclerosis. 2012;220(1):128-33. doi:10.1016/j.jcmg.2013.11.014.
7. Ridker PM, Cushman M, Stampfer MJ, et al. Plasma concentration of C-reactive protein and risk of developing peripheral vascular disease. Circulation. 1998;97(5):425-8. doi:10.1161/01.cir.97.5.425.
8. Aletaha D, Neogi T, Silman AJ, et al. 2010 rheumatoid arthritis classification criteria: an American College of Rheumatology/European League Against Rheumatism collaborative initiative. Ann Rheum Dis. 2010;69(9):1580-8. doi:10.1136/ard.2010.138461. Erratum in: Ann Rheum Dis. 2010;69(10):1892.
9. Catapano AL, Graham I, De Backer G, et al. 2016 ESC/EAS Guidelines for the Management of Dyslipidaemias: The Task Force for the Management of Dyslipidaemias of the European Society of Cardiology (ESC) and European Atherosclerosis Society (EAS) Developed with the special contribution of the European Assocciation for Cardiovascular Prevention & Rehabilitation (EACPR). Atherosclerosis. 2016;253:281344. doi:10.1016/j.atherosclerosis.2016.08.018.
10. Touboul PJ, Hennerici MG, Meairs S, et al. Mannheim carotid intima-media thickness and plaque consensus (2004—2006—2011). An update on behalf of the advisory board of the 3rd, 4th and 5th watching the risk symposia, at the 13th, 15th and 20th European Stroke Conferences, Mannheim, Germany, 2004, Brussels, Belgium, 2006, and Hamburg, Germany, 2011. Cerebrovasc Dis. 2012;34:2906. doi:10.1159/000343145.
11. Sakaguchi M, Kitagawa K, Nagai Y, et al. Equivalence of plaque score and intima-media thickness of carotid ultrasonography for predicting severe coronary artery lesion. Ultrasound Med Biol. 2003;29(3):367-71. doi:10.1016/s0301-5629(02)00743-3.
12. Терновой С. К., Синицын В. Е. Спиральная компьютерная и электронно-лучевая ангиография. М.: Видар, 1998. 141 с. ISBN: 5-88429-035-7.
13. Российское кардиологическое общество (РКО). Стабильная ишемическая болезнь сердца. Клинические рекомендации 2020. 2020;25(11):4076. doi:10.15829/29/1560-4071-2020-4076.
14. Meune C, Touz´e E, Trinquart L, et al. Highrisk of clinical cardiovascular events in rheumatoid arthritis: levels of associations of myocardial infarction and stroke through a systematic review and meta-analysis Archives of Cardiovascular Diseases. 2010;103(4):253-61. doi:10.1016/j.acvd.2010.03.007.
15. Amaya-Amaya J, Montoya-Sánchez L, Rojas-Villarraga A. Cardiovascular involvement in autoimmune diseases. Biomed Res Int. 2014;2014:367359. doi:10.1155/2014/367359.
16. Kobayashi H, Giles JT, Polak JF, et al. Increased prevalence of carotid artery atherosclerosis in rheumatoid arthritis is artery-specific. J Rheumatol. 2010;37(4):730-9. doi:10.3899/jrheum.090670.
17. Герасимова Е. В., Попкова Т. В., Шалыгина М. В. и др. Субклинический атеросклероз сонных артерий у больных ревматоидным артритом с низким сердечно-сосудистым риском. Терапевтический архив. 2023;95(5):375-9. doi:10.26442/00403660.2023.05.202203.
18. Aubry MC, Maradit-Kremers H, Reinalda MS, et al. Differences in atherosclerotic coronary heart disease between subjects with and without rheumatoid arthritis. J Rheumatol. 2007;34(5):937-42.
19. Evans MR, Escalante A, Battafarano DF, et al. Carotid atherosclerosis predicts incident acute coronary syndromes in rheumatoid arthritis. Arthritis Rheum. 2011;63:1211-20. doi:10.1002/art.30265.
20. Ершова А. И., Мешков А. Н., Шальнова С. А. и др. Ультразвуковые параметры атеросклероза сонных и бедренных артерий у больных ишемической болезнью сердца. Профилактическая медицина. 2014;17(6):56-63. doi:10.17116/profmed201417656-63.
21. Semb AG, Rollefstad S, Provan SA, et al. Carotid plaque characteristics and disease activity in rheumatoid arthritis. J Rheumatol. 2013;40(4):359-68. doi:10.3899/jrheum.120621.
22. Störk S, van den Beld AW, von Schacky C, et al. Carotid artery plaque burden, stiffness, and mortality risk in elderly men: a prospective, population-based cohort study. Circulation. 2004;110(3):344-8. doi:10.1161/01.CIR.0000134966.10793.C9.
23. Герасимова Е. В., Попкова Т. В., Новикова Д. С. и др. Факторы риска развития стеноза коронарных артерий у больных ревматоидным артритом. Научно-практическая ревматология. 2017;55(6):628-33. doi:10.14412/1995-4484-2017-628-633.
24. Liang KP, Liang KV, Matteson EL, et al. Incidence of noncardiac vascular disease in rheumatoid arthritis and relationship to extraarticular disease manifestations. Arthritis Rheum. 2006;54(2):642-8. doi:10.1002/art.21628.
25. Frerix M, Stegbauer J, Kreuter A, et al. Atherosclerotic plaques occur in absence of intima-media thickening in both systemic sclerosis and systemic lupus erythematosus: a duplexsonography study of carotid and femoral arteries and follow-up for cardiovascular events. Arthritis Res Ther. 2014;16(1):R54. doi:10.1186/ar4489.
Об авторах
О. А. ФомичеваРоссия
Фомичева Ольга Аркадьевна — к. м. н., с. н. с. отдела ангиологии.
Москва
Конфликт интересов:
Нет
Т. В. Балахонова
Россия
Балахонова Татьяна Валентиновна — д. м. н., профессор, г. н. с. отдела ультразвуковых методов исследования.
Москва
Конфликт интересов:
Нет
О. А. Погорелова
Россия
Погорелова Ольга Александровна — к. м. н., с. н. с. отдела ультразвуковых методов исследования.
Москва
Конфликт интересов:
Нет
М. И. Трипотень
Россия
Трипотень Мария Ильинична — к. м. н., с. н. с. отдела ультразвуковых методов исследования.
Москва
Конфликт интересов:
Нет
Ф. Ф. Шингареева
Россия
Шингареева Фируза Фаниловна — врач-кардиолог отдела ангиологии.
Москва
Конфликт интересов:
Нет
С. О. Кузякина
Россия
Кузякина Светлана Олеговна — лаборант лаборатории биостатистики отдела эпидемиологии хронических неинфекционных заболеваний.
Москва
Конфликт интересов:
Нет
Е. Б. Яровая
Россия
Яровая Елена Борисовна — д. ф.- м. н., профессор кафедры теории вероятностей, отделение математики, механико-математический факультет.
Москва
Конфликт интересов:
Нет
Е. В. Герасимова
Россия
Герасимова Елена Владимировна — к. м. н., с. н. с. лаборатории системной красной волчанки.
Москва
Конфликт интересов:
Нет
Т. В. Попкова
Россия
Попкова Татьяна Валентиновна — д. м. н., начальник отдела системных ревматических заболеваний.
Москва
Конфликт интересов:
Нет
Ю. А. Карпов
Россия
Карпов Юрий Александрович — д. м. н., профессор, руководитель отдела ангиологии.
Москва
Конфликт интересов:
Нет
Е. Л. Насонов
Россия
Насонов Евгений Львович — д. м. н., профессор, академик РАН, научный руководитель ФГБНУ НИИ ревматологии им. В.А. Насоновой.
Москва
Конфликт интересов:
Нет
Дополнительные файлы
- Метод ультразвукового исследования сонных артерий при ревматоидном артрите (РА) определен в качестве скринингового метода на наличие бессимптомных атеросклеротических бляшек (АСБ) для реклассификации сердечно-сосудистого риска.
- Параметры атеросклеротической нагруженности (АСН), являясь более широкими характеристиками АСБ, демонстрируют выраженную прогностическую значимость развития сердечно-сосудистых осложнений.
- В работе впервые показано, что параметры АСН периферических артерий при РА в сочетании с ишемической болезнью сердца (ИБС) выше, чем у больных РА без ИБС, что может рассматриваться в качестве этапа неинвазивной диагностики ИБС при РА.
Рецензия
Для цитирования:
Фомичева О.А., Балахонова Т.В., Погорелова О.А., Трипотень М.И., Шингареева Ф.Ф., Кузякина С.О., Яровая Е.Б., Герасимова Е.В., Попкова Т.В., Карпов Ю.А., Насонов Е.Л. Атеросклеротическая нагруженность периферических артерий в диагностике коронарного атеросклероза при ревматоидном артрите. Российский кардиологический журнал. 2024;29(8):5902. https://doi.org/10.15829/1560-4071-2024-5902. EDN: FJPFWE
For citation:
Fomicheva O.A., Balakhonova T.V., Pogorelova O.A., Tripoten M.I., Shingareeva F.F., Kuzyakina S.O., Yarovaya E.B., Gerasimova E.V., Popkova T.V., Karpov Yu.A., Nassonov E.L. Peripheral plaque burden in the diagnosis of coronary atherosclerosis in rheumatoid arthritis. Russian Journal of Cardiology. 2024;29(8):5902. (In Russ.) https://doi.org/10.15829/1560-4071-2024-5902. EDN: FJPFWE
JATS XML

















































