Перейти к:
Предикторы развития сердечно-сосудистых осложнений у больных с хронической сердечной недостаточностью и пневмонией, вызванной Pseudomonas aeruginosa
https://doi.org/10.15829/1560-4071-2024-5817
EDN: PNNAGK
Аннотация
Цель. Выявить предикторы развития сердечно-сосудистых осложнений (ССО) у больных с хронической сердечной недостаточностью (ХСН) и пневмонией, вызванной P. аeruginosa.
Материал и методы. В исследование включено 92 пациента с ХСН с промежуточной или низкой фракцией выброса (ФВ) левого желудочка (ЛЖ) и нозокомиальной пневмонией. На основании микробиологического исследования мокроты или бронхоальвеолярного лаважа пациенты были разделены на 2 группы: в I группу были включены 51 больной с ХСН и пневмонией, вызванной P. аeruginosa, во II группу — 41 пациент с ХСН и пневмонией, вызванной другими возбудителями (Staphylococcus aureus, Streptococcus pneumoniae). За время пребывания в стационаре были оценены следующие ССО: смерть от сердечно-сосудистых причин, острый коронарный синдром, нефатальное острое нарушение мозгового кровообращения, тромбоэмболия легочной артерии, тромбоз вен нижних конечностей.
Результаты. ССО достоверно чаще наблюдались у больных с ХСН и пневмонией, вызванной P. аeruginosa — 30 (58,8%), чем у пациентов с ХСН и пневмонией, вызванной S. aureus или S. pneumoniae — 5 (12,1%). В общем анализе крови у пациентов I группы выявлено снижение уровня гемоглобина до 114 [95; 133] г/л, при сравнении с больными II группы — 139 [118; 150] г/л (р<0,001) и повышение уровня лейкоцитов 10,2×109/л и 6,96×109/л (p<0,001). В биохимическом анализе крови у пациентов I группы обнаружено значимое увеличение С-реактивного белка (СРБ) 105 [60; 191] и 18 [14; 55,1] мг/л (p<0,001). Пациенты с пневмонией, вызванной P. aeruginosa, имели более распространенное поражение легких, чем пациенты с пневмонией другой этиологии.
Заключение. Наиболее значимыми предикторами развития ССО у больных с ХСН и пневмонией, вызванной P. aeruginosa, являются: снижение ФВ ЛЖ <40% (относительный риск (RR) 1,833; 95% доверительный интервал (ДИ): 1,188-3,400; p=0,005), лейкоцитоз >11×109/л (RR 2,412; 95% ДИ: 1,399-4,158; p=0,048), увеличение СРБ >133 мг/л (RR 3,115; 95% ДИ: 1,611-6,025; p<0,001) и гипопротеинемия <57 г/л (RR 5,225; 95% ДИ: 1,249-21,854; p=0,012).
Ключевые слова
Для цитирования:
Подзолков В.И., Тарзиманова А.И., Пономарева Л.А., Соколова Е.Е., Чинова А.А., Попова Е.Н., Пономарев А.Б., Лория И.Ж., Варгина Т.С., Сизова Ж.М., Зискина Н.К. Предикторы развития сердечно-сосудистых осложнений у больных с хронической сердечной недостаточностью и пневмонией, вызванной Pseudomonas aeruginosa. Российский кардиологический журнал. 2024;29(4):5817. https://doi.org/10.15829/1560-4071-2024-5817. EDN: PNNAGK
For citation:
Podzolkov V.I., Tarzimanova A.I., Ponomareva L.A., Sokolova E.E., Chinova A.A., Popova E.N., Ponomarev A.B., Loria I.Zh., Vargina T.S., Sizova Zh.M., Ziskina N.K. Predictors of cardiovascular events in patients with heart failure and Pseudomonas aeruginosa pneumonia. Russian Journal of Cardiology. 2024;29(4):5817. (In Russ.) https://doi.org/10.15829/1560-4071-2024-5817. EDN: PNNAGK
Хроническая сердечная недостаточность (ХСН) является одним из наиболее распространенных заболеваний сердечно-сосудистой системы. Согласно продолжающимся популяционным исследованиям, влияние бронхолегочной инфекции имеет важное значение в развитии тяжелых сердечно-сосудистых осложнений (ССО) при ХСН. В исследовании McMurray JJ, et al. (2013) было показано, что у пациентов с ХСН с низкой фракцией выброса (ФВ) левого желудочка (ЛЖ) перенесенная пневмония увеличивала риск развития летального исхода в 4,34 раза, а также приводила к более длительной декомпенсации ХСН [1].
Несмотря на достижения в создании новых антибактериальных препаратов, пневмония, названная сэром Уильямом Ослером "другом стариков", остается одним из самых тяжелых заболеваний среди ослабленных пациентов с коморбидными патологиями [2]. Возникновение пневмонии в 4 раза увеличивает риск ССО в течение первого месяца госпитализации и более чем в 100 раз в первые 3 дня после госпитализации [3].
В большом проспективном обсервационном исследовании, включавшем 3921 пациента, госпитализированного с внебольничной пневмонией, у 315 (8%) больных были диагностированы несколько ССО во время госпитализации. Авторы показали, что факторами риска развития острых ССО являются: возраст старше 65 лет, ХСН, тахикардия, септический шок, мультилобарная пневмония, гипоальбуминемия <30 г/л и пневмококковая пневмония [4].
Патогенез развития ССО у пациентов с ХСН и пневмонией обусловлен системной воспалительной реакцией, повреждением эндотелия и развитием протромботической активности. Поскольку ССО чаще возникают после тяжелого течения инфекции, можно полагать, что вирулентность возбудителя и иммунный ответ вносят определенный вклад в их развитие [5].
В настоящее время имеются единичные клинические исследования, посвященные изучению роли пневмонии, вызванной P. аeruginosa, в развитии ССО у больных с ХСН. Учитывая высокую вирулентность бактерии, можно предположить, что пневмония, ассоциированная с P. аeruginosa, будет приводить к более тяжелым ССО, чем пневмония другой этиологии.
Цель исследования: выявить предикторы развития ССО у больных с ХСН и пневмонией, вызванной P. аeruginosa.
Материал и методы
В исследование включено 92 пациента с ХСН с промежуточной или низкой ФВ ЛЖ и нозокомиальной пневмонией, госпитализированных в клинику факультетской терапии № 2 УКБ № 4 ФГАОУ ВО Первого МГМУ им. И. М. Сеченова (Сеченовский Университет). На основании микробиологического исследования мокроты или бронхоальвеолярного лаважа пациенты были разделены на 2 группы: в I группу были включены 51 больной с ХСН и пневмонией, вызванной P. аeruginosa, во II группу — 41 пациент с ХСН и пневмонией, вызванной другими возбудителями (S. aureus, S. pneumoniae). Критериями исключения были подтвержденная коронавирусная инфекция SARS-CoV-2, хроническая обструктивная болезнь легких, тяжелая патология внутренних органов, онкологические заболевания, беременность.
Верификация ХСН проводилась на основании повышения уровня мозгового натрийуретического пептида >400 пг/мл (NT-proBNP) и данных эхокардиографии (ЭхоКГ) (наличия диастолической дисфункции миокарда или снижение ФВ ЛЖ <50%), что соответствует критериям диагноза ХСН в современных клинических рекомендациях [6]. Исследование было выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации и было одобрено локальным этическим комитетом Первого МГМУ им. И. М. Сеченова (Сеченовского Университета), протокол № 23-22 от 17.11.2022. До включения в исследование у всех участников было получено письменное информированное согласие.
Пациенты I и II группы были сопоставимы по возрасту, полу, частоте встречаемости артериальной гипертензии, ишемической болезни сердца, сахарного диабета, ожирения, хронической болезни почек. У пациентов I группы достоверно чаще была диагностирована ХСН с промежуточной и низкой ФВ ЛЖ, чем во II группе. Клиническая характеристика пациентов представлена в таблице 1.
За время пребывания в стационаре были оценены следующие ССО: смерть от сердечно-сосудистых причин, острый коронарный синдром (ОКС), нефатальное острое нарушение мозгового кровообращения (ОНМК), тромбоэмболия легочной артерии (ТЭЛА), тромбоз вен нижних конечностей. Медиана длительности наблюдения составила 20±2,3 дней. Для диагностики ССО проводилось общеклиническое обследование, включающее общий и биохимический анализы крови, коагулограмму и определение мозгового натрийуретического пептида, компьютерную томографию органов грудной клетки и головного мозга, спирометрию, пульсоксиметрию, трансторакальную ЭхоКГ, электрокардиографию, ультразвуковую допплерографию сосудов нижних конечностей.
Статистическая обработка данных выполнена с помощью программы jamovi версии 2.0.1 для операционной системы macOS BigSur версии 11.5.2. Для представления количественных данных использовалась медиана с указанием интерквартильного размаха (Me [Q1; Q3]). Представление качественных переменных осуществлялось с помощью указания абсолютного числа и процентного соотношения (n, %). Сравнение количественных данных производилось с помощью U-критерия Манна-Уитни. Для сравнения качественных показателей использовались точный критерий Фишера (при частоте ожидаемых явлений <5), критерий χ2 Пирсона с поправкой Йетса на непрерывность (при частоте ожидаемых явлений 6-9) и критерий χ2 Пирсона (при частоте ожидаемых явлений >10). Для всех критериев использован уровень статистической значимости 5%, статистические различия признавались значимыми при p<0,05. Многофакторный регрессионный логистический анализ применялся с целью определения прогностических маркеров развития событий. Для оценки чувствительности и специфичности маркера проводился ROC-анализ с использованием программного обеспечения MedCalc 22.019.
Таблица 1
Клиническая характеристика пациентов, включенных в исследование
|
Клиническая характеристика |
I группа |
II группа |
p-value |
|
Количество пациентов, n (%) |
51 (100%) |
41 (100%) |
— |
|
Возраст, лет |
62 [ 48,0; 71,0] |
65 [ 48,0; 74,0] |
0,368 |
|
Мужчины, n (%) |
26 (51%) |
26 (63%) |
0,232 |
|
Женщины, n (%) |
25 (49%) |
15 (36%) |
0,232 |
|
Артериальная гипертензия, n (%) |
34 (67%) |
26 (63%) |
0,750 |
|
Ишемическая болезнь сердца, n (%) |
40 (78%) |
31 (76%) |
0,821 |
|
Постинфарктный кардиосклероз, n (%) |
10 (20%) |
6 (15%) |
0,535 |
|
Сахарный диабет, n (%) |
6 (12%) |
10 (24%) |
0,114 |
|
Ожирение, n (%) |
31 (60%) |
30 (73%) |
0,194 |
|
ХБП, n (%) |
20 (39%) |
21 (51%) |
0,252 |
|
ХСН с промежуточной ФВ ЛЖ (от 40% до 49%), n (%) |
36 (70,5%) |
37 (90%) |
0,022 |
|
ХСН с низкой ФВ ЛЖ (<40%), n (%) |
15 (29,5%) |
4 (10%) |
0,025 |
Сокращения: ЛЖ — левый желудочек, ФВ — фракция выброса, ХБП — хроническая болезнь почек, ХСН — хроническая сердечная недостаточность.
Результаты
ССО достоверно чаще наблюдались у больных с ХСН и пневмонией, вызванной P. аeruginosa — 30 (58,8%), чем у пациентов с ХСН и пневмонией, вызванной S. aureus или S. pneumoniae — 5 (12,1%). Смерть от сердечно-сосудистых причин была диагностирована у 11 (21,5%) пациентов I группы и у 1 (2,4%) больного II группы; ОКС — у 10 (19,6%) и 1 (2,4%) пациента, соответственно; ОНМК — у 5 (9,8%) больных I группы, во II группе ОНМК не было; ТЭЛА — у 5 (9,8%) пациентов в группе I, во II группе ТЭЛА не диагностировалась; тромбоз вен нижних конечностей достоверно чаще был диагностирован в I группе — 12 (23,5%), чем во II группе — 1 (2,4%) (p<0,05), что представлено на рисунке 1.
В общем анализе крови у пациентов с ХСН и пневмонией, вызванной P. аeruginosa, выявлено снижение уровня гемоглобина до 114 [ 95; 133] г/л, при сравнении с больными ХСН и пневмонией, вызванной S. aureus или S. pneumoniae — 139 [ 118; 150] г/л (р<0,001); повышение уровня тромбоцитов 357×109/л и 215×109/л (p<0,001) и лейкоцитов 10,2×109/л и 6,96×109/л (p<0,001). В биохимическом анализе крови у пациентов I группы обнаружено значимое увеличение С-реактивного белка (СРБ) и фибриногена в сравнении с аналогичными показателями во II группе: СРБ — 105 [ 60; 191] и 18 [ 14; 55,1] мг/л (p<0,001), фибриноген — 5,4 [ 4; 7] и 3,4 [ 3; 4] г/л (p=0,006), соответственно (табл. 2).
При проведении ЭхоКГ было установлено, что средние значения ФВ ЛЖ были снижены как у больных I группы — 45 [ 39,0; 54]%, так и во II группе — 48 [ 40; 59]%, но достоверно не различались (рис. 2).
Пациенты с пневмонией, вызванной P. aeruginosa, имели более распространенное поражение легких, чем пациенты с пневмонией другой этиологии. Среднее количество пораженных сегментов легких было достоверно выше в I группе, чем во II группе (5 vs 2, p=0,011). Сатурация кислорода на воздухе (SpO2) была достоверно меньше у пациентов I группы — 91 [ 89; 94], чем у больных II группы — 94 [ 92; 95], (p=0,022), при этом достоверных различий по показателям спирометрии обнаружено не было (табл. 3).
При проведении многофакторного регрессионного анализа наиболее значимыми предикторами развития ССО при пневмонии, вызванной P. aeruginosa, были снижение гемоглобина (относительный риск (RR) 2,119; 95% доверительный интервал (ДИ): 1,212-3,707; p<0,001), тромбоцитоз (RR 3,216; 95% ДИ: 1,453-7,118; p=0,001), лейкоцитоз (RR 2,412; 95% ДИ: 1,399-4,158; p=0,048), увеличение скорости оседания эритроцитов (RR 2,412; 95% ДИ: 1,452-4,007; p<0,001), увеличение СРБ (RR 3,115; 95% ДИ: 1,611-6,025; p<0,001), гипопротеинемия (ОР 5,225; 95% ДИ: 1,249-21,854; p=0,012), увеличение фибриногена (RR 1,847; 95% ДИ: 1,035-3,296; p=0,020), снижение ФВ ЛЖ <40% (RR 1,833; 95% ДИ: 1,188-3,400; p=0,005), количество пораженных сегментов на мультиспиральной компьютерной томографии >3 (RR 2,871; 95% ДИ: 1,383-5,960; p=0,045) (табл. 4).
Для определения пороговых значений маркёров возникновения ССО у больных с пневмонией, вызванной P. aeruginosa, был выполнен ROC-анализ. Наибольшей чувствительностью и специфичностью обладали лейкоцитоз >11×109/л, увеличение СРБ >133 мг/л, гипопротеинемия <57 г/л и снижение гемоглобина <110 г/л.
Лейкоцитоз >11×109/л с чувствительностью 81,2% и специфичностью 78,8% свидетельствует о высоком риске развития ССО у больных с пневмонией P. aeruginosa (Area Under Curve, AUC=0,784) (рис. 3).
Увеличение СРБ >133 мг/л с чувствительностью 75% и специфичностью 88,9% свидетельствует о высоком риске развития ССО у больных с пневмонией P. aeruginosa (Area Under Curve, AUC=0,790) (рис. 4).
Гипопротеинемия <57 г/л обладает высокой диагностической ценностью для определения риска развития ССО у больных с пневмонией P. aeruginosa с чувствительностью 92,3% и специфичностью 93,7% (Area Under Curve, AUC=0,957) (рис. 5).
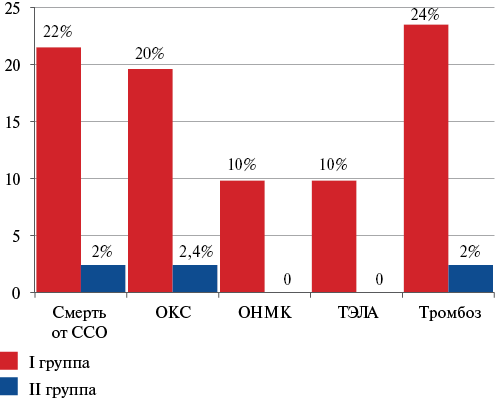
Рис. 1. Распространенность ССО в исследуемых группах.
Сокращения: ОКС — острый коронарный синдром, ОНМК — острое нарушение мозгового кровообращения, ССО — сердечно-сосудистые осложнения, ТЭЛА — тромбоэмболия легочной артерии.
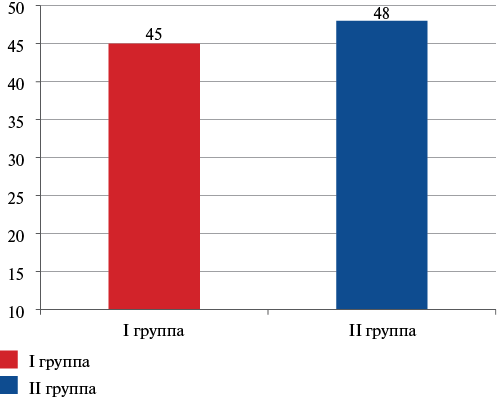
Рис. 2. Значение ФВ ЛЖ в исследуемых группах.
Таблица 2
Результаты лабораторных исследований у пациентов I и II групп
|
Показатель |
I группа |
II группа |
p-value |
|
Гемоглобин, г/л |
114 [ 95,3; 133] |
139 [ 118; 150] |
<0,001 |
|
Тромбоциты, ×109/л |
357 [ 244; 453] |
215 [ 164; 276] |
<0,001 |
|
Эритроциты, ×1012/л |
4,14 [ 3,16; 4,48] |
4,52 [ 4,13; 5,17] |
0,001 |
|
Лейкоциты, ×109/л |
10,2 [ 8,50; 15,0] |
6,96 [ 5,80; 9,10] |
<0,001 |
|
СОЭ, мм/ч |
46,5 [ 34,3; 62,0] |
12,0 [ 9,75; 24,5] |
<0,001 |
|
Общий белок, г/л |
63 [ 56,0; 72,0] |
70 [ 64,1; 74,0] |
0,016 |
|
CРБ, мг/л |
105 [ 57,75; 197] |
18 [ 14; 55,1] |
<0,001 |
|
Фибриноген, г/л |
5,40 [ 3,80; 6,67] |
3,38 [ 2,80; 4,35] |
0,006 |
Сокращения: СОЭ — скорость оседания эритроцитов, СРБ — С-реактивный белок.
Таблица 3
Поражение легких в исследуемых группах
|
I группа |
II группа |
p-value |
|
|
Количество пораженных сегментов легких, n |
5 [ 3; 7] |
2 [ 1; 3,5] |
0,011 |
|
Дыхательная недостаточность 1 степени 2 степени 3 степени |
11 (21,5%) 6 (10%) 3 (6%) |
9 (22%) 2 (10%) 0 (0%) |
0,954 0,962 0,112 |
|
Спирометрия ОФВ1, % ЖЕЛ, % ФЖЕЛ, % Индекс Тиффно, % |
83,0 [ 77,0; 95,0] 90,0 [ 81,0; 103,0] 92,0 [ 85,5; 112,0] 79,0 [ 75,0; 90,5] |
91,0 [ 66,0; 95,0] 85,0 [ 74,0; 106,0] 94,0 [ 80,0; 105,0] 74,5 [ 71,0; 78,0] |
>0,999 0,628 0,764 |
|
Сатурация кислорода на воздухе (SpO2), % |
91 [ 89; 94] |
94 [ 92; 95] |
0,022 |
Сокращения: ЖЕЛ — жизненная емкость легких, ОФВ1 — объем форсированного выдоха за секунду, ФЖЕЛ — форсированная жизненная емкость легких.
Таблица 4
Независимые предикторы развития ССО у пациентов с ХСН и пневмонией, вызванной P. aeruginosa
|
Показатель |
RR |
95% ДИ |
p-value |
|
Снижение гемоглобина |
2,119 |
1,212-3,707 |
<0,001 |
|
Тромбоцитоз |
3,216 |
1,453-7,118 |
0,001 |
|
Лейкоцитоз |
2,412 |
1,399-4,158 |
0,048 |
|
Увеличение СОЭ |
2,412 |
1,452-4,007 |
<0,001 |
|
Увеличение СРБ |
3,115 |
1,611-6,025 |
<0,001 |
|
Гипопротеинемия |
5,225 |
1,249-21,854 |
0,012 |
|
Увеличение фибриногена |
1,847 |
1,035-3,296 |
0,020 |
|
Снижение ФВ ЛЖ <40% |
1,833 |
1,188-3,400 |
0,005 |
|
Количество пораженных сегментов на МСКТ >3 |
2,871 |
1,383-5,960 |
0,045 |
Сокращения: ДИ — доверительный интервал, ЛЖ — левый желудочек, МСКТ — мультиспиральная компьютерная томография, СОЭ — скорость оседания эритроцитов, СРБ — С-реактивный белок, ФВ — фракция выброса, RR — относительный риск.
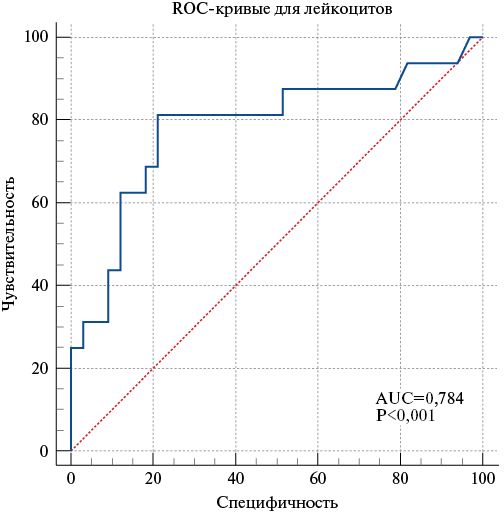
Рис. 3. ROC-кривая для прогнозирования развития ССО у больных с пневмонией P. aeruginosa при повышении лейкоцитов >11×109/л.
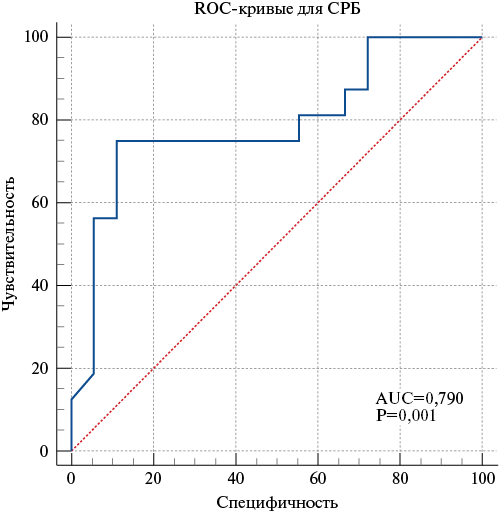
Рис. 4. ROC-кривая для прогнозирования развития ССО у больных с пневмонией P. aeruginosa при увеличении концентрации СРБ >133 мг/л.
Сокращение: СРБ — С-реактивный белок.
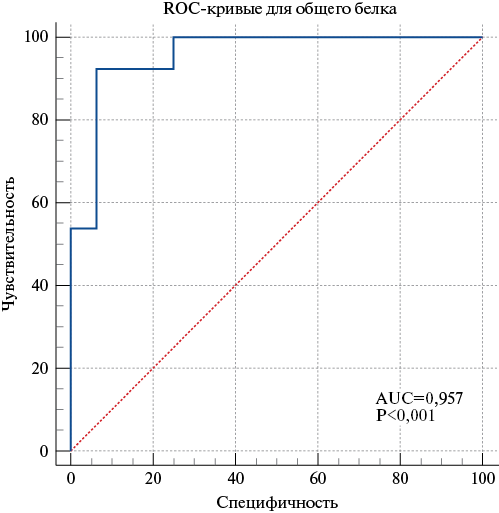
Рис. 5. ROC-кривая для прогнозирования развития ССО у больных с пневмонией P. aeruginosa при снижении уровня белка плазмы крови <57 г/л.
Обсуждение
Большинство исследований, проведенных до настоящего времени, доказывает важное значение внебольничной пневмонии, вызванной S. pneumoniae, в возникновении ССО у коморбидных пациентов [7][8]. Pseudomonas aeruginosa — один из самых распространенных возбудителей пневмонии и сепсиса в условиях стационара, уровень летальности которой достигает 30%. Инфекция P. aeruginosa характеризуется синдромом системного воспалительного ответа, экспрессией патоген-ассоциированных молекулярных фрагментов (PAMPs) и молекулярных фрагментов, ассоциированных с повреждениями (DAMPs), в кровеносное русло, что ведет к вторичным осложнениям, включая нарушение инотропной функции сердца. Циркулирующие эндотоксины и другие PAMPs/DAMPs активируют тромбоциты, приводя к прокоагулянтному состоянию. Данные патологические изменения увеличивают частоту сердечных сокращений и сосудистое сопротивление, что снижает сердечный выброс и кровоснабжение миокарда [9].
В нашем исследовании мы показали, что течение ассоциированной с P. aeruginosa пневмонии характеризуется высоким риском смерти от ССО, ОКС и тромбоза вен нижних конечностей. Нами было выявлено, что независимыми факторами высокого риска неблагоприятного прогноза у пациентов I группы были анемия, тромбоцитоз, увеличение уровня фибриногена. В исследовании Minandri F, et al. (2016) было показано, что P. aeruginosa поглощает железо для поддержания стабильного бактериального роста [10]. В специально воспроизведенной модели мышей инфекция P. aeruginosa приводила к развитию железодефицитной анемии в отличие от S. pneumoniae [11].
Тромбоциты и фибриноген являются маркерами инфекционно-воспалительного синдрома, и их повышенный уровень у пациентов с вызванной P. aeruginosa пневмонией по сравнению с группой пациентов с пневмонией, вызванной S. aureus, S. pneumoniae, предрасполагает к развитию тромбоэмболических осложнений. Состояние гиперкоагуляции наблюдается при пневмонии и коррелирует с уровнем эндотоксинов [12], а маркеры повышенной активности тромбоцитов связаны с развитием инфаркта миокарда у пациентов с пневмонией [13]. Hansen GM, et al. (2016) при исследовании тромбов коронарных артерий у пациентов с инфарктом миокарда с подъемом сегмента ST обнаружили ДНК P. аeruginosa [14].
В нашем исследовании было показано, что пневмония, вызванная P. aeruginosa, характеризуется более распространенным поражением легочной ткани. Многоочаговый характер поражения с формированием инфильтратов и ретикулярных изменений позволяет рассматривать поражение легких у больных во многом сходный с идиопатическими аналогами интерстициальной болезни легких, отличающийся развитием необратимого фиброза, длительно сохраняющейся активностью воспаления и фиброобразования на территории альвеолокапиллярной мембраны, что требует более длительного наблюдения и лечения данных больных.
Молекулярные механизмы повреждения миокарда P. aeruginosa до конца не ясны. Было показано, что индуктор ферроптоза доксорубицин вызывал кардиомиопатию у мышей, а применение ингибитора ферроптоза ферростатина-1 уменьшало выраженность кардиомиопатии и увеличивало выживаемость у исследуемых животных. На данный момент ферроптоз изучен только у P. aeruginosa и M. tuberculosis [15]. Другой недавно открытый механизм P. aeruginosa-ассоциированного повреждения сердца связан с повышенной экспрессией кальпротектина. Kumar N, et al. (2023) обнаружили, что при инфекции P. aeruginosa увеличивается инфильтрация миокарда клетками иммунной системы и повышается уровень S100A8/A9 (кальпротектина) в крови. S100A8/A9 обеспечивает защиту от бактериальной инфекции, однако его избыточная выработка активирует иммунные реакции, что приводит к тяжелым ССО [9].
Заключение
Наиболее значимыми предикторами развития ССО у больных с ХСН и пневмонией, вызванной P. aeruginosa, являются: снижение ФВ ЛЖ <40% (RR 1,833; 95% ДИ: 1,188-3,400; p=0,005), лейкоцитоз >11×109/л (RR 2,412; 95% ДИ: 1,399-4,158; p=0,048), увеличение СРБ >133 мг/л (RR 3,115; 95% ДИ: 1,611-6,025; p<0,001) и гипопротеинемия <57 г/л (RR 5,225; 95% ДИ: 1,249-21,854; p=0,012).
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. McMurray JJ, Packer M, Desai AS, et al. Dual angiotensin receptor and neprilysin inhibition as an alternative to angiotensin-converting enzyme inhibition in patients with chronic systolic heart failure: rationale for and design of the Prospective comparison of ARNI with ACEI to Determine Impact on Global Mortality and morbidity in Heart Failure trial (PARADIGM-HF). Eur J Heart Fail. 2013;15(9):1062-73. doi:10.1093/eurjhf/hft052.
2. Зайцев А. А., Лиходий В. И., Кулагина И. Ц. Антибактериальная терапия внебольничной пневмонии у пожилых в условиях стационара. Клиническая геронтология. 2018;24(11-12):13-7. doi:10.26347/1607-2499201811-12013-017.
3. Corrales-Medina VF, Suh KN, Rose G, et al. Cardiac complications in patients with community-acquired pneumonia: a systematic review and meta-analysis of observational studies. PLoS Med. 2011;8(6):e1001048. doi:10.1371/journal.pmed.1001048.
4. Viasus D, Garcia-Vidal C, Manresa F, et al. Risk stratification and prognosis of acute cardiac events in hospitalized adults with community-acquired pneumonia. J Infect. 2013;66(1):27-33. doi:10.1016/j.jinf.2012.09.003.
5. Авдеев С. Н., Белобородов В. Б., Белоцерковский Б. З. и др. Тяжелая внебольничная пневмония у взрослых. Клинические рекомендации Федерации анестезиологов и реаниматологов России. Анестезиология и реаниматология. 2022;(1):6-35. doi:10.17116/anaesthesiology20220116.
6. Российское кардиологическое общество (РКО). Хроническая сердечная недостаточность. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(11):4083. doi:10.15829/1560-4071-2020-4083.
7. Tada A, Omote K, Nagai T, et al. Prevalence, Determinants, and Prognostic Significance of Hospital Acquired Pneumonia in Patients with Acute Heart Failure. J Clin Med. 2020;9(7):2219. doi:10.3390/jcm9072219.
8. Аксенова А. В., Шостак Н. А., Гусева О. А. Постстрептококковые заболевания в клинической практике. Вестник оториноларингологии. 2016;81(2):39-43. doi:10.17116/otorino201681239-43.
9. Kumar N, Pestrak MJ, Wu Q, et al. Pseudomonas aeruginosa pulmonary infection results in S100A8/A9-dependent cardiac dysfunction. PLoS Pathog. 2023;19(8):e1011573. doi:10.1371/journal.ppat.1011573.
10. Minandri F, Imperi F, Frangipani E, et al. Role of Iron Uptake Systems in Pseudomonas aeruginosa Virulence and Airway Infection. Infect Immun. 2016;84(8):2324-35. doi:10.1128/IAI.00098-16.
11. Boshuizen M, van Bruggen R, Zaat SA, et al. Development of a model for anemia of inflammation that is relevant to critical care. Intensive Care Med Exp. 2019;7(Suppl 1):47. doi:10.1186/s40635-019-0261-2.
12. Cangemi R, Della Valle P, Calvieri C, et al. Low-grade endotoxemia and clotting activation in the early phase of pneumonia. Respirology. 2016;21(8):1465-71. doi:10.1111/resp.12854.
13. Cangemi R, Casciaro M, Rossi E, et al. Platelet activation is associated with myocardial infarction in patients with pneumonia. J Am Coll Cardiol. 2014;64(18):1917-25. doi:10.1016/j.jacc.2014.07.985.
14. Hansen GM, Belstrøm D, Nilsson M, et al. Pseudomonas aeruginosa Microcolonies in Coronary Thrombi from Patients with ST-Segment Elevation Myocardial Infarction. PLoS One. 2016;11(12):e0168771. doi:10.1371/journal.pone.0168771.
15. Подзолков В. И., Тарзиманова А. И., Пономарева Л. А. и др. Ферроптоз-ассоциированное повреждение как потенциальная мишень в терапии сердечно-сосудистых заболеваний. Терапевтический архив. 2022;16;94(12):1421-5. doi:10.26442/00403660.2022.12.201996.
Об авторах
В. И. ПодзолковРоссия
Д. м. н., профессор, зав. кафедрой факультетской терапии № 2.
Москва
Конфликт интересов:
Нет
А. И. Тарзиманова
Россия
Д. м. н., профессор кафедры факультетской терапии № 2.
Москва
Конфликт интересов:
Нет
Л. А. Пономарева
Россия
Ассистент кафедры факультетской терапии № 2.
Москва
Конфликт интересов:
Нет
Е. Е. Соколова
Россия
К. м. н., ассистент кафедры факультетской терапии № 2.
Москва
Конфликт интересов:
Нет
А. А. Чинова
Россия
Клинический ординатор кафедры факультетской терапии им. акад. А.И. Нестерова.
Москва
Конфликт интересов:
Нет
Е. Н. Попова
Россия
Д. м. н., профессор кафедры внутренних, профессиональных болезней и ревматологии.
Москва
Конфликт интересов:
Нет
А. Б. Пономарев
Россия
К. м. н., доцент института клинической морфологии и цифровой патологии.
Москва
Конфликт интересов:
Нет
И. Ж. Лория
Россия
К. м. н., доцент кафедры факультетской терапии № 2.
Москва
Конфликт интересов:
Нет
Т. С. Варгина
Россия
К. м. н., доцент кафедры факультетской терапии № 2.
Москва
Конфликт интересов:
Нет
Ж. М. Сизова
Россия
Д. м. н., профессор, зав. кафедрой медико-социальной экспертизы, неотложной и поликлинической терапии.
Москва
Конфликт интересов:
Нет
Н. К. Зискина
Россия
Клинический ординатор кафедры факультетской терапии № 2.
Москва
Конфликт интересов:
Нет
Дополнительные файлы
Что уже известно о предмете исследования?
- Пациенты с хронической сердечной недостаточностью (ХСН) достоверно чаще заболевают пневмонией, что приводит к декомпенсации ХСН, повторным госпитализациям и увеличивает риск летальности.
- P. aeruginosaотносится к одному из самых распространенных возбудителей внутрибольничной инфекции, в особенности, среди полиморбидных пациентов.
Что нового?
- Были установлены наиболее значимые предикторы и их пороговые значения для развития сердечно-сосудистых осложнений (ССО) у больных ХСН и пневмонией, вызванной
P. aeruginosa.
Возможный вклад в клиническую практику
- Мониторирование гемоглобина, воспалительных маркеров и общего белка позволит предупредить развитие ССО у пациентов с пневмонией P. aeruginosa.
Рецензия
Для цитирования:
Подзолков В.И., Тарзиманова А.И., Пономарева Л.А., Соколова Е.Е., Чинова А.А., Попова Е.Н., Пономарев А.Б., Лория И.Ж., Варгина Т.С., Сизова Ж.М., Зискина Н.К. Предикторы развития сердечно-сосудистых осложнений у больных с хронической сердечной недостаточностью и пневмонией, вызванной Pseudomonas aeruginosa. Российский кардиологический журнал. 2024;29(4):5817. https://doi.org/10.15829/1560-4071-2024-5817. EDN: PNNAGK
For citation:
Podzolkov V.I., Tarzimanova A.I., Ponomareva L.A., Sokolova E.E., Chinova A.A., Popova E.N., Ponomarev A.B., Loria I.Zh., Vargina T.S., Sizova Zh.M., Ziskina N.K. Predictors of cardiovascular events in patients with heart failure and Pseudomonas aeruginosa pneumonia. Russian Journal of Cardiology. 2024;29(4):5817. (In Russ.) https://doi.org/10.15829/1560-4071-2024-5817. EDN: PNNAGK

















































