Перейти к:
Ремоделирование сердца у пациентов с хронической сердечной недостаточностью с умеренно низкой фракцией выброса и метаболическими нарушениями: ассоциация с биомаркерами и параметрами автономной нервной системы
https://doi.org/10.15829/1560-4071-2024-5752
EDN: LMWSDJ
Аннотация
Цель. Высокая распространенность ожирения в когорте пациентов с сердечной недостаточностью и умеренно низкой фракцией выброса (СНунФВ) определяет актуальность уточнения роли биомаркерного профиля и автономного дисбаланса в процессах ремоделирования миокарда с учетом метаболических факторов риска.
Материал и методы. Обследовано 19 мужчин с постинфарктным кардиосклерозом и СНунФВ (медиана возраста 62 года) II функционального класса, избыточным весом/ожирением I-II ст., сахарным диабетом 2 типа в 53/47%, 48% случаев, соответственно, находящихся на стабильной терапии. В панель исследуемых биомаркеров вошли N-концевой промозговой натрийуретический пептид (NT-proBNP), галектин-3, С-концевой пропептид проколлагена I типа (PICP), N-концевой пропептид проколлагена III типа (PIIINP), С-терминальный телопептид коллагена I типа, матриксная металлопротеиназа-9 (MMP-9), тканевой ингибитор матриксной протеиназы-1 (TIMP-1), лептин и адипонектин. Значения вариабельности сердечного ритма (ВСР) и его турбулентности получены с помощью 24-ч холтеровского мониторирования. Оценивали временную и частотную области ВСР (24 ч) и 5 мин записи бодрствования в покое, вычисляли ТО (начало турбулентности), TS (наклон турбулентности).
Результаты. Подтверждены достоверные положительные ассоциации уровня лептина и TIMP-1 с маркерами гипертрофии левого желудочка. Выявлены положительные корреляции пика e' с показателями ВСР: SDNN (r=0,68; p=0,02) и RMSSD (r=0,69; р=0,003). Меньшие значения TS были ассоциированы с более высокими показателями индексных параметров массы миокарда левого желудочка (все p<0,05). Наблюдались связи биомаркеров с показателями автономной нервной системы (АНС): MMP-9 с RMSSD (r=0,54) и pNN50 (r=0,51); TIMP-1 c TO (r=0,46); отношения PICP/PIIINP c HFn (5 мин) (r=-0,49); отношения NT-proBNP/адипонектин с SDNN (r=-0,49); уровня лептина с TS (r=-0,54) (все p<0,05).
Заключение. У пациентов с СНунФВ ишемической этиологии и дополнительными метаболическими рисками сывороточные биомаркеры фиброза, адипокины, а также показатели АНС ассоциированы в основном с маркерами повышения давления наполнения левого желудочка. Результаты исследования предопределяют дальнейший поиск потенциальных риск-стратификационных маркеров неблагоприятного ремоделирования миокарда и прогноза в больших выборках пациентов с метаболическими девиациями и СН с ФВ >40% на фоне современной медикаментозной терапии в условиях проспективного наблюдения.
Ключевые слова
Для цитирования:
Лясникова Е.А., Гареева А.И., Муслимова В.К., Жабина Е.С., Козлова С.Н., Ситникова М.Ю., Шляхто Е.В. Ремоделирование сердца у пациентов с хронической сердечной недостаточностью с умеренно низкой фракцией выброса и метаболическими нарушениями: ассоциация с биомаркерами и параметрами автономной нервной системы. Российский кардиологический журнал. 2024;29(4):5752. https://doi.org/10.15829/1560-4071-2024-5752. EDN: LMWSDJ
For citation:
Lyasnikova E.A., Gareeva A.I., Muslimova V.K., Zhabina E.S., Kozlova S.N., Sitnikova M.Yu., Shlyakhto E.V. Cardiac remodeling in patients with heart failure with mildly reduced ejection fraction and metabolic disorders: association with biomarkers and autonomic nervous system parameters. Russian Journal of Cardiology. 2024;29(4):5752. (In Russ.) https://doi.org/10.15829/1560-4071-2024-5752. EDN: LMWSDJ
С 2022г в медицинском сообществе термин "сердечная недостаточность с промежуточной фракцией выброса" заменен на термин "сердечная недостаточность с умеренно низкой фракцией выброса (СНунФВ)", что подчеркивает единство между данным фенотипом сердечной недостаточности (СН) и СН с низкой фракцией выброса (ФВ) левого желудочка (ЛЖ) (СНнФВ) по ряду параметров, включая этиологию, коморбидность и медикаментозный подход [1]. Немалый вклад в патофизиологию СНунФВ наряду с атеросклерозом коронарных артерий и артериальной гипертензией (АГ), вносят метаболические факторы риска — ожирение и часто сопутствующие ему нарушения углеводного обмена, приводящие к структурно-функциональной перестройке миокарда: интерстициальному фиброзу, повышению жесткости и развитию диастолической дисфункции.
Диапазон встречаемости метаболических факторов, таких как ожирение и сахарный диабет 2 типа (СД2), в когорте пациентов с СНунФВ различной этиологии по данным ряда исследований довольно широк [1]. Более 50% больных с СНунФВ и постинфарктным кардиосклерозом (ПИКС) из амбулаторной выборки имеют избыточный вес или ожирение, а у каждого четвертого диагностируется СД2. Существуют определенные трудности в постановке диагноза СН у тучных пациентов и ФВ ЛЖ >40% в силу общности ряда симптомов, неоптимальной эхокардиографической (ЭхоКГ) визуализации и остающихся на сегодняшний день разногласий в подходах к интерпретации данных ЭхоКГ, связанных с индексацией размеров левого предсердия (ЛП) и массы миокарда ЛЖ (ММЛЖ) у больных с индексом массы тела (ИМТ) ≥30 кг/м2 [2].
Многокомпонентные процессы ремоделирования сердца при ожирении связывают с гормонально-метаболическими нарушениями и автономным дисбалансом, свойственными ему, уделяя особое внимание роли адипокинов. СН в коморбидности с ожирением может быть результатом дисбаланса лептина/адипонектина, чрезмерной активности неприлизина и/или усиленной передачи сигналов минералокортикоидов [3, 4]. Патофизиологический механизм, ассоциированный с ожирением, приводящий к развитию гипертрофии, низкоуровневому воспалению и фиброзу миокарда, позволяет расценивать это состояние как дополнительное звено патогенеза СН, развивающейся преимущественно на фоне ФВ ЛЖ >40%, и морфо-функционального ремоделирования сердца на определённой стадии сердечно-сосудистого континуума. Значительное внимание в процессах ремоделирования сердечной мышцы и экстрацеллюлярного матрикса уделяется лептину и адипонектину, являющимся маркерами воспаления и метаболических нарушений [3]. Немаловажную кардиопротективную роль в патогенезе СН играет система натрийуретических пептидов (НУП), препятствующая вышеописанным патофизиологическим процессам. Надо отметить, что в когорте пациентов с метаболическим синдромом наблюдается "дефицит НУП", причины которого до конца не определены [2][5]. Среди множества факторов снижения НУП при ИМТ ≥30 кг/м2 обсуждается роль адипокинов, не исключается модулирующее влияние автономного дисбаланса [2].
Вариабельность (ВСР) и турбулентность сердечного ритма (ТСР) являются оригинальными маркерами оценки автономной нервной системы (АНС) сердца у пациентов с сердечно-сосудистыми заболеваниями и сопутствующими метаболическими рисками. Независимая прогностическая значимость автономного дисбаланса, параметров ВСР и ТСР в отношении фатальных аритмических событий и смертности показана у пациентов с ПИКС и СН различной этиологии [6-8]. Стоит заметить, что и заместительный фиброз миокарда, развивающийся после повреждения, и интерстициальный фиброз, ассоциированный с метаболическими рисками, обеспечивают электрическую гетерогенность и субстрат для развития аритмий, что определяет поиск ассоциаций автономного дисбаланса с маркерами фиброза и неблагоприятного структурно-функционального и электрофизиологического ремоделирования сердца. Наибольшее количество работ по оценке АНС проведено на когорте пациентов с СНнФВ. Вместе с тем исследования роли вегетативного дисбаланса в развитии диастолической дисфункции и в прогнозе у пациентов с СН с сохраненной ФВ (СНсФВ) менее многочисленны и противоречивы, а работы, посвященные этой тематике в группе пациентов с СНунФВ, в доступной литературе не представлены [9][10].
Учитывая вышеизложенное, изучение потенциальной роли биомаркеров и автономного дисбаланса в ремоделировании миокарда у пациентов с СНунФВ с учетом широкого распространения метаболических девиаций в данной группе приобретает особую актуальность.
Цель исследования: проанализировать связи клинических, ЭхоКГ параметров, уровней биомаркеров, показателей ВСР и ТСР у пациентов c СНунФВ ишемической этиологии с учетом метаболических факторов риска.
Материал и методы
Исследование проведено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации. Протокол исследования одобрен Этическим комитетом НМИЦ им. В. А. Алмазова (протокол № 06-21 от 15.06.2021г), у всех участников получено письменное информированное согласие.
Набор больных проводился из когорты 111 пациентов с ПИКС и СНунФВ с клиническими проявлениями СН преимущественно II функционального класса (ФК), обследованных в 2020г и вошедших в исследование, описанное на предыдущих этапах работы [2]. На предмет соответствия критериям включения/невключения было обследовано 30 мужчин с ПИКС и СНунФВ II ФК, из которых в протокол исследования были включены 19 пациентов.
Критерии включения: мужской пол, возраст 40-65 лет, перенесенный >12 мес. назад инфаркт миокарда, ФВ ЛЖ (Симпсон) 41-49%, клинические проявления стабильной хронической СН (ХСН) II ФК, оптимальная и стабильная медикаментозная терапия СН, АГ и СД2 не менее 3 мес.
Критерии невключения в исследование: постмиокардитическая, дилатационная и гипертрофическая кардиомиопатии, гемодинамически значимые органические поражения клапанов сердца, болезни накопления, вторичные АГ, тромбоэмболия легочной артерии или госпитализация по причине декомпенсации ХСН в течение последних 6 мес., ангинозный синдром на уровне III-IV ФК, эквивалентная стенокардия, а также реваскуляризация миокарда, вальвулопластика или любое электрофизиологическое вмешательство в течение 12 мес. до включения в исследование, неоптимальная визуализация при проведении ЭхоКГ [2].
Дополнительными критериями невключения, потенциально способными повлиять на показатели автономного баланса и маркеры фиброза, явились: постоянная или персистирующая форма фибрилляции предсердий, сахарного диабета 1 типа, инсулинотерапия, уровень гликированного гемоглобина (НbA1c) >7,1%, скорость клубочковой фильтрации по формуле CKD-EPI <60 мл/мин/1,73 м2, ревматологические заболевания, ожирение IV степени; тяжелое течение бронхиальной астмы, хронической обструктивной болезни легких; текущее онкологическое заболевание. Дизайн исследования представлен на рисунке 1.
Использованы стандартные клинико-лабораторные и инструментальные методы диагностики (осмотр, измерение артериального давления, веса, роста, окружности талии (ОТ), расчет ИМТ, электрокардиография). Исследованы гликемический статус, НbA1c, уровень инсулина для расчета индекса инсулинорезистентности HOMA-IR (Homeostasis model assessment of insulin Resistance). Ожирение оценивали по индексу сухой массы тела пациентов в состоянии эуволемии (без отёчного синдрома). О наличии абдоминального ожирения судили по величине ОТ ≥94 см [11]. ЭхоКГ выполняли по стандартному протоколу центра на аппарате Toshiba Medical Systems (Япония) одним заслепленным оператором. Объем ЛП (ОЛП) и ММЛЖ индексировали к площади поверхности тела (ППТ) и степенной выраженности роста (в метрах) [2][12][13]. Холтеровское мониторирование в 12 отведениях проводили с помощью носимого суточного монитора ЭКГ "Кардиотехника-4000-7", полученные данные обрабатывали в программе "KT Result 3" (ЗАО "Инкарт", РФ). Показатели ВСР и ТСР рассчитывали автоматически. Проводили временной и частотный анализы ВСР. Посредством обработки временных отрезков между сердечными сокращениями в ходе 24-часовой записи оценивали следующие показатели: стандартное отклонение NN интервалов (SDNN), отражающее все циклические компоненты, ответственные за ВСР, и зависящее как от симпатического, так и от парасимпатического отделов АНС; квадратный корень средних квадратов разницы между смежными NN интервалами (RMSSD) и пропорцию интервалов между смежными NN, превосходящих 50 мс, к общему количеству NN интервалов в записи (pNN50), отражающие быстрые высокочастотные колебания в структуре ВСР и активность парасимпатического отдела АНС. С помощью спектрального метода в ходе 5-минутной записи в период бодрствования в покое оценивали показатели: LF, HF, nHF, а также, согласно действующим рекомендациям, рассчитывали симпато-вагальный индекс (LF/HF) [6][7]. При анализе ТСР вычисляли параметры: ТО — "начало турбулентности" и TS — "наклон турбулентности". Значения ТО <0% и TS >2,5 мс/RR считаются нормальными, а ТО >0% и TS <2,5 мс/RR — патологическими [8][14].
Образцы крови собирали у каждого испытуемого натощак, после утреннего приема текущей терапии, далее образцы сыворотки крови на биомаркеры замораживали при -80 C до проведения анализа. Сывороточную концентрацию N-концевого промозгового НУП (NT-proBNP) оценивали электрохемилюминесцентным методом c применением тест-системы Elecsys (Roche Diagnostic). Уровень высокочувствительного С-реактивного белка определяли иммунотурбидиметрическим методом при использовании реактивов и анализатора Cobas Integra 400 plus (Roche, Франция). Сывороточные уровни матриксной металлопротеиназы-9 (MMP-9), тканевого ингибитора матриксной протеиназы-1 (TIMP-1) (R&D system), С-концевого пропептида проколлагена I типа (PICP), N-концевого пропептида проколлагена III типа (PIIINP) (USCN Life Science), являющиеся маркерами синтеза коллагена I и III типов, соответственно, и С-терминального телопептида коллагена I типа (CTIP) (Serum CrossLaps (CTX-I) ELISA), являющегося маркером деградации коллагена I типа, оценивали методом иммуноферментного анализа. Определение уровней лептина и адипонектина в сыворотке крови проводили иммуноферментным методом с использованием автоматического анализатора (BioRad 680-монометр, автоматизированный анализатор, США).
Дополнительно рассчитывали соотношения лептин/адипонектин, NT-proBNP/адипонектин, MMP-9/TIMP-1, PICP/PIIINP, PICP/CTIP.
Забор крови на биомаркеры, электрокардиография, ЭхоКГ, постановка холтеровского мониторирования всем пациентам были проведены на фоне синусового ритма, в один день.
Статистическую обработку данных осуществляли с помощью пакетов Microsoft Excel 2010, Statistica 10. Непрерывные переменные представлены как медиана и межквартильный диапазон (Me, 25% квартиль — 75% квартиль), категориальные переменные представлены как число (n) и процент (%). Анализ вида распределения количественных данных оценивали с помощью критерия Шапиро-Уилка. Для корреляционного анализа использовался критерий Спирмена. Размер выборки и характер распределения признаков при уровне статистической мощности 0,8 и доверительной вероятности 95% позволяли выявлять средние и сильные корреляционные связи между изучаемыми параметрами (величина коэффициента корреляции Спирмена (r) ≥0,60) [15]. Различия считали статистически достоверными при значениях р<0,05.
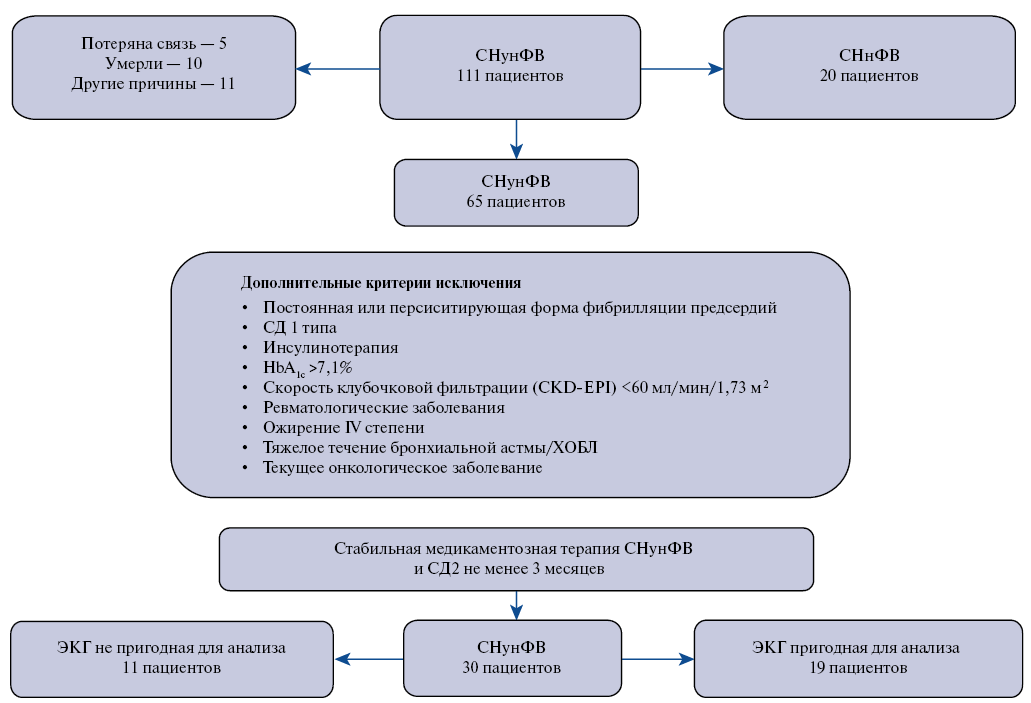
Рис. 1. Дизайн исследования.
Сокращения: СД — сахарный диабет, СД2 — сахарный диабет 2 типа, СНнФВ — сердечная недостаточность с низкой фракцией выброса, СНунФВ — сердечная недостаточность с умеренно низкой фракцией выброса, ХОБЛ — хроническая обструктивная болезнь легких, ЭКГ — электрокардиография, HbA1с — гликированный гемоглобин.
Результаты
В исследование включены мужчины от 43 до 65 лет (Ме 62), имеющие СНунФВ II ФК. В таблице 1 представлены основные характеристики группы.
АГ в анамнезе регистрировалась у всех больных и выступала как конкурирующая по отношению к ишемической болезни сердца причина СН. В 100% случаев ранее была выполнена реваскуляризация миокарда, показаний к реваскуляризации на момент обследования не было. Стенокардия напряжения II ФК наблюдалась в 43% случаев. Пароксизмальная форма фибрилляции предсердий в анамнезе фигурировала у 26% больных. СД2, избыточный вес и ожирение диагностировались в 48%, 53% и 47% случаев, соответственно. Выявлялось преимущественно ожирение I степени (в 66% случаев), при этом ОТ у всех респондентов, независимо от значения ИМТ, превышала нормативные значения, что являлось косвенным маркером абдоминального ожирения.
Терапия ХСН была представлена ингибиторами ангиотензинпревращающего фермента (периндоприлом)/ангиотензиновых рецепторов и неприлизина ингибитором, рекомендованными для терапии СНнФВ бета-адреноблокаторами, антагонистами минералокортикоидных рецепторов, диуретиками (торасемидом) в 100%, 100%, 53% и 100% случаев, соответственно (табл. 1). Диета, метформин, и/или ингибиторы натрий-глюкозного ко-транспортера 2 типа применялись в качестве сахароснижающей терапии. Дапаглифлозин или эмпаглифлозин применялись в 53% случаев.
По данным ЭхоКГ у 100% больных выявлялись маркеры гипертрофии ЛЖ (ГЛЖ), увеличение ОЛП, приведенного к (росту, м)2, и диастолическая дисфункция преимущественно 1 степени. При проведении корреляционного анализа был получен ряд взаимосвязей параметров морфо-функционального ремоделирования миокарда, являющихся индикаторами повышения давления наполнения ЛЖ, с факторами метаболического риска и циркулирующими биомаркерами миокардиального стресса и метаболических нарушений. ОТ и уровень глюкозы натощак положительно ассоциировались с размером ЛП (r1=0,56; р1=0,011 и r2=0,51; р2=0,032), а более высокий уровень триглицеридов ассоциировался с более высоким значением ММЛЖ и его индексным значением, приведенным к ППТ (r1=0,49; р1=0,038 и r2=0,51; р2=0,029). Как и ожидалось, NT-proBNP положительно ассоциировался с ОЛП, приведенным к (росту, м)2 (r=0,55; р=0,017), и показателем E/A (r=0,66; p=0,002). Значимая позитивная связь прослеживалась между циркулирующим уровнем лептина и ММЛЖ (r=0,46; p=0,046). В то же время уровень адипонектина отрицательно ассоциировался с ММЛЖ и её индексным значением, приведенным к ППТ (r1=-0,48; р1=0,033 и r2=-0,46; р2=0,048). Данные корреляционного анализа между маркерами структурного ремоделирования миокарда, метаболическими факторами риска, уровнями циркулирующих NT-proBNP и адипокинов представлены в таблице 2.
При дальнейшем анализе взаимосвязей было показано, что баланс металлопротеиназ и их ингибиторов, представленный соотношением ММР-9/ТIMP-1, положительно ассоциировался с размером ЛП (r=0,52; p=0,022). Обнаружены позитивные корреляции уровня ТIMP-1 с маркерами ГЛЖ: толщиной межжелудочковой перегородки (r=0,58; p=0,009), размером задней стенки (r=0,62; p=0,004) и относительной толщиной стенки ЛЖ (r=0,74; p=0,0003). Данные представлены на рисунке 2.
Соотношение между циркулирующим маркером синтеза коллагена 1 типа и маркером его деградации (PICP/CTIP) у пациентов с ГЛЖ и ММЛЖ/(рост, м)2,7 >48 г/м2,7 было достоверно меньше по сравнению с группой пациентов с ММЛЖ/(рост, м)2,7 ≤48 г/м2,7 (250 (162; 321) vs 408 (364; 725), p=0,02).
Анализ взаимосвязей показателей ВСР и ТСР у больных СНунФВ также продемонстрировал ряд корреляций c ЭхоКГ параметрами ремоделирования сердца и биомаркерами. Обнаружены положительные связи SDNN — маркера, отражающего общий тонус вегетативной нервной системы, с ФВ ЛЖ (r=0,54; p=0,043), пиком e' (r=0,68; p=0,007) и отрицательные корреляции SDNN с соотношением NT-proBNP/адипонектин (r=-0,49; p=0,043). Временные показатели ВРС, характеризующие высокочастотный компонент спектра — RMSSD и pNN50 — положительно ассоциировались с MMP-9 (r=0,54 и r=0,51; все p<0,05). Спектральные показатели низкочастотного компонента ВСР, включая как абсолютный, так и нормализованный показатели HF, отрицательно коррелировали с ОЛП/(рост, м)2 (r=-0,62; p=0,005) и PICP/PIIINP (r=-0,49; p=0,03), соответственно. В то же время показатель LF/HF, отражающий симпато-вагальный баланс, положительно коррелировал с показателем PICP/PIIINP (r=0,50; p=0,03). Увеличение показателя ТО ассоциировалось с увеличением значения TIMP-1 (r=0,46; p=0,046). В то же время более высокие показатели TS ассоциировались с уменьшением уровня лептина, лептин/адипонектинового соотношения, ММЛЖ и всех индексных значений ММЛЖ (все р<0,05). Результаты взаимосвязей показателей автономного баланса со структурно-функциональными параметрами сердца и биомаркерами представлены в таблице 3.
Таблица 1
Характеристика исследуемой группы пациентов
|
Показатель |
Пациенты с СНунФВ (n=19), Me (25;75) |
|
Возраст, лет, Me (25; 75), (мин-макс) |
62 (58; 63), (43-65) |
|
Реваскуляризация, % (n) |
100 (19) |
|
Стенокардия напряжения II ФК, % (n) |
43 (8) |
|
Артериальная гипертензия, % (n) |
100 (19) |
|
Офисное САД, мм рт.ст. |
120 (110; 130) |
|
ЧСС средняя по данным ХМ, уд./мин |
71 (60; 85) |
|
Пароксизмальная фибрилляция предсердий, % (n) |
26 (5) |
|
ХОБЛ, % (n) |
47 (9) |
|
СД 2 типа, % (n) |
42 (8) |
|
HbA1c (у пациентов с СД 2 типа), % |
6,5 (6; 7) |
|
Индекс массы тела, кг/м2 |
29,8 (25,3; 33,5) |
|
Избыточный вес/ожирение I-II степени % (n) |
53 (10)/47 (9) |
|
Окружность талии, см |
102 (100; 111) |
|
СКФ, мл/мин/1,73 м2 |
82 (73; 93) |
|
Гемоглобин, г/л |
145 (142; 152) |
|
ЛНП, ммоль/л |
1,9 (1,2; 2,7) |
|
Триглицериды, ммоль/л |
1,2 (1; 1,4) |
|
Глюкоза натощак, ммоль/л |
5,7 (5,5; 6,7) |
|
HOMA-IR |
3,2 (2,6; 4,0) |
|
Текущая терапия |
|
|
иАПФ/АРНИ, % (n) |
53 (10)/47 (9) |
|
Бета-адреноблокаторы, % (n) |
100 (19) |
|
Антагонисты минералокортикоидных рецепторов, % (n) |
53 (10) |
|
Диуретики, % (n) |
100 (19) |
|
ИНГКТ-2, % (n) |
53 (10) |
|
Метформин, % (n) |
31 (6) |
|
Статины/эзетемиб, % (n) |
100 (19)/26 (5) |
|
Эхокардиографические параметры, Me (25; 75) |
|
|
Фракция выброса (Simpson), % |
43 (40; 47) |
|
Левое предсердие, размер, мм |
49 (44; 51) |
|
Объём левого предсердия/ППТ, мл/м2 |
43 (39; 48) |
|
Объём левого предсердия/(рост, м)2, мл/м2 |
28 (25; 34) |
|
Давление в легочной артерии, мм рт.ст. |
34 (30; 41) |
|
E/e' сред. |
9 (8; 11) |
|
Конечно-диастолический размер ЛЖ, мм |
59 (55; 63) |
|
Конечно-диастолический объем ЛЖ, мл |
160 (134; 237) |
|
Межжелудочковая перегородка ЛЖ, мм |
12 (8; 14) |
|
Задняя стенка ЛЖ, мм |
10 (8; 11) |
|
Относительная толщина стенки ЛЖ |
0,36 (0,29; 0,40) |
|
ММЛЖ, г |
270 (193; 342) |
|
ММЛЖ/(рост, м)1, г/м1 |
146 (106; 191) |
|
ММЛЖ/(рост, м)2,7, г/м2,7 |
56 (39; 71) |
|
ММЛЖ/ППТ, г/м2 |
134 (95; 156) |
|
Циркулирующие биомаркеры, Me (25; 75) |
|
|
NT-proBNP, пг/мл |
320 (142; 525) |
|
вчСРБ, мг/л |
1,6 (0,5; 2,6) |
|
Адипонектин, мкг/мл |
5,9 (4,7; 7,3) |
|
Лептин, нг/мл |
10,1 (5,5; 27,2) |
|
Лептин/адипонектин, нг/мкг |
2,3 (0,8; 7,7) |
|
NT-proBNP/адипонектин, пг/мкг |
46 (28; 71) |
|
TIMP-1, нг/мл |
211 (196; 289) |
|
MMP-9, нг/мл |
892 (464; 1350) |
|
Таблица 1. Продолжение |
|
|
Показатель |
Пациенты с СНунФВ (n=19), Me (25;75) |
|
MMP-9/TIMP-1 |
3 (2; 5) |
|
PICP, нг/мл |
60 (54; 64) |
|
PIIINP, нг/мл |
14 (7; 16) |
|
CTIP, нг/мл |
0,2 (0,1; 0,3) |
|
PICP/PIIINP |
4,2 (3,5; 8,5) |
|
PICP/CTIP |
321 (230; 412) |
|
Галектин-3, нг/мл |
4,1 (3,4; 5,4) |
Сокращения: АРНИ — ангиотензиновых рецепторов и неприлизина ингибитор, вчСРБ — высокочувствительный С-реактивный белок, иАПФ — ингибиторы ангиотензинпревращающего фермента, ИНГКТ-2 — ингибиторы натрий глюкозного ко-транспортера 2 типа, ЛЖ — левый желудочек, ЛНП — липопротеиды низкой плотности, ММЛЖ — масса миокарда левого желудочка, ППТ — площадь поверхности тела, САД — систолическое артериальное давление, СД — сахарный диабет, СКФ — скорость клубочковой фильтрации, СНунФВ — сердечная недостаточность с умеренно низкой фракцией выброса, ФК — функциональный класс, ХМ — Холтеровское мониторирование, ХОБЛ — хроническая обструктивная болезнь легких, ЧСС — частота сердечных сокращений, CTIP — С-терминальный телопептид коллагена I типа, Е/e' — отношение скорости раннего наполнения трансмитрального потока (пик Е), к скорости диастолического наполнения по данным движения фиброзного кольца митрального клапана в тканевом допплеровском режиме (пик e'), HbA1с — гликированный гемоглобин, HOMA-IR — индекс инсулинорезистентности, MMP-9 — матриксная металлопротеиназа-9, NT-proBNP — N-концевой промозговой натрийуретический пептид, PICP — С-концевой пропептид проколлагена I типа, PIIINP — N-концевой пропептид проколлагена III типа, TIMP-1 — тканевой ингибитор матриксной протеиназы-1.
Таблица 2
Корреляции между маркерами ремоделирования миокарда и метаболическими факторами риска, уровнями циркулирующих NT-proBNP и адипокинов
|
ЛП, размер |
ОЛП/(рост, м)2 |
ММЛЖ |
ММЛЖ/ППТ |
|
Объём талии |
|||
|
r=0,56; p=0,011 |
нс |
нс |
нс |
|
Глюкоза натощак |
|||
|
r=0,51; p=0,032 |
нс |
нс |
нс |
|
Триглицериды |
|||
|
нс |
нс |
r=0,49; p=0,038 |
r=0,51; р=0,029 |
|
NT-proBNP |
|||
|
нс |
r=0,55; р=0,017 |
нс |
нс |
|
Лептин |
|||
|
нс |
нс |
r=0,46; p=0,046 |
нс |
|
Адипонектин |
|||
|
нс |
нс |
r=-0,48; р=0,033 |
r=-0,46; р=0,048 |
Сокращения: ЛП — левое предсердие, МЖП — межжелудочковая перегородка, ММЛЖ — масса миокарда левого желудочка, нс — различия статистически незначимые, ОЛП — объём левого предсердия, ППТ — площадь поверхности тела.
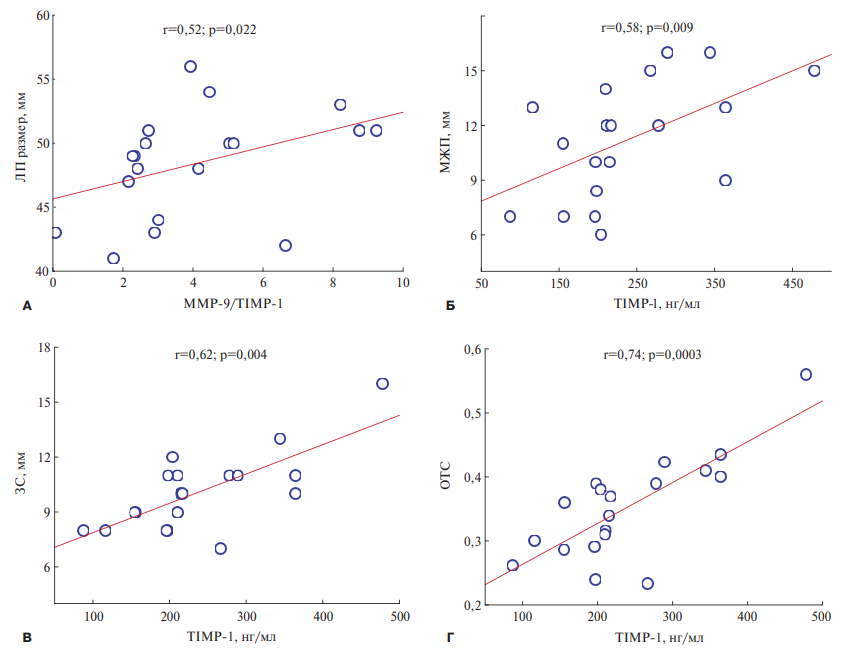
Рис. 2. Корреляции между соотношением ММР-9/ТIMP-1 и размером ЛП (А), TIMP-1 и толщиной межжелудочковой перегородки (Б), задней стенки ЛЖ (В) и относительной толщиной стенки ЛЖ (Г).
Сокращения: ЗС — задняя стенка, ЛП — левое предсердие, МЖП — межжелудочковая перегородка, ОТС — относительная толщина стенки, MMP-9 — матриксная металлопротеиназа-9, TIMP-1 — тканевой ингибитор матриксной протеиназы-1.
Таблица 3
Показатели ВСР и ТСР и их корреляции с ЭхоКГ параметрами и биомаркерами
|
Показатель |
Значение, Ме (25; 75) |
Корреляции |
|
Временной анализ 24-часовой записи |
||
|
SDNN, мс |
122 (106; 164) |
NT-proBNP/адипонектин r=-0,49; p=0,043 |
|
ФВ ЛЖ r=0,54; p=0,02 |
||
|
Пик e' r=0,68; p=0,007 |
||
|
RMSSD, мс |
23 (18; 45) |
Пик e' r=0,69; p=0,003 |
|
ММР-9 r=0,54; p=0,02 |
||
|
pNN50, % |
3 (1; 12) |
ММР-9 r=0,51; p=0,03 |
|
Спектральный анализ 5 минутной записи (бодрствование в покое) |
||
|
HF, мс2 |
103 (38; 240) |
Объем левого предсердия/(рост, м)2 r=-0,62; p=0,005 |
|
HFn, % |
21 (15; 39) |
PICP/PIIINP r=-0,49; p=0,03 |
|
LF/HF, усл. ед. |
3,7 (1,6; 5,5) |
PICP/PIIINP r=0,50; p=0,03 |
|
Турбулентность сердечного ритма (24 ч) |
||
|
TO (%) |
-1,0 (-2,6; 0) |
TIMP-1 r=0,46; p=0,046 |
|
TS (мс/RR) |
6,8 (3,6; 10) |
ММЛЖ r=-0,62; p=0,004 ММЛЖ/ППТ r=-0,57; p=0,01 ММЛЖ/(рост, м)1 r=-0,65; p=0,002 ММЛЖ/(рост, м)2,7 r=-0,67; p=0,0016 Лептин r=-0,54; p=0,017 Лептин/адипонектин r=-0,53; p=0,016 |
Сокращения: ЛЖ — левый желудочек, ММЛЖ — масса миокарда левого желудочка, пик e' — скорость диастолического наполнения по данным движения фиброзного кольца митрального клапана в тканевом допплеровском режиме, ППТ — площадь поверхности тела, ФВ — фракция выброса, HF — высокочастотный компонент, HFn — нормализованные единицы частотного компонента HF, LF — низкочастотный компонент, MMP-9 — матриксная металлопротеиназа-9, NT-proBNP — N-концевой промозговой натрийуретический пептид, pNN50 — процент от общего количества последовательных пар интервалов R-R, различающихся более чем на 50 мс, PICP — С-концевой пропептид проколлагена I типа, PIIINP — N-концевой пропептид проколлагена III типа, RMSSD — среднеквадратичное различие между продолжительностью соседних синусовых интервалов R-R, SDNN — стандартное отклонение от средней длительности всех синусовых интервалов R-R, TIMP-1 — тканевой ингибитор матриксной протеиназы-1, ТО — начало турбулентности, TS — наклон турбулентности.
Обсуждение
Ремоделирование сердца, ассоциированное с метаболическими факторами, затрагивает, прежде всего, левые камеры сердца, что демонстрируют данные настоящей работы. Положительные ассоциации компонентов метаболического синдрома были отмечены с параметрами ГЛЖ и ЛП в наших предыдущих исследованиях у пациентов с ожирением на стадии предсердечной недостаточности и с клиническими проявлениями СН и ФВ >40% [2][3][16]. Следует подчеркнуть, что миокардиальная дисфункция у лиц с ИМТ ≥30 кг/м2 манифестирует прежде всего с диастолических нарушений, а дилатация ЛП, гипертрофия и дилатация правого желудочка присоединяются в рамках дальнейших структурно-функциональных изменений миокарда [17]. В основном при ожирении имеют место концентрические варианты ремоделирования сердца. На данный момент предполагается, что увеличение массы сердца у тучных пациентов связано не только с гипертрофией кардиомиоцитов, но и с увеличением как количества эпикардиальной жировой ткани, так и жировой инфильтрацией миокарда или миокардиальным стеатозом [3]. С помощью магнитно-резонансной томографии-спектроскопии в миокарде у больных с ожирением было продемонстрировано наличие повышенного накопления триглицеридов, которое ассоциировалось с увеличением ММЛЖ и меньшим утолщением межжелудочковой перегородки в систолу, что отражает наличие субклинического функционального нарушения [18][19]. Надо отметить, что в нашей работе уровень триглицеридов был положительно ассоциирован со значением ММЛЖ.
Гиперлептинемия играет важную роль в сердечно-сосудистых заболеваниях, связанных с ожирением, включая ишемическую болезнь сердца. Увеличенный уровень циркулирующего лептина может оказывать дезадаптивный эффект на функцию сердца, реализующийся через гемодинамические и метаболические факторы, воспалительные изменения и ремоделирование, приводя к гипертрофии миокарда [20]. Ряд экспериментальных и клинических данных подтверждает связь лептина с активностью симпатической нервной системы, особенно, при ожирении [21][22]. Противоположный лептину эффект производит адипонектин, который на клеточном и молекулярном уровнях играет кардиопротекторную роль, модулируя процессы гипертрофии и фиброза миокарда. Однако у людей связь между циркулирующим адипонектином и ГЛЖ в целом остается спорной, различаясь в зависимости от стадии и тяжести СН [3]. В представленном исследовании у пациентов с клиническими проявлениями СНунФВ, имеющих дополнительные метаболические риски в большинстве случаев, циркулирующий уровень лептина положительно коррелировал с ММЛЖ, в то время как сывороточный уровень адипонектина демонстрировал противоположные ассоциации. У пациентов с СНунФВ, наряду с представленными корреляциями, наблюдались положительные связи между маркерами ГЛЖ с уровнем TIMP-1. Пациенты с ГЛЖ имели меньшее значение отношения PICP/CTIP, отражающего баланс синтеза и деградации коллагена I типа. Стоит отметить, что сывороточные маркеры компонентов экстрацеллюлярного матрикса относятся к релевантным маркерам фиброза, однако есть ряд замечаний, которые стоит принимать во внимание при их оценке, которыми мы попытались руководствоваться. Метаболические факторы, терапия, ассоциированные с фиброобразованием состояния, включая заболевания легких, почек, печени, костной системы, могут оказывать влияние на концентрацию биомаркеров в крови, что предопределило жесткие критерии отбора в представленный фрагмент исследования. Ремоделирование является динамичным процессом, и ассоциации биомаркеров фиброза со структурно-функциональными показателями сердца целесообразно рассматривать в определённой точке сердечно-сосудистого континуума, понимая потенциальную возможность изменчивости направленностей связей в зависимости от стадии заболевания [16][23].
НУП зарекомендовали себя как индикаторы миокардиального стресса или дисфункции миокарда, что демонстрируют и данные представленной работы. В нашем исследовании NT-proBNP был положительно ассоциирован со структурно-функциональными маркерами повышения давления наполнения ЛЖ. Однако высокая вариабельность НУП в зависимости от различных факторов вызывает ряд проблем, связанных с применением их в качестве жесткого диагностического критерия в реальной клинической практике, что было подробно освещено в нашей предыдущей работе [2]. Возрастной фактор и выраженная коморбидность, часто сопутствующие и ожирению, и СН с ФВ >40%, оказывают существенное разнонаправленное влияние на уровни NT-proBNP [24]. Ряд экспериментальных и клинических исследований демонстрирует взаимодействие АНС и системы НУП. Показан ингибиторный эффект различных молекул семейства НУП на симпатический компонент АНС [25]. С другой стороны, симпатическая активация способна влиять как на синтез и высвобождение НУП кардиомиоцитами, так и на клиренс этих биомаркеров за счет регуляции клеточных рецепторов мозгового НУП периферических тканей [26]. В данном фрагменте исследования мы предприняли попытку изучения ассоциаций уровня NT-proBNP с балансом адипокинов и параметрами АНС у пациентов с метаболическими нарушениями. Соотношение NT-proBNP/адипонектин отрицательно коррелировало с суммарным показателем регуляторного влияния вегетативного баланса SDNN. В то же время увеличение лептина и лептин/адипонектинового соотношения ассоциировалось с патологической направленностью изменения такого показателя ТСР, как TS. Ряд исследователей показали, что гиперлептинемия и баланс лептина и адипонектина могут вовлекаться в процесс сердечной автономной дисфункции у пациентов с СД2 и висцеральным ожирением [27, 28]. Учитывая представленные данные, можно предположить наличие тонкого равновесия между адипокинами и АНС, которое наряду с другими факторами способно оказывать влияние на уровень НУП у пациентов с СН на фоне ФВ ЛЖ ˃40% и висцеральным ожирением. Данные, подтверждающие ассоциированное с ожирением занижение показателя NT-proBNP, способствовали включению в практические рекомендации Европейского общества кардиологов в 2023г более низких пороговых значений данного биомаркера (меньше на 25-40% в зависимости от ИМТ) в алгоритмы не только ранней диагностики различных фенотипов СН, но и для выявления пациентов повышенного риска СН на её доклинических стадиях [29].
При анализе взаимосвязей основных временных и частотных показателей ВСР и показателей ТСР были выявлены ассоциации с биомаркерами и структурно-функциональными параметрами сердца, в основном, отражающими повышение давления наполнения ЛЖ, включая показатели диастолической функции и ГЛЖ. Уменьшение значений показателей, имеющих малую продолжительность цикла, и отражающих парасимпатические влияния на ВСР — RMSSD и HF — ассоциировалось с ухудшением параметров диастолической функции: уменьшением пика e' и увеличением индексного ОЛП. В то же время меньшие значения TS были ассоциированы с более высокими показателями ММЛЖ и её индексных параметров. Немногочисленные исследования других авторов демонстрируют связь временных показателей ВСР не только с систолической, но и с диастолической дисфункцией, как в общей популяции, так и у пациентов с клиническими проявлениями СНсФВ [9]. Стоит подчеркнуть, что снижение ВСР у пациентов с ХСН ассоциировано с неблагоприятным прогнозом, и показатели ВСР, в целях выявления декомпенсации, интерполированы в системы удаленного мониторинга у пациентов с СН, получающих сердечную ресинхронизирующую терапию. Снижение стандартного отклонения всех синусовых интервалов NN (SDNN) продемонстрировало свою прогностическую значимость у пациентов с СНнФВ и ПИКС, в т. ч. в отношении аритмических событий и внезапной сердечной смерти [7][30]. В исследовании Ksela J, et al. (2022) более низкие значения TS и SDNN ассоциировались с 1-годичной смертностью у пациентов с СНсФВ [10]. Эти факты обосновывают поиск ассоциаций показателей ВСР и ТСР с неблагоприятным ремоделированием и маркерами фиброза. В единичных исследованиях были предприняты попытки изучения связи паттернов экстрацеллюлярного коллагенообразования с временными и спектральными параметрами ВСР у пациентов с СН и ФВ ЛЖ ≤50%. Так, Lin YH, et al. (2010) продемонстрировали ассоциацию сывороточного уровня PIIINP с более низкими значениями SDNN, pNN50, HF, в то время как корреляций с другими биомаркерами, участвующими в процессах обмена экстрацеллюлярного матрикса и определяющими направленность процессов деградации коллагена, MMP-9 и TIMP-1, исследователями выявлено не было. Полученные данные позволили авторам предположить связь циркулирующего маркера фиброза PIIINP с автономным дисбалансом и его потенциальную роль в алгоритмах прогнозирования желудочковых аритмий и внезапной сердечной смерти [31]. Надо отметить, что в нашей работе паттерн равновесия маркеров синтеза коллагенов I и III типа (соотношение PICP/PIIINP) отрицательно коррелировал с показателями, отражающими симпато-вагальный баланс в сторону снижения влияния на синусовый узел парасимпатического компонента нервной системы. В то же время сывороточный уровень MMP-9 положительно был связан с временными показателями ВСР, характеризующими парасимпатические влияния, а увеличение TIMP-1, ассоциируемое с маркерами ГЛЖ, как было отмечено выше, ассоциировалось и с увеличением показателя ТСР — ТО. Анализ полученных взаимосвязей сывороточных биомаркеров фиброза с вегетативной регуляцией создает предпосылки для разработки новых способов диагностики риск-стратификационных маркеров неблагоприятного ремоделирования и прогноза у пациентов с СН и ФВ ЛЖ >40%. Продемонстрированные корреляции на глубоко фенотипированной выборке пациентов в рамках поискового исследования позволяют предполагать целесообразность включения комплексной оценки параметров АНС при разработке многофакторных моделей предикции неблагоприятного ремоделирования и клинических исходов у пациентов с СН, имеющих метаболические девиации.
Мы понимаем, что наличие многих факторов, обычно сопровождающих избыточную массу тела в рамках метаболического синдрома и способных самостоятельно индуцировать морфо-функциональные изменения миокарда, включая ГЛЖ и диастолическую дисфункцию, таких как АГ, инсулинорезистентность, гипергликемия, активация ренин-ангиотензин-альдостероновой и симпатической нервной систем, гиперволемия, затрудняет установление причинно-следственной связи [3]. В то же время очевидно, что процессы ремоделирования миокарда у пациентов с СНунФВ ишемической этиологии обусловлены не только наличием ПИКС, но и комплексным взаимодействием метаболических нарушений, ассоциированными с ними симпато-вагальным балансом, процессами воспаления и фиброза.
Ограничения исследования. Небольшая выборка пилотного исследования, отобранная согласно жестким критериям включения и невключения, с учетом факторов, влияющих на показатели ВСР, ТСР, маркеры фиброза и адипокины, включая пол, возраст, сопутствующие заболевания и пр., не исключает возможное участие в патогенезе ремоделирования сердца других факторов, не вошедших в анализ. В частности, оценка композиционного состава тела и размера эпикардиального жира могли повлиять на полученные результаты, что, несомненно, является ограничением проведенного исследования. Несмотря на однородность выборки, отсутствие анализа доверительных интервалов рассчитанных коэффициентов корреляций может быть одним из ограничений в отношении репрезентативности полученных взаимосвязей.
Заключение
- У пациентов с СН, ПИКС, ФВ ЛЖ 41-49% и метаболическими рисками сывороточные биомаркеры фиброза, адипокины, а также показатели ВСР и ТСР ассоциированы в основном с маркерами ГЛЖ и диастолической дисфункции.
- Баланс между лептином, адипонектином и АНС с другими факторами, вероятно, может определять уровень циркулирующего NT-proBNP у пациентов с СН на фоне ФВ ЛЖ >40% и ожирением.
- Результаты представленного пилотного исследования предопределяют дальнейший поиск потенциальных риск-стратификационных маркеров неблагоприятного ремоделирования миокарда и прогноза в больших выборках пациентов с метаболическими девиациями и СН с ФВ >40% на фоне современной медикаментозной терапии в условиях проспективного наблюдения.
Благодарности. Коллектив авторов выражает признательность и искреннюю благодарность за помощь в проведении различных этапов исследования сотрудникам ФГБУ "НМИЦ им. В. А. Алмазова": Лелявиной Татьяне Александровне, Галенко Виктории Леонидовне, Трукшиной Марии Александровне, Дзебоевой Альбине Юрьевне.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Savarese G, Stolfo D, Sinagra G, et al. Heart failure with mid-range or mildly reduced ejection fraction. Nat Rev Cardiol. 2022;19(2):100-16. doi:10.1038/s41569-021-00605-5.
2. Лясникова Е. А., Куулар А. А., Павловская А. В. и др. Влияние ожирения на эхокардиографические особенности и N-концевой предшественник мозгового натрийуретического пептида у больных с сердечной недостаточностью и промежуточной фракцией выброса левого желудочка: нерешенные вопросы. Российский кардиологический журнал. 2021;26(6):4462. doi:10.15829/1560-4071-2021-4462.
3. Лясникова Е. А., Матвеев Г. А., Голикова Т. И. и др. Ассоциация между адипокинами и ремоделированием сердца у пациентов с ожирением на доклинических стадиях сердечной недостаточности. Медицинский Совет. 2022;(17):80-91. doi:10.21518/2079-701X-2022-16-17-80-91.
4. Reinmann M, Meyer P. B-type natriuretic peptide and obesity in heart failure: a mysterious but important association in clinical practice. Cardiovasc Med. 2020;23(01):w02095. doi:10.4414/cvm.2020.02095.
5. van der Hoef CCS, Boorsma EM, Emmens JE, et al. Biomarker signature and pathophysiological pathways in patients with chronic heart failure and metabolic syndrome. Eur J Heart Fail. 2023;25(2):163-73. doi:10.1002/ejhf.2760.
6. Heart rate variability: standards of measurement, physiological interpretation and clinical use. Task Force of the European Society of Cardiology and the North American Society of Pacing and Electrophysiology. Circulation. 1996;93(5):1043-65.
7. Steinberg JS, Varma N, Cygankiewicz I, et al. 2017 ISHNE-HRS expert consensus statement on ambulatory ECG and external cardiac monitoring/telemetry. Heart Rhythm. 2017;14(7):e55-e96. doi:10.1016/j.hrthm.2017.03.038.
8. Бернгардт Э. Р., Пармон Е. В., Цветникова А. А. и др. Турбулентность сердечного ритма — новый маркер риска внезапной смерти. Артериальная гипертензия. 2008;14(1-S2):54-60.
9. Arshi B, Geurts S, Tilly MJ, et al. Heart rate variability is associated with left ventricular systolic, diastolic function and incident heart failure in the general population. BMC Med. 2022;20(1):91. doi:10.1186/s12916-022-02273-9.
10. Ksela J, Rupert L, Djordjevic A, et al. Altered Heart Rate Turbulence and Variability Parameters Predict 1-Year Mortality in Heart Failure with Preserved Ejection Fraction. J Cardiovasc Dev Dis. 2022;9(7):213. doi:10.3390/jcdd9070213.
11. Дедов И. И., Мокрышева Н. Г., Мельниченко Г. А. и др. Ожирение. Клинические рекомендации. Consilium Medicum. 2021;23(4):311-25. doi:10.26442/20751753.2021.4.200832.
12. Williams B, Mancia G, Spiering W, et al. ESC Scientific Document Group. 2018 ESC/ESH Guidelines for the management of arterial hypertension. Eur Heart J. 2018;39(33):3021-104. doi:10.1093/eurheartj/ehy339.
13. Marwick TH, Gillebert TC, Aurigemma G, et al. Recommendations on the Use of Echocardiography in Adult Hypertension: A Report from the European Association of Cardiovascular Imaging (EACVI) and the American Society of Echocardiography (ASE). J Am Soc Echocardiogr. 2015;28(7):727-54. doi:10.1016/j.echo.2015.05.002.
14. Schmidt G, Malik M, Barthel P, et al. Heart-rate turbulence after ventricular premature beats as a predictor of mortality after acute myocardial infarction. Lancet. 1999;353 (9162):1390-6. doi:10.1016/S0140-6736(98)08428-1.
15. Гржибовский А. М., Горбатова М. А., Наркевич А. Н. и др. Объем выборки для корреляционного анализа. Морская медицина. 2020;6(1);101-6. doi:10.22328/2413-5747-2020-6-1-101-106.
16. Лебедев Д. А., Лясникова Е. А., Васильева А. А. и др. Молекулярный биомаркерный профиль хронической сердечной недостаточности с промежуточной и сохраненной фракцией выброса левого желудочка на фоне сахарного диабета 2 типа. Российский кардиологический журнал. 2020;25(10):3967. doi:10.15829/1560-4071-2020-3967.
17. Ebong IA, Goff DC Jr, Rodriguez CJ, et al. Mechanisms of heart failure in obesity. Obes Res Clin Pract. 2014;8(6):e540-8. doi:10.1016/j.orcp.2013.12.005.
18. Sletten AC, Peterson LR, Schaffer JE. Manifestations and mechanisms of myocardial lipotoxicity in obesity. J Intern Med. 2018;284:478-91. doi:10.1111/joim.12728.
19. Szczepaniak LS, Dobbins RL, Metzger GJ, et al. Myocardial triglycerides and systolic function in humans: in vivo evaluation by localized proton spectroscopy and cardiac imaging. Magn Reson Med. 2003;49:417-23. doi:10.1002/mrm.10372.
20. Polyakova E, Mikhaylov E, Galagudza M, et al. Hyperleptinemia results in systemic inflammation and the exacerbation of ischemia-reperfusion myocardial injury. Heliyon. 2021;7e08491. doi:10.1016/j.heliyon.2021.e08491.
21. Rahmouni K. Leptin-Induced Sympathetic Nerve Activation: Signaling Mechanisms and Cardiovascular Consequences in Obesity. Curr Hypertens Rev. 2010;6(2):104-209. doi:10.2174/157340210791170994.
22. Shi Z, Pelletier NE, Wong J, et al. Leptin increases sympathetic nerve activity via induction of its own receptor in the paraventricular nucleus. Elife. 2020;9:e55357. doi:10.7554/eLife.55357.
23. Lijnen PJ, Maharani T, Finahari N, et al. Serum collagen markers and heart failure. Cardiovasc Hematol Disord Drug Targets. 2012;12(1):51-5. doi:10.2174/187152912801823147.
24. Dădârlat-Pop A, Sitar-Tăut A, Zdrenghea D, et al. Profile of Obesity and Comorbidities in Elderly Patients with Heart Failure. Clin Interv Aging. 2020;15:547-56. doi:10.2147/CIA.S248158.
25. Kuwahara K. The natriuretic peptide system in heart failure: Diagnostic and therapeutic implications. Pharmacol Ther. 2021;227:107863. doi:10.1016/j.pharmthera.2021.107863.
26. Luchner A, Schunkert H. Interactions between the sympathetic nervous system and the cardiac natriuretic peptide system. Cardiovasc Res. 2004;63(3):443-9. doi:10.1016/j.cardiores.2004.05.004.
27. Kurajoh M, Koyama H, Kadoya M, et al. Plasma leptin level is associated with cardiac autonomic dysfunction in patients with type 2 diabetes: HSCAA study. Cardiovasc Diabetol. 2015;14:117. doi:10.1186/s12933-015-0280-6.
28. Zhu T, Chen M, Wang M, et al. Association between adiponectin-to-leptin ratio and heart rate variability in new-onset paroxysmal atrial fibrillation: A retrospective cohort study. Ann Noninvasive Electrocardiol. 2022;27(2):e12896. doi:10.1111/anec.12896.
29. Bayes-Genis A, Docherty KF, Petrie MC, et al. Practical algorithms for early diagnosis of heart failure and heart stress using NT-proBNP: A clinical consensus statement from the Heart Failure Association of the ESC. Eur J Heart Fail. 2023;25(11):1891-8. doi:10.1002/ejhf.3036.
30. La Rovere MT, Pinna GD, Maestri R, et al. GISSI-HF Investigators. Autonomic markers and cardiovascular and arrhythmic events in heart failure patients: still a place in prognostication? Data from the GISSI-HF trial. Eur J Heart Fail. 2012;14(12):1410-9. doi:10.1093/eurjhf/hfs126.
31. Lin YH, Lin C, Lo MT, et al. The relationship between aminoterminal propeptide of type III procollagen and heart rate variability parameters in heart failure patients: a potential serum marker to evaluate cardiac autonomic control and sudden cardiac death. Clin Chem Lab Med. 2010;48(12):1821-7. doi:10.1515/CCLM.2010.348.
Об авторах
Е. А. ЛясниковаРоссия
Лясникова Елена Анатольевна — к. м. н., доцент кафедры факультетской терапии с клиникой ИМО, в. н. с. НИО сердечной недостаточности.
Санкт-Петербург
AuthorID 630408
Конфликт интересов:
Нет
А. И. Гареева
Россия
Гареева Аделия Ильдаровна — клинический ординатор кафедры факультетской терапии с клиникой ИМО.
Санкт-Петербург
Конфликт интересов:
Нет
В. К. Муслимова
Россия
Муслимова Виктория Камилевна — клинический ординатор кафедры факультетской терапии с клиникой ИМО.
Санкт-Петербург
Конфликт интересов:
Нет
Е. С. Жабина
Россия
Жабина Екатерина Сергеевна — к. м. н., с. н. с. НИЛ электрокардиологии, ассистент кафедры факультетской терапии с клиникой ИМО.
Санкт-Петербург
AuthorID 1027245
Конфликт интересов:
Нет
С. Н. Козлова
Россия
Козлова Светлана Николаевна — д. м. н., профессор кафедры факультетской терапии с клиникой ИМО.
Санкт-Петербург
AuthorID 657957
Конфликт интересов:
Нет
М. Ю. Ситникова
Россия
Ситникова Мария Юрьевна — д. м. н., г. н. с., зав. НИО сердечной недостаточности, профессор кафедры факультетской терапии ИМО.
Санкт-Петербург
AuthorID 630219
Конфликт интересов:
Нет
Е. В. Шляхто
Россия
Шляхто Евгений Владимирович — д. м. н., академик РАН, генеральный директор, зав. кафедрой факультетской терапии с клиникой ИМО.
Санкт-Петербург
AuthorID 136786
Конфликт интересов:
Нет
Дополнительные файлы
- Высокая распространенность ожирения и ассоциированных с ним метаболических нарушений в когорте пациентов с сердечной недостаточностью и умеренно низкой фракцией выброса (СНунФВ) ишемической этиологии определяет поиск ассоциаций автономного дисбаланса с биомаркерным профилем и неблагоприятным структурно-функциональным ремоделированием сердца.
- Продемонстрировано, что у пациентов с СНунФВ и метаболическими рисками показатели вариабельности и турбулентности сердечного ритма ассоциированы с сывороточными биомаркерами фиброза, адипокинами, маркерами повышения давления наполнения левого желудочка.
- Баланс между адипокинами и автономной нервной системой может быть звеном многофакторного механизма, влияющего на уровень N-концевого промозгового натрийуретического пептида у пациентов с ожирением и сердечной недостаточностью.
Рецензия
Для цитирования:
Лясникова Е.А., Гареева А.И., Муслимова В.К., Жабина Е.С., Козлова С.Н., Ситникова М.Ю., Шляхто Е.В. Ремоделирование сердца у пациентов с хронической сердечной недостаточностью с умеренно низкой фракцией выброса и метаболическими нарушениями: ассоциация с биомаркерами и параметрами автономной нервной системы. Российский кардиологический журнал. 2024;29(4):5752. https://doi.org/10.15829/1560-4071-2024-5752. EDN: LMWSDJ
For citation:
Lyasnikova E.A., Gareeva A.I., Muslimova V.K., Zhabina E.S., Kozlova S.N., Sitnikova M.Yu., Shlyakhto E.V. Cardiac remodeling in patients with heart failure with mildly reduced ejection fraction and metabolic disorders: association with biomarkers and autonomic nervous system parameters. Russian Journal of Cardiology. 2024;29(4):5752. (In Russ.) https://doi.org/10.15829/1560-4071-2024-5752. EDN: LMWSDJ
JATS XML

















































