Перейти к:
Первый опыт в Российской Федерации лечения дислипидемии препаратами миРНК у пациентов после трансплантации сердца
https://doi.org/10.15829/1560-4071-2024-5747
EDN: ISMANC
Аннотация
Пациенты после перенесенной трансплантации сердца относятся к категории очень высокого риска развития сердечно-сосудистых заболеваний. Протоколы ведения реципиентов сердца включают в себя инициацию гиполипидемической терапии (ГЛТ) вне зависимости от пола, возраста и генеза сердечной недостаточности. С учетом лекарственных взаимодействий и риска развития посттрансплантационных осложнений возможности ГЛТ ограничены в трансплантированной популяции. В работе представлены клинические случаи первого опыта применения в Российской Федерации миРНК ГЛТ для лечения дислипидемии у реципиентов солидных органов.
Для цитирования:
Симоненко М.А., Алиева А.С., Ситникова М.Ю., Федотов П.А. Первый опыт в Российской Федерации лечения дислипидемии препаратами миРНК у пациентов после трансплантации сердца. Российский кардиологический журнал. 2024;29(1):5747. https://doi.org/10.15829/1560-4071-2024-5747. EDN: ISMANC
For citation:
Simonenko M.A., Alieva A.S., Sitnikova M.Yu., Fedotov P.A. First Russian experience of treating dyslipidemia with siRNA drugs in patients after heart transplantation. Russian Journal of Cardiology. 2024;29(1):5747. (In Russ.) https://doi.org/10.15829/1560-4071-2024-5747. EDN: ISMANC
За счет отсутствия специфической клинической картины дислипидемия (ДЛП) представляет собой "тихий" фактор развития сердечно-сосудистых заболеваний (ССЗ) [1]. Более того, у реципиентов сердца атеросклероз протекает более агрессивно, увеличивая риск болезни коронарных артерий пересаженного сердца (БКАПС) на 10% каждые 2 года после трансплантации [2]. Особая форма коронарного атеросклероза — васкулопатия сердечного аллографта, которая морфологически отличается от типичной атероматозной бляшки, ухудшает выживаемость больных в течение трех лет после появления первых изменений по результатам инструментальной диагностики [3][4]. Поэтому разработка возможностей медикаментозной терапии для достижения целевых уровней холестерина липопротеинов низкой плотности (ХС ЛНП) в плазме является одним из ключевых залогов для снижения риска ССЗ и осложнений (событий) [1]. Инклисиран — новый препарат, механизм действия которого основан на инновационном ингибировании транскрипции малой интерферирующей РНК (миРНК) гена PCSK9, что приводит к снижению уровня ХС ЛНП [1]. Поэтому целью работы стало описание первого опыта в Российской Федерации (РФ) лечения препаратами миРНК у пациентов после трансплантации сердца (ТС).
Материал и методы
В ФГБУ "НМИЦ им. В. А. Алмазова" Минздрава России (далее — Центр им. В. А. Алмазова) все пациенты после перенесенной ТС включались в группу диспансерного наблюдения реципиентов сердца и подписывали информированное согласие для наблюдения в условиях Центра. Протокол посттрансплантационного ведения включал не только иммуносупрессивную терапию, но и назначение статинов вне зависимости от пола, возраста и генеза хронической сердечной недостаточности (ХСН). С целью достижения целевых значений ХС ЛНП у двоих пациентов были определены показания к применению миРНК препарата — раствора инклисирана. Исследование выполнено в соответствии с принципами Хельсинкской декларации.
Результаты
Клинический случай 1
Пациент мужского пола (64 года) через 12 лет после ортотопической ТС по поводу ХСН ишемического генеза. С 2014г объем иммуносупрессивной терапии был представлен двумя компонентами: такролимусом и эверолимусом. Посттрансплантационный период был осложнен развитием хронической болезни почек (ХБП) C3б смешанного генеза (атеросклероз, применение ингибиторов кальциневрина) и генерализованного атеросклероза: БКАПС, облитерирующим атеросклерозом артерий нижних конечностей, брахиоцефальных артерий, почечных артерий и аорты и её ветвей, по поводу чего с 2017 по 2023гг пациенту было выполнено 12 эндоваскулярных вмешательств. Также была отмечена прогрессия ДЛП типа IIb (табл. 1, рис. 1) и при попытке увеличения дозы аторвастатина была зарегистрирована статин-индуцированная миопатия нижних конечностей, осложненная атаксией, которая была купирована редукцией дозы статинов. По результатам лабораторного контроля липидного спектра был увеличен объем гиполипидемической терапии (ГЛТ) до трехкомпонентной, которая была представлена аторвастатином в дозе 20 мг, фенофибратом 145 мг и эзетимибом 10 мг. До осени 2022г расчетная скорость клубочковой фильтрации (СКФ) была >45 мл/мин/1,73 м². В дальнейшем было отмечено резкое снижение СКФ, <30 мл/мин/1,73 м². Несмотря на ДЛП, в связи с ухудшением почечной функции фенофибрат был отменен. При обследовании у пациента был диагностирован рестеноз левой почечной артерии, по поводу чего в декабре 2022г было выполнено стентирование левой почечной артерии стентом с лекарственным покрытием.
Таблица 1
Динамика липидограммы и объема ГЛТ у пациента (клинический случай 1): 2019-2022гг
|
Показатели |
06.03.19 |
27.09.19 |
04.08.20 |
16.12.20 |
03.02.21 |
31.05.21 |
20.05.22 |
23.08.22 |
|
Общий холестерин, ммоль/л |
8,06 |
5,64 |
5,07 |
6,07 |
3,92 |
4,46 |
5,8 |
3,37 |
|
Триглицериды, ммоль/л |
2,1 |
1,71 |
2,79 |
3,33 |
1,65 |
1,73 |
3,76 |
2,39 |
|
ХС ЛВП, ммоль/л |
1,34 |
1,21 |
0,85 |
1,07 |
1,09 |
0,94 |
0,8 |
0,75 |
|
ХС ЛОНП, ммоль/л |
0,96 |
0,78 |
1,28 |
1,53 |
0,75 |
0,79 |
1,72 |
1,1 |
|
ХС ЛНП, ммоль/л |
5,76 |
3,65 |
2,94 |
3,47 |
2,07 |
2,73 |
3,28 |
1,52 |
|
Коэффициент атерогенности |
5,01 |
3,66 |
4,96 |
4,67 |
2,6 |
3,74 |
6,25 |
3,49 |
|
Гиполипидемическая терапия |
Аторвастатин 20 мг, Фенофибраты 145 мг |
Аторвастатин 20 мг, Эзетимиб 10 мг |
Аторвастатин 20 мг, Эзетимиб 10 мг, Фенофибрат 145 мг |
|||||
Сокращения: ХС ЛВП — холестерин липопротеинов высокой плотности,
ХС ЛОНП — холестерин липопротеинов очень низкой плотности,
ХС ЛНП — холестерин липопротеинов низкой плотности.
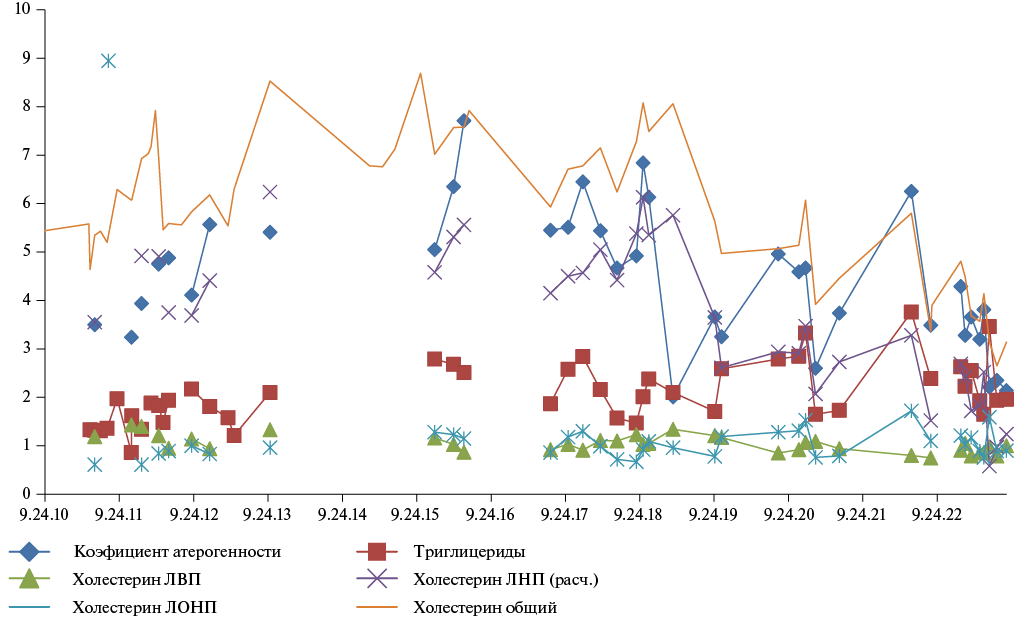
Рис. 1. Динамика липидного спектра у пациента (клинический случай 1).
Примечание: цветное изображение доступно в электронной версии журнала.
Сокращения: ЛВП — липопротеины высокой плотности,
ЛОНП — липопротеины очень низкой плотности,
ЛНП — липопротеины низкой плотности.
Наличие генерализованного атеросклероза с неэффективностью трехкомпонентной ГЛТ и необходимостью отмены одного из компонентов лечения свидетельствуют об отсутствии резервов для лечения ДЛП у данного пациента. После определения показаний к введению раствора инклисирана было рекомендовано применение препарата.
24 мая 2023г и 28 августа 2023г пациенту были выполнены подкожные инъекции раствора инклисирана с положительным эффектом в виде улучшения липидного спектра (рис. 1). Нежелательных явлений (НЯ) после применения препарата не было, концентрации такролимуса и эверолимуса оставались стабильными, почечная функция не ухудшилась. С учетом анамнеза и результатов лабораторного контроля пациенту было рекомендовано продолжить ежедневный пероральный прием аторвастатина (20 мг) и эзетимиба (10 мг), а также введение препарата инклисиран (284 мг) 1 раз в 6 мес.
Клинический случай 2
В 2022г пациенту мужского пола (51 год) была проведена ортотопическая ТС по бикавальной методике по поводу дилатационной кардиомиопатии смешанного генеза, осложненная на 3-и сутки послеоперационного периода развитием Q-инфаркта миокарда передней стенки левого желудочка пересаженного сердца, по поводу чего была выполнена баллонная ангиопластика с тромбоэкстракцией из передней межжелудочковой артерии и последующим стентированием стентом с лекарственным покрытием. В связи с прогрессией почечной дисфункции в раннем посттрансплантационном периоде до ХБП С5 (рис. 2) ему была назначена заместительная почечная терапия, которая проводилась у пациента с октября 2022г по ноябрь 2023г. Согласно стандартному протоколу ведения реципиентов сердца после ТС ему была инициирована терапия аторвастатином в дозе 10 мг. В январе 2023г по результатам липидного спектра доза препарата была увеличена до 20 мг/сут. По результатам лабораторного контроля от 31.05.2023 выявлено нарастание ДЛП. Результаты динамики липидограммы представлены в таблице 2.
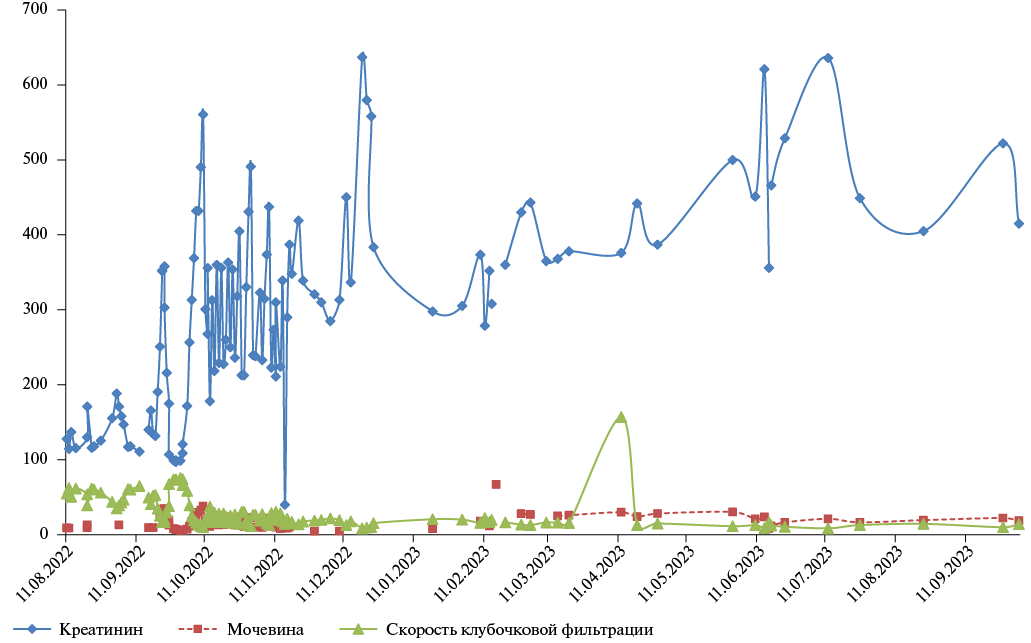
Рис. 2. Динамика почечной функции у пациента (клинический случай 2).
Примечание: цветное изображение доступно в электронной версии журнала.
Таблица 2
Динамика липидограммы и объемы ГЛТ у пациента (клинический случай 2)
|
Показатели |
12.08.2022 (до ТС) |
19.01.23 |
31.05.23 |
|
Общий холестерин, ммоль/л |
4,04 |
6,14 |
8,29 |
|
Триглицериды, ммоль/л |
1,25 |
2,51 |
3,5 |
|
ХС ЛВП, ммоль/л |
0,6 |
0,93 |
1,1 |
|
ХС ЛОНП, ммоль/л |
0,57 |
1,15 |
1,61 |
|
ХС ЛНП, ммоль/л |
2,87 |
4,06 |
5,58 |
|
Коэффициент атерогенности |
5,73 |
5,6 |
6,54 |
|
Препараты |
— |
Аторвастатин 10 мг, с 19.01.23 доза увеличена до 20 мг в сутки |
|
Сокращения: ТС — трансплантация сердца,
ХС ЛВП — холестерин липопротеинов высокой плотности,
ХС ЛОНП — холестерин липопротеинов очень низкой плотности,
ХС ЛНП — холестерин липопротеинов низкой плотности.
После ТС пациенту была назначена стандартная четырехкомпонентная иммуносупрессивная терапия: такролимус, микофеноловая кислота, метилпреднизолон и базиликсимаб.
Более того, в посттрансплантационном периоде у больного развились НЯ после применения дженериков такролимуса короткого действия, которые были репортированы в Федеральную службу по надзору в сфере здравоохранения. НЯ были ассоциированы с применением ингибиторов кальциневрина в высоких дозах у пациента для достижения целевой концентрации такролимуса, что привело к неэффективности варфарина и невозможности достижения целевого уровня международного нормализованного отношения. Значимая редукция медикаментозных препаратов, действующих через цитохром P450 (CYP450), в т. ч. инициация эверолимуса с последующей редукцией дозы такролимуса более, чем в 2 раза привела к нарастанию концентрации такролимуса (обратная реакция по сравнению с другими пациентами) и достижению целевого уровня международного нормализованного отношения, в связи с чем решением врачебной комиссии принято решение о переводе пациента на такролимус пролонгированного действия по жизненным показаниям. С учетом анамнеза пациента и его индивидуальной чувствительности к препаратам, действующим через CYP450, предпочтительно применение препаратов, не действующих через CYP450. Для купирования ДЛП и снижения риска развития криза отторжения сердечного трансплантата и/или прогрессии БКАПС были определены показания к введению раствора инклисирана.
18 августа и 15 декабря 2023г пациенту были выполнены подкожные инъекции инклисирана. Уже через 1 мес. после выполненной первой инъекции миРНК препарата отмечена значимая положительная динамика в виде улучшения результатов липидного спектра (рис. 3). НЯ не было зарегистрировано. С учетом успешного лечения и в соответствии с инструкцией показано продолжение применения инклисирана.
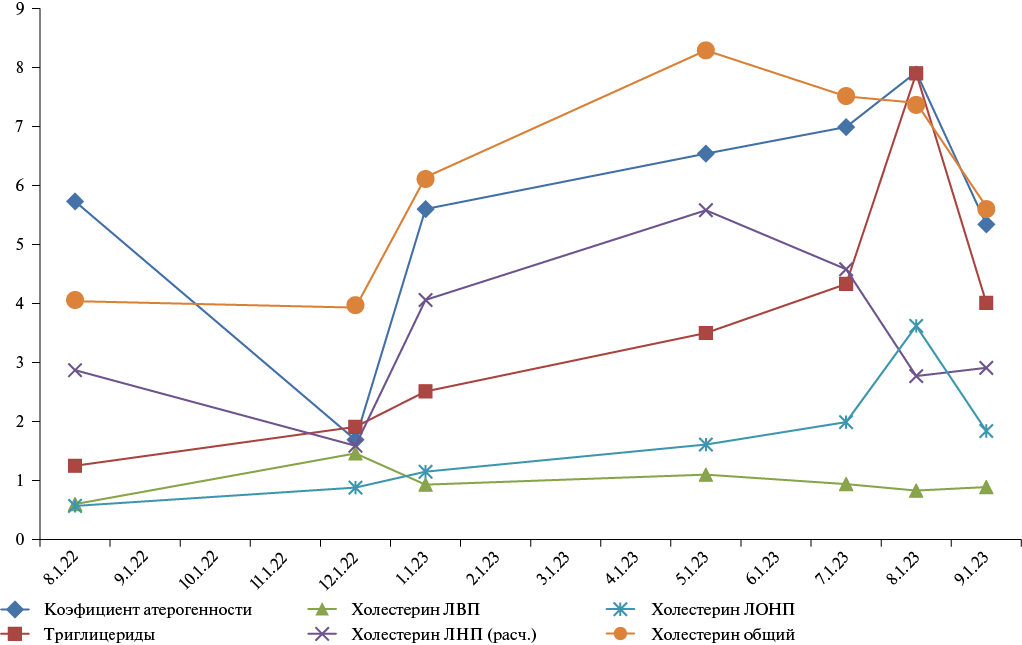
Рис. 3. Динамика липидограммы у пациента (клинический случай 2): 2022-2023гг.
Примечание: цветное изображение доступно в электронной версии журнала.
Сокращения: ЛВП — липопротеины высокой плотности,
ЛОНП — липопротеины очень низкой плотности,
ЛНП — липопротеины низкой плотности.
Заслуживает внимания то, что уменьшение объема медикаментозной терапии, действующей через CYP450, привело к улучшению почечной функции через 13 мес. после ТС и отмене сеансов заместительной почечной терапии в конце ноября 2023г. Продолжается наблюдение пациента совместно с врачами-нефрологами ПСПбГМУ им. акад. И. П. Павлова (г. Санкт-Петербург).
При оценке ранних результатов применения миРНК ГЛТ в описываемых нами клинических случаях было отмечено значимое улучшение всех анализируемых показателей липидного спектра, в т. ч. снижение уровня триглицеридов, и отсутствие краткосрочных НЯ. В дальнейшем планируется отдаленная оценка результатов инъекционной ГЛТ, также будет продолжено применение препарата инклисиран у обоих пациентов.
Обсуждение
Рекомендации Российского кардиологического общества (РКО) по кардиоваскулярной профилактике (2022) включают пациентов после трансплантации солидных органов в группу высокого риска развития ДЛП [5], в связи с этим в действующих Национальных клинических рекомендациях по ведению реципиентов сердца указано, что им независимо от уровней общего холестерина рекомендовано назначение средств из группы ГМГ-КоА редуктазы (УУР А и УДД 2), но не указаны алгоритмы ведения больных в случае неэффективности оптимальной дозы статинов1.
Согласно рекомендациям Международного сообщества трансплантации сердца и легких (The International Society of Heart and Lung Transplantation, ISHLT) от 2010г и их последнему пересмотру в 2023г, всем пациентам после ТС вне зависимости от их пола, возраста и генеза сердечной недостаточности рекомендовано пожизненное добавление ГЛТ из-за высокого риска развития БКАПС и/или прогрессии атеросклероза периферических сосудов [6][7]. ГЛТ также снижает риск развития криза отторжения сердечного трансплантата [8][9]. Первой линией терапии являются статины в редуцированных дозах из-за высокого риска миопатии и миозита, а также почечной и/или печеночной дисфункции [6-8][10]. Дальнейшая титрация статинов должна проводиться с осторожностью и с учетом лекарственных взаимодействий, в т. ч. под контролем концентраций иммуносупрессивных препаратов в крови. В случае непереносимости статинов или их неэффективности при максимально переносимой дозе в качестве альтернативы или второй линии терапии рекомендовано применение эзетимиба [6][7][10]. Ко второй линии ГЛТ у реципиентов сердца относятся следующие препараты — эзетимиб; при развитии триглицеридемии ко второй и третьей линиям — фенофибрат и омега-3 полиненасыщенные жирные кислоты [6][7][10]. Согласно рекомендациям Европейского сообщества кардиологов (European Society of Cardiology, ESC), применение ингибиторов PCSK9 входит в схему ведения пациентов высокого риска ССЗ с неэффективностью статинов, но данная группа препаратов не включена в алгоритмы ведения реципиентов сердца [10]. В мировой литературе были опубликованы единичные клинические случаи, показывающие эффективность ингибиторов PCSK9 в схеме ГЛТ у трансплантированных пациентов [11][12]. Однако в настоящее время применение данной группы препаратов не включено в алгоритмы ведения реципиентов солидных органов. Проведение дальнейшего исследования эффективности и безопасности ингибиторов PCSK9 у реципиентов солидных органов позволит разработать персонифицированный подход к назначению ГЛТ.
В 2022г в РФ был зарегистрирован инновационный инъекционный препарат для лечения ДЛП — инклисиран (международное непатентованное название), предназначенный для лечения пациентов с первичной гиперхолестеринемией или смешанной ДЛП. И опубликованные в 2023г клинические рекомендации по коррекции "Нарушений липидного обмена" [13] включили применение инклисирана у пациентов экстремального и очень высокого риска в случае отсутствия резервов пероральной ГЛТ (УУР А, УДД 1), а также у больных "с непереносимостью любой дозы статина, которые на фоне приема эзетимиба не достигли целевого уровня ХС ЛНП" (УУР А, УДД 2). В то же самое время в современных клинических рекомендациях [13] отсутствуют персонифицированные рекомендации по ведению пациентов после перенесенной трансплантации солидных органов, что осложняет выбор лечебной тактики и поддержание удовлетворительной функции аллографтов.
В связи с тем, что лекарственный препарат инклисиран не является субстратом, ингибитором или индуктором CYP450, не ожидается, что его применение будет иметь значимые клинические взаимодействия с другими лекарственными препаратами, в т. ч. с иммуносупрессивной терапией [14][15]. За прошедший год были опубликованы первые успешные результаты применения инклисирана у реципиентов солидных органов [14][16][17]. Как было показано в представленных нами клинических случаях, ограничением в применении второй и третьей линий ГЛТ было развитие почечной дисфункции. Поэтому ключевой причиной целесообразности использования инклисирана являются опубликованные данные 2020г исследований ORION-7 и ORION-1, в которых было продемонстрировано эффективное и безопасное в краткосрочном наблюдении применение препарата у пациентов с тяжелой ХБП со снижением СКФ <30 мл/мин/1,73 м² [15][16].
Разработка алгоритмов назначения ГЛТ в описываемой популяции позволит редуцировать риск развития посттрансплантационных осложнений и улучшить прогноз реципиентов. Более того, своевременное назначение ГЛТ в качестве первичной или вторичной профилактики ДЛП у трансплантированных больных уменьшит финансовую нагрузку на здравоохранение за счет снижения частоты госпитализаций и хирургических вмешательств по поводу ССЗ.
Заключение
Согласно нашим данным, применение миРНК инъекционной ГЛТ у пациентов с наличием трансплантированного сердца эффективно и безопасно: хорошая переносимость препарата в течение 5-6 мес. его применения, значимое улучшение результатов липидного спектра, отсутствие ухудшения функционирования сердечного трансплантата и почечной функции, отсутствие межлекарственного взаимодействия с иммуносупрессивной терапией. Необходимо проведение дальнейшего наблюдения реципиентов и организация многоцентрового исследования для разработки алгоритмов назначения ГЛТ у трансплантированных больных.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
1. Клинические рекомендации РФ "Трансплантация сердца, наличие трансплантированного сердца, отмирание и отторжение трансплантата сердца" (2023).
Список литературы
1. Scicchitano P, Milo M, Mallamaci R, et al. Inclisiran in lipid management: a literature overview and future perspectives. 2021;143:112227. doi:10.1016/j.biopha.2021.112227.
2. Warden BA, Duell PB. Management of dyslipidemia in adult solid organ transplant recipients. J.Clin. Lipidol. 2019;13:231-45.
3. Patel CB, Holley CL. Cardiac Allograft Vasculopathy: A Formidable Foe. J.Am. Coll. Cardiol. 2019;74:52-3.
4. Iannuzzo G, Cuomo G, Di Lorenzo A, et al. Dyslipidaemia in transplant patient: which therapy? Journal of Clinical Medicine. 2022;11(4080):1-19. doi:10.3390/jcm11144080.
5. Аншелес А.А., Бадтиева В.А., Балахонова Т.В. и др. Кардиоваскулярная профилактика 2022. Российские национальные рекомендации. Российский кардиологический журнал. 2023;28(5):5452: doi:10.15829/1560-4071-2023-5452.
6. Costanzo MR, Dipchand A, Starling R, et al. The International Society of Heart and Lung Transplantation Guidelines for the care of heart transplant recipients. J Heart Lung Transplant. 2010;29(8):914-56. doi:10.1016/j.healun.2010.05.034.
7. Velleca A, Shullo MA, Dhital K, et al. The International Society for Heart and Lung Transplantation (ISHLT) guidelines for the care of heart transplant recipients. J Heart Lung Transplant. 2023;42(5):E1-E141. doi:10.1016/j.healun.2022.10.015.
8. Kittleson MM, Kobashigawa JA. Statins in heart transplantation. Clin Transpl. 2023;135-43.
9. Stehlik J, Kemeyou L. Protecting the heart allograft with a statin. The perfect intervention or too good to be true? Circulation. 2019;140(8):641-4. doi:10.1161/CIRCULATIONAHA.119.042016.
10. Mach F, Baigent C, Catapano AL, et al. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. EHJ. 2020;41:111-88. doi:10.1093/eurheartj/ehz455.
11. Gurgoze MT, Muller-Hansma AHG, Schreuder MM, et al. Adverse events associated with PCSK9 inhibitors: a real-world experience. 2018;105(2):496-504. doi:10.1002/cpt.1193.
12. Warden BA, Kaufman T, Minnier J, et al. Use of PCSK9 inhibitors in solid organ transplantation recipients. JACC Case Rep. 2020;2(3):396-9. doi:10.1016/j.jaccas.2019-09.026.
13. Ежов М.В., Кухарчук В.В., Сергиенко И.В. и др. Нарушения липидного обмена. Клинические рекомендации 2023. Российский кардиологический журнал. 2023;28(5):5471. doi:10.15829/1560-4071-2023-5471.
14. Ray KK, Kallend D, Leiter LA, et al. Effect of Inclisiran on lipids in primary prevention: the ORION-11 trial. EHJ. 2022;43:5047-57.
15. Wright RS, Collins MG, Stoekenbroek RM, et al. Effects of Renal Impairment on the Pharmacokinetics, Efficacy, and Safety of Inclisiran: an analysis of the ORION-7 an ORION-1 Studies. Mayo Clin Proc. 2020;95(1):77-89.. doi:10.1016/j.mayocp.2019.08.021.
16. Ueberdiek L, Jehn U, Pavenstadt H, et al. Novel therapeutic strategies for dyslipidaemia: first report of Inclisiran therapy in a kidney transplanted patient. Transpl Int. 2023;36:11104. doi:10.3389/ti.2023.11104.
17. Медведева Е.А., Григоренко Е.А., Митьковская Н.П. Инновационная гиполипидемическая терапия: опыт применения инклисирана в Республике Беларусь. Российский кардиологический журнал. 2023;28(4):5417. doi:10.15829/1560-4071-2023-5417
Об авторах
М. А. СимоненкоРоссия
Симоненко Мария Андреевна — н. с. НИЛ кардиопульмонального тестирования, врач-кардиолог-трансплантолог КДЦ
Санкт-Петербург
А. С. Алиева
Россия
Алиева Асият Сайгидовна — к.м.н., зав. НИЛ нарушений липидного обмена и атеросклероза НЦМУ "Центр персонализированной медицины", руководитель Центра Атеросклероза и нарушений липидного обмена, врач-кардиолог
Санкт-Петербург
М. Ю. Ситникова
Россия
Ситникова Мария Юрьевна — д.м.н., профессор, г.н.с., руководитель НИО сердечной недостаточности и профессор кафедры факультетской терапии с клиникой
Санкт-Петербург
П. А. Федотов
Россия
Федотов Петр Алексеевич — к.м.н., зав. НИЛ высокотехнологичных методов лечения сердечной недостаточности, доцент кафедры кардиологии ИМО
Санкт-Петербург
Дополнительные файлы
Рецензия
Для цитирования:
Симоненко М.А., Алиева А.С., Ситникова М.Ю., Федотов П.А. Первый опыт в Российской Федерации лечения дислипидемии препаратами миРНК у пациентов после трансплантации сердца. Российский кардиологический журнал. 2024;29(1):5747. https://doi.org/10.15829/1560-4071-2024-5747. EDN: ISMANC
For citation:
Simonenko M.A., Alieva A.S., Sitnikova M.Yu., Fedotov P.A. First Russian experience of treating dyslipidemia with siRNA drugs in patients after heart transplantation. Russian Journal of Cardiology. 2024;29(1):5747. (In Russ.) https://doi.org/10.15829/1560-4071-2024-5747. EDN: ISMANC
JATS XML

















































