Перейти к:
Состояние бета-адренореактивности мембран эритроцитов при различных фенотипах неконтролируемой артериальной гипертензии
https://doi.org/10.15829/1560-4071-2024-5668
EDN: KCXNTU
Аннотация
Цель. Оценить функциональное состояние симпатической нервной системы по данным β-адренореактивности мембран эритроцитов (β-АРМэ) у больных рефрактерной (рфАГ) и резистентной артериальной гипертензией (РАГ) во взаимосвязи с поражением органов мишеней.
Материал и методы. В одномоментное сравнительное исследование было включено 78 пациентов с неконтролируемой АГ, средний возраст 57,4±9,3 года (33 мужчины), уровень 24-часового артериального давления (АД) (систолическое/диастолическое) 160,0±18,8/88,1±17,3 мм рт.ст., 39 (50%) больных сахарным диабетом 2 типа. Исходно пациенты были разделены на 2 группы в зависимости от фенотипа неконтролируемой АГ. Первую группу составили больные с рфАГ (n=26 (33,3%)), вторую — с РАГ (при отсутствии контроля АД на фоне приёма от 3 до 4 препаратов) (n=52 (66,7%)). Всем пациентам проводили измерение офисного и среднесуточного АД, определение β-АРМэ, оценку поражения органов-мишеней согласно стандартам обследования при АГ.
Результаты. Сравниваемые группы не отличались по половозрастному составу, частоте сахарного диабета 2 типа и основным клиническим данным. Однако, несмотря на сопоставимый уровень офисного и среднесуточного АД, частота гипертрофии левого желудочка (ЛЖ) по данным эхокардиографии при рфАГ была существенно выше, чем при РАГ (96,2% vs 76,9%, p=0,027, соответственно). Повышение β-АРМэ (>20 усл. ед.) документировано у 87,1% больных общей группы. При этом среднее значение β-АРМэ в группе рфАГ было значимо выше, чем в группе РАГ (51,5±18,7 vs 39,3±18,2, p=0,008). Согласно ROC-анализу, пороговое значение уровня β-АРМэ, соответствующее наличию рфАГ, составило ≥44,8 усл. ед. (чувствительность — 69,2%, специфичность — 64,5%, площадь под ROC-кривой 0,687). Уровень β-АРМэ в группе рфАГ не имел прямой связи с индексом массы миокарда ЛЖ, однако коррелировал с увеличением пульсового АД.
Заключение. Наличие рфАГ ассоциируется с более высокими значениями β-АРМэ, чем у больных РАГ, что может косвенно подтверждать более выраженную симпатическую активность и объяснять более высокую частоту гипертрофии ЛЖ, реализуемую через повышение сосудистой жёсткости и пульсатильной нагрузки на ЛЖ.
Ключевые слова
Для цитирования:
Манукян М.А., Фальковская А.Ю., Мордовин В.Ф., Зюбанова И.В., Личикаки В.А., Солонская Е.И., Вторушина А.А., Хунхинова С.А., Скомкина И.А., Руденко В.В., Реброва Т.Ю., Муслимова Э.Ф., Афанасьев С.А. Состояние бета-адренореактивности мембран эритроцитов при различных фенотипах неконтролируемой артериальной гипертензии. Российский кардиологический журнал. 2024;29(5):5668. https://doi.org/10.15829/1560-4071-2024-5668. EDN: KCXNTU
For citation:
Manukyan M.A., Falkovskaya A.Yu., Mordovin V.F., Zyubanova I.V., Lichikaki V.A., Solonskaya E.I., Vtorushina A.A., Khunkhinova S.A., Skomkina I.A., Rudenko V.V., Rebrova T.Yu., Muslimova E.F., Afanasyev S.A. Beta-adrenergic reactivity of erythrocyte membranes in various phenotypes of uncontrolled hypertension. Russian Journal of Cardiology. 2024;29(5):5668. (In Russ.) https://doi.org/10.15829/1560-4071-2024-5668. EDN: KCXNTU
Известно, что симпатическая гиперактивация является одним из ключевых механизмов развития артериальной гипертензии (АГ) [1]. Рефрактерная АГ (рфАГ) определяется как артериальное давление (АД), которое не контролируется, несмотря на прием ≥5 антигипертензивных препаратов различных классов, включая тиазидный диуретик длительного действия и антагонист минералокортикоидных рецепторов в максимальных или максимально переносимых дозах. Этот фенотип отличается от неконтролируемой резистентной АГ (РАГ), определяемой при отсутствии целевого уровня АД, несмотря на прием от 3 до 4 препаратов в максимальных или максимально переносимых дозах [2], более высоким риском сердечно-сосудистых осложнений [3][4]. При этом предполагается, что в основе рфАГ лежит симпатическая гиперактивация, тогда как для неконтролируемой РАГ в большей степени характерен объем-зависимый механизм повышения АД [5]. В настоящее время существуют как прямые, так и косвенные методы оценки симпато-адреналовой системы (САС). Прямые методы обладают высокой специфичностью и чувствительностью, однако для анализа полученных результатов требуются дорогостоящие реактивы и специальное оборудование. К ним относится определение обмена катехоламинов и их предшественников в крови или моче радиоизотопным, гистохимическим и иными способами. Косвенным методом оценки функционального состояния САС служит определение β-адренореактивности мембран эритроцитов (β-АРМэ), отражающей общие закономерности изменений мембранных и клеточных структур под действием катехоламинов [6]. Повышение степени симпатической активности сопровождается устойчивой стимуляцией катехоламинами бета-адренорецепторов, что ведёт к уменьшению количества или снижению их функциональной активности на поверхности клеток и увеличению β-АРМэ [6][7]. На основе понимания этих процессов для изучения активности САС Стрюк Р. И. и Длусской И. Г. был разработан метод определения β-АРМэ [6], позволяющий количественно измерять степень десенситизации адренорецепторов к длительному воздействию высоких концентраций катехоламинов. Преимуществом данного метода, определяющим его доступность для реальной клинической практики, является простота использования, высокая информативность и низкая стоимость расходных материалов. В настоящее время накоплены данные об особенностях β-АРМэ у больных после инфаркта миокарда (ИМ) [8-10], у пациентов с хронической сердечной недостаточностью (СН) [11], а также у больных РАГ [12]. Тем не менее сведения о степени выраженности симпатической гиперактивации на основе β-АРМэ в селективной группе больных с рфАГ как крайнего фенотипа неконтролируемой АГ до настоящего времени отсутствуют. В основу исследования положена гипотеза о том, что у больных рфАГ в сравнении с лицами с РАГ наблюдаются более высокие значения β-АРМэ, коррелирующие с другими маркерами симпатической гиперактивации, тяжестью АГ, а также поражением органов-мишеней.
В связи с этим целью данной работы была оценка функционального состояния симпатической нервной системы по данным β-АРМэ у больных рфАГ и неконтролируемой РАГ во взаимосвязи с уровнем катехоламинов, показателями АД и поражением органов мишеней.
Материал и методы
Исследование было выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации. Протокол исследования был одобрен Этическими комитетами всех участвующих клинических центров. До включения в исследование у всех участников было получено письменное информированное согласие.
Сбор данных проводился в отделении артериальных гипертоний НИИ кардиологии Томского НИМЦ с 2011 по 2021гг.
В одномоментное сравнительное исследование были включены 26 пациентов с рфАГ и 52 пациента с РАГ, проходивших лечение в отделении артериальных гипертоний НИИ кардиологии Томского НИМЦ с 2011 по 2021гг. Критерием рфАГ считали документированное в течение 6-мес. периода наблюдения отсутствие контроля АД на фоне приема ≥5 классов антигипертензивных препаратов, включая тиазидный диуретик длительного действия и антагонист минералокортикоидных рецепторов в максимальных или максимально переносимых дозах. К РАГ относили отсутствие контроля АД на фоне приема 3-4 классов антигипертензивных препаратов, включая диуретик. В исследовании принимали участие лица обоего пола в возрасте от 40 до 80 лет после подписания информированного согласия. Из исследования исключали лиц с псевдорезистентностью, симптоматическими формами АГ, сахарного диабета 1 типа, уровнем гликированного гемоглобина >10%, расчетной скоростью клубочковой фильтрации <30 мл/мин/1,73 м², беременностью, перенесенными менее года назад острыми сосудистыми осложнениями, нестабильной стенокардией, хронической СН выше II функционального класса по классификации Нью-Йоркской ассоциации сердца (NYHA), с тяжелыми сопутствующими заболеваниями, требующими активного специфического лечения и препятствующими участию в исследовании или завершению участия в исследовании.
Всем пациентам проводили общеклинические исследования согласно стандартам обследования больных АГ, измерение офисного и среднесуточного АД. β-АРМэ определяли с помощью набора БЕТА-АРМ АГАТ фирмы "Агат-Мед" (Российская Федерация, г. Балашиха) в соответствии с инструкцией производителя. Значения β-АРМэ выражали в условных единицах (усл. ед.). Диапазоном нормальных значений считали значения от 2 до 20 усл. ед. [6].
Определение β-АРМэ было основано на оценке степени ингибирования гипоосмотического гемолиза эритроцитов в присутствии β-адреноблокатора. Метод основан на торможении гемолиза эритроцитов, помещенных в гипоосмотическую среду. Торможение гемолиза обеспечивается добавлением к опытной пробе (цельная кровь + антикоагулянт + физиологический раствор) β-адреноблокатора 1-(1-изопропиламино)-3-(1-нафталенил-окси)-2-пропанола гидрохлорида, препятствующего разрушению мембран эритроцитов в гипоосмотическом буфере. Увеличение значения β-АРМэ отражает уменьшение количества функционально активных β-адренорецепторов на мембранах эритроцитов на фоне длительной симпатической гиперактивации.
Дополнительно для оценки симпатической активности мы измеряли уровень катехоламинов (метанефринов и норметанефринов) в суточной моче методом иммуноферментного анализа (наборы IBL International, ИФА).
Офисное АД (систолическое/диастолическое) измеряли по стандартной методике, суточное мониторирование АД выполняли с помощью систем автоматического измерения артериального давления АВРМ-04 (Meditech, Венгрия) и BPLab (ООО "Петр Телегин", Россия). Всем больным проводили комплексное обследование согласно стандартам медицинской практики, включая эхокардиографию с измерением массы миокарда левого желудочка (ЛЖ) (ММЛЖ) по общепринятой методике (формула B. L. Troy и соавторов в модификации R. B. Devereux). Сбор сведений о количестве принимаемых препаратов и приверженности к лечению проводился по данным опроса.
Статистическую обработку полученных данных проводили в программе Statistica 10.0. Согласие с нормальным законом распределения признаков проверяли с помощью критериев Колмогорова-Смирнова и Шапиро-Уилка. При нормальном распределении непрерывные переменные представляли в виде средней величины и стандартного отклонения — M±SD, в отсутствие нормального распределения — в виде медианы и межквартильного интервала — Me [ 25-й процентиль; 75-й процентиль]. При сравнительном анализе двух несвязанных групп в случае нормального распределения использовали t-критерий Стьюдента, при распределении, отличном от нормального — критерии Манна-Уитни. Качественные значения выражали в абсолютных и относительных величинах — n (%). При анализе качественных данных применяли точный критерий Фишера. Оценку корреляций осуществляли с использованием параметрического коэффициента корреляции Пирсона. Для расчета чувствительности, специфичности, нахождения диагностической точки разделения проводили ROC-анализ. Критическим уровнем значимости p для всех используемых процедур статистического анализа считали 0,05.
Результаты
В таблице 1 представлена клиническая характеристика больных рфАГ и неконтролируемой РАГ, из которой следует, что различий по половозрастному составу, индексу массы тела, частоте сахарного диабета 2 типа, продолжительности АГ между двумя группами больных выявлено не было. Частота поражения органов-мишеней в виде периферического атеросклероза, изолированной систолической АГ, предшествующих инсультов и ИМ, почечной дисфункции также не имела значимых отличий, за исключением более высокой частоты гипертрофии ЛЖ (ГЛЖ).
Таблица 1
Клиническая характеристика пациентов (M±SD, Me [ 25%;75%])
|
Показатели |
РАГ (n=52) |
рфАГ (n=26) |
р |
|
Возраст, годы |
57,8±9,1 |
56,8±9,9 |
0,691 |
|
Пол, женщины |
30 (57,7) |
15 (57,7) |
0,594 |
|
Индекс массы тела, кг/м² |
34,1±5,3 |
35±4,9 |
0,443 |
|
Ишемическая болезнь сердца |
26 (50,0) |
12 (46,2) |
0,468 |
|
Сахарный диабет |
25 (48,1) |
14 (53,9) |
0,405 |
|
Инфаркт миокарда в анамнезе |
8 (15,4) |
3 (11,5) |
0,465 |
|
Инсульт в анамнезе |
4 (7,7) |
5 (19,2) |
0,131 |
|
Продолжительность АГ, годы |
20 [ 12,0; 33,0] |
19,5 [ 13,0; 27,0] |
0,429 |
|
Периферический атеросклероз |
43 (82,7) |
23 (88,5) |
0,380 |
|
Абдоминальное ожирение |
43 (82,7) |
22 (84,6) |
0,552 |
|
Изолированная систолическая АГ |
15 (28,9) |
9 (34,6) |
0,393 |
|
Гипертрофия левого желудочка |
40 (76,9%) |
25 (96,2%) |
0,027 |
|
ХБП (рСКФ <60), % |
9 (19,6) |
4 (18,2) |
0,586 |
|
Офисное CАД, мм рт.ст. |
165,2±21,6 |
170,1±20,1 |
0,335 |
|
Офисное ДАД, мм рт.ст. |
91,9±18,0 |
93,1±17,6 |
0,793 |
|
Офисная ЧСС, уд./мин |
70,7±10,7 |
69,3±10,5 |
0,604 |
|
CАД-24, мм рт.ст. |
159,1±20,2 |
161,4±16,0 |
0,617 |
|
ДАД-24, мм рт.ст. |
88,5±18,4 |
87,3±15,4 |
0,764 |
|
ЧСС, уд./мин |
68,4±10,2 |
64,2±11,9 |
0,112 |
|
Пульсовое АД-24, мм рт.ст. |
70,5±14,6 |
74,1±15,5 |
0,325 |
|
рСКФ (CKD-EPI), мл/мин/1,73 м² |
73,9±20,5 |
74,2±17,6 |
0,948 |
|
Экскреция метанефринов, мг/сут. |
108,8 [ 53; 139] |
109,1 [ 74; 111] |
0,835 |
|
Экскреция норметанефринов, мг/сут. |
243,5 [ 100; 348] |
223,3 [ 121; 287] |
0,871 |
Примечание: цветом выделены статистически значимые изменения.
Сокращения: АГ — артериальная гипертензия, АД — артериальное давление, ДАД — диастолическое артериальное давление, РАГ — резистентная артериальная гипертензия, рСКФ — расчётная скорость клубочковой фильтрации, рфАГ — рефрактерная артериальная гипертензия, САД — систолическое артериальное давление, ЧСС — частота сердечных сокращений, ХБП — хроническая болезнь почек, 24 — среднесуточный показатель.
Межгрупповые различия показателей АД, частоты сердечных сокращений (как офисных, так и среднесуточных) не достигали статистической значимости.
Частота рфАГ среди обследованных нами больных с РАГ составила 24,3%. Закономерно, что пациенты с рфАГ принимали больше антигипертензивных препаратов, что было обусловлено не только более частым применением спиронолактона, но также β-адреноблокаторов и антагонистов кальция (табл. 2). Состав сахароснижающей терапии в обеих группах был сопоставимым, статины принимали все пациенты.
Таблица 2
Характеристика антигипертензивной терапии
|
Число АГП |
4 [ 3,0; 4,0] |
5 [ 5,0; 6,0] |
0,001 |
|
Бета-адреноблокаторы |
39 (75,0) |
25 (96,2) |
0,011 |
|
Блокаторы РААС |
49 (94,2) |
25 (96,2) |
0,593 |
|
Диуретики |
50 (96,2) |
26 (100,0) |
0,442 |
|
Антагонисты кальция |
34 (65,4) |
25 (96,2) |
0,002 |
|
Спиронолактон |
45 (86,5) |
26 (100,0) |
0,001 |
|
Дополнительные классы: |
16 (30,8) |
12 (46,2) |
0,139 |
|
Агонисты имидазолиновых рецепторов |
7 (26,9) |
10 (19,2) |
0,309 |
|
Альфа-адреноблокаторы |
7 (13,5) |
7 (26,9) |
0,127 |
Примечание: цветом выделены статистически значимые изменения.
Сокращения: АГП — антигипертензивные препараты, РААС — ренин-ангиотензин-альдостероновая система.
По результатам сравнения уровень β-АРМэ у больных рфАГ значимо превышал данный показатель по сравнению с группой РАГ (рис. 1), несмотря на сопоставимый уровень катехоламинов суточной мочи (табл. 1).
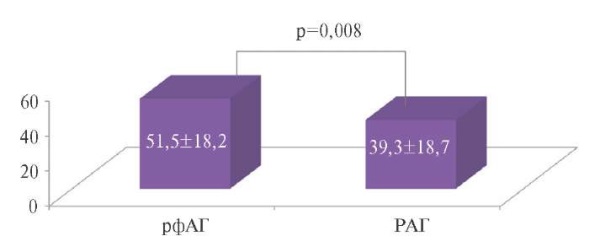
Рис. 1. Сравнение уровня β-АРМэ у больных рфАГ и неконтролируемой РАГ.
Сокращения: РАГ — резистентная артериальная гипертензия,
рфАГ — рефрактерная артериальная гипертензия.
Примечательно, что в обеих группа β-АРМэ значимо превышало порог нормальных значений, равный 20 усл. ед. (84,6% в группе РАГ, 92,3% в группе рфАГ).
Для выявления порогового значения β-АРМэ, соответствующего рфАГ, был выполнен ROC-анализ (рис. 2). Площадь под ROC-кривой составила 0,687 (95% доверительный интервал: 0,561-0,813) (p=0,004). Пороговое значение уровня β-АРМэ, соответствующее наличию рфАГ, составило ≥44,8 усл. ед., с чувствительностью 69,2%, специфичностью 64,5%.
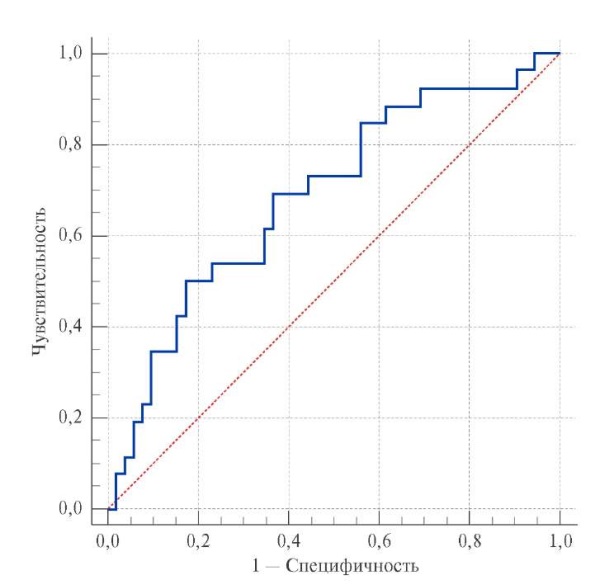
Рис. 2. ROC-кривая, характеризующая зависимость наличия рфАГ
от значений концентрации β-АРМэ.
Основываясь на полученных результатах, мы сравнили частоту повышения β-АРМэ >50 усл. ед., которая в группе рфАГ вполне закономерно оказалась значимо выше (p=0,019), чем у лиц с РАГ (рис. 3).
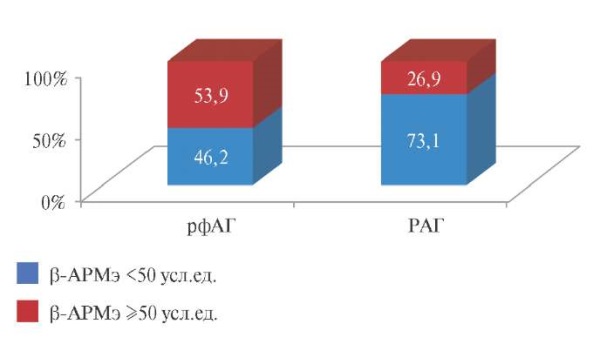
Рис. 3. Частота повышения β-АРМэ у больных рфАГ и РАГ.
Сокращения: РАГ — резистентная артериальная гипертензия,
рфАГ — рефрактерная артериальная гипертензия,
β-АРМэ — бета-адренореактивность мембран эритроцитов.
По данным корреляционного анализа уровень β-АРМэ в группе рфАГ не имел прямой количественной связи с концентрацией катехоламинов в суточной моче, индексом ММЛЖ и показателями АД, за исключением уровня среднесуточного пульсового АД (рис. 4).
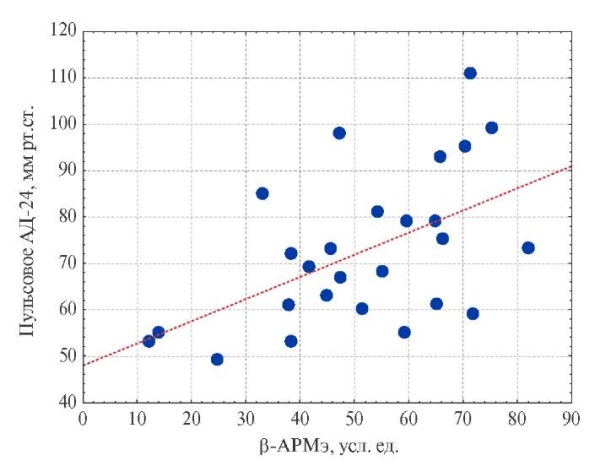
Рис. 4. Связь пульсового АД и β-АРМэ у больных рфАГ.
Сокращения: АД — артериальное давление,
β-АРМэ — бета-адренореактивность мембран эритроцитов.
Обсуждение
В данной работе для оценки симпатической активности у больных рфАГ впервые использовалось определение β-АРМэ. Важным результатом проведённого исследования стало выявление более высоких показателей β-АРМэ у больных рфАГ по сравнению с пациентами с РАГ. Аналогичных работ для больных неконтролируемой АГ мы не обнаружили. Установленный нами порог β-АРМэ, соответствующий наличию рфАГ, составил 44,8 усл. ед. Ранее в работе Гарганеевой А. А. и др. [10] было обнаружено, что значения β-АРМэ ≥49,53 усл. ед. у пациентов, перенесших ИМ, ассоциируются с более чем пятикратным увеличением риска прогрессирования СН, что усиливает клиническую значимость полученных нами данных.
Суточная экскреция катехоламинов в моче, в отличие от уровня β-АРМэ, в сравниваемых группах была сопоставимой. При этом следует отметить, что сведения о различиях уровня катехоламинов у больных рфАГ и РАГ весьма противоречивы [5][13], что может быть обусловлено ограничениями данного метода в оценке симпатической активности, а также особенностями выборок пациентов. Прямых корреляционных связей β-АРМэ с уровнем суточной экскреции катехоламинов мы также не обнаружили.
При анализе клинического статуса обращает на себя внимание более высокая частота ГЛЖ у больных рфАГ в сравнении с РАГ, несмотря на сопоставимый уровень АД, что согласуется с ранее выполненными исследованиями [2][3][5] и может свидетельствовать о самостоятельной роли симпатической гиперактивации в увеличении ММЛЖ.
Примечательно, что в нашей работе повышение уровня β-АРМэ ассоциировалось с возрастанием пульсового АД. Как известно, пульсовое АД является одним из методов оценки артериальной жесткости, в повышении которой существенное значение принадлежит изменению биомеханических свойств сосудистой стенки в результате вызванных симпатической гиперактивацией процессов фиброза и ремоделирования [14]. В недавнем обсервационном многоцентровом исследовании (8066 пациентов) было показано, что высокое пульсовое давление опосредует увеличение ММЛЖ [15], что обусловлено увеличением пульсатильной нагрузки на ЛЖ. Таким образом, документированная нами связь пульсового АД с β-АРМэ во многом может объяснять более высокую частоту ГЛЖ в группе рфАГ в отсутствии прямой связи ММЛЖ с уровнем β-АРМэ.
Ограничение исследования. Настоящее исследование было ограничено небольшим количеством больных и отсутствием анализа связей β-АРМэ с приёмом различных антигипертензивных препаратов.
Заключение
Наличие рфАГ ассоциируется с более высокими значениями β-АРМэ, чем у больных РАГ, что может косвенно подтверждать более выраженную симпатическую активность и объяснять более высокую частоту ГЛЖ, реализуемую через повышение сосудистой жёсткости и пульсатильной нагрузки на ЛЖ. Полученные нами данные подтверждают фундаментальную роль симпатической гиперактивации в патобиологии этого фенотипа АГ и её органных осложнений.
Практическая значимость полученных результатов определяется возможностью оценки β-АРМэ для отбора больных на ренальную денервацию. Ренальная денервация позволяет существенно снизить чрезмерную симпатическую активность, однако выявление пациентов с таким профилем вегетативного дисбаланса как кандидатов на вмешательство остается нерешенной клинической задачей.
Перспективой дальнейших исследований может стать изучение влияния ренальной денервации на β-АРМэ у больных рфАГ и сравнительный анализ влияния на β-АРМэ разных групп антигипертензивных препаратов.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Mann SJ. Neurogenic hypertension: pathophysiology, diagnosis and management. Clin Auton Res. 2018;28(4):363-74. doi:10.1007/s10286-018-0541-z.
2. Matanes F, Khan MB, Siddiqui M, et al. An update on refractory hypertension. Curr Hypertens Rep. 2022;24(7):225-34. doi:10.1007/s11906-022-01185-6.
3. Bacan G, Ribeiro-Silva A, Oliveira VAS, et al. Refractory hypertension: a narrative systematic review with emphasis on prognosis. Curr Hypertens Rep. 2022;24(4):95-106. doi:10.1007/s11906-022-01165-w.
4. Денисова А. Р., Солнцева Т. Д., Зарманбетова А. С. и др. Частота развития сердечно-сосудистых осложненийу больных с неконтролируемым течением артериальной гипертонии. Терапевтический архив. 2022;94(1):94-9. doi:10.26442/00403660.2022.01.201395.
5. Dudenbostel T, Acelajado MC, Pisoni R, et al. Refractory Hypertension: Evidence of heightened sympathetic activity as a cause of antihypertensive treatment failure. Hypertension. 2015;66(1):126-33. doi:10.1161/HYPERTENSIONAHA.115.05449.
6. Стрюк Р. И., Длусская И. Г. Адренореактивность и сердечно-сосудистая система. М: Медицина, 2003. c. 160. ISBN: 5-225-04337-2.
7. Seravalle G, Grassi G. Sympathetic nervous system and hypertension: new evidences. Auton Neurosci. 2022;238:102954. doi:10.1016/j.autneu.2022.102954.
8. Сравнительный анализ адренореактивности эритроцитов у пациентов с инфарктом миокарда в зависимости от выраженности коронарной обструкции. Российский кардиологический журнал. 2020;25(5):3735. doi:10.15829/1560-4071-2020-3735.
9. Реброва Т. Ю., Муслимова Э. Ф., Александренко В. А. и др. Динамика адренореактивности после перенесенного инфаркта миокарда: годичное наблюдение. Терапевтический архив. 2021;93(1):44-8. doi:10.26442/00403660.2021.01.200592.
10. Гарганеева А. А., Александренко В. А., Кужелева Е. А. и др. Бета-адренореактивность эритроцитов и прогрессирование хронической сердечной недостаточности у пациентов, перенесших инфаркт миокарда. Российский кардиологический журнал. 2020;25(1):3407. doi:10.15829/1560-4071-2020-1-3407.
11. Александренко В. А., Реброва Т. Ю., Афанасьев С. А. и др. Взаимосвязь адрено-реактивности со стадией хронической сердечной недостаточности у пациентов, перенесших инфаркт миокарда. Сибирский медицинский журнал. 2019;34(2):79-83. doi:10.29001/20738552-2019-34-2-79-83.
12. Зюбанова И. В., Фальковская А. Ю., Мордовин В. Ф. и др. Особенности изменения бета-адренореактивности мембран эритроцитов у больных резистентной артериальной гипертензией после ренальной денервации, взаимосвязь с антигипертензивной и кардиопротективной эффективностью вмешательства. Кардиология. 2021;61(8):32-9. doi:10.18087/cardio.2021.8.n1556.
13. Фальковская А. Ю., Мордовин В. Ф., Пекарский С. Е. и др. Рефрактерная и резистентная артериальные гипертонии у больных сахарным диабетом 2-го типа: различия метаболического статуса и состояния эндотелиальной функции. Терапевтический архив. 2021;93(1):49-58. doi:10.26442/00403660.2021.01.200593.
14. Орехов А. Ю., Каражанова Л. К. Роль симпатической нервной системы при резистентной артериальной гипертензии: патофизиологические и клинические аспекты. Артериальная гипертензия. 2022;28(4):348-56. doi:10.18705/1607-419X-2022-28-4-348-356.
15. Moyá-Amengual A, Ruiz-García A, Pallarés-Carratalá V, et al. Elevated pulse pressure and cardiovascular risk associated in Spanish population attended in primary care:IBERICAN study. Front Cardiovasc Med. 2023;10:1090458. doi:10.3389/fcvm.2023.1090458.
Об авторах
М. А. МанукянРоссия
м.н.с, отделение артериальных гипертоний
А. Ю. Фальковская
Россия
д.м.н., зав. отделением артериальных гипертоний
В. Ф. Мордовин
Россия
д.м.н., профессор, в.н.с., отделение артериальных гипертоний
И. В. Зюбанова
Россия
к. м. н., н. с., отделение артериальных гипертоний
В. А. Личикаки
Россия
к. м. н., н. с., отделение артериальных гипертоний
Е. И. Солонская
Россия
к. м. н., м. н. с., отделение артериальных гипертоний
А. А. Вторушина
Россия
аспирант, лаборант-исследователь, отделение артериальных гипертоний
С. А. Хунхинова
Россия
аспирант, лаборант-исследователь, отделение артериальных гипертоний
И. А. Скомкина
Россия
лаборант-исследователь, отделение артериальных гипертоний
В. В. Руденко
Россия
студентка 5 курса
Т. Ю. Реброва
Россия
к. м. н., н. с. лаборатории молекулярно-клеточной патологии и генодиагностики
Э. Ф. Муслимова
Россия
к. м. н., н. с. лаборатории молекулярно-клеточной патологии и генодиагностики
С. А. Афанасьев
Россия
д. м. н., профессор, зав. лабораторией молекулярно-клеточной патологии и генодиагностики
Дополнительные файлы
- Рассмотрена роль симпатической нервной системы в повышении уровня β-адренореактивности мембран эритроцитов (β-АРМэ) у больных различными фенотипами неконтролируемой артериальной гипертензии.
- Показано, что у больных рефрактерной артериальной гипертензией (рфАГ) определяются более высокие показатели β-АРМэ по сравнению с пациентами с резистентной артериальной гипертензией (РАГ).
- Повышение уровня β-АРМэ ассоциируется с возрастанием пульсового артериального давления у больных рфАГ, что может объяснять более высокую частоту гипертрофии левого желудочка по сравнению с пациентами с РАГ.
Рецензия
Для цитирования:
Манукян М.А., Фальковская А.Ю., Мордовин В.Ф., Зюбанова И.В., Личикаки В.А., Солонская Е.И., Вторушина А.А., Хунхинова С.А., Скомкина И.А., Руденко В.В., Реброва Т.Ю., Муслимова Э.Ф., Афанасьев С.А. Состояние бета-адренореактивности мембран эритроцитов при различных фенотипах неконтролируемой артериальной гипертензии. Российский кардиологический журнал. 2024;29(5):5668. https://doi.org/10.15829/1560-4071-2024-5668. EDN: KCXNTU
For citation:
Manukyan M.A., Falkovskaya A.Yu., Mordovin V.F., Zyubanova I.V., Lichikaki V.A., Solonskaya E.I., Vtorushina A.A., Khunkhinova S.A., Skomkina I.A., Rudenko V.V., Rebrova T.Yu., Muslimova E.F., Afanasyev S.A. Beta-adrenergic reactivity of erythrocyte membranes in various phenotypes of uncontrolled hypertension. Russian Journal of Cardiology. 2024;29(5):5668. (In Russ.) https://doi.org/10.15829/1560-4071-2024-5668. EDN: KCXNTU

















































