Перейти к:
Значение микрососудистой обструкции по данным контрастной магнитно-резонансной томографии сердца в оценке прогноза больных с острым инфарктом миокарда с подъемом сегмента ST
https://doi.org/10.15829/1560-4071-2024-5603
EDN: ERFWCJ
Аннотация
Цель. Изучение взаимосвязи наличия и размеров очагов микрососудистой обструкции (МСО) с прогнозом больных с острым инфарктом миокарда (ИМ) с подъемом сегмента ST (ОИМпST), подвергнутых первичному чрескожному коронарному вмешательству (пЧКВ), в течение одного года.
Материал и методы. В исследование были включены 50 больных с первым ОИМпST, которым было выполнено пЧКВ на инфаркт-связанной артерии. На 3-7-е сут. и через 12 мес. выполнялась магнитно-резонансная томография сердца с контрастированием с оценкой фракции выброса (ФВ) левого желудочка (ЛЖ), конечно-диастолического объема (КДО) ЛЖ, очагов МСО. Через 12 мес. проводилась повторная госпитализация и оценка прогноза на основании данных о развитии сердечно-сосудистых осложнений.
Результаты. Пациенты с МСО имели статистически значимо меньшую ФВ ЛЖ в остром периоде ИМ (44,1±10,6%) по сравнению с пациентами без МСО (52,9±10,5%), p=0,0209, а также при повторном исследовании через год (44,8±11,1%) по сравнению с пациентами без МСО (58,9±8,0%), p=0,0004. Была выявлена статистически значимая обратная корреляция между ФВ ЛЖ при первичном и повторном исследовании и размером МСО при первичном исследовании: ρ=-0,42 (95% доверительный интервал (ДИ): -0,66 — -0,12, p=0,008) и ρ=-0,61 (95% ДИ: -0,78 — -0,34, p=0,0001). Также была выявлена статистически значимая обратная корреляция между ФВ ЛЖ и размером МСО при повторном исследовании, ρ=-0,40 (95% ДИ: -0,65 — -0,07, p=0,0205). Была выявлена статистически значимая прямая корреляция между размером МСО в остром периоде инфаркта и КДО ЛЖ при обследовании через год, ρ=0,35 (95% ДИ: 0,02-0,62, р=0,0409). Развитие аневризмы ЛЖ было зарегистрировано у 40% пациентов с наличием МСО при первичном исследовании и не зарегистрировано среди пациентов без МСО (р=0,0039).
Заключение. Наличие очагов МСО было связано с формированием постинфарктной аневризмы ЛЖ. Увеличение размеров очагов МСО коррелировало с уменьшением ФВ ЛЖ, увеличением КДО ЛЖ как в остром периоде, так и через год после ИМ.
Ключевые слова
Для цитирования:
Тереничева М.А., Шахнович Р.М., Стукалова О.В., Певзнер Д.В., Явелов И.С., Шалагинова Ю.О., Терновой С.К. Значение микрососудистой обструкции по данным контрастной магнитно-резонансной томографии сердца в оценке прогноза больных с острым инфарктом миокарда с подъемом сегмента ST. Российский кардиологический журнал. 2024;29(3):5603. https://doi.org/10.15829/1560-4071-2024-5603. EDN: ERFWCJ
For citation:
Terenicheva M.A., Shakhnovich R.M., Stukalova O.V., Pevzner D.V., Yavelov I.S., Shalaginova Yu.O., Ternovoy S.K. The value of microvascular obstruction according to contrast-enhanced cardiac magnetic resonance imaging in assessing the prognosis of patients with acute ST-segment elevation myocardial infarction. Russian Journal of Cardiology. 2024;29(3):5603. (In Russ.) https://doi.org/10.15829/1560-4071-2024-5603. EDN: ERFWCJ
Несмотря на значительные успехи последних десятилетий в лечении инфаркта миокарда (ИМ) и заметное улучшение прогноза данной категории пациентов, смертность в результате ИМ остается высокой и сохраняется на уровне 7,3% в течение первого года, а частота развития хронической сердечной недостаточности (ХСН) после перенесенного инфаркта составляет от 14 до 36% [1]. Развитие ХСН по-прежнему часто приводит к инвалидизации и смертности пациентов с ИМ, снижает качество жизни.
В настоящее время метод магнитно-резонансной томографии (МРТ) сердца с контрастированием позволяет выявить ряд структурных характеристик ИМ, оценивающих прогноз больных с острым ИМ с подъемом сегмента ST (ОИМпST) [2]. Одним из основных параметров, определяющих прогноз больных с ОИМпST, является микрососудистая обструкция (МСО), которая отражает глубокое нарушение перфузии миокарда на уровне микрокапилляров в зоне ИМ, несмотря на успешную реваскуляризацию инфаркт-связанной артерии (ИСА) [3][4].
Ранее проводившиеся исследования показали, что наличие очагов МСО и их размер влияет на показатели смертности от всех причин и частоту госпитализаций по поводу ХСН даже в большей степени, чем размер инфаркта [5]. Тем не менее связь МСО и ее динамических изменений в течение 1 года с клиническим течением и прогнозом у больных с ИМ остаются предметом для дальнейших исследований.
Целью исследования являлось изучение взаимосвязи наличия и размеров очагов МСО и их динамических изменений в течение года с прогнозом больных с ОИМпST, подвергнутых первичному чрескожному коронарному вмешательству (пЧКВ).
Материал и методы
В исследование были включены 50 больных с первым ОИМпST, поступившие в течение 48 ч от начала заболевания. Диагноз ОИМпST устанавливался на основании критериев, приведенных в четвертом универсальном определении ИМ [6]. Критериями невключения в исследование являлись: ИМ в анамнезе, время >48 ч от начала симптомов ОИМпST, тяжелые сопутствующие заболевания, самостоятельно влияющие на прогноз, противопоказания к выполнению контрастной МРТ.
Всем больным в экстренном порядке проводилась коронароангиография и пЧКВ на ИСА. Все пациенты получали оптимальную медикаментозную терапию согласно рекомендациям по острому коронарному синдрому с подъемом сегмента ST [7].
На 3-7-е сут. и через 12 мес. выполнялась МРТ сердца с контрастированием на сверхпроводящем томографе с напряженностью магнитного поля 1,5 Тл (Siemens Avanto). Исследование состояло из двух частей. Бесконтрастная часть включала:
— кино-МРТ в стандартных проекциях (2- и 4-камерная длинные оси, короткая ось левого желудочка (ЛЖ)) с оценкой конечно-диастолического объема (КДО) ЛЖ, фракции выброса (ФВ) ЛЖ, оценкой нарушений локальной сократимости в 17 сегментах ЛЖ;
— Т2-взвешенные изображения в тех же проекциях для оценки отека миокарда (повышение интенсивности сигнала более чем в 2 раза по сравнению с неповрежденным миокардом).
Для проведения контрастной части использовался гадолиний-содержащий контрастный препарат (гадобутрол, компания Байер) в дозе 0,15 ммоль/кг массы тела больного. Контрастная часть включала:
— раннее контрастирование (через 2 мин после внутривенного введения контрастного препарата);
— отсроченное контрастирование (через 10-20 мин после внутривенного введения контрастного препарата).
Участки, накопившие контрастный препарат, расценивались как зоны острого или хронического повреждения миокарда (в зависимости от наличия отека по данным Т2-взвешенных изображений).
Зоны сниженной интенсивности сигнала, расположенные внутри области, накопившей контрастный препарат, расценивались как МСО (рис. 1).
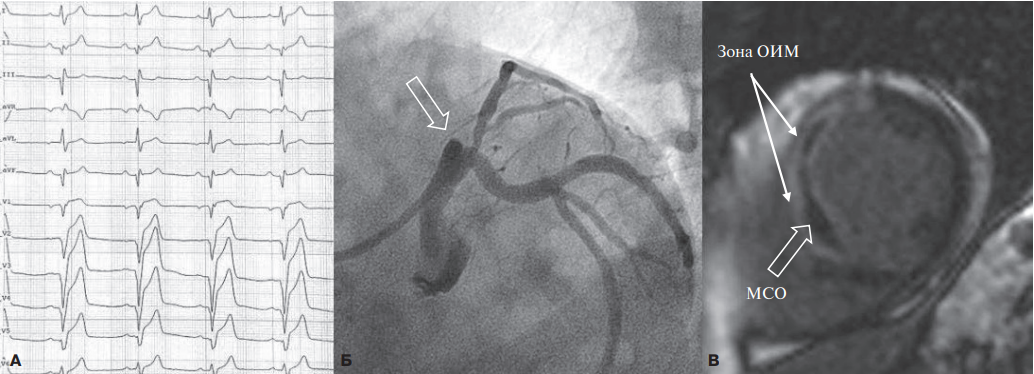
Рис. 1. МСО у больного с ОИМпST передней локализации.
Примечание: А — ЭКГ (отведения V1-V3) больного с ОИМпST. Б — исходная ангиограмма пациента. Стрелкой указана тромботическая окклюзия ПНА. В — MРТ, короткая ось ЛЖ, отсроченное контрастирование. Стрелками указаны зоны инфаркта и МСО.
Сокращения: ЛЖ — левый желудочек, МРТ — магнитно-резонансная томография, МСО — микрососудистая обструкция, ОИМпST — острый инфаркт миокарда с подъемом сегмента ST, ПНА — передняя нисходящая артерия, ЭКГ — электрокардиограмма.
Для проведения тканевого анализа изображений использовалась программа CVI-42 (circle cardiovascular imaging). Оценивались размер ИМ, МСО, ФВ ЛЖ. На основе анализа интенсивности сигнала в зоне повреждения доля некроза определялась как зона с интенсивностью сигнала >5 стандартных отклонений в сравнении с неповрежденным миокардом.
Все пациенты находились на стандартной двойной антиагрегантной терапии (ацетилсалициловая кислота в дозе 75-150 мг в сут. и клопидогрел в дозе 75 мг в сут. либо тикагрелор 90 мг 2 раза/сут.). После проведения реваскуляризации каждому пациенту был рекомендован постоянный прием аспирина в дозе 75-100 мг, клопидогрел 75 мг в сут. либо тикагрелор 90 мг 2 раза/сут. в течение 12 мес. Также стандартная терапия включала ингибиторы ангиотензинпревращающего фермента, бета-адреноблокаторы, статины, при наличии признаков сердечной недостаточности к терапии добавлялись петлевые и калий сберегающие диуретики.
Неблагоприятные события регистрировали во время госпитализации, а также в течение 1 года после госпитализации. С пациентами и их родственниками осуществлялся телефонный контакт. В случае неблагоприятных сердечно-сосудистых событий (смерть по кардиальным причинам, нефатальный ИМ, госпитализация по поводу обострения ишемической болезни сердца, незапланированная реваскуляризация, ишемический инсульт) собиралась информация о госпитализациях, выполненных коронароангиографиях и патологоанатомической экспертизе. Через 12 мес. проводилась повторная госпитализация и оценка прогноза на основании данных о развитии сердечно-сосудистых осложнений.
Согласно актуальным клиническим рекомендациям наличие ХСН у больного, перенесшего ИМ, определялось наличием клинических симптомов (одышка, повышенная утомляемость, отечность голеней и стоп) и признаков (повышение давления в яремных венах, хрипы в легких, наличие венозного застоя в легких по данным рентгенографии в сочетании с повышением уровня мозгового натрийуретического пептида >35 пг/мл [8].
Комбинированная конечная точка исследования:
- Общая смертность;
- Нефатальный ИМ;
- Развитие ХСН;
- Госпитализация по поводу обострения ишемической болезни сердца и декомпенсации ХСН;
- Незапланированная реваскуляризация;
- Ишемический инсульт.
Статистический анализ. Статистический анализ и визуализация полученных данных проводилась с использованием среды для статистических вычислений R 4.1.0 (R Foundation for Statistical Computing, Австрия).
Описательные статистики для количественных переменных представлены в виде среднего (стандартное отклонение) и медианы (1-3 квартили), для качественных — в виде относительных частот.
Для изучения связи категориальных переменных использовался точный тест Фишера, ассоциацию считали статистически значимой при p<0,05. Для оценки размера эффекта качественных и количественных предикторов в отношении бинарных исходов использовалось отношение шансов (ОШ) с соответствующим 95% доверительным интервалом (ДИ). Диагностические характеристики предикторов оценивались с использованием чувствительности и специфичности (с соответствующими точными 95% ДИ).
Для сравнения количественных переменных между группами пациентов использовался тест Манна-Уитни, для сравнения связанных выборок — тест Уилкоксона, различия считали статистически значимыми при p<0,05.
Для оценки взаимосвязи между количественными переменными использовался коэффициент ранговой корреляции (ρ) Спирмена с соответствующим 95% ДИ.
Проведенное исследование соответствует положениям Хельсинкской декларации Всемирной медицинской ассоциации и было одобрено локальным этическим комитетом ФГБУ "НМИЦК им. акад. Е. И. Чазова" Минздрава России. Всеми исследуемыми пациентами было самостоятельно подписано добровольное информированное согласие на участие в исследовании.
Результаты
Мужчины составили 76%, средний возраст 57,2±8,9 лет. У всех больных реперфузионная терапия осуществлялась посредством пЧКВ. Полная характеристика группы представлена в таблице 1. Из 50 включенных в исследование пациентов вторую точку исследования прошли 39 человек.
В течение периода наблюдения у 20 (53,8%) больных отмечался комбинированный исход (рис. 2). У 15 из 39 человек (38,5%) отмечалось развитие начальных признаков ХСН. 8 больным (20,5%) потребовалось проведение внеплановой реваскуляризации. У 2 (5,1%) отмечалось развитие острого нарушения мозгового кровообращения, у 3 (7,7%) — повторного ИМ. У 4 пациентов (10,3%) отмечалось развитие летального исхода.
У 51,3% пациентов была выявлена МСО в остром периоде ИМ. Средние ее значения составляли 0,1% от массы миокарда ЛЖ. При повторном исследовании МСО сохранялась у 17,6% пациентов. Статистически значимой взаимосвязи между наличием и размерами МСО при первичном и повторном исследовании и частотой достижения комбинированной конечной точки выявлено не было.
У пациентов с наличием МСО в остром периоде ИМ наблюдалась более высокая частота развития летального исхода (14,3%) по сравнению с пациентами без МСО (5,6%), однако данная ассоциация не была статистически значимой (ОШ 2,83 (95% ДИ: 0,33-60,42), p=0,6094).
В ходе анализа зависимости риска развития ХСН от наличия МСО была выявлена тенденция (p=0,0978) к более высокой частоте ХСН через 1 год после первичного исследования среди пациентов с МСО (52,4%), по сравнению с пациентами, у которых МСО выявлена не была (22,2%). ОШ развития ХСН при МСО составило 3,85 (95% ДИ: 1,00-17,31). Чувствительность наличия МСО в отношении данного исхода составила 73,3%, специфичность — 58,3%.
Несмотря на отсутствие достоверных взаимосвязей с развитием ХСН, пациенты с МСО имели статистически значимо меньшую ФВ ЛЖ в остром периоде ИМ (44,1±10,6%) по сравнению с пациентами без МСО (52,9±10,5%), p=0,0209 (рис. 3 А). Также пациенты с МСО имели статистически значимо меньшую ФВ ЛЖ при повторном исследовании через год (44,8±11,1%) по сравнению с пациентами без МСО (58,9±8,0%), p=0,0004.
Была выявлена статистически значимая обратная корреляция между ФВ ЛЖ при первичном (рис. 3 А) и повторном (рис. 3 Б) исследовании и размером МСО при первичном исследовании: ρ=-0,42 (95% ДИ: -0,66 — -0,12, p=0,008) и ρ=-0,61 (95% ДИ: -0,78 — -0,34, p=0,0001). Также была выявлена статистически значимая обратная корреляция между ФВ ЛЖ при повторном исследовании и размером МСО при повторном исследовании (рис. 4): ρ=-0,40 (95% ДИ: -0,65 — -0,07, p=0,0205).
Была выявлена статистически значимая прямая корреляция между размером МСО в остром периоде инфаркта и КДО ЛЖ при обследовании через год (рис. 5), ρ=0,35 (95% ДИ: 0,02-0,62, р=0,0409).
У 20% пациентов отмечалось развитие аневризмы ЛЖ. Все они имели верхушечную локализацию вследствие окклюзии передней нисходящей артерии (ПНА). Развитие аневризмы ЛЖ было зарегистрировано у 40% пациентов с наличием МСО при первичном исследовании и не зарегистрировано среди пациентов без МСО (р=0,0039).
Таблица 1
Характеристика когорты пациентов
|
Характеристики пациентов |
n |
|
|
Мужской пол |
38/50 (76%) |
|
|
Средний возраст Медианный возраст |
57,2 (8,9) 58,0 (52,5-64,0) |
|
|
Активные курильщики |
32/50 (64%) |
|
|
Гипертоническая болезнь |
29/50 (58%) |
|
|
Ожирение (индекс массы тела >30 кг/м2) |
20/50 (40%) |
|
|
Отягощенный семейный анамнез (ИБС у родственников 1-й линии: мужчины до 55 лет, женщины до 60 лет) |
3/50 (6%) |
|
|
Сахарный диабет 2 типа |
9/50 (18%) |
|
|
Отсутствие анамнеза ИБС |
33/50 (66%) |
|
|
Сердечная недостаточность в анамнезе |
0 |
|
|
Класс Killip при поступлении >II |
2/50 (4%) |
|
|
пЧКВ <3 ч от начала болевого синдрома |
24/50 (48%) |
|
|
ИСА |
ПНА |
21/50 (30%) |
|
ПКА |
17/50 (34%) |
|
|
ОА |
13/50 (26%) |
|
|
Состояние ИСА |
полная окклюзия |
27/50 (54%) |
|
проходимая ИСА |
23/50 (46%) |
|
Сокращения: ИБС — ишемическая болезнь сердца, ИМТ — индекс массы тела, ИСА — инфаркт-связанная артерия, ОА — огибающая артерия, ПКА — правая коронарная артерия, ПНА — передняя нисходящая артерия, пЧКВ — первичное чрескожное коронарное вмешательство.
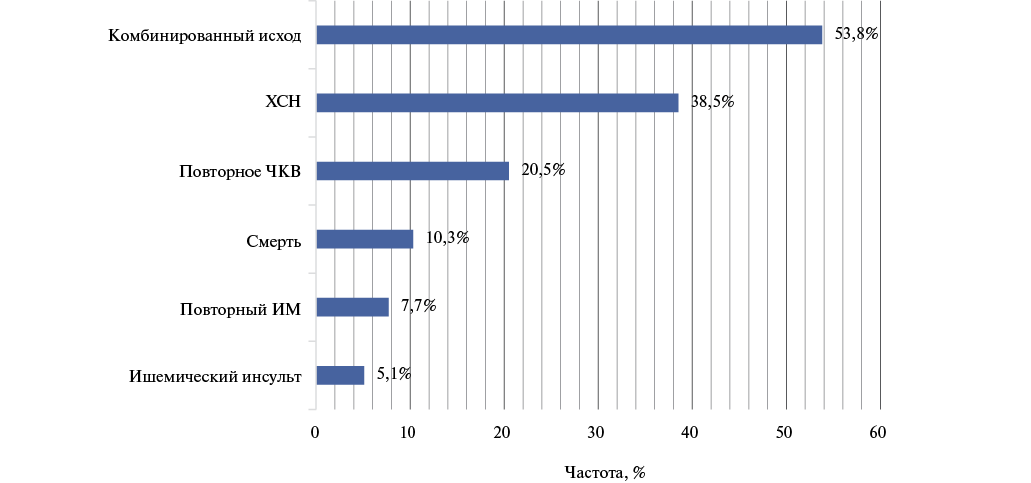
Рис. 2. Частота исходов через 1 год после госпитализации.
Сокращения: ИМ — инфаркт миокарда, ХСН — хроническая сердечная недостаточность, ЧКВ — чрескожное коронарное вмешательство.
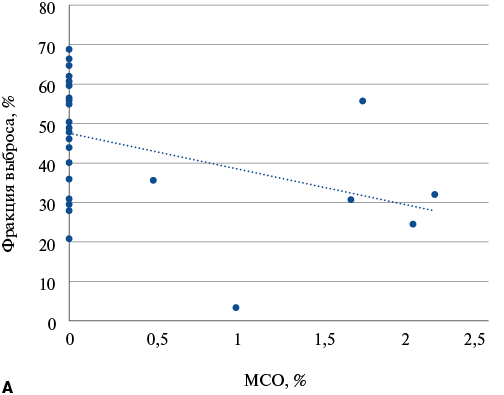
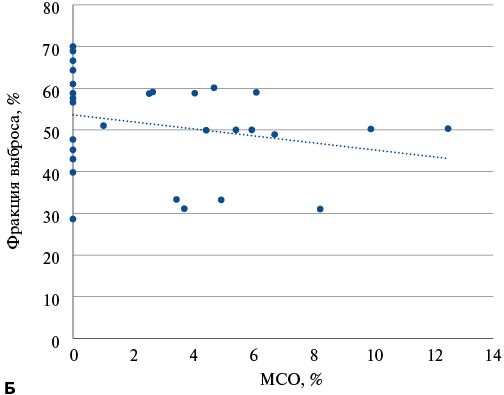
Рис. 3. Корреляционный анализ взаимосвязи ФВ и размера МСО.
Примечание: А — взаимосвязь ФВ и размера МСО в остром периоде ИМ. Б — взаимосвязь ФВ при исследовании через 1 год и размера МСО в остром периоде ИМ.
Сокращения: ИМ — инфаркт миокарда, МСО — микрососудистая обструкция, ФВ — фракция выброса.
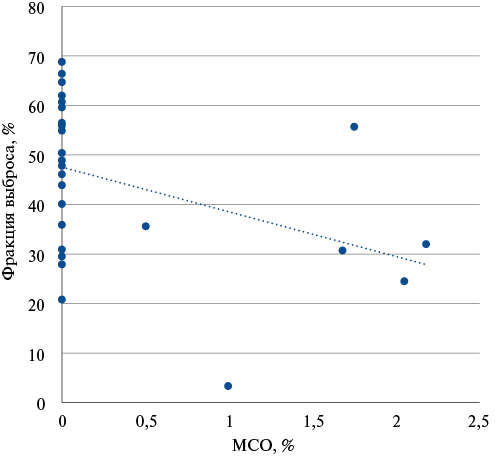
Рис. 4. Корреляционный анализ взаимосвязи ФВ и размера МСО при исследовании через 1 год.
Сокращение: МСО — микрососудистая обструкция.
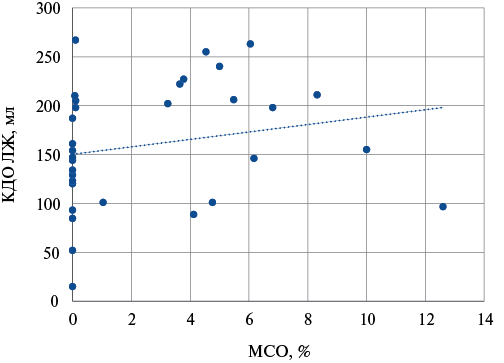
Рис. 5. Взаимосвязь КДО ЛЖ при повторном исследовании и МСО при первичном исследовании.
Сокращения: КДО — конечно-диастолический объем, ЛЖ — левый желудочек, МСО — микрососудистая обструкция.
Обсуждение
МСО является результатом нарушения коронарной микроциркуляции в бассейне ИСА, несмотря на восстановление в ней кровотока. По данным исследований с использованием МРТ сердца с контрастированием, частота развития этого феномена составляет 50-65% среди больных с ОИМпST, которым проводилось пЧКВ [9]. Патофизиологическим механизмом МСО являются вазоконстрикция микроциркуляторного русла, а также дистальная эмболизация элементами атеросклеротической бляшки, частицами фибрина, тромбоцитов и эритроцитов [10]. На изображениях МРТ МСО определяется как темное (гипоинтенсивное) ядро внутри накопивших контрастный препарат участков с высокой интенсивностью сигнала, как в фазу раннего контрастирования с гадолинием (ранняя МСО), так и в фазу отсроченного контрастирования (поздняя МСО). В проводившихся исследованиях МСО показала себя как более значимый предиктор неблагоприятных исходов (смерть от всех причин, госпитализации по поводу декомпенсации ХСН) по сравнению с размером ИМ [4].
Согласно данным нашего исследования среди пациентов с МСО отмечалась тенденция к более частому развитию ХСН и увеличению частоты развития летальных исходов, однако эти ассоциации не были статистически достоверными. Однако, несмотря на отсутствие достоверных взаимосвязей с развитием ХСН, пациенты с МСО имели статистически значимо меньшую ФВ ЛЖ как в остром периоде ИМ, так и при исследовании через год по сравнению с пациентами без МСО. Более того, отмечалась достоверная обратная корреляционная взаимосвязь между размером МСО и ФВ ЛЖ: с увеличением очагов МСО отмечалось снижение ФВ ЛЖ. Эта взаимосвязь распространялась как на результаты первичного обследования, так и на результаты обследования пациентов через год.
Согласно данным ранее проводившихся исследований, МСО является независимым предиктором патологического ремоделирования, даже более сильным, чем размер инфаркта [4][11][12].
В нашем исследовании была выявлена статистически значимая прямая корреляция между размером МСО в остром периоде инфаркта и КДО ЛЖ при обследовании через год: у пациентов с большим размером зон МСО в остром периоде ИМ отмечались большие значения КДО ЛЖ при обследовании через год.
В настоящее время благодаря широкому использованию реперфузионной терапии частота возникновения постинфарктных аневризм заметно снизилась (с 30-35% до, по различным данным, 0,2-5%). Однако формирование аневризмы остается серьезным осложнением инфаркта. У пациентов с аневризмой ЛЖ чаще встречаются желудочковые аритмии, остановка сердца, острая сердечная недостаточность, кардиогенный шок, тромбы в полости ЛЖ. Прогноз заболевания находится в тесной связи с размером аневризмы и связанных с ней клинических проявлений. По данным, приведенным Sattar Y, et al. (2023), пятилетняя смертность среди пациентов с крупными аневризмами ЛЖ составляет от 30 до 80% 1. Основными известными факторами риска формирования аневризм на сегодняшний день являются полная окклюзия преимущественно ПНА и неоптимальная реваскуляризация. Также по результатам 17-летнего наблюдения (регистр HCUP-NIH) развитие этого осложнения чаще наблюдалось у женщин с наличием коморбидной патологии. В нашем исследовании у 8 из 39 пациентов (20%) отмечалось развитие аневризмы ЛЖ. Все они имели верхушечную локализацию вследствие окклюзии ПНА. По результатам нашей работы появление данного осложнения было зарегистрировано у 40% пациентов с наличием МСО и не отмечалось у пациентов без очагов МСО (р=0,0039). МСО является показателем более глубокого трансмурального поражения миокарда. По данным Rios-Navaro C, et al. (2019), наличие МСО у пациента с острым ИМ коррелирует с глубиной повреждения миокарда и соответственно с худшими показателями сердечной функции в остром периоде [13]. В работе Wu K, et al. (1998), помимо взаимосвязи наличия МСО и увеличения объемов камер сердца, была показана связь наличия МСО с истончением миокарда в зоне поражения [11]. Таким образом, имеются патофизиологические предпосылки к формированию постинфарктной аневризмы. Кроме нашего исследования, нет доступных литературных данных, показывающих прямую взаимосвязь наличия МСО и формирования аневризмы ЛЖ.
Заключение
В нашем исследовании феномен МСО по данным МРТ был выявлен более чем у половины (51,3%) больных с ОИМпST и успешным пЧКВ в исследуемой группе, что соответствует данным других исследований (50-65%). Наличие очагов МСО достоверно ассоциировалось с формированием постинфарктной аневризмы ЛЖ. Увеличение размеров очагов МСО достоверно коррелировало с уменьшением ФВ ЛЖ, увеличением КДО ЛЖ как в остром периоде, так и через год после ИМ. Таким образом, проведение МРТ сердца с отсроченным контрастированием у больных с ОИМпST с выявлением очагов МСО и оценкой их размеров позволяет более точно определить течение заболевания и прогноз пациентов.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
1 Sattar Y. Ventricular Aneurysm. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; https://www.ncbi.nlm.nih.gov/books/NBK555955/ (3.Apr.2023).
Список литературы
1. Bahit MC, Kochar A, Granger CB. Post-Myocardial Infarction Heart Failure. JACC Heart Fail. 2018;6(3):179-86. doi:10.1016/j.jchf.2017.09.015.
2. Bulluck H, Dharmakumar R, Arai AE, et al. Cardiovascular Magnetic Resonance in Acute ST-Segment-Elevation Myocardial Infarction: Recent Advances, Controversies, and Future Directions.Circulation.2018;137(18):1949-64. doi:10.1161/CIRCULATIONAHA.117.030693.
3. van Kranenburg M, Magro M, Thiele H, et al. Prognostic value of microvascular obstruction and infarct size, as measured by CMR in STEMI patients. JACC Cardiovasc Imaging. 2014;7(9):930-9. doi:10.1016/j.jcmg.2014.05.010.
4. Тереничева М. А., Стукалова О. В., Шахнович Р. М. и др. Роль магнитно-резонансной томографии сердца в определении прогноза больных с острым инфарктом миокарда с подъемом сегмента ST. Часть 2. Оценка прогноза заболевания. Терапевтический архив. 2022;94(4):552-7. doi:10.26442/00403660.2022.04.201458.
5. Stone GW, Selker HP, Thiele H, et al. Relationship Between Infarct Size and Outcomes Following Primary PCI: Patient-Level Analysis From 10 Randomized Trials. J Am Coll Cardiol. 2016;67(14):1674-83. doi:10.1016/j.jacc.2016.01.069.
6. Thygesen K, Alpert JS, Jaffe AS, et al. Task Force for the Universal Definition of Myocardial Infarction. Fourth Universal Definition of Myocardial Infarction (2018). J Am Coll Cardiol. 2018;72(18):2231-64. doi:10.1016/j.jacc.2018.08.1038.
7. Ibanez B, James S, Agewall S, et al. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation: The Task Force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology (ESC), European Heart Journal. 2018;39;2:119-77. doi:10.1093/eurheartj/ehx393.
8. Агеев Ф. Т., Арутюнов Г. П., Беграмбекова Ю. Л. и др. Хроническая сердечная недостаточность. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25;4083. doi:10.15829/1560-4071-2020-4083.
9. Symons R, Pontone G, Schwitter J, et al. Long-Term Incremental Prognostic Value of Cardiovascular Magnetic Resonance After ST-Segment Elevation Myocardial Infarction: A Study of the Collaborative Registry on CMR in STEMI. JACC Cardiovasc Imaging. 2018;11(6):813-25. doi:10.1016/j.jcmg.2017.05.023.
10. Abbas A, Matthews GH, Brown IW, et al. Cardiac MR assessment of microvascular obstruction. Br J Radiol. 2015;88(1047):20140470. doi:10.1259/bjr.20140470.
11. Wu KC, Zerhouni EA, Judd RM, et al. Prognostic significance of microvascular obstruction by magnetic resonance imaging in patients with acute myocardial infarction. Circulation. 1998;97(8):765-72. doi:10.1161/01.cir.97.8.765.
12. Hamirani YS, Wong A, Kramer CM, et al. Effect of microvascular obstruction and intramyocardial hemorrhage by CMR on LV remodeling and outcomes after myocardial infarction: a systematic review and meta-analysis. JACC Cardiovasc Imaging. 2014;7(9):940-52. doi:10.1016/j.jcmg.2014.06.012.
13. Rios-Navarro C, Marcos-Garces V, Bayes-Genis A, et al. Microvascular Obstruction in ST-Segment Elevation Myocardial Infarction: Looking Back to Move Forward. Focus on CMR. Clin. Med. 2019;8(11):1805. doi:10.3390/jcm8111805.
Об авторах
М. А. ТереничеваРоссия
Мария Алексеевна Тереничева — врач-кардиолог палаты реанимации и интенсивной терапии 1-го кардиологического отделения.
Москва
Конфликт интересов:
нет
Р. М. Шахнович
Россия
Роман Михайлович Шахнович — д. м. н., профессор Института подготовки кадров высшей квалификации.
Москва
Конфликт интересов:
нет
О. В. Стукалова
Россия
Ольга Владимировна Стукалова — к. м. н., с. н. с. отдела томографии.
Москва
Конфликт интересов:
нет
Д. В. Певзнер
Россия
Дмитрий Вольфович Певзнер — к. м. н., в. н. с. отдела неотложной кардиологии.
Москва
Конфликт интересов:
нет
И. С. Явелов
Россия
Игорь Семенович Явелов — д. м. н., профессор, руководитель отдела фундаментальных и клинических проблем тромбоза при неинфекционных заболеваниях.
Москва
Конфликт интересов:
нет
Ю. О. Шалагинова
Россия
Юлия Олеговна Шалагинова — врач-кардиолог отдела неотложной кардиологии.
Москва
Конфликт интересов:
нет
С. К. Терновой
Россия
Сергей Константинович Терновой — академик РАН, д. м. н., профессор, г. н. с. отдела томографии, зав. кафедрой лучевой диагностики и лучевой терапии.
Москва
Конфликт интересов:
нет
Дополнительные файлы
Рецензия
Для цитирования:
Тереничева М.А., Шахнович Р.М., Стукалова О.В., Певзнер Д.В., Явелов И.С., Шалагинова Ю.О., Терновой С.К. Значение микрососудистой обструкции по данным контрастной магнитно-резонансной томографии сердца в оценке прогноза больных с острым инфарктом миокарда с подъемом сегмента ST. Российский кардиологический журнал. 2024;29(3):5603. https://doi.org/10.15829/1560-4071-2024-5603. EDN: ERFWCJ
For citation:
Terenicheva M.A., Shakhnovich R.M., Stukalova O.V., Pevzner D.V., Yavelov I.S., Shalaginova Yu.O., Ternovoy S.K. The value of microvascular obstruction according to contrast-enhanced cardiac magnetic resonance imaging in assessing the prognosis of patients with acute ST-segment elevation myocardial infarction. Russian Journal of Cardiology. 2024;29(3):5603. (In Russ.) https://doi.org/10.15829/1560-4071-2024-5603. EDN: ERFWCJ
JATS XML

















































