Перейти к:
Рекомендации по оценке и коррекции сердечно-сосудистых рисков при несердечных операциях 2023
https://doi.org/10.15829/1560-4071-20235555
EDN: MQQWMW
Аннотация
Российское кардиологическое общество (РКО)
Ключевые слова
Для цитирования:
Сумин А.Н., Дупляков Д.В., Белялов Ф.И., Баутин А.Е., Безденежных А.В., Гарькина С.В., Гордеев М.Л., Затейщиков Д.А., Иртюга О.Б., Корок Е.В., Кулагина Т.Ю., Медведева Е.А., Мензоров М.В., Напалков Д.А., Павлова Т.В., Петрунько О.В., Протасов К.В., Сибагатуллина Ю.С., Черепанова Н.А., Чомахидзе П.Ш., Шутов А.М. Рекомендации по оценке и коррекции сердечно-сосудистых рисков при несердечных операциях 2023. Российский кардиологический журнал. 2023;28(8):5555. https://doi.org/10.15829/1560-4071-20235555. EDN: MQQWMW
For citation:
Sumin A.N., Duplyakov D.V., Belyalov F.I., Bautin A.E., Bezdenezhnykh A.V., Garkina S.V., Gordeev M.L., Zateishchikov D.A., Irtyuga O.B., Korok E.V., Kulagina T.Yu., Medvedeva E.A., Menzorov M.V., Napalkov D.A., Pavlova T.V., Petrunko O.V., Protasov K.V., Sibagatullina Yu.S., Cherepanova N.A., Chomakhidze P.Sh., Shutov A.M. Assessment and modification of cardiovascular risk in non-cardiac surgery. Clinical guidelines 2023. Russian Journal of Cardiology. 2023;28(8):5555. (In Russ.) https://doi.org/10.15829/1560-4071-20235555. EDN: MQQWMW
Методология создания рекомендаций
Клинические рекомендации разработаны специалистами-экспертами Российского кардиологического общества на основе достижений доказательной медицины, отечественного и зарубежного клинического опыта в ведении кардиологических пациентов при проведении несердечных хирургических вмешательств.
Основой настоящей версии клинических рекомендаций стали рекомендации ВНОК 2011г, ACC/AHA 2014г, ESC/ESA 2022г, результаты опубликованных позднее крупных международных медицинских регистров и рандомизированных исследований, входящие в зарубежные и российские базы научного цитирования.
Ввиду того, что представленные рекомендации невозможно изложить исключительно в формате, представленном методическими рекомендациями ФГБУ ЦЭККМП Минздрава РФ 2018г, в ходе разработки были использованы только шкалы уровня убедительности рекомендаций и уровня достоверности доказательств Европейского общества кардиологов (ЕОК) (табл. 1, 2).
Целевая аудитория данных клинических рекомендаций
- Врач-кардиолог медицинских организаций, оказывающий помощь в амбулаторных и стационарных условиях.
- Врач-терапевт медицинских организаций, оказывающий помощь в амбулаторных и стационарных условиях.
- Врач общей практики (семейный врач).
- Врач-анестезиолог.
- Врач-хирург.
Порядок обновления клинических рекомендаций
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию — не реже чем 1 раз в 3 года или при появлении новой информации о тактике ведения пациентов с данным заболеванием. Решение об обновлении принимает Комитет по клиническим рекомендациям Российского общества кардиологов на основе предложений, представленных медицинскими некоммерческими профессиональными организациями.
Таблица 1
Классы показаний согласно рекомендациям ЕОК
Класс рекомендаций ЕОК | Определение | Предлагаемая формулировка |
I | Доказано или общепризнанно, что диагностическая процедура, вмешательство/лечение являются эффективными и полезными | Рекомендовано/показано |
II | Противоречивые данные и/или мнения об эффективности/пользе диагностической процедуры, вмешательства, лечения | |
IIa | Большинство данных/мнений в пользу эффективности/пользы диагностической процедуры, вмешательства, лечения | Целесообразно применять |
IIb | Эффективность/польза диагностической процедуры, вмешательства, лечения установлены менее убедительно | Можно применять |
III | Данные или единое мнение, что диагностическая процедура, вмешательство, лечение бесполезны/неэффективны, а в ряде случаев могут приносить вред | Не рекомендуется применять |
Таблица 2
Уровни достоверности доказательств согласно рекомендациям ЕОК
Уровни достоверности доказательств ЕОК | |
A | Данные многочисленных рандомизированных клинических исследований или метаанализов |
B | Данные получены по результатам одного рандомизированного клинического исследования или крупных нерандомизированных исследований |
C | Согласованное мнение экспертов и/или результаты небольших исследований, ретроспективных исследований, регистров |
Актуальность и распространенность проблемы
Во всем мире ежегодно проводится >200 млн. несердечных операций, и это число постоянно возрастает. Такие операции зачастую сопровождаются нарушениями гемодинамики, гиперкоагуляцией, воспалением, симпатической активацией и кровотечением, что создает предрасположенность к развитию ишемических повреждений миокарда и других сердечно-сосудистых заболеваний (ССЗ) [1].
По данным исследования VISION периоперационное повреждение миокарда было второй по частоте причиной смерти в течение 30 сут. после состоявшегося кровотечения [2]. В другом многоцентровом исследовании среди пациентов, умерших в стационаре, кардиоваскулярные осложнения отмечались в 68% случаев, что было чаще инфекционных (50%) [3]. Среди сердечно-сосудистых осложнений (ССО) при летальных исходах выявлены остановка сердца (64%), аритмии (52%), отек легких (24%), инфаркт миокарда (ИМ) (18%), инсульт (13%), тромбоэмболия легочной артерии (3,5%).
Данные национального регистра США показали, что периоперационный ИМ возникает у 0,9% пациентов, которым проводят большие несердечные операции, и четко связан с риском смерти после операции [4]. За период с 2005г по 2013г в США частота развития периоперационных ИМ снизилась с 898 до 729 на 100 тыс. операций преимущественно за счет снижения числа ИМ с подъемом сегмента ST (ИМпST). Данное снижение могло быть следствием лучшей стратификации риска перед операцией, улучшением медикаментозной и интервенционной стратегии лечения ишемической болезни сердца (ИБС), а также за счет проведения реваскуляризации миокарда у пациентов высокого риска перед несердечной операцией. Кроме того, возможно, сыграло роль понимание опасности развития тромбоза стента после чрескожного коронарного вмешательства (ЧКВ) и, как следствие, отсрочка проведения несердечной операции после стентирования коронарных артерий [4]. Следует отметить, что уменьшение числа ИМ произошло на фоне увеличения частоты регистрации факторов риска (ФР) и ССЗ: ≥2 ФР выявлено у 40,5 и 48,2% в пациентов, ИБС — у 17,2 и 18,2%, периферического атеросклероза — у 6,3 и 7,4%, инсульта — у 3,5 и 4,7% пациентов в 2008–2009 и 2012–2013гг, соответственно. Также выросло число пациентов с повышенным сердечно-сосудистым периоперационным риском (≥3 баллов по шкале RCRI) с 6,6 до 7,7% [5].
Таким образом, необходимость выявления пациентов с повышенным риском кардиоваскулярных осложнений перед несердечными операциями и разработка оптимальной диагностической и лечебной стратегии остаются актуальными задачами.
Подготовка к несердечным операциям
С целью оптимизации ведения пациентов разработан пошаговый алгоритм периоперационного ведения для пациентов с ССЗ.
Алгоритм, модифицированный с учетом тяжести заболеваний сердца и прогностических шкал, представлен на рисунке 1 [6–9]. Такой подход позволяет структурировать и унифицировать подготовку и принятие решений по оперативному лечению, хотя сравнительные исследования алгоритмов и обычной практики по влиянию на клинические исходы отсутствуют. Вместе с тем алгоритм не должен восприниматься как обязательный и жестко детерминированный инструмент, поскольку не может учесть разнообразие возможных клинических ситуаций, а должен использоваться как возможный ориентир для обеспечения максимальной безопасности пациента во время хирургического вмешательства. Общие рекомендации по периоперационной тактике ведения пациентов с ССЗ представлены в таблице 3.
I этап. Срочность операции. Экстренная операция должна быть выполнена без отлагательств, как правило, в течение 6 ч. В этом случае жизнеопасная ситуация определяет тактику лечения и не позволяет проводить детальную диагностику или лечение болезни сердца. Консультант-кардиолог дает рекомендации по периоперационному медикаментозному лечению и продолжению назначенной ранее постоянной терапии. При неотложной операции есть некоторое время для клинической оценки — обычно от 6 до 24 ч. При время-зависимых процедурах есть возможность отсрочить их выполнение на 1–6 нед. (например, большинство онкологических операций попадают в эту категорию). Плановые вмешательства в большинстве случаев можно отложить на период до 1 года.
Возможные сроки задержки предполагаемой несердечной операции могут повлиять на выбор той или иной лечебной стратегии (например, выбор метода реваскуляризации или стента). Соответственно, пациенты с известным заболеванием сердца (или высоким риском его развития), подвергающиеся несердечным операциям высокого риска, требуют оценки мультидисциплинарной команды в составе анестезиолога, кардиолога и хирурга. При плановом хирургическом вмешательстве — переход на II этап алгоритма с оценкой кардиального статуса.
II этап. Кардиальный статус. При наличии острых или нестабильных состояний (нестабильная/тяжелая стенокардия (СК), ИМ до 30–60 сут., декомпенсированная сердечная недостаточность (СН), потенциально жизнеопасные нарушения ритма, тяжелое клапанное поражение) рекомендуется отложить плановую хирургическую операцию до улучшения кардиального статуса и стабилизации состояния.
Наличие у пациента факторов сердечно-сосудистого риска (ССР) может увеличить риск периоперационных осложнений, включая ИМ, однако нет исследований, подтверждающих, что использование и коррекция ФР может улучшить точность прогноза [10].
Возможности лечения пациентов с нестабильными и тяжелыми болезнями сердца, которым планируется операция c повышенным риском сердечно-сосудистых событий, должны обсуждаться мультидисциплинарной командой, поскольку интервенции могут влиять на анестезиологическую и хирургическую тактику.
Для оценки состояния сердечно-сосудистой системы при наличии или подозрении на заболевание сердца у пациента обычно используют эхокардиографию (ЭхоКГ) с оценкой размеров камер по индексам и функции левого желудочка (ЛЖ) по Симпсону, электрокардиографию (ЭКГ), холтеровское мониторирование, а также мозговой натрийуретический пептид (BNP) и тропонин.
При отсутствии неотложных кардиальных проблем осуществляется переход на III этап алгоритма с оценкой риска операции.
III этап. Сердечно-сосудистый периоперационный риск. Оценка риска кардиальных осложнений перед операциями проводится с учетом как хирургических (объем и тяжесть оперативного вмешательства), так и клинических факторов (наличие у пациента тех или иных заболеваний).
Упрощенная классификация рисков включает операции с низким (<1%) и повышенным (≥1%) ССР, поскольку тактика обследования при операциях промежуточного и высокого риска не различается.
Такая оценка риска реализована в клинических шкалах, последние версии которых включают как характеристики хирургического вмешательства, так и сведения о клиническом состоянии пациента. Удобно для оценки периоперационного риска при несердечных операциях использовать простые и валидизированные прогностические инструменты, такие как индекс RCRI (Revised Cardiac Risk Index) или более универсальная шкала Gupta MICA (Myocardial Infarction or Cardiac Arest).
При отнесении операции к вмешательствам низкого риска не требуется дополнительного обследования, операцию можно выполнять. При повышенном риске операции проводится оценка функционального состояния пациента.
IV этап. Функциональное состояние. Наилучший способ оценки функционального состояния — проведение нагрузочных тестов. В то же время исследования не подтверждают, что предоперационные стресс-тесты могут улучшить прогноз [11][12]. При невозможности проведения нагрузочных тестов рекомендуют использовать индекс DASI (Duke Activity Status Index), который лучше предсказывал риск смерти или ИМ, чем обычная оценка переносимости нагрузок [13].
При отличном функциональном состоянии (>10 MET) считается возможным проведение операции без дальнейшего обследования. При наличии удовлетворительного функционального состояния (4–10 MET) бессимптомным или стабильным пациентам возможно проведение хирургического вмешательства без дальнейшего обследования с назначением медикаментозной терапии. При низком (<4 МЕТ) или неизвестном функциональном состоянии показан переход на V этап алгоритма.
V этап. Дополнительное обследование. При сниженной функциональной способности для выявления скрытых/латентных заболеваний и уточнения прогноза проводится дополнительное обследование. При подозрении на заболевание коронарных артерий проводят компьютерную томографическую ангиографию и/или визуальный стресс-тест. При отрицательных результатах тестов выполняется хирургическое вмешательство, при положительных — решается вопрос о необходимости и сроках реваскуляризации миокарда.
В случае сниженной функциональной способности пациента целесообразно оценить состояние сердца с помощью BNP и ЭхоКГ, если это не было сделано ранее.
Хотя предоперационная ЭхоКГ в целом не улучшает выживаемость пациентов и риск ССЗ, выявление серьезных аномалий (например, выраженной митральной регургитации) может повлиять на риск ССО у отдельных пациентов [14–17].
VI этап. Превентивное лечение. Медикаментозное и инвазивное лечение пациентов с заболеваниями сердца проводится с учетом российских и международных рекомендаций и более детально обсуждается в соответствующих разделах.

Рис. 1. Алгоритм периоперационного ведения пациентов при несердечных операциях.
Таблица 3
Общие рекомендации по ведению пациентов с заболеваниями сердца, которым планируется несердечная операция
Рекомендации | Класс | Уровень |
Обследование и лечение пациентов с нетяжелыми сердечно-сосудистыми заболеваниями, которым требуется несердечная операция невысокого риска, проводят кардиолог и анестезиолог. | IIa | C |
Обследование и лечение пациентов с тяжелыми сердечно-сосудистыми заболеваниями и/или которым требуется несердечная операция высокого риска, осуществляется по решению мультидисциплинарной команды. | IIa | C |
Целесообразно оптимизировать лечение сердечно-сосудистых заболеваний перед проведением операции. | I | C |
Ведение пациентов, имеющих сердечно-сосудистые заболевания, перед несердечной операцией рекомендуется осуществлять на основе оценок периоперационного риска и этапов алгоритма. | IIa | C |
Периоперационная оценка сердечно-сосудистых рисков
Точная оценка возможности развития опасных ССЗ перед плановыми операциями позволяет обсудить с пациентом потенциальные риски и принять оптимальное решение, рационально использовать диагностические и лечебные ресурсы, провести эффективную подготовку к операции, выбрать оптимальный план вмешательства, снизить риски в послеоперационном периоде. При неотложных хирургических вмешательствах оценка ССР способствует проведению своевременных профилактических и лечебных мероприятий.
На вероятность развития неблагоприятных послеоперационных событий могут повлиять многие факторы, включая ассоциированные как с хирургией, так и с пациентом (рис. 2).

Рис. 2. Факторы, влияющие на риск периоперационных неблагоприятных событий.
Сокращение: ССЗ — сердечно-сосудистые заболевания.
4.1. Оценка сердечно-сосудистого риска хирургического вмешательства
На ССР, связанные с хирургическим вмешательством, влияют срочность операции (экстренная, неотложная, время-зависимая, плановая), тип (лапароскопическая, внутрисосудистая, открытая), продолжительность операции, анестезиологическое пособие (вид анестезии, медикаменты).
На основании модели S-MPM, оценивающей общую смертность после несердечной хирургии, экспертной группой ESC/ESA-NCS была разработана 3-уровневая классификация 30-сут. риска сердечно-сосудистой смерти и ИМ [18]. Классификация была валидизирована на данных больших регистров, где частота сердечной смерти и ИМ в группах составила 0,6%, 1,2% и 3,4%, а комбинации смерти от любых причин и ИМ — 1,5%, 4,6% и 14,9% [19]. В последних европейских рекомендациях классификация была уточнена (табл. 4).
Поскольку современные исследования не подтверждают вывода старого рандомизированного исследования CREST о повышении частоты перипроцедурного инсульта после каротидного стентирования по сравнению с эндартерэктомией, а последняя может увеличить риск ИМ, каротидная реваскуляризация была отнесена в группу среднего риска [20][21].
Риски, ассоциированные с хирургическими вмешательствами, включаются в шкалы и модели, оценивающие вероятность развития послеоперационных осложнений и смерти.
4.2. Интегральная оценка периоперационного риска
Одним из быстро развивающихся направлений клинической медицины является прогнозирование заболеваний с помощью математических моделей и шкал (табл. 5), которые могут использоваться в качестве основного инструмента или как дополнение к традиционной оценке рисков [22]. Преимуществом прогностических шкал являются унификация принятия решения, отсутствие существенной зависимости от опыта и квалификации врача, количественная оценка состояния и прогноза, возможность контроля решения. Показано, что шкалы точнее прогнозируют исходы операции по сравнению с интуитивными оценками врача [23][38]. Среди ограничений шкал следует выделить неопределенность временного интервала, в течение которого действителен прогноз, зависимость от популяции, статический и групповой характер прогноза.
Учитывая последнее, при обсуждении с пациентом его следует информировать о риске операции, например, указать на возможность развития периоперационного ИМ или остановки сердца у 8 из 100 похожих людей, основываясь на показателях шкалы.
Точность разграничения групп риска шкалами определяется по С-статистике и обычно классифицируется как отличная (0,91–1,00), хорошая (0,81–0,90), средняя (0,71–0,80), плохая (0,61–0,70) и очень плохая (<0,61).
Прогностические шкалы для оценки вероятности неблагоприятных событий включают факторы, связанные как с самим вмешательством, так и с пациентом. Поскольку доля ССО в общем периоперационном риске может быть недоминирующей, для хирургов и анестезиологов важно оценивать широкий спектр осложнений и общую смертность с использованием универсальных моделей, таких как ACS NSQIP, POSSUM или простую модель SORT, включающую всего 6 предикторов [24]. Кардиологи могут использовать более простые и доступные специализированные шкалы для оценки ССР.
Один из популярных прогностических инструментов разработан Lee TH, et al., который оценивает периоперационный риск ИМ, отека легких, остановки сердца и полной атриовентрикулярной (АВ) блокады [39]. Реконструированный индекс rRCRI (табл. 6), который не включает инсулинотерапию, а вместо повышенного уровня креатинина использует клиренс креатинина <30 мл/мин, показал близкие прогностические возможности с оригинальным индексом [25].
По результатам большого валидизирующего исследования VISION отмечена плохая способность индекса RCRI выделять группу пациентов с ССО [40]. Однако более корректный анализ с унификацией различающихся исходов (без отека легких и внутрисердечных блокад) в обоих исследованиях показал сопоставимые оценки 0,71 и 0,69 [41]. Дискриминантные возможности шкалы существенно снижаются у пациентов старше 75 лет, а также при сосудистых и торакальных операциях [33].
Для практического использования удобна универсальная и простая модель Gupta MICA (табл. 7), которая позволяет оценить риск интра- и послеоперационного ИМ и остановки сердца в период 30 сут. после сердечных и несердечных вмешательств [42].
Преимуществом модели Gupta MICA перед индексом RCRI является широкий спектр учитываемых несердечных и сердечных операций, большая точность (непрерывная шкала) в оценке риска смерти, ИМ и инсульта [42–45]. Несовпадение между шкалами Gupta MICA и RCRI в плане предсказания низкого риска составляет 21%, а между шкалами Gupta MICA и ACS NSQIP — 15% [24]. В то же время способность индекса RCRI прогнозировать развитие отека легких и полной АВ блокады может быть полезной у ряда пациентов.
Использование шкал RCRI и Gupta MICA перед хирургическими вмешательствами может существенно снизить число неоправданных сердечных тестов у пациентов с низким риском [46].
Заслуживает внимания простой индекс AUB-HAS2, показавший хорошую дискриминацию в независимых исследованиях, в т. ч. у пациентов с сосудистыми операциями [47][48].
Проверка шкал RCRI и Gupta MICA у пациентов с вмешательствами на сосудах, показала более низкую способность разграничивать группы риска в сравнении с другими типами операций [26][32]. При проведении рутинной коронарной ангиографии у больных перед сосудистыми операциями при наличии одного ФР по шкале RCRI в 69% случаях выявлялись гемодинамически значимые стенозы коронарных артерий, а в 19% — трехсосудистое поражение и/или стеноз ствола левой коронарной артерии, а при отсутствии ФР — в 59% и 16%, соответственно [49].
Для оценки риска сосудистых операций (каротидная эндартерэктомия (КЭЭ), эндоваскулярное и хирургическое лечение аневризм аорты, шунтирование ниже и выше уровня паховой области) предпочтительнее использовать специализированные шкалы VQI–CRI, VSG-CRI, VSGNE CEA [50–52].
Универсальная модель ACS NSQIP с непрерывной оценкой риска может использоваться как при несердечных хирургических вмешательствах, так и в кардиохирургии. Модель ACS NSQIP включает американскую кодировку хирургических операций и 21 показатель для вычисления риска смерти, пневмонии, инфекционных осложнений, легочной эмболии, почечной недостаточности, кардиальных и других осложнений [30]. Большее число используемых предикторов, с одной стороны, повышает точность прогноза, а с другой — усложняет практическое использование шкалы. Платой за универсальность модели является снижение точности прогноза для некоторых операций [34][35].
Модель ACS NSQIP показала сопоставимые результаты прогнозирования больших сердечно-сосудистых событий со шкалой RCRI [31].
В практической работе удобно использовать программы для мобильных устройств, включающие наборы востребованных шкал. Среди таких программ можно отметить QxMD, MDCalc и КардиоЭксперт.
При определении периоперационного риска следует учитывать тенденцию недооценки риска осложнений (до 30–40%), которая менее выражена у прогностических моделей, чем у врачей-хирургов [36]. При детальном разъяснении пациентам пользы и рисков хирургического вмешательства они чаще выбирают неинвазивное лечение с меньшей выраженностью конфликта принятия решений [37].
4.3. Оценка функционального состояния
Оценка функционального статуса является неотъемлемым этапом по оценке периоперационного риска (табл. 8). Имеются различия в интерпретации результатов такой оценки (в рекомендациях АСС/АНА выделяется не только хорошее, но и отличное функциональное состояния), при этом, хотя предпочтение и отдается нагрузочным тестам, считается возможным проведение приблизительной оценки функционального статуса по уровню физической активности пациента [7]. Исследование METS тем не менее показало, что при сопоставлении с результатами кардиореспираторного нагрузочного теста субъективная оценка выявляла пациентов с максимальным потреблением кислорода <14 мл/кг/мин с чувствительностью 19,2%. Неудивительно, что субъективная оценка не позволяла предсказать развитие кардиальных осложнений и летальных исходов после операции в отличие от более объективных методов оценки. Так, низкие баллы по опроснику Duke Activity Status Index (DASI) предсказывали 30-дневную смертность или ИМ, повышенная концентрация N-концевого фрагмента мозгового натрийуретического пептида (NT-proBNP) — 30-дневную смертность и повреждение миокарда с повышением уровня тропонина, а снижение максимального потребления кислорода — периоперационные осложнения [13][56][57]. По-видимому, такие результаты заставили канадских экспертов в своих рекомендациях отказаться от оценки функционального состояния каким-либо способом и ограничиться только определением уровня NT-proBNP [29], но надо признать, что исследований по валидизации данного подхода пока не появилось. Также не выделяется оценка функционального статуса пациентов в отдельный этап диагностического алгоритма в бразильских рекомендациях, в них предлагается учитывать его снижение при решении вопроса о проведении неинвазивных тестов при операциях промежуточного риска [58]. Совсем другой подход реализован в Великобритании — в большинстве клиник перед операциями проводятся кардиореспираторные нагрузочные тесты с объективизацией функционального состояния [59]. Такие тесты показаны для обеспечения объективной оценки физической работоспособности до операции и выявления причин ограничения физической нагрузки. Эта информация может быть использована для оказания помощи клиницистам и пациентам в принятии решений о наиболее подходящем хирургическом и нехирургическом лечении в периоперационном периоде.
Показаниями для кардиореспираторных нагрузочных тестов являются:
(1) оценка вероятности периоперационной заболеваемости и смертности и дополнение предоперационной оценки риска (класс В);
(2) получение дополнительной информации при междисциплинарном совместном принятии решений и согласительного мнения (класс С);
(3) принятие клинических решений о наиболее подходящем уровне периоперационного наблюдения (палата интенсивной терапии или отделение реанимации; класс В);
(4) проведение дооперационных консультаций/обследований для коррекции сопутствующих заболеваний (класс С);
(5) выявление ранее не известной патологии (класс В);
(6) оценка эффектов вновь назначенной адъювантной терапии рака, включая химиотерапию и лучевую терапию (класс В).
В исследовании Shulman MA, et al. [60] приведены результаты анализа субисследования METS по возможностям использования теста c 6-минутной ходьбой (ТШХ) для оценки пациентов перед несердечными операциями. Результаты ТШХ слабо коррелировали с данными кардиореспираторного теста, однако низкие значения пройденной дистанции при ТШХ были ассоциированы с большей 30-дневной и годичной смертностью. Также результаты ТШХ обладали равной предсказательной ценностью с кардиореспираторным нагрузочным тестом относительно 12-мес. выживания после операции без инвалидизации, немного уступая данным по шкале DASI [60]. Прогностическая способность данного теста нуждается в дальнейших исследованиях, но пока он выглядит вполне разумной альтернативой кардиореспираторным тестам в оценке функционального состояния пациентов.
4.4. Биомаркеры
4.4.1. Натрийуретические пептиды
В настоящее время не вызывает сомнения прогностическое значение уровня натрийуретического пептида (НУП) при несердечных операциях [61][62]. Определение уровня BNP/NT-proBNP до и непосредственно после операции позволяет существенно улучшить базовую модель оценки риска операции как в течение 30 дней, так и через ≥180 дней после вмешательства [61]. В метаанализе 2019г показано, что повышенный уровень BNP повышает риск развития ССО при операциях в 4,5 раза; повышенный уровень NT-proBNP — в 3,48 раза (р<0,001 в обоих случаях) [62]. Кроме того, в большом когортном исследовании показана связь повышения предоперационного уровня BNP/NT-proBNP при несердечных операциях не только с уровнем 30-дневной сосудистой смерти и миокардиального повреждения (МП), но и с общей 30-дневной смертностью (при NT-proBNP <100 пг/мл летальный исход развивался в 0,3% случаев; при 100–200 пг/мл — в 0,7%; при 200–1500 пг/мл — в 1,4% и при >1500 пг/мл — в 4,0% случаев) [57]. В таблице 9 представлены ключевые рекомендации по периоперационной оценке уровня НУП.
Определение уровня BNP и NT-proBNP имеет более высокую дискриминационную способность, чем шкала RCRI [63]. Предлагается включать определение уровней BNP/NT-proBNP в алгоритм предоперационной оценки, а при повышении данных показателей рекомендуется более тщательное периоперационное мониторирование, отслеживание уровня тропонина в течение 72 ч после операции и ведение пациента мультидисциплинарной бригадой (с включением кардиолога) после операции [29] или традиционное предоперационное обследование с проведением неинвазивных тестов [64]. Однако не проводились проспективные рандомизированные контролируемые исследования (РКИ) для оценки влияния тактики ведения пациентов с оценкой уровней BNP/NT-proBNP на число периоперационных осложнений.
4.4.2. Периоперационное повреждение миокарда
МП при несердечных операциях определяется как по крайней мере однократное повышение уровня сердечного тропонина в течение 30 дней после операции (в подавляющем большинстве случаев в течение 48–72 ч) выше 99 перцентиля верхней границы нормы [65]. Понятие МП также включает в себя периоперационный ИМ, для диагностики которого необходимо наличие по крайней мере одного из следующих дополнительных признаков: наличие симптомов ишемии, "новых" ишемических изменений ЭКГ, появления патологического зубца Q, подтвержденное наличие коронарного тромбоза [66]. Периоперационное повреждение миокарда имеет неблагоприятное влияние как на 30-дневный, так и на отдаленный прогноз [67][73].
Распространенность МП составляет 8–20%, и выявляемость зависит от принятых в медицинской организации подходов к периоперационному мониторингу, качества применяемых лабораторных наборов [67][73–75].
Пациентам высокого риска целесообразно проводить исследование концентрации тропонина до операции, далее — в первые 48–72 ч в послеоперационном периоде (табл. 10). При выявлении первой повышенной концентрации должны быть проведены дополнительные исследования для выявления закономерной динамики (снижения или дальнейшего повышения маркера). Периоперационное МП считается острым (т. е. потенциально ишемического происхождения) при выявлении первичного уровня тропонина более 99 перцентиля и при последующей его динамике (снижение или повышение) более чем на 20% [66].
Интраоперационная гипотония связана с органным повреждением у пациентов, подвергающихся несердечной хирургии. Короткие эпизоды гипотонии приводят к повреждению миокарда, почек и сопровождаются большей смертностью [68]. Для снижения частоты и выраженности эпизодов гипотонии целесообразно использовать непрерывный инвазивный мониторинг. Открытым остается вопрос оптимального подхода к управлению артериальным давлением (АД), количестве и составе инфузионной терапии, применении и выборе вазопрессоров, управлении глубиной анестезии.
В отсутствие иных причин повышение уровня тропонинов следует рассматривать как событие ишемического происхождения. Исходя из данных исследований POISE и MANAGE можно предположить положительное влияние антитромботических препаратов (в частности, дабигатрана этексилата) [69][76][77] и статинов [70][77].
Усиление кардиоваскулярной терапии у пациентов с МП было связано с отсутствием на протяжении года больших сердечно-сосудистых событий, что сопоставимо с пациентами без МП, в то время как при отсутствии усиления терапии пациенты имели почти вдвое больший риск развития сердечно-сосудистых событий по сравнению с пациентами без МП [71].
Пациенты с МП, которые имеют признаки периоперационного ИМ в соответствии с четвертым универсальным определением, должны получать рекомендованную терапию с учетом возможных рисков и положительных влияний [65][78].
Уточнение анатомии коронарных артерий целесообразно у пациентов с МП, которые имеют множественные ФР при значительном повышении послеоперационного уровня тропонина или критериях периоперационного ИМ [72]. На данный момент нет информации, может ли быть полезным рутинное инвазивное обследование пациентов с МП, однако пациенты высокого риска должны быть направлены на коронарографию (КГ). Также неопределенным остается оптимальное время проведения КГ. Решение должно приниматься на основании данных конкретного пациента, уровня повышения тропонина, наличия иных симптомов ишемии и соотноситься с риском развития кровотечения после несердечного вмешательства. Коррекция традиционных факторов ССР, таких как курение, масса тела, гипертония, нарушения углеводного обмена, гиподинамия, а также вовлечение пациентов в программы реабилитации, несмотря на отсутствие прямых доказательств для пациентов с МП, представляются весьма желательными.
4.5. Электрокардиография и суточное мониторирование ЭКГ
Проведение ЭКГ в покое в 12 отведениях рекомендуется всем пациентам, которым планируется выполнение оперативного лечения среднего и высокого кардиального риска, при наличии ФР ССЗ или самой кардиальной патологии, вне зависимости от исходного расчетного риска операции (табл. 11). При этом ЭКГ является доступным скрининговым методом выявления кардиальной патологии и, с учетом высокой доли бессимптомного течения ряда ССЗ, в особенности нарушений ритма и проводимости, должно выполняться даже при отсутствии жалоб, особенностей анамнеза и объективного статуса пациента.
Пациенты с любыми изменениями на ЭКГ покоя, отличными от нормы, имеют больший риск смерти от ССО, чем пациенты, имеющие нормальную ЭКГ [81][82]. С более высоким риском смерти от ССО в периоперационном периоде ассоциированы: наличие рубцовых изменений на ЭКГ, полная блокада левой или правой ножки пучка Гиса [39][83]. Независимыми предикторами периоперационных кардиологических осложнений являются признаки гипертрофии миокарда ЛЖ (критерий Соколова-Лайона) [84][85]. Кроме того, периоперационные осложнения чаще развиваются у пациентов с увеличенным корригированным интервалом QT. Увеличение корригированного интервала QT на каждые 10 мсек соответствовало учащению периоперационных ССО на 30% [86].
Противопоказанием для планового несердечного вмешательства с отсрочкой операции на время дообследования следует считать:
— впервые выявленные нарушения сердечного ритма и проводимости;
— частота сердечных сокращений (ЧСС) <50 уд./мин в покое;
— ЧСС в покое >100 уд./мин при синусовом ритме и >110 в мин при фибрилляции предсердий (ФП);
— признаки структурных изменений сердца, если ЭхоКГ не была проведена за последние полгода (блокада левой ножки пучка Гиса, признаки гипертрофии миокарда, рубцовых изменений миокарда);
— перемежающаяся блокада системы Гиса (чередование полной блокады правой и левой ножек пучка Гиса на серии ЭКГ у одного пациента).
Выявление нарушений сердечного ритма и проводимости (в особенности — АВ или синоатриальная блокада, ФП, блокада в системе Гиса, брадикардия) должно расцениваться как показание для проведения дообследования, включая суточное мониторирование ЭКГ, вне зависимости от риска предстоящей операции. В целом мониторирование ЭКГ по Холтеру перед операцией и в послеоперационном периоде следует проводить по стандартным показаниям [87][88].
4.6. Эхокардиография
Рутинное проведение ЭхоКГ всем пациентам, вне зависимости от их анамнеза и степени риска предстоящей операции, было признано нецелесообразным [93]. Наряду с этим известно, что наличие кардиомиопатии, значительной систолической дисфункции, а также критических пороков сердца, которые требуют кардиохирургического вмешательства, значительно повышают риски несердечной операции и требуют исключения [89]. В связи с этим проведение ЭхоКГ должно быть рекомендовано всем пациентам перед операцией высокого риска при наличии признаков структурной патологии сердца на ЭКГ покоя или измененной аускультативной картины сердца, если исследование ранее не выполнялось (табл. 12).
В ряде исследований было показано, что умеренные клапанные изменения (асимптомный аортальный стеноз умеренной степени, митральная и аортальная недостаточность умеренной степени, трикуспидальная недостаточность 1–2 степени) не влияют на риск несердечной операции [94][95].
Основным показателем систолической функции миокарда является фракция выброса (ФВ) ЛЖ, определенная по методу Симпсона. ФВ <35% является серьезным предиктором развития кардиальных осложнений в периоперационном периоде [89, 96]. Чомахидзе П. Ш. и соавт. [97] показали, что снижение ФВ ниже 50% было ассоциировано с почти 3-х кратным ростом различных кардиальных осложнений при несердечных операциях.
Наряду с оценкой ФВ ЛЖ существует возможность оценки дополнительных параметров систолической функции ЛЖ — определение глобальной деформации миокарда (GLS) и линейной скорости кровотока (VTI) в выносящем тракте ЛЖ. Прогностическое значение данных показателей при несердечных операциях изучено пока недостаточно. Снижение показателя GLS ниже 25% является независимым предиктором периоперационных осложнений при выполнении аортокоронарного шунтирования. Кроме того, выживаемость в течение года после операции была выше у пациентов с нормальным показателем GLS [98]. Снижение показателя GLS ЛЖ ниже 19% ассоциировалось с высоким риском ИМ и смерти в периоперационном периоде при несердечных вмешательствах. Также с развитием больших кардиальных периоперационных осложнений ассоциировано снижение показателя VTI в выходном тракте ЛЖ <18 см. [97][99]. У пациентов с хронической СН (ХСН) показатель GLS ЛЖ ниже 17% был достоверным предиктором неблагоприятных событий (инфаркт, госпитализация, смерть от кардиальной причины) в отличие от ФВ ЛЖ, которая не имела достоверной корреляции с наличием осложнений при ХСН [100].
Не менее значимым является наличие диастолической дисфункции миокарда. Предиктором кардиальных периоперационных осложнений следует считать выраженную диастолическую дисфункцию миокарда ЛЖ с повышением отношения E/E’ >15 или же снижением скорости движения фиброзного кольца митрального клапана в диастолу ниже 7 см/с [99][101].
Из других показателей ЭхоКГ следует учитывать наличие гипертрофии миокарда. Электрическая неоднородность миокарда и повышенная потребность в кислороде достоверно ассоциировались с развитием больших периоперационных кардиальных осложнений [89][99].
Таблица 4
Классификация ССР хирургического вмешательства в зависимости от локализации и вида [6, с изменениями]
Оценка риска хирургического вмешательства в зависимости от локализации и вида операции | ||
Низкий риск: <1% | Средний риск: 1–5% | Высокий риск: >5% |
• Операции на грудной железе • Стоматологические операции • Операции на щитовидной железе • Офтальмологические операции • Малые гинекологические операции • Малые ортопедические операции (менискэктомия) • Реконструктивные операции • Поверхностные операции • Малые урологические операции (трансуретральная резекция простаты) • Малая резекция легких с видеоподдержкой | • Каротидная реваскуляризация • Эндоваскулярная пластика аневризмы аорты • Операции головы и шеи • Абдоминальные операции: спленэктомия, коррекция грыжы пищеводного отверстия диафрагмы, холецистэктомия • Торакальные небольшие операции • Неврологические или ортопедические большие операции (бедро, позвоночник) • Периферическая артериальная ангиопластика • Трансплантация почек • Большие урологические или гинекологические операции | • Резекция надпочечников • Операции на аорте и крупных сосудах • Дуоденально-панкреатические операции • Резекция печени, хирургия желчных протоков • Эзофагэктомия • Открытая реваскуляризация нижних конечностей или ампутация • Пневмонэктомия • Трансплантация легких или печени • Коррекция перфорации кишечника • Тотальная цистэктомия |
Таблица 5
Рекомендации по стратификации ССР с помощью шкал
Рекомендации | Класс | Уровень | Ссылки |
С целью оценки сердечно-сосудистых рисков перед несердечной хирургией рекомендуется использовать специализированные или универсальные шкалы, прошедшие независимую валидизацию. | I | В | [6][22–29] |
Сердечно-сосудистые риски следует оценивать в контексте общей смертности и риска других осложнений. | IIa | С | [22][30][31] |
Оценку рисков сердечно-сосудистых событий целесообразно использовать в структуре алгоритма периоперационного ведения пациентов. | IIa | C | [6][8] |
Выбор шкал и моделей прогнозирования неблагоприятных событий осуществляется с учетом потенциальных рисков, особенностей оперативного вмешательства, организации лечебного процесса и целей прогноза. | IIa | C | [24][32–35] |
Необходимо обсуждать с пациентами возможные риски оперативного лечения с указанием предполагаемой частоты неблагоприятных событий в группе сходных людей. | I | С | [36][37] |
Таблица 6
Индекс rRCRI
Показатель | Характеристика |
Состояние | Плановые большие несердечные хирургические вмешательства |
Предикторы | Хирургия высокого риска, ИБС, сердечная недостаточность, транзиторная ишемическая атака/инсульт, клиренс креатинина <30 мл/мин |
Прогноз | Остановка сердца, ИМ, отек легких, полная атриовентрикулярная блокада |
Риск | Низкий (<1 балла), средний (1 балл), высокий (≥2 баллов) |
С-статистика | 0,79 [25], 0,71 [32] |
Сокращения: ИБС — ишемическая болезнь сердца, ИМ — инфаркт миокарда.
Таблица 7
Шкала Gupta MICA
Показатель | Характеристика |
Состояние | Плановые сердечные и несердечные хирургические вмешательства |
Предикторы | Тип операции, функциональный статус, креатинин, физический статус пациента согласно классу Американского общества анестезиологов (ASA), возраст |
Прогноз | Инфаркт миокарда, остановка сердца |
Риск | Низкий (<1%), средний (1–1,9%), высокий (≥2%) |
С-статистика | 0,87 [42], 0,76 [43] |
Таблица 8
Рекомендации по оценке функционального состояния
Рекомендации | Класс | Уровень | Ссылки |
Оценка функционального состояния рекомендуется у пациентов с промежуточным и высоким риском развития кардиальных осложнений (>1%). | I | B | [53] |
Наиболее оптимальным методом оценки функционального состояния является проведение кардиореспираторного нагрузочного теста, а при его невозможности — тест с 6-минутной ходьбой или заполнение опросника DASI. | IIa | B | [54] |
Применение субъективной шкалы оценки функционального состояния нецелесообразно из-за ее низкой предсказательной способности. | IIb | B | [53–55] |
Таблица 9
Рекомендации по предоперационной оценке биомаркеров
Рекомендации | Класс | Уровень | Ссылки |
Измерение NT-proBNP или BNP перед несердечной операцией для улучшения оценки периоперационного сердечного риска у пациентов в возрасте 65 лет и старше, в возрасте 45–64 лет с наличием сердечно-сосудистого заболевания или с показателем RCRI ≥1. | IIa | В | [57][61–63] |
Рутинное исследование уровней BNP и NT-proBNP при предоперационной оценке не рекомендуется. | III | C | [29][64] |
Сокращения: BNP — мозговой натрийуретический пептид, NT-proBNP — N-концевой промозговой натрийуретический пептид.
Таблица 10
Рекомендации по диагностике и тактике ведения периоперационного МП
Рекомендация | Класс | Уровень | Ссылки |
Всем пациентам старше 65 лет и пациентам старше 45 при наличии у них известных сердечно-сосудистых заболеваний следует исследовать уровень тропонина до и в течение 48–72 ч после оперативного вмешательства. | I | B | [65][66] |
Пациентам с повышением уровня тропонина необходимо выявление возможной причины, отличной от ишемического МП, а также исследование его уровня в динамике для дифференциальной диагностики МП с хроническим состоянием. | IIa | С | [65][67] |
Пациентам высокого сердечно-сосудистого риска может быть рекомендован интраоперационный инвазивный мониторинг гемодинамики. | IIa | C | [68] |
Пациентам с МП целесообразно назначение АСК для снижения 30-дневной летальности. | IIa | А | [69] |
Пациентам с МП, имеющим признаки ИМ в соответствии с 4 универсальным определением целесообразно назначение АСК для снижения 30-дневной летальности. | I | C | [69] |
Пациентам с МП целесообразно назначение статинов для снижения 30-дневной летальности. | IIa | C | [70] |
Для улучшения прогноза у пациентов с МП необходимо назначение оптимальной медикаментозной терапии сердечно-сосудистых заболеваний. | IIa | C | [71] |
Пациентам с МП, имеющим критерии периоперационного ИМ, показано проведение коронарной ангиографии. | I | A | [72] |
Пациентам с МП рекомендована консультация кардиолога, для выявления скрытой коронарной недостаточности. | I | С | [72] |
Сокращения: АСК — ацетилсалициловая кислота, ИМ — инфаркт миокарда, МП — миокардиальное повреждение.
Таблица 11
Рекомендации по ЭКГ и суточному мониторированию ЭКГ перед несердечными операциями
Рекомендации | Класс | Уровень | Ссылки |
ЭКГ показана пациентам (особенно старше 65 лет), имеющим факторы риска ССЗ, при планируемом хирургическом вмешательстве высокого или среднего риска. | I | B | [79] |
ЭКГ показана всем пациентам с ухудшением течения ССЗ. | I | B | [79] |
ЭКГ показана пациентам, имеющим факторы риска кардиальной патологии, при планируемом хирургическом вмешательстве низкого риска. | IIa | B | [79][80] |
Суточное мониторирование ЭКГ перед несердечными операциями или в послеоперационном периоде проводится в соответствии со стандартными показаниями. | I | C |
Сокращения: ССЗ — сердечно-сосудистые заболевания, ЭКГ — электрокардиография.
Таблица 12
Рекомендации по выполнению ЭхоКГ при планировании несердечных вмешательств
Рекомендации | Класс | Уровень | Ссылки |
Целесообразно выполнить ЭхоКГ-исследование при планируемом несердечном вмешательстве высокого риска у пациентов с низкой функциональной способностью, высоким уровнем биомаркеров, систолической дисфункцией, кардиомиопатиями, пороками сердца, впервые выявленными сердечными шумами и подозрением на заболевание сердечно-сосудистой системы. | I | В | [16][89–92] |
Проведение ЭхоКГ-исследования можно рассмотреть при планируемом несердечном вмешательстве промежуточного риска у пациентов с низкой функциональной способностью, высоким уровнем биомаркеров, систолической дисфункцией, кардиомиопатиями, пороками сердца, впервые выявленными сердечными шумами и подозрением на заболевание сердечно-сосудистой системы. | IIb | C | |
Рутинное проведение ЭхоКГ для оценки функции ЛЖ перед операцией среднего или низкого кардиального риска не показано. | III | C |
Сокращения: ЛЖ — левый желудочек, ЭхоКГ — эхокардиография.
Периоперационное лечение
5.1. Антитромботическая терапия
Алгоритм ведения пациентов, принимающих антитромботические препараты и нуждающихся в выполнении несердечных операций, должен учитывать риск кровотечений и тромбозов, связанных как с самой инвазивной процедурой, так и с основным заболеванием, которое явилось показанием к долгосрочному приему препаратов, контролирующих активность системы гемостаза. Принятие клинических решений у пациентов данного профиля является сложной задачей, поэтому междисциплинарная оценка риска осложнений перед вмешательством имеет решающее значение для успешного выполнения хирургического вмешательства и дальнейшей реабилитации.
Антитромбоцитарные препараты
Фармакокинетические и фармакодинамические характеристики антитромбоцитарных препаратов представлены в таблице 13.
Монотерапия антиагрегантами. У пациентов, принимающих ацетилсалициловую кислоту (АСК) с целью первичной профилактики, риск ишемических событий низкий, поэтому АСК можно отменить перед проведением несердечного хирургического вмешательства. После операции у пациентов с низким и умеренным риском атеросклеротических ССЗ и/или у пациентов с высоким риском кровотечения следует рассмотреть вопрос о полном прекращении лечения [102][103].
У пациентов с установленным ССЗ АСК играет важную роль в долгосрочной профилактике новых сердечно-сосудистых событий благодаря доказанному оптимальному соотношению риска и пользы. К настоящему моменту закончено исследование POISE-2, которое является крупнейшим рандомизированным плацебо-контролируемым исследованием, изучавшим периоперационное применение АСК у пациентов, перенесших внесердечное хирургическое вмешательство [104]. В исследование было включено 10010 пациентов с установленным ССЗ или с повышенным ССР, перенесших несердечное хирургическое вмешательство. Пациенты были рандомизированы в группы АСК или плацебо. Кроме того, все больные были стратифицированы в зависимости от того, принимали ли они АСК до рандомизации или нет. Результаты исследования показали, что прием АСК не снижал уровень смертности или несмертельного ИМ через 30 дней (7,0% vs 7,1% в группе плацебо (относительный риск (ОР) 0,99; 95% доверительный интервал (ДИ): 0,86–1,15; р=0,92)). Большие кровотечения чаще встречались в группе АСК, чем в группе плацебо (4,6% vs 3,8% (ОР 1,23; 95% ДИ: 1,01–1,49; р=0,04)). Первичные исходы были одинаковыми, независимо от того, принимали ли пациенты АСК до начала исследования, а также у пациентов с сосудистыми заболеваниями и без них.
Следующим этапом исследования POISE-2 был ретроспективный анализ группы пациентов, перенесших ранее ЧКВ (470 человек, <5% от популяции исследования POISE-2) [105]. В данной группе применение АСК было связано со значительным снижением первичной конечной токи — смерти или ИМ (ОР 0,50; 95% ДИ: 0,26–0,95; р=0,036) и вторичной конечной точки — развитие ИМ (ОР 0,44; 95% ДИ: 0,22–0,87; р=0,021), в то время как риск больших или опасных для жизни кровотечений существенно не увеличивался. Несмотря на некоторые ограничения данного анализа, он подтверждает мнение о том, что польза от периоперационного использования АСК у пациентов с предшествующим ЧКВ превышает риск кровотечения. Таким образом, у пациентов с ЧКВ в анамнезе при отсутствии очень высокого риска кровотечения в периоперационном периоде следует продолжать прием низких доз АСК (табл. 14).
Пациентам, перенесшим транскатетерную имплантацию аортального клапана (ТИАК), и не имеющим других показаний к терапии оральными антикоагулянтами, в качестве стандартной терапии рекомендованы низкие дозы АСК [106]. В настоящее время отсутствуют рандомизированные исследования, оценивавшие отмену или продолжение приема АСК при необходимости выполнения несердечного хирургического вмешательства у пациентов, перенесших TAVI и получающих монотерапию АСК.
В случае, если риск кровотечения превышает потенциальную пользу от приема АСК, его следует отменить. Пациентам с высоким риском периоперационного кровотечения (например, при операциях на позвоночнике или некоторых нейрохирургических или офтальмологических операциях) прием АСК следует прекратить как минимум за 7 дней до вмешательства.
В редких случаях пациенты с хронической ИБС могут получать монотерапию клопидогрелом на основании рекомендаций по лечению острого коронарного синдрома (ОКС) без подъема сегмента ST [107]. При необходимости выполнения несердечного хирургического вмешательства у пациентов с высоким риском кровотечения рекомендуется краткосрочный перерыв приема монотерапии ингибитором P2Y12.
Пациентам, получающим монотерапию ингибитором P2Y12 вследствие деэскалации антитромбоцитарного лечения после ЧКВ/ОКС или вследствие недавно перенесенного инсульта, заболеваний периферических артерий или непереносимости АСК, также может потребоваться инвазивное вмешательство. В этом случае необходима тщательная междисциплинарная оценка периоперационного риска кровотечения в сравнении с риском ишемии, а также принятие индивидуального решения в отношении антитромбоцитарного лечения (например, хирургическое вмешательство на фоне монотерапии P2Y12, переход на АСК, короткий перерыв приема препарата), однако к настоящему моменту доказательства эффективности и безопасности этих схем отсутствуют.
Двойная антитромбоцитарная терапия. Ингибиторы P2Y12 в дополнение к АСК рекомендованы для длительного приема пациентам, перенесшим ЧКВ [107, 108]. Частота больших несердечных хирургических вмешательств за первый год после ЧКВ составляет 4%. Чаще всего это ортопедические, абдоминальные и сосудистые вмешательства [109]. Другие данные свидетельствуют о следующей кумулятивной частоте несердечных хирургических вмешательств после ЧКВ: в течение 30 дней — 1%, 6 мес. — 5%, 1 года — 9% [110]. ФР серьезных неблагоприятных сердечно-сосудистых событий после несердечных хирургических вмешательств являются: время от ЧКВ до операции, с самым высоким риском в первый месяц; первичное ЧКВ при ИМпST; прерывание/прекращение двойной антитромбоцитарной терапии (ДАТТ); характеристики поражения коронарных артерий, включая устьевые и дистальные поражения [110]. Еще одним ФР является срочность выполнения операции. ЕОК разработана шкала для прогнозирования вероятности развития больших ССО в зависимости от типа операции [19] (см. Раздел 4.1).
Данные о предпочтительной тактике ведения пациентов, получающих ДАТТ после ЧКВ, противоречивы. Метаанализ 54 исследований, включавший в целом 50048 пациентов, показал, что прекращение приема клопидогрела как минимум на 5 дней снижает риск повторной операции по поводу массивного кровотечения на 50%, не повышая при этом риск неблагоприятных сердечно-сосудистых событий или смерти [111]. Однако публикованы и другие данные, которые указывают на увеличение частоты неблагоприятных сердечно-сосудистых событий при коротких перерывах в приеме ДАТТ [112]. Следует подчеркнуть, что прогноз пациентов при тромбозе стента хуже, чем при коронарной окклюзии de novo (и зависит от локализации стента), а преждевременное прекращение ДАТТ у пациентов с недавней имплантацией коронарного стента является наиболее значимым предиктором тромбоза стента.
Предпочтительной тактикой ведения пациентов, получающих ДАТТ после ЧКВ, является отсрочка планового несердечного хирургического вмешательства до завершения полного курса ДАТТ (6 мес. после планового ЧКВ и 12 мес. после ОКС) [107][108]. Тем не менее несколько недавних исследований показали, что сокращение продолжительности ДАТТ до 1–3 мес. после имплантации современных стентов с лекарственным покрытием ассоциируется с приемлемой частотой серьезных нежелательных сердечно-сосудистых событий и тромбозов стентов у пациентов с низким и умеренным риском. Основываясь на этих данных, рекомендуется отложить внесердечное хирургическое вмешательство как минимум на 1 мес. лечения ДАТТ. Пациентам ССЗ высокого риска, например, с ОКС, следует рассмотреть возможность проведения ДАТТ продолжительностью не менее 3 мес. перед проведением хирургической операции [6]. После отмены приема ингибитора P2Y12 оперативное вмешательство следует проводить на фоне монотерапии АСК.
Долгосрочную ДАТТ (>1 года) с клопидогрелом, прасугрелом или тикагрелором в дополнение к АСК следует рассмотреть у пациентов с высоким риском ишемии. Кроме того, ДАТТ может быть рассмотрена у пациентов с умеренным риском ишемии при отсутствии опасных для жизни кровотечений. В случае необходимости выполнения планового несердечного оперативного вмешательства пациенту, принимающему ДАТТ, рекомендуется прекратить прием ингибитора P2Y12 за 3–7 дней (в зависимости от препарата) (табл. 14).
Деэскалация антитромбоцитарной терапии. У пациентов, недавно перенесших ЧКВ, которым запланировано несердечное хирургическое вмешательство, состав антитромбоцитарной терапии должен быть согласован между хирургом и кардиологом.
В случае, если пациенту, принимающему ДАТТ, требуется неотложное хирургическое вмешательство, рекомендуется деэскалация ДАТТ или ее укорочение. Это может быть либо переход с более сильнодействующих ингибиторов P2Y12 прасугрела или тикагрелора на клопидогрел или прекращение приема АСК и использование монотерапии прасугрелом или тикагрелором. Если ни один из этих вариантов не является приемлемым, может быть рассмотрено преждевременное прекращение приема ингибитора P2Y12. Тикагрелор отменяют за 3–5 дней, клопидогрел — за 5 дней, прасугрел — за 7 дней до операции [113]. По возможности в этой ситуации операцию следует проводить без отмены АСК, но при очень высоком риске кровотечения и сравнительно низком риске ишемии его прием может быть прекращен в качестве крайней меры. Такие хирургические процедуры должны выполняться в лечебных учреждениях, в составе которых есть рентгенхирургические отделения, работающие в режиме 24/7, для немедленного лечения (интракоронарного вмешательства) пациентов в случае возникновения периоперационных ишемических событий.
Пациентам, у которых на фоне приема антитромбоцитарной терапии возникло выраженное или угрожающее жизни периоперационное кровотечение, в качестве экстренной стратегии рекомендуется переливание тромбоцитов.
Контроль функции тромбоцитов в периоперационном периоде. Тестирование функции тромбоцитов имеет несколько теоретических преимуществ в периоперационном периоде: выявление пациентов, у которых на фоне антитромбоцитарной терапии повышен риск кровотечений, связанных с хирургическим вмешательством; определение индивидуального времени выполнения плановой операции после прекращения антитромбоцитарной терапии; управление терапией при возникновении геморрагических осложнений. Однако к настоящему времени ни оптимальные параметры тромбоцитарной функции, ни их пороговые значения, ассоциированные с кровоточивостью, не определены и не изучены у пациентов, перенесших несердечное хирургическое вмешательство [6].
5.2. Оральные антикоагулянты
Длительный прием антикоагулянтов показан при целом ряде заболеваний (ФП, венозные тромбоэмболические осложнения (ВТЭО), имплантированные механические клапаны сердца (МКС) и др.). В случае возникновения у таких пациентов необходимости проведения хирургического вмешательства, следует решить вопрос о целесообразности сохранения антикоагулянтной терапии на период процедуры или временной отмены приема антикоагулянта. Согласно статистическим данным, такие ситуации не являются редкостью — результаты проспективного неинтервенционного регистра, включавшего >2100 пациентов, принимавших прямые оральные антикоагулянты (ПОАК), свидетельствуют, что 27,3% из них в течение 2 лет были вынуждены прервать антикоагулянтное лечение вследствие необходимости выполнения инвазивного вмешательства [115]. В последние годы антикоагулянты все более широко применяются в клинической медицине, соответственно, практические врачи все чаще будут сталкиваться с необходимостью ведения пациентов хирургического профиля, длительно принимающих антикоагулянты.
Выбор тактики периоперационного ведения пациентов зависит от факторов, связанных с риском кровоточивости хирургического вмешательства (табл. 15) и срочностью его выполнения, от индивидуальных ФР самого пациента, а также от фармакокинетических и фармакодинамических характеристик антикоагулянта (табл. 16), который принимает больной.
Инвазивные процедуры, при которых выполнение механической компрессии невозможно, сопряжены с высоким риском серьезных кровотечений.
Факторы, связанные с пациентом, включают возраст, индивидуальный тромботический риск, анамнез геморрагических осложнений, нарушение функции почек, сопутствующее медикаментозное лечение, коморбидность и т. д. Пациенты, нуждающиеся в применении нейтрализующего препарата, во время периоперационного периода должны находиться под наблюдением с тщательным мониторингом параметров гемостаза и регулярной переоценкой риска развития ВТЭО и кровотечения, т. к. нейтрализация эффекта антикоагулянта может быть недостаточной, или наоборот, может возникнуть рикошетная гиперкоагуляция [6]. В этом случае следует принять междисциплинарное решение о досрочном возобновлении лечения антикоагулянтами.
5.2.1. Антагонисты витамина К
В Российской Федерации в подавляющем большинстве случаев в качестве антагонистов витамина К (АВК) применяется варфарин.
АВК у пациентов с МКС. Малые хирургические вмешательства и инвазивные процедуры с возможностью хорошего контроля кровотечения могут выполняться без прерывания терапии АВК, при этом уровень международного нормализованного отношения (МНО) следует поддерживать у нижнего уровня терапевтического диапазона. В случае выполнения больших хирургических вмешательств, требующих снижения МНО ≤1,5, следует рассмотреть прекращение приема АВК и использование терапии "моста". Однако свидетельства в поддержку терапии моста ограничены и получены в когортных исследованиях с небольшими группами сравнения или вообще без них [115]. Кроме того, механические аортальные клапаны нового поколения ассоциированы с более низким риском тромбоэмболических осложнений (ТЭО) в сравнении с предыдущими поколениями [115]. Рандомизированные контролируемые испытания, сравнивавшие терапию "моста" и сохранение терапии базовым антикоагулянтом у пациентов с ФП без МКС, установили более высокий риск кровотечений без преимуществ по частоте ВТЭО в группе терапии "моста" [116][117].
Недавно были опубликованы результаты исследования PERI-OP, в котором сравнивались исходы терапии "моста" и плацебо у пациентов с МКС, ФП или трепетанием предсердий (ТП), которым требовалось прерывание антикоагулянтной терапии для выполнения хирургического вмешательства. Авторам не удалось установить достоверной эффективности терапии "моста" с далтепарином для профилактики больших ТЭО [118]. Результаты были аналогичными как у пациентов с МКС, так и у больных с ФП. Следовательно, у пациентов с МКС и низким риском ВТЭО (например, механический двустворчатый аортальный клапан у пациентов с синусовым ритмом) терапия моста может быть не нужна. У пациентов с МКС и высоким риском ВТЭО (механический аортальный клапан и любые ФР ВТЭО или механический аортальный клапан первого поколения, или механический митральный или трехстворчатый клапан) терапию "моста" с использованием гепарина следует рассмотреть в периоперационном периоде, когда МНО находится на субтерапевтическом уровне. В каждом конкретном случае риск кровотечения следует сопоставить с пользой профилактики ВТЭО.
Внутривенное введение нефракционированного гепарина (НФГ) является единственной терапевтической тактикой, одобренной для терапии "моста" у пациентов с МКС. Однако подкожное введение низкомолекулярных гепаринов (НМГ), хотя и не является одобренным, используется в настоящее время чаще НФГ вследствие меньшей частоты тромбоцитопении, удобства применения и лучшей предсказуемости действия. Результаты метаанализа 9 исследований, включавших в целом 1042 пациента с МКС, не показали достоверных различий между НМГ и НФГ в отношении риска ВТЭО или крупных кровотечений [119].
В случае использования НМГ его следует вводить в терапевтической дозе дважды в сут. с учетом почечной функции. Мониторинг анти-Xa активности с целевыми уровнями от 0,5 до 1,0 ЕД/мл может быть полезным в случаях, когда оптимальную дозу препарата трудно определить (например, у пациентов с почечной дисфункцией или ожирением).
АВК у пациентов с ФП/ВТЭО. У пациентов, использующих АВК для лечения ФП или ВТЭО, инвазивные вмешательства с низким риском кровоточивости могут быть выполнены без прерывания приема АВК [120–122]. Уровень МНО следует поддерживать на нижнем уровне терапевтического диапазона. В исследовании BRIDGE, которое включало 1884 пациента с ФП, прием варфарина был прекращен за 5 сут. до хирургического вмешательства, и пациенты были рандомизированы в группы терапии "моста" или плацебо. Результаты исследования показали, что эффективность обоих подходов была одинакова, при этом частота периоперационных кровотечений статистически значимо повышалась в группе антикоагулянтной терапии [116].
Терапию моста следует рассмотреть у пациентов с высоким тромботическим риском (например, ФП с CHA2DS2-VASc >6 баллов, кардиоэмболический инсульт в течение последних 3 мес. или высокий риск рецидива ВТЭО).
Возобновление приема АВК после инвазивных вмешательств. В случае прекращения терапии АВК перед операцией, возобновить его прием следует через 12–24 ч после инвазивного вмешательства в случае адекватного контроля гемостаза и восстановлении функции желудочно-кишечного тракта. Стартовая доза должна быть поддерживающей с последующим повышением на 50% через 2 дня. Пациенты, получавшие терапию моста, должны начать лечение НМГ или НФГ вместе с АВК через 24 ч после операции, если гемостаз адекватно контролируется, и продолжать комбинированную антикоагулянтную терапию до тех пор, пока МНО не достигнет терапевтического диапазона. У пациентов, перенесших операцию с высоким риском кровотечения, введение терапевтической дозы НМГ следует отложить на 48–72 ч, до достижения адекватного гемостаза [6].
Нейтрализация действия АВК. В случае необходимости быстрого нивелирования антикоагуляционного эффекта АВК используется введение препаратов витамина К, концентратов протромбинового комплекса (КПК) и плазмы. Витамин К (от 2 до 10 мг в зависимости от значения МНО) можно применять перорально с предсказуемым снижением МНО через 18–24 ч или внутривенно (в 25–50 мл физиологического раствора) для более быстрого снижения МНО (через 4–6 ч). Следует отметить, что, несмотря на нормализацию МНО, активность факторов свертывания крови может оставаться ниже нормы, что повышает риск кровоточивости. У пациентов, нуждающихся в неотложном хирургическом вмешательстве, следует использовать КПК или плазму. Предпочтительно применять КПК, содержащие четыре фактора свертывания крови [123]. Необходимая доза препарата зависит от уровня МНО и массы тела пациента (при МНО 2–4 — по 25 ЕД/кг, при МНО 4–6 — по 35 ЕД/кг, при МНО >6 — по 50 ЕД/кг; максимальная доза 5000 ЕД на 100 кг массы тела). Когда четырехфакторные КПК недоступны, можно использовать трехфакторные КПК или плазму. У пациентов, нуждающихся в нивелировании антикоагуляционного эффекта АВК, необходимо тщательно мониторировать параметры гемостаза и оценивать тромботические и геморрагические риски в периоперационном периоде, т. к. нейтрализация действия антикоагулянта может быть как недостаточной, так и избыточной. В последнем случае следует принять междисциплинарное решение в отношении досрочного возобновления лечения антикоагулянтами.
5.2.2. ПОАК
Фармакокинетические и фармакодинамические характеристики ПОАК представлены в таблице 16.
Незапланированное хирургическое вмешательство у пациентов, принимающих ПОАК. При необходимости выполнения неотложного хирургического вмешательства рекомендуется немедленное прекращение терапии ПОАК.
Специфический антагонист дабигатрана этексилата — идаруцизумаб. Его внутривенное введение позволяет быстро нейтрализовать антикоагуляционное действие данного ПОАК и уже через 1,6 ч выполнить хирургическое вмешательство [124].
Андексанет альфа — специфический антагонист антикоагулянтов, блокирующих FXа, был изучен только в популяции пациентов с острыми массивными кровотечениями, но не у пациентов, нуждающихся в неотложном хирургическом вмешательстве [125]. Однако его применение не по прямому назначению может быть рассмотрено в опасных для жизни ситуациях, требующих немедленного вмешательства. В этих случаях необходимо помнить, что андексанет альфа блокирует все ингибиторы FXa, что может иметь значение при дальнейшем лечении НФГ или НМГ.
В случае, если специфические антидоты недоступны, могут быть использованы КПК, однако к настоящему моменту доказательства их эффективности и безопасности при неотложных процедурах у пациентов, принимающих ПОАК, недостаточны [115][126].
Выполнение неотложного хирургического вмешательства целесообразно проводить под общей, а не спинальной анестезией, для снижения риска образования эпидуральной гематомы.
Плановые вмешательства у пациентов, принимающих ПОАК. Инвазивные вмешательства с относительно низким риском кровотечения могут выполняться без прекращения терапии ПОАК, или перерыв в их приеме может быть кратковременным. Хирургические вмешательства с высоким риском кровотечения могут потребовать временной отмены терапии ПОАК.
Терапия "моста". У пациентов, принимающих ПОАК, введение НФГ или НМГ в периоперационном периоде было ассоциировано с повышением риска кровотечения без снижения частоты ТЭО [115][127–129]. Поэтому большинству пациентов терапия "моста" не рекомендуется, за исключением тех, которые имеют высокий риск тромбообразования: пациенты с недавним (в течение 3 мес.) тромбоэмболическим событием (инсульт, системная эмболия или ВТЭО); пациенты, перенесшие ТЭО во время предыдущего перерыва в терапии ПОАК.
Однако тромбопрофилактику в послеоперационном периоде с применением НМГ следует использовать у пациентов, у которых быстрое возобновление терапии ПОАК невозможно. У пациентов, находящихся на терапии "моста" с применением НМГ, может быть рассмотрен мониторинг анти-FXa активности с коррекцией дозы до целевого уровня 0,5–1,0 ЕД/мл.
Рекомендации по специфическим процедурам. Перед вмешательствами, сопряженными с очень высоким риском кровотечения (спинальная или эпидуральная анестезия, анестезия или люмбальная пункция), следует рассмотреть прекращение приема ПОАК на срок до пяти периодов полувыведения (т. е. 3 дня для ингибиторов FXa или 4–5 дней для дабигатрана), прием ПОАК обычно может быть возобновлен через 24 ч после вмешательства [130][131].
Стоматологические процедуры, как правило, имеют незначительный риск кровотечения, а адекватный локальный гемостаз обеспечивается легко. Поэтому большинство стоматологических процедур могут быть выполнены в амбулаторных условиях без перерыва в приеме ПОАК (или с однократным пропуском дозы), и с применением специфических местных гемостатических средств (окисленная целлюлоза, рассасывающаяся желатиновая губка, швы, жидкость для полоскания рта с транексамовой кислотой или компрессионная марля).
Возобновление приема ПОАК после хирургического вмешательства. Как правило, терапию ПОАК можно возобновить через 6–8 ч после вмешательства, при условии достижения адекватного гемостаза. В случае, если риск кровотечения при приеме полной дозы антикоагулянта превышает риск ВТЭО, возобновление приема препарата можно отложить до >48–72 ч после процедуры, при этом безопасным считается использование профилактической послеоперационной тромбопрофилактики с гепарином до возобновления полной дозы ПОАК [132]. Послеоперационное введение гепарина также следует рассмотреть у пациентов, которые не могут принимать пероральные препараты. Применение сниженной дозы ПОАК в послеоперационном периоде не рекомендуется [6].
Комбинированная антитромботическая терапия (антитромбоцитарная и антикоагулянтная). Двойную антитромботическую терапию следует использовать у большинства пациентов с ФП, ЧКВ [133]. Плановое оперативное вмешательство следует отложить до момента, когда антитромбоцитарная терапия может быть безопасно прекращена (6 мес. после планового ЧКВ или через 12 мес. после ЧКВ вследствие ОКС) [132]. Периоперационное применение ПОАК проводится в соответствии с действующими рекомендациями (табл. 17) [6]. В случае неотложного вмешательства с высоким риском кровотечения могут быть использованы хирургические методы по остановке кровотечения и/или отмена антикоагулянтной терапии. У пациентов, получающих комбинированную терапию по другим показаниям (например, ТИАК и ФП), согласно результатам недавних исследований, антитромбоцитарная терапия может быть безопасно прекращена перед несердечной операцией [134]. У пациентов, получающих низкие дозы ривароксабана в рамках стратегии защиты сосудов, его прием следует приостановить не менее чем за 24 ч до операции и возобновить в зависимости от риска послеоперационного кровотечения.
5.2.3. Периоперационная тромбопрофилактика
Развитие периоперационных ВТЭО является маркером повышенного риска смерти, поэтому тщательная оценка риска их развития перед хирургическим вмешательством необходима для выявления пациентов, которым может быть полезна периоперационная тромбопрофилактика (табл. 18). Выделяют ФР ВТЭО, связанные с операцией (например, тип вмешательства и вероятность послеоперационной иммобилизации), и факторы, связанные с индивидуальными особенностями пациента. Для неортопедических хирургических пациентов с низким риском ВТЭО рекомендуются механические методы профилактики (градуированные компрессионные чулки, прерывистая пневматическая компрессия или венозный ножной насос) вместо фармакологической профилактики или отсутствия профилактики. Пациенты с ССЗ (например, с недавно перенесенным ИМ или ХСН) имеют повышенный риск развития ВТЭО в периоперационном периоде [138]. Для стратификации риска была разработана шкала Caprini [139], которая показала свою эффективность у больных хирургического профиля.
Тромбопрофилактику следует рассмотреть в случае, если пациент соответствует среднему (5–8 баллов) и высокому риску (≥9 баллов). Тромбопрофилактику следует начинать в стационаре за 12 ч до несердечной операции и возобновлять после окончания вмешательства в зависимости от индивидуального риска кровотечения. В большинстве случаев тромбопрофилактику следует продолжать до того момента, когда пациент полностью восстановит свою подвижность, или до момента выписки из стационара (обычно до 10 дней). Продленная фармакологическая профилактика ВТЭО большинству неортопедических хирургических пациентов после выписки не рекомендуется.
Несмотря на то, что данных о тромбопрофилактике после онкологических операций (в частности, обширных абдоминальных и/или тазовых операций) недостаточно, представляется целесообразным увеличение продолжительности лечения с предпочтительным использованием НМГ в течение 3–4 нед. [6]. При решении вопросов о профилактике у лиц, для которых валидность шкалы Caprini не подтверждена (например, ортопедическая хирургия), следует основываться на оценке ФР, связанных с пациентом и процедурой. При этом самым сильным прогностическим ФР является анамнез ВТЭО [140]. Для особых клинических ситуаций и специфических популяций (например, нейрохирургия, пожилой возраст, ожирение) доступны конкретные практические разделы в рекомендациях для соответствующих категорий пациентов.
Крупные исследования 3 и 4 фаз, сравнивавшие ПОАК с НМГ, показали сходные результаты в отношении эффективности и безопасности этих препаратов после обширных ортопедических операций [141]. Обычный период времени для профилактики тромбообразования после эндопротезирования коленного и тазобедренного суставов составляет до 14 и 35 дней, соответственно.
Программа ухода за пациентами после оперативных вмешательств должна быть комплексной и включать послеоперационную мобилизацию, доступность рекомендательных материалов по профилактике (в т. ч. и в электронном виде), обучающие занятия по ежедневному использованию тромбопрофилактики, т. к. они показали свою эффективность в снижении риска послеоперационных ВТЭО [142].
5.3. Ингибиторы ренин-ангиотензин-альдостероновой системы
Основные рекомендации по тактике периоперационной терапии блокаторами ренин-ангиотензин-альдостероновой системы (РААС) представлены в таблице 19.
В рамках крупного международного проспективного когортного исследования VISION проанализированы исходы пациентов, получавших ингибиторы ангиотензинпревращающего фермента/антагонисты рецепторов ангиотензина II (иАПФ/АРА) в периоперационном периоде несердечных хирургических вмешательств по сравнению с пациентами, прекратившими приём препаратов. Среди 4802 пациентов, которые принимали исходно иАПФ/АРА, прекращение их приёма в день операции сопровождалось 18%-ным снижением относительного риска комбинированной конечной точки (смерть, инсульт, периоперационное повреждение миокарда). Прекращение приёма иАПФ/АРА также было сопряжено с 20% относительным снижением риска интраоперационной гипотензии, но не было связано с послеоперационной гипотензией [143].
В систематическом обзоре (Cohrane) 2016г, в котором оценивалось влияние иАПФ/АРА на периоперационные события, из 7 включённых РКИ только 2 исследования были посвящены несердечным вмешательствам (всего 36 пациентов с вмешательством на брюшном отделе аорты). В ходе анализа не было найдено доказательств, подтверждающих, что периоперационное применение иАПФ или АРА при хирургических вмешательствах может предотвратить смертность, заболеваемость и осложнения (гипотензия, периоперационные цереброваскулярные осложнения и почечная недостаточность, связанная с операцией на сердце). Маленький объём выборки не позволил провести анализ подгруппы пациентов с несердечными вмешательствами, авторами обзора констатирована необходимость проведения дополнительных РКИ, посвящённых данной проблеме [147].
По данным метаанализа 2018г, включавшего 5 РКИ и 4 когортных исследования, в общей сложности 6022 пациента, которые постоянно принимали иАПФ/АРА до несердечного вмешательства, прекращение/продолжение терапии не было связано с различиями в смертности или больших сердечно-сосудистых событиях. Однако прекращение терапии было асcоциировано со значительно меньшей интраоперационной гипотензией [144].
Важным свойством блокаторов РААС является нефропротекция. В свою очередь, хирургические вмешательства увеличивают риск почечного повреждения, поэтому влияние указанных лекарственных препаратов на почечную функцию в периоперационном периоде также представляет интерес как для исследователей, так и для клиницистов. Тем не менее по результатам когортного исследования с участием 949 пациентов, перенесших хирургические вмешательства на брюшной полости, иАПФ и АРА не продемонстрировали протективного эффекта в отношении развития послеоперационного острого повреждения почек [148]. Безусловно, для определения эффективности и безопасности этих классов лекарственных препаратов в периоперационном периоде необходимы дальнейшие исследования.
Исследования по оценке периоперационного продолжения/прекращения приёма комплекса валсартан+сакубитрил не проводились. При необходимости их использования в периоперационном периоде у пациентов с СН следует проводить тщательный мониторинг, учитывая гипотензию как наиболее часто наблюдаемое нежелательное явление.
5.4. Бета-блокаторы
По результатам Coсhrane обзора c включением 83 РКИ бета-адреноблокаторы не продемонстрировали значимого влияния на общую смертность в первые 30 дней после несердечного вмешательства, однако снижали риск ИМ (меньше на 13 событий на 1000 (ОР 0,72, 95% ДИ: 0,60–0,87), доказательства с низкой достоверностью) и периоперационной ФП и ТП (на 26 случаев на 1000 (ОР 0,41, 95% ДИ: 0,21–0,79), доказательства с низкой достоверностью) [161].
Пациентам, принимающим длительно бета-блокаторы, следует продолжать терапию в периоперационном периоде, поскольку её прекращение ассоциировано с увеличением риска сердечно-сосудистых событий и смерти (табл. 20). Однако необходимо отметить, что данная позиция подтверждена только результатами обсервационных исследований [149–154][168], и отсутствуют РКИ, оценивающие влияние продолжения или прекращения терапии бета-блокаторами в периоперационном периоде на исходы. При продолжении терапии бета-блокаторами может возникнуть необходимость изменения периоперационных доз или отмены препарата для устранения меняющихся клинических обстоятельств, таких как гипотензия, брадикардия, массивная кровопотеря или других [169].
По данным метаанализа с включением 14 исследований (>10 тыс. пациентов) было показано, что инициация терапии бета-блокаторами в течение 24 ч до несердечного вмешательства связана с повышением риска смерти, нефатального инсульта, гипотонии и брадикардии [162]. Назначение бета-блокаторов перед операцией может быть рассмотрено у отдельных пациентов с ИБС или с множественными ФР, а также при высоком риске периоперационной ишемии или ИМ [155][156]. При этом ключевым аспектом является временной период инициации бета-блокаторов по отношению к хирургической операции, в обсервационном анализе с включением 940 пациентов, перенесших сосудистую операцию, меньше сердечно-сосудистых событий отмечено при старте терапии более чем за 1 нед. до операции по сравнению с более коротким периодом (15% vs 27%, соответственно; P<0,001) [8][157].
По данным метаанализа [1] и крупного когортного исследования [160] применение различных бета-блокаторов не выявило значимых отличий между ними по влиянию на общую смертность, ИМ, брадикардию и гипотонию. Кроме различных препаратов изучается также роль пути введения для безопасного применения бета-блокаторов в периоперационном периоде. Например, РКИ с применением трансдермальной формы бисопролола продемонстрировало отсутствие влияния на частоту периоперационной ишемии миокарда и сердечно-сосудистых событий при высокой безопасности, тем не менее субанализ выявил его преимущество по сравнению с плацебо в профилактике периоперационной ФП [164, 170].
Таким образом, целый ряд клинических аспектов требует проведения РКИ и детального анализа, чтобы ответить на вопросы: какие пациенты получают пользу от терапии бета-блокаторов в периоперационном периоде; есть ли классовый эффект или есть предпочтительные препараты с максимальным эффектом; какое оптимальное время инициации терапии в периоперационном периоде; каковы оптимальные дозы и/или гемодинамические цели (включая АД и ЧСС) для терапии бета-блокаторами.
5.5. Гиполипидемические препараты
Статины (ингибиторы 3-гидрокси-3-метилглютарил-коэнзим А редуктазы) применяются в лечении пациентов с ИБС (вторичная профилактика), ФР ее развития (первичная профилактика), а также при атеросклеротическом поражении аорты, сонных и периферических артерий с целью вторичной профилактики. Кроме основного гиполипидемического эффекта, данный класс лекарственных препаратов имеет целый ряд плейотропных эффектов: противовоспалительный, антиагрегантный, антиоксидантный и другие. Плейотропные эффекты в совокупности с основным липидснижающим препятствуют дестабилизации атеросклеротических бляшек, за счёт чего реализуется профилактика неблагоприятных сердечно-сосудистых событий, в т. ч. и в периоперационный период.
В опубликованном в 2015г метаанализе по инициации предоперационной статинотерапии 3 из 16 включённых РКИ (1130 пациентов) были посвящены несердечным вмешательствам [177]. Анализ указанной подгруппы показал значительное снижение показателей смертности (ОР 0,50, 95% ДИ: 0,27–0,91, p=0,02) и ИМ (ОР 0,53, 95% ДИ: 0,37–0,77; p=0,001) среди пациентов, получавших статины. В то же время данная когорта не имела преимущества по частоте развития инсульта, ФП и длительности пребывания в стационаре после несердечного вмешательства. В свою очередь, необходимо подчеркнуть, что РКИ, посвящённые несердечным вмешательствам, характеризовались длительной предоперационной статинотерапией ≥30 дней с её продолжением в послеоперационном периоде (15–30 дней).
В 2018г был опубликован новый систематический обзор и метаанализ с включением уже 35 РКИ, 10 из которых оценивали периоперационную статинотерапию при несердечных вмешательствах (3502 пациента), в частности, в 8 исследованиях при плановой несердечной хирургии и в 2 исследованиях при экстренной абдоминальной хирургии [171]. В отличие от предыдущего, данный метаанализ включал не только РКИ с инициацией статинотерапии, но и те, в которых пациенты уже находились на длительной статинотерапии. Частота послеоперационного ИМ была достоверно ниже у пациентов, рандомизированных на приём статинов. Метарегрессионный анализ не выявил возможных взаимосвязей между длительностью пред- или послеоперационной статинотерапии и клиническими исходами [171].
Безусловно, необходимо отметить результаты крупных когортных исследований, отражающих результаты применения статинов при несердечных вмешательствах в реальной клинической практике.
Крупное проспективное когортное исследование VISION (Vascular events In non-cardiac Surgery patIents cOhort evaluatioN), которое проводилось с 2007 по 2011гг в 8 странах (12 центрах) с участием 15478 пациентов, было нацелено на оценку влияния предоперационной терапии статинами на сердечно-сосудистые события в первые 30 дней после несердечного вмешательства [172]. Анализ результатов продемонстрировал, что предоперационное использование статинов ассоциировано с более низким риском первичного исхода (комбинированная точка: смертность от всех причин, повреждение миокарда или инсульт в течение 30 дней после несердечного вмешательства) (ОР 0,83; 95% ДИ: 0,73–0,95; p=0,007).
Ещё в одном крупном когортном исследовании (ретроспективном) оценивалась роль статинов в профилактике ССО при несердечных вмешательствах у пациентов, ранее перенесших стентирование коронарных артерий. В качестве исходов авторами оценивались большие кардиальные и цереброваскулярные события в течение 30 дней после несердечного вмешательства. По результатам исследования были сделаны выводы, что поддержание терапии статинами при несердечных вмешательствах связано со снижением 30-дневной смертности у пациентов, перенесших ЧКВ, которым ранее были назначены как бета-блокаторы, так и статины [173].
В последние годы опубликованы крупные метаанализы и обзоры, свидетельствующие об увеличении доказательной базы в пользу периоперационной статинотерапии при несердечных вмешательствах (табл. 21). Тем не менее очевидна и необходимость дальнейших исследований, прежде всего направленных на риск-стратификацию, определение оптимальных сроков инициации статинотерапии, ее интенсивности и длительности.
В комбинации со статинами эзетимиб продемонстрировал дополнительное снижение числа сердечно-сосудистых событий в когорте пациентов с хронической болезнью почек (ХБП) (исследование SHARP, Study of the Heart and Renal Protection) [180], аортальным стенозом (исследование SEAS, Simvastatin and Ezetimibe in Aortic Stenosis) [181], а также в крупном исследовании IMPROVE-IT (Improved Reduction of Outcomes: Vytorin Efficacy International Trial) [182] у пациентов, перенесших ОКС. При этом необходимо подчеркнуть подтверждённую безопасность и хорошую переносимость данного препарата. Приведённые данные свидетельствуют о потенциальной эффективности и безопасности применения эзетимиба в периоперационном периоде несердечных вмешательств. В настоящее время отсутствуют крупные РКИ по изучению продолжения терапии или инициации моно- или комбинированной со статинами терапии эзетимибом в периоперационном периоде несердечных вмешательств.
Безопасность инициации терапии эзетимибом перед плановой холецистэктомией продемонстрирована в 1 РКИ с включением 40 пациентов, которые были рандомизированы на 4 группы лечения: симвастатин 80 мг в сут., эзетимиб 10 мг в сут., симвастатин 80 мг+эзетимиб 10 мг в сут. или плацебо. Приём препаратов начинали за 4 нед. (25–30 дней) до операции и заканчивали непосредственно перед хирургическим вмешательством. Симвастатин, эзетимиб и комбинированное лечение снижали связывание липопротеина, содержащего аполипопротеин В, с внеклеточными протеогликанами интимы, что является атеропротективным эффектом и потенциально может объяснить снижение сердечно-сосудистых событий, наблюдаемое в указанных выше РКИ. Нежелательные явления как во время терапии, так и после её завершения зарегистрированы не были [183].
Механизм действия ингибиторов PCSK9 связан со снижением уровня пропротеиновой конвертазы субтилизин-кексина типа 9 (PCSK9) в плазме крови, который становится недоступен для связывания с рецепторами липопротеинов низкой плотности.
Ингибиторы PCSK9 кроме эффективного снижения липопротеинов низкой плотности снижают частоту сердечно-сосудистых событий. Так, метаанализ с включением 13 РКИ продемонстрировал, что алирокумаб значительно уменьшает частоту сердечно-сосудистых событий по сравнению с контрольной группой и снижает общую смертность [184].
РКИ по применению ингибиторов PCSK9 перед несердечными вмешательствами в настоящее время отсутствуют. По данным обсервационного исследования эволокумаб продемонстрировал безопасность при применении в периоперационном периоде сосудистого вмешательства: эволокумаб назначался пациентам с острым нарушением мозгового кровообращения, получавшим максимально переносимые дозы статинов, в среднем за 15 дней до стентирования сонной артерии. Многомерный логистический анализ показал, что терапия с эволокумабом была независимым предиктором отсутствия новых ишемических поражений на диффузионно-взвешенных изображениях по данным магнитно-резонансной визуализации (р=0,029) [185].
Ввиду увеличения числа пациентов, принимающих комбинированную гиполипидемическую терапию, необходимо проведение дополнительных исследований, которые определят целевые группы пациентов и тактику периоперационной липидснижающей терапии.
5.6. Ингибиторы натрий-глюкозного котранспортёра 2-типа
Ингибиторы натрий-глюкозного котранспортёра 2 типа (иНГЛТ2) представляют собой группу сахароснижающих препаратов, механизм действия которых заключается в ингибировании реабсорбции глюкозы в проксимальных извитых почечных канальцах и развитии глюкозурии.
В последние годы значительно расширились показания для применения этой группы препаратов за счёт большого числа крупных рандомизированных контролируемых исследований, продемонстрировавших благоприятное влияние на исходы у пациентов при СН и почечной недостаточности.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) рекомендует временно прекращать приём иНГЛТ2 по крайней мере за 3 дня до запланированной операции, что обусловлено возможностью развития эугликемического диабетического кетоацидоза [186–189]. Провоцирующими факторами для развития данного осложнения являются изменение противодиабетической терапии, модификация диеты и интеркуррентные заболевания [190].
Таблица 13
Фармакокинетические и фармакодинамические характеристики антитромбоцитарных препаратов [6]
АСК | Клопидогрел | Прасугрел | Тикагрелор | Кангрелор | Эптифибатид | Тирофибан | |
Ингибирование | ЦОГ –1 (необратимо) | P2Y12 (необратимо) | P2Y12 (необратимо) | P2Y12 (обратимо) | P2Y12 (обратимо) | GPIIB/IIIa (обратимо) | GPIIB/IIIa (обратимо) |
Применение | перорально | перорально | перорально | перорально | внутривенно | внутривенно | внутривенно |
Время достижения максимальной концентрации | 30 мин — 1 ч | 2 ч (нагрузочная доза 600 мг) | 30 мин (нагрузочная доза 60 мг) | 30 мин (нагрузочная доза 180 мг) | 2 мин | 5 мин | 5 мин |
Пролекарство | нет | да | да | нет | нет | нет | нет |
Биодоступность (%) | ~50 | ~50 | 80 | 36 | 100 | 100 | 100 |
Лекарственные взаимодействия | НПВП (особенно ибупрофен + напроксен) | CYP3A4, CYP3A5 или CYP2C19 ингибиторы или индукторы | CYP3A4/A5 и CYP2B6 ингибиторы | CYP3A4 индукторы или ингибиторы | нет | нет | нет |
Период полувыведения | 20 мин | 30 мин — 1 ч (активный метаболит) | 30 мин — 1 ч (активный метаболит) | 6–12 ч | 3–6 мин | 2,5–2,8 ч | 1,2–2 ч |
Продолжительность действия после последней дозы | 7–10 дней | 3–10 дней | 7–10 дней | 3–5 дней | 1–2 ч | 4 ч | 8 ч |
Почечный клиренс (мл/мин) | не применимо | не применимо | не применимо | не применимо | 58 | ~50 | 65 |
Режим дозирования | 1 раз/сут. | 1 раз/сут. | 1 раз/сут. | 2 раза/сут. | болюсно, инфузия | болюсно, инфузия | болюсно, инфузия |
Сокращения: АСК — ацетилсалициловая кислота, НПВП — нестероидные противовоспалительные препараты, ЦОГ — циклооксигеназа.
Таблица 14
Рекомендации по использованию антитромбоцитарных препаратов у пациентов, нуждающихся в несердечном хирургическом вмешательстве [6]
Рекомендации | Класс | Уровень | Ссылка |
Плановое несердечное хирургическое вмешательство рекомендуется отложить до 6 мес. от момента выполнения планового ЧКВ и до 12 мес. после эпизода ОКС. | I | A | [113] |
После планового ЧКВ рекомендовано по возможности отложить несердечное хирургическое вмешательство до тех пор, пока длительность приема ДАТТ не достигнет как минимум 1 мес. | I | B | [114] |
Антитромбоцитарная терапия у пациентов с недавним ЧКВ перед несердечным хирургическим вмешательством должна обсуждаться совместно хирургом, анестезиологом-реаниматологом и кардиологом. | I | C | [6] |
У пациентов с высоким ишемическим риском, перенесших недавно ЧКВ (например, у пациентов с ИМпST или у пациентов с ОКСбпST и высоким риском), следует рассмотреть продолжительность ДАТТ не менее 3 мес. перед несердечным хирургическим вмешательством. | IIa | C | [6] |
Продолжение терапии | |||
Пациентам с предшествующим ЧКВ рекомендовано продолжить прием АСК в периоперационном периоде, если позволяет риск кровотечения. | I | B | [105] |
Рекомендуемый временной интервал для прерывания приема препарата перед внесердечным хирургическим вмешательством | |||
Если пациенту показан перерыв в приеме ингибитора P2Y12, рекомендуется прекратить прием тикагрелора за 3–5 дней, клопидогрела за 5 дней и прасугрела за 7 дней перед несердечным хирургическим вмешательством. | I | B | [113] |
В случае, если операция имеет высокий риск кровотечения (например, внутричерепное, спинальное нейрохирургическое или витреоретинальное вмешательство), рекомендовано прерывать прием АСК не менее чем за 7 дней до операции. | I | C | [6] |
У пациентов без анамнеза ЧКВ может быть рассмотрено прекращение приема АСК с целью снижения риска кровотечения по крайней мере за 3 дня до несердечного хирургического вмешательства, если риск кровотечения превышает ишемический риск. | IIb | B | [104] |
Возобновление терапии | |||
Если перед хирургическим вмешательством антитромбоцитарная терапия была прервана, после операции рекомендовано возобновить ее как можно скорее (в течение 48 ч) в соответствии с междисциплинарной оценкой риска. | I | C | [6] |
Сокращения: АСК — ацетилсалициловая кислота, ДАТТ — двойная антитромбоцитарная терапия, ИМпST — инфаркт миокарда с подъемом сегмента ST, ОКС — острый коронарный синдром, ОКСбпST — острый коронарный синдром без подъема сегмента ST, ЧКВ — чрескожное коронарное вмешательство.
Таблица 15
Риск кровотечения в зависимости от типа несердечного хирургического вмешательства [6]
Операции с минимальным риском кровотечения | Операции с низким риском кровотечения | Операции с высоким риском кровотечения |
• Хирургическое лечение катаракты и глаукомы • Стоматологические процедуры: удаление (1–3 зуба), пародонтальная хирургия, установка имплантов, эндодонтические процедуры (депульпирование), субдесневая чистка • Эндоскопия без биопсии или резекции • Поверхностная хирургия (например, вскрытие абсцесса, небольшие разрезы кожи/биопсия) | • Абдоминальная хирургия: холецистэктомия, грыжесечение, резекция толстой кишки • Грудная хирургия • Сложные стоматологические процедуры (удаление >3 зубов) • Эндоскопия с простой биопсией • Гастроскопия или колоноскопия с простой биопсией • Процедуры с использованием игл большого диаметра (например, биопсия костного мозга или лимфатических узлов) • Офтальмологическая хирургия (за исключением катаракты) • Малая ортопедическая хирургия (артроскопия стопы или кисти) | • Абдоминальная хирургия с биопсией печени, экстракорпоральной ударно-волновой литотрипсией • Обширная хирургия рака (например, поджелудочной железы, печени) • Нейроаксиальная (спинальная или эпидуральная) анестезия • Нейрохирургия (внутричерепная, спинальная) • Обширные ортопедические операции • Процедуры с биопсией васкуляризированных органов (почки или простаты) • Реконструктивная пластическая хирургия • Специфические вмешательства (полипэктомия толстой кишки, люмбальная пункция, эндоваскулярное лечение аневризмы) • Торакальная хирургия, резекция легкого • Урологические вмешательства (простатэктомия, резекция опухоли мочевого пузыря) • Сосудистая хирургия (например, лечение аневризмы брюшной аорты, сосудистое шунтирование) |
Таблица 16
Фармакокинетические и фармакодинамические характеристики пероральных антикоагулянтов [6]
Варфарин | Фенпрокумон | Апиксабан | Дабигатран | Эдоксабан | Ривароксабан | |
Ингибирование | VKORC1 | VKORC1 | FXa | FIIa | FXa | FXa |
Применение | перорально | перорально | перорально | перорально | перорально | перорально |
Время достижения максимальной концентрации | 2–6 ч | 1,52 ч | 3–4 ч | 1,25–3 ч | 1–2 ч | 2–4 ч |
Пролекарство | нет | нет | нет | да | нет | нет |
Биодоступность (%) | >95 | 100 | 50 | 6,5 | 62 | 80–100 |
Лекарственные взаимодействия | CYP2C9, CYP2C19, CYP2C8, CYP2C18, CYP1A2, CYP3A4, Витамин К | CYP2C9, CYP2C8, Витамин К | ингибиторы или индукторы CYP3A4, ингибиторы или индукторы P-гликопротеина | ингибиторы или индукторы P-гликопротеина | ингибиторы P-гликопротеина | ингибиторы или индукторы CYP3A4, ингибиторы или индукторы P-гликопротеина |
Период полувыведения | 36–48 ч | ~100 ч | 12 ч | 12–14 ч | 6–11 ч | 7–11 ч (11–13 ч у пожилых) |
Продолжительность действия после последней дозы | ~5 дней | ~7 дней | 24 ч | 24 ч | 24 ч | 24 ч |
Почечный клиренс (мл/мин) | не применимо | не применимо | 27 | 85 | 37–50 | 33 |
Режим дозирования | скорректировать согласно МНО | скорректировать согласно МНО | 2 раза/сут. | 2 раза/сут. | 1 раз/сут. | 1–2 раза/сут. |
Сокращения: МНО — международное нормализованное отношение, VKORC1 — витамин К эпоксидредуктаза.
Таблица 17
Рекомендации по прерыванию и возобновлению приема антикоагулянтов у пациентов, перенесших несердечные хирургические вмешательства [6]
Рекомендации | Класс | Уровень | Ссылка |
Прерывание антикоагулянтной терапии | |||
При необходимости неотложного хирургического вмешательства рекомендуется немедленное прекращение терапии ПОАК. | I | C | [6] |
У пациентов, принимающих дабигатран и требующих неотложного хирургического вмешательства, в случае среднего или высокого риска кровотечения следует рассмотреть введение идаруцизумаба. | IIa | B | [124] |
У пациентов, принимающих ПОАК, при вмешательствах с низким или высоким риском кровотечения рекомендуется прерывание антикоагулянтной терапии в соответствии со свойствами ПОАК, функцией почек и риском кровоточивости. | I | B | [135][136] |
В случае выполнения вмешательств с очень высоким риском кровотечения (например, спинальная или эпидуральная анестезия) следует рассмотреть прерывание приема ПОАК на срок до пяти периодов полувыведения и возобновление приема через 24 ч после выполнения операции. | IIa | C | [6] |
В случае отсутствия специфического нейтрализующего препарата для ингибирования эффекта ПОАК следует рассматривать введение концентрата протромбинового комплекса или активированного концентрата протромбинового комплекса. | IIa | C | [6] |
Продолжение терапии | |||
При выполнении операций с минимальным риском кровотечения, а также вмешательств с возможностью хорошего контроля кровотечения, рекомендуется терапию ОАК не прерывать. | I | B | [120–122][137] |
У пациентов с механическими клапанами сердца и высоким хирургическим риском при терапии моста в качестве альтернативы НФГ рекомендуются НМГ. | I | B | [119] |
У пациентов, принимающих ПОАК, выполнение вмешательств с минимальным риском кровотечения рекомендуется в момент минимальной остаточной концентрации (обычно через 12–24 ч после последнего приема, в зависимости от препарата). | I | C | [6] |
Пациентам с механическими клапанами сердца, нуждающимся в несердечном хирургическом вмешательстве, следует рассмотреть терапию моста с применением НФГ или НМГ в случае, если необходимо прерывание приема ОАК, и у пациентов есть: механический аортальный клапан и любой фактор риска тромбоэмболии; механический аортальный клапан старого поколения; или механический митральный или трикуспидальный клапан. | IIa | C | [6] |
Терапия моста при выполнении несердечных хирургических вмешательств не рекомендуется пациентам с низким/умеренным тромботическим риском. | III | B | [115–117][127–129][136] |
Начало/возобновление терапии | |||
В случае, если риск кровотечения при возобновлении приема антикоагулянта в полной дозе перевешивает риск тромботических осложнений, терапия может быть отсрочена до 48–72 ч после процедуры, с использованием послеоперационной тромбопрофилактики до момента, когда возобновление приема антикоагулянта в полной дозе будет безопасным. | IIb | C | [6] |
Использование сниженных доз ПОАК в послеоперационном периоде не рекомендуется. | III | C | [6] |
Сокращения: НМГ — низкомолекулярный гепарин, НФГ — нефракционированный гепарин, ОАК — оральные антикоагулянты, ПОАК — прямые оральные антикоагулянты.
Таблица 18
Рекомендации по тромбопрофилактике [6]
Рекомендации | Класс | Уровень | Ссылка |
Решения о периоперационной тромбопрофилактике при несердечных операциях рекомендуется принимать на основе индивидуального связанного с процедурой риска. | I | A | [140] |
Если тромбопрофилактика необходима, ее тип и продолжительность (НМГ, ПОАК или фондапаринукс) рекомендуется выбрать в зависимости от типа несердечной операции, длительности последующей иммобилизации и факторов, связанных с пациентом. | I | A | [140] |
У пациентов с эндопротезированием коленного или тазобедренного сустава и с низким риском кровотечения следует рассмотреть возможность периоперационной тромбопрофилактики продолжительностью до 14 или 35 дней, соответственно. | IIa | A | [6] |
ПОАК в дозе, рекомендованной для тромбопрофилактики при эндопротезировании коленного и тазобедренного суставов, могут быть рассмотрены как альтернатива лечению НМГ. | IIb | A | [6][141] |
Сокращения: НМГ — низкомолекулярный гепарин, ПОАК — прямые оральные антикоагулянты.
Таблица 19
Рекомендации по периоперационной терапии ингибиторами РААС
Рекомендации | Класс | Уровень | Ссылки |
Рассмотреть продолжение терапии ингибиторами РААС при несердечных вмешательствах у стабильных пациентов с сердечной недостаточностью при тщательном мониторинге. | IIb | C | [6][143] |
Временное прекращение терапии иАПФ и АРА в день выполнения несердечного вмешательства может быть рассмотрено у пациентов без сердечной недостаточности. | IIa | В | [6][143–145] |
Если иАПФ/АРА отменялись в предоперационном периоде, рекомендовано возобновление их приема в послеоперационном периоде, исходя из клинической ситуации. | IIa | C | [145][146] |
Сокращения: АРА — антагонисты рецепторов ангиотензина II, иАПФ — ингибиторы ангиотензинпревращающего фермента, РААС — ренин-ангиотензин-альдостероновая система.
Таблица 20
Рекомендации по периоперационной терапии бета-блокаторами
Рекомендации | Класс | Уровень | Ссылки |
Рекомендовано продолжить периоперационную терапию бета-блокаторами у пациентов, постоянно принимающих эти препараты. | I | B | [149–154] |
Инициация терапии бета-блокаторами перед операцией может быть рассмотрена у пациентов с установленной ИБС или ишемией миокарда. | IIb | B | [8][155–158] |
Инициация терапии бета-блокаторами перед операцией* может быть рассмотрена у пациентов с запланированным хирургическим вмешательством высокого риска, имеющих ≥2 клинических факторов риска по шкале RCRI, для снижения частоты периоперационного инфаркта миокарда. | IIb | А | [8, 149, 153, 155, 156] |
Терапия бета-блокаторами в послеоперационном периоде назначается в зависимости от клинической ситуации. | IIа | B | [153, 159, 160] |
Инициация периоперационной терапии бета-блокаторами без титрации или в течение 24 ч до несердечного вмешательства не рекомендована. | III | B | [153, 161, 162] |
Периоперационная рутинная инициация терапии бета-блокаторами не рекомендована. | III | A | [6, 153, 161, 163–165] |
Примечание: * — инициация терапии предпочтительна по крайней мере за 1 нед. до операции, начиная с низких доз с последующей титрацией для достижения целевой ЧСС в покое 60–70 уд./мин при систолическом АД >100 мм рт.ст. [155, 159, 163, 166, 167].
Сокращения: АД — артериальное давление, ИБС — ишемическая болезнь сердца, ЧСС — частота сердечных сокращений.
Таблица 21
Рекомендации по периоперационной липидснижающей терапии
Рекомендации | Класс | Уровень | Ссылки |
У пациентов, принимающих статины, рекомендовано продолжить терапию в периоперационном периоде. | I | B | [171-176] |
Рассмотреть возможность инициации терапии статинами у пациентов перед выполнением сосудистых операций, при этом лечение следует начинать не позднее, чем за 2 нед. до предполагаемой даты операции. | IIa | B | [171][177-179] |
У пациентов при наличии показаний к применению статинов рассмотреть возможность периоперационной инициации статинотерапии. | IIa | C | [6] |
Отдельные заболевания
6.1. Ишемическая болезнь сердца
6.1.1. Неинвазивная диагностика ИБС
Рекомендации по тактике периоперационной неинвазивной диагностики ИБС суммированы в таблице 22.
В метаанализе при оценке роли дооперационных стресс-тестов при несердечных операциях [11] не выявлено различий в риске 30-дневной смертности при сравнении пациентов с проведением стресс-тестов и без них. Однако эти данные были получены при анализе результатов только 6 рандомизированных исследований из 79 проанализированных, что вызывает сомнение в адекватности отбора источников. Дело в том, что наибольший вклад в пользу нецелесообразности проведения стресс-тестов (по числу включенных пациентов) внесло исследование DECREASE II [198], относительно которого имеется заключение этического комитета о существенных нарушениях при его проведении. Вполне возможно, что без учета данной работы стратегия включения стресс-тестов в предоперационное обследование показала бы положительное влияние на 30-дневный послеоперационный прогноз. Результаты остальных когортных нерандомизированных исследований чрезвычайно гетерогенны, что не позволяет сделать окончательное заключение о том, приводит ли стресс-тестирование к снижению периоперационной смертности [11]. Например, в одноцентровом ретроспективном исследовании при добавлении неинвазивных стресс-тестов к оценке риска с помощью шкалы RCRI и функционального статуса отмечено только незначительное увеличение предсказательного значения развития периоперационных осложнений и 1-годичной смертности [199]. С другой стороны, результаты неинвазивных тестов при выявлении ишемии миокарда послужили основанием для проведения инвазивной КГ и проведения реваскуляризации миокарда (ЧКВ), что вполне могло снизить частоту периоперационных осложнений и улучшить годовой прогноз [199]. Также в исследовании Valle JA, et al. [200] среди пациентов, подвергающихся несердечным операциям, отмечена существенная вариабельность проведения стресс-тестов. При этом в клиниках с более частым проведением стресс-тестов не отмечено снижения числа послеоперационных кардиоваскулярных осложнений. Однако данный анализ имеет существенные ограничения: во-первых, в исследование были включены только пациенты после проведенной реваскуляризации миокарда (ЧКВ). Во-вторых, нет данных о виде проведенных стресс-тестов, частоте положительных результатов и их корреляции с результатами несердечных операций. В-третьих, нет также сведений о возможных изменениях тактики лечения по результатам проведения стресс-тестов. Все эти ограничения заставляют с осторожностью относиться к возможности применить эти результаты ко всей когорте пациентов перед несердечными операциями.
Действительно, влияние контингента обследованных пациентов хорошо демонстрирует исследование Wijeysundera DN, et al. [197] в популяционной когорте пациентов, оценивших влияние неинвазивных тестов на смертность в течение года после несердечных операций. Проведение стресс-тестов позволило снизить годовую смертность в целом по группе (ОР 0,92; 95% ДИ: 0,86–0,99; р=0,03). При анализе по подгруппам в зависимости от исходного RCRI индекса оказалось, что проведение тестирования повышало риск смерти у пациентов с низким риском (RCRI 0; ОР 1,35) и снижало при промежуточном (RCRI 1–2; ОР 0,92) и высоком риске кардиальных осложнений (RCRI 3–6 баллов; ОР 0,80) [197].
По-видимому, не стоит у пациентов без явной кардиальной патологии и явлений системного атеросклероза (операции на аорте и артериальных сосудистых бассейнах) стремиться проводить полноценную диагностику обструктивных поражений коронарных артерий. Достаточно провести кардиопульмональный тест, чтобы объективизировать возможность выполнения пациентами установленного порога нагрузки. Такой подход широко применяется в Великобритании, где разработаны подробные рекомендации [196] и постоянно возрастает число клиник, использующих такой метод предоперационной оценки.
Другой возможностью неинвазивной оценки пациентов является проведение мультиспиральной компьютерной томографии (МСКТ) коронарных артерий. Метаанализ 11 исследований показал, что риск периоперационных кардиоваскулярных событий (кардиальная смерть, нефатальный ИМ, застойная СН или гемодинамически значимая желудочковая аритмия или полная АВ блокада) возрастал при нарастании тяжести и распространенности поражения коронарных артерий. При отсутствии поражения коронарных артерий неблагоприятные события развились в 2,0% случаев, при необструктивных поражениях — в 4,1%; при однососудистом обструктивном поражении — в 7,1%; при многососудистом — в 23,1%. Также увеличение кальциевого индекса было ассоциировано с повышением частоты периоперационных осложнений (при кальциевом индексе ≥100 ОР составило 5,1; при ≥1000 — ОР 10,4). В исследовании VISION CT-study отмечено существенное завышение риска по данным предоперационной МСКТ коронарных артерий [194]. Это потенциально может приводить либо к отказу от несердечной операции, либо к необоснованному дообследованию пациента (например, проведение инвазивной коронароангиографии). Однако такие результаты могут объясняться включением в исследование пациентов с исходно низким клиническим риском операций (в когорте обследованных >75% пациентов имели значения RCRI ≤1). По-видимому, проведение МСКТ коронарных артерий имеет смысл только у пациентов с промежуточным и высоким риском по шкале RCRI, как предлагают авторы метаанализа [193]. Кроме того, как показало субисследование VISION-CTA, проведение не только МСКТ коронарных артерий, но и стресс-теста со сцинтиграфией миокарда позволило достичь улучшения прогнозирования периоперационных осложнений: чувствительность составила 100%, специфичность — 72,7%, положительное предсказательное значение — 50%, а отрицательное — 100% [195].
6.1.2. Инвазивная коронарная ангиография
ИБС может присутствовать у значительного числа пациентов, нуждающихся в несердечных операциях, при этом показания к предоперационной мультиспиральной или инвазивной КГ и реваскуляризации миокарда аналогичны таковым в нехирургических условиях [107][108][203]. По данным предоперационного обследования следует выделять группу пациентов, которым проведение инвазивной КГ оправдано, т. к. у них высока вероятность наличия гемодинамически значимого стеноза коронарных артерий, требующего реваскуляризации (табл. 23). В ином случае проведение инвазивной КГ лишь увеличивает временные и экономические затраты на предоперационное обследование.
Следует учесть, что ОКС в периоперационном периоде часто развивается по второму типу — на фоне мало- или неизмененных коронарных артерий. При наличии умеренного коронарного атеросклероза и подбора антиангинального лечения со стабилизацией пациента на уровне средней или высокой толерантности к нагрузке реваскуляризация не показана [204].
Сложным и до конца не решённым остаётся вопрос выполнения коронарной ангиографии в послеоперационном периоде несердечных вмешательств при развитии МП. Рутинная инвазивная коронарная ангиография при МП вряд ли принесет пользу, но у пациентов с высоким риском развития неблагоприятных событий является необходимой. Оптимальные сроки КГ в послеоперационном периоде не определены и обсуждаются мультидисциплинарной командой специалистов с учетом клинического контекста, пика вч-тропонина, наличия продолжающейся ишемии и риска кровотечения [65].
Проведение инвазивной КГ перед несердечным хирургическим вмешательством считается целесообразным:
— при высоком риске развития ССО в ходе хирургического вмешательства, на основании предшествующих неинвазивных тестов;
— рефрактерной или нестабильной СК;
— сомнительных результатах предшествующих нагрузочных тестов перед оперативным вмешательством высокого и промежуточного риска;
— перед проведением экстренных и срочных хирургических вмешательств у пациентов в первые 30 дней от развития ИМ;
— развитии ИМ в ходе хирургического вмешательства.
6.1.3. Реваскуляризация миокарда
Несмотря на то, что вопрос о целесообразности проведения превентивной реваскуляризации миокарда стоит в конце цепочки оценки и коррекции риска, но именно от ответа на него — показана ли реваскуляризация миокарда перед несердечными операциями — зависит весь алгоритм предоперационной оценки. Если сделать вывод о том, что она неэффективна (независимо от степени тяжести поражения коронарного русла), то необходимости проводить обследование на выявление скрытой ишемии миокарда нет.
Эксперты ЕОК отмечают, что затруднительно дать однозначные рекомендации по поводу профилактической реваскуляризации миокарда у пациентов с бессимптомно протекающей или стабильной ИБС, т. к. большая часть данных получена из ретроспективных исследований и регистров [18]. Из нескольких рандомизированных исследований за основу приняты результаты исследования CARP [207], в котором сравнивали оптимальную медикаментозную терапию с реваскуляризацией (АКШ или ЧКВ) у пациентов со стабильной ИБС перед обширными сосудистыми вмешательствами. В течение 2,7 лет после начала исследований различий в смертности или периоперационном ИМ не наблюдалось. Хотя, казалось бы, результаты исследования CARP говорят в пользу того, что систематическая профилактическая реваскуляризация миокарда перед сосудистыми вмешательствами не улучшает исход для стабильных пациентов, у данного исследования имеются существенные ограничения (включение пациентов низкого риска, исключение пациентов с поражением ствола левой коронарной артерии) [208].
В то же время опубликованы результаты более поздних проспективных рандомизированных исследований [201][205], в которых у пациентов перед выполнением сосудистых операций было показано преимущество стратегии с рутинным проведением КГ и при необходимости — последующей реваскуляризации миокарда. При такой стратегии прослеживалось снижение частоты серьезных периоперационных госпитальных осложнений и улучшение долгосрочных исходов, что отмечено и в отечественных исследованиях [206][209].
При анализе результатов двух клиник с разными стратегиями снижения риска кардиальных осложнений при сосудистых операциях отмечено, что в клинике с проведением рутинной коронароангиографии и при необходимости превентивной реваскуляризации миокарда меньше был уровень периоперационной летальности и число периоперационных ИМ по сравнению с клиникой, где предоперационное обследование ограничивалось записью ЭКГ, осмотром терапевта (или кардиолога) и продолжением получаемой пациентом стандартной терапии [209].
В исследовании Алекяна Б. Г. и соавт. [206] было показано, что у 79,9% пациентов с атеросклерозом аорты и периферических артерий выявляется поражение как минимум одной коронарной артерии >50%, при этом 368 (66,4%) из них не имели клинических проявлений. У 316 (57,0%) пациентов по решению мультидисциплинарной Сердечной команды были выполнены операции реваскуляризации миокарда: у 21 (6,7%) — коронарное шунтирование, а у 295 (50,3%) — ЧКВ. В результате выполненных 923 (564 эндоваскулярных и 359 хирургических) операций ИМ на госпитальном этапе не был выявлен ни у одного из пациентов.
Несмотря на эти результаты, эксперты считают, что убедительных научных данных в пользу превентивной реваскуляризации миокарда пока недостаточно [210]. У пациентов с доказанной ИБС (наличие гемодинамически значимого поражения коронарных артерий), подвергающихся несердечным операциям высокого риска, решение о необходимости и сроках проведения превентивной реваскуляризации миокарда целесообразно принимать в рамках мультидисциплинарного консилиума в составе анестезиолога, кардиолога и хирурга. При необходимости состав этого консилиума может быть расширен с включением специалистов других специальностей (терапевт, пульмонолог, геронтолог и т. д.). Такой подход является эффективной и безопасной стратегией лечения пациентов с патологией аорты и периферических артерий атеросклеротического генеза и сопутствующей ИБС. Суммированные на основе доказательности рекомендации по реваскуляризации миокарда при планировании несердечной операции представлены в таблице 24.
6.2. Артериальная гипертензия
В общей популяции установлена линейная взаимосвязь между артериальной гипертензией (АГ) и ССР, однако эти данные полностью не экстраполируются на периоперационный период. Авторы систематического обзора и метаанализа 30 наблюдательных исследований, в которых проводилась оценка влияния АГ на риск ССО в течение первых 30 дней после вмешательства, пришли к выводу, что АД при поступлении <180/110 мм рт.ст. не ассоциировано с неблагоприятным прогнозом [217]. Таким образом, при 1 и 2 степени АГ польза от отсрочки или отмены вмешательства практически отсутствует, в то же время при уровне АД >180/110 мм рт.ст. целесообразно отложить оперативное вмешательство за исключением экстренных ситуаций. В свою очередь, периоперационная антигипертензивная терапия представляет особый интерес не только в контексте эффективности и безопасности для пациента, но и главным образом в оценке влияния на прогноз после вмешательства (табл. 25).
Какой же уровень АД является оптимальным в периоперационном периоде? Достаточной доказательной базы для однозначного ответа в настоящее время не получено.
В 2019г опубликован консенсус "Perioperative Quality Initiative consensus statement on postoperative blood pressure, risk and outcomes for elective surgery", в котором экспертами сформулированы следующие практические рекомендации по контролю АД в периоперационном периоде [218]:
- Целевой диапазон послеоперационного уровня АД должен определяться индивидуально на основе его базового уровня в предоперационном периоде и клинического статуса.
- Клиническая оценка должна проводиться как при высоком, так и при низком уровнях послеоперационного АД. Триггерные значения АД должны индуцировать своевременную оценку в случаях, когда АД имеет тенденцию к снижению или повышению.
Поддержание систолического АД >90 и <160 мм рт.ст. рассматривается как разумная терапевтическая цель для широкого круга пациентов в послеоперационном периоде с нормальным исходным уровнем АД. Эти цели должны быть адаптированы для пациентов с исходно изменёнными значениями (например, систолическое давление >140 или <100 мм рт.ст.), данные наблюдений предполагают, что интраоперационное систолическое АД >70% от базового предоперационного уровня ассоциировано с меньшим риском. Другие цели могут быть выбраны в зависимости от сопутствующих заболеваний и клинического статуса, например, после сосудистых и нейрохирургических вмешательств.
Экспертами предложены следующие триггерные значения для оценки АД: уровень систолического АД <100 мм рт.ст. (или <75% от базового уровня) или >160 мм рт.ст. (или >140% от исходного уровня, в зависимости от того, что ниже). Эти триггерные значения могут быть дополнительно адаптированы к клинической ситуации.
- Частота контроля уровня АД определяется состоянием пациента и клиническим статусом. Стандартная практика для большинства пациентов предполагает периодическое измерение жизненно важных функций каждые 4–6 ч.
- Прицельный прикроватный мониторинг следует проводить в ответ на послеоперационную гипотензию/гипертензию для того, чтобы определить этиологию, выбрать соответствующее лечение и определить тактику.
В то же время представляется актуальной оценка кардиологом периоперационного риска, ассоциированного как с типом несердечного вмешательства (низкого, среднего или высокого риска развития кардиальных осложнений), так и с клиническими ФР (модифицируемый индекс кардиального риска — RCRI). Действительно, гетерогенность популяции пациентов, разнородность выполняемых несердечных вмешательств затрудняет определение единого целевого уровня как в интра-, так и послеоперационном периодах. У пациентов, подвергшихся абдоминальным хирургическим вмешательствам, было продемонстрировано преимущество стратегии интраоперационной терапии с поддержанием АД в пределах 10-процентной разницы с предоперационным уровнем офисного систолического АД. Данный подход сопровождался снижением риска послеоперационной дисфункции органов, при этом не было получено значимых доказательств преимущества того или иного класса антигипертензивных препаратов [213].
Тем не менее целый ряд исследований посвящен оценке пользы и риска применения разных классов антигипертензивных препаратов в периоперационном периоде несердечных вмешательств. По ряду литературных данных, использование иАПФ или АРА связано с повышенным риском послеоперационной острой почечной недостаточности. Предполагалось, что для уменьшения риска необходимо приостанавливать прием этих классов препаратов в периоперационном периоде. Для оценки влияния терапии иАПФ и сартанами на частоту развития острой почечной недостаточности было проведено проспективное когортное исследование с включением 949 пациентов, подвергшихся большим вмешательствам на желудочно-кишечном тракте и/или печени, из 160 центров Великобритании и Ирландии. Из этой популяции 573 (60,4%) пациента получали иАПФ или АРА в периоперационном периоде. По результатам не было выявлено различий в распространенности острой почечной недостаточности между пациентами, получавшими иАПФ/сартаны и без данной терапии. иАПФ и АРА не продемонстрировали протективного эффекта в отношении развития послеоперационного острого почечного повреждения (ОПП) [148].
Кроме того, предоперационное прекращение приема блокаторов РААС было поддержано результатами недавнего проспективного когортного исследования в гетерогенной группе пациентов: отмена иАПФ/сартанов за 24 ч до вмешательства была ассоциирована со значимым снижением сердечно-сосудистых событий и смертности в течение 30 дней после вмешательства, что нашло свое отражение в рекомендациях [143][147].
Периоперационное применение другого класса антигипертензивных препаратов — бета-блокаторов было предметом многочисленных исследований и научных дискуссий в течение последних 7–10 лет. По результатам Coсhrane обзора c включением 83 РКИ бета-адреноблокаторы не продемонстрировали значимого влияния на общую смертность в первые 30-дней после несердечного вмешательства, однако снижали риск ИМ и периоперационной ФП и ТП [161].
В то же время установлено, что интраоперационная гипотензия на 30% повышает риск развития 30-дневной смертности, на 60% других неблагоприятных событий, особенно МП (67%) и острой дисфункции почек (39%) [219].
Таким образом, пациентам не рекомендуется инициация терапии бета-блокаторами в день операции из-за риска развития гипотензии. В то же время пациентам, принимающим бета-адреноблокаторы, абсолютно показано продолжение терапии, т. к. отмена приводит к выраженным колебаниям АД и может провоцировать нарушения сердечного ритма [220].
Возможность инициации терапии бета-блокаторами в периоперационном периоде рассматривается по показаниям и требует подбора эффективной и безопасной дозы. Кроме того, в последние годы обсуждается целесообразность инициации терапии бета-блокаторами с учетом модифицируемого индекса риска: с низким риском (низкий RCRI или неосложненная АГ) бета-блокаторы не рекомендованы, у пациентов с промежуточным риском (средний RCRI, комбинированные ФР или изолированная ИБС) терапия может рассматриваться, в то время как для пациентов с высоким риском (высокий RCRI или СН) бета-блокаторы имеют значимое преимущество по снижению смертности [220].
Инициация терапии другими классами антигипертензивных лекарственных препаратов (альфа-блокаторы, антагонисты кальция) не рекомендована для профилактики ССО. Крупное международное исследование с участием 10010 пациентов продемонстрировало, что периоперационное назначение клонидина сопровождалось увеличением риска клинически значимой гипотензии и брадикардии [221].
Таким образом, целый ряд исследований подтверждает, что периоперационная гипотензия ассоциирована с неблагоприятными сердечно-сосудистыми событиями. В случае наличия показаний для назначения иАПФ, бета-блокаторов (ИБС, ХСН) необходима титрация дозы с оценкой эффективности и безопасности.
Периоперационная антигипертензивная терапия — сложная проблема, требующая взвешенной оценки пользы и риска. Безусловно, необходимы дополнительные исследования и мультидисциплинарный подход, предполагающий обсуждение тактики кардиологами, хирургами, анестезиологами и другими специалистами, вовлеченными в процесс лечения конкретного пациента.
6.3. Сердечная недостаточность
Наличие у пациента с планирующимся несердечным хирургическим вмешательством проявлений ХСН требует от клинициста оценки риска с необходимым диагностическим алгоритмом, определения прогноза и лечебной тактики, направленной на компенсацию ХСН и профилактику периоперационных осложнений (табл. 26). У пациентов с декомпенсированной СН не рекомендовано выполнение плановых несердечных операций [214].
Исследование крупной базы данных США по госпитализации (n=21560996) выявило СН у 4,9% (n=1063405) госпитализированных по поводу несердечных хирургических вмешательств. Внутрибольничная периоперационная летальность была чаще среди пациентов с любым диагнозом СН по сравнению с лицами без СН — 4,8% vs 0,78% (P<0,001), а связь между СН и смертностью была наибольшей в небольших больницах. Смертность при острой СН без ХСН составила 8,0%. Среди пациентов с ХСН в периоперационном периоде смертность была выше у пациентов с острой декомпенсацией по сравнению со стабильной ХСН (7,8% vs 3,9%, P<0,001). Кроме того, было установлено, что СН ассоциировалась с периоперационной смертностью при всех основных типах хирургических вмешательств, самые высокие показатели смертности отмечались в ортопедической хирургии [229][230].
Канадское когортное исследование, включавшее 38047 пациентов, перенесших несердечные вмешательства, использовало 3 базы данных, поддерживаемые министерством здравоохранения провинции Альберта. В результате сформированы 4 группы сравнения: 1 — пациенты с неишемической этиологией ХСН (n=7700); 2 — с ишемической этиологией ХСН (n=12249), 3 — ИБС без ХСН (n=13786) и 4 — ФП без ХСН (n=4312). Анализ продемонстрировал достоверно более высокую 30-дневную послеоперационную летальность в группах 1, 2, 4 по сравнению с 3 (p=0,0001) [61]. Также в группах ХСН ишемической и неишемической этиологии достоверно чаще отмечались повторные госпитализации в сравнении с группой ИБС без ХСН (1 группа vs 3, p=0,0001; 2 группа vs 3, p=0,001). Во всех 4 когортах послеоперационная 30-дневная летальность после экстренных и срочных операций была достоверно выше, чем после плановых и амбулаторных. Кроме того, продемонстрировано значение сроков выполнения операции относительно постановки диагноза ССЗ. Для обеих групп пациентов с ХСН вмешательство в течение 4 нед. после постановки диагноза ассоциировалось с более высоким уровнем летальности по сравнению с операциями, выполненными в сроки >4 нед. после диагностики ХСН (13,2% vs 7,0% для неишемической ХСН (p=0,0001); 13,9% vs 7,2% для ХСН ишемической этиологии (p=0,0001)). Среди пациентов, перенесших операцию в течение 4 нед. от постановки диагноза ССЗ, в обеих группах с ХСН послеоперационная летальность была в 2 раза выше, чем у пациентов с ИБС [231].
Сходные результаты были ранее опубликованы и по данным крупного американского регистра пациентов старше 65 лет, подвергшихся несердечным вмешательствам. Из 159327 пациентов 29356 были включены в группу ХСН, которая характеризовалась увеличением риска периоперационной летальности на 51% и риска повторной госпитализации на 30% по сравнению с группой ИБС [232].
Таким образом, СН является важным предиктором развития периоперационных осложнений и повышает риск повторных госпитализаций. Особый интерес представляет влияние систолической и диастолической дисфункции ЛЖ на прогноз при выполнении несердечных вмешательств, в свою очередь, имеющиеся по этой проблеме данные противоречивы и дискутабельны.
Так, в ретроспективном исследовании, включавшем 174 пациента с ХСН, которые были стратифицированы по ФВ на 4 группы: >50%, 40–50%, 30–40% и <30%, определялось влияние ФВ на ранние и отдалённые исходы. Выявлены следующие факторы, ассоциированные с неблагоприятными исходами в первые 30 дней после несердечного вмешательства: пожилой возраст (>80 лет), сахарный диабет и значительное снижение ФВ (<30%) [224]. В другом ретроспективном исследовании (n=557) оценивались ранние и отдалённые исходы после несердечных вмешательств у пациентов с ФВ >40% и ≤40%: показатели летальности достоверно не отличались. В свою очередь, коэффициент смертности за 1 год составил 1,71 (95% ДИ: 1,5–2,0) для всей когорты, 2,1 (95% ДИ: 1,7–2,6) у пациентов с ФВ ≤40% и 1,4 (95% ДИ: 1,2–1,8) в группе в ФВ >40% (p<0,01 для всех 3 сравнений) [233].
По результатам систематического обзора и метаанализа, опубликованного в 2016г и включавшего 13 исследований (n=3876), периоперационная диастолическая дисфункция была ассоциирована с отёком лёгких/застойной СН (3 исследования; 996 пациентов), ИМ (3 исследования; 717 пациентов), а также c совокупным исходом неблагоприятных сердечно-сосудистых событий (4 исследования; 1814 пациентов) [234].
В последние годы активно изучаются периоперационные риски в когортах пациентов с ХСН и имплантированными устройствами. В 2015г опубликован систематический обзор, целью которого была оценка исходов при выполнении несердечных хирургических вмешательств стабильным пациентам с имплантированными устройствами вспомогательного кровообращения ЛЖ. В обзор включены 7 исследований (n=161), размер когорты колебался от 8 до 47 пациентов. 30-дневная послеоперационная летальность варьировала от 6,4 до 16,7%, хотя в 4 исследованиях не сообщалось о смертельных случаях. Формальный количественный метаанализ не был выполнен ввиду небольшой выборки и различных оценочных показателей в результатах исследований. Таким образом, несердечные хирургические вмешательства у пациентов с имплантированными устройствами вспомогательного кровообращения представляются относительно безопасными и выполнимыми у ряда пациентов, однако не вызывает сомнения необходимость дополнительных спланированных исследований со стандартным дизайном и параметрами оценки результативности и безопасности выполнения плановых несердечных вмешательств среди данной группы пациентов ХСН [225].
Диагностический алгоритм обследования пациентов с установленной или подозреваемой СН перед несердечными вмешательствами чётко сформулирован экспертами и включает оценку функции ЛЖ с помощью трансторакальной ЭхоКГ и/или определение уровня НУП [6][61][222–224]. Целесообразность применения кардиопульмонального нагрузочного теста (КПНТ) для оценки общей функциональной способности у пациентов с ХСН перед несердечным вмешательством не определена и продолжает активно исследоваться [235][236].
Тактика терапии определяется действующими рекомендациями по лечению пациентов с СН [6][225]. Оптимальная медикаментозная терапия рекомендована для всех пациентов перед несердечными вмешательствами, также перед вмешательством рассматривается вопрос об имплантации устройств кардиоресинхронизирующей терапии или имплантации кардиовертера-дефибриллятора (ИКД) при наличии показаний.
Особое внимание следует уделять балансу жидкости, поскольку часто требуется инфузия большого объема в периоперационном периоде. Инвазивный мониторинг АД с целью получения дополнительных данных во время несердечного вмешательства часто требуется при выполнении операций промежуточного и высокого риска пациентам с СН. Кроме того, динамические переменные, полученные по кривой АД, полезны для проведения целенаправленной управляемой терапии. Использование более инвазивных инструментов, таких как катетеризация правых отделов сердца или чреспищеводная ЭхоКГ, может рассматриваться в индивидуальном порядке [6].
Особенности терапии ингибиторами АПФ и бета-блокаторами в периоперационном периоде подробно изложены в соответствующем Разделе 6.2 "Артериальная гипертензия". Необходимо подчеркнуть важность мониторинга показателей гемодинамики на фоне продолжения терапии бета-блокаторами и блокаторами РААС. В послеоперационном периоде прием препаратов для лечения СН должен быть возобновлен в максимально короткие сроки с учётом клинического состояния.
6.4. Болезни клапанов сердца
Тяжелые заболевания клапанного аппарата сердца являются клиническим предиктором повышенного риска периоперационных кардиальных осложнений для пациентов во время и после несердечных хирургических вмешательств [250].
Основные этапы ведения пациентов с клапанной патологией перед несердечными хирургическими вмешательствами/несердечными операциями:
- Определиться с экстренностью несердечной операции.
- Определиться со степенью тяжести порока, его компенсированностью.
- Выявить наличие осложнений (ХСН, нарушения ритма, тромбоэмболии, легочная гипертензия (ЛГ)).
- Рассчитать риск несердечной операции.
- Определиться с необходимостью оперативной коррекции клапанного порока сердца.
- При наличии показаний к коррекции клапанного порока сердца рассчитать риск кардиохирургического вмешательства.
- Определиться с очередностью оперативного вмешательства.
- Составить предоперационный план профилактики инфекционного эндокардита, профилактики ТЭО и профилактики интраоперационных кровотечений, связанных с приемом АВК, антиагрегантов.
Соблюдение поэтапного ведения пациентов с клапанной патологией перед несердечным хирургическим вмешательством позволит выявить факторы, определяющие риск развития кардиальных осложнений в периоперационном периоде, к которым относятся вид порока клапана и его тяжесть, выраженность ассоциированных нарушений в работе сердечно-сосудистой системы и связанных с ними повреждений внутренних органов [6][83][237][251]. Совокупность указанных факторов указывает на то, что решение вопроса об оперативном лечении должно быть согласовано мультидисциплинарной группой, в которую входят кардиолог (терапевт), анестезиолог и лечащий врач [237][238]. Основываясь на полученных при обследовании данных, группа определяет предоперационную тактику, включающую необходимое обследование, медикаментозную подготовку, выбор адекватного метода анестезии и интраоперационного мониторинга (табл. 27).
Диагноз заболевания клапанного аппарата сердца должен быть установлен ранее или во время предоперационного обследования. Если заболевание сердца заподозрено на основании симптомов или сердечных шумов, выслушанных при физикальном обследовании, то эхокардиографическое исследование является обязательным методом, который необходимо выполнить больному перед операцией. Если о приобретенном пороке сердца известно, но при этом давность эхокардиографического исследования более года либо меньше, но за этот период времени с момента последней оценки ЭхоКГ произошло значимое изменение клинического статуса или физикального обследования, также необходимо повторить исследование перед несердечным вмешательством.
Периоперационные осложнения включают в себя развитие [6, 83, 92, 237]:
- ИМ;
- гипотонии;
- СН;
- аритмий;
- летального исхода.
Предикторами повышенного риска несердечной хирургии у пациентов с клапанной патологией являются [6, 92, 237]:
- сниженная ФВ ЛЖ;
- размеры ЛЖ;
- сопутствующие заболевания (т. е. ИБС, сахарный диабет, почечная недостаточность);
- отсутствие периоперационного лечения;
- нарушения ритма (ФП, желудочковая тахикардия (ЖТ) и т. д.);
- экстренное несердечное вмешательство.
У пациентов с клапанной патологией до планового несердечного хирургического вмешательства необходимо оценить вероятность наличия ИБС в следующих случаях [237, 252, 253]:
- наличие болей в грудной клетке или эквивалентов СК;
- наличие симптомов СН, которые ранее отсутствовали, или снижение ФВ ЛЖ;
- ОКС в анамнезе;
- мужчинам старше 40 лет и женщинам в менопаузе перед оперативным лечением клапанного порока необходимо выполнять КГ.
У пациентов, нуждающихся в срочной или экстренной операции, оценка вероятности ИБС не должна задерживать необходимую несердечную операцию [253, 254].
6.4.1. Митральная регургитация
Периоперационный риск
Риск несердечного хирургического вмешательства у пациентов с хронической недостаточностью митрального клапана зависит от этиологии и тяжести митральной регургитации, а также от выраженности нарушения гемодинамики и клинической компенсации больного.
Ведение пациентов с митральной регургитацией
В связи с тем, что пациенты с митральной регургитацией тяжелой степени имеют высокий риск неблагоприятных периоперационных исходов, этим пациентам должна быть выполнена индивидуальная оценка риска по шкалам EUROSCORE II или STS [45, 94, 237, 255, 256]. Также должна быть проведена оценка типа поражения клапана (первичная или вторичная митральная регургитация) и функции ЛЖ. По результатам междисциплинарной командой должен быть решен вопрос о возможности и необходимости оперативной коррекции порока перед несердечным хирургическим вмешательством. У пациентов с недостаточностью митрального клапана на риск несердечных хирургических вмешательств также влияют другие заболевания сердца, например, ИБС, в связи с этим желательно выполнение КГ [6, 7, 237, 247].
Хирургическая коррекция недостаточности митрального клапана (пластика или протезирование) показана предпочтительно до плановой несердечной операции промежуточного или высокого риска в следующих ситуациях (табл. 27, рис. 3):
- симптомная тяжелая хроническая первичная митральная регургитация с ФВ >30%;
- бессимптомная тяжелая митральная регургитация с нарушенной систолической функцией ЛЖ (ФВ <60%) и/или увеличением конечно-систолического размера ЛЖ ≥45 мм [6, 237];
- при наличии симптомной вторичной митральной регургитации от умеренной до тяжелой и при соответствии критериям оценки сердечно-сосудистых исходов чрескожной имплантации MitralClip у пациентов с СН с функциональной митральной регургитацией (Cardiovascular Outcomes Assessment of the MitraClip Percutaneous Therapy for Heart Failure Patients With Functional Mitral Regurgitation), должно быть обсуждено выполнение транскатетерного хирургического лечения перед несердечным хирургическим вмешательством [237, 246].
Тем не менее операция на митральном клапане до несердечной хирургии у этих пациентов не всегда выполнима, т. к. некоторым пациентам показана срочная или экстренная несердечная процедура, у ряда пациентов риск операции на митральном клапане может считаться неприемлемым, кроме того, пациент может отказаться от операции на митральном клапане.
Большинству пациентов с бессимптомным течением тяжелой митральной недостаточности может быть выполнена срочная или плановая несердечная операция с приемлемым риском с адекватным интраоперационным и послеоперационным лечением [237, 248, 257, 258]. Особое внимание необходимо уделять контролю постнагрузки на ЛЖ и балансу жидкости, т. к. эти факторы могут влиять на тяжесть митральной регургитации (особенно функциональной).
Для пациентов с первичной недостаточностью митрального клапана следует предварительно поддерживать или уменьшать преднагрузку на ЛЖ, поддерживать внутрисосудистый объем, избегая при этом перегрузки жидкостью, следует избегать чрезмерной системной постнагрузки. У пациентов с митральной регургитацией следует избегать заметного повышения АД, т. к. они могут увеличить регургитацию на клапане. При наличии СН требуется тщательный подбор дозы диуретиков и снижение постнагрузки для улучшения гемодинамического статуса во время операции [248, 258, 259].
6.4.2. Аортальная регургитация
Периоперационный риск
Риск несердечной хирургии у пациентов с хронической аортальной недостаточностью зависит от тяжести и этиологии порока, степени гемодинамической и клинической компенсации, а также от уровня риска процедуры.
Ведение пациентов с аортальной регургитацией
В связи с тем, что пациенты с аортальной недостаточностью тяжелой степени имеют высокий риск несердечной хирургии, они должны быть выявлены до операции. Этим пациентам должно быть проведено соответствующее лечение, а также выполнена индивидуальная оценка риска перед несердечной операцией. У пациентов с недостаточностью аортального клапана на риск несердечной хирургии также влияют другие заболевания сердца, такие как ИБС [6, 7, 237, 247].
Протезирование или пластика аортального клапана показаны предпочтительно до плановой несердечной операции со средним или высоким риском в следующих ситуациях (рис. 3):
- симптомная тяжелая хроническая аортальная регургитация;
- бессимптомная хроническая аортальная регургитация с ФВ ЛЖ <50% и/или с увеличением конечно-систолического размера ЛЖ ≥50 мм.
В случае расширения корня аорты или восходящего отдела аорты по данным ЭхоКГ, пациентам должна быть выполнена МСКТ грудного и брюшного отделов аорты с контрастированием и ЭКГ синхронизацией.
Тем не менее операция на аортальном клапане до несердечной хирургии у этих пациентов не всегда выполнима, т. к. некоторым пациентам показана срочная или экстренная несердечная процедура, у ряда пациентов риск операции на аортальном клапане может считаться неприемлемым, кроме того, пациент может отказаться от операции на аортальном клапане.
Большинству пациентов с бессимптомным течением тяжелой аортальной недостаточности может быть выполнена срочная или плановая несердечная операция с приемлемым риском, с адекватным интраоперационным и послеоперационным лечением.
Во время несердечной операции пациенту необходимо поддерживать ЧСС, поскольку увеличение общего диастолического времени, связанное с брадикардией, может резко увеличить регургитацию на аортальном клапане, что может вызвать декомпенсацию СН; постнагрузка должна контролироваться; и преднагрузка должна поддерживаться или уменьшаться по мере необходимости для поддержания адекватного внутрисосудистого объема без ускорения перегрузки жидкостью, принимая во внимание увеличенные объемы ЛЖ и его комплаенс. У пациентов с прогрессирующей аортальной регургитацией следует избегать заметного повышения системного АД, поскольку это может привести к уменьшению сердечного выброса. Пациенты с СН и аортальной регургитацией нуждаются в диуретиках и снижении постнагрузки, для оптимизации объема жидкости в организме перед операцией на сердце [258].
6.4.3. Аортальный стеноз
Периоперационный риск
Риск несердечной хирургии у пациентов с аортальным стенозом зависит от тяжести стеноза, наличия симптомов заболевания и сопутствующих ФР (ИБС, сопутствующая митральная недостаточность, ЛГ) [94, 239]. Риск также зависит от вида самой несердечной операции. Небольшие операции под местной анестезией имеют меньший риск [95].
Риск кардиальных осложнений у пациентов со стенозом аортального клапана, перенесших несердечную хирургию, составляет 10–30%. Тяжелый симптомный аортальный стеноз является значительным ФР развития послеоперационного ИМ или СН, а также предиктором 30-дневной и долгосрочной смертности после несердечных хирургических вмешательств [260].
Пациенты с аортальным стенозом умеренной или тяжелой степени имеют склонность к кровотечениям из-за приобретенного синдрома фон Виллебранда, который может увеличить риск, связанный с несердечной хирургией. В некоторых случаях требуется стресс-ЭхоКГ или радионуклидное стресс-тестирование бессимтомным пациентам с тяжелым аортальным стенозом для уточнения его выраженности.
Предоперационное ведение
Плановые хирургические вмешательства умеренного риска с соответствующим интраоперационным мониторингом и послеоперационным гемодинамическим мониторингом (манометрия правых отделов сердца и/или интраоперационная чреспищеводная ЭхоКГ) возможно выполнить пациентам с бессимптомным тяжелым аортальным стенозом с приемлемым риском осложнений [6, 7, 92, 94, 237].
Пациентам с наличием показаний к протезированию аортального клапана по поводу стеноза рекомендовано отложить плановую несердечную операцию [94, 237]. Замена аортального клапана ассоциируется со снижением внутрибольничной и 30-дневной смертности среди пациентов с аортальным стенозом, подлежащих несердечным хирургическим вмешательствам среднего и высокого риска [261]. В случае несердечного вмешательства высокого риска может быть рассмотрено выполнение баллонной вальвулопластики перед несердечным вмешательством [94].
Тем не менее операция на аортальном клапане до несердечной хирургии у этих пациентов не всегда выполнима, т. к. некоторым пациентам показана срочная или экстренная несердечная процедура, у ряда пациентов риск операции на аортальном клапане может считаться неприемлемым, кроме того, пациент может отказаться от операции на аортальном клапане.
В таких ситуациях возможно выполнение несердечной операции с соответствующим поражению клапана периоперационным ведением (мониторинг гемодинамики, лечение) или выполнение в первую очередь ТИАК и/или в некоторых случаях возможно проведение баллонной аортальной вальвулопластики (рис. 4) [6, 7, 237, 244].
Периоперационное ведение
Команда анестезиологов должна знать о наличии и тяжести аортального стеноза и других ФР [7, 92]. Пациентам с тяжелым аортальным стенозом при несердечных операциях при наличии технических возможностей и опыта у персонала может быть обеспечен инвазивный гемодинамический мониторинг (манометрия правых отделов сердца и/или чреспищеводная ЭхоКГ) [247].
Пациентам с лёгкой или умеренной степенью выраженности аортального стеноза при небольших несердечных операциях обычно является достаточным неинвазивный мониторинг ЭКГ, АД и насыщения крови кислородом.
Основные принципы периоперационного ведения больного со стенозом аортального клапана [6, 92, 237, 243, 245]:
- Поддержание нормального синусового ритма с умеренной ЧСС. Поскольку ударный объем через стенозированный клапан относительно фиксирован, брадикардии <40 в 1 мин также следует избегать.
- Необходимо поддерживать адекватный объем и преднагрузку на сердце.
- Снижение системного сосудистого сопротивления вследствие эпидуральной или спинальной анестезией может привести к значительному снижению коронарной перфузии. Системной гипотонии и тахикардии следует избегать, учитывая риск ишемии миокарда, СН и аритмий. Таким образом, методы анестезии должны быть адаптированы для поддержания адекватного системного сосудистого сопротивления.
Эти принципы применяются до и во время хирургического вмешательства, а также в течение 48–72 ч послеоперационного периода, когда могут произойти значительные сдвиги внутрисосудистого объема в зависимости от типа хирургической процедуры.
6.4.4. Митральный стеноз
Предоперационная оценка риска
Бессимптомные пациенты с легким (площадь отверстия >1,5 см2) митральным стенозом и митральным стенозом от умеренного до тяжелого (площадь отверстия ≤1,5 см2) при отсутствии ЛГ (систолическое давление в легочной артерии (СДЛА) <50 мм рт.ст.) и/или ФП не имеют повышенного риска при выполнении несердечных операций [6]. В то же время симптомные пациенты с митральным стенозом при отсутствии адекватного лечения имеют значительный риск осложнений при выполнении несердечных операций.
Бессимптомным пациентам с тяжелой степенью стеноза митрального клапана перед несердечной операцией рекомендовано (рис. 5) [6][237][247]:
- выполнение чрескожной баллонной митральной комиссуротомии при благоприятной анатомии перед проведением плановой несердечной операции среднего или высокого риска;
- пациентам, которым невозможно выполнить чрескожную баллонную митральную комиссуротомию, возможно проведение плановой несердечной операции с соответствующим интраоперационным и послеоперационным гемодинамическим мониторингом и лечением.
Симптомным пациентам с тяжелым митральным стенозом или пациентам с СДЛА >50 мм рт.ст. рекомендовано выполнение коррекции порока митрального клапана перед плановой несердечной операцией при высоком риске несердечного вмешательства [237].
Периоперационное ведение
Пациентам с некорригированным тяжелым стенозом митрального клапана при проведении несердечной операции необходимо соблюдать следующие рекомендации [6][237][247]:
- адекватный контроль сердечного ритма — следует не допускать развития тахикардии, поскольку это может привести к снижению сердечного выброса, увеличению трансмитрального градиента и, возможно, застойным явлениям в легких. У пациентов с ФП частота сокращений желудочков должна хорошо контролироваться до плановой операции;
- тщательный контроль за объемом циркулирующей крови. Необходимо контролировать и поддерживать легочное венозное давление (т. е. давление заклинивания легочной артерии) — необходимое для поддержания адекватного сердечного выброса, но достаточно низкое во избежание развития отека легких. Мониторинг давления в правых отделах сердца имеет важное значение для управления состоянием объема крови;
- поддержание системного сосудистого сопротивления, поскольку внезапное, вызванное лекарственными средствами, снижение системного сосудистого сопротивления может привести к гипотонии;
- избегать выраженных изменений легочного сосудистого сопротивления, т. к. нарастание ЛГ (например, из-за артериальной гипоксемии) может привести к декомпенсации правого желудочка (ПЖ);
- избегать использования эпидуральной и спинальной анестезии, поскольку в условиях низкого сердечного выброса, имеющего фиксированный митральным стенозом характер, вазоплегия может привести к фатальной артериальной гипотонии.
6.4.5. Послеоперационный период
Необходимо выделить следующие ключевые положения в обеспечении раннего послеоперационного периода несердечных вмешательств у пациентов с пороками клапанного аппарата сердца:
— адекватный состоянию больного мониторинг;
— поддержание стабильной гемодинамики, при необходимости продолжение интенсивной терапии синдрома малого сердечного выброса и кардиогенного отека легких;
— предупреждение гиперволемии и перегрузки сердца преднагрузкой;
— достижение эффективной анальгезии;
— предупреждение развития гипотермии.
У пациентов с тяжелыми пороками клапанного аппарата сердца после несердечных вмешательств промежуточного и высокого риска кардиальных осложнений желательно продолжать мониторинг гемодинамики в течение 24 ч после вмешательства. Крайне важно понимать, что вследствие комплексного характера нарушений со стороны сердечно-сосудистой системы, при оценке состояния у этих пациентов недостаточно опираться только на клинические показатели и уровень АД. Интегральными маркерами адекватности гемодинамики в данных случаях служат показатели доставки и потребления кислорода. Об ухудшении состояния свидетельствует снижение сатурации венозной крови <65%, а у пациентов с выраженной дооперационной ХСН — менее исходных значений. В пользу декомпенсации гемодинамики будет говорить уровень лактата >2 ммоль/л и дальнейшее повышение этого показателя. В случае развития декомпенсации должна быть выполнена трансторакальная ЭхоКГ для контроля состояния клапанного аппарата, СДЛА, адекватности преднагрузки, сократимости ЛЖ [226].
При тяжелых пороках клапанного аппарата с высоким риском развития кардиогенного отека легких — митральном стенозе, митральной недостаточности, стенозе аортального клапана и аортальной недостаточности особое внимание следует уделять предупреждению гиперволемии и объемной перегрузки сердца и малого круга. О развитии такой неблагоприятной ситуации будет свидетельствовать появление признаков интерстициального застоя на рентгенограмме легких и ЭхоКГ-признаки, такие как рост давления в легочной артерии, увеличение степени регургитации на трехстворчатом и митральном клапанах, увеличение конечно-диастолического объема ЛЖ. В послеоперационном периоде необходимо не только стремиться к поддержанию нулевого жидкостного баланса, но и попытаться компенсировать гиперволемию, допущенную на этапе вмешательства. Для решения этой задачи можно использовать постоянную инфузию фуросемида в дозе 1–5 мг/ч.
Метаанализ, выполненный на основе базы данных Cohrane, показал возможность значимого снижения частоты развития ИМ в послеоперационном периоде при использовании эпидуральной анальгезии в сравнении с внутривенно вводимыми опиоидами.
6.5. Нарушения ритма сердца
Наличие сопутствующих нарушений ритма сердца может повлиять на течение периоперационного периода и особенности реабилитации пациентов, в т. ч. учитывая психологический фактор стресса и возможный вегетативный дисбаланс на фоне хирургического вмешательства.
В плановых ситуациях, когда в ходе предоперационной подготовки выявляются нарушения ритма, не сопровождающиеся нарушением гемодинамики, как правило, хирургическое вмешательство выполняется в установленные сроки. В периоперационном периоде также нередко выявляются бессимптомные аритмии, также, в большинстве случаев, не требующие отмены запланированного хирургического вмешательства. Выявление жизнеугрожающих нарушений ритма требует незамедлительной реакции и быстрого купирования с помощью медикаментозной терапии или электрической кардиоверсии, при этом начало оперативного вмешательства возможно только после устранения аритмии.
Всем пациентам при наличии аритмического анамнеза следует проводить тщательную клиническую оценку жалоб/симптомов, регистрацию ЭКГ, определение уровня электролитов, а при необходимости и других диагностических методов. Прием антиаритмических препаратов обычно не прекращается.
6.5.1. Суправентрикулярные аритмии
Суправентрикулярная экстрасистолия, как правило, не требует терапевтических вмешательств. Из суправентрикулярных тахикардий (СВТ) наиболее важное клиническое значение имеют АВ-узловая тахикардия и АВ тахикардия при синдроме Вольфа-Паркинсона-Уайта (ВПВ). Данные нарушения ритма встречаются в 0,9–3% случаев в общей популяции [262]. Как правило, если подобные симптомные СВТ рецидивируют часто и выявляются до плановой операции, хирургическое вмешательство рекомендуется отложить, и пациенты в большинстве случаев направляются на радиочастотную катетерную аблацию, которая позволяет достичь устойчивого эффекта и прекращения приступов аритмии. Если дебют СВТ происходит в периоперационном периоде, необходимо устранить все возможные факторы, усугубляющие аритмию, такие как дыхательная недостаточность, нарушение электролитного и кислотно-щелочного баланса. Для купирования тахикардии в отдельных случаях может использоваться маневр Вальсальвы и другие вагусные пробы, или внутривенное введение аденозина [263].
В случае часто рецидивирующей СВТ в периоперационном периоде могут быть использованы бета-блокаторы, антагонисты кальция или амиодарон, но с учетом профиля безопасности данных препаратов. При выборе средств для анестезии у пациентов с синдромом ВПВ и высоким риском развития ФП необходимо также учитывать возможность быстрого антеградного АВ проведения с участием дополнительного пути, что может сопровождаться развитием жизнеопасных нарушений ритма, включая фибрилляцию желудочков. Рекомендовано избегать факторов, увеличивающих уровень симпатической активности, таких как тревога и стресс перед операцией, неконтролируемый болевой синдром, стрессовый ответ в ходе интубации и последствия гиповолемии [264]. Из антиаритмических средств следует исключить дигоксин и верапамил и, кроме того, минимизировать назначение вазопрессоров, если это возможно, чтобы избежать ускорения проведения по дополнительному пути и инициации ре-энтри тахикардии. Преимущество имеет плановая эпидуральная анестезия с сегментарной блокадой на различных уровнях, что позволяет достичь стабилизации гемодинамики и адекватного уровня постоперационной аналгезии [265]. При обеспечении общей анестезии тиопентан безопасен, но предпочтительнее использовать пропофол, т. к. он не влияет на рефрактерный период дополнительного пути проведения у пациентов с синдромом ВПВ. Атропин, гликопирролат и кетамин вызывают тахикардию, поэтому их следует избегать. Изофлуран и севофлуран не влияют на проводимость АВ-узла и обеспечивают оптимальный гемодинамический статус. Фентанил также обладает достаточным профилем безопасности и не нарушает стабильность гемодинамики. Векуроний и рокуроний являются кардиостабильными миорелаксантами, которые предпочтительнее панкурония и атракурия [265, 266]. Неостигмин замедляет АВ проводимость, может способствовать ускорению проведения по дополнительному пути и тем самым спровоцировать ФП с высокой частотой желудочкового ответа. В подобной ситуации перспективно применение новых миорелаксантов, таких как цис-атракуриум, мивакуриум, которые имеют лучший профиль безопасности [266]. При нестабильной гемодинамике у пациентов с ФП и быстрым желудочковым ответом с участием дополнительного пути проведения показана немедленная кардиоверсия с мощностью 150–200 Дж (двухфазный дефибриллятор). Необходимо помнить, что в периоперационном периоде даже у бессимптомного пациента с анамнезом синдрома ВПВ могут развиться аритмии, поэтому необходим тщательный контроль клинического статуса и длительный мониторинг [267–270].
6.5.2. ФП
ФП ассоциируется с повышением риска неблагоприятных исходов, главным образом за счет риска тромбоэмболий. Ведение пациентов осуществляется в соответствии с национальными клиническими рекомендациями [271]. Тем не менее достоверно оценить влияние ФП на развитие осложнений в периоперационном периоде не представляется возможным. Пациентам с ФП рекомендовано продолжать ранее назначенную антиаритмическую терапию, с ранним возобновлением ее в послеоперационном периоде [264]. У пациентов с частыми симптомными пароксизмами ФП предпочтительно отсрочить плановое оперативное вмешательство и рассмотреть выполнение радиочастотной аблации ФП с последующим направлением на хирургическое вмешательство через 2–3 мес. В случае выполнения экстренных операций рекомендован контроль ритма и ЧСС с помощью медикаментозной терапии либо выполнение электрической кардиоверсии при условии нестабильной гемодинамики (табл. 28).
Развитие ФП впервые в послеоперационном периоде наиболее часто происходит после выполнения оперативных вмешательств на легких, пищеводе и средостении (12–44%) [272]. В подобных ситуациях есть вероятность более тяжелого течения послеоперационного периода и увеличения длительности госпитализации, в т. ч. пребывания в отделении интенсивной терапии. Профилактическая терапия бета-блокаторами, амиодароном или блокаторами кальциевых каналов может быть рекомендована в отдельных случаях (только у пациентов высокого риска), с предварительной оценкой соотношения "риск/польза", учитывая профиль безопасности и потенциальное лекарственное взаимодействие при назначении антиаритмической терапии. Рекомендации по контролю ритма у пациентов с ФП в послеоперационном периоде не отличаются от общепринятой тактики, когда кардиоверсия выполняется в случае дестабилизации гемодинамики. Кроме того, предпочтение электрической кардиоверсии следует отдавать и в случаях, когда наблюдается плохая переносимость медикаментозной антиаритмической терапии или симптомы ФП сохраняются свыше 48 ч. Тем не менее, согласно данным большинства клинических наблюдений, наиболее часто послеоперационная ФП купируется самостоятельно или на фоне фармакотерапии в течение первых двух суток от начала симптомов.
Ведение пациентов с ТП в периоперационном периоде не отличается от принципов терапии ФП, но нужно помнить, что эффективность катетерной аблации значительно выше и достигает 95–96% при типичном ТП, поэтому предпочтительно устранить аритмию до направления на плановую операцию. В случае экстренных вмешательств кардиоверсия может также потребоваться для купирования устойчивого гемодинамически значимого ТП с последующим контролем ритма с помощью бета-блокаторов и амиодарона. Антикоагулянтная поддержка и сроки ее инициации в периоперационном периоде определяются с учетом индивидуального тромбоэмболического риска (Раздел 5.2).
6.5.3. Желудочковые аритмии
Нет данных, свидетельствующих о том, что наличие изолированных желудочковых экстрасистол или неустойчивой мономорфной ЖТ существенно влияет на исход при выполнении несердечных хирургических вмешательств. Вместе с тем частая желудочковая экстрасистолия (>10–20% от общего числа сокращений) может неблагоприятно влиять на прогноз даже в отсутствии заболеваний сердца [276–278]. Хотя подобных исследований у пациентов, которым предстоят несердечные операции, не существует. В целом лечение желудочковых нарушений ритма должно проводиться по существующим рекомендациям [279].
Клинические проявления желудочковых тахиаритмий могут существенно различаться — от отсутствия жалоб до чувства сердцебиения, дискомфорта в груди, загрудинной боли, удушья, головокружения, пресинкопальных и синкопальных состояний, полной остановки кровообращения. Учащенное сердцебиение, предобморочное состояние/обмороки и семейный анамнез внезапной смерти — три наиболее важных признака, которые требуют тщательного сбора анамнеза и дополнительного обследования.
Рутинное обследование пациентов с подозрением на желудочковые нарушения ритма, помимо стандартного объективного осмотра, аускультации и оценки пульса, включает выполнение ЭКГ в 12-ти отведениях, ЭхоКГ и нагрузочные тесты по показаниям. Кроме того, необходима оценка лабораторных данных с целью исключения обратимых причин нарушений ритма (анемический синдром, дисбаланс электролитов, расстройства тиреоидного обмена и т. д.). Магнитно-резонансную томографию сердца или компьютерную томографию следует рассматривать в качестве диагностического метода у пациентов с желудочковыми аритмиями, если ЭхоКГ не позволяет точно оценить функцию ЛЖ и ПЖ и/или структурные изменения.
Основные принципы назначения медикаментозной антиаритмической терапии при желудочковой эктопии у пациентов без структурной патологии сердца/дисфункции ЛЖ регламентируются действующими клиническими рекомендациями МЗ РФ [279].
Отдельно рассматривается лечение устойчивой ЖТ в различных клинических ситуациях:
Устойчивая мономорфная ЖТ. Вне зависимости от причины, устойчивая мономорфная ЖТ, сопровождающаяся нарушениями гемодинамики, должна быть незамедлительно купирована с помощью электрической кардиоверсии. В случае стабильной гемодинамики может быть рассмотрено внутривенное введение амиодарона. Амиодарон используется также, если при ЖТ с нарушениями гемодинамики электрическая кардиоверсия была неэффективна или не может быть выполнена по каким-либо причинам.
Устойчивая полиморфная ЖТ. При нарушениях гемодинамики устойчивая полиморфная ЖТ должна быть купирована с помощью электрической кардиоверсии. У пациентов с рецидивирующей полиморфной ЖТ для лечения и предупреждения повторных эпизодов должны быть использованы бета-адреноблокаторы, особенно если возможной причиной ЖТ является ишемия миокарда. При отсутствии синдрома удлиненного QT для лечения также может использоваться внутривенное введение амиодарона.
Синдром удлиненного интервала QT. Удлинение интервала QT может быть врожденным (генетическим) или приобретенным. Наиболее грозными проявлениями синдрома удлиненного интервала QT (LQTS) являются полиморфная ЖТ (torsades de pointes), внезапная аритмическая смерть, развитие синкопальных состояний. Наличие на ЭКГ LQTS значительно осложняет периоперационное ведение пациента [280].
Периоперационное ведение пациентов с приобретенным LQTS основывается на устранении возможных триггеров, включая влияние фармакотерапии или немедикаментозных факторов, потенциально способных увеличивать продолжительность QT интервала [280]. Следует корректировать электролитные нарушения в периоперационном периоде, особенно гипокалиемию (рекомендовано поддерживать концентрацию на уровне >4,5 ммоль/л) [281]. Возможно назначение магния сульфата (2 г в/в) с целью укорочения QT интервала и стабилизации мембраны кардиомиоцитов, а также уменьшения риска развития ранней желудочковой экстрасистолии, способной провоцировать Torsades de Pointes у данной группы пациентов. При развитии полиморфной ЖТ необходима экстренная электрическая кардиоверсия. В случае брадизависимой ЖТ у пациентов с LQTS может быть полезна временная кардиостимуляция и применение техники "overdrive pacing" (с частотой стимуляции 90 в мин) [282]. С подобной целью также может быть рекомендована инфузия изопротеренола, оказывающего эффект ускорения.
Важным условием является адекватный постоперационный уход за пациентами, включая контроль болевого синдрома и предотвращение воздействия триггеров аритмии (особенно громких звуков). На протяжении всего периоперационного периода рекомендовано проводить мониторинг QT интервала на ЭКГ, а при наличии имплантированного ИКД следует выполнить внеплановое программирование устройства с целью оценки записей статистики и контроля основных параметров после операции, а также для восстановления исходных настроек электротерапии [283].
Тактика ведения пациентов с желудочковыми нарушениями ритма в периоперационном периоде представлена в таблице 29 [6].
6.5.4. Брадиаритмии
Если в ходе обследования перед плановым хирургическим вмешательством у пациента выявляются тяжелые симптомные брадиаритмии за счет остановки синусового узла или далеко зашедшей блокады АВ-проведения при отсутствии потенциально корригируемых причин, рекомендовано выполнение плановой имплантации электрокардиостимулятора (ЭКС) с последующим решением вопроса о сроках переноса несердечной операции.
Брадиаритмии и блокады проведения, впервые развившиеся в периоперационном периоде, обычно возможно корректировать с помощью медикаментозной терапии, но может возникнуть необходимость в проведении временной кардиостимуляции [287, 288]. Временная кардиостимуляция в периоперационном периоде должна быть ограничена пациентами, которым требуется неотложное хирургическое вмешательство на фоне гемодинамически значимой брадикардии (несмотря на внутривенное введение хронотропных медикаментов) или при наличии заместительных эпизодов желудочковых тахиаритмий во время продолжительных пауз ритма [6]. Профилактическое использование кардиостимуляции перед несердечным хирургическим вмешательством не рекомендовано. Следует избегать медикаментов, увеличивающих риск брадикардии и замедляющих АВ проведение (к примеру, бета-блокаторы, дигидропиридиновые антагонисты кальция, дигоксин, амиодарон).
Во всех случаях развития брадикардии и блокады проведения рекомендовано мониторное наблюдение на протяжении всего периоперационного периода.
Периоперационные сложности ведения общей анестезии у пациентов с брадиаритмиями могут быть обусловлены несколькими причинами: ингаляционные анестетики и опиаты способствуют усугублению брадикардии и замедлению АВ проводимости, кроме того, хирургическая травма может сопровождаться повышением парасимпатического тонуса и снижением активности работы синусового узла. Хотя брадиаритмии, вызванные как лекарственными средствами, так и особенностями хирургического вмешательства, обычно корригируются медикаментозно применением холинолитических средств (атропин, гликопирролат) или симпатомиметиками (адреналин, изопротеренол), проведение временной трансвенозной кардиостимуляции является более надежным и должно применяться при наличии показаний. Также в ряде случаев лекарственные препараты могут вызывать чрезмерную тахикардию и обладать проаритмогенным действием, учитывая, что их эффект не всегда является быстро обратимым. Если АВ-проведение не нарушено и доступна чреспищеводная стимуляция, данный метод предпочтительнее, чем медикаменты для лечения синусовой брадикардии и узлового ритма. Лекарственно-устойчивые клинически значимые брадиаритмии всегда следует лечить с помощью внешней (чреспищеводной или чрескожной) или внутренней (трансвенозной или эпикардиальной) стимуляции с целью стабилизации гемодинамики.
6.5.5. Имплантированные устройства
Пациенты с имплантированными постоянным ЭКС, ресинхронизирующим устройством (СРТ), ИКД имеют потенциальные периоперационные риски. Во всех случаях перед планированием несердечного хирургического вмешательства у пациентов с имплантированными электронными устройствами требуется взаимодействие команды, включая оперирующего хирурга, кардиолога и специалиста, осуществляющего контроль работы ЭКС/СРТ/ИКД с целью оптимизации предоперационной подготовки и согласования дальнейшей тактики ведения [283][289]. Необходима предоперационная оценка параметров работы устройства и контрольное программирование как минимум в течение 12 мес. до хирургического вмешательства для пациентов с ЭКС или в пределах последних 6 мес. для пациентов с ИКД, если нет подозрения на нарушение работы устройства (в т. ч. с помощью удаленного мониторинга работы имплантированных устройств) [6]. Во всех случаях перед хирургическим вмешательством при проведении контрольного программирования имплантированного устройства необходимо определение следующих параметров:
- Тип устройства;
- Производитель и модель;
- Зависимость пациента от устройства;
- Срок службы батареи;
- Общее количество трансвенозных и внутрисердечных электродов, в т. ч. после предыдущих имплантаций;
- Режим стимуляции;
- Базовая частота стимуляции;
- Определение параметров сенсинга, импеданса электрода и порога стимуляции;
- Анализ программ детекции тахикардий и электротерапии в ИКД/СРТ.
При использовании в ходе оперативного вмешательства электрокоагуляции возможны следующие ситуации:
а) ингибирование кардиостимуляции у ЭКС-зависимых пациентов;
б) немотивированные срабатывания устройства у пациентов с ИКД;
в) риск прямого механического воздействия с повреждением аппарата и/или электродов [290].
Наибольшее значение имеют следующие факторы [291]:
- Объем и область оперативного вмешательства.
Вероятность электромагнитной интерференции намного выше для процедур, проводимых на расстоянии <15 см от места локализации имплантированного устройства. Операции на нижних отделах брюшной полости и конечностях практически не имеют подобного риска.
- Основной сердечный ритм.
Только часть пациентов с кардиостимуляторами полностью жизненно зависят от антибрадикардической стимуляции (на фоне желудочковой асистолии). В большинстве случаев свой собственный ритм сохранен в некоторой степени, поэтому риски/последствия возможной ингибиции работы устройства являются менее выраженными.
- Тип устройства и параметры программирования.
Так, имплантированные устройства с униполярными электродами или униполярным режимом стимуляции имеют более высокую вероятность возникновения помех по сравнению с биполярным режимом. Необоснованное увеличение частоты стимуляции может регистрироваться в устройствах, которые имеют датчики активности. Имплантируемые устройства, у которых есть минутные датчики вентиляции (некоторые ЭКС и ИКД, производимые Sorin и Boston Scientific), имеют возможность увеличивать ЧСС, отслеживая увеличение минутного объема. В то же время в ходе искусственной вентиляции легких на операции существует риск значительного увеличения частоты стимуляции, что может ошибочно расцениваться как ЖТ. Применение магнита исключает эту опцию в случае кардиостимуляторов, тогда как в аппаратах ИКД (производства Sorin и Boston Scientific) необходимо предварительно провести коррекцию программируемых параметров.
- Тип используемого электрокаутера в хирургии.
Электромагнитные помехи более часто встречаются при использовании униполярной электрокоагуляции, поэтому для таких пациентов предпочтительнее использовать биполярные каутеры. В случае применения униполярной электрокоагуляции индифферентный электрод следует размещать как можно дальше от имплантированного устройства (как правило, на поверхности бедра). Рекомендуется использовать короткие (<5 секунд) аппликации с 5-секундными перерывами между воздействиями [291][292].
Для нивелирования влияний электромагнитной интерференции перед выполнением хирургического вмешательства с применением электрохирургической техники рекомендуется перевод ЭКС в асинхронный режим стимуляции [293]. Для большинства моделей ЭКС данной цели можно достичь путем размещения магнита над корпусом устройства [281]. У пациентов с ИКД и СРТ необходимо отключить алгоритмы детекции и лечения тахикардии с целью избегания необоснованных шоков. Кроме этого, рекомендовано отключить функцию частотной адаптации, повысить чувствительность, амплитуду (до заводских установок), увеличить длительность импульса (до 1,0 мс). Все современные модели ИКД реагируют на аппликацию магнита путем ингибирования антитахикардитической терапии, в то время как кардиостимуляция остается интактной. Другой способ деактивации электротерапии ИКД посредством программирования требует телеметрии и обеспечения оборудования для неотложной кардиоверсии на весь период, пока не будет осуществлена повторная активация устройства [6]. В дальнейшем, при проведении хирургического вмешательства, рекомендовано постоянно мониторировать ЭКГ, а также проводить повторный опрос устройства до и после операции с целью контроля его работы. Восстановление прежних настроек стимуляции и электротерапии должно происходить перед переводом пациента в отделение реанимации.
Наружная кардиоверсия/дефибрилляция в ходе оперативного вмешательства может приводить к нарушению алгоритмов стимуляции сердца и, как результат, к автоматическому переводу устройства с запрограммированных индивидуальных параметров работы на стандартные параметры (заводские установки). Кроме этого, зарегистрированы случаи повреждения корпуса и/или коннектора устройства. При проведении кардиоверсии/дефибрилляции рекомендуется накладывать наружные электроды как можно дальше от корпуса устройства и не использовать переднезаднее положение электродов.
Радиотерапия, чрескожная электрическая стимуляция нервов, стимуляция спинного мозга, проведение пластических процедур также могут вызвать нарушения работы устройств. Их проведение необходимо минимизировать у пейсмейкер-зависимых пациентов и лиц с имплантированными ИКД и СРТ. Проведение вышеописанных процедур должно осуществляться прерывистым способом, с минимально возможной мощностью, в биполярном режиме, под постоянным мониторированием ЭКГ. Кроме того, проведение лучевой терапии требует предварительного экранирования корпуса ЭКС.
Трансуретральная резекция при аденоме простаты, гастро- и колоноскопия, бронхиальная эндоскопия, электромиелография, литотрипсия, ионофорез, фотодинамическая терапия и дентальные процедуры, как правило, не вызывают нарушения работы имплантированных устройств. Тем не менее необходимо проводить непрерывное мониторирование ЭКГ в процессе процедуры. При проведении литотрипсии расстояние от фокуса направленного луча аппарата до корпуса устройства должно быть не меньше 15 см.
При наличии имплантированных регистраторов ритма (особенно если они не имеют функции удаленного мониторинга и не отправляют периодически события на интернет-сервер) следует в дооперационном периоде выгрузить статистику из памяти устройства перед началом операции (имеющей риск электромагнитной интерференции или при расположении операционного поля близко к корпусу устройства), чтобы избежать ложной диагностики аритмий или регистрации шумов и помех, а также предупреждения переполнения памяти [6].
Основные принципы и рекомендации по периоперационному ведению пациентов с имплантированными устройствами изложены в таблице 30 [6].
6.6. Легочная гипертензия
ЛГ гемодинамически определяется как среднее давление в легочной артерии по данным катетеризации правых отделов сердца ≥20 мм рт.ст. [294]. Классификация ЛГ включает пациентов с легочной АГ (ЛАГ) (группа I), пациентов с ЛГ вследствие болезни левого сердца (группа II), пациентов с ЛГ вследствие хронического заболевания легких и/или гипоксии (группа III), пациентов с хронической тромбоэмболической ЛГ (группа IV) и пациентов с ЛГ с многофакторными механизмами (группа V) [294][295]. Основные рекомендации по периоперационной тактике ведения пациентов с ЛАГ представлены в таблице 31.
Летальность при несердечных операциях среди пациентов с ЛАГ стабильно высока и составляет от 3,5% до 7% [299–301]. Смерть чаще всего вызвана развитием правожелудочковой СН и обычно наступает в течение 48 ч после процедуры (Price LC, 2010). Основные периоперационные осложнения включают дыхательную недостаточность, правожелудочковую СН и/или перегрузку объемом, развитие нарушений ритма сердца, нестабильность гемодинамики, острое повреждение почек и ишемию миокарда [296].
При оценке периоперационного риска у пациентов с ЛАГ следует учитывать факторы, связанные с пациентом и хирургическим вмешательством (табл. 32) [297].
Предоперационная подготовка
Предлагаются некоторые общие рекомендации по предоперационному обследованию пациентов с ЛГ [6, 298, 302, 303]:
— минимальное предоперационное обследование включает:
- лабораторную диагностику (обязательна оценка уровня гемоглобина, почечной функции, уровня НУП);
- ЭКГ;
- ЭхоКГ;
- рентгенографию органов грудной клетки;
- при необходимости катетеризацию правых отделов сердца;
— пациентам с ЛАГ необходимо оптимизировать терапию до операции. Базовая терапия ЛАГ-специфическими препаратами (стимуляторы растворимой гуанилатциклазы, антагонисты рецепторов эндотелина, ингибиторы фосфодиэстеразы 5 типа, простаноиды) не прекращается и проводится в соответствии с рекомендациями по лечению ЛГ [294][295];
— всесторонняя оценка междисциплинарной командой с привлечением специалиста по ЛГ;
— предусмотреть возможность перевода пациента в периоперационном периоде на ингаляционную или парентеральную терапию простаноидами, т. к. резкое прекращение приема пероральных легочных вазодилататоров может вызвать декомпенсацию ЛГ вплоть до летального исхода;
— заранее спланировать хирургическое вмешательство и обсудить минимизацию времени операции. Предпочтительнее оперативное вмешательство делать в учреждении, имеющем опыт оказания помощи пациентам с ЛГ;
— до оперативного вмешательства следует решить вопрос, является ли пациент кандидатом на экстракорпоральную мембранную оксигенацию. В некоторых случаях оно может использоваться в качестве моста к восстановлению (или трансплантации) в условиях периоперационного гемодинамического коллапса;
— определить особые обстоятельства, которые следует принимать во внимание (например, акушерская помощь), необходимость привлечения профильных специалистов в данной области.
Интраоперационное ведение
Базовый интраоперационный мониторинг (ЭКГ, сатурация, мониторинг АД и т. п.) можно считать достаточным для небольших оперативных вмешательств при 2 функциональном классе; в остальных случаях и при 3 функциональном классе следует рассмотреть возможность расширенного мониторинга (инвазивный мониторинг давления в легочной артерии, чреспищеводная ЭхоКГ) [304].
Убедительных доказательств, подтверждающих преимущества каких-либо конкретных методов анестезии, на настоящий момент не существует [298]. Однако евразийские рекомендации кардиологов при проведении хирургических вмешательств у пациентов с ЛАГ рекомендуют эпидуральную анестезию в качестве первого выбора (класс IIа, уровень С) [295]. Использование местной или регионарной анестезии может устранить необходимость в искусственной вентиляции легких.
Крайне важно поддерживать функцию ПЖ и избегать провоцирующих событий, которые могли бы вызвать легочную вазоконстрикцию (увеличение постнагрузки ПЖ) или системную гипотензию (снижение перфузии ПЖ) [303].
Периоперационные факторы, повышающие легочное сосудистое сопротивление [298]: гипоксия и гиперкапния (вследствие седации, анальгезии, задержки интубации), ацидоз (вторичный по отношению к гиповолемии, инфекции, снижению сердечного выброса), гипотермия (вызванная холодными внутривенными жидкостями или низкой температурой окружающей среды), ателектаз и гиперинфляция (дыхательный объем, положительное давление конца выхода), выброс катехоламинов (боль, неадекватная анестезия, тревога), использование ряда лекарственных препаратов (альфа-адреномиметики).
Следует избегать введения больших объемов жидкости (особенно холодной), поскольку повышенная преднагрузка ухудшает потребление кислорода ПЖ [296].
Ингаляционный оксид азота (или ингаляционные простаноиды) могут быть использованы для быстрого снижения постнагрузки ПЖ у пациентов с тяжелой ЛГ и острой декомпенсацией [305].
В абдоминальной хирургии открытые вмешательства предпочтительнее лапароскопических, учитывая негативное влияние высокого внутрибрюшного давления на легочное сосудистое сопротивление (через изменение механики дыхания и гиперкапнию) и нагрузку на ПЖ [296].
Послеоперационный период
Наиболее частыми причинами смерти в послеоперационном периоде являются развитие дыхательной недостаточности (60%) и ПЖ недостаточности (50%) [298].
Предпочтительным местом послеоперационного лечения пациентов с ЛГ является отделение интенсивной терапии [306]. Необходимо обеспечить пациенту адекватное обезболивание, включая региональную анестезию и неопиоидные препараты [296].
Поддержание системного давления с помощью вазопрессоров и инотропов имеет первостепенное значение. Необходимо избегать введения больших объемов жидкости [302][303][305].
Терапия легочными вазодилататорами должна быть продолжена и постепенно возвращена к дооперационному режиму пациента [305].
Развитие в послеоперационном периоде предсердных тахиаритмий является неблагоприятным маркером правожелудочковой недостаточности и ФР летального исхода. Препаратом выбора в таких ситуациях является амиодарон. Использование бета-блокаторов следует избегать, поскольку они плохо переносятся этими пациентами. Если синусовый ритм не удается восстановить, для контроля ЧСС следует рассмотреть использование дигоксина [298]. Послеоперационные осложнения, такие как кровотечение и инфекция, должны быстро контролироваться и лечиться.
6.7. Болезни почек
Наличие патологии почек как при сниженной, так и при сохранной функции почек повышает риск сердечно-сосудистой заболеваемости и смертности [334–336]. Cформулирована концепция кардиоренального синдрома [337], которая получила развитие в консенсусе по кардиоренальному синдрому Американской ассоциации сердца (Cardiorenal Syndrome: Classification, Pathophysiology, Diagnosis, and Treatment Strategies: A Scientific Statement From the American Heart Association) (2019) [338]. По данным крупных регистров, ОПП развивается примерно у 1% пациентов, подвергнутых несердечным операциям, при этом риск смерти возрастает в 8 раз [308][319]. В этой связи оценка состояния почек необходима перед выполнением хирургического вмешательства (табл. 33).
ОПП определяется как [326][327]:
— увеличение креатинина сыворотки ≥26,5 мкмоль/л на протяжении 48 ч;
— увеличение креатинина сыворотки ≥1,5 раз от базального на протяжении 7 сут.;
— диурез <0,5 мл/кг/ч в течение 6 ч.
Деление ОПП на стадии представлено в таблице 34.
Острая болезнь почек определяется как увеличение креатинина сыворотки ≥1,5 раз от базального в промежутке от >7 сут. до 3 мес. или маркеров повреждения почек (протеинурия, гематурия и др.) на протяжении <3 мес. [309][326].
ХБП определяется как нарушения структуры или функции почек продолжительностью >3 мес., влияющие на здоровье [339][340]. Помимо нарушения структуры учитывается наличие маркеров повреждения почек (протеинурия, гематурия). Деление ХБП на стадии по уровню скорости клубочковой фильтрации (СКФ) представлено в таблице 35, индексация по уровню альбуминурии в таблице 36.
Возможно развитие острого повреждения почек на фоне хронической болезни почек (ОПП на ХБП). Согласно современных представлений ОПП, острая болезнь почек и ХБП взаимно связаны между собой и являются частями "почечного континуума" (рис. 6).
Целью оценки состояния почек перед несердечными оперативными вмешательствами являются:
- Принятие решения о возможности выполнения оперативного вмешательства, его объеме и прогнозирование возможных осложнений при наличии у пациента патологии почек.
- Предотвращение развития ОПП, острой болезни почек и, следовательно, в перспективе ХБП.
- Коррекция дозы или отмена лекарственных препаратов с учетом функционального состояния почек.
- Возможность использования заместительной почечной терапии, если в послеоперационном периоде разовьется ОПП.
При стабильном состоянии пациента для оценки функционального состояния почек целесообразно использовать формулу Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI) [307]. Для подбора дозы препаратов у пациента с ХБП следует руководствоваться инструкцией к лекарственному препарату, если в инструкции речь идет о клиренсе креатинина, то используется формула Кокрофта-Голта (Cockcroft-Gault) [310]. Если говорится о СКФ, то формула Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI) [307] или ранее использовавшаяся в клинических исследованиях формула Modification of Diet in Renal Disease (MDRD) [341]. Все указанные формулы доступны как приложения (калькуляторы) к электронным устройствам на сайтах KDIGO (kdigo.org) и РКО (scardio.ru).
Изменение функционального состояния почек в послеоперационном периоде необходимо оценивать по динамике креатинина сыворотки крови, частота и сроки определения должны определяться индивидуально в зависимости от клинической ситуации. Для диагностики ОПП необходимо исследование уровня креатинина перед операцией, далее как минимум через 48 ч и на 7 сут. после оперативного вмешательства. У госпитализированных пациентов с высоким риском ОПП требуется измерять креатинин ежедневно, а у пациентов в критическом состоянии кроме того мониторировать объем выделяемой мочи (почасовой диурез) [327][328]. При отсутствии показаний для катетеризации мочевого пузыря сбор мочи и подсчет почасового диуреза затруднен, тем не менее эксперты ERA-EDTA считают, что почасовой диурез может быть рассчитан на основании измерения объема мочи, выделенного за определенный промежуток времени [329].
Развитие острого повреждения почек возможно как de novo, так и на фоне ХБП, которая предрасполагает к развитию острого повреждения почек ("ОПП на ХБП"). Следует иметь в виду возможность госпитализации пациента с ОПП, развившимся на догоспитальном этапе.
При неизвестном до операции уровне креатинина допускается использование расчетного креатинина (базального), соответствующего СКФ 75 мл/мин/1,73 м2 [326][342], однако такой подход не позволяет при отсутствии анамнеза дифференцировать ОПП от ХБП.
Вероятность развития ОПП у пациентов возможно оценить до проведения хирургического вмешательства, при этом модифицируемые ФР можно устранить, а планируемые вмешательства, если позволяет клиническая ситуация, — отложить, отменить или изменить объем и характер вмешательства, чтобы снизить риск развития ОПП.
К предикторам развития ОПП после несердечных хирургических вмешательств относят: возраст >56 лет, мужской пол, застойную СН, асцит, АГ, неотложные вмешательства и вмешательства на органах брюшной полости, предоперационное повышение креатинина, сахарный диабет. Разработан индекс риска развития ОПП у пациентов, подвергнутых хирургическому вмешательству, на основании данных American College of Surgeons — National Surgical Quality Improvement Program (ACS NSQIP). Индекс основан на результатах лечения 150 тыс. пациентов [308]. Однако указанная шкала не получила широкого клинического распространения в связи с исключением пациентов, подвергавшихся акушерским, офтальмологическим, урологическим, ортопедическим и сосудистым вмешательствам, более того она не была валидирована в крупных клинических исследованиях.
Цель ранней диагностики ОПП на 1 стадии — предотвратить развитие 2 и 3 стадий ОПП. Чем тяжелей ОПП, тем выше внутригоспитальная летальность и выше риск формирования ХБП, а следовательно, выше в отдаленном периоде риск сердечно-сосудистой и общей смертности. Возможности профилактики заключаются в исключении потенциально нефротоксичных препаратов и обеспечении адекватной гидратации.
Роль биомаркеров повреждения почек в последние годы активно обсуждается, но пока недостаточно убедительных данных для включения их в повседневную клиническую практику [343].
Все более широкое распространение получают диагностические и лечебные методы с использованием рентгеноконтрастных средств (РКС), применение которых может вести к развитию контраст-индуцированного ОПП (КИ-ОПП) [388]. Эксперты KDIGO, ERA-EDTA предлагают использовать для диагностики КИ-ОПП стандартные критерии острого повреждения почек ("контраст индуцированное ОПП" вместо "контраст-индуцированная нефропатия") [309][329]. В 2020г Американским колледжем радиологии и Национальным фондом почек было выпущено совместное Положение по использованию РКС, в котором предложено отказаться от традиционного термина контраст-индуцированная нефропатия, поскольку он вводит в заблуждение относительно роли контраста, который часто является "свидетелем", но не "виновником" развития ОПП. Предложено использовать термин контраст-ассоциированное ОПП, который используют в случаях, когда предполагается связь с введением контраста, но нельзя исключить другие причины ОПП. Термин контраст-индуцированная ОПП предлагается применять, когда все другие причины ОПП кроме РКС исключены [344].
Для прогнозирования развития контраст-индуцированной ОПП необходимо оценивать ФР (возраст >75 лет, заболевание почек в анамнезе, сахарный диабет, известное или подозреваемое ОПП, гиповолемия, дегидратация, нестабильная гемодинамика, гипотензия, шок, тяжелая ХСН (NYHA класс 3–4), низкая ФВ ЛЖ, ИМ (<24 ч), множественная миелома, анемия, применение нефротоксических препаратов) и факторы, обусловленные особенностями процедуры (большой объем оперативного вмешательства, внутриартериальное введение контраста, повторное использование РКС в течение 24 ч, применение высоко-осмолярных РКС, осложнения при предыдущем применении РКС) [328][330].
Для профилактики развития КИ-ОПП предложен ряд стратегий: минимизация объема РКС, использование гипо- и изоосмолярных РКС, гидратация пациента физиологическим раствором или бикарбонатом натрия. Доказательства использования с профилактической целью N-ацетилцистеина остаются неубедительными [344].
Для оценки риска развития ОПП при несердечных оперативных вмешательствах возможно использование несложной шкалы SPARK (табл. 37) (Simple postoperative AKI risk) [315].
Наличие ХБП или ОПП свидетельствует о повышении ССР. Знание функционального состояния почек позволит в предоперационном периоде определиться с дозами лекарственных препаратов, исключив, по возможности, потенциально нефротоксичные препараты, оценить состояние гидратации, исключив гиповолемию, определиться с тактикой оперативного вмешательства и ведения больного в послеоперационном периоде, что позволит снизить риск развития ОПП, которое предрасполагает к кардиальным осложнениям при несердечных хирургических вмешательствах.
6.8. Респираторные болезни
Респираторные осложнения являются одними из самых частых при несердечной хирургии и выявляются почти у 5% пациентов [360]. Появление таких осложнений повышает раннюю послеоперационную смертность, частоту переводов в палату интенсивной терапии и длительность госпитализации [368].
Среди респираторных осложнений чаще встречаются дыхательная недостаточность, плевральный выпот, ателектазы и заметно реже бронхиальная обструкция, пневмоторакс, аспирационный пневмонит, респираторный дистресс-синдром [368][369]. Обычно осложнения развиваются на 2–6 сут. после операции и ассоциируются со значительным повышением риска госпитальной смертности. Почти в каждом четвертом случае респираторные осложнения сочетаются с сердечными. Рекомендации по периоперационной тактике ведения пациентов с респираторными заболеваниями представлены в таблице 38.
Для оценки риска постоперационных респираторных осложнений разработана специализированная шкала ARISCAT, которая лучше разграничивала группы риска респираторных осложнений (С-статистика 0,71) в сравнительном исследовании 29 моделей [358][370].
У пациентов с заболеваниями легких респираторные осложнения преобладают, частота которых составляет 6–8% [369][371]. Хроническая обструктивная болезнь легких, бронхиальная астма, интерстициальные заболевания легких, обструктивное апноэ сна увеличивают риск периоперационных осложнений, длительность госпитализации и смертность при несердечных вмешательствах, особенно при торакальных и абдоминальных [345][357][371].
В то же время не доказано, что рутинное использование спирометрии и рентгенографии легких у асимптомных пациентов влияет на риски периоперационных осложнений [360][361].
Заболевания легких могут быть связаны с увеличением частоты ССЗ и, соответственно, периоперационных рисков. Например, среди пациентов с хронической обструктивной болезнью легких помимо легочного сердца значительно повышен риск заболеваний сердца, в т. ч. СК в 8,2 раза, ИМ в 2,7 раза, СН в 2,6 раза, аритмий в 1,9 раза [346]. Кроме того, сочетание сердечно-сосудистых и респираторных болезней повышает общую смертность [370].
Существует дефицит исследований по оценке влияния респираторных болезней на периоперационные ССР у пациентов с несердечными операциями.
Поскольку дисфункция легких, дыхательная недостаточность и гипоксемия способны негативно повлиять на течение болезней сердца, целесообразно провести адекватное лечение респираторных заболеваний с учетом коморбидности [347].
Бактериальную инфекцию устраняют с помощью антибиотиков по крайней мере за 10 сут. до операции. Следует учитывать, что макролиды, фторхинолоны (особенно моксифлоксацин и левофлоксацин) вызывают удлинение интервала QT, особенно при наличии других ФР (заболевания сердца, прием ряда лекарственных препаратов, электролитные нарушения, гипоксемия, гипогликемия), с развитием жизнеопасной желудочковой аритмии [351–353].
Лечение бронхиальной обструкции с помощью бета2-агонистов и холинолитиков, особенно в больших дозах, повышает риск тахиаритмий, особенно ФП, у предрасположенных пациентов [354–356].
С другой стороны, препараты с бета-блокирующим эффектом (бета-блокаторы, карведилол, пропафенон) способны негативно повлиять на лабильную бронхиальную обструкцию у пациентов с астмой или синдромом "бронхиальная астма-хроническая обструктивная болезнь легких".
Нестероидные противовоспалительные препараты, используемые для контроля боли, могут спровоцировать обострение астмы у предрасположенных пациентов, наряду с повышенными рисками гастроинтестинальных повреждений и внутрисосудистых тромбозов.
Наличие заболеваний респираторной системы требует повышенного внимания при использовании наркотических анальгетиков и седативных препаратов, контроля обеспечения кислородом.
Показано снижение риска респираторных осложнений почти на 25% при использовании реабилитационных программ, профилактического приема муколитиков, послеоперационной длительной вентиляции с положительным давлением, респираторной физиотерапии, эпидуральной анестезии, гемодинамической терапии [360].
Коронавирусная инфекция COVID-19 повышает риск периоперационных осложнений (дыхательная недостаточность, пневмония, легочная эмболия, острый респираторный дистресс-синдром, сепсис/шок, острое повреждение почек, остановка сердца) и смертность в 7 и 9 раз, соответственно [348]. В исследовании COVIDSurg у половины пациентов с периоперационной коронавирусной инфекцией после операции регистрировались легочные осложнения с высокой смертностью [362].
Поэтому в период коронавирусной пандемии всем пациентам, независимо от наличия симптомов, проводят тест на определение антигена с помощью полимеразной цепной реакции и при положительном результате рекомендуют отложить плановую операцию, чтобы избежать периоперационных осложнений и риска инфицирования медицинского персонала [362][372].
Повышенный риск постоперационных осложнений может сохраняться в течение 7–8 нед. после перенесенной инфекции COVID-19, особенно в первые 4 нед. [362][373][374]. В исследовании COVIDSurg 30-суточная послеоперационная смертность составила 4,1, 3,9, 3,6 и 1,5% в период 0–2, 3–4, 5–6 и ≥7 нед. после диагноза коронавирусной инфекции [362]. Наблюдение за пациентами после коронавирусной инфекции показало, что риск больших сердечно-сосудистых событий, развившихся у 12% пациентов в течение 30 сут. после операции, снижался с увеличением времени с момента установления диагноза COVID-19 в период 1–7 мес. [374].
Серьезную проблему представляет повышение почти в 2 раза венозных тромбоэмболий у пациентов с недавней коронавирусной инфекцией [375].
В редких случаях инфекции COVID-19 и после вакцинации аденовирусными и РНК вакцинами возможно появление миокардита, обычно нетяжелого [376]. С учетом времени возникновения осложнений вакцинации хирургическое вмешательство целесообразно проводить не ранее 2 нед. после вакцинации [365].
Обструктивное апноэ сна повышает риск послеоперационной гипоксемии, респираторных и сердечных осложнений, непланируемых переводов в палату интенсивной терапии [345, 349, 350]. При подозрении на обструктивное апноэ во время сна показан скрининг с помощью шкалы STOP-Bang, разработанной и валидизированной для хирургических пациентов [359]. Заслуживает внимания простая шкала NoSAS, показавшая лучшую дискриминацию групп риска. Лечение с помощью неинвазивной вентиляции лёгких — CPAP-терапии (терапия постоянным положительным давлением в дыхательных путях) позволяет снизить частоту апноэ и гипопноэ, улучшить оксигенацию, уменьшить частоту механической вентиляции и ССО [366–368].
6.9. Психические расстройства
Многочисленные наблюдательные исследования показали связь психических факторов (депрессия, тревога, стресс, тип личности D) с ССЗ, включая негативное влияние на тяжесть, риск осложнений, смертность, качество жизни, затраты на лечение, инвалидность и другие составляющие лечебного процесса [377–381].
Чаще всего в периоперационном периоде регистрируется тревога, реже депрессия и другие психические симптомы и состояния. Тревога у пациентов, ожидающих операции, может быть обусловлена ожиданием хирургического вмешательства, страхом не проснуться после анестезии, зависимостью от компетентности врачей, сомнениями в уровне медицинского оборудования и наличии современных лекарственных препаратов, что увеличивает потребность в анестетиках и анальгетиках [382]. Наличие депрессии уменьшает порог боли, повышает риск послеоперационного делирия, длительность госпитализации и функционального восстановления, снижает качество жизни и удовлетворенность результатами лечения [383–386].
Исследования показали связь депрессии и психоэмоционального стресса с тяжестью заболевания, риском ИМ и других сердечно-сосудистых событий, смертностью у пациентов с имеющейся ИБС [401–404].
Также наличие других психических расстройств, особенно тяжелых, может негативно повлиять на боль, делирий, длительность и стоимость госпитального лечения, исходы операции, повторные госпитализации [405–407].
Психологическая подготовка к оперативному лечению (информация о процедуре, поведенческие инструкции, когнитивная терапия, релаксация) способна уменьшить боль и длительность госпитализации, оптимизировать поведение пациентов [408].
В то же время существует дефицит исследований по влиянию психических факторов и их коррекции на периоперационные ССР у пациентов с несердечными операциями. Основные рекомендации по периоперационной тактике у пациентов с психическими расстройствами представлены в таблице 39.
Диагностика психических расстройств и симптомов проводится с помощью опроса на основе разработанных критериев заболеваний. Вспомогательную роль играют шкалы для скрининга симптомов и расстройств, например, шкала HADS. Также для оценки генерализованной тревоги используют шкалу GAD, а для депрессии — шкалу PHQ, которые хорошо валидизированы. С целью быстрой оценки тревоги и депрессии риска разработаны варианты шкал с двумя критериями: GAD-2 (нервозность, беспокойство или ощущение на грани срыва; неспособность успокоиться или контролировать волнение) и PHQ-2 (снижение интереса или чувства удовольствия; плохое настроение, подавленность или чувство безысходности).
Хотя транквилизаторы используются для контроля предоперационной тревоги, прием препаратов ассоциируется с повышением послеоперационной заболеваемости [389]. Уменьшить тревогу и избежать приема транквилизаторов может помочь разъяснение особенностей предстоящей операции и анестезии [409].
Несмотря на проблемы, может быть целесообразным продолжение приема антидепрессантов при персистирующей депрессии и тревоге (с отменой в день операции), поскольку возможно усиление психических симптомов [390].
Вместе с тем нужно учитывать возможные негативные эффекты психотропных препаратов. Селективные ингибиторы обратного захвата серотонина, ингибиторы обратного захвата серотонина и норадреналина, вальпроевая кислота способны снизить агрегацию тромбоцитов и увеличить риск периоперационных кровотечений, вызвать гипонатриемию [392][393]. Если риск кровотечения во время операции высок, особенно в случае приема противотромботических препаратов, лучше эти препараты отменить с учетом периода полувыведения препаратов [410].
Риск гипонатриемии, встречающейся у 9% пожилых пациентов и ассоциирующейся с повышением смертности у пациентов с СН, принимающих антидепрессанты, значительно возрастает при использовании диуретиков [411, 412].
Селективные ингибиторы обратного захвата серотонина (циталопрам, эсциталопрам), трициклические антидепрессанты, многие антипсихотики, литий и гидроксизин удлиняют интервал QT, что может увеличить риск опасных желудочковых аритмий, особенно при исходно увеличенном интервале QT или сочетании с другими препаратами аналогичного действия (соталол, амиодарон, ранолазин, макролиды, фторхинолоны) [394].
Концентрация и побочные эффекты лития, используемого для контроля биполярного расстройства, могут существенно возрасти при нестабильной гемодинамике и снижении функции почек, приеме диуретиков и нестероидных противовоспалительных препаратов, поэтому препарат рекомендуют отменить за 72 ч до операции.
В случаях отказа от психотропного лечения следует учитывать возможность обострения психических расстройств и нередко встречающийся синдром отмены.
Курение и злоупотребление алкоголем, особенно сочетанное, повышают риски осложнений, повторных госпитализаций и операций [395].
Для скрининга расстройств потребления алкоголя можно использовать краткий опросник AUDIT-C, который характеризует употребление алкогольных напитков в последний год. Отказ от алкоголя за 4–8 нед. до оперативного вмешательства у лиц с избыточным потреблением может снизить риск периоперационных осложнений [396].
Курение рекомендуют прекратить по крайней мере за 4–8 нед. до вмешательства, поскольку повышается риск ТЭО, инфекций, замедляется заживление ран, увеличивается эффективная доза анестетиков и миорелаксантов [397–399]. Кроме того, отказ от курения перед операцией может быть продолжен и после хирургического вмешательства с долгосрочными позитивными эффектами [413]. Для лечения зависимости от табака более эффективна системная программа, включающая консультирование, лекарственные препараты (варениклин), брошюры, дистанционную поддержку [400][414].
Таблица 22
Рекомендации по периоперационной неинвазивной диагностике ИБС
Рекомендации | Класс | Уровень | Ссылки |
Нагрузочное тестирование с визуализацией миокарда целесообразно перед выполнением операций повышенного риска при сниженном функциональном состоянии (<4 MET), высокой вероятности ИБС (ПТВ >15%) или высоким клиническим риском (RCRI ≥1). | I | B | [191][192] |
МСКТ коронарных артерий следует рассматривать для исключения ИБС в случае ее низкой/средней клинической вероятности или у пациентов, не подходящих для неинвазивного функционального тестирования, подвергающихся операциям промежуточным и высокого риска. | IIa | С | [193–195] |
Перед несердечной операцией высокого риска следует рассмотреть проведение МСКТ коронарных артерий пациентам с подозрением на ИБС (низкая-промежуточная вероятность) или ОКС без подъема сегмента ST низкого риска, если невозможно выполнить неинвазивное тестирование. | IIa | С | |
Нагрузочное тестирование с визуализацией миокарда целесообразно перед выполнением операций высокого риска у бессимптомных пациентов с плохой функциональной способностью и предшествующим ЧКВ или АКШ. | IIa | С | |
Стресс-визуализацию можно рассмотреть перед несердечными операциями промежуточного риска, когда ишемия вызывает беспокойство у пациентов с клиническими факторами риска и плохой функциональной способностью. | IIb | В | |
Для пациентов с повышенным риском и функциональной способностью от умеренной до хорошей (от 4 до 10 МЕТ) возможно отказаться от дальнейшего нагрузочного теста с визуализацией сердца и перейти к хирургическому вмешательству. | IIb | В | [13] |
Для пациентов с повышенным риском и неизвестной функциональной способностью возможно проведение нагрузочного теста для оценки функциональной способности. | IIb | В | [59][196] |
Рутинное проведение неинвазивного нагрузочного теста или стресс-визуализации в качестве скрининга бесполезно у пациентов с несердечными хирургическими вмешательствами низкого риска. | III | В | [197] |
Сокращения: АКШ — аортокоронарное шунтирование, ИБС — ишемическая болезнь сердца, МСКТ — мультиспиральная компьютерная томография, ОКС — острый коронарный синдром, ПТВ — предтестовая вероятность, ЧКВ — чрескожное коронарное вмешательство.
Таблица 23
Рекомендации по периоперационной инвазивной коронарной ангиографии
Рекомендации | Класс | Уровень | Ссылки |
Показания для проведения инвазивной КГ аналогичны таковым у пациентов без планируемых несердечных вмешательств. | I | С | [107][108] |
Проведение инвазивной КГ может быть рассмотрено у пациентов со стабильной ИБС перед проведением плановой каротидной эндартерэктомии. | IIb | B | [201] |
Проведение инвазивной КГ не рекомендовано у пациентов со стабильной ИБС перед выполнением хирургических вмешательств низкого и промежуточного риска. | III | C | |
Выполнение рутинной инвазивной КГ не рекомендовано перед плановыми операциями у пациентов с заболеваниями периферических артерий или c абдоминальной аневризмой аорты. | III | С | [6] |
Проведение инвазивной КГ после операции следует рассмотреть у пациентов с миокардиальным повреждением с признаками высокого риска (значительное повышение уровня вч-тропонина, наличие ишемических симптомов, стойких электро- и эхокардиографических изменений), ввиду значительного риска смерти и повторной госпитализация по поводу сердечно-сосудистых заболеваний. | IIa | C | [4][65][202] |
Сокращения: ИБС — ишемическая болезнь сердца, КГ — коронарография.
Таблица 24
Рекомендации по реваскуляризации миокарда при планировании несердечной операции
Рекомендации | Класс | Уровень | Ссылки |
Выполнение реваскуляризации миокарда рекомендуется в соответствии с действующими рекомендациями по лечению стабильной ИБС. | I | B | [108] |
Реваскуляризацию миокарда после успешной несердечной операции следует рассмотреть, в соответствии с рекомендациями МЗ РФ по стабильной ИБС. | I | C | |
Профилактическая реваскуляризация миокарда целесообразна перед сосудистыми операциями. | IIa | В | [201][205][206] |
Профилактическая реваскуляризация миокарда перед операциями высокого риска может рассматриваться, в зависимости от степени стресс-индуцированного дефекта перфузии (ишемии миокарда), наличия рефрактерных симптомов и результатов коронарографии (как в случае поражения ствола левой коронарной артерии). | IIb | B | [207] |
Рутинная профилактическая реваскуляризация миокарда перед операциями с низким риском у пациентов с доказанной ИБС не рекомендуется. | III | B | [207] |
Сокращение: ИБС — ишемическая болезнь сердца.
Таблица 25
Рекомендации по периоперационному ведению пациентов с АГ
Рекомендации | Класс | Уровень | Ссылки |
При впервые выявленной АГ перед плановым хирургическим вмешательством рекомендуется провести обследование с целью оценки сердечно-сосудистого риска и выявления поражений органов-мишеней. | I | C | [211][212] |
Рекомендуется избегать существенных периоперационных колебаний АД, особенно гипотензии в периоперационном периоде. | I | A | [145][213][214] |
У пациентов с АГ 1-й или 2-й степеней (САД <180 мм рт.ст., ДАД <110 рт.ст.) можно не откладывать несердечное вмешательство. | IIb | C | [211][212][215] |
Пациентам, длительно получающим бета-блокаторы, следует продолжить эту терапию в периоперационном периоде. | I | B | [150][153][154][160][216] |
Внезапная отмена бета-блокаторов и препаратов центрального действия (например, клонидина) потенциально опасна и не рекомендуется. | III | B | [145][211] |
Целесообразно рассмотреть временную отмену блокаторов ренин-ангиотензин-альдостероновой системы перед несердечным вмешательством у пациентов с АГ. | IIa | C | [143][145][147] |
Сокращения: АГ — артериальная гипертензия, АД — артериальное давление, ДАД — диастолическое артериальное давление, САД — систолическое артериальное давление.
Таблица 26
Рекомендации по тактике ведения пациентов с СН при выполнении несердечных вмешательств
Рекомендации | Класс | Уровень | Ссылки |
У пациентов с установленной или вероятной СН, которым планируется выполнение несердечного хирургического вмешательства, рекомендована оценка функции ЛЖ с помощью трансторакальной ЭхоКГ и/или определения уровня НУП, если недавно подобное обследование не проводилось. | I | A | [61][222–224] |
Пациенты с устройствами механической поддержки кровообращения, которым необходимо выполнение несердечного хирургического вмешательства, должны в периоперационном периоде наблюдаться мультидисциплинарной командой, включая специалистов по устройствам механической поддержки желудочков. | I | C | [6][225] |
У пациентов с СН, подвергшихся несердечному вмешательству, рекомендуется регулярно оценивать волемический статус и признаки органной перфузии. | I | C | [6] |
Пациентам с установленной СН, которым планируется выполнение несердечного хирургического вмешательства, рекомендовано назначение оптимальной медикаментозной терапии согласно действующим клиническим рекомендациям по лечению СН. | I | A | [226][227] |
Терапию бета-блокаторами у пациентов с СН рекомендовано продолжать непрерывно в периоперационном периоде, в то время как прием дозы иАПФ/АРА/АРНИ утром в день операции может быть пропущен, принимая во внимание уровень АД пациента. Если же иАПФ/АРА/АРНИ принимались непрерывно, необходим тщательный мониторинг показателей гемодинамики пациента и, при необходимости, адекватное возмещение объема жидкости. | I | С | [143][160] |
При отсутствии достаточного времени для титрации дозы в предоперационном периоде назначение высоких доз бета-блокаторов непосредственно перед несердечным хирургическим вмешательством у пациентов с СН не рекомендовано. | III | B | [228] |
В послеоперационном периоде препараты для лечения СН (иАПФ/АРА/АРНИ), если они отменялись, должны быть назначены в максимально ранние сроки с учётом клинического состояния пациента. | IIa | C | [7] |
Пациентам с СН, принимающим иНГЛТ2, следует их временно отменить перед плановым хирургическим вмешательством по крайней мере за 3 дня до операции. | I | C | [186–188][206] |
Сокращения: АД — артериальное давление, АРА — антагонисты рецепторов ангиотензина II, АРНИ — ангиотензиновых рецепторов и неприлизина ингибитор, иАПФ — ингибиторы ангиотензинпревращающего фермента, иНГЛТ2 — ингибиторы натрий-глюкозного котранспортера 2 типа, ЛЖ — левый желудочек, НУП — натрийуретический пептид, СН — сердечная недостаточность, ЭхоКГ — эхокардиография.
Таблица 27
Рекомендации по ведению пациентов с болезнями клапанов сердца при выполнении несердечных операций
Рекомендации | Класс | Уровень | Ссылки |
Проведение клинического и эхокардиографического обследования рекомендовано у всех пациентов с известным или подозреваемым клапанным пороком сердца, которым предстоит плановое несердечное хирургическое вмешательство среднего или высокого риска. | I | C | [2][14][45][237–239][240][241] |
У пациентов с впервые выявленным шумом, предполагающим наличие клинически значимой патологии, рекомендовано проведение трансторакальной ЭхоКГ перед несердечным хирургическим вмешательством высокого риска. | I | C | [6][242] |
У пациентов с впервые выявленным шумом, но без других признаков или симптомов сердечно-сосудистой патологии, должная быть обсуждена возможность проведения трансторакальной ЭхоКГ перед несердечным вмешательством умеренного и высокого риска. | IIa | C | [6][242] |
Протезирование аортального клапана рекомендовано у симптомных пациентов с тяжелым аортальным стенозом перед плановой несердечной операцией среднего или высокого риска в том случае, если они не имеют высокого риска неблагоприятных событий во время кардиохирургического вмешательства. | I | В | [6][92][94][237][238] |
Протезирование аортального клапана (ПАК или ТИАК) должно быть рассмотрено у бессимптомных пациентов с тяжелым аортальным стенозом перед плановой несердечной операцией высокого риска в том случае, если согласно заключению Сердечной команды (Heart Team), они не имеют высокого риска неблагоприятных событий во время кардиохирургического вмешательства. | IIa | C | [6][92][237–239, 243] |
Выполнение плановой несердечной хирургической операции низкого или среднего риска должно быть обсуждено у асимптомных пациентов с тяжелым аортальным стенозом без предварительного оперативного лечения аортального стеноза. | IIa | C | [6][237–239] |
Возможность предварительного выполнения ТИАК должна быть оценена консилиумом специалистов для симптомных пациентов с тяжелым аортальным стенозом, которым предстоит выполнение планового несердечного хирургического вмешательства, и которые имеют высокий риск неблагоприятного исхода при стандартном ПАК. | IIa | C | [6][237][244][245] |
У пациентов с тяжелым симптомным аортальным стенозом, которым в короткие сроки требуется несердечная операция или кому ТИАК или ПАК выполнить невозможно, баллонная вальвулопластика аортального клапана может быть рассмотрена как "мост" перед несердечной операцией и последующей коррекцией аортального клапана. | IIb | C | [6][237][244][245] |
Выполнение плановой несердечной хирургической операции первым этапом должно быть рассмотрено у пациентов с тяжелой аортальной или митральной регургитацией и не имеющих выраженную сердечную недостаточность или дисфункцию ЛЖ. | IIa | C | [6][237] |
У пациентов с симптомной тяжелой или бессимптомной тяжелой аортальной регургитацией и КСР ЛЖ >50 мм или индексированным КСР ЛЖ (КСР ЛЖ/ППТ) >25 мм/м2 (у пациентов с небольшими размерами тела) или ФВ ЛЖ в покое ≤50%, показано оперативное вмешательство на клапане перед плановым несердечным хирургическим вмешательством промежуточного или высокого риска. | I | C | [6][237] |
У пациентов с симптомной тяжелой первичной митральной регургитацией или бессимптомной тяжелой первичной митральной регургитацией при сочетании с дисфункцией ЛЖ (КСР ЛЖ ≥40 мм и/или ФВ ЛЖ ≤60%), клапанное вмешательство (хирургическое или транскатетерное) должно обсуждаться до проведения несердечного хирургического вмешательства промежуточного или высокого риска, если позволяет время. | IIa | С | [6][237][246] |
У пациентов с тяжелой вторичной митральной регургитацией, с сохраняющейся симптоматикой, несмотря на проводимую оптимальную медикаментозную терапию (включая сердечную ресинхронизирующую терапию, если она показана), клапанное вмешательство (транскатетерное или хирургическое) должно быть обсуждено перед несердечным вмешательством. | IIa | С | [6][237][246] |
Чрескожную митральную комиссуротомию или протезирование рекомендовано выполнить пациентам с тяжелым или умеренным симптомным ревматическим митральным стенозом и расчетным СДЛА >50 мм рт.ст. перед плановым несердечным хирургическим вмешательством среднего или высокого риска. | I | C | [6][237][247] |
При развитии острых тяжелых продолжительных нарушений гемодинамики в случае соответствующего технического обеспечения и наличия подготовленного персонала в периоперационном периоде некардиохирургических вмешательств рекомендуется выполнение чреспищеводной ЭхоК Г. | I | C | [6][248][249] |
Мониторирование параметров с помощью чреспищеводной ЭхоКГ может рассматриваться у пациентов с повышенным риском развития значительных нарушений гемодинамики во время и после выполнения операций высокого риска. | IIb | C | [6][248][249] |
Мониторирование параметров с помощью чреспищеводной ЭхоКГ может рассматриваться у пациентов с тяжелыми клапанными пороками сердца во время операций высокого риска, сопровождающихся существенными гемодинамическими изменениями. | IIb | C | [6][248][249] |
Сокращения: КСР — конечно-систолический размер, ЛЖ — левый желудочек, ПАК — протезирование аортального клапана, ППТ — площадь поверхности тела, СДЛА — систолическое давление в легочной артерии, ТИАК — транскатетерная имплантация аортального клапана, ФВ — фракция выброса, ЭхоКГ — эхокардиография.
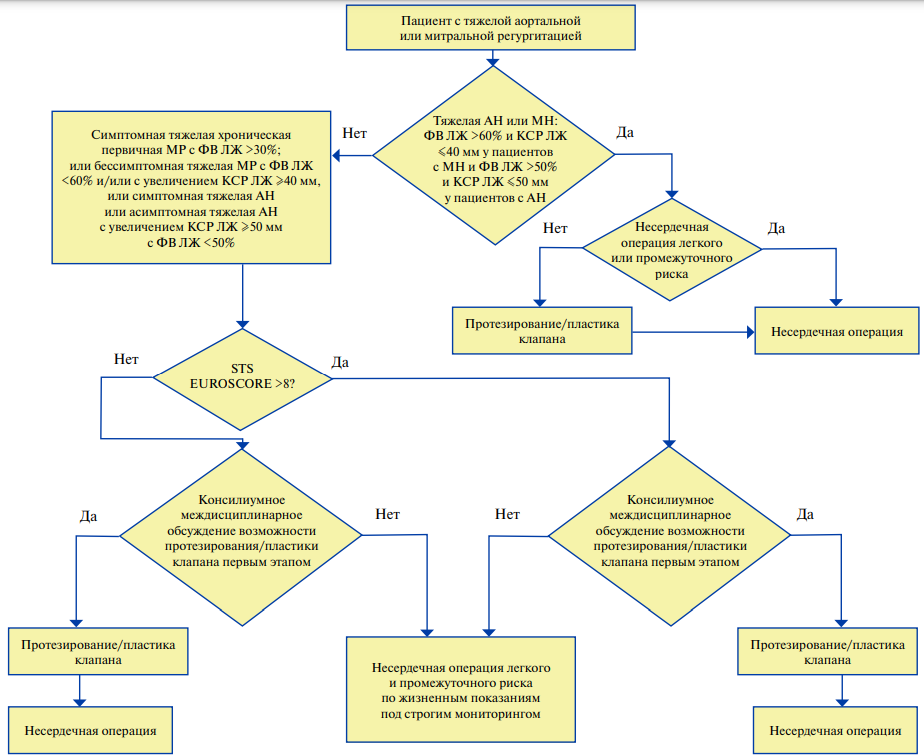
Рис. 3. Алгоритм ведения пациентов с тяжелой аортальной и митральной недостаточностью, нуждающихся в несердечной хирургии (Иртюга О. Б. и др. 2021), с модификацией рекомендаций ESC 2021 по клапанной патологии [237][238].
Сокращения: АН — аортальная недостаточность, КСР — конечно-систолический размер, ЛЖ — левый желудочек, МН — митральная недостаточность, МР — митральная регургитация, ФВ — фракция выброса.
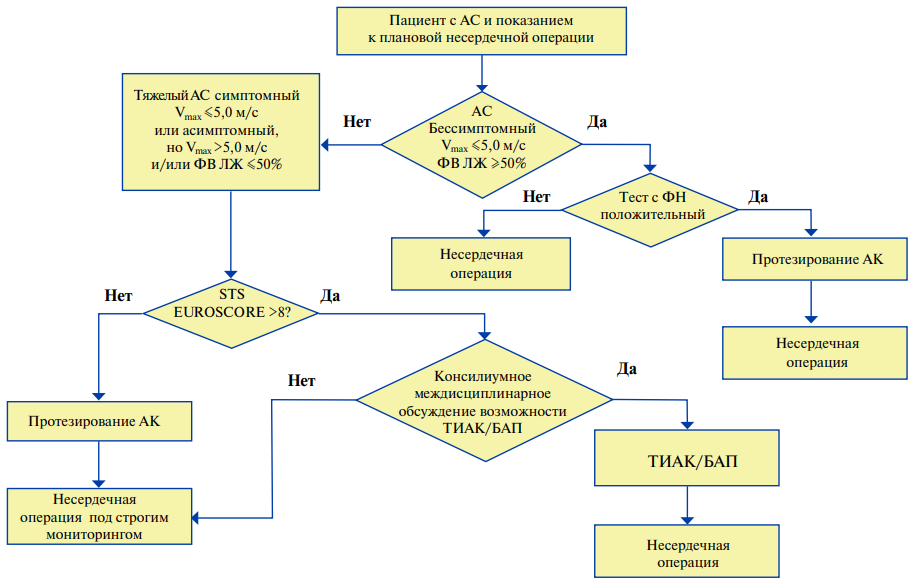
Рис. 4. Алгоритм ведения пациентов с тяжелым аортальным стенозом, нуждающихся в плановой несердечной хирургии (Иртюга О. Б. и др. 2021), с модификацией рекомендаций ESC 2021 по клапанной патологии [237][238].
Сокращения: АК — аортальный клапан, АС — аортальный стеноз, БАП — баллонная ангиопластика, ЛЖ — левый желудочек, ТИАК — транскатетерная имплантация аортального клапана, ФВ — фракция выброса, ФН — физическая нагрузка, Vmax — максимальная скорость на аортальном клапане.

Рис. 5. Алгоритм ведения пациентов с митральным стенозом, нуждающихся в несердечной хирургии (Иртюга О. Б. и др. 2021), с модификацией рекомендаций ESC 2021 по клапанной патологии [237][238].
Сокращения: МК — митральный клапан, МО — митральное отверстие, МС — митральный стеноз, СДЛА — систолическое давление в лёгочной артерии, ЧКВ — чрескожное коронарное вмешательство, ЭхоКГ — эхокардиография.
Таблица 28
Рекомендации по ведению пациентов с суправентрикулярными нарушениями ритма с запланированными несердечными хирургическими вмешательствами [6]
Рекомендации | Класс | Уровень | Ссылки |
Наджелудочковые аритмии | |||
Пациентам, получающим антиаритмическую терапию по поводу СВТ, рекомендовано продолжить прием препаратов в периоперационном периоде. | I | C | |
Аблацию следует рассматривать у симптомных пациентов с рецидивирующими или персистирующими СВТ (на фоне оптимальной медикаментозной терапии) перед несердечными хирургическими вмешательствами высокого риска. | IIа | B | [273–275] |
Гемодинамически значимая ФП | |||
У пациентов с ФП, имеющих острое или прогрессивно ухудшающееся нарушение гемодинамики перед предстоящей несердечной операцией, рекомендована неотложная электрическая кардиоверсия. | I | B | |
У пациентов с ФП и нестабильной гемодинамикой для неотложной медикаментозной кардиоверсии можно рассмотреть введение амиодарона. | IIb | B | |
Сокращения: СВТ — суправентрикулярная тахикардия, ФП — фибрилляция предсердий.
Таблица 29
Рекомендации по периоперационному ведению пациентов с желудочковыми нарушениями ритма
Рекомендации | Класс | Уровень | Ссылки |
У пациентов с рецидивирующей симптомной мономорфной устойчивой субстрат-ассоциированной ЖТ (несмотря на оптимальную медикаментозную терапию) рекомендована катетерная аблация перед проведением планового несердечного хирургического вмешательства. | I | B | [284–286] |
Инициация антиаритмической терапии у бессимптомных пациентов с мономорфной желудочковой экстрасистолией в периоперационном периоде не рекомендована. | III | А |
Сокращение: ЖТ — желудочковая тахикардия.
Таблица 30
Рекомендации по ведению пациентов с брадиаритмиями и имплантированными электронными устройствами
Рекомендации | Класс | Уровень |
У пациентов с брадиаритмиями и наличием показаний для имплантации ЭКС следует отложить выполнение несердечного вмешательства и рассмотреть ее проведение. | IIа | С |
У пациентов с временно деактивированными ИКД рекомендован ЭКГ мониторинг на протяжении всего хода несердечной операции, а также наблюдение квалифицированными специалистами в периоперационном периоде с целью раннего выявления нарушений ритма и своевременной их коррекции. У пациентов высокого риска (ЭКС-зависимых или имеющих имплантированный ИКД) или при возможном затруднении доступа к грудной клетке в ходе хирургической операции, во всех случаях рекомендовано размещение накожных электродов ЭКС/дефибриллятора перед началом внесердечного вмешательства. | I | C |
Всем пациентам с имплантированными электронными устройствами, которым проводилось программирование перед началом хирургической операции, рекомендовано контрольное программирование и оценка статуса устройства как можно раньше в постоперационном периоде. | I | C |
У пациентов высокого риска (ЭКС-зависимых или имеющих имплантированный ИКД) перед несердечным вмешательством с использованием электрохирургической техники с высокой вероятностью электомагнитной интерференции (к примеру, в умбиликальной зоне), рекомендовано контрольное программирование устройства с внесением необходимых коррекций непосредственно перед началом операции. | IIа | С |
Сокращения: ИКД — имплантируемый кардиовертер-дефибриллятор, ЭКГ — электрокардиография, ЭКС — электрокардиостимулятор.
Таблица 31
Рекомендации для пациентов с ЛАГ при несердечных операциях (адаптировано из [6])
Рекомендация | Класс | Уровень | Ссылка |
Рекомендуется продолжить базовую терапию ЛАГ в периоперационном периоде. | I | C | [294][295] |
Рекомендуется послеоперационный мониторинг гемодинамики у пациентов с тяжелой ЛАГ не менее 24 ч. | I | C | [296][297] |
В случае прогрессирования правожелудочковой СН в послеоперационном периоде у пациентов с ЛАГ рекомендуется оптимизировать дозу диуретика и, при необходимости, начать внутривенное введение аналогов простациклина под руководством врача, имеющего опыт в лечении ЛАГ. | I | C | [296][297] |
В соответствии с гемодинамическим статусом пациента следует рассматривать сосудорасширяющие препараты (добутамин, милринон, левосимендан), которые увеличивают сердечный выброс и снижают легочное сосудистое сопротивление. | IIа | C | [294][297][298] |
Сокращения: ЛАГ — легочная артериальная гипертензия, СН — сердечная недостаточность.
Таблица 32
Факторы, связанные с пациентом и хирургическим вмешательством, которые следует учитывать при оценке периоперационного риска у пациентов с ЛАГ
Факторы, связанные с пациентом | Факторы, связанные с оперативным вмешательством |
— 2 функциональный класс — уменьшение расстояния в тесте 6-минутной ходьбы — ишемическая болезнь сердца — перенесенная ТЭЛА — хроническая почечная недостаточность — тяжелая дисфункция ПЖ | — экстренное хирургическое вмешательство — длительность анестезии >3 ч — интраоперационная потребность в вазопрессорах |
Сокращения: ПЖ — правый желудочек, ТЭЛА — тромбоэмболия легочной артерии.
Таблица 33
Рекомендации по оценке функции почек, оценке риска и профилактике ОПП у пациентов перед несердечными операциями
Рекомендации | Класс | Уровень | Ссылки |
ОПП | |||
Определить функциональное состояние почек, рассчитав рСКФ по формуле CKD-EPI, если пациент в стабильном состоянии. | I | B | [307] |
Если пациент в нестабильном состоянии, ориентироваться на уровень креатинина сыворотки крови в динамике. | I | B | [308][309] |
Если в инструкции к препарату рекомендуется дозу корригировать по СКФ, то коррекцию дозы препарата проводить по формуле CKD-EPI, если по клиренсу креатинина, то использовать формулу Кокрофта-Голта (Cockcroft-Gault). | I | С | [307][310] |
Для оценки сердечно-сосудистого и "почечного" риска в дополнение к рСКФ необходимо оценить наличие и выраженность альбуминурии (протеинурии). | IIa | B | [311–315] |
До оперативного вмешательства оценить состояние гидратации, объем циркулирующей плазмы и восполнить ее, для чего в отсутствии геморрагического шока предпочтительно использовать изотонические растворы кристаллоидов, не допуская перегрузки объемом. | I | С | [316–318] |
До оперативного вмешательства оценить лекарственную терапию, обратив внимание на потенциально нефротоксичные препараты. | I | C | [308][315][319] |
У пациентов с высоким риском развития ОПП не использовать диуретики для стимуляции диуреза, при развившемся ОПП эффективность петлевых диуретиков сомнительна, за исключением экстренных случаев лечения отека легких. | I | B | [320–324] |
У пациентов с высоким риском развития или развившимся ОПП не использовать допамин для стимуляции диуреза. | I | A | [321][325] |
Контраст-индуцированная ОПП | |||
Для диагностики контраст-индуцированной ОПП целесообразно использовать систему классификации ОПП (KDIGO, 2012). | I | С | [326–330] |
Перед процедурой с использованием рентген-контрастных средств рекомендуется оценить риск развития контраст-индуцированной ОПП и провести обследование функции почек. Риск значительно увеличивается при СКФ <30 мл/мин/1,73 м2. | I | C | [331–333] |
У пациентов с факторами риска развития контраст-индуцированной ОПП рекомендуется использовать изо-осмолярные или низко-осмолярные йодсодержащие рентген-контрастные средства*. | I | A | [332][333] |
Примечание: * — Клинические рекомендации научного общества нефрологов России по профилактике, диагностике и лечению контраст-индуцированной нефропатии размещены на сайте (nonr.ru).
Сокращения: ОПП — острое почечное повреждение, рСКФ — расчетная скорость клубочковой фильтрации, СКФ — скорость клубочковой фильтрации.
Таблица 35
Стадии ХБП [339, 340]
Стадия | Характеристика функции почек | СКФ, мл/мин/1,73 м2 |
С1 | Высокая или оптимальная | >90 |
С2 | Незначительно сниженная | 60–89 |
С3а | Умеренно сниженная | 45–59 |
С3b | Существенно сниженная | 30–44 |
С4 | Резко сниженная | 15–29 |
С5 | Терминальная почечная недостаточность | <15 |
Сокращение: СКФ — скорость клубочковой фильтрации.
Таблица 36
Градации альбуминурии [340]
A1 | A2 | A3 | А4 |
Оптимальная или повышенная | Высокая | Очень высокая | Нефротическая |
<10–29 мг/сут. | 30–299 мг/сут. | 300–1999* мг/сут. | ≥2000** мг/сут. |
Примечание: * — соответствует суточной протеинурии ≥0,5 г; ** — соответствует суточной протеинурии ≥3,5 г.
Таблица 34
Стадии ОПП [326, 327]
Стадия | Уровень креатинина сыворотки крови | Объем выделенной мочи |
1 | повышение креатинина на ≥26,5 мкмоль/л или в 1,5–1,9 раза выше исходного | <0,5 мл/кг/ч за 6–12 ч |
2 | в 2–2,9 раза выше исходного | <0,5 мл/кг/ч за ≥12 ч |
3 | в 3 раза и выше исходного или повышение >353,6 мкмоль/л, или начало заместительной почечной терапии, или у пациентов моложе 18 лет снижение СКФ <35 мл/мин/1,73 м2 | <0,3 мл/кг/ч за ≥24 ч или анурия ≥12 ч |
Сокращение: СКФ — скорость клубочковой фильтрации.

Рис. 6. Почечный континуум.
Примечание: континуум может начинаться с острой болезни почек. Шутов А. М. и соавт. Архив внутренней медицины. 2021;2:94-7.
Таблица 37
Шкала SPARK (Simple postoperative AKI risk)
Факторы риска | Баллы |
Возраст (годы) <40 ≥40 и <60 ≥60 и <80 ≥80 | 0 6 9 13 |
рСКФ (мл/мин/1,73 м2) ≥60 ≥45 и <60 ≥30 и <45 ≥15 и <30 Альбуминурия (тест полоски ≥1+) | 0 8 15 22 6 |
Пол Женщина Мужчина | 0 8 |
Предполагаемая продолжительность хирургического вмешательства (часы) Экстренная операция | х5 7 |
Сахарный диабет Прием блокаторов РААС | 4 6 |
Гипоальбуминемия (<3,5 г/дл) Анемия (<12 г/дл у женщин, <13 г/дл у мужчин) Гипонатриемия (<135 ммоль/л) | 8 4 3 |
Класс А: <20 баллов, риск ОПП <2%, риск критического ОПП* <2% Класс B: 20–39 баллов, риск ОПП ≥2%, риск критического ОПП* <2% Класс С: 40–59 баллов, риск ОПП ≥10%, риск критического ОПП* ≥2% Класс D: ≥60 баллов, риск ОПП ≥20%, риск критического ОПП* ≥10% |
Примечание: * — критическое ОПП: ОПП ≥2 стадии, или смерть при развитии ОПП, или начало заместительной почечной терапии на протяжении 90 дней.
Сокращения: ОПП — острое почечное повреждение, РААС — ренин-ангиотензин-альдостероновая система, рСКФ — расчетная скорость клубочковой фильтрации.
Таблица 38
Рекомендации по подготовке к несердечной операции у пациентов с респираторными болезнями
Рекомендации | Класс | Уровень | Ссылки |
Респираторные болезни могут увеличить риски сердечно-сосудистых заболеваний, включая периоперационный период. | IIа | В | [345–350] |
Перед хирургическим вмешательством необходимо провести адекватное лечение респираторных и сердечных заболеваний с учетом коморбидности и рисков, связанных с приемом медикаментов. | I | C | [347][351–356] |
Для оценки риска периоперационных респираторных осложнений можно использовать специализированные шкалы. | IIа | В | [357–359] |
У асимптомных пациентов проведение рутинной спирометрии и рентгенографии легких нецелесообразно. | III | В | [360][361] |
Использование реабилитационных программ, профилактического приема муколитиков, респираторной физиотерапии, эпидуральной анестезии, гемодинамической терапии позволяет снизить частоту респираторных осложнений. | I | В | [360] |
При положительном результате на вирус SARS-CoV-2 рекомендуется отложить плановую операцию до исчезновения признаков инфекции и не менее чем до 4–8 нед. | I | В | [348][362–364] |
После вакцинации против COVID-19 рекомендуется отложить плановую операцию на 2 нед. | IIb | B | [365] |
Лечение обструктивного апноэ сна с помощью CPAP-терапии может снизить частоту респираторных и сердечно-сосудистых событий, сократить длительность госпитализации. | I | B | [346][361][366][367] |
Таблица 39
Рекомендации по подготовке к несердечной операции у пациентов с психическими расстройствами
Рекомендации | Класс | Уровень | Ссылки |
Психические факторы риска ассоциируются с возрастанием частоты и повышением тяжести сердечно-сосудистых болезней. | IIа | В | [377–381] |
Психические расстройства могут негативно повлиять на боль, делирий, длительность и стоимость оперативного лечения, удовлетворенность лечением и качество жизни. | IIa | B | [382][384–386] |
Для скрининга тревоги и депрессии в предоперационном периоде рекомендуется использовать валидизированные шкалы. | IIa | B | [27][387] |
Пациентам с предшествующим или появившимся в периоперационном периоде психическим расстройством рекомендуется консультация психиатра для выработки оптимальной лечебной программы. | I | С | [27, 387, 388] |
У пациентов с персистирующими психическими расстройствами целесообразно продолжить лечение психотропными препаратами, если имеется приемлемое соотношение польза/риск, а в случаях высокого риска неблагоприятных лекарственных реакций рассмотреть возможность отмены/замены потенциально опасных психотропных препаратов. | I | B | [387–391] |
Необходимо оценить риск кровотечений и пользу/риск продолжения терапии у пациентов, принимающих селективные ингибиторы обратного захвата серотонина, ингибиторы обратного захвата серотонина и норадреналина, вальпроевую кислоту. | I | В | [392][393] |
Целесообразно оценить риск синдрома удлиненного интервала QT и опасных аритмий, пользу/риск продолжения терапии у пациентов, принимающих циталопрам, эсциталопрам, трициклические антидепрессанты, антипсихотики, литий и гидроксизин. | I | В | [394][395] |
Следует отказаться от алкоголя за 4–8 нед. до оперативного вмешательства у лиц с избыточным потреблением. | IIa | B | [396] |
Отказ от курения перед операцией чаще достигается с помощью многокомпонентной программы и позволяет снизить частоту периоперационных осложнений, особенно при раннем отказе (более чем за 4 нед.). | I | B | [397–400] |
Отдельные операции
7.1. Сосудистые операции
Пациенты, которым запланировано проведение оперативного вмешательства по причине некоронарного атеросклероза, имеют существенные особенности в предоперационной оценке риска кардиальных осложнений. Это связано с высокой распространенностью у таких пациентов сопутствующего поражения коронарных артерий и, соответственно, бессимптомным течением ИБС, а также особенностями самого вмешательства — большими внутрисосудистыми и экстраваскулярными сдвигами жидкости, длительным пережатием аорты при операциях на аорте, большим объемом кровопотери, а также гипотермией. Стрессовая реакция, сопровождающаяся значительным ростом циркулирующего уровня кортизола и катехоламинов в операционном и периоперационном периоде, способствует развитию гиперкоагуляции и увеличению потребности миокарда в кислороде. Соответственно, при выполнении сосудистых операций отмечается значительное число периоперационных осложнений [415].
В рекомендациях ЕОК вмешательства на сонных артериях (стентирование при бессимптомном поражении и КЭЭ) отнесены к операциям среднего риска. Стентирование каротидных артерий при наличии симптомов и обширные вмешательства на аорте и крупных сосудах, вмешательства на нижних конечностях (открытая реваскуляризация, ампутация либо тромбэмболэктомия) — к операциям высокого риска [6].
В определении тактики обследования пациентов перед сосудистыми операциями следует учитывать, что частота обструктивных поражений коронарных артерий достигает 25–35% при каротидном атеросклерозе, 50% при аневризмах брюшной аорты и облитерирующем атеросклерозе артерий нижних конечностей [416]. В исследовании Hertzer NR, et al. [417] частота выявления значимых стенозов коронарных артерий, поддающихся хирургической коррекции, составила 26%, что очень близко к цифре, полученной в отечественном исследовании [418]. Рекомендации по периоперационной тактике ведения пациентов с заболеваниями периферических артерий представлены в таблице 40.
Следует отметить работы итальянских авторов [201][205][419], в которых были сопоставлены стратегии, в одной из которых было изучено рутинное проведение в предоперационном периоде инвазивной КГ. Illuminati G, et al. [201] обследовали 426 пациентов перед операцией КЭЭ при отсутствии ИБС в анамнезе и без изменений ЭКГ и ЭхоК Г. Пациентов рандомизировали в группу с предварительным проведением инвазивной КГ (n=216) и группу без проведения КГ. Признаки бессимптомного поражения коронарных артерий были выявлены на инвазивной КГ у 68 пациентов первой группы. Эти стенозы подверглись реваскуляризации перед операцией КЭЭ — у 66 пациентов выполнено стентирование коронарных артерий, у 2 пациентов — операция коронарного шунтирования. Хотя группы с различной диагностической стратегией не различались по частоте летальных исходов и фатальных ИМ, после КГ и превентивной реваскуляризации миокарда таких случаев вообще не было за регистрировано. Также в этой группе не было и ишемических осложнений после КЭЭ, в то же время в группе без КГ их было 4,3% (р=0,01). При проведении множественного логистического регрессионного анализа только проведение КГ приводило к снижению риска развития периоперационных ишемических осложнений (р=0,02) [201]. Снижение риска развития ИМ в группе рутинной КГ отмечалось и при последующем проспективном наблюдении в течение 5 лет [419].
В исследовании Monaco M, et al. [205] было проведено сравнение двух диагностических стратегий — проведение рутинной КГ, либо выполнение неинвазивных стресс-тестов с последующей КГ при наличии показаний. Авторы обследовали 208 пациентов перед сосудистыми операциями промежуточного и высокого риска при наличии двух и более кардиальных ФР (по шкале RCRI). Все пациенты были рандомизированы либо в группу с селективным выполнением инвазивной КГ только по результатам неинвазивных стресс-тестов — группа А (n=104), либо в группу с рутинным проведением КГ всем пациентам (группа В, n=105). В группе рутинного выполнения КГ существенно чаще выявляли ИБС (в 61,9%) по сравнению с группой селективного выполнения КГ (в 44,7%, р=0,02). Соответственно, различия отмечались и в частоте выполнения превентивной реваскуляризации миокарда, хотя и недостоверные (58,1% и 40,1%, р=0,01). При анализе 30-дневных результатов двух диагностических стратегий в группе рутинной КГ по сравнению с ее селективным проведением отмечалась тенденция к меньшему числу развития ИМ (1,9% и 3,9%, р=0,6), сердечно-сосудистой смертности (1,9% и 6,8%, р=0,08) и больших неблагоприятных событий (4,8% и 11,7%, р=0,1). При долговременном наблюдении (в течение 100 мес.) выживаемость в группе пациентов с рутинным проведением КГ (и более частым использованием превентивной реваскуляризации миокарда) была выше, чем при селективном выполнении КГ (р=0,01) [205].
В работах отечественных авторов [209][420] оценивались послеоперационные кардиальные осложнения в когортах пациентов с рутинным проведением КГ (и при необходимости — превентивной реваскуляризации миокарда) и обычной диагностической тактикой. Так, в исследовании Чернявского А. М. и соавт. [420] инвазивная КГ была выполнена у 88,7% пациентов перед операциями на брюшной аорте. По результатам последней, значимых стенозов не было выявлено у 19 (26,7%) пациентов, однососудистое поражение — в 8 (11,3%) случаях, двухсосудистое — в 27 (38,1%) случаях, трехсосудистое — у 17 (23,9%) пациентов. Соответственно, этапные хирургические вмешательства с превентивной реваскуляризацией миокарда на первом этапе выполнены у 53,8% пациентов. Это позволило снизить, по сравнению с группой медикаментозной терапии, число периоперационных ИМ (с 10,1% до 1,2%) и число летальных исходов в раннем послеоперационном периоде (с 23,2% до 7,5%). При наблюдении в течение 5 лет выживаемость пациентов группы КГ и превентивной реваскуляризации миокарда составила 91,3%, а в группе медикаментозной терапии — 77,5% [420].
Похожий по дизайну анализ проведен и в исследовании Сумина А. Н. и соавт. [209], в котором сопоставлены результаты работы двух клиник с разными стратегиями снижения риска кардиальных осложнений при сосудистых операциях. В одной клинике (86 пациентов) предпочтение отдавалось проведению рутинной инвазивной КГ (выполнена в 90% случаев) и при необходимости — превентивной реваскуляризации миокарда (осуществлена у 28% пациентов). Во второй клинике (95 пациентов) предоперационное обследование ограничивалось записью ЭКГ, осмотром терапевта (или кардиолога) и продолжением стандартной терапии. Уровень периоперационной летальности был достоверно выше во второй группе (10,5%) по сравнению с первой (2,3%; р=0,026), достоверными также были различия и по развитию периоперационного ИМ (6,3% и 0%, р=0,017). При мультивариантном анализе проведение инвазивной КГ было ассоциировано со снижением периоперационной летальности [209].
В недавнем исследовании Алекяна Б. Г. и соавт. [206] было показано, что у 79,9% пациентов с атеросклерозом аорты и периферических артерий выявляется поражение как минимум одной коронарной артерии >50%, при этом 66,4% пациентов имели клинические проявления. У 316 (57,0%) пациентов по решению мультидисциплинарной Сердечной команды была выполнена реваскуляризация миокарда: у 21 (6,7%) — коронарное шунтирование, а у 295 (50,3%) — ЧКВ. В результате выполненных 923 (564 эндоваскулярных и 359 хирургических) операций ИМ на госпитальном этапе не был выявлен ни у одного из пациентов.
Все вышеперечисленные исследования подтверждают обоснованность тактики проведения рутинной КГ перед выполнением сосудистых операций высокого (на брюшной аорте, артериях нижних конечностей) и промежуточного (на сонных артериях) риска. С учетом ограниченности предоперационной оценки риска кардиальных осложнений, основанной только на выявлении клинических ФР и проведении неинвазивных стресс-тестов, которая показала свою неэффективность в последних рандомизированных исследованиях, складывается впечатление, что рутинное проведение КГ является оправданным перед выполнением открытых операций на брюшной аорте, на артериях нижних конечностей и сонных артериях.
Таким образом, в случае подтверждения гемодинамически значимого поражения коронарных артерий у пациентов, подвергающихся сосудистым операциям высокого риска, необходимо оценить целесообразность инвазивного лечения ИБС, которое, наряду с возможными выгодами, сопровождается риском развития осложнений. Необходимо решить, когда, кому и на каком этапе показана реваскуляризация миокарда, какой вид вмешательства в наибольшей степени поможет больному сохранить приемлемое качество жизни, а главное — улучшить прогноз. Такие ответственные решения целесообразно принимать коллективно в рамках мультидисциплинарного консилиума (кардиокоманды), состоящего из кардиолога, рентгенхирурга, кардиохирурга и анестезиолога (рис. 7).
7.2. Злокачественные новообразования
Рекомендации по периоперационной оценке и тактике ведения пациентов со злокачественными новообразованиями (ЗНО) отражены в таблице 41.
Оценка хирургического риска у пациентов с ЗНО
При оценке хирургического риска ССО следует учитывать, что вмешательства при наиболее распространенных опухолях в силу своей обширности и длительности, например, пневмонэктомия, панкреато-доуденальная резекция, резекция печени, тотальная цистэктомия, резекция пищевода, отнесены к категории высокого риска 30-дневной сердечно-сосудистой смертности или развития ИМ (>5%). К категории промежуточного риска (1–5%) относятся операции на голове и шее, на органах малого таза, небольшие торакальные вмешательства [6]. У пациентов с раком повышен риск периоперационного кровотечения вследствие: а) операций на печени, поджелудочной железе, легких, простатэктомии, резекции мочевого пузыря, биопсии почек или предстательной железы; б) более частого приема антиагрегантов и антикоагулянтов по поводу ССЗ; в) неоадьювантной лекарственной терапии рака антиангиогенными препаратами и ингибиторами тирозинкиназы Брутона [6].
Оценка ССР у пациентов с ЗНО
При оценке ССР у онкологических пациентов следует учитывать следующие ассоциированные с раком факторы, увеличивающие риск периоперационных ССО:
— бóльшая, чем в общей популяции, распространенность среди пациентов с ЗНО ФР образа жизни — курения, ожирения, малоподвижного образа жизни;
— преобладание в возрастной структуре пациентов старшего возраста;
— плохой контроль АГ и диабета;
— бóльшая распространенность ССЗ, включая болезни, связанные с терапией рака (ИБС и клапанная патология после лучевой терапии, СН после неоадьювантной химиотерапии антрациклинами и трастузумабом);
— высокий риск онкоассоциированных венозных и артериальных тромбозов;
— высокий риск послеоперационных аритмий, прежде всего ФП у пациентов после резекции легкого [6].
Специальные шкалы оценки риска периоперационных ССО в онкохирургии с учетом вышеприведенных отягощающих прогноз факторов не разработаны. Шкала RCRI в онкологической практике не показала достаточной предсказательной способности [424][428][439]. В этой связи более предпочтительными выглядят шкалы, включающие как характеристики хирургического вмешательства, так и сведения о клиническом состоянии пациента, например, калькулятор риска ACS NSQIP. Шкала валидирована в когортах онкологических пациентов и с приемлемой точностью прогнозировала кардиальные осложнения онкогинекологических операций [427], резекций нейроэндокринных опухолей желудочно-кишечного тракта [440], пневмонэктомий по поводу рака легкого [424]. Попытка увеличить предсказательную точность ACS NSQIP путем добавления связанных с онкологией переменных (предшествующая операция в той же зоне или химиолучевая терапия) оказалась неуспешной [426]. Внешняя валидация широко используемого в клинической практике калькулятора NSQIP MICA на когортах онкологических пациентов не проводилась.
Шкала ThRCRI (Thoracic Revised Cardiac Risk Index) разработана на основе шкалы RCRI в когорте 1629 пациентов с немелкоклеточным раком легкого, у 1426 из них проведена лобэктомия и у 270 — пневмонэктомия. В данной модели уменьшено число оцениваемых показателей по сравнению с шкалой RCRI (табл. 42) [432].
В дальнейшем ThRCRI валидирована на двух внешних популяциях [429][433]. Доказана ее возможность предсказывать не только периоперационные кардиальные осложнения, но и отдаленную выживаемость пациентов, а также смертность от кардиальных причин [430]. Разработан алгоритм предоперационного обследования пациентов с немелкоклеточным раком легкого с использованием данного индекса (рис. 8) [436].
При ThRCRI <2 дальнейшего исследования сердечно-сосудистой системы не требуется, однако проводится оценка респираторной функции. Значение ThRCRI ≥2 указывает на высокий периоперационный кардиальный риск и предполагает обследование у кардиолога с проведением дополнительных неинвазивных диагностических тестов в соответствии с действующими рекомендациями [6, 7]. Это единственная из систем стратификации кардиального риска, включенная в специализированные рекомендации периоперационной оценки риска у пациентов раком легкого [431].
Роль биомаркеров
В последние годы получены убедительные доказательства предикторного значения предоперационного уровня НУП и послеоперационного уровня сердечного тропонина Т и I в оценке риска общей смертности и кардиальных осложнений как в общей популяции пациентов, подвергшихся несердечным хирургическим вмешательствам [57][75], так и в когортах онкологических пациентов [434, 435, 441]. Таким образом, у пациентов с ЗНО высокого риска концентрация НУП и тропонина в плазме может служить дополнением к оценке ССР и выявления повреждения миокарда после несердечных операций.
В соответствии с Рекомендациями Канадского кардиоваскулярного общества по оценке периоперационного кардиального риска перед несердечной операцией 2017г рекомендуется измерить BNP или NT-proBNP перед операцией у пациентов в возрасте ≥65 или ≥45 лет с ССЗ или RCRI ≥1. При BNP ≥92 мг/л или NT-proBNP ≥300 мг/л следует измерять уровень тропонина после операции для скрининга бессимптомного повреждения миокарда (сильная рекомендация, доказательство среднего качества) [29].
В Руководстве ЕОК 2022 концепция использования биомаркеров для оценки периоперационного риска получила дальнейшее развитие: у пациентов с установленными ранее ССЗ, ФР ССЗ (включая возраст ≥65 лет) или симптомами, указывающими на ССЗ, рекомендуется измерять высокочувствительный тропонин T или I в крови перед несердечной операцией промежуточного и высокого риска, через 24 и 48 ч после нее. Следует также рассмотреть определение BNP или NT-proBNP перед операцией [6].
Оценка функционального статуса пациентов с ЗНО
Общие подходы к оценке функционального статуса у пациентов с ЗНО не отличаются от таковых у хирургических пациентов без ЗНО (см. Раздел 4.3). С этой целью в онкохирургии наиболее часто используется опросник Duke Activity Status Index (DASI) с расчетом метаболических эквивалентов (МЕТ) [421][422]. Низкая функциональная способность устанавливается при МЕТ <4. Дальнейшая тактика ведения таких пациентов заключается в дополнительном обследовании в соответствии с общими алгоритмами [6, 7]. "Хрупкость" хирургических пациентов старшего возраста имеет предикторное значение, поэтому скрининг данного состояния следует проводить у лиц >70 лет при планировании операций промежуточного и высокого хирургического риска [6]. "Хрупкость" была ассоциирована с неблагоприятными исходами хирургического лечения рака легкого [423], поджелудочной железы [442], желудка [443], колоректального рака [444]. В этой связи оценка "хрупкости" посредством валидированных шкал (например, Clinical Frailty Scale) может явиться полезным инструментом прогноза послеоперационных осложнений у пожилых пациентов с ЗНО.
Точную оценку функционального состояния обеспечивает КПНТ. Однако его использование ограничено в силу недостаточной доказательной базы [13], а также высокой стоимости и недоступности в большинстве российских хирургических и онкологических клиник. В Руководствах ЕОК 2022г и Канадского кардиоваскулярного общества 2017г проведение КПНТ с целью стратификации риска послеоперационных осложнений и смертности не предусмотрено [6][29]. В соответствии с Рекомендациями Американской ассоциации сердца/Американской коллегии кардиологов 2014г проведение КПНТ может рассматриваться у пациентов, подлежащих операциям высокого хирургического риска, у которых функциональное состояние неизвестно [7].
Более широкое использование КПНТ целесообразно при оценке периоперационного риска у пациентов с раком легкого. Это связано с тем, что показатели КПНТ отражают не только коронарный, но и легочный функциональный резерв, ассоциированы с прогнозом как кардиальных, так и легочных послеоперационных осложнений [439]. В настоящее время получены доказательства значимости пикового потребления кислорода (VO2max) и вентиляционного эквивалента по углекислому газу (VE/VСO2) в прогнозе сердечно-легочных осложнений хирургических вмешательств на легких. Прогностическая ценность КПНТ увеличивается по мере ухудшения легочной функции после операции [445]. Поэтому целесообразность проведения теста устанавливается на основании оценки прогноза легочной функции после резекции легкого. В действующих рекомендациях Американской коллегии торакальных врачей по оценке риска у пациентов с раком легкого 2013г проведение КПНТ с определением VO2max рекомендуется пациентам с раком легкого и предсказанным послеоперационным объемом форсированного выдоха за 1 с (ппОФВ1) <30% или предсказанной послеоперационной диффузионной способности легких по монооксиду углерода (DLCO) <30% (1B) [431]. В алгоритме, предложенном М. Salati в 2016г, критерием для проведения КПНТ является ппОФВ1 <60% или предсказанной послеоперационной диффузионной способности легких по монооксиду углерода <60%. Далее по результатам КПНТ оцениваются VO2max и VE/VCO2. При VO2max <10 мл/кг/мин или VE/VCO2 >35 риск сердечно-легочных осложнений хирургического вмешательства и смерти считается высоким (рис. 8) [436].
"Низкотехнологичные" функциональные тесты (лестничная проба, тест шестиминутной ходьбы, тест прерывистой челночной ходьбы) могут использоваться в качестве первого скринингового теста с физической нагрузкой. В онкохирургии целесообразность их проведения обоснована, прежде всего, при раке легкого [437, 438, 446]. Согласно вышеупомянутым рекомендациям Американской коллегии торакальных врачей пациентам с раком легкого проведение лестничной пробы или теста прерывистой челночной ходьбы показано при нахождении ппОФВ1 или предсказанной послеоперационной диффузионной способности легких по монооксиду углерода (DLCO) в диапазоне от 30% до 60% (1С). Если по результатам проб дистанция челночной ходьбы <400 м или высота подъема в лестничной пробе <22 м, показано проведение КПНТ [431]. В позднее опубликованном алгоритме периоперационной оценки пациентов с раком легкого проведение данных функциональных проб рассматривается как альтернатива КПНТ у бессимптомных пациентов с ФР ССО [447].
Принципы и методы профилактики периоперационных ССО у пациентов с ЗНО не отличаются от таковых у пациентов общей популяции и включают продолжение приема бета-блокаторов и статинов, если они были показаны и назначены ранее (см. Разделы 5.3, 5.4). Рекомендуется скорректировать выявленные у пациента сердечно-сосудистые ФР, прежде всего курение [6]. Особое внимание следует обращать на периоперационную профилактику венозных тромбоэмболий в соответствии с действующими рекомендациями [434][448]. Все онкологические пациенты, которым планируется большая операция, должны получать медикаментозную профилактику НФГ или НМГ как минимум 7–10 дней после вмешательства. Более длительная (до 4–5 нед.) антикоагулянтная терапия показана после больших открытых или лапароскопических операций на брюшной полости и в малом тазу при наличии следующих факторов: ограниченная подвижность, ожирение, венозные тромбоэмболии в анамнезе [425][434]. В то же время эффективность периоперационного приема АСК и других антитромбоцитарных препаратов в профилактике периоперационных артериальных тромбозов не доказана. АСК перед онкологической операцией, как правило, отменяется, за исключением случаев недавнего ЧКВ [6]. Рутинного проведения предоперационной КГ не требуется. В выборе тактики по превентивной реваскуляризации миокарда у онкологических пациентов с коронарным атеросклерозом следует ориентироваться на актуальные российские и международные рекомендации по реваскуляризации миокарда [449][450].
C целью скрининга нарушений ритма всем пациентам с ЗНО рекомендуется периоперационный мониторинг ЭКГ [6]. Для профилактики и ранней диагностики СН кардиотоксического генеза у пациентов с ЗНО, получающих неоадьювантную (предоперационную) лекарственную противоопухолевую терапию, показаны тщательный кардиоваскулярный мониторинг и профилактическая медикаментозная терапия в соответствии с рекомендациями ЕОК по кардиоонкологии 2022г [451].
Оптимальная тактика хирургического лечения ЗНО у пациентов с высоким риском ССО должна приниматься на междисциплинарном консилиуме с участием всех заинтересованных специалистов (кардиолог, анестезиолог, хирург-онколог). При сочетании высокого риска ССО и высокого хирургического риска рекомендуется минимально-инвазивный хирургический подход или альтернативные нехирургические методы лечения [436][452][453]. В частности, в онкохирургии при планировании резекции легкого у пациентов высокого риска следует рассмотреть видеоассистированные и торакоскопические вмешательства [6].
Таблица 40
Рекомендации по предоперационному обследованию и ведению пациентов с заболеваниями периферических артерий и аорты
Рекомендации | Класс | Уровень | Ссылки |
Все пациенты с заболеваниями периферических артерий должны быть обследованы с целью выявления ИБС, и в случае наличия более двух клинических факторов риска следует рассмотреть вопрос о проведении неинвазивного нагрузочного тестирования в предоперационном периоде. | IIa | С | |
Проведение инвазивной КГ может быть рассмотрено у пациентов со стабильной ИБС перед проведением плановой каротидной эндартерэктомии. | IIb | В | [201] |
Профилактическая реваскуляризация миокарда целесообразна перед сосудистыми операциями. | IIa | В | [201][205][419] |
Сокращения: ИБС — ишемическая болезнь сердца, КГ — коронарография.
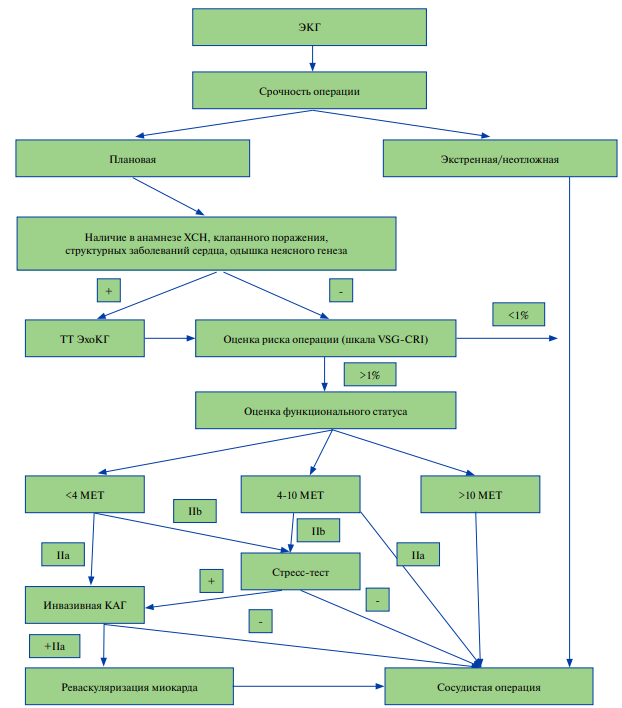
Рис. 7. Алгоритм периоперационного ведения пациентов при больших сосудистых операциях.
Сокращения: КАГ — коронароангиография, ТТ ЭхоКГ — трансторакальная эхокардиография, ХСН — хроническая сердечная недостаточность, ЭКГ — электрокардиография.
Таблица 41
Рекомендации по периоперационной тактике ведения пациентов с ЗНО
Рекомендации | Класс | Уровень | Ссылки |
Для оценки хирургического и сердечно-сосудистого периоперационного риска, функционального состояния у пациентов с ЗНО рекомендуется использовать те же подходы и принципы, что и у пациентов в общей популяции. | I | С | [6][209][421–423] |
Для оценки риска сердечно-сосудистых осложнений несердечной операции у пациентов с ЗНО следует применять шкалу ACS NSQIP. | IIа | В | [424–428] |
Для оценки риска больших сердечно-сосудистых событий при хирургическом лечении рака легкого следует применять шкалу ThRCR I. | IIa | В | [429–433] |
У пациентов с ЗНО и установленными ранее ССЗ или факторами риска ССЗ (включая возраст ≥65 лет), или симптомами, указывающими на ССЗ, рекомендуется измерять высокочувствительный тропонин T или I в крови перед операцией промежуточного и высокого риска, через 24 и 48 ч после нее. | I | B | [6] |
Для дополнительной оценки риска периоперационных сердечно-сосудистых событий и смертности у пациентов высокого риска* с ЗНО следует определять предоперационный уровень НУП. | IIа | В | [29][434][435] |
Для оценки предоперационного функционального статуса у пациентов с раком легкого высокого риска** можно рассмотреть использование кардиопульмонального нагрузочного теста. | IIb | В | [7][431][436] |
Для оценки предоперационного функционального статуса у бессимптомных пациентов с раком легкого, факторами риска и небольшим снижением легочной функции можно рассмотреть использование функциональных тестов (лестничная проба, тест шестиминутной ходьбы, тест прерывистой челночной ходьбы) в качестве скринингового теста. | IIb | С | [431][437][438] |
Медикаментозная профилактика периоперационных сердечно-сосудистых осложнений у пациентов с ЗНО осуществляется так же, как у хирургических пациентов в общей популяции. | I | С | [6][431] |
Для снижения риска периоперационных венозных тромбоэмболических осложнений пациентам с ЗНО, которым планируется большая операция, показана медикаментозная тромбопрофилактика нефракционированным или низкомолекулярным гепарином как минимум в течение 7–10 дней после вмешательства. | I | A | [434] |
Более длительная (до 4–5 нед.) антикоагулянтная терапия низкомолекулярными гепаринами показана после больших открытых или лапароскопических операций на брюшной полости и в малом тазу при наличии следующих факторов: ограниченная подвижность, ожирение, венозные тромбоэмболии в анамнезе и в отсутствие активного кровотечения и высокого геморрагического риска. | I | B | [425] |
Для снижения риска периоперационных сердечно-сосудистых осложнений у пациентов высокого риска с раком легкого при планировании резекции легкого следует рассмотреть видеоассистированные и торакоскопические вмешательства. | IIa | B | [6] |
Примечание: * — возраст ≥65 лет или ≥45 лет с ССЗ или индекс RCRI ≥1 [29]; ** — ThRCRI ≥2 или ССЗ, требующее лекарственной терапии, или вновь выявленное ССЗ, или невозможность подняться на 2 пролета по лестнице [431].
Сокращения: ЗНО — злокачественные новообразования, НУП — натрийуретический пептид, ССЗ — сердечно-сосудистые заболевания.
Таблица 42
Шкала ThRCRI
Критерий | Количество баллов |
ИБС в анамнезе | 1,5 |
Цереброваскулярная болезнь в анамнезе | 1,5 |
Креатинин сыворотки >2 мг/дл (177 мкмоль/л) | 1 |
Пневмонэктомия | 1,5 |
Класс А: 0 баллов. Риск сердечных осложнений 1,5% (низкий) Класс B: 1–1,5 балла. Риск сердечных осложнений 5,8% (умеренный) Класс С: 2–2,5 балла. Риск сердечных осложнений 19% (высокий) Класс D: >2,5 балла. Риск сердечных осложнений 23% (очень высокий) |
Сокращение: ИБС — ишемическая болезнь сердца.

Рис. 8. Алгоритм оценки риска ССО резекции легких у пациентов с раком легкого (адапт. по Salati M, 2016).
Сокращения: КПНТ — кардиопульмональный нагрузочный тест, ппОФВ1 — предсказанный послеоперационный объем форсированного выдоха за 1 с, ппDLCO — предсказанная послеоперационная диффузионная способность легких по монооксиду углерода, ThRCRI — Thoracic Revised Cardiac Risk Index, VE/VСO2 — вентиляционный эквивалент по углекислому газу, VO2max — пиковое потребление кислорода.
Нерешенные проблемы
Следует подчеркнуть, что выработка рекомендаций по оценке кардиального риска несердечных операций связана с объективными трудностями:
- Частота таких осложнений в каждом конкретном центре относительно невелика, и зачастую в клинике трудно сформировать свои подходы к оценке риска.
- Проведение многоцентровых исследований затруднено вследствие возможных различных диагностических и тактических подходов в разных клиниках.
- Также зачастую решение по тактике лечения пациентов принимается в рамках мультидисциплинарных консилиумов, что крайне затрудняет проведение рандомизации и может вести к эффекту смещения результатов.
- Как следствие, в данной области немного исследований, отвечающих стандартам доказательной медицины, разработанных на основе изучения новых фармпрепаратов. Кроме того, часть проведенных РКИ оказались невысокого качества, а результаты других были отозваны после проверки научной целостности. Соответственно, в выработке рекомендаций приходится опираться на данные регистров, исследования отдельных научных центров и на мнения экспертов.
- Как следствие, разные группы экспертов приходят к различным вариантам рекомендаций, основываясь вроде бы на одних и тех же опубликованных данных. С учетом национальных особенностей вполне логичным выглядит разработка отечественных рекомендаций по данному вопросу, что уже давно стоит в повестке дня.
Список литературы
1. Devereaux PJ, Sessler DI. Cardiac complications in patients undergoing major noncardiac surgery. N Engl J Med. 2015;373:2258–69.
2. Vascular Events in Noncardiac Surgery Patients Cohort Evaluation (VISION) Study Investigators. Association between complications and death within 30 days after noncardiac surgery. CMAJ. 2019;191(30): E830-E837. doi:10.1503/cmaj.190221.
3. International Surgical Outcomes Study group. Global patient outcomes after elective surgery: prospective cohort study in 27 low-, middleand high-income countries. Br J Anaesth. 2016;117(5):601–9. doi:10.1093/bja/aew316.
4. Smilowitz NR, Gupta N, Guo Y, et al. Perioperative acute myocardial infarction associated with non-cardiac surgery. Eur Heart J. 2017;38(31):2409–17. doi:10.1093/eurheartj/ehx313.
5. Smilowitz NR, Gupta N, Guo Y, et al. Trends in cardiovascular risk factor and disease prevalence in patients undergoing non-cardiac surgery. Heart. 2018;104(14):1180–6. doi:10.1136/heartjnl-2017-312391.
6. Halvorsen S, Mehilli J, Cassese S, et al. 2022 ESC Guidelines on cardiovascular assessment and management of patients undergoing non-cardiac surgery. European Heart Journal. 2022;43:3826–924. doi:10.1093/eurheartj/ehac270.
7. Fleisher LA, Fleischmann KE, Auerbach AD, et al. 2014 ACC/AHA guideline on perioperative cardiovascular evaluation and management of patients undergoing noncardiac surgery: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation. 2014;130: e278-e333. doi:10.1161/CIR.0000000000000106.
8. Smilowitz NR, Berger JS. Perioperative Cardiovascular Risk Assessment and Management for Noncardiac Surgery: A Review. JAMA. 2020;324(3):279–90.
9. Сумин А. Н., Корок Е. В., Белялов Ф. И. Периоперационноe ведение. В кн: Клинические рекомендации по кардиологии и коморбидным болезням. Под ред. Ф. И. Белялова. 11-е изд. Москва: ГЭОТАР-Медиа, 2021. с. 234–242. ISBN 978-5-9704-6040-5.
10. Wilcox T, Smilowitz NR, Xia Y, et al. Cardiovascular Risk Factors and Perioperative Myocardial Infarction After Noncardiac Surgery. Can J Cardiol. 2021;37(2):224–31.
11. Kalesan B, Nicewarner H, Intwala S, et al. Preoperative stress testing in the evaluation of patients undergoing non-cardiac surgery: A systematic review and meta-analysis. PLoS ONE. 2019;7: e0219145. doi:10.1371/journal.pone.0219145.
12. Rubin DS, Hughey R, Gerlach R, et al. Frequency and Outcomes of Preoperative Stress Testing in Total Hip and Knee Arthroplasty from 2004 to 2017. JAMA Cardiol. 2021;6(1):13–20.
13. Wijeysundera DN, Pearse RM, Shulman MA, et al.; METS study investigators. Assessment of functional capacity before major non-cardiac surgery: an international, prospective cohort study. Lancet. 2018;391(10140):2631–40. doi:10.1016/S0140-6736(18)31131-0. PMID: 30070222.
14. Wijeysundera DN, Beattie WS, Karkouti K, et al. Association of echocardiography before major elective non-cardiac surgery with postoperative survival and length of hospital stay: population based cohort study. BMJ. 2011;342: d3695.
15. Liu Z, Xu G, Zhang Y, et al. Preoperative Transthoracic Echocardiography Predicts Cardiac Complications in Elderly Patients with Coronary Artery Disease Undergoing Noncardiac Surgery. Clin Interv Aging. 2022;17:1151–61.
16. Chang HY, Chang WT, Liu YW. Application of transthoracic echocardiography in patients receiving intermediateor high-risk noncardiac surgery. PLoS ONE. 2019;14(4): e0215854.
17. Levitan E, Graham L, Valle J, et al. Pre-operative echocardiography among patients with coronary artery disease in the United States Veterans Affairs healthcare system: A retrospective cohort study. BMC Cardiovascular Disorders. 2016;1:173.
18. Kristensen SD, Knuuti J, Saraste A, et al. 2014 ESC/ESA Guidelines on non-cardiac surgery: cardiovascular assessment and management: The Joint Task Force on noncardiac surgery: cardiovascular assessment and management of the European Society of Cardiology (ESC) and the European Society of Anaesthesiology (ESA). Eur Heart J. 2014;35(35):2383–431.
19. Norderud K, Egholm G, Thim T, et al. Validation of the European Society of Cardiology and European Society of Anaesthesiology non-cardiac surgery risk score in patients treated with coronary drug-eluting stent implantation. Eur Heart J Qual Care Clin Outcomes. 2019;5(1):22–7.
20. Halliday A, Bulbulia R, Bonati L, et al. Second asymptomatic carotid surgery trial (ACST-2): a randomised comparison of carotid artery stenting versus carotid endarterectomy. The Lancet. 2021;10305:1065–73.
21. Wang J, Bai X, Wang T, et al. Carotid Stenting Versus Endarterectomy for Asymptomatic Carotid Artery Stenosis: A Systematic Review and Meta-Analysis. Stroke. 2022;10:3047–54.
22. Belialov F. Prognosis and scores in medicine. Moscow: GEOTAR-Media, 2023. 416 p. (In Russ.) Белялов Ф. И. Прогнозирование и шкалы в медицине. 4-е изд. Москва: ГЭОТАР-медиа, 2022. 416 с. ISBN 978-5-9704-7307-8.
23. Dilaver NM, Gwilym BL, Preece R, et al. Systematic review and narrative synthesis of surgeons’ perception of postoperative outcomes and risk. BJS Open. 2020;4(1):16–26.
24. Glance LG, Faden E, Dutton RP, et al. Impact of the Choice of Risk Model for Identifying Low-risk Patients Using the 2014 American College of Cardiology/American Heart Association Perioperative Guidelines. Anesthesiology. 2018;129(5):889–900.
25. Davis C, Tait G, Carroll J, et al. The Revised Cardiac Risk Index in the new millennium: a single-centre prospective cohort reevaluation of the original variables in 9,519 consecutive elective surgical patients. Can. J. Anaesth. 2013;60(9):855–63.
26. Fronczek J, Polok K, Devereaux PJ, et al. External validation of the Revised Cardiac Risk Index and National Surgical Quality Improvement Program Myocardial Infarction and Cardiac Arrest calculator in noncardiac vascular surgery. Br J Anaesth. 2019;123(4):421–9.
27. De Hert S, Staender S, Fritsch G, et al. Pre-operative evaluation of adults undergoing elective noncardiac surgery: Updated guideline from the European Society of Anaesthesiology. European Journal of Anaesthesiology (EJA). 2018;35.
28. ICSI Perioperative Guideline. Sixth Edition. 2020. 86 p. https://www.icsi.org/wp-content/uploads/2020/01/Periop_6th-Ed_2020_v2.pdf.
29. Duceppe E, Parlow J, MacDonald P, et al. Canadian Cardiovascular Society Guidelines on Perioperative Cardiac Risk Assessment and Management for Patients Who Undergo Noncardiac Surgery. Can J Cardiol. 2017;33(1):17–32.
30. Bilimoria KY, Liu Y, Paruch JL, et al. Development and Evaluation of the Universal ACS NSQIP Surgical Risk Calculator: A Decision Aid and In-formed Consent Tool for Patients and Surgeons. J. Am. Coll. Surg. 2013;217:833–42.e3.
31. Yap MKC, Ang KF, Gonzales-Porciuncula LA, et al. Validation of the American College of Surgeons Risk Calculator for preoperative risk stratification. Heart Asia. 2018;10(2): e010993.
32. Ford MK, Beattie WS, Wijeysundera DN. Systematic Review: Prediction of Perioperative Cardiac Complications and Mortality by the Revised Cardiac Risk Index. Ann. Intern. Med. 2010;152(1):26–35.
33. Andersson C, Wissenberg M, Jorgensen ME, et al. Age-specific performance of the revised cardiac risk index for predicting cardiovascular risk in elective noncardiac surgery. Circ. Cardiovasc. Qual. Outcomes. 2015;8(1):103–8.
34. McMillan MT, Allegrini V, Asbun HJ, et al. Incorporation of Procedure-specific Risk Into the ACS-NSQIP Surgical Risk Calculator Improves the Prediction of Morbidity and Mortality After Pancreatoduodenectomy. Ann. Surg. 2017;265(5):978–86.
35. Teoh D, Halloway RN, Heim J, et al. Evaluation of the American College of Surgeons National Surgical Quality Improvement Program Surgical Risk Calculator in Gynecologic Oncology Patients Undergoing Minimally Invasive Surgery. J. Minim. Invasive Gynecol. 2017;24(1):48–54.
36. Glasgow RE, Hawn MT, Hosokawa PW, et al. Comparison of Prospective Risk Estimates for Postoperative Complications: Human vs Computer Model. Journal of the American College of Surgeons. 2014;218(2):237–45.e4.
37. Knops AM, Legemate DA, Goossens A, et al. Decision aids for patients facing a surgical treatment decision: a systematic review and meta-analysis. Ann. Surg. 2013;257(5):860–6.
38. Farges O, Vibert E, Cosse C, et al. "Surgeons' intuition" versus "prognostic models": predicting the risk of liver resections. Ann Surg. 2014;260(5):923–8.
39. Lee TH, Marcantonio ER, Mangione CM, et al. Derivation and Prospective Validation of a Simple Index for Prediction of Cardiac Risk of Major Noncardiac Surgery. Circulation. 1999;100(10):1043–9.
40. Roshanov P, Sessler D, Chow C, et al. Predicting Myocardial Injury and Other Cardiac Complications After Elective Noncardiac Surgery with the Revised Cardiac Risk Index: The VISION Study. Canadian Journal of Cardiology. 2021;8:1215–24.
41. Beattie WS. A Simple, Reliable, and Validated Preoperative Cardiac Risk Index. Can J Cardiol. 2021;37(8):1159–62.
42. Gupta PK, Gupta H, Sundaram A, et al. Development and Validation of a Risk Calculator for Prediction of Cardiac Risk After Surgery. Circulation. 2011;124(4):381–7.
43. Cohn SL, Fernandez Ros N. Comparison of 4 Cardiac Risk Calculators in Predicting Postoperative Cardiac Complications After Noncardiac Operations. Am J Card. 2017;121(1):125–30.
44. Wilcox T, Smilowitz N, Xia Y, et al. Cardiovascular Risk Scores to Predict Perioperative Stroke in Noncardiac Surgery. Stroke. 2019;8:2002–6.
45. Dakik H, Chehab O, Eldirani M, et al. A New Index for Pre-Operative Cardiovascular Evaluation. Journal of the American College of Cardiology. 2019;24:3067–78.
46. King S, Calisi O, Caldwell C, et al. Frequency and Predictors of Preoperative Cardiac Testing Overuse in Low-Risk Patients Before Laparoscopic Bariatric Surgery. American Journal of Cardiology. 2023;186:181–5.
47. Msheik A, Kaspar C, Mailhac A, et al. Performance of the AUB-HAS2 Cardiovascular Risk Index in vascular surgery patients. Vasc Med. 2021;26(5):535–41. doi:10.1177/1358863X21996806.
48. Chehab O, Eldirani M, Tamim H, et al. Effect of age and gender on pre-operative cardiovascular risk assessment. Perioperative Medicine. 2022;1:23. doi:10.1186/s13741-022-00247-2.
49. Sumin AN, Barbarash OL, Barbarash LS. Cardiac complications in non-cardiac surgery. — Kemerovo: Kuzbassvuzizdat, 2013. 175 p. (In Russ.) Сумин А. Н., Барбараш О. Л., Барбараш Л. С. Кардиологические осложнения при некардиальных хирургических операциях. — Кемерово: Кузбассвузиздат, 2013. 175 с.
50. Bertges DJ, Goodney PP, Zhao Y, et al. The Vascular Study Group of New England Cardiac Risk Index (VSG-CRI) predicts cardiac complications more accurately than the Revised Cardiac Risk Index in vascular surgery patients. J. Vasc. Surg. 2010;52(3):674–83.
51. Bertges DJ, Neal D, Schanzer A, et al. The Vascular Quality Initiative Cardiac Risk Index for prediction of myocardial infarction after vascular surgery. J. Vasc. Surg. 2016;64(5):1411–21.e4.
52. Eslami MH, Rybin D, Doros G, et al. An externally validated robust risk predictive model of adverse outcomes after carotid endarterectomy. J. Vasc. Surg. 2016;63(2):345–54.
53. Snowden CP, Prentis JM, Anderson HL, et al. Submaximal cardiopulmonary exercise testing predicts complications and hospital length of stay in patients undergoing major elective surgery. Ann Surg. 2010;251:535–41.
54. Hartley RA, Pichel AC, Grant SW, et al. Preoperative cardiopulmonary exercise testing and risk of early mortality following abdominal aortic aneurysm repair. Br J Surg. 2012;99:1539–46.
55. Junejo MA, Mason JM, Sheen AJ, et al. Cardiopulmonary exercise testing for preoperative risk assessment before hepatic resection. Br J Surg. 2012;99:1097–104.
56. Paladugu S, Donato AA. Adding NT-proBNP to the Revised Cardiac Risk Index improved prediction of CV events after noncardiac surgery. Ann Intern Med. 2020;172(10): JC59. doi:10.7326/ACPJ202005190-059.
57. Duceppe E, Patel A, Chan MTV, et al. Preoperative N-Terminal Pro-B-Type Natriuretic Peptide and Cardiovascular Events After Noncardiac Surgery: A Cohort Study. Ann Intern Med. 2020;172(2):96–104. doi:10.7326/M19-2501. PMID: 31869834.
58. Gualandro DM, Yu PC, Caramelli B, et al. 3rd Guideline for Perioperative Cardiovascular Evaluation of the Brazilian Society of Cardiology. Arq Bras Cardiol 2017;109(3Suppl.1):1–104.
59. Reeves T, Bates S, Sharp T, et al. Perioperative Exercise Testing and Training Society (POETTS). Cardiopulmonary exercise testing (CPET) in the United Kingdom-a national survey of the structure, conduct, interpretation and funding. Perioper Med (Lond). 2018;7:2. doi:10.1186/s13741-017-0082-3.
60. Shulman MA, Cuthbertson BH, Wijeysundera DN, et al.; Measurement of Exercise Tolerance for Surgery Study Investigators. Using the 6-minute walk test to predict disability-free survival after major surgery. Br J Anaesth. 2019;122(1):111–9. doi:10.1016/j.bja.2018.08.016.
61. Rodseth RN, Biccard BM, Le Manach Y, et al. The prognostic value of pre-operative and post-operative B-type natriuretic peptides in patients undergoing noncardiac surgery: B-type natriuretic peptide and N-terminal fragment of pro-B-type natriuretic peptide: a systematic review and individual patient data meta-analysis. J Am Coll Cardiol. 2014;63:170–80. doi:10.1016/j.jacc.2013.08.1630.
62. Zhang LJ, Li N, Li Y, et al. Cardiac Biomarkers Predicting MACE in Patients Undergoing Noncardiac Surgery: A Meta-Analysis. Front Physiol. 2019;9:1923. doi:10.3389/fphys.2018.01923.
63. Vernooij LM, van Klei WA, Moons KG, et al. The comparative and added prognostic value of biomarkers to the Revised Cardiac Risk Index for preoperative prediction of major adverse cardiac events and all-cause mortality in patients who undergo noncardiac surgery. Cochrane Database Syst Rev. 2021;12(12): CD013139. doi:10.1002/14651858.CD013139.pub2.
64. Yurttas T, Hidvegi R, Filipovic M. Biomarker-Based Preoperative Risk Stratification for Patients Undergoing Non-Cardiac Surgery. J Clin Med. 2020;9(2):351. doi:10.3390/jcm9020351.
65. Ruetzler K, Smilowitz NR, Berger JS, et al. Diagnosis and Management of Patients With Myocardial Injury After Noncardiac Surgery: A Scientific Statement From the American Heart Association. Circulation. 2021;144(19):287–305. doi:10.1161/CIR.0000000000001024. Epub 2021 Oct 4. PMID: 34601955.
66. Thygesen K, Alpert JS, Jaffe AS, et al.; Executive Group on behalf of the Joint European Society of Cardiology (ESC)/American College of Cardiology (ACC)/American Heart Association (AHA)/World Heart Federation (WHF) Task Force for the Universal Definition of Myocardial Infarction. Fourth Universal Definition of Myocardial Infarction (2018). Circulation. 2018;138(20): e618-e651. doi:10.1161/CIR.0000000000000617. Erratum in: Circulation. 2018;138(20):652. PMID: 30571511.
67. Botto F, Alonso-Coello P, Chan MT, et al. Myocardial injury after noncardiac surgery: a large, international, prospective cohort study establishing diagnostic criteria, characteristics, predictors, and 30-day outcomes. Anesthesiology. 2014;120(3):564–78. doi:10.1097/ALN.0000000000000113. PMID: 24534856.
68. Salmasi V, Maheshwari K, Yang D, et al. Relationship between intraoperative hypotension, defined by either reduction from baseline or absolute thresholds, and acute kidney and myocardial injury after noncardiac surgery: a retrospective cohort analysis. Anesthesiology. 2017;126:47–65. doi:10.1097/ALN.0000000000001432.
69. Baigent C, Blackwell L, Collins R, et al. Aspirin in the primary and secondary prevention of vascular disease: collaborative meta-analysis of individual participant data from randomised trials. Lancet. 2009;373:1849–60. doi:10.1016/S0140-6736(09)60503-1.
70. Baigent C, Keech A, Kearney P, et al.; Cholesterol Treatment Trialists’ (CTT) Collaborators. Efficacy and safety of cholesterol-lowering treatment: prospective meta-analysis of data from 90,056 participants in 14 randomised trials of statins. Lancet. 2005;366:1267–78. doi:10.1016/S0140-6736(05)67394-1.
71. Foucrier A, Rodseth R, Aissaoui M, et al. The long-term impact of early cardiovascular therapy intensification for postoperative troponin elevation after major vascular surgery. Anesth Analg. 2014;119:1053–63. doi:10.1213/ANE.0000000000000302.
72. Parashar A, Agarwal S, Krishnaswamy A, et al. Percutaneous intervention for myocardial infarction after noncardiac surgery: patient characteristics and outcomes. J Am Coll Cardiol. 2016;68:329–38. doi:10.1016/j.jacc.2016.03.602.
73. Writing Committee for the VISION Study Investigators. Association of Postoperative High-Sensitivity Troponin Levels With Myocardial Injury and 30-Day Mortality Among Patients Undergoing Noncardiac Surgery. JAMA. 2017;317(16):1642–51. doi:10.1001/jama.2017.4360. PMID: 28444280.
74. Serrano AB, GomezRojo M, Ureta E, et al. Preoperative clinical model to predict myocardial injury after non-cardiac surgery: a retrospective analysis from the MANAGE cohort in a Spanish hospital. BMJ Open. 2021;11: e045052. doi:10.1136/bmjopen-2020-045052.
75. Smilowitz NR, Redel-Traub G, Hausvater A, et al. Myocardial Injury After Noncardiac Surgery: A Systematic Review and Meta-Analysis. Cardiol Rev. 2019;27(6):267–73. doi:10.1097/CRD.0000000000000254. PMID: 30985328; PMCID: PMC6776733.
76. Devereaux PJ, Duceppe E, Guyatt G, et al.; MANAGE Investigators. Dabigatran in patients with myocardial injury after non-cardiac surgery (MANAGE): an international, randomised, placebo-controlled trial. Lancet. 2018;391:2325–34. doi:10.1016/S01406736(18)30832-8.
77. Devereaux PJ, Xavier D, Pogue J, et al.; POISE (PeriOperative ISchemic Evaluation) Investigators. Characteristics and short-term prognosis of perioperative myocardial infarction in patients undergoing noncardiac surgery: a cohort study. Ann Intern Med. 2011;154:523–8. doi:10.7326/0003-4819-154-8-201104190-00003.
78. Amsterdam EA, Wenger NK, Brindis RG, et al. 2014 AHA/ACC guideline for the management of patients with non-ST-elevation acute coronary syndromes: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines [published correction appears in Circulation. 2014;130:433–4]. Circulation. 2014;130(25): e344–426. doi:10.1161/CIR.0000000000000134.
79. Jeger RV, Probst C, Arsenic R, et al. Longterm prognostic value of the pre-operative 12-lead electrocardiogram before major noncardiac surgery in coronary artery disease. Am Heart J. 2006;151:508–13.
80. Schein OD, Katz J, Bass EB, et al. The value of routine pre-operative medical testing before cataract surgery. Study of Medical Testing for Cataract Surgery. N Engl J Med. 2000;342:168–75.
81. Noordzij PG, Boersma E, Bax JJ, et al. Prognostic value of routine preoperative electrocardiography in patients undergoing noncardiac surgery. Am J Cardiol. 2006;97:1103–6.
82. Чомахидзе П. Ш., Мозжухина Н. В., Полтавская М. Г. др. Применение методов функциональной диагностики для оценки кардиального риска у пациентов старше 65 лет или с наличием кардиальной патологии при плановых абдоминальных хирургических вмешательствах. Кардиология. 2019;59(1):69–78. doi:10.18087/cardio.2019.1.10210.
83. Wirthlin DJ, Cambria RP. Surgery-specific considerations in the cardiac patient undergoing noncardiac surgery. Prog Cardiovasc Dis. 1998;40:453–68.
84. Kumar R, McKinney W P, Raj G, et al. Adverse Cardiac Events After Surgery Assessing Risk in a Veteran Population. J Gen Intern Med. 2001;16(8):507–18. doi:10.1046/j.15251497.2001.016008507.x.
85. Hollenberg M, Mangano DT, Browner WS, et al. Predictors of postoperative myocardial ischemia in patients undergoing noncardiac surgery. The Study of Perioperative Ischemia Research Group. JAMA. 1992;268(2):205–9.
86. Biteker M, Duman D, Tekkeşin AI. Predictive value of preoperative electrocardiography for perioperative cardiovascular outcomes in patients undergoing noncardiac, nonvascular surgery. Clin Cardiol. 2012;35(8):494–9.
87. Макаров Л. М., Комолятова В. Н., Куприянова О. О. и др. Национальные российские рекомендации по применению методики холтеровского мониторирования в клинической практике. Российский кардиологический журнал. 2014;(2):6–71. doi:10.15829/1560-4071-2014-2-6-71.
88. Steinberg JS, Varma N, Cygankiewicz I, et al. 2017 ISHNE-HRS expert consensus statement on ambulatory ECG and external cardiac monitoring/telemetry. Heart Rhythm. 2017;14(7): e55-e96.
89. Rohde LE, Polanczyk CA, Goldman L, et al. Usefulness of transthoracic echocardiography as a tool for risk stratification of patients undergoing major noncardiac surgery. Am J Cardiol. 2001;87:505–9.
90. Sougawa H, Ino Y, Kitabata H, et al. Impact of left ventricular ejection fraction and preoperative hemoglobin level on perioperative adverse cardiovascular events in noncardiac surgery. Heart Vessels. 2021;36:1317–26.
91. Hreybe H, Zahid M, Sonel A, et al. Noncardiac surgery and the risk of death and other cardiovascular events in patients with hypertrophic cardiomyopathy. Clin Cardiol. 2006;29:65–8.
92. Kertai MD, Bountioukos M, Boersma E, et al. Aortic stenosis: an underestimated risk factor for perioperative complications in patients undergoing noncardiac surgery. Am J Med. 2004;116:8–13.
93. Halm EA, Browner WS, Tubau JF, et al. Echocardiography for assessing cardiac risk in patients having noncardiac surgery. Study of Peri-operative Ischemia Research Group. Ann Intern Med. 1996;125:433–41.
94. Tashiro T, Pislaru SV, Blustin JM, et al. Perioperative risk of major non-cardiac surgery in patients with severe aortic stenosis: a reappraisal in contemporary practice. Eur Heart J. 2014;35:2372–81.
95. Calleja AM, Dommaraju S, Gaddam R, et al. Cardiac risk in patients aged.75 years with asymptomatic, severe aortic stenosis undergoing noncardiac surgery. Am J Cardiol. 2010;105:1159–63.
96. Kazmers A, Cerqueira MD, Zierler RE. Peri-operative and late outcome in patients with left ventricular ejection fraction of 35% or less who require major vascular surgery. J Vasc Surg. 1988;8:307–15.
97. Чомахидзе П. Ш., Полтавская М. Г., Седов В. П., Сыркин А. Л. Современные показатели эхокардиографии в прогнозировании кардиального риска при плановом протезировании коленного или тазобедренного сустава. Ультразвуковая и функциональная диагностика. 2017;2:49–59.
98. Howard-Quijano K, Salem A, Barkulis C, et al. Preoperative Three-Dimensional Strain Imaging Identifies Reduction in Left Ventricular Function and Predicts Outcomes After Cardiac Surgery. Anesth Analg. 2017;124(2):419–28.
99. Чомахидзе П. Ш., Мозжухина Н. В., Полтавская М. Г. и др. Эхокардиография с тканевой допплерографией и оценкой деформации микоарда в прогнозировании кардиального риска плановых абдоминальных хирургических вмешательств. Ультразвуковая и функциональная диагностика. 2016;5:33–41.
100. Goo-Yeong Ch, Sang-Ho J, Min-Kyu K, et al. Left atrial dyssynchrony assessed by strain imaging in predicting future development of atrial fibrillation in patients with heart failure. Int. J. Cardiol. 2009;134(3):336–41.
101. Cho DH, Park SM, Kim MN, et al. Presence of preoperative diastolic dysfunction predicts postoperative pulmonary edema and cardiovascular complications in patients undergoing noncardiac surgery. Echocardiography. 2014;31(1):42–9.
102. Visseren FLJ, Mach F, Smulders YM, et al. 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice. Eur Heart J. 2021;42:3227–337. doi:10.1093/eurheartj/ehab484.
103. Shah S, Urtecho M, Firwana M, et al. Perioperative Management of Antiplatelet Therapy: A Systematic Review and Meta-analysis. Mayo Clin Proc Innov Qual Outcomes. 2022;6(6):564–73. doi:10.1016/j.mayocpiqo.2022.09.006.
104. Devereaux PJ, Mrkobrada M, Sessler DI, et al. Aspirin in patients undergoing noncardiac surgery. N Engl J Med. 2014;370:1494–503. doi:10.1056/NEJMoa1401105.
105. Graham MM, Sessler DI, Parlow JL, et al. Aspirin in patients with previous percutaneous coronary intervention undergoing noncardiac surgery. Ann Intern Med. 2018;168:237– 44. doi:10.7326/M17-2341.
106. Alkhalil M, Edwards R, Puri R, et al. Aspirin Versus Dual Antiplatelet Therapy in Patients Undergoing Trans-Catheter Aortic Valve Implantation, Updated Meta-Analysis. Cardiovasc Drugs Ther. 2022;36(2):279–83. doi:10.1007/s10557-021-07146-6.
107. Collet JP, Thiele H, Barbato E, et al. 2020 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation. Eur Heart J. 2021;42:1289–367. doi:10.1093/eurheartj/ehaa575.
108. Knuuti J, Wijns W, Saraste A, et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. Eur Heart J. 2020;41:407–77. doi:10.1093/eurheartj/ehz425.
109. Berger PB, Kleiman NS, Pencina MJ, et al. Frequency of major noncardiac surgery and subsequent adverse events in the year after drug-eluting stent placement results from the EVENT (Evaluation of Drug-Eluting Stents and Ischemic Events) Registry. JACC Cardiovasc Interv. 2010;3:920–7. doi:10.1016/j.jcin.2010.03.021.
110. Saia F, Belotti LMB, Guastaroba P, et al. Risk of adverse cardiac and bleeding events following cardiac and noncardiac surgery in patients with coronary stent: how important is the interplay between stent type and time from stenting to surgery? Circ Cardiovasc Qual Outcomes. 2016;9:39–47. doi:10.1161/CIRCOUTCOMES.115.002155.
111. Siller-Matula JM, Petre A, Delle-Karth G, et al. Impact of preoperative use of P2Y12 receptor inhibitors on clinical outcomes in cardiac and non-cardiac surgery: a systematic review and meta-analysis. Eur Heart J Acute Cardiovasc Care. 2017;6:753–70. doi:10.1177/2048872615585516.
112. Mehran R, Baber U, Steg PG, et al. Cessation of dual antiplatelet treatment and cardiac events after percutaneous coronary intervention (PARIS): 2 year results from a prospective observational study. Lancet. 2013;382:1714–22. doi:10.1016/S0140-6736(13)61720-1.
113. Valgimigli M, Bueno H, Byrne RA, et al. 2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTS: the Task Force for dual antiplatelet therapy in coronary artery disease of the European Society of Cardiology (ESC) and of the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J. 2018;39:213–60. doi:10.1093/eurheartj/ehx419.
114. Feres F, Costa RA, Abizaid A, et al. Three vs twelve months of dual antiplatelet therapy after zotarolimus-eluting stents: the OPTIMIZE randomized trial. JAMA. 2013;310:2510– 22. doi:10.1001/jama.2013.282183.
115. Beyer-Westendorf J, Gelbricht V, Forster K, et al. Peri-interventional management of novel oral anticoagulants in daily care: results from the prospective Dresden NOAC registry. Eur Heart J. 2014;35:1888–96. doi:10.1093/eurheartj/eht557.
116. Douketis JD, Spyropoulos AC, Kaatz S, et al. Perioperative bridging anticoagulation in patients with atrial fibrillation. N Engl J Med. 2015;373:823–33. doi:10.1056/ NEJMoa1501035.
117. Kuo HC, Liu FL, Chen JT, et al. Thromboembolic and bleeding risk of periprocedural bridging anticoagulation: a systematic review and meta-analysis. Clin Cardiol. 2020;43:441–9. doi:10.1002/clc.23336.
118. Kovacs MJ, Wells PS, Anderson DR, et al. Postoperative low molecular weight heparin bridging treatment for patients at high risk of arterial thromboembolism (PERIOP2): double blind randomised controlled trial. BMJ. 2021;373: n1205. doi:10.1136/bmj.n1205.
119. Caldeira D, David C, Santos AT, et al. Efficacy and safety of low molecular weight heparin in patients with mechanical heart valves: systematic review and meta-analysis. J Thromb Haemost. 2014;12:650–9. doi:10.1111/jth.12544.
120. Birnie DH, Healey JS, Wells GA, et al. Pacemaker or defibrillator surgery without interruption of anticoagulation. N Engl J Med. 2013;368:2084–93. doi:10.1056/NEJMoa1302946.
121. Sant’anna RT, Leiria TL, Nascimento T, et al. Meta-analysis of continuous oral anticoagulants versus heparin bridging in patients undergoing CIED surgery: reappraisal after the BRUISE study. Pacing Clin Electrophysiol. 2015;38:417–23. doi:10.1111/pace.12557.
122. Eichhorn W, Barsukov E, Al-Dam A, et al. Postoperative bleeding risk for cutaneous surgery in the head and neck region with continued phenprocoumon therapy. J CranioMaxillofac Surg. 2014;42:608–11. doi:10.1016/j.jcms.2013.08.006.
123. Chai-Adisaksopha C, Hillis C, Siegal DM, et al. Prothrombin complex concentrates versus fresh frozen plasma for warfarin reversal: a systematic review and meta-analysis. Thromb Haemost. 2016;116:879–90. doi:10.1160/TH16-04-0266.
124. Pollack CV Jr., Reilly PA, van Ryn J, et al. Idarucizumab for dabigatran reversal — full cohort analysis. N Engl J Med. 2017;377:431–41. doi:10.1056/NEJMoa1707278.
125. Connolly SJ, Crowther M, Eikelboom JW, et al. Full study report of andexanet alfa for bleeding associated with factor Xa inhibitors. N Engl J Med. 2019;380:1326–35. doi:10.1056/NEJMoa1814051.
126. Majeed A, Ågren A, Holmström M, et al. Management of rivaroxabanor apixabanassociated major bleeding with prothrombin complex concentrates: a cohort study. Blood. 2017;130:1706–12. doi:10.1182/blood-2017-05-782060.
127. Healey JS, Eikelboom J, Douketis J, et al. Periprocedural bleeding and thromboembolic events with dabigatran compared with warfarin: results from the Randomized Evaluation of Long-Term Anticoagulation Therapy (RE-LY) Randomized Trial. Circulation. 2012;126:343–8. doi:10.1161/CIRCULATIONAHA.111.090464.
128. Garcia D, Alexander JH, Wallentin L, et al. Management and clinical outcomes in patients treated with apixaban vs warfarin undergoing procedures. Blood. 2014;124:3692–8. doi:10.1182/blood-2014-08-595496.
129. Sherwood MW, Douketis JD, Patel MR, et al. Outcomes of temporary interruption of rivaroxaban compared with warfarin in patients with nonvalvular atrial fibrillation: results from the rivaroxaban once daily, oral, direct factor Xa inhibition compared with vitamin K antagonism for prevention of stroke and embolism trial in atrial fibrillation (ROCKET AF). Circulation. 2014;129:1850–9. doi:10.1161/CIRCULATIONAHA.113.005754.
130. Albaladejo P, Pernod G, Godier A, et al. Management of bleeding and emergency invasive procedures in patients on dabigatran: updated guidelines from the French Working Group on Perioperative Haemostasis (GIHP) — September 2016. Anaesth Crit Care Pain Med. 2018;37:391–9. doi:10.1016/j.accpm.2018.04.009.
131. Narouze S, Benzon HT, Provenzano DA, et al. Interventional spine and pain procedures in patients on antiplatelet and anticoagulant medications: guidelines from the American Society of Regional Anesthesia and Pain Medicine, the European Society of Regional Anaesthesia and Pain Therapy, the American Academy of Pain Medicine, the International Neuromodulation Society, the North American Neuromodulation Society, and the World Institute of Pain. Reg Anesth Pain Med. 2015;40:182–212. doi:10.1097/AAP.0000000000000223.
132. Neumann FJ, Sousa-Uva M, Ahlsson A, et al. 2018 ESC/EACTS Guidelines on myocardial revascularization. Eur Heart J. 2019;40:87–165. doi:10.1093/eurheartj/ehy394.
133. Hindricks G, Potpara T, Dagres N, et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J. 2021;42:373–498. doi:10.1093/eurheartj/ehaa612.
134. Nijenhuis VJ, Brouwer J, Delewi R, et al. Anticoagulation with or without clopidogrel after transcatheter aortic-valve implantation. N Engl J Med. 2020;382:1696–707. doi:10.1056/NEJMoa1915152.
135. Godier A, Dincq AS, Martin AC, et al. Predictors of pre-procedural concentrations of direct oral anticoagulants: a prospective multicentre study. Eur Heart J. 2017;38:2431–9. doi:10.1093/eurheartj/ehx403.
136. Douketis JD, Spyropoulos AC, Duncan J, et al. Perioperative management of patients with atrial fibrillation receiving a direct oral anticoagulant. JAMA Intern Med. 2019;179:1469– 78. doi:10.1001/jamainternmed.2019.2431.
137. Steffel J, Collins R, Antz M, et al. 2021 European Heart Rhythm Association Practical Guide on the use of non-vitamin k antagonist oral anticoagulants in patients with atrial fibrillation. Europace. 2021;23:1612–76. doi:10.1093/europace/euab065.
138. Gangireddy C, Rectenwald JR, Upchurch GR, et al. Risk factors and clinical impact of postoperative symptomatic venous thromboembolism. J Vasc Surg. 2007;45:335–41; discussion 341–2. doi:10.1016/j.jvs.2006.10.034.
139. Caprini JA. Risk assessment as a guide for the prevention of the many faces of venous thromboembolism. Am J Surg. 2010;199: S3-S10. doi:10.1016/j.amjsurg.2009.10.006.
140. Falck-Ytter Y, Francis CW, Johanson NA, et al. Prevention of VTE in orthopedic surgery patients: antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest. 2012;141: e278S-e325S. doi:10.1378/chest.11-2404.
141. Cimminiello C, Prandoni P, Agnelli G, et al. Thromboprophylaxis with enoxaparin and direct oral anticoagulants in major orthopedic surgery and acutely ill medical patients: a meta-analysis. Intern Emerg Med. 2017;12:1291–305. doi:10.1007/s11739-0171714-9.
142. Cassidy MR, Rosenkranz P, McAneny D. Reducing postoperative venous thromboembolism complications with a standardized risk-stratified prophylaxis protocol and mobilization program. J Am Coll Surg. 2014;218:1095–104. doi:10.1016/j.jamcollsurg.2013.12.061.
143. Roshanov PS, Rochwerg B, Patel A, et al. Withholding versus continuing angiotensinconverting enzyme inhibitors or angiotensin II receptor blockers before noncardiac surgery: an analysis of the vascular events in noncardiac surgery patients cohort evaluation prospective cohort. Anesthesiology. 2017;(1):16–27.
144. Hollmann C, Fernandes NL, Biccard BM. A Systematic Review of Outcomes Associated With Withholding or Continuing Angiotensin-Converting Enzyme Inhibitors and Angiotensin Receptor Blockers Before Noncardiac Surgery. Anesth Analg. 2018;127(3):678–87. doi:10.1213/ANE.0000000000002837.
145. Williams B, Mancia G, Spiering W, et al.; ESC Scientific Document Group. 2018 ESC/ESH Guidelines for the management of arterial hypertension. Eur Heart J. 2018;39(33):3021–104. doi:10.1093/eurheartj/ehy339.
146. Turan A, You J, Shiba A, et al. Angiotensin converting enzyme inhibitors are not associated with respiratory complications or mortality after noncardiac surgery. Anesth Analg. 2012;114:552–60.
147. Zou Z, Yuan HB, Yang B, et al. Perioperative angiotensin-converting enzyme inhibitors or angiotensin II type 1 receptor blockers for preventing mortality and morbidity in adults. Cochrane Database of Systematic Reviews. 2016;2016(1):1–47.
148. STARSurg Collaborative. Association between peri-operative angiotensin-converting enzyme inhibitors and angiotensin-2 receptor blockers and acute kidney injury in major elective non-cardiac surgery: a multicentre, prospective cohort study. STARSurg Collaborative. Anaesthesia. 2018;73(10):1214–22. doi:10.1111/anae.14349.
149. Lindenauer PK, Pekow P, Wang K, et al. Perioperative beta-blocker therapy and mortality after major noncardiac surgery. N Engl J Med. 2005;353:349–61.
150. Andersson C, Mérie C, Jørgensen M, et al. Association of beta-blocker therapy with risks of adverse cardiovascular events and deaths in patients with ischemic heart disease undergoing noncardiac surgery: a Danish nationwide cohort study. JAMA Intern Med. 2014;174:336–44.
151. Hoeks SE, Scholte Op Reimer WJM, van Urk H, et al. Increase of 1-year mortality after perioperative beta-blocker withdrawal in endovascular and vascular surgery patients. Eur J Vasc Endovasc Surg. 2007;33:13–9.
152. Barrett TW, Mori M, De Boer D. Association of ambulatory use of statins and betablockers with longterm mortality after vascular surgery. J Hosp Med. 2007;2:241–52.
153. London MJ, Hur K, Schwartz GG, et al. Association of perioperative beta-blockade with mortality and cardiovascular morbidity following major noncardiac surgery. JAMA. 2013;309:1704–13.
154. Kwon S, Thompson R, Florence M, et al. b-blocker continuation after noncardiac surgery: a report from the surgical care and outcomes assessment program. Arch Surg. 2012;147:467–73.
155. Mangano DT, Layug EL, Wallace A, Tateo I. Effect of atenolol on mortality and cardiovascular morbidity after noncardiac surgery. Multicenter Study of Peri-operative Ischemia Research Group. New Engl J Med. 1996;335:1713–20.
156. Wallace A, Layug B, Tateo I, et al. Prophylactic atenolol reduces post-operative myocardial ischemia. McSPI Research Group. Anesthesiology 1998;88:7–17.
157. Flu WJ, van Kuijk JP, Chonchol M, et al. Timing of pre-operative beta-blocker treatment in vascular surgery patients: influence on post-operative outcome. J Am Coll Cardiol. 2010;56(23):1922–9. doi:10.1016/j.jacc.2010.05.056.
158. Le Manach Y, Collins GS, Ibanez C, et al. Impact of perioperative bleeding on the protective effect of beta-blockers during infrarenal aortic reconstruction. Anesthesiology. 2012;117:1203–11.
159. Devereaux PJ, Yang H, Guyatt GH, et al. Rationale, design, and organization of the PeriOperative ISchemic Evaluation (POISE) trial: a randomised controlled trial of metoprolol versus placebo in patients undergoing noncardiac surgery. Am Heart J. 2006;152:223–30.
160. Jørgensen ME, Sanders RD, Køber L, et al. Beta-blocker subtype and risks of perioperative adverse events following non-cardiac surgery: a nationwide cohort study. European Heart Journal. 2017;38:2421–8. doi:10.1093/eurheartj/ehx214.
161. Blessberger H, Lewis SR, Pritchard MW, et al. Perioperative beta-blockers for preventing surgery-related mortality and morbidity in adults undergoing non-cardiac surgery. Cochrane Database Syst Rev. 2019;9(9): CD013438. doi:10.1002/14651858.CD013438.
162. Wijeysundera DN, Duncan D, Nkonde-Price C, et al. Perioperative beta blockade in noncardiac surgery: a systematic review for the 2014 ACC/AHA guideline on perioperative cardiovascular evaluation and management of patients undergoing noncardiac surgery: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines. Circulation. 2014;130:2246–64.
163. Angeli F, Verdecchia P, Karthikeyan G, et al. b-Blockers reduce mortality in patients undergoing high-risk non-cardiac surgery. Am J Cardiovasc Drugs. 2010;10:247–59.
164. Iwano T, Toda H, Nakamura K; MAMACARI Investigators. Preventative effects of bisoprolol transdermal patches on postoperative atrial fibrillation in high-risk patients undergoing non-cardiac surgery: A subanalysis of the MAMACARI study. J Cardiol. 2021;78(5):349–54. doi:10.1016/j.jjcc.2021.05.001.
165. Hajibandeh S, Hajibandeh S, Antoniou SA, et al. Effect of betablockers on perioperative outcomes in vascular and endovascular surgery: a systematic review and meta-analysis. Br J Anaesth. 2017;118:11–21.
166. Ellenberger C, Tait G, Beattie WS. Chronic beta blockade is associated with a better outcome after elective noncardiac surgery than acute beta blockade: a singlecenter propensity-matched cohort study. Anesthesiology 2011;114:817–23.
167. Zaugg M, Bestmann L, Wacker J, et al. Adrenergic receptor genotype but not perioperative bisoprolol therapy may determine cardiovascular outcome in at-risk patients undergoing surgery with spinal block: the Swiss Beta Blocker in Spinal Anesthesia (BBSA) study: a double-blinded, placebocontrolled, multicenter trial with 1-year follow-up. Anesthesiology. 2007;107:33–44.
168. Wallace AW, Au S, Cason BA. Association of the pattern of use of perioperative betablockade and postoperative mortality. Anesthesiology. 2010;113:794–805.
169. Alegria S, Costa J, Vaz-Carneiro A, Caldeira D. Cochrane Corner: Perioperative betablockers for preventing surgery-related mortality and morbidity. Rev Port Cardiol (Engl Ed). 2019;38(10):691–4. doi:10.1016/j.repc.2018.10.014.
170. Toda H, Nakamura K, Shimizu K; MAMACARI Investigators. Effects of Bisoprolol Transdermal Patches for Prevention of Perioperative Myocardial Injury in High-Risk Patients Undergoing Non-Cardiac Surgery — Multicenter Randomized Controlled Study. Circ J. 2020;84(4):642–9. doi:10.1253/circj.CJ-19-0871.
171. Putzu A, de Carvalho E Silva CMPD, de Almeida JP, et al. Perioperative statin therapy in cardiac and non-cardiac surgery: a systematic review and meta-analysis of randomized controlled trials. Ann Intensive Care. 2018;27;8(1):95. doi:10.1186/s13613-018-0441-3.
172. Berwanger O, Le Manach Y, Suzumura EA, et al.; VISION Investigators. Association between pre-operative statin use and major cardiovascular complications among patients undergoing non-cardiac surgery: the VISION study European Heart Journal. 2016;37:177–85. doi:10.1093/eurheartj/ehv456.
173. Richman JS, Graham LA, DeRussy A, et al. Perioperative beta blockers and statins for noncardiac surgery patients with coronary stents. The American Journal of Surgery. 2017;214(2):180–5. doi:10.1016/j.amjsurg.2017.05.001.
174. Lindenauer PK, Pekow P, Wang K, et al. Lipidlowering therapy and in-hospital mortality following major noncardiac surgery. JAMA. 2004;291:2092–9.
175. Kennedy J, Quan H, Buchan AM, et al. Statins are associated with better outcomes after carotid endarterectomy in symptomatic patients. 2005;36(10):2072–6. doi:10.1161/01.STR.0000183623.28144.32.
176. Desai H, Aronow WS, Ahn C, et al. Incidence of perioperative myocardial infarction and of 2-year mortality in 577 elderly patients undergoing noncardiac vascular surgery treated with and without statins. Arch Gerontol Geriatr. 2010;51:149–51.
177. de Waal BA, Buise MP, van Zundert AA. Perioperative statin therapy in patients at high risk for cardiovascular morbidity undergoing surgery: a review. British Journal of Anaesthesia. 2015;114(1):44–52.
178. Durazzo AES, Machado FS, Ikeoka DT, et al. Reduction in cardiovascular events after vascular surgery with atorvastatin: a randomized trial. J Vasc Surg. 2004;39:967–75.
179. Schouten O, Boersma E, Hoeks SE, et al. Fluvastatin and perioperative events in patients undergoing vascular surgery. N Engl J Med. 2009;361:980–9.
180. Baigent C, Landry M. Study of Heart and Renal Protection (SHARP). Kidney Int Suppl. 2003;(84): S207–10. doi:10.1046/j.1523-1755.63.s84.4.x.
181. Greve AM, Bang CN, Boman K, et al. Effect Modifications of Lipid-Lowering Therapy on Progression of Aortic Stenosis (from the Simvastatin and Ezetimibe in Aortic Stenosis [SEAS] Study). Am J Cardiol. 2018;121(6):739–45. doi:10.1016/j.amjcard.2017.12.011.
182. Sharma A, Sun JL, Lokhnygina Y, et al. Patient Phenotypes, Cardiovascular Risk, and Ezetimibe Treatment in Patients After Acute Coronary Syndromes (from IMPROVE-IT). Am J Cardiol. 2019 Apr 15;123(8):1193–201. doi:10.1016/j.amjcard.2019.01.034.
183. Ahmed O, Littmann K, Gustafsson U, et al. Ezetimibe in Combination With Simvastatin Reduces Remnant Cholesterol Without Affecting Biliary Lipid Concentrations in Gallstone Patients. J Am Heart Assoc. 2018 Dec 18;7(24): e009876. doi:10.1161/JAHA.118.009876.
184. Wang W, Feng Z, Bai J. Effects of alirocumab on cardiovascular events and all-cause mortality: a systematic review and meta-analysis. Rev Cardiovasc Med. 2021 Sep 24;22(3):873–81. doi:10.31083/j.rcm2203093.
185. Mizobe T, Nakamura M, Motooka Y, et al. Impact of Additional Lipid-Lowering Therapy on New Ischemic Lesions of Diffusion-Weighted Imaging in Carotid Artery Stenting. J Stroke Cerebrovasc Dis. 2018 Mar;27(3):764–70. doi:10.1016/j.jstrokecerebrovasdis.2017.10.009.
186. Bamgboye AO, Oni IO, Collier A. Predisposing factors for the development of diabetic ketoacidosis with lower than anticipated glucose levels in type 2 diabetes patients on SGLT2-inhibitors: a review. Eur J Clin Pharmacol. 2021 May;77(5):651–7. doi:10.1007/s00228-020-03051-3.
187. US Food and Drug Administration. FDA drug safety communication: FDA revises labels of SGLT2 inhibitors for diabetes to include warnings about too much acid in the blood and serious urinary tract infections. Available from: https://www.fda.gov/Drugs/DrugSafety/ucm475463.htm. Accessed April 28, 2017.
188. Chacko B, Whitley M, Beckmann U, et al. Postoperative euglycaemic diabetic ketoacidosis associated with sodium-glucose cotransporter-2 inhibitors (gliflozins): a report of two cases and review of the literature. Anaesth Intensive Care. 46(2):215–9. doi:10.1177/0310057X180460021.
189. Maddox TM, Januzzi Jr JL, Allen LA, et al. 2021 Update to the 2017 ACC Expert Consensus Decision Pathway for Optimization of Heart Failure Treatment: Answers to 10 Pivotal Issues About Heart Failure With Reduced Ejection Fraction: A Report of the American College of Cardiology Solution Set Oversight Committee. J Am Coll Cardiol. 2021;77(6):772–810. doi:10.1016/j.jacc.2020.11.022.
190. Patoulias D, Manafis A, Mitas C, et al. Sodium-glucose cotransporter 2 inhibitors and the risk of diabetic ketoacidosis; from pathophysiology to clinical practice. Cardiovasc Hematol Disord Drug Targets. 2018;18:139–46.
191. Kertai MD, Boersma E, Bax JJ, et al. A meta-analysis comparing the prognostic accuracy of six diagnostic tests for predicting perioperative cardiac risk in patients undergoing major vascular surgery. Heart. 2003;89(11):1327–34.
192. Kayano D, Nakajima K, Ohtake H, Kinuya S. Gated myocardial perfusion SPECT for preoperative risk stratification in patients with noncardiac vascular disease. Ann Nucl Med. 2009;23(2):173–81.
193. Koshy AN, Ha FJ, Gow PJ, et al. Computed tomographic coronary angiography in risk stratification prior to non-cardiac surgery: a systematic review and meta-analysis. Heart. 2019;105(17):1335–42. doi:10.1136/heartjnl-2018-314649.
194. Sheth T, Chan M, Butler C, et al. Prognostic capabilities of coronary computed tomographic angiography before non-cardiac surgery: prospective cohort study. BMJ. 2015;350: h1907. doi:10.1136/bmj.h1907.
195. Dowsley TF, Sheth T, Chow BJW. Complementary pre-operative risk assessment using coronary computed tomography angiography and nuclear myocardial perfusion imaging in non-cardiac surgery: A VISION-CTA sub-study. J Nucl Cardiol. 2019 Jul 15. doi:10.1007/s12350-019-01779-9.
196. Levett DZH, Jack S, Swart M, et al.; Perioperative Exercise Testing and Training Society (POETTS). Perioperative cardiopulmonary exercise testing (CPET): consensus clinical guidelines on indications, organization, conduct, and physiological interpretation. Br J Anaesth. 2018;120(3):484–500. doi:10.1016/j.bja.2017.10.020.
197. Wijeysundera DN, Beattie WS, Austin PC, et al. Non-invasive cardiac stress testing before elective major non-cardiac surgery: population based cohort study. BMJ. 2010;340: b5526. doi:10.1136/bmj.b5526.
198. Poldermans D, Bax JJ, Schouten O, et al. Should major vascular surgery be delayed because of preoperative cardiac testing in intermediate-risk patients receiving betablocker therapy with tight heart rate control? Journal of the American College of Cardiology. 2006;48(5):964–9. doi:10.1016/j.jacc.2006.03.059.
199. Kaw R, Nagarajan V, Jaikumar L, et al. Predictive Value of Stress Testing, Revised Cardiac Risk Index, and Functional Status in Patients Undergoing Noncardiac Surgery. J Cardiothorac Vasc Anesth. 2019;33(4):927–32. doi:10.1053/j.jvca.2018.07.020.
200. Valle JA, Graham L, Thiruvoipati T, et al. Facility-level association of preoperative stress testing and postoperative adverse cardiac events. Heart. 2018;104(24):2018–25. doi:10.1136/heartjnl-2018-313047.
201. Illuminati G, Ricco JB, Greco C, et al. Systematic preoperative coronary angiography and stenting improves postoperative results of carotid endarterectomy in patients with asymptomatic coronary artery disease: a randomised controlled trial. Eur J Vasc Endovasc Surg. 2010;39(2):139–45.
202. Smilowitz NR, Beckman JA, Sherman SE, Berger JS. Hospital readmission after perioperative acute myocardial infarction associated with noncardiac surgery. Circulation. 2018;137:2332–9. doi:10.1161/CIRCULATIONAHA.117.032086.
203. Чомахидзе П. Ш., Полтавская М. Г., Сыркин А. Л. Данные коронароангиографии в комплексной оценке риска сердечно-сосудистых осложнений при плановых несердечных хирургических вмешательствах. Кардиология и сердечно-сосудистая хирургия. 2018;11(2):63–7. doi:10.17116/kardio201811263-67.
204. Lawton JS, Tamis-Holland JE, Bangalore S, et al. 2021 ACC/AHA/SCAI Guideline for Coronary Artery Revascularization: A Report of the American College of Cardiology/ American Heart Association Joint Committee on Clinical Practice Guidelines. J Am Coll Cardiol. 2022 Jan 18;79(2): e21-e129. doi:10.1016/j.jacc.2021.09.006.
205. Monaco M, Stassano P, Di Tommaso L, et al. Systematic strategy of prophylactic coronary angiography improves long-term outcome after major vascular surgery in mediumto high-risk patients: a prospective, randomized study. J Am Coll Cardiol. 2009;54:989–96.
206. Алекян Б. Г., Покровский А. В., Карапетян Н. Г., Ревишвили А. Ш. Мультидисциплинарный подход в определении частоты выявления ишемической болезни сердца и стратегии лечения у пациентов с патологией аорты и периферических артерий. Российский кардиологический журнал. 2019;(8):8–16. doi:10.15829/1560-4071-2019-8-8-16.
207. McFalls EO, Ward HB, Moritz TE, et al. Coronary-artery revascularization before elective major vascular surgery. New Engl J Med. 2004;351:2795–804.
208. Landesberg G, Mosseri M. Prophylactic pre-operative coronary revascularization: is the Phoenix awakening? J Am Coll Cardiol. 2009;54(11):997–8. doi:10.1016/j.jacc.2009.05.045.
209. Сумин А. Н., Корок Е. В., Панфилов С. Д. и др. Сопоставление двух стратегий снижения риска кардиальных осложнений при сосудистых операциях: отдаленные результаты. Комплексные проблемы сердечно-сосудистых заболеваний. 2013;3:18–25.
210. Wong EY, Lawrence HP, Wong DT. The effects of prophylactic coronary revascularization or medical management on patient outcomes after noncardiac surgery–a meta-analysis. Can J Anaesth. 2007;54(9):705–17. doi:10.1007/BF03026867.
211. Manolis A, Doumas M, Poulimenos L, et al. The unappreciated importance of blood pressure in recent and older atrial fibrillation trials. J Hypertens. 2013;31:2109–17.
212. Casadei B, Abuzeid H. Is there a strong rationale for deferring elective surgery in patients with poorly controlled hypertension? J Hypertens. 2005;23:19–22.
213. Futier E, Lefrant JY, Guinot PG, et al. Effect of individualized vs standard blood pressure management strategies on postoperative organ dysfunction among high-risk patients undergoing major surgery: a randomized clinical trial. JAMA. 2017;318:1346–57.
214. Messina A, Robba C, Calabro L, et al. Association between perioperative fluid administration and postoperative outcomes: a 20-year systematic review and a metaanalysis of randomized goal-directed trials in major visceral/noncardiac surgery. Crit Care. 2021;25:43.
215. Кобалава Ж. Д., Конради А. О., Недогода С. В. и др. Артериальная гипертензия у взрослых. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(3):3786. doi:10.15829/1560-4071-2020-3-3786.
216. Smith H, Yeung C, Gowing S, et al. Prediction, prevention and management of POAF after thoracic surgery. Journal of Thoracic Disease. 2018;10(Suppl 32): S3799-S3808.
217. Howell SJ, Sear JW, Foëx P. Hypertension, hypertensive heart disease and peri-operative cardiac risk. Br J Anaesth. 2004;92:570–83. doi:10.1093/bja/aeh091.
218. McEvoy MD, Gupta R, Koepke EJ, et al. Perioperative Quality Initiative consensus statement on postoperative blood pressure, risk and outcomes for elective surgery. Br J Anaesth. 2019 May;122(5):575–86. doi:10.1016/j.bja.2019.01.019.
219. Gu WJ, Hou BL, Kwong JSW, et al. Association between intraoperative hypotension and 30-day mortality, major adverse cardiac events, and acute kidney injury after noncardiac surgery: A meta-analysis of cohort studies. Int J Cardiol. 2018;258(2017):68–73. doi:10.1016/j.ijcard.2018.01.137.
220. Bouri S, Shun-Shin MJ, Cole GD, et al. Meta-analysis of secure randomised controlled trials of β-blockade to prevent perioperative death in non-cardiac surgery. Heart. 2014;100(6):456–64.
221. Devereaux PJ, Sessler DI, Leslie K, et al. Clonidine in Patients Undergoing Noncardiac Surgery. N Engl J Med. 2014;370(16):1504–13. doi:10.1056/NEJMoa1401106.
222. Biccard BM, Lurati Buse GA, Burkhart C, et al. The influence of clinical risk factors on pre-operative B-type natriuretic peptide risk stratification of vascular surgical patients. Anaesthesia. 2012;67:55–9.
223. Rajagopalan S, Croal BL, Reeve J, et al. N-terminal pro-B-type natriuretic peptide is an independent predictor of all-cause mortality and MACE after major vascular surgery in medium-term follow-up. Eur J Vasc Endovasc Surg. 2011;41:657–62.
224. Healy KO, Waksmonski CA, Altman RK, et al. Peri-operativeoutcome and long-term mortality for heart failure patients undergoing intermediateand high-risk noncardiac surgery: impact of left ventricular ejection fraction. Congest Heart Fail. 2010;16:45–9.
225. Davis J, Sanford D, Schilling J, et al. Systematic Review of Outcomes After Noncardiac Surgery in Patients with Implanted Left Ventricular Assist Devices. ASAIO J. 2015;61(6):648–51. doi:10.1097/MAT.0000000000000278.
226. McDonagh TA, Metra M, Adamo M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2021 Sep 21;42(36):3599–726. doi:10.1093/eurheartj/ehab368.
227. Терещенко С. Н., Галявич А. С., Ускач Т. М. и др. Хроническая сердечная недостаточность. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(11):4083. doi:10.15829/1560-4071-2020-4083.
228. Devereaux PJ, Yang H, Yusuf S, et al. Effects of extended-release metoprolol succinate in patients undergoing non-cardiac surgery (POISE trial): a randomised controlled trial. Lancet. 2008;371:1839–47.
229. Smilowitz NR, Banco D, Katz SD, et al. Association between heart failure and perioperative outcomes in patients undergoing non-cardiac surgery. Eur Heart J Qual Care Clin Outcomes. 2021 Jan 25;7(1):68–75. doi:10.1093/ehjqcco/qcz066.
230. Han Y, Hu H, Liu Y, et al. The Association Between Congestive Heart Failure and OneYear Mortality After Surgery in Singaporean Adults: A Secondary Retrospective Cohort Study Using Propensity-Score Matching, Propensity Adjustment, and Propensity-Based Weighting. Front Cardiovasc Med. 2022;9:858068. doi:10.3389/fcvm.2022.858068.
231. Upshaw J, Kiernan MS. Pre-operative cardiac risk assessment for noncardiac surgery in patients with heart failure. Curr Heart Fail Rep. 2013;10:147–56.
232. Hammill BG, Curtis LH, Bennett-Guerrero E, et al. Impact of heart failure on patients undergoing major noncardiac surgery. Anesthesiology. 2008;108:559–67.
233. Xu-Cai YO, Brotman DJ, Phillips CO, et al. Outcomes of patients with stable heart failure undergoing elective noncardiac surgery. Mayo Clin Proc. 2008;83:280–8.
234. Fayad A, Ansari MT, Phil M, et al. Perioperative Diastolic Dysfunction in Patients Undergoing Noncardiac Surgery Is an Independent Risk Factor for Cardiovascular Events A Systematic Review and Meta-analysis. Anesthesiology. 2016;125:72–91.
235. Wijeysundera DN, Pearse RM, Shulman MA, et al. Measurement of Exercise Tolerance before Surgery (METS) study: a protocol for an international multicentre prospective cohort study of cardiopulmonary exercise testing prior to major non-cardiac surgery. BMJ Open. 2016;6(3): e010359. doi:10.1136/bmjopen-2015-010359.
236. Wijeysundera DN, Pearse RM, Shulman MA, et al.; METS study investigators. Assessment of functional capacity before major non-cardiac surgery: an international, prospective cohort study. Lancet. 2018;391(10140):2631–40. doi:10.1016/S0140-6736(18)31131-0.
237. Vahanian A, Beyersdorf F, Praz F, et al.; ESC/EACTS Scientific Document Group. 2021 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J. 2022;43(7):561–632. doi:10.1093/eurheartj/ehab395.
238. Иртюга О. Б., Малев Э. Г., Гордеев М. Л. Ведение пациентов с приобретенными клапанными пороками сердца при некардиохирургических вмешательствах. Российский кардиологический журнал. 2021;26(8):4580. doi:10.15829/1560-4071-2021-4580.
239. Tarantini G, Nai Fovino L, Tellaroli P, et al. Asymptomatic severe aortic stenosis and noncardiac surgery. Am J Cardiol. 2016;117:486–8.
240. Gragnano F, Cattano D, Calabrò P. Perioperative care of cardiac patient’s candidate for non-cardiac surgery: a critical appraisal of emergent evidence and international guidelines. Intern Emerg Med. 2018 Dec;13(8):1185–90. doi:10.1007/s11739-0181927-6. PMID: 30136124.
241. Cowie B. Focussed transthoracic echocardiography predicts peri-operative cardiovascular morbidity. J Cardiothorac Vasc Anesth. 2012;26:989–93.
242. Kueh SH, Pasley Т, Wheeler M, Pemberton J. The not so innocent heart murmur: a 5-year experience. Intern Med J. 2017;47:199–205.
243. Christ M, Sharkova Y, Geldner G, Maisch B. Preoperative and perioperative care for patients with suspected or established aortic stenosis facing noncardiac surgery. Chest. 2005;128:2944.
244. Wacławski J, Wilczek K, Hudzik B, et al. Aortic balloon valvuloplasty as a bridge-todecision in patients with aortic stenosis. Postepy Kardiol Interwencyjnej. 2019;15(2):195– 202. doi:10.5114/aic.2019.86012. PMID: 31497052.
245. Mittnacht AJ, Fanshawe M, Konstadt S. Anesthetic considerations in the patient with valvular heart disease undergoing noncardiac surgery. Semin Cardiothorac Vasc Anesth. 2008;12:33.
246. Stone GW, Lindenfeld J, Abraham WT, et al. Transcatheter mitral-valve repair in patients with heart failure. N Engl J Med. 2018;379:2307–18.
247. Otto CM, Nishimura RA, Bonow RO, et al. 2020 ACC/AHA Guideline for the Management of Patients With Valvular Heart Disease: Executive Summary: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation. 2021 Feb 2;143(5): e35-e71. doi:10.1161/CIR.0000000000000932. Erratum in: Circulation. 2021 Feb 2;143(5): e228. Erratum in: Circulation. 2021 Mar 9;143(10): e784. PMID: 33332149.
248. Bajaj NS, Agarwal S, Rajamanickam A, et al. Impact of severe mitral regurgitation on postoperative outcomes after noncardiac surgery. Am J Med. 2013;126:529.
249. Practice guidelines for peri-operative transesophageal echocardiography. An updated report by the American Society of Anesthesiologists and the Society of Cardiovascular Anesthesiologists Task Force on Transesophageal echocardiography. Anesthesiology. 2010;112:1084–96. doi:10.1097/ALN.0b013e3181c51e90.
250. Liu Z, Xu G, Zhang Y, et al. Preoperative Transthoracic Echocardiography Predicts Cardiac Complications in Elderly Patients with Coronary Artery Disease Undergoing Noncardiac Surgery. Clin Interv Aging. 2022;17:1151–61. doi:10.2147/CIA.S369657.
251. Glance LG, Lustik SJ, Hannan EL, et al. The Surgical Mortality Probability Model: derivation and validation of a simple risk prediction rule for noncardiac surgery. Ann Surg. 2012;255:696–702.
252. Chobadi R, Wurzel M, Teplitsky I, et al. Coronary artery disease in patients 35 years of age or older with valvular aortic stenosis. Am J Cardiol. 1989;64:811.
253. Wiklund RA, Stein HD, Rosenbaum SH. Activities of daily living and cardiovascular complications following elective, noncardiac surgery. Yale J Biol Med. 2001;74:75–87.
254. Morris CK, Ueshima K, Kawaguchi T, et al. The prognostic value of exercise capacity: a review of the literature. Am Heart J. 1991;122:1423–31.
255. Barili F, Pacini D, Capo A, et al. Does EuroSCORE II perform better than its original versions? A multicentre validation study. Eur Heart J. 2013 Jan;34(1):22–9. doi:10.1093/eurheartj/ehs342. PMID: 23028171.
256. Provenchère S, Chevalier A, Ghodbane W, et al. Is the EuroSCORE II reliable to estimate operative mortality among octogenarians? PLoS One. 2017 Nov 16;12(11): e0187056. doi:10.1371/journal.pone.0187056.
257. Bajaj NS, Agarwal S, Rajamanickam A, et al. Impact of severe mitral regurgitation on postoperative outcomes after noncardiac surgery. Am J Med. 2013;126(6):529–35. doi:10.1016/j.amjmed.2012.12.005.
258. Lai HC, Lai HC, Lee WL, et al. Mitral regurgitation complicates postoperative outcome of noncardiac surgery. Am Heart J. 2007;153:712.
259. Bach DS, Eagle KA. Perioperative assessment and management of patients with valvular heart disease undergoing noncardiac surgery. Minerva Cardioangiol. 2004;52:255.
260. Taniguchi T, Morimoto T, Shiomi H, et al. Elective non-cardiac surgery in patients with severe aortic stenosis — observations from the CURRENT AS Registry. Circ J. 2020;84:1173–82.
261. Luis SA, Dohaei A, Chandrashekar P, et al. Impact of aortic valve replacement for severe aortic stenosis on perioperative outcomes following major noncardiac surgery. Mayo Clin Proc. 2020;95:727–37.
262. Urbanek C, Palm F, Buggle F, et al. Recent surgery or invasive procedures and the risk of stroke. Cerebrovasc Dis. 2014;38:370–6.
263. Бокерия А. Л., Голухова Е. З., Попов С. В. и др. Наджелудочковые тахикардии у взрослых. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(5):4484. doi:10.15829/1560-4071-2021-4484.
264. Cho MS, Lee CH, Kim J, et al. Clinical Implications of Preoperative Nonvalvular Atrial Fibrillation with Respect to Postoperative Cardiovascular Outcomes in Patients Undergoing Non-Cardiac Surgery. Korean Circ J. 2020;50(2):148–59. doi:10.4070/kcj.2019.0219.
265. Rosner MH, Brady WJ Jr, Kefer MP, Martin ML. Electrocardiography in patient with the WPW syndrome: Diagnostic and initial therapeutic issues. Am J Emerg Med. 1999;17:705–14.
266. Rahul S, Patel RD, Dewoolkar. Anesthetic management of WPW syndrome. The Internet Journal of Anesthesiology. 2006;11(2). Available from https://print.ispub.com/api/0/ispub-article/13272.
267. Hines RL, Marschall KE. Abnormalities of Cardiac Conduction and Cardiac Rhythm In: Stoelting RK, Dierdorf SF, editors. Anesthesia and co-existing disease. 5th ed. Philadelphia: Churchill-Livingstone; 2008. p. 72–3.
268. Nazir SA, Shoukat AG, Ayaz KF, et al. Anaesthetic management of Wolff Parkinson White syndrome for caesarean section. 2007;16(2). Available from https://print.ispub.com/api/0/ispub-article/11681.
269. Chhabra A, Trikha A, Sharma N. Unmasking of benign Wolff-Parkinson-White pattern under general anesthesia. Indian J Anesth. 2003;47:208–11.
270. Kabade SD, Sheikh S, Periyadka B. Anaesthetic management of a case of WolffParkinson-White syndrome. Indian J Anaesth. 2011;55:381–3.
271. Аракелян М. Г., Бокерия Л. А., Васильева Е. Ю. и др. Фибрилляция и трепетание предсердий. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(7):4594. doi:10.15829/1560-4071-2021-4594.
272. Sorajja D, Ramakrishna H, Poterack AK, et al. Brugada syndrome and its relevance in the perioperative period. Ann Card Anaesth. 2015;18:403–13.
273. Katritsis DG, Zografos T, Katritsis GD, et al. Catheter ablation vs. antiarrhythmic drug therapy in patients with symptomatic atrioventricular nodal re-entrant tachycardia: a randomized, controlled trial. Europace. 2017;19:602–6.
274. Pappone C, Vicedomini G, Manguso F, et al. Wolff-Parkinson-White syndrome in the era of catheter ablation: insights from a registry study of 2169 patients. Circulation. 2014;130:811–9.
275. Spector P, Reynolds MR, Calkins H, et al. Meta-analysis of ablation of atrial flutter and supraventricular tachycardia. Am J Cardiol. 2009;104:671–7.
276. Parreira L, Marinheiro R, Amador P, et al. Frequent premature ventricular contractions. Association of burden and complexity with prognosis according to the presence of structural heart disease. Ann Noninvasive Electrocardiol. 2021;26: e12800.
277. Agarwal V, Vittinghoff E, Whitman IR, et al. Relation between ventricular premature complexes and incident heart failure. Am J Cardiol. 2017;119:1238–42.
278. Marcus GM. Evaluation and management of premature ventricular complexes. Circulation. 2020;141:1404–18.
279. Лебедев Д. С., Михайлов Е. Н., Неминущий Н. М. и др. Желудочковые нарушения ритма. Желудочковые тахикардии и внезапная сердечная смерть. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(7):4600. doi:10.15829/1560-4071-2021-4600.
280. Barra S, Agarwal S, Begley D, Providencia R. Post-acute management of the acquired long QT syndrome. Postgrad Med J. 2014;90:348e58.
281. Sorajja D, Munger TM, Shen WK. Optimal antiarrhythmic drug therapy for electrical storm. J Biomed Res. 2015;29:20e34.
282. Banai S, Tzivoni D. Drug therapy for torsade de pointes. J Cardiovasc Electrophysiol. 1993;4:206e10.
283. Gifford J, Larimer K, Thomas C, et al. ICD-ON Registry for Perioperative Management of CIEDs: Most Require No Change. Pacing Clin Electrophysiol. 2017;40(2):128–34. doi:10.1111/pace.12990.
284. Kheiri B, Barbarawi M, Zayed Y, et al. Antiarrhythmic drugs or catheter ablation in the management of ventricular tachyarrhythmias in patients with implantable cardioverterdefibrillators: a systematic review and meta-analysis of randomized controlled trials. Circ ArrhythmElectrophysiol. 2019;12: e007600.
285. Santangeli P, Muser D, Maeda S, et al. Comparative effectiveness of antiarrhythmic drugs and catheter ablation for the prevention of recurrent ventricular tachycardia in patients with implantable cardioverterdefibrillators: a systematic review and metaanalysis of randomized controlled trials. Heart Rhythm. 2016;13:1552–9.
286. Briceno DF, Gupta T, Romero J, et al. Catheter ablation of ventricular tachycardia in nonischemic cardiomyopathy: a propensity score-matched analysis of in-hospital outcomes in the United States. J Cardiovasc Electrophysiol. 2018;29:771–9.
287. Zanaboni PB, Hantler CB. Bradyarrhythmias. Complications in Anesthesia (Second Edition) 2011; 1020 p.
288. Cheung CC, Martyn A, Campbell N, et al. Predictors of intraoperative hypotension and bradycardia. Am J Med. 2015;128(5):532–8. doi:10.1016/j.amjmed.2014.11.030.
289. Menzel Ellis MK, Treggiari MM, Robertson JM, et al. Process Improvement Initiative for the Perioperative Management of Patients With a Cardiovascular Implantable Electronic Device. Ambulatory Anesthesiology and Perioperative Management. 2017;125:58–65.
290. Cronin B, Essandoh MK. Perioperative Interrogation of St. Jude Cardiovascular Implantable Electronic Devices: A Guide for Anesthesiologists. Journal of Cardiothoracic and Vascular Anesthesia. 2018;32(2):982–1000. doi:10.1053/j.jvca.2017.11.050.
291. Pavlović N, Manola Š, Vražić H, et al. Recommendations for perioperative management of patients with cardiac implantable electronic devices. Acta Clin Croat. 2018;57(2):383–90.
292. Ahmed I, Patel AS, Balgaard TJ, Rosenfeld LE. Technician-Supported Remote Interrogation of CIEDs: Initial Use in US Emergency Departments and Perioperative Areas. PACE. 2016;39:275–81. doi:10.1111/pace.12798.
293. Potyk D, Raudaskoski P. Preoperative cardiac evaluation for elective noncardiac surgery. Arch Fam Med 1998;7:164–73.
294. Humbert M, Kovacs G, Hoeper Marius M, et al. 2022 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension. Eur Heart J. 2022;43(38):3618– 731. doi:10.1093/eurheartj/ehac237.
295. Chazova IE, Martynyuk TV, Valieva ZS, et al. Eurasian clinical guidelines on diagnosis and treatment of pulmonary hypertension. Eurasian heart journal. 2020;(1):78–122. (In Russ.) Чазова И. Е., Мартынюк Т. В., Валиева З. С. и др. Евразийские клинические рекомендации по диагностике и лечению легочной гипертензии. Евразийский кардиологический журнал. 2020;(1):78–122. doi:10.38109/2225-16852020-1-78-122.
296. Pilkington SA, Taboada D, Martinez G. Pulmonary hypertension and its management in patients undergoing non-cardiac surgery. Anaesthesia. 2015;70:56–70. doi:10.1111/anae.12831.
297. Olsson KM, Halank M, Egenlauf B, et al. Decompensated right heart failure, intensive care and perioperative management in patients with pulmonary hypertension: updated recommendations from the Cologne Consensus Conference 2018. Int J Cardiol. 2018;272S:46–52. doi:10.1016/j.ijcard.2018.08.081.
298. Steppan J, Diaz-Rodriguez N, Barodka VM, et al. Focused Review of Perioperative Care of Patients with Pulmonary Hypertension and Proposal of a Perioperative Pathway. Cureus. 2018;10(1): e2072. doi:10.7759/cureus.2072.
299. Meyer S, McLaughlin VV, Seyfarth HJ, et al. Outcomes of noncardiac, nonobstetric surgery in patients with PAH: an international prospective survey. Eur Respir J. 2013;41:1302–7. doi:10.1183/09031936.00089212.
300. Price LC, Montani D, Jais X, et al. Noncardiothoracic nonobstetric surgery in mild-to-moderate pulmonary hypertension. Eur Respir J. 2010;35:1294–302. doi:10.1183/09031936.00113009.
301. Hassan HJ, Housten T, Balasubramanian A, et al. A novel approach to perioperative risk assessment for patients with pulmonary hypertension. ERJ Open Res. 2021;7(3):00257– 2021. doi:10.1183/23120541.00257-2021.
302. Fox DL, Stream AR, Bull T. Perioperative management of the patient with pulmonary hypertension. Semin Cardiothorac Vasc Anesth. 2014;18:310–8. doi:10.1177/1089253214534780.
303. Seyfarth HJ, Gille J, Sablotzki A, et al. Perioperative management of patients with severe pulmonary hypertension in major orthopedic surgery: experience-based recommendations. GMS Interdiscip Plast Reconstr Surg DGPW. 2015;4: Doc03. doi:10.3205/iprs000062.
304. Rajagopal S, Ruetzler K, Ghadimi K, et al. Evaluation and Management of Pulmonary Hypertension in Noncardiac Surgery: A Scientific Statement From the American Heart Association. Circulation. 2023;147(17):1317–43. doi:10.1161/CIR.0000000000001136.
305. Steppan J, Paul M, Heerdt P. Pre-operative assessment and peri-operative management of the patient with pulmonary vascular disease. Clin Chest Med. 2021;42(1):133–41. doi:10.1016/j.ccm.2020.11.013.
306. Tartavoulle T, Bonanno LS, Hall S. Perioperative Considerations for Patients Diagnosed With Pulmonary Hypertension Undergoing Noncardiac Surgery. J Perianesth Nurs. 2019;34(2):240–9. doi:10.1016/j.jopan.2017.11.008.
307. Stevens LA, Claybon MA, Schmid CH, et al. Evaluation of the Chronic Kidney Disease Epidemiology Collaboration equation for estimating the glomerular filtration rate in multiple ethnicities. Kidney Int. 2011;79(5):555–62. doi:10.1038/ki.2010.462.
308. Kheterpal S, Tremper KK, Englesbe MJ, et al. Predictors of postoperative acute renal failure after noncardiac surgery in patients with previously normal renal function. Anesthesiology. 2007;107:892–902. doi:10.1097/01.anes.0000290588.29668.38.
309. Levey AS, Eckardt KU, Dorman NM, et al. Nomenclature for kidney function and diseaseexecutive summary and glossary from a Kidney Disease: Improving Global Outcomes (KDIGO) consensus conference. Eur. Heart J. 2020;41(48):4592–8. doi:10.1093/eurheartj/ehaa650.
310. Cockcroft DW, Gault MH. Prediction of creatinine clearance from serum creatinine. Nephron. 1976;16:31–41. doi:10.1159/000180580.
311. Ocak G, Rookmaaker MB, Algra A, et al. Chronic kidney disease and bleeding rusk in patients at high cardiovascular risk: a cohort study. Journal of Thrombosis and Haemostasis. 2017;16:65–73. doi:10.1111/jth.13904.
312. Harrison TG, Ruzzycki SM, James MT, et al. Estimated GFR and incidence of major surgery: a population-based cohort study. Am. J. Kidney Dis. 2021;77(3):365–75. doi:10.1053/j.ajkd.2020.08.009.
313. Grams ME, Sang Y, Ballew SH, et al. A Meta-analysis of the association of estimated GFR, albuminuria, age, race, and sex with acute kidney injury. Am. J. Kidney Dis. 2015;66(4):591–601. doi:10.1053/j.ajkd.2015.02.337.
314. Hsu CY, Ordonez JD, Chertow GM, et al. The risk of acute renal failure in patients with chronic kidney disease. Kidney Int. 2008;74(1):101–7. doi:10.1038/ki.2008.107.
315. Park S, Cho H, Park S. Simple Postoperative AKI Risk (SPARK) Classification before Noncardiac Surgery: A Prediction Index Development Study with External Validation. J. Am. Soc. Nephrol. 2019;30(1):170–81. doi:10.1681/ASN.2018070757.
316. Finfer S, Bellomo R, Boyce N, et al. A comparison of albumin and saline for fluid resuscitation in the intensive care unit. N. Engl. J. Med. 2004;350:2247–56. doi:10.1056/NEJMoa040232.
317. Ertmer C, Rehberg S, Van Aken H, et al. Relevance of non-albumin colloids in intensive care medicine. Best Pract. Res. Clin. Anaesthesiol. 2009;23:193–212. doi:10.1016/j. bpa.2008.11.001.
318. van Haren F, Zacharowski K. What’s new in volume therapy in the intensive care unit? Best Pract. Res. Clin. Anaesthesiol. 2014;28(3):275–83. doi:10.1016/j.bpa.2014.06.004.
319. Kheterpal S, Tremper KK, Heung M, et al. Development and validation of an acute kidney injury risk index for patients undergoing general surgery: results from a national data set. Anesthesiology. 2009;110(3):505–15. doi:10.1097/ALN.0b013e3181979440.
320. Ho KM, Power BM. Benefits and risks of furosemide in acute kidney injury. Anaesthesia. 2010;65:283–93. doi:10.1111/j.1365-2044.2009.06228.x.
321. Friedrich JO, Adhikari N, Herridge MS, et al. Meta-analysis: low-dose dopamine increases urine output but does not prevent renal dysfunction or death. Ann. Intern. Med. 2005;142(7):510–24. doi:10.7326/0003-4819-142-7-200504050-00010.
322. Zhao G, Xu C, Ying J, et al. Association between furosemide administration and outcomes in critically ill patients with acute kidney injury. Critical Care. 2020;24(75):2–9. doi:10.1186/s13054-020-2798-6.
323. Patschan D, Patschan S, Buschmann I, Ritter O. Loop Diuretics in Acute Kidney Injury Prevention, Therapy, and Risk Stratification. Kidney Blood Press. Res. 2019;44(4):457– 64. doi:10.1159/000501315.
324. Bagshaw SM, Gibney RTN, Kruger P, et al. The effect of low-dose furosemide in critically ill patients with early acute kidney injury: A pilot randomized blinded controlled trial (the SPARK study). J. Crit. Care. 2017;42:138–46. doi:10.1016/j.jcrc.2017.07.030.
325. Karthik S, Lisbon A. Low-dose dopamine in the intensive care unit. Semin. Dial. 2006;19:465–71. doi:10.1111/j.1525-139X.2006.00208.x.
326. KDIGO Clinical Practice Guideline for Acute Kidney Injury. Kidney Disease: Improving Global Outcomes (KDIGO) Acute Kidney Injury Work Group. Kidney inter. Suppl. 2012;2(6):1–138. doi:10.1038/kisup.2012.3.
327. Смирнов А. В., Добронравов В. А., Румянцев А. Ш. и др. Национальные рекомендации. Острое повреждение почек: основные принципы диагностики, профилактики и терапии. Часть I. Нефрология. 2016;20(1):79–104.
328. Смирнов А. В., Добронравов В. А., Румянцев А. Ш. и др. Национальные рекомендации. Острое повреждение почек: основные принципы диагностики, профилактики и терапии. Часть II. Нефрология. 2016;20(2):86–100.
329. Fliser D, Laville M, Covic A, et al. European Renal Best Practice (ERBP) position statement on the Kidney Disease Improving Global Outcomes (KDIGO) clinical practice guidelines on acute kidney injury: part 1: definitions, conservative management and contrast-induced nephropathy. Nephrol. Dial. Transplant. 2012 Dec;27(12):4263–72. doi:10.1093/ndt/gfs375.
330. Волгина Г. В., Козловская Н. Л. Контраст-индуцированная нефропатия. В кн: Нефрология. Клинические рекомендации / под ред. Шилова Е. М., Смирнова А. В., Козловской Н. Л. М.: ГЭОТАР-Медиа, 2016. 816 с. ISBN 978-5-9704-3714-8.
331. Donald JS, McDonald RJ, Carter RE, et al. Risk of intravenous contrast material-mediated acute kidney injury: a propensity score -matched study stratified by baseline-estimated glomerular filtration rate. Radiology. 2014;271:1;65–73. doi:10.1148/radiol.13130775.
332. Ellis JH, Halatbari S, Yoset M, et al. Influence of clinical factors on risk on contrastinduced nephrotoxicity from IV low-osmolality contrast material in patients with low glomerular filtration rate. American Journal of Roentgenology. 2019;213(5): W188-W193. doi:10.1148/radiol.13130775.
333. McDonald JS, McDonald RJ, Comin J, et al. Frequency of acute kidney injury following intravenous contrast medium administration: a systematic review and meta-analysis. Radiology. 2013;267:119–28. doi:10.1148/radiol.12121460.
334. Go AS, Chertow GM, Fan D, et al. Chronic kidney disease and the risks of death, cardiovascular events, and hospitalization [published correction appears in N. Engl. J. Med. 2008;18(4):4]. N. Engl. J. Med. 2004;351(13):1296–305. doi:10.1056/NEJMoa041031.
335. Manjunath G, Tighiouart H, Ibrahim H, et al. Level of kidney function as a risk factor for atherosclerotic cardiovascular outcomes in the community. J. Am. Coll. Cardiol. 2003;41(1):47–55. doi:10.1016/s0735-1097(02)02663-3.
336. McCullough PA, Li S, Jurkovitz CT, et al. CKD and cardiovascular disease in screened high-risk volunteer and general populations: the Kidney Early Evaluation Program (KEEP) and National Health and Nutrition Examination Survey (NHANES) 1999–2004. Am. J. Kidney Dis. 2008;51(4 Suppl 2): S38-S45. doi:10.1053/j.ajkd.2007.12.017.
337. Ronco C, Haapio M, House AA, et al. Cardiorenal syndrome. J. Am. Coll. Cardiol. 2008;52:1527–39. doi:10.1016/j.jacc.2008.07.051.
338. Rangaswami J, Bhalla V, Blair JEA, et al. American Heart Association Council on the Kidney in Cardiovascular Disease and Council on Clinical Cardiology. Cardiorenal Syndrome: Classification, Pathophysiology, Diagnosis, and Treatment Strategies: A Scientific Statement from the American Heart Association. Circulation. 2019;139(16): e840-e878. doi:10.1161/CIR.0000000000000664.
339. KDIGO 2012 Clinical Practice Guideline for the Evaluation and Management of Chronic Kidney Disease / Improving Global Outcomes (KDIGO) CKD Work Group. Kidney inter. Suppl. 2013;3(1):1–150.
340. Хроническая болезнь почек. Клинические рекомендации. Одобрены научно-практическим советом Министерства здравоохранения России [Электронный ресурс]. 2021. Режим доступа: https://cr.minzdrav.gov.ru/recomend/469_2.
341. Levey AS, Bosch JP, Lewis JB, et al. A more accurate method to estimate glomerular filtration rate from serum creatinine: a new prediction equation. Modification of Diet in Renal Disease Study Group. Ann. Intern. Med. 1999;130:461–70. doi:10.7326/00034819-130-6-199903160-00002.
342. Bellomo R, Ronco C, Kellum JA, et al. Acute renal failure–definition, outcome measures, animal models, fluid therapy and information technology needs: the Second International Consensus Conference of the Acute Dialysis Quality Initiative (ADQI) Group. Crit, Care. 2004;8(4): R204-R212. doi:10.1186/cc2872.
343. Ostermann M, Zarbock A, Goldstein S, et al. Recommendations on Acute Kidney Injury Biomarkers from the Acute Disease Quality Initiative Consensus Conference: A Consensus Statement. J.A.M.A. Net Open. 2020;3(10): e2019209. doi:10.1001/jamanetworkopen.2020.19209.
344. Davenport MS, Perazella MA, Yee J, et al. Use of Intravenous Iodinated Contrast Media in Patients with Kidney Disease: Consensus Statements from the American College of Radiology and the National Kidney Foundation. Kidney Med. 2020;2(1):85–93. doi:10.1016/j.xkme.2020.01.001.
345. Kaw R, Pasupuleti V, Walker E, et al. Postoperative Complications in Patients With Obstructive Sleep Apnea. Chest. 2012;141(2):436–41.
346. Chen W, Thomas J, Sadatsafavi M, et al. Risk of cardiovascular comorbidity in patients with chronic obstructive pulmonary disease: a systematic review and meta-analysis. The Lancet Respiratory Medicine. 2015;8:631–39.
347. Белялов Ф. И. Лечение болезней в условиях коморбидности. 12-е изд. Москва: ГЭОТАР-Медиа, 2022. 560 с. ISBN: 978–5–9704–6360–4.
348. Knisely A, Zhou ZN, Wu J, et al. Perioperative Morbidity and Mortality of Patients With COVID-19 Who Undergo Urgent and Emergent Surgical Procedures. Ann Surg. 2021;273(1):34–40.
349. Chan MTV, Wang CY, Seet E, et al. Association of Unrecognized Obstructive Sleep Apnea With Postoperative Cardiovascular Events in Patients Undergoing Major Noncardiac Surgery. JAMA. 2019;321(18):1788–98.
350. Gaddam S, Gunukula SK, Mador MJ, et al. Post-operative outcomes in adult obstructive sleep apnea patients undergoing non-upper airway surgery: a systematic review and meta-analysis. Sleep Breath. 2014;18(3):615–33.
351. Cheng Y, Nie X, Chen X, et al. The Role of Macrolide Antibiotics in Increasing Cardiovascular Risk. J Am Coll Cardiol. 2015;66(20):2173–84.
352. Gérard A, Romani S, Fresse A, et al. "Off-label" use of hydroxychloroquine, azithromycin, lopinavir-ritonavir and chloroquine in COVID-19: A survey of cardiac adverse drug reactions by the French Network of Pharmacovigilance Centers. Therapie. 2020;75(4):371–9.
353. Liu X, Ma J, Huang L, et al. Fluoroquinolones increase the risk of serious arrhythmias: A systematic review and meta-analysis. Medicine (Baltimore). 2017;96(44): e8273.
354. Wilchesky M, Ernst P, Brophy JM, et al. Bronchodilator Use and the Risk of Arrhythmia in COPD Bronchodilators and Arrhythmia Risk: Part 1: Saskatchewan Cohort Study. CHEST. 2012;142(2):298–304.
355. Wilchesky M, Ernst P, Brophy JM, et al. Bronchodilator Use and the Risk of Arrhythmia in COPD. Risk in COPD Part 2: Reassessment in the Larger Quebec Cohort. CHEST. 2012;142(2):305–11.
356. Lee C-H, Choi S, Jang EJ, et al. Inhaled bronchodilators and the risk of tachyarrhythmias. Int J Card. 2015;190:133–9.
357. Canet J, Gallart L, Gomar C, et al. Prediction of postoperative pulmonary complications in a population-based surgical cohort. Anesthesiology. 2010;113(6):1338–50.
358. STARSurg Collaborative and TASMAN Collaborative. Evaluation of prognostic risk models for postoperative pulmonary complications in adult patients undergoing major abdominal surgery: a systematic review and international external validation cohort study. The Lancet Digital Health. 2022;7: e520-e531.
359. Hwang M, Nagappa M, Guluzade N, et al. Validation of the STOP-Bang questionnaire as a preoperative screening tool for obstructive sleep apnea: a systematic review and metaanalysis. BMC Anesthesiol. 2022;22(1):366.
360. Odor P, Bampoe S, Gilhooly D, et al. Perioperative interventions for prevention of postoperative pulmonary complications: systematic review and meta-analysis. BMJ. 2020;368: m540.
361. Mutter T, Chateau D, Moffatt M, et al. A Matched Cohort Study of Postoperative Outcomes in Obstructive Sleep Apnea: Could Preoperative Diagnosis and Treatment Prevent Complications? Anesthesiology. 2014;4:707–18.
362. COVIDSurg Collaborative. Mortality and pulmonary complications in patients undergoing surgery with perioperative SARS-CoV-2 infection: an international cohort study. Lancet. 2020;396(10243):27–38.
363. Lei S, Jiang F, Su W, et al. Clinical characteristics and outcomes of patients undergoing surgeries during the incubation period of COVID-19 infection. EClinicalMedicine. 2020;21:100331.
364. The ASA and APSF Joint Statement on Perioperative Testing for the COVID-19 Virus. 2020. URL: https://www.asahq.org/-/media/files/spotlight/asa-and-apsf-statementon-perioperative-testing-for-the-covid-19-virus-june-3.pdf.
365. Kovoor J, Jacobsen J, Duncan J, et al. Achieving safe surgery after COVID-19 vaccination. ANZ Journal of Surgery. 2022;5:946–9.
366. Jonsson Fagerlund M, Franklin KA. Perioperative Continuous Positive Airway Pressure Therapy: A Review With the Emphasis on Randomized Controlled Trials and Obstructive Sleep Apnea. Anesth Analg. 2021 May 1;132(5):1306–13.
367. Nagappa M, Mokhlesi B, Wong J, et al. The Effects of Continuous Positive Airway Pressure on Postoperative Outcomes in Obstructive Sleep Apnea Patients Undergoing Surgery: A Systematic Review and Anesth Analg. 2015;120(5):1013–23.
368. Fernandez-Bustamante A, Frendl G, et al. Postoperative Pulmonary Complications, Early Mortality, and Hospital Stay Following Noncardiothoracic Surgery: A Multicenter Study by the Perioperative Research Network Investigators. JAMA Surg. 2017;152(2):157–66.
369. Mazo V, Sabate S, Canet J, et al. Prospective external validation of a predictive score for postoperative pulmonary complications. Anesthesiology. 2014;121(2):219–31.
370. Carter P, Lagan J, Fortune C, et al. Association of Cardiovascular Disease With Respiratory Disease. Journal of the American College of Cardiology. 2019;17:2166–77.
371. Numata T, Nakayama K, Fujii S, et al. Risk factors of postoperative pulmonary complications in patients with asthma and COPD. BMC Pulmonary Medicine. 2018;18:4.
372. Young EM, Farmer JD. Preoperative Chest Radiography in Elective Surgery: Review and Update. S D Med. 2017;70(2):81–7.
373. Deng JZ, Chan JS, Potter AL, et al. The Risk of Postoperative Complications After Major Elective Surgery in Active or Resolved COVID-19 in the United States. Ann Surg. 2022 Feb 1;275(2):242–6.
374. Bryant JM, Boncyk CS, Rengel KF, et al. Association of Time to Surgery After COVID-19 Infection With Risk of Postoperative Cardiovascular Morbidity. JAMA Netw Open. 2022;5(12): e2246922.
375. COVIDSurg Collaborative; GlobalSurg Collaborative. SARS-CoV-2 infection and venous thromboembolism after surgery: an international prospective cohort study. Anaesthesia. 2022;77(1):28–39.
376. Patone M, Mei X, Handunnetthi L, et al. Risks of myocarditis, pericarditis, and cardiac arrhythmias associated with COVID-19 vaccination or SARS-CoV-2 infection. Nat Med. 2022;28(2):410–22. doi:10.1038/s41591-021-01630-0.
377. Batelaan NM, Seldenrijk A, Bot M, et al. Anxiety and new onset of cardiovascular disease: critical review and meta-analysis. Br J Psych. 2016;208(3):223–31.
378. Hooker S, O’Connor P, Sperl-Hillen J, et al. Depression and cardiovascular risk in primary care patients. Journal of Psychosomatic Research. 2022;158:110920.
379. Harshfield E, Pennells L, Schwartz J, et al. Association Between Depressive Symptoms and Incident Cardiovascular Diseases. JAMA. 2020;23:2396–405.
380. O’Dell KR, Masters KS, Spielmans GI, Maisto SA. Does type-D personality predict outcomes among patients with cardiovascular disease? A meta-analytic review. J Psychosom Res. 2011;71(4):199–206.
381. Belialov F. Psychosomatics. 9th ed. Moscow: GEOTAR-Media, 2022. 400 p. (In Russ.) Белялов Ф. И. Психосоматика. 9-е изд. Москва: ГЭОТАР-Медиа, 2022. 400 с. ISBN 978-5-9704-6724-4.
382. Chen YK, Soens MA, Kovacheva VP. Less stress, better success: a scoping review on the effects of anxiety on anesthetic and analgesic consumption. J Anesth. 2022;36(4):532–53.
383. Ghoneim MM, O’Hara MW. Depression and postoperative complications: an overview. BMC Surg. 2016;16(1):5.
384. Kerper LF, Spies CD, Buspavanich P, et al. Preoperative depression and hospital length of stay in surgical patients. Minerva Anestesiol. 2014;80(9):984–91.
385. Ma J, Li C, Zhang W, et al. Preoperative anxiety predicted the incidence of postoperative delirium in patients undergoing total hip arthroplasty: a prospective cohort study. BMC Anesthesiol. 2021 Feb 12;21(1):48.
386. Martin R, Christoforetti J, McGovern R, et al. The Impact of Depression on Patient Outcomes in Hip Arthroscopic Surgery. Orthopaedic Journal of Sports Medicine. 2018;11:2325967118806490.
387. Байкальская психосоматическая ассоциация. Клинические рекомендации по психосоматической медицине. Иркутск. 2023. 35 с. URL: https://therapy.irkutsk.ru/ispm/psomatic5.pdf.
388. Заболотских И. Б., Грицан А. И., Лебединский К. М. и др. Периоперационное ведение пациентов с психическими заболеваниями. Методические рекомендации Общероссийской общественной организации "Федерация анестезиологов и реаниматологов", второй пересмотр. Вестник интенсивной терапии имени А. И. Салтанова. 2021;(1):19–47. doi:10.21320/1818474X-2021-1-19-47.
389. Fagenson A, Schleider C, Philp M, et al. Preoperative Opioid and Benzodiazepine Use: Influence on Abdominal Surgical Outcomes. Journal of the American College of Surgeons. 2023;236(4):925–34. doi:10.1097/XCS.0000000000000572.
390. Kudoh A, Katagai H, Takazawa T, et al. Antidepressant treatment for chronic depressed patients should not be discontinued prior to anesthesia. Can J Anaesth. 2002;49(2):132–6.
391. Rajamäki TJ, Moilanen T, Puolakka PA, et al. Is the Preoperative Use of Antidepressants and Benzodiazepines Associated with Opioid and Other Analgesic Use After Hip and Knee Arthroplasty? Clin Orthop Relat Res. 2021;479(10):2268–80.
392. Singh I, Achuthan S, Chakrabarti A, et al. Influence of pre-operative use of serotonergic antidepressants (SADs) on the risk of bleeding in patients undergoing different surgical interventions: a meta-analysis. Pharmacoepidemiol Drug Saf. 2015;24(3):237–45.
393. Post DS, van der Veer A, Schijns O, et al. Assessment of need for hemostatic evaluation in patients taking valproic acid: A retrospective cross-sectional study. PLoS One. 2022 Feb 25;17(2): e0264351.
394. Xiong G, Pinkhasov A, Mangal J, et al. QTc monitoring in adults with medical and psychiatric comorbidities: Expert consensus from the Association of Medicine and Psychiatry. Journal of Psychosomatic Research. 2020;135:110138.
395. Beach SR, Kostis WJ, Celano CM, et al. Meta-analysis of selective serotonin reuptake inhibitor-associated QTc prolongation. J Clin Psychiatry. 2014;75(5): e441–9.
396. Egholm JWM, Pedersen B, Møller AM, et al. Perioperative alcohol cessation intervention for postoperative complications. Cochrane Database of Systematic Reviews 2018, Issue 11. Art. No.: CD008343.
397. Mills E, Eyawo O, Lockhart I, et al. Smoking cessation reduces postoperative complications: a systematic review and meta-analysis. Am J Med. 2011;124(2):144–54.e8.
398. Myers K, Hajek P, Hinds C, et al. Stopping Smoking Shortly Before Surgery and Postoperative Complications: A Systematic Review and Meta-analysis. Arch Intern Med. 2011;171(11):983–9.
399. Sørensen LT. Wound healing and infection in surgery. The clinical impact of smoking and smoking cessation: a systematic review and meta-analysis. ArchSurg. 2012;147(4):373–83.
400. Gavilan E, Fernández E, Minguell J, et al. Efficacy of Presurgical Interventions to Promote Smoking Cessation: A Systematic Review. Anesth Analg. 2023;136(1):43–50.
401. Nicholson A, Kuper H, Hemingway H. Depression as an aetiologic and prognostic factor in coronary heart disease: a meta-analysis of 6362 events among 146538 participants in 54 observational studies. Eur Heart J. 2006;27:2763–74.
402. May HT, Horne BD, Carlquist JF, et al. Depression After Coronary Artery Disease Is Associated With Heart Failure. J Am Coll Cardiol. 2009;53(16):1440–7.
403. Papasavvas T, Alhashemi M, Micklewright D. Association Between Depressive Symptoms and Exercise Capacity in Patients With Heart Disease: A Meta-analysis. J CardiopulmRehabilPrev. 2017;37(4):239–49.
404. Geovanini GR, Gowdak LHW, Pereira AC, et al. OSA and depression are common and independently associated with refractory angina in patients with coronary artery disease. CHEST Journal. 2014;146:73–80.
405. Song I, Park H, Oh T, et al. Effect of preoperative psychiatric morbidity on postoperative outcomes of lung cancer surgery: A nationwide cohort study in South Korea. Journal of Psychosomatic Research. 2022;161:111002.
406. McBride KE, Solomon MJ, Young JM, et al. Impact of serious mental illness on surgical patient outcomes. ANZ J Surg. 2018;88(7–8):673–7.
407. Maeda T, Babazono A, Nishi T, Tamaki K. Influence of psychiatric disorders on surgical outcomes and care resource use in Japan. Gen Hosp Psychiatry. 2014;36(5):523–7.
408. Powell R, Scott NW, Manyande A, et al. Psychological preparation and postoperative outcomes for adults undergoing surgery under general anaesthesia. Cochrane Database Syst Rev. 2016 May 26;2016(5): CD008646.
409. Kharod U, Panchal NN, Varma J, Sutaria K. Effect of pre-operative communication using anaesthesia information sheet on pre-operative anxiety of patients undergoing elective surgery-A randomised controlled study. Indian J Anaesth. 2022;66(8):559–72.
410. Castanheira L, Fresco P, Macedo AF. Guidelines for the management of chronic medication in the perioperative period: systematic review and formal consensus. J ClinPharmTher. 2011;36(4):446–67.
411. Farmand S, Lindh JD, Calissendorff J, et al. Differences in Associations of Antidepressants and Hospitalization Due to Hyponatremia. Am J Med. 2018;131(1):56–63.
412. De Picker L, Van Den Eede F, Dumont G, et al. Antidepressants and the Risk of Hyponatremia: A Class-by-Class Review of Literature. Psychosomatics. 2014;55:536–47.
413. Lee SM, Landry J, Jones PM, et al. Long-term quit rates after a perioperative smoking cessation randomized controlled trial. AnesthAnalg. 2015;120(3):582–7.
414. Wong J, Abrishami A, Riazi S, et al. A Perioperative Smoking Cessation Intervention With Varenicline, Counseling, and Fax Referral to a Telephone Quitline Versus a Brief Intervention: A Randomized Controlled Trial. AnesthAnalg. 2017;125(2):571–9.
415. Smilowitz NR, Gupta N, Ramakrishna H, et al. Perioperative Major Adverse Cardiovascular and Cerebrovascular Events Associated With Noncardiac Surgery. JAMA Cardiol. 2017 Feb 1;2(2):181–7. doi:10.1001/jamacardio.2016.4792.
416. Gallino A, Aboyans V, Diehm C, et al. Non-coronary atherosclerosis. Eur Heart J. 2014 May;35(17):1112–9. doi:10.1093/eurheartj/ehu071.
417. Hertzer NR, Bever EG, Young JR, et al. Coronary artery disease in peripheral vascular patients: A classification of 1000 coronary angiograms and results of surgical management. Ann Surg. 1984;199:223–33.
418. S Сумин А. Н., Безденежных А. В., Евдокимов Д. О. и др. Коронароангиография в оценке кардиоваскулярного риска при операциях на некоронарных сосудистых бассейнах: взгляд кардиолога. Кардиология и сердечно-сосуд хирургия. 2010;5:4–11.
419. Illuminati G, Schneider F, Greco C, et al. Long-term results of a randomized controlled trial analyzing the role of systematic pre-operative coronary angiography before elective carotid endarterectomy in patients with asymptomatic coronary artery disease. Eur J Vasc Endovasc Surg. 2015 Apr;49(4):366–74. doi:10.1016/j.ejvs.2014.12.030.
420. Чернявский А. М., Карпенко А. А., Рахметов Н. Р. и др. Выбор и этапность хирургического вмешательства у пациентов с инфраренальной аневризмой брюшной аорты при сочетанном поражении коронарного русла и брахиоцефальных артерий. Ангиология и Сосудистая Хирургия. 2011;17(3):111–9.
421. Deana C, Vetrugno L, Bignami E, Bassi F. Peri-operative approach to esophagectomy: a narrative review from the anesthesiological standpoint. J Thorac Dis. 2021;13(10):6037– 51. doi:10.21037/jtd-21-940.
422. Papadopoulou A, Mathers E. Risk stratification of the cancer patient: a narrative review. Dig Med Res. 2020;3:27. doi:10.21037/dmr-20-69.
423. Pennathur A, Brunelli A, Criner GJ, et al. Definition and assessment of high risk in patients considered for lobectomy for stage I non-small cell lung cancer: The American Association for Thoracic Surgery expert panel consensus document. J Thorac Cardiovasc Surg. 2021;162(6):1605–18.e6. doi:10.1016/j.jtcvs.2021.07.030.
424. Большедворская О. А., Протасов К. В., Улыбин П. С., Дворниченко В. В. Послеопер ационный инфаркт миокарда у пациентов раком легкого: частота выявления, клинические особенности, прогностические факторы. Российский кардиологический журнал. 2020;25(11):3946. doi:10.15829/1560-4071-2020-3946.
425. Bergqvist D, Agnelli G, Cohen AT, et al. Duration of prophylaxis against venous thromboembolism with enoxaparin after surgery for cancer. N Engl J Med. 2002;346:975– 80. doi:10.1056/NEJMoa012385.
426. Liu J, Weber S, Berian J, et al. Role of operative complexity variables in risk adjustment for patients with cancer. JAMA Surg. 2016;151:1084–6. doi:10.1001/jamasurg.2016.2253.
427. Rivard C, Nahum R, Slagle E, et al. Evaluation of the performance of the ACS NSQIP surgical risk calculator in gynecologic oncology patients undergoing laparotomy. Gynecol Oncol. 2016;141:281–6. doi:10.1016/j.ygyno.2016.02.015.
428. Wotton R, Marshall A, Kerr A, et al. Does the revised cardiac risk index predict cardiac complications following elective lung resection? J Cardiothorac Surg. 2013;8:220. doi:10.1186/1749-8090-8-220.
429. Brunelli A, Cassivi SD, Fibla J, et al. External validation of the recalibrated thoracic revised cardiac risk index for predicting the risk of major cardiac complications after lung resection. Ann Thorac Surg. 2011;92:445–8. doi:10.1016/j.athoracsur.2011.03.095.
430. Brunelli A, Ferguson MK, Salati M, et al. Thoracic Revised Cardiac Risk Index Is Associated With Prognosis After Resection for Stage I Lung Cancer. Ann Thorac Surg. 2015;100(1):195–200. doi:10.1016/j.athoracsur.2015.03.103.
431. Brunelli A, Kim AW, Berger KI, Addrizzo-Harris DJ. Physiologic evaluation of the patient with lung cancer being considered for resectional surgery: Diagnosis and management of lung cancer, 3rd ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest. 2013;143(5 Suppl): e166S-e190S. doi:10.1378/chest.122395.
432. Brunelli A, Varela G, Salati M, et al. Recalibration of the revised cardiac risk index in lung resection candidates. Ann Thorac Surg. 2010;90(1):199–203. doi:10.1016/j.athoracsur.2010.03.042.
433. Ferguson M, Celauro A, Vigneswaran W. Validation of a modified scoring system for cardiovascular risk associated with major lung resection. Eur J Cardiothorac Surg. 2012;41(3):598–602. doi:10.1093/ejcts/ezr081.
434. Большедворская О. А., Протасов К. В., Батунова Е. В., Семенова Е. Н. Биомаркеры повреждения миокарда при хирургическом лечении рака легкого: периоперационная динамика и прогностическое значение. Комплексные проблемы сердечнососудистых заболеваний. 2022;11(2):27–38. doi:10.17802/2306-1278-2022-11-227-38.
435. Hou Y, Zhou Y, Hussain M, et al. Cardiac risk stratification in cancer patients: A longitudinal patient-patient network analysis. PLoS Med. 2021;18(8): e1003736. doi:10.1371/journal. pmed.1003736.
436. Salati M, Brunelli A. Risk Stratification in Lung Resection. Curr Surg Rep. 2016;4(11):37. doi:10.1007/s40137-016-0158-x.
437. Brunelli A, Refai M, Xiume F, et al. Performance at symptom-limited stair-climbing test is associated with increased cardiopulmonary complications, mortality, and costs after major lung resection. Ann Thorac Surg. 2008;86:240–7. doi:10.1016/j.athoracsur.2008.03.025.
438. Wesolowski S, Orlowski T, Kram M. The 6-min walk test in the functional evaluation of patients with lung cancer qualified for lobectomy. Interact Cardiovasc Thorac Surg. 2020;30(4):559–64. doi:10.1093/icvts/ivz313.
439. Brunelli A, Belardinelli R, Pompili C, et al. Minute ventilation-to-carbon dioxide output (VE/VCO2) slope is the strongest predictor of respiratory complications and death after pulmonary resection. Ann Thorac Surg. 2012;93:1802–06. doi:10.1016/j.athoracsur.2012.03.022.
440. Armstrong EA, Beal EW, Lopez-Aguiar AG, et al. Evaluating the ACS-NSQIP risk calculator in primary GI neuroendocrine tumor: Results from the United States neuroendocrine Tumor Study Group. Am Surg. 2019;85:1334–40.
441. Шестопалова И. М., Герасимов С. С., Кадагидзе З. Г., Шелепова В. М. Применение маркера NT-proBNP в мониторинге периоперационной сердечной недостаточности у онкологических пациентов, страдающих ишемической болезнью сердца. Журнал сердечная недостаточность. 2008;4(48):172–4.
442. Mima K, Hayashi H, Nakagawa S, et al. Frailty is associated with poor prognosis after resection for pancreatic cancer. Int J Clin Oncol. 2021;26(10):1938–46. doi:10.1007/s10147-021-01983-z.
443. Lu J, Zheng HL, Li P, et al. High preoperative modified frailty index has a negative impact on shortand long-term outcomes of octogenarians with gastric cancer after laparoscopic gastrectomy. Surg Endosc. 2018;32(5):2193–200. doi:10.1007/s00464018-6085-4.
444. Mima K, Miyanari N, Morito A, et al. Frailty is an independent risk factor for recurrence and mortality following curative resection of stage I–III colorectal cancer. Ann Gastroenterol Surg. 2020;4(4):405–12. doi:10.1002/ags3.12337.
445. Teh E, Sinha S, Joshi N, et al. Cardiopulmonary exercise testing (CPET) and the prediction of perioperative events in patients undergoing lung resection in the modern era: A comparison of clinical, CPET and combined assessment. J Clin Anesth. 2020;62:109749. doi:10.1016/j.jclinane.2020.109749.
446. Fennelly J, Potter L, Pompili C, Brunelli A. Performance in the shuttle walk test is associated with cardiopulmonary complications after lung resections. J Thorac Dis. 2017;9(3):789–95. doi:10.21037/jtd.2017.03.22.
447. Liu D, Wen H, He J, et al. Society for Translational Medicine Expert Consensus on the preoperative assessment of circulatory and cardiac functions and criteria for the assessment of risk factors in patients with lung cancer. J Thorac Dis. 2018;10(9):5545–9. doi:10.21037/jtd.2018.08.91.
448. Сомонова О. В., Антух Э. А., Варданян А. В. др. Практические рекомендации по профилактике и лечению тромбоэмболических осложнений у онкологических больных. Злокачественные опухоли. 2021;11(3s2– 2):145–55. doi:10.18027/2224-5057-2021-11-3s2-47.
449. Сумин А. Н. Подготовка пациента с сердечно-сосудистыми заболеваниями к плановым хирургическим вмешательствам при онкопатологии. Комплексные проблемы сердечно-сосудистых заболеваний. 2019;8(1):123–33. doi:10.17802/2306-1278-2019-8-1-123-133.
450. Сумин А. Н., Старовойтова А. В., Щеглова А. В., Горбунова Е. В. Роль консультации кардиолога в обследовании пациентов перед онкологическими операциями. Терапевтический архив. 2020;92(1):25–9. doi:10.26442/00403660.2020.01.000478.
451. Lyon AR, López-Fernández T, Couch LS, et al. 2022 ESC Guidelines on cardio-oncology developed in collaboration with the European Hematology Association (EHA), the European Society for Therapeutic Radiology and Oncology (ESTRO) and the International Cardio-Oncology Society (IC-OS). Eur Heart J. 2022: ehac244. doi:10.1093/eurheartj/ehac244.
452. Hanley C, Donahoe L, Slinger P. "Fit for Surgery? What's New in Preoperative Assessment of the High-Risk Patient Undergoing Pulmonary Resection". J Cardiothorac Vasc Anesth. 2021;35(12):3760–73. doi:10.1053/j.jvca.2020.11.025.
453. Straatman J, van der Wielen N, Cuesta MA, et al. Minimally Invasive Versus Open Esophageal Resection: Three-year Follow-up of the Previously Reported Randomized Controlled Trial: the TIME Trial. Ann Surg. 2017;266(2):232–6. doi:10.1097/SLA.0000000000002171.
Об авторах
А. Н. СуминРоссия
Доктор медицинских наук, председатель.
Кемерово
Конфликт интересов:
нет
Д. В. Дупляков
Россия
Профессор, доктор медицинских наук, сопредседатель.
Самара
Конфликт интересов:
нет
Ф. И. Белялов
Россия
Профессор, доктор медицинских наук, сопредседатель.
Иркутск
Конфликт интересов:
нет
А. Е. Баутин
Россия
Профессор, доктор медицинских наук.
Санкт-Петербург
Конфликт интересов:
нет
А. В. Безденежных
Россия
Кандидат медицинских наук.
Кемерово
Конфликт интересов:
нет
С. В. Гарькина
Россия
Кандидат медицинских наук.
Санкт-Петербург
Конфликт интересов:
нет
М. Л. Гордеев
Россия
Профессор, доктор медицинских наук.
Санкт-Петербург
Конфликт интересов:
нет
Д. А. Затейщиков
Россия
Профессор, доктор медицинских наук.
Москва
Конфликт интересов:
нет
О. Б. Иртюга
Россия
Кандидат медицинских наук, доцент.
Санкт-Петербург
Конфликт интересов:
нет
Е. В. Корок
Россия
Кандидат медицинских наук.
Кемерово
Конфликт интересов:
нет
Т. Ю. Кулагина
Россия
Доктор медицинских наук.
Москва
Конфликт интересов:
нет
Е. А. Медведева
Россия
Кандидат медицинских наук.
Санкт-Петербург
Конфликт интересов:
нет
М. В. Мензоров
Россия
Профессор, доктор медицинских наук.
Ульяновск
Конфликт интересов:
нет
Д. А. Напалков
Россия
Профессор, доктор медицинских наук.
Москва
Конфликт интересов:
нет
Т. В. Павлова
Россия
Профессор, Доктор медицинских наук.
Самара
Конфликт интересов:
нет
О. В. Петрунько
Россия
Кандидат медицинских наук, доцент.
Иркутск
Конфликт интересов:
нет
К. В. Протасов
Россия
Профессор, доктор медицинских наук.
Иркутск
Конфликт интересов:
нет
Ю. С. Сибагатуллина
Россия
Санкт-Петербург
Конфликт интересов:
нет
Н. А. Черепанова
Россия
Самара
Конфликт интересов:
нет
П. Ш. Чомахидзе
Россия
Профессор, доктор медицинских наук.
Москва
Конфликт интересов:
нет
А. М. Шутов
Россия
Профессор, доктор медицинских наук.
Ульяновск
Конфликт интересов:
нет
Рецензия
Для цитирования:
Сумин А.Н., Дупляков Д.В., Белялов Ф.И., Баутин А.Е., Безденежных А.В., Гарькина С.В., Гордеев М.Л., Затейщиков Д.А., Иртюга О.Б., Корок Е.В., Кулагина Т.Ю., Медведева Е.А., Мензоров М.В., Напалков Д.А., Павлова Т.В., Петрунько О.В., Протасов К.В., Сибагатуллина Ю.С., Черепанова Н.А., Чомахидзе П.Ш., Шутов А.М. Рекомендации по оценке и коррекции сердечно-сосудистых рисков при несердечных операциях 2023. Российский кардиологический журнал. 2023;28(8):5555. https://doi.org/10.15829/1560-4071-20235555. EDN: MQQWMW
For citation:
Sumin A.N., Duplyakov D.V., Belyalov F.I., Bautin A.E., Bezdenezhnykh A.V., Garkina S.V., Gordeev M.L., Zateishchikov D.A., Irtyuga O.B., Korok E.V., Kulagina T.Yu., Medvedeva E.A., Menzorov M.V., Napalkov D.A., Pavlova T.V., Petrunko O.V., Protasov K.V., Sibagatullina Yu.S., Cherepanova N.A., Chomakhidze P.Sh., Shutov A.M. Assessment and modification of cardiovascular risk in non-cardiac surgery. Clinical guidelines 2023. Russian Journal of Cardiology. 2023;28(8):5555. (In Russ.) https://doi.org/10.15829/1560-4071-20235555. EDN: MQQWMW
JATS XML
















































