Перейти к:
Показатели клинического анализа крови и поражения коронарного русла в прогнозировании госпитальной летальности у больных острым инфарктом миокарда с подъемом сегмента ST после чрескожного коронарного вмешательства
https://doi.org/10.15829/1560-4071-2024-5549
EDN: UWCBEN
Аннотация
Цель. Оценка предиктивного потенциала показателей клинического анализа крови (КАК) и поражения коронарных артерий (КА) для прогнозирования госпитальной летальности (ГЛ) у больных инфарктом миокарда с подъемом сегмента ST (ИМпST) после чрескожного коронарного вмешательства (ЧКВ).
Материал и методы. Проведено одноцентровое когортное ретроспективное исследование по данным 4677 электронных историй болезни пациентов с ИМпST (3203 мужчины и 1474 женщины). Было выделено 2 группы лиц, первую из которых составили 318 (6,8%) больных, умерших в стационаре, вторую — 4359 (93,2%) — с благоприятным исходом. Степень влияния предикторов на конечную точку определяли методом Шепли.
Результаты. Наилучшие метрики качества имела модель, структура которой помимо 7 факторов КАК включала показатели трехсосудистого поражения коронарного русла, ремоделирования ствола левой КА и ограничения коронарной перфузии после ЧКВ по шкале TIMI <2 (AUC — 0,845, чувствительность — 0,78, специфичность — 0,786). Наибольший вклад в реализацию конечной точки был связан с уровнем гемоглобина, лейкоцитов, иммуновоспалительного индекса и нейтрофилов >75,4%. Менее заметное влияние на ГЛ оказывали индикаторы состояния КА, а минимальное — тромбокрит >0,22%, лимфоциты <13,3% и скорость оседания эритроцитов.
Заключение. Модель многофакторной логистической регрессии на основе комбинации показателей КАК и индикаторов, характеризующих состояние коронарного русла, обладает высокой прогностической точностью, что определяет перспективы ее дальнейшего использования в качестве одного из доступных инструментов рискометрии в клинической практике.
Ключевые слова
Для цитирования:
Гельцер Б.И., Шахгельдян К.И., Домжалов И.Г., Куксин Н.С., Котельников В.Н. Показатели клинического анализа крови и поражения коронарного русла в прогнозировании госпитальной летальности у больных острым инфарктом миокарда с подъемом сегмента ST после чрескожного коронарного вмешательства. Российский кардиологический журнал. 2024;29(2):5549. https://doi.org/10.15829/1560-4071-2024-5549. EDN: UWCBEN
For citation:
Geltser B.I., Shahgeldyan K.I., Domzhalov I.G., Kuksin N.S., Kotelnikov V.N. Parameters of complete blood count and coronary lesions in predicting inhospital mortality in patients with acute ST-segment elevation myocardial infarction after percutaneous coronary intervention. Russian Journal of Cardiology. 2024;29(2):5549. (In Russ.) https://doi.org/10.15829/1560-4071-2024-5549. EDN: UWCBEN
Несмотря на постоянное совершенствование методов диагностики и лечения, ишемическая болезнь сердца (ИБС) остается одной из основных причин смертности населения в большинстве стран мира [1]. Инфаркт миокарда с подъемом сегмента ST на электрокардиограмме (ИМпST) относится к наиболее опасным клиническим вариантам ИБС. Реваскуляризация миокарда посредством чрескожных коронарных вмешательств (ЧКВ) является приоритетной стратегией восстановления кровотока в инфаркт-связанных (ИСА) коронарных артериях (КА), позволяющей сократить число неблагоприятных исходов у больных с ИМпST. Вместе с тем госпитальная летальность (ГЛ) при плановых ЧКВ составляет 0,5-1%, а при экстренных от 4 до 7%, что указывает на необходимость актуализации технологий рискометрии [2]. В ряде работ было показано, что к факторам, обладающим предсказательной ценностью для оценки вероятности развития неблагоприятных сердечно-сосудистых событий, относятся показатели клинического анализа крови (КАК) [3]. Установлены, в частности, корреляции между содержанием в крови лейкоцитов (WBC), лимфоцитов (LYM), нейтрофилов (NEUT) и тромбоцитов (PLT) с неблагоприятными исходами ИБС [4]. В работе Dong G, et al. [5] представлены доказательства взаимосвязи отношения PLT к LYM (PLR) с высоким риском ГЛ при остром коронарном синдроме. В других исследованиях отношение NEUT к LYM (NLR) было выделено в качестве предиктора обструктивного поражения КА и обладало приемлемым прогностическим потенциалом для оценки вероятности ГЛ у больных с ИМпЅТ [6]. Иммуновоспалительный индекс (systemic immune inflammation index — SII), рассчитанный как произведение PLT и NLR, имел более высокую предиктивную ценность в отношении прогноза ИМпЅТ после ЧКВ, чем другие факторы риска [7]. К важным прогностическим маркерам результативности ЧКВ у больных с ИМпЅТ относят распространенность поражения КА. Показано, что почти у 50% больных ИМпST регистрируется многососудистое поражение, которое часто сочетается со сниженной фракцией выброса левого желудочка (ФВ ЛЖ) и более высокой вероятностью ГЛ по сравнению с однососудистым поражением коронарного русла (ОПКР). Успех ЧКВ определяется восстановлением оптимального кровотока в ИСА, а низкая скорость коронарной перфузии или ее полное отсутствие рассматриваются как предикторы ГЛ [8]. Вместе с тем имеются лишь единичные исследования, в которых для разработки прогностических алгоритмов ГЛ используется комплексный подход, включающий анализ предиктивной ценности показателей КАК и индикаторов, характеризующих состояние коронарного русла.
Цель исследования состояла в комплексной оценке предиктивного потенциала показателей КАК, индикаторов поражения КА и восстановления коронарного кровотока для прогнозирования ГЛ у больных ИМпST после ЧКВ.
Материал и методы
Выполнено одноцентровое когортное ретроспективное исследование, в рамках которого анализировали показатели из 4677 электронных историй болезни пациентов (3203 мужчины и 1474 женщины) с ИМпST в возрасте от 26 до 93 лет с медианой (ME) 63 года и 95% доверительным интервалом (ДИ) [ 62; 63], поступивших в 2015-2021гг в Региональный сосудистый центр ГБУЗ "Приморская краевая клиническая больница № 1" г. Владивостока. Исследование проводилось в соответствии с принципами Хельсинкской декларации.
Всем пациентам была выполнена экстренная инвазивная коронарография с последующей транслюминальной баллонной ангиопластикой со стентированием ИСА на ангиографической системе General Electric Innova 3100. Было выделено 2 группы больных, в первую из которых вошли 318 (6,8%) человек, умерших в период госпитализации в стационаре, во вторую — 4359 (93,2%) — с благоприятным исходом. Причиной смерти у 201 больного было повторное ишемическое событие, у 34 — рецидивирующие желудочковые тахиаритмии, у 27 — геморрагические осложнения, у 42 — полиорганная недостаточность на фоне тяжелой коморбидности и инфекционных осложнений, у 14 — интраоперационные осложнения ЧКВ.
В первые сутки стационарного лечения анализировали следующие параметры КАК: содержание гемоглобина (Hb), эритроцитов (RBC), WBC, NEUT, LYM, моноцитов (MON), эозинофилов (EOS), PLT, скорость оседания RBC (СОЭ), гематокрит (Ht), тромбокрит (PCT), средний объем RBC и PLT, среднее содержание Hb в RBC, среднюю концентрацию Hb в эритроцитарной массе, абсолютное и относительное значение распределения RBC по объему, ширину распределения PLT. Рассчитывали индексы NLR, PLR, а также SII по формуле PLT*NLR (табл. 1).
Распространенность поражения КА и локализацию ИСА оценивали по результатам коронарографии (табл. 2, 3). Выделяли больных с ОПКР, двухсосудистым (ДПКР) и трехсосудистым (ТПКР) поражением КА, а также пациентов с ремоделированием ствола левой КА (ЛКА). Оценку качества восстановления коронарного кровотока после ЧКВ проводили с использованием шкалы TIMI (Thrombolysis In Myocardial Infarction) по данным ангиографической съемки, полученной сразу после имплантации коронарного стента. TIMI 3 соответствует оптимальной перфузии КА, TIMI 1-2 — ограниченной перфузии (феномен "slow-flow"), TIMI 0 — указывает на отсутствие ангиографических признаков восстановления коронарного кровотока (феномен "no-reflow").
Конечная точка исследования была представлена показателем ГЛ больных ИМпST после ЧКВ от всех причин в форме категориального бинарного признака ("отсутствие" или "развитие"). Входные признаки — подгруппа потенциальных предикторов выражалась в форме непрерывных и категориальных переменных. Для обработки и анализа данных использовали методы статистического анализа и машинного обучения. Первые из них включали тесты хи-квадрат, Фишера, Манна-Уитни и однофакторную логистическую регрессию (ЛР). Вторые — метод многофакторной ЛР (МЛР). Показатели были представлены Me и их 95% ДИ, т. к. их распределение не соответствовало нормальному. Статистическая значимость подтверждалась значением p-value <0,05. Разработка моделей МЛР выполнялась с использованием в их структуре только одной из коррелируемых переменных для исключения проблемы мультиколлинеарности. Качество моделей оценивали по 3 метрикам: площадь под ROC-кривой (AUC), чувствительность (Sen) и специфичность (Sp).
Дизайн исследования включал 4 этапа. На первом из них для выделения потенциальных предикторов, линейно связанных с ГЛ, в группах сравнения был проведен статистический анализ 45 факторов. Для непрерывных переменных использовали тест Манна-Уитни, а для категориальных — χ². Отношение шансов (ОШ) и их 95% ДИ рассчитывали точным тестом Фишера. На втором этапе по нормализованным данным с помощью однофакторных ЛР-моделей определяли весовые коэффициенты отдельных показателей, позволяющие дать предварительную оценку степени их влияния на конечную точку исследования. На третьем этапе на основе ЛР выделяли пороговые значения потенциальных предикторов, критериям отбора которых были максимальные значения AUC. На четвертом этапе были разработаны прогностические модели на основе МЛР. Данные для обучения, кросс-валидации и заключительного тестирования были разделены следующим образом: 30% — для заключительного тестирования, 70% — для обучения и кросс-валидации, которая проводилась методом стратифицированного Монте-Карло на 50 выборках. Для определения степени влияния отдельных предикторов на конечную точку в лучшей модели МЛР использовали метод аддитивного объяснения Шепли [9]. Анализ данных и разработка моделей выполнялась на языке Python.
Результаты
Межгрупповой анализ демографических и лабораторных показателей демонстрировал, что большинство из них имеют статистически значимые различия (табл. 1). Больные первой группы отличались преобладанием лиц старшего возраста, женского пола, наличием лейкоцитоза, более высоким уровнем COЭ, NEUT, MON, NLR, PLR, SII и более низкими значениями показателей Ht, EOS и LYM (%). Несмотря на достоверность межгрупповых различий, показатели RBC, Hb, LYM (абс.), абсолютное и относительное значение распределения RBC по объему, средний объем PLT, PCT, коэффициенту крупных PLT, PLR находились в пределах физиологической нормы. Максимальный уровень статистической значимости (p-value <0,0001) фиксировался у большинства показателей КАК, включая индексы NLR, PLR и SII. Менее заметные, но достоверные различия были связаны с параметрами PCT, коэффициентом крупных PLT (p-value =0,001), PLT (p-value =0,02), средним объёмом RBC (p-value =0,036), СОЭ (p-value =0,017). Показатели средней концентрации Hb в эритроцитарной массе (p-value =0,22) и ширина распределения PLT (p-value =0,13) не имели линейной ассоциации с ГЛ.
Таблица 1
Показатели КАК у больных ИМпST после ЧКВ
в группах сравнения (Me, 95% ДИ)
|
Предиктор |
Группа 1 (n=318) |
Группа 2 (n=4359) |
p-value |
|
Возраст, лет |
71 [ 69; 72] |
62 [ 62; 63] |
<0,0001 |
|
Женский пол |
142 (44,65%) |
1332 (30,56%) |
<0,0001 |
|
WBC, 10⁹/л |
14,51 [ 13,62; 15,40] |
9,78 [ 9,67; 9,89] |
<0,0001 |
|
RBC, 10¹²/л |
4,21 [ 4,08; 4,32] |
4,54 [ 4,52; 4,56] |
<0,0001 |
|
Hb, г/л |
130 [ 126; 133] |
141 [ 140; 141] |
<0,0001 |
|
PLT, 10⁹/л |
228 [ 220; 244] |
221 [ 219; 223] |
0,02 |
|
Ht, % |
36,3 [ 35,2; 37] |
40,3 [ 40,1; 40,5] |
<0,0001 |
|
СОЭ, мм/ч |
20 [ 17; 25] |
18 [ 17; 19] |
0,0177 |
|
NEUT, 10⁹/л |
11,07 [ 10,11; 11,89] |
6,29 [ 6,19; 6,39] |
<0,0001 |
|
NEUT, % |
81,3 [ 79,8; 83,3] |
66,7 [ 66,3; 67,3] |
<0,0001 |
|
LYM, 10⁹/л |
1,56 [ 1,41; 1,7] |
1,9 [ 1,87; 1,93] |
<0,0001 |
|
LYM, % |
10,7 [ 9,66; 11,74] |
19,6 [ 19,31; 19,89] |
<0,0001 |
|
MON, 10⁹/л |
1,1 [ 0,99; 1,2] |
0,85 [ 0,83; 0,87] |
<0,0001 |
|
MON, % |
7,7 [ 7,19; 8,21] |
9 [ 8,91; 9,09] |
<0,0001 |
|
EOS, 10⁹/л |
0,01 [ 0; 0,02] |
0,08 [ 0,076; 0,084] |
<0,0001 |
|
EOS, % |
0,1 [ 0,02; 0,22] |
0,9 [ 0,85; 0,95] |
<0,0001 |
|
MCV, фл |
87 [ 86,02; 87,98] |
87,8 [ 87,59; 88,01] |
0,036 |
|
MCH, пг |
30,5 [ 30,11; 30,89] |
31 [ 30,92; 31,08] |
0,004 |
|
MCHC, г/л |
344 [ 334,41; 353,59] |
348 [ 346,07; 349,93] |
0,22 |
|
RDW-CV, % |
14,1 [ 13,78; 14,42] |
13,5 [ 13,45; 13,55] |
<0,0001 |
|
RDW-SD, фл |
46 [ 45,16; 46,84] |
44,8 [ 44,65; 44,95] |
<0,0001 |
|
MPV, фл |
9,4 [ 9,18; 9,62] |
9,1 [ 9,05; 9,15] |
0,0003 |
|
PDW, 10⁹/л |
15,25 [ 14,85; 15,65] |
15,1 [ 15,02; 15,18] |
0,13 |
|
PCT, % |
0,22 [ 0,21; 0,23] |
0,2 [ 0,198; 0,202] |
0,0012 |
|
P-LCR, % |
34,65 [ 33,21; 36,09] |
32,6 [ 32,34; 32,86] |
0,001 |
|
NLR, усл. ед. |
7,51 [ 6,48; 8,54] |
3,21 [ 3,10; 3,31] |
<0,0001 |
|
PLR, усл. ед. |
149 [ 131; 167] |
115 [ 112; 117] |
<0,0001 |
|
SII, усл. ед. |
1772 [ 1408; 2136] |
714 [ 683; 746] |
<0,0001 |
Сокращения: СОЭ — скорость оседания эритроцитов, WBC — лейкоциты,
RBC — эритроциты, Hb — гемоглобин, PLT — тромбоциты, Ht — гематокрит,
NEUT — нейтрофилы, LYM — лимфоциты, MON — моноциты,
EOS — эозинофилы, MCV — средний объем эритроцита,
MCH — среднее содержание гемоглобина в эритроците,
MCHC — средняя концентрация гемоглобина в эритроците,
RDW-CV — относительное значение распределения эритроцитов по объему,
RDW-SD — абсолютное значение распределения эритроцитов по объему,
MPV — средний объем тромбоцита, PDW — ширина распределения тромбоцитов,
PCT — тромбокрит, P-LCR — коэффициент крупных тромбоцитов,
NLR — отношение нейтрофилов к лимфоцитам,
PLR — отношение тромбоцитов к лимфоцитам,
SII — иммуновоспалительный индекс.
В группе больных с неблагоприятным исходом ИМпST регистрировалось сопоставимое количество лиц с ОПКР, ДПКР и ТПКР (31,5%, 34,6% и 33,9%, соответственно). У больных с ТПКР риск ГЛ увеличивался в 2,5 раза (ОШ =2,5, р-value <0,0001), а среди 30 (9,43%) пациентов с атеросклеротическим ремоделированием ствола ЛКА он возрастал в 3 раза (табл. 2). В когорте умерших к ИСА чаще всего относились передняя межжелудочковая ветвь (48,7%), правая КА (25,5%) и огибающая ветвь (15,1%) (табл. 3). При этом среди лиц с благоприятным исходом ИМпST число случаев с инфаркт-связанным поражением правой КА было в 1,7 раза выше, чем в группе умерших, что исключало дальнейшее использование данного фактора в качестве предиктора ГЛ. Локализация ИСА в области ствола ЛКА имела место только у 4,7% больных первой группы и у 0,46% — во второй. Расчет ОШ демонстрировал, что при инфаркт-зависимой передней межжелудочковой ветви вероятность ГЛ увеличивается в 1,3 раза, огибающей ветви — в 1,6 раза, а ствола ЛКА — в 11 раз. Локализация ИСА в таких ветвях коронарного русла, как дистальная ветвь, ветвь тупого края, задняя межжелудочковая ветвь, задняя боковая ветвь и промежуточная артерия, не имела достоверной взаимосвязи с риском ГЛ. Оценка восстановления коронарного кровотока после ЧКВ показала, что при TIMI-0 вероятность ГЛ увеличивается почти в 4 раза, а при TIMI-1 — в 2,5 раза. При этом показатель TIMI-2 не был достоверно связан с риском летальности (p-value =0,1), а TIMI-3 ассоциировался с благоприятным исходом ИМпST после ЧКВ (табл. 3).
Таблица 2
Индикаторы поражения КА и восстановления коронарного кровотока после ЧКВ
у больных ИМпST (Me, 95% ДИ)
|
Предиктор |
Группа 1 (n=318) |
Группа 2 (n=4359) |
ОШ (95%) ДИ |
p-value |
|
ОПКР, абс. (%) |
100 (31,45%) |
2068 (47,41%) |
0,51 [ 0,40; 0,65] |
<0,0001 |
|
ДПКР, абс. (%) |
110 (34,59%) |
1554 (35,63%) |
0,96 [ 0,75; 1,21] |
0,76 |
|
ТПКР, абс. (%) |
108 (33,96%) |
740 (16,96%) |
2,5 [ 1,97; 3,22] |
<0,0001 |
|
Поражение ствола ЛКА, абс. (%) |
30 (9,43%) |
137 (3,14%) |
3,2 [ 2,13; 4,85] |
<0,0001 |
|
TIMI 0, абс. (%) |
23 (7,23%) |
86 (1,97%) |
3,9 [ 2,41; 6,23] |
<0,0001 |
|
TIMI 1, абс. (%) |
45 (14,15%) |
274 (6,28%) |
2,5 [ 1,75; 3,45] |
<0,0001 |
|
TIMI 2, абс. (%) |
9 (2,83%) |
64 (1,47%) |
2 [ 0,96; 3,97] |
0,1 |
|
TIMI 3, абс. (%) |
241 (75,79%) |
3939 (90,28%) |
0,34 [ 0,26; 0,44] |
<0,0001 |
Сокращения: ДПКР — двухсосудистое поражение коронарного русла,
ЛКА — левая коронарная артерия,
ОПКР — однососудистое поражение коронарного русла,
ТПКР — трехсосудистое поражение коронарного русла,
TIMI — Thrombolysis In Myocardial Infarction (шкала оценки коронарного кровотока).
Таблица 3
Локализация инфаркт-связанных КА у больных ИМпST
в группах сравнения (Me, 95% ДИ)
|
Предиктор |
Группа 1 (n=318) |
Группа 2 (n=4359) |
ОШ (95%) ДИ |
p-value |
|
Ствол ЛКА |
15 (4,72%) |
20 (0,46%) |
11 [ 5,44; 21,19] |
<0,0001 |
|
ПМЖВ |
155 (48,74%) |
1839 (42,19%) |
1,3 [ 1,04; 1,64] |
0,03 |
|
ДВ |
4 (1,26%) |
72 (1,65%) |
0,76 [ 0,28; 2,09] |
0,76 |
|
ОВ |
48 (15,09%) |
434 (9,96%) |
1,6 [ 1,16; 2,22] |
0,005 |
|
ВТК |
7 (2,20%) |
57 (1,31%) |
1,7 [ 0,77; 3,76] |
0,28 |
|
ПКА |
81 (25,47%) |
1842 (42,26%) |
0,47 [ 0,36; 0,61] |
<0,0001 |
|
ЗМЖВ |
2 (0,63%) |
26 (0,60%) |
1,1 [ 0,25; 4,46] |
1 |
|
ЗБВ |
4 (1,26%) |
58 (1,33%) |
0,94 [ 0,34; 2,62] |
1 |
|
ПрА |
2 (0,63%) |
11 (0,25%) |
2,5 [ 0,55; 11,34] |
0,45 |
Сокращения: ВТК — ветвь тупого края, ДВ — дистальная ветвь,
ЗБВ — задняя боковая ветвь, ЗМЖВ — задняя межжелудочковая ветвь,
ЛКА — левая коронарная артерия, ОВ — огибающая ветвь,
ПКА — правая коронарная артерия, ПМЖВ — передняя межжелудочковая ветвь,
ПрА — промежуточная артерия.
На втором этапе исследования было установлено, что статистически значимый уровень весовых коэффициентов имел место у 13 факторов (табл. 4). Их наибольшие значения ассоциировались с уровнем NEUT (%) (6,6; p-value <0,0001), LYM (%) (-5,7; p-value <0,0001), NLR (5,6; p-value <0,0001) и SII (5,3; p-value <0,0001). Меньшими по величине, но сопоставимыми по уровню значимости были показатели WBC (4,9), EOS (%) (-4,4), PLR (3,4), Hb (-3,1), Ht (-2,8), PCT (2,34), СОЭ (2,32), MON (%) (-2,3). В разработанных однофакторных моделях положительные значения весовых коэффициентов большинства показателей указывают на увеличение вероятности ГЛ при наличии этих признаков или повышении их уровня, а отрицательные значения LYM (%), EOS (%), Hb, Ht и MON (%) свидетельствуют о возрастании риска ГЛ при снижении их уровня.
Таблица 4
Весовые коэффициенты однофакторных моделей ЛР (Me, 95% ДИ)
|
Предиктор |
Коэффициент |
p-value |
|
NEUT, % |
6,643 [ 6,639; 6,647] |
<0,0001 |
|
LYM, % |
-5,711 [ -5,714; -5,707] |
<0,0001 |
|
NLR |
5,583 [ 5,580; 5,586] |
<0,0001 |
|
SII |
5,324 [ 5,323; 5,326] |
<0,0001 |
|
WBC |
4,910 [ 4,909; 4,911] |
<0,0001 |
|
EOS, % |
-4,407 [ -4,409; -4,405] |
<0,0001 |
|
Возраст |
4,185 [ 4,18; 4,19] |
<0,0001 |
|
PLR |
3,416 [ 3,414; 3,419] |
<0,0001 |
|
Hb |
-3,082 [ -3,084; -3,079] |
<0,0001 |
|
Ht |
-2,846 [ -2,847; -2,845] |
<0,0001 |
|
PCT |
2,344 [ 2,341; 2,346] |
<0,0001 |
|
СОЭ |
2,32 [ 2,28; 2,36] |
<0,0001 |
|
MON, % |
-2,3 [ -2,305; -2,296] |
<0,0001 |
Сокращения: СОЭ — скорость оседания эритроцитов, NEUT — нейтрофилы,
LYM — лимфоциты, NLR — отношение нейтрофилов к лимфоцитам,
SII — иммуновоспалительный индекс, WBC — лейкоциты,
EOS — эозинофилы, PLR — отношение тромбоцитов к лимфоцитам,
Hb — гемоглобин, Ht — гематокрит, PCT — тромбокрит, MON — моноциты.
На третьем этапе исследования с помощью однофакторной ЛР среди ранее отобранных показателей выделяли пороговые значения, отклонение от которых приводило к повышению их предиктивного потенциала (табл. 5). Результаты анализа позволили выделить критериальную границу возраста больных (>65 лет), превышение которой увеличивало вероятность ГЛ (ОШ =3,7, p-value <0,0001). Прогностически значимые критериальные границы были установлены также для отдельных показателей КАК. Так, у пациентов с уровнем NEUT >75,4% риск ГЛ возрастал более чем в 11 раз (ОШ =11, p-value <0,0001), содержание EOS <0,3% увеличивало вероятность ГЛ в 8 раз (ОШ =7,87, p-value <0,0001), а при уровне LYM <13,3% — в 6 раз (ОШ =5,94, p-value <0,0001).
Таблица 5
Пороговые значения потенциальных предикторов (Me, 95% ДИ)
|
Предиктор |
Группа 1 (n=318) |
Группа 2 (n=4359) |
ОШ (95%) ДИ |
p-value |
AUC |
|
NEUT >75,4% |
136 (77,714%) |
936 (23,636%) |
11,27 [ 7,83; 16,21] |
<0,0001 |
0,774 |
|
EOS <0,3% |
127 (72,159%) |
981 (24,779%) |
7,87 [ 5,62; 11,07] |
<0,0001 |
0,741 |
|
NLR >6,8 усл. ед. |
101 (57,714%) |
579 (14,647%) |
7,95 [ 5,82; 10,87] |
<0,0001 |
0,739 |
|
SII >1290,5 усл. ед. |
118 (67,429%) |
844 (21,356%) |
7,62 [ 5,51; 10,55] |
<0,0001 |
0,736 |
|
LYM <13,3% |
143 (65,596%) |
1016 (24,289%) |
5,94 [ 4,45; 7,93] |
<0,0001 |
0,73 |
|
WBC >12,9 10⁹/л |
129 (64,179%) |
1137 (26,553%) |
4,96 [ 3,685; 6,664] |
<0,0001 |
0,724 |
|
Возраст >65 лет |
219 (68,868%) |
1623 (37,199%) |
3,74 [ 2,92; 4,77] |
<0,0001 |
0,667 |
|
PLR >171,9 усл. ед. |
96 (44,037%) |
823 (19,689%) |
3,21 [ 2,43; 4,24] |
<0,0001 |
0,628 |
|
MON <7% |
81 (46,023%) |
872 (22,009%) |
3,02 [ 2,23; 4,1] |
<0,0001 |
0,625 |
|
Ht <37,7% |
161 (65,984%) |
1879 (43,566%) |
2,51 [ 1,93; 3,3] |
<0,0001 |
0,619 |
|
Hb <135 г/л |
123 (61,2%) |
1557 (36,4%) |
2,76 [ 2,06; 3,67] |
<0,0001 |
0,624 |
|
PCT >0,22% |
104 (48,372%) |
1417 (34,038%) |
1,82 [ 1,38; 2,39] |
<0,0001 |
0,598 |
|
СОЭ >28 мм/ч |
68 (38,418%) |
1139 (28,305%) |
1,58 [ 1,16; 2,16] |
0,0047 |
0,563 |
|
TIMI <2 |
68 (21,384%) |
360 (8,253%) |
3,02 [ 2,265; 4,037] |
<0,0001 |
0,568 |
Сокращения: СОЭ — скорость оседания эритроцитов, NEUT — нейтрофилы,
EOS — эозинофилы, NLR — отношение нейтрофилов к лимфоцитам,
SII — иммуновоспалительный индекс, LYM — лимфоциты,
WBC — лейкоциты, PLR — тромбоциты/лимфоциты, MON — моноциты,
TIMI — Thrombolysis In Myocardial Infarction (шкала оценки коронарного кровотока),
Ht — гематокрит, Hb — гемоглобин, PCT — тромбокрит.
Повышение WBC >10,1*10⁹/л ассоциировалось с ростом вероятности ГЛ в 2,9 раза, а увеличение PCT >0,22% и СОЭ >28 мм/ч в 1,8 и 1,6 раза, соответственно. Снижение MON <7%, Ht <37,7%, Hb <135 г/л было также связано с возрастающим риском ГЛ в 2,3-3 раза. Критериальные значения индексов NLR >6,8 усл. ед. и SII >1290,5 усл. ед. значительно увеличивали их предиктивную ценность в отношении ГЛ (ОШ =7,95 и 7,62, соответственно; p-value <0,0001), что коррелирует с высоким рискометрическим потенциалом NEU и LYM, входящих в структуру этих индикаторов. Уровень PLR >171,9 усл. ед. также демонстрировал возрастающий предиктивный потенциал (ОШ =3,21, p-value <0,0001), значение которого было ниже, чем у SII и NLR, что может объясняться меньшим влиянием PLT на риск ГЛ. Для повышения качества интерпретации данных было выделено пороговое значение индикаторов восстановления коронарного кровотока после ЧКВ, которое при уровне TIMI <2 обладало высокой предиктивной ценностью (ОШ =3, p-value <0,0001).
На четвертом этапе исследования на основе МЛР были разработаны прогностические модели ГЛ с использованием ранее отобранных предикторов (табл. 6). Структура модели (1) была представлена только показателями, характеризующими состояние коронарного русла (ТПКР, поражение ствола ЛКА и TIMI <2). Оценка качества модели указывала на ее недостаточную прогностическую точность (AUC — 0,655, Sen — 0,474, Sp — 0,743). Для построения модели (2) использовались только показатели КАК в непрерывной форме, что позволило существенно увеличить ее точность (AUC — 0,825, Sen — 0,737, Sp — 0,761). Модель (3) включала факторы КАК в категориальной форме и была сопоставима по критериям качества с моделью (2). Структура модели (4) была представлена комбинацией факторов КАК в непрерывной и категориальной формах, что позволило добиться увеличения AUC на тестовых выборках и выборках для валидации. Данную модель рассматривали как базовую с последующим пошаговым включением в ее структуру индикаторов поражения КА и восстановления коронарной перфузии (модели 5-9), что приводило к увеличению или снижению отдельных метрик качества. Максимальный подъем AUC фиксировался в модели (9) при сочетании 10 признаков, где помимо 7 базовых предикторов КАК использовались показатели ТПКР, TIMI <2 и поражение ствола ЛКА.
Таблица 6
Оценка точности прогностических моделей
|
Предикторы моделей |
Тестовые выборки |
Выборки для валидации |
|||||
|
Auc |
Sen |
Sp |
Auc |
Sen |
Sp |
||
|
1 |
ТПКР, поражение ствола ЛКА, TIMI <2 |
0,655 |
0,474 |
0,743 |
0,68 |
0,701 |
0,408 |
|
2 |
NEUT %, LYM %, SII, WBC, Hb, Ht, СОЭ |
0,825 |
0,737 |
0,761 |
0,855 |
0,778 |
0,762 |
|
3 |
NEUT >75,4%, LYM <13,3%, SII >1290,5 усл. ед., WBC >10,1 10⁹/л , Hb <135 г/л, PCT >0,22%, СОЭ >28 мм/ч |
0,824 |
0,76 |
0,781 |
0,847 |
0,8 |
0,781 |
|
4 |
NEUT >75,4%, LYM <13,3%, SII, WBC, Hb, PCT >0,22%, СОЭ |
0,836 |
0,76 |
0,78 |
0,854 |
0,8 |
0,782 |
|
5 |
NEUT >75,4%, LYM <13,3%, SII, WBC, Hb, PCT >0,22%, СОЭ, поражение ствола ЛКА |
0,837 |
0,76 |
0,785 |
0,852 |
0,80 |
0,785 |
|
6 |
NEUT >75,4%, LYM <13,3%, SII, WBC, Hb, PCT >0,22%, СОЭ, TIMI <2 |
0,841 |
0,76 |
0,783 |
0,855 |
0,8 |
0,782 |
|
7 |
NEUT >75,4%, LYM <13,3%, SII, WBC, Hb, PCT >0,22%, СОЭ, ТПКР |
0,843 |
0,78 |
0,789 |
0,864 |
0,8 |
0,786 |
|
8 |
NEUT >75,4%, LYM <13,3%, SII, WBC, Hb, PCT >0,22%, СОЭ, ТПКР, TIMI <2 |
0,841 |
0,77 |
0,786 |
0,865 |
0,8 |
0,789 |
|
9 |
NEUT >75,4%, LYM <13,3%, SII, WBC, Hb, PCT >0,22%, СОЭ, ТПКР, TIMI <2, поражение ствола ЛКА |
0,845 |
0,78 |
0,786 |
0,866 |
0,8 |
0,786 |
Сокращения: ЛКА — левая коронарная артерия, СОЭ — скорость оседания эритроцитов,
ТПКР — трехсосудистое поражение коронарного русла, AUC — площадь под ROC-кривой,
NEUT — нейтрофилы, LYM — лимфоциты, SII — иммуновоспалительный индекс,
WBC — лейкоциты, Hb — гемоглобин, Ht — гематокрит, PCT — тромбокрит,
TIMI — Thrombolysis In Myocardial Infarction (шкала оценки коронарного кровотока),
Sen — чувствительность, Sp — специфичность.
Эта модель имела наилучшее соотношение критериев качества: AUC — 0,845, Sen — 0,78, Sp — 0,786. Прогностические алгоритмы, включающие комбинации других предикторов, в т. ч. указывающих на локализацию ИСА, обладали существенно меньшей предсказательной ценностью.
Относительный вклад отдельных предикторов в реализацию конечной точки исследования определяли методом аддитивного объяснения Шепли по данным модели (9) (рис. 1).
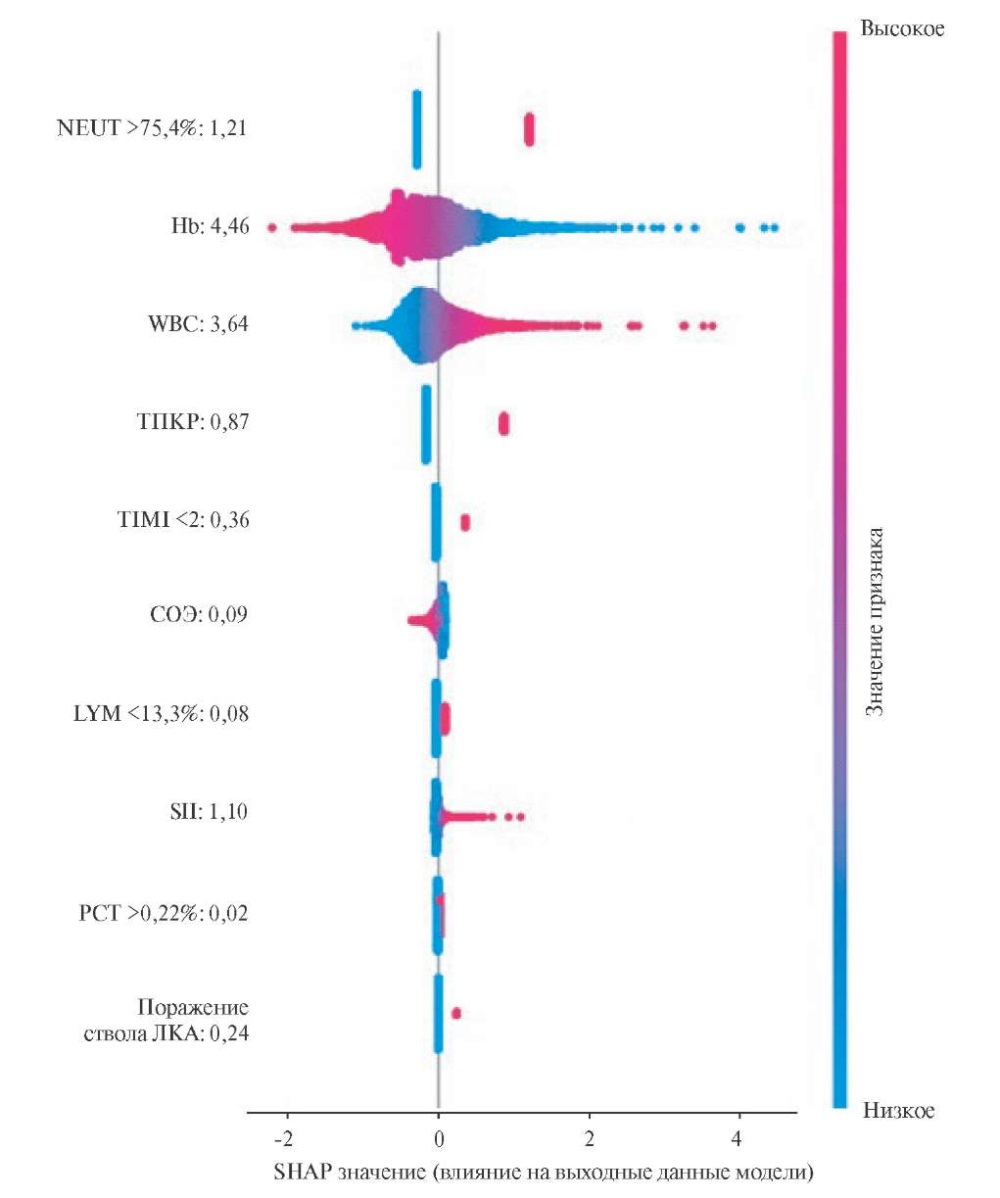
Рис. 1. Оценка влияния отдельных предикторов модели (9) на ГЛ
по методу Шепли (SHAP).
Сокращения: ЛКА — левая коронарная артерия,
СОЭ — скорость оседания эритроцитов,
ТПКР — трехсосудистое поражение коронарного русла,
Hb — гемоглобин, LYM — лимфоциты, NEUT — нейтрофилы,
PCT — тромбокрит, SII — иммуновоспалительный индекс,
TIMI — Thrombolysis In Myocardial Infarction, WBC — лейкоциты.
Наибольшее влияние на риск ГЛ оказывали показатели Hb (4,46 усл. ед.) и WBC (3,64 усл. ед.). Менее заметный вклад в реализацию конечной точки ассоциировался с NEUT >75,4% (1,21 усл. ед.), SII (1,1 усл. ед.), ТПКР (0,87 усл. ед.), TIMI <2 (0,36 усл. ед.) и поражением ствола ЛКА (0,24 усл. ед.), а наименьший — с LYM <13,3% (0,08 усл. ед.) и PCT >0,22% (0,02 усл. ед.).
Обсуждение
Показатели КАК являются наиболее доступными лабораторными индикаторами для оценки клинико-функционального статуса больных с различными формами патологий и все чаще используются в прогностических исследованиях [3-6]. В настоящей работе было установлено, что среди показателей КАК наибольшей предиктивной ценностью в отношении риска ГЛ обладали 7 факторов, 3 из которых были в категориальной форме (NEUT >75,4%, LYM <13,3%, PCT >0,22%) и 4 — в непрерывной (WBC, Hb, СОЭ и SII). Анализ прогностического ресурса показателей локализации ИСА указывал на его низкий уровень, что ограничивало возможность их применения для оценки вероятности ГЛ (табл. 3). Более высокий предиктивный потенциал ассоциировался с параметрами ТПКР, поражения ствола ЛКА и TIMI <2. Однако комбинация этих факторов в модели (1) указывала на ее недостаточную прогностическую способность, что послужило поводом для объединения данных индикаторов с показателями КАК. Известно, что развитие ИБС и ее осложнений обусловлено прогрессирующим атеросклеротическим ремоделированием КА, к патофизиологическим детерминантам которого относится хроническое системное воспаление. NLR рассматривается как индикатор воспалительного ответа и как предиктор неблагоприятных исходов при сердечно-сосудистых заболеваниях. Увеличение этого соотношения более 3,39 усл. ед. у больных ИМпST ассоциировалось с высокой концентрацией тропонина I, наличием ТПКР и показателем смертности от всех причин [10]. В нашей работе при пороговом значении NLR >6,8 усл. ед. вероятность летального исхода возрастала почти в 8 раз (ОШ =7,95, p-value <0,0001), однако включение этого фактора в модели не приводило к улучшению их предсказательной способности, что может объясняться большей предиктивной ценностью изолированных показателей LYM и NEUT. Индекс SII ранее использовался как предиктор ГЛ у больных ИМпST после ЧКВ. В нашем исследовании он обладал высокой предсказательной способностью (ОШ =7,62, p-value <0,0001) и был включен в базовую и итоговую модели. В ряде исследований показано, что у больных ИМпST лейкоцитоз был взаимосвязан с риском ГЛ, снижением ФВ ЛЖ, вероятностью развития феномена "no-reflow" и фатальным нарушением сердечного ритма [11]. Фактор WBC включен в структуру рискометрических шкал APACHE II, SAPS II и апробируется в новых прогностических инструментах. В нашей работе WBC являлся важным предиктором базовой и итоговой моделей ГЛ.
Результаты недавно опубликованного метаанализа демонстрировали, что увеличение PLR у больных ИМпST после ЧКВ ассоциировано с риском ГЛ от всех причин [5]. В нашем исследовании категориальное значение PLR >171,9 усл. ед. обладало приемлемой предиктивной ценностью, но при комбинации с другими индикаторами провоспалительного ответа его прогностическая значимость снижалась. Ранее было показано, что повышение РСТ обусловлено увеличением незрелых форм PLT и взаимосвязано с частотой развития повторного ИМпST и высоким риском ГЛ [12]. В нашем исследовании значение PCT >0,22% имело приемлемую предсказательную способность и вошло в базовую и итоговую модели ГЛ.
Увеличение уровня Hb является универсальным механизмом адаптации к гипоксии, в т. ч. обусловленной патологией сердца. В исследовании Zeren G, et al. была представлена прогностическая модель ГЛ у больных ИМпST после ЧКВ, в которой Hb являлся лучшим предиктором неблагоприятных исходов [13]. В нашем исследовании показатель Hb <135 г/л демонстрировал высокую предсказательную способность, а его вклад в реализацию конечной точки был наибольшим.
В ряде исследований показано, что у больных ИМпST с ТПКР риск ГЛ существенно возрастает, несмотря на выполнение ЧКВ. Так, в исследовании Dimitriu-Leen AC, et al. [14] приведены данные о том, что пациенты с ТПКР и стентированием ИСА имели более высокий риск реперфузионных осложнений и повторного ИМпST, чем больные с ОПКР. В настоящей работе включение ТПКР в структуру модели (7) приводило к увеличению ее прогностической способности (AUC — 0,843). Ранее было показано, что при сочетании ТПКР и поражения ствола ЛКА, которое имело место у 52% пациентов с острым коронарным синдромом, частота развития фатальных осложнений резко возрастала [15]. В нашей работе атеросклеротическое ремоделирование ствола ЛКА увеличивало риск ГЛ в 3,2 раза, а включение данного предиктора в модель (5) лишь незначительно увеличивало ее прогностический потенциал по сравнению с базовой моделью (4) (AUC 0,837 vs 0,836). Известно, что восстановление оптимального кровотока в ИСА в кратчайшие сроки ассоциируется с благоприятными исходами ИМпST, а коронарная перфузия на уровне TIMI 0-2 является независимым предиктором ГЛ. В исследовании Deng L, et al. [16] на основе МЛР была создана прогностическая модель для оценки риска развития феномена "no-reflow" (AUC — 0,786). Авторы показали, что нарушение коронарного кровотока по TIMI 0-1 тесно коррелировало с увеличением WBC, снижением ФВ ЛЖ, Hb и риском ГЛ. В нашем исследовании показатель коронарной перфузии после ЧКВ на уровне TIMI <2 обладал высоким предиктивным потенциалом не только в качестве изолированного фактора (ОШ =3, p-value <0,0001), но и при его сочетании с ТПКР и поражением ствола ЛКА в лучшей модели (9) (AUC — 0,845). Результаты ряда исследований указывают на высокую степень взаимосвязи воспалительных индексов КАК и индикаторов поражения коронарного русла. Так, SII >750 усл. ед. ассоциировался с тяжелым атеросклеротическим ремоделированием КА, а NLR — с ГЛ у больных ИМпST с высокими баллами по шкале SYNTAX Score [17]. Использование в нашей работе метода Шепли, относящегося к технологиям объяснимого искусственного интеллекта, позволило оценить прогностическую ценность отдельных факторов. Так, в структуре лучшей модели (9) наибольшее влияние на риск ГЛ оказывали уровень Hb, WBC и NEUT >75,4%, а прогностическое значение факторов ТПКР, поражения ЛКА и TIMI <2 было менее заметным.
Ограничения исследования. Ограничения исследования связаны с необходимостью расширения выборки больных, спектра методов машинного обучения и валидации моделей на данных из других лечебных учреждений.
Заключение
Многоступенчатый анализ предиктивного потенциала показателей КАК и индикаторов поражения КА у больных ИМпST после ЧКВ демонстрировал его различный уровень по отношению к риску ГЛ. Прогностическая модель на основе показателей ТПКР, поражения ЛКА и TIMI <2 значительно уступала по точности алгоритму с предикторами КАК. Тестирование предиктивной ценности признаков локализации ИСА не улучшило качество моделей. Локализация ИСА в области ствола ЛКА, несмотря на тесную ассоциацию с ГЛ (ОШ =11, p-value <0,0001), не рассматривалась нами в качестве предиктора из-за малого числа наблюдений (4,7% больных в первой группе и 0,46% — во второй) и известной роли данного признака в танатогенезе ИМпST. Необходимо также отметить, что в настоящей работе нами намеренно не анализировался предиктивный потенциал факторов, входящих в классические шкалы-рискометры, прогностическое значение которых в отношении ГЛ доказано в многочисленных исследованиях. Это позволило детализировать оценку показателей КАК, прогностические возможности которых недостаточно изучены и нуждаются в дальнейшем исследовании.
Отношения и деятельность. Исследование выполнено в рамках проекта FZNS-2023-0010 Госзадания ДВФУ.
Список литературы
1. GBD 2019 Diseases and Injuries Collaborators. Global burden of 369 diseases and injuries in 204 countries and territories, 1990-2019: a systematic analysis for the Global Burden of Disease Study 2019. Lancet. 2020;396(10258):1204-22. doi:10.1016/S0140-6736(20)30925-9.
2. Алекян Б. Г., Ганюков В. И., Маношкина Е. М., Ганюков В. И. Реваскуляризация при инфаркте миокарда с подъемом сегмента ST в Российской Федерации. Эндоваскулярная хирургия. 2019;6(2):89-97. doi:10.24183/2409-4080-2019-6-2-89-97.
3. Циванюк М. М., Гельцер Б. И., Шахгельдян К. И. и др. Показатели клинического анализа крови, липидного спектра и их соотношений в прогнозировании обструктивного поражения коронарных артерий у больных с острым коронарным синдромом без подъема ST. Российский кардиологический журнал. 2022;27(8):5079. doi:10.15829/1560-4071-2022-5079. EDN ADACCL.
4. Чаулин А. М., Григорьева Ю. В., Павлова Т. В., Дупляков Д. В. Диагностическая ценность клинического анализа крови при сердечно-сосудистых заболеваниях. Российский кардиологический журнал. 2020;25(12):3923. doi:10.15829/1560-4071-2020-3923.
5. Dong G, Huang A, Liu L. Platelet-to-lymphocyte ratio and prognosis in STEMI: A meta-analysis. Eur J Clin Invest. 2021;51(3):e13386. doi:10.1111/eci.13386.
6. Ji Z, Liu G, Guo J, et al. The Neutrophil-to-Lymphocyte Ratio Is an Important Indicator Predicting In-Hospital Death in AMI Patients. Front Cardiovasc Med. 2021;8:706852. doi:10.3389/fcvm.2021.706852.
7. Öcal L, Keskin M, Cerşit S, et al. Systemic immune-inflammation index predicts in-hospital and long-term outcomes in patients with ST-segment elevation myocardial infarction. Coron Artery Dis. 2022;33(4):251-60. doi:10.1097/MCA.0000000000001117.
8. Sorajja P, Gersh BJ, Cox DA, et al. Impact of multivessel disease on reperfusion success and clinical outcomes in patients undergoing primary percutaneous coronary intervention for acute myocardial infarction. Eur Heart J. 2007;28(14):1709-16. doi:10.1093/eurheartj/ehm184.
9. Molnar C. Interpretable Machine Learning: A Guide for Making Black Box Models Explainable. Raleigh: Lulu Press, 2020. p. 320. ISBN: 978-0-244-76852-2.
10. Xu N, Tang X-F, Yao Y, Yao X. Predictive value of neutrophil to lymphocyte ratio in long-term outcomes of left main and/or three-vessel disease in patients with acute myocardial infarction. Catheter Cardiovasc Interv. 2018;91:551-7.
11. van Blokland IV, Groot HE, Hendriks T, et al. Sex differences in leukocyte profile in ST-elevation myocardial infarction patients Sci Rep. 2020;10(1):6851. doi:10.1038/s41598-020-63185-3.
12. Petzold T, Zhang Z, Ballesteros I, Saleh I, et al. Neutrophil "plucking" on megakaryocytes drives platelet production and boosts cardiovascular disease. Immunity. 2022;55(12):2285-2299.e7. doi:10.1016/j.immuni2022.10.001.
13. Zeren G, Avcı İİ, Şimşek B, et al. Post percutaneous coronary intervention hemoglobin levels predict in-hospital mortality in patients with STEMI treated with primary percutaneous coronary intervention. Anatol J Cardiol. 2021;25(9):623-9. doi:10.5152/AnatolJCardiol.2021.07282.
14. Dimitriu-Leen AC, Hermans MPJ, Veltman CE, et al. Prognosis of complete versus incomplete revascularization of patients with STEMI with multivessel coronary artery disease: an observational study. Open Heart. 2017;4:e000541. doi:10.1136/openhrt-2016-000541.
15. Барбараш О. Л., Поликутина О. М., Тавлуева Е. В., Барбараш Н. А. Поражение ствола левой коронарной артерии: взгляд кардиолога. Креативная кардиология. 2015;9(2):5-20. doi:10.15275/kreatkard-2015.02.01.
16. Deng L, Zhao X, Su X, et al. Machine learning to predict no reflow and in-hospital mortality in patients with ST-segment elevation myocardial infarction that underwent primary percutaneous coronary intervention. BMC Med Inform Decis Mak. 2022;22(1):109. doi:10.1186/s12911-022-01853-2.
17. Altun B, Turkon H, Tasolar H, et al. The relationship between high-sensitive troponin T, neutrophil lymphocyte ratio and SYNTAX Score. Scand J Clin Lab Invest. 2014;74(2):108-15. doi:10.3109/00365513-2013-860619.
Об авторах
Б. И. ГельцерРоссия
Борис Израилевич Гельцер — д. м. н., профессор, член-корр. РАН, Школа медицины, зам. директора по научной работе
Владивосток
К. И. Шахгельдян
Россия
Карина Иосифовна Шахгельдян — д. т. н., доцент, Школа медицины, зав. лабораторией анализа больших данных в медицине и здравоохранении; директор института информационных технологий
Владивосток
Конфликт интересов:
конфликта нет
И. Г. Домжалов
Россия
Игорь Геннадьевич Домжалов — аспирант департамента клинической медицины, Школа медицины; врач отделения реанимации и интенсивной терапии регионального сосудистого центра
Владивосток
Н. С. Куксин
Россия
Никита Сергеевич Куксин — магистрант
Владивосток
Конфликт интересов:
конфликта нет
В. Н. Котельников
Россия
Владимир Николаевич Котельников — д. м. н., профессор, Школа медицины, профессор департамента клинической медицины
Владивосток
Дополнительные файлы
- Прогностический алгоритм госпитальной летальности у больных инфарктом миокарда с подъемом сегмента ST после чрескожного коронарного вмешательства с использованием только предикторов клинического анализа крови (КАК) превосходил по точности модель на основе изолированных показателей поражения коронарного русла (AUC — 0,655 vs 0,836).
- Наибольшей предиктивной ценностью обладала прогностическая модель с комбинацией 7 факторов КАК (лейкоциты, гемоглобин, скорость оседания эритроцитов, иммуновоспалительный индекс, нейтрофилы >75,4%, лимфоциты <13,3%, тромбокрит >0,22%), показателя трехсосудистого поражения коронарных артерий, ремоделирования левой коронарной артерии и TIMI <2 (AUC — 0,845).
- Метод аддитивного объяснения Шепли является эффективным инструментом для определения интенсивности влияния предикторов на конечную точку исследования.
Рецензия
Для цитирования:
Гельцер Б.И., Шахгельдян К.И., Домжалов И.Г., Куксин Н.С., Котельников В.Н. Показатели клинического анализа крови и поражения коронарного русла в прогнозировании госпитальной летальности у больных острым инфарктом миокарда с подъемом сегмента ST после чрескожного коронарного вмешательства. Российский кардиологический журнал. 2024;29(2):5549. https://doi.org/10.15829/1560-4071-2024-5549. EDN: UWCBEN
For citation:
Geltser B.I., Shahgeldyan K.I., Domzhalov I.G., Kuksin N.S., Kotelnikov V.N. Parameters of complete blood count and coronary lesions in predicting inhospital mortality in patients with acute ST-segment elevation myocardial infarction after percutaneous coronary intervention. Russian Journal of Cardiology. 2024;29(2):5549. (In Russ.) https://doi.org/10.15829/1560-4071-2024-5549. EDN: UWCBEN
JATS XML

















































