Перейти к:
Особенности экспрессии ферментов метаболизма церамидов в жировых депо различной локализации при сердечно-сосудистых заболеваниях
https://doi.org/10.15829/1560-4071-2023-5390
Аннотация
Цель. Выявить особенности экспрессии генов ферментов сфингомиелиназного пути биосинтеза церамидов и ферментов деградации церамидов в жировых депо различной локализации у пациентов с сердечно-сосудистыми заболеваниями.
Материал и методы. Обследовано 38 пациентов: 20 — с ишемической болезнью сердца (ИБС) и 18 — с аортальным стенозом/недостаточностью. Биоптаты подкожной, эпикардиальной, периваскулярной жировой ткани (ЖТ) (ПЖТ, ЭЖТ, ПВЖТ, соответственно) получены во время операции. Экспрессия генов ферментов сфингомиелиназного пути синтеза (кислой и нейтральной сфингомиелиназ SMPD1 и SMPD3) и деградации церамидов (кислой церамидазы ASAH1; сфингомиелинсинтазы 1 и 2 SGMS1 и SGMS2) оценена при помощи количественной полимеразной цепной реакции. Анализ уровня соответствующих белков проведен с использованием иммуноблоттинга (вестернблоттинг). Статистическая обработка выполнена в программе GraphPad Prism 8 (GraphPad Software).
Результаты. При ИБС максимальная экспрессия SMPD1 наблюдалась в подкожных и эпикардиальных адипоцитах. У лиц с приобретенными пороками сердца (ППС) уровень мРНК SMPD1 в ПЖТ был выше, чем в ПВЖТ. Экспрессия гена SMPD1 в ЭЖТ пациентов с ИБС была более выражена по сравнению с пациентами с ППС. ПВЖТ отличалась минимальной экспрессией SMPD1 независимо от нозологии. Экспрессия SMPD3 не имела тканевых особенностей в исследуемых группах, ген SMPD1 был более экспрессирован в адипоцитах ЖТ сердца, чем SMPD3. Экспрессия ASAH1 в ЭЖТ при ИБС была максимальной относительно ЖТ других локализаций. Лица с ППС характеризовались высокой экспрессией ASAH1 независимо от локализации ЖТ, превышающей показатели больных с ИБС. При ИБС уровень SGMS1 в ЭЖТ был выше, чем в ПЖТ и ПВЖТ, у пациентов ППС тканевых особенностей не выявлено. Генная экспрессия SGMS1 в ЭЖТ пациентов с ИБС была выше, чем в группе пороков сердца. Экспрессия SGMS2 значительно превышала SGMS1 в обеих исследуемых группах и была максимальной в адипоцитах ПЖТ и ПВЖТ по сравнению с ЭЖТ в группе ИБС и в ПВЖТ в группе ППС. Коронарогенная патология характеризовалась более высоким уровнем мРНК SGMS2 в ПЖТ и ЭЖТ. Уровень ферментов метаболизма церамидов в адипоцитах ЖТ пациентов соответствовал экспрессии их генов.
Заключение. При коронарогенной патологии ЖТ сердца (преимущественно эпикардиальной локализации) характеризуется не только повышенной экспрессией генов ферментов синтеза церамидов по сфингомиелиназному пути, но и активацией утилизации церамидов с образованием сфингозина. Наблюдаемые изменения могут способствовать аккумуляции церамидов и сфингомиелина, ассоциированных с атеросклеротическими процессами в ЖТ данной локализации.
Ключевые слова
Для цитирования:
Груздева О.В., Белик Е.В., Дылева Ю.А., Учасова Е.Г., Понасенко А.В., Кутихин А.Г., Маркова В.Е., Горбатовская Е.Е., Фанаскова Е.В., Иванов С.В., Стасев А.Н., Зинец М.Г., Cлесарева Т.А., Барбараш О.Л. Особенности экспрессии ферментов метаболизма церамидов в жировых депо различной локализации при сердечно-сосудистых заболеваниях. Российский кардиологический журнал. 2023;28(4):5390. https://doi.org/10.15829/1560-4071-2023-5390
For citation:
Gruzdeva O.V., Belik E.V., Dyleva Yu.A., Uchasova E.G., Ponasenko A.V., Kutikhin A.G., Markova V.E., Gorbatovskaya E.E., Fanaskova E.V., Ivanov S.V., Stasev A.N., Zinets M.G., Slesareva T.A., Barbarash O.L. Gene expression of ceramide metabolism enzymes in fat depots of different localization in cardiovascular diseases. Russian Journal of Cardiology. 2023;28(4):5390. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5390
Несмотря на проводимые профилактику и лечение, смертность от сердечно-сосудистых заболеваний (ССЗ) остается высокой. Поэтому поиск новых диагностических подходов к оценке риска развития и прогрессирования ССЗ является актуальной задачей [1]. Появляется все больше данных о том, что церамиды играют важную роль в развитии атерогенных и неатерогенных заболеваний сердца [2].
Церамиды — это биоактивные липиды, которые не только являются структурными компонентами клеточных мембран, но и участвуют в передаче сигналов и в метаболизме, в реакциях на стресс, апоптозе, регулируют пролиферацию и гибель клеток, в т.ч. адипоцитов [3]. Считается, что накопление церамидов ассоциировано с неблагоприятными сердечно-сосудистыми событиями [4]. Ранее нами продемонстрировано, что коронарогенная патология жировой ткани (ЖТ) сердца характеризуется активацией синтеза церамидов de novo, преимущественно в эпикардиальной локализации, что может приводить к аккумуляции церамидов, потенцируя ряд патологических процессов, ассоциированных с атеросклерозом [5].
Известно, что церамиды в ЖТ могут образовываться не только de novo, но и из сфингомиелина (SM) [6]. Этот путь реализуется при помощи сфингомиелиназ (SMase) и является быстрым временным механизмом, за счет которого уровень церамидов в адипоцитах может резко повышаться в несколько раз [3][7]. Провоспалительные цитокины, высокий уровень которых ассоциирован с атеросклерозом (фактор некроза опухоли-α, интерлейкин-1β и интерферон-γ), стимулируют активность SMase, повышая концентрацию церамидов в клетках, что, вероятно, может быть реализовано и в адипоцитах ЖТ сердца и коронарных артерий. Ранее нами была показана высокая экспрессия провоспалительных адипоцитокинов в эпикардиальной ЖТ (ЭЖТ) [8]. Наряду с активацией воспаления в ЭЖТ нами было обнаружено и увеличение размеров жирового депо этой локализации у пациентов с ишемической болезнью сердца (ИБС), что на фоне дислипидемии может приводить к локальной гипоксии и активации факторов, индуцируемых гипоксией, таких как, например, HIFs. В свою очередь, HIF-1α в адипоцитах повышает экспрессию SMase, активируя тем самым синтез церамидов из SM.
Содержание церамидов в адипоцитах зависит от соотношения скорости их образования и утилизации, что особенно важно для ЭЖТ и периваскулярной ЖТ (ПВЖТ), локализованных в непосредственной близости от очага поражения при ССЗ [9]. Показано, что ингибирование синтеза либо ускорение деградации церамидов приводит к снижению их уровня в клетках и тканях и улучшает течение атеросклероза [10]. Деградация церамидов на сфингозин и свободные жирные кислоты в аппарате Гольджи опосредуется ферментом церамидазой. Идентифицировано 5 различных церамидаз в соответствии с оптимальным рН для их каталитической активности: кислая (ASAH1, pH=4,5), нейтральная (ASAH2, pH=7,5), щелочная церамидаза 1 (ACER1, pH=8,5), щелочная церамидаза 2 (ACER2, pH=9,0) и щелочная церамидаза 3 (ACER3, pH=9,5). В сердце экспрессируется кислая церамидаза ASAH1, сверхэкспрессия которой снижает гибель кардиомиоцитов и обеспечивает кардиопротекцию [11].
Церамиды являются субстратом для фермента сфингомиелинсинтазы (SMS), имеющей несколько изоформ. SMS1 отвечает за синтез SМ в аппарате Гольджи (SGMS1), SMS2 локализован в плазматической мембране (SGMS2). В результате этой реакции образуется SM, содержание которого в стенке аорты и плазме ассоциировано с атеросклерозом. Стратегия снижения/нормализации уровня церамидов при инфаркте миокарда (ИМ), артериальной гипертензии и атеросклерозе привлекает все больше внимания исследователей [12].
В настоящее время данных об особенностях экспрессии генов ферментов метаболизма в ЖТ недостаточно, практически все они ограничены результатами экспериментальных работ на моделях грызунов [13]. В то же время изменение их активности в ЖТ сердечной локализации может вызывать избыточный синтез и накопление церамидов не только в ЖТ, но и в кардиомиоцитах. Аккумуляция церамидов способна индуцировать целый ряд патологических процессов, ассоциированных с атерогенезом. Поэтому целью исследования явилось выявление особенностей экспрессии генов ферментов сфингомиелиназного пути биосинтеза церамидов и ферментов деградации церамидов в жировых депо различной локализации у пациентов с ССЗ.
Материал и методы
В исследование включено 38 пациентов, подписавших добровольное информированное согласие на участие, среди которых было 20 пациентов с ИБС в возрасте до 75 лет (основная группа). Группу сравнения составили 18 пациентов с некоронарогенными патологиями сердца — дегенеративные неревматические приобретенные пороки сердца (ППС) (аортальный стеноз/недостаточность) и показаниями для проведения открытой операции на клапанах сердца, сопоставимых по полу и возрасту с основной группой. Все пациенты имели показания для проведения открытого вмешательства на сердце — прямой реваскуляризации миокарда методом коронарного шунтирования или операции на клапанах сердца. В исследование не включали пациентов старше 75 лет, с наличием клинически значимой сопутствующей патологии (сахарный диабет 1 и 2 типа, ИМ, анемия, почечная и печеночная недостаточность, онкологические и инфекционно-воспалительные заболевания в период обострения, аутоиммунные заболевания). На госпитальном этапе все пациенты получали стандартную медикаментозную терапию в соответствии с рекомендациями Минздрава России (2020) и Европейского общества кардиологов (2020). Подробная клинико-анамнестическая характеристика и методы исследования представлены ранее [5]. Во время оперативного вмешательства (коронарное шунтирование или коррекции пороков сердца) были получены образцы ЖТ подкожной (ПЖТ), ЭЖТ и ПВЖТ локализации (3-5 г), которые подвергались криогенной заморозке жидким азотом с последующим хранением при температуре -150ºС. Источником ПЖТ служила подкожная клетчатка нижнего угла средостенной раны, ЭЖТ — правые отделы сердца (правое предсердие и правый желудочек), ПВЖТ — область правой коронарной артерии.
Оценка генной экспрессии. Для измерения экспрессии генов ферментов синтеза и деградации церамидов использовался метод количественной полимеразной цепной реакции с праймерами, синтезированными ЗАО "Евроген" (г. Москва, Россия), на амплификаторе ViiA 7 (Applied Biosystems, США). Структура праймеров представлена в таблице 1.
Таблица 1
Праймеры, используемые для оценки генной экспрессии ферментов синтеза и деградации церамидов
|
Ген |
Направленность |
Последовательность (5’->3’) |
Длина праймера |
|
SMPD1 |
Forward primer |
сcgctggctctatgaagcgat |
21 |
|
Reverse primer |
cggggtatggggaaagagcat |
21 |
|
|
SMPD3 |
Forward primer |
gaaggacaacaaggtcccagt |
21 |
|
Reverse primer |
caactccggctggtcaatgg |
20 |
|
|
ASAH1 |
Forward primer |
ctgaaccgcaccagccaaga |
20 |
|
Reverse primer |
ggcagtcccgcaggtaagttt |
21 |
|
|
SGMS1 |
Forward primer |
ccagtgcaacgtgacgacag |
20 |
|
Reverse primer |
agtccacactccttcagtcgct |
22 |
|
|
SGMS2 |
Forward primer |
actctacctgtgcctggaatgc |
22 |
|
Reverse primer |
tcagtgtcagcgtaaccgtgt |
21 |
Сокращения: ASAH1 — ген кислой церамидазы, SGMS1 — ген сфингомиелинсинтазы 1, SGMS2 — ген сфингомиелинсинтазы 2, SMPD1 — ген кислой сфингомиелиназы, SMPD3 — ген нейтральной сфингомиелиназы.
Анализ ферментов метаболизма церамидов в адипоцитах ЖТ различной локализации у пациентов с ССЗ методом вестерн-блотт. Анализ уровня ферментов синтеза и деградации церамидов в адипоцитах ЖТ пациентов исследуемых групп был проведен методом иммуноблоттинга (вестерн-блоттинг) с использованием соответствующих наборов (ARY005B, R&D Systems; ab193655, Abcam) в соответствии с протоколами производителя. Хемилюминесцентная детекция проводилась посредством цифрового сканера блоттов C-DiGit (LI-COR Biosciences) в высокочувствительном режиме (12-мин сканирование). Для иммуноблоттинга использовались антитела кролика фирмы Cusabio (Китай) к ферментам синтеза и деградации церамидов, антитела козы к бета-тубулину (контроль загрузки, ab21057, 1:1000, Abcam) и конъюгированные с пероксидазой хрена вторичные антитела козы против кролика (Anti-rabbit IgG, HRP-linked Antibody #7074, Cell Signaling Technology). Инкубация с антителами выполнялась c применением набора iBind Flex (SLF2020, Invitrogen), карточек iBind Flex (SLF2010, Invitrogen) и прибора iBind Flex Western Device (SLF2000, Invitrogen) в течение 3 ч в соответствии с протоколами производителя. Хемилюминесцентная детекция проводилась с использованием субстрата SuperSignal West Pico PLUS (34580, Thermo Scientific) и цифрового сканера блотов C-DiGit (LI-COR Biosciences) в высокочувствительном режиме (12-мин сканирование). Изображение сканировали и анализировали при помощи программ обработки изображений Empiria Studio и Image Studio.
Денситометрию выполняли с использованием программы ImageJ (National Institutes of Health) по стандартному алгоритму (последовательный выбор и графическое представление полос в виде пиков с измерением их площади и последующей поправкой на контроль загрузки (β-tubulin) и группу сравнения (пациенты с ППС).
Статистический анализ. Статистический анализ полученных результатов проводили в программе GraphPad Prism 8 (GraphPad Software). Данные представлены в виде медианы, 25-го и 75-го процентилей. Для анализа межгрупповых различий использовали непараметрические критерии. Сравнение двух независимых групп проводили с использованием U-критерия Манна-Уитни. Категориальные переменные, выраженные в процентах, сравнивали с использованием критерия хи-квадрат или точного критерия Фишера. Значения р<0,05 считались статистически значимыми.
Результаты
Экспрессия генов ферментов сфингомиелиназного пути синтеза церамидов. Получено, что в ЖТ сердечной локализации в большей степени экспрессировалась кислая SMase (aSMase) SMPD1, чем нейтральная SMPD3. При ИБС уровень мРНК SMPD1 был максимальным в подкожных (p=0,011) и эпикардиальных адипоцитах (p=0,002) (рис. 1). При пороках сердца экспрессия SMPD1 в подкожных адипоцитах была выше, чем в периваскулярных (p=0,026) (рис. 1). Экспрессия SMPD3 не различалась в зависимости от нозологии и локализации жирового депо (рис. 2).

Рис. 1. Экспрессия гена aSMase (SMPD1) в адипоцитах ЖТ сердца и сосудов пациентов с ССЗ.
Сокращения: ИБС — ишемическая болезнь сердца, ПВЖТ — периваскулярная жировая ткань, ПЖТ — подкожная жировая ткань, ЭЖТ — эпикардиальная жировая ткань.
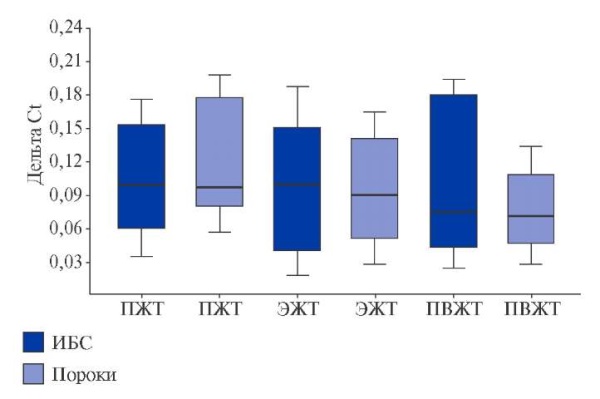
Рис. 2. Экспрессия генов нейтральной SMase (SMPD3) в адипоцитах ЖТ сердца и сосудов пациентов с ССЗ.
Сокращения: ИБС — ишемическая болезнь сердца, ПВЖТ — периваскулярная жировая ткань, ПЖТ — подкожная жировая ткань, ЭЖТ — эпикардиальная жировая ткань.
Учитывая, что экспрессия гена SMPD1 в ЭЖТ при ИБС была более выражена, чем у пациентов с пороками сердца, можно предположить, что в ЖТ данной локализации при коронарогенной патологии активируется гидролиз SM, а церамиды, синтезируемые aSMase в ЖТ, могут участвовать в атерогенезе.
Экспрессия генов ферментов деградации церамидов. Недостаток ферментов катаболизма также может приводить к накоплению церамидов в клетке, поэтому была оценена экспрессия генов ферментов деградации церамидов. Показано, что уровень мРНК ASAH1 в ЭЖТ пациентов с ИБС был максимальным относительно ЖТ других локализаций (р=0,026, р=0,034) (рис. 3). В группе ППС наблюдалась высокая экспрессия ASAH1 во всех типах ЖТ. При этом у лиц с пороками сердца уровни мРНК ASAH1 в ПЖТ (р=0,0003), ЭЖТ (р=0,037) и ПВЖТ (р=0,002) значительно превышали аналогичные показатели пациентов с ИБС (рис. 3).
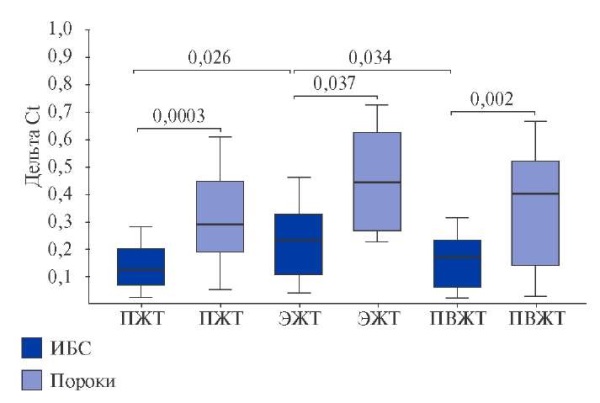
Рис. 3. Экспрессия гена кислой церамидазы (ASAH1) в ЖТ сердца и сосудов пациентов с ССЗ.
Сокращения: ИБС — ишемическая болезнь сердца, ПВЖТ — периваскулярная жировая ткань, ПЖТ — подкожная жировая ткань, ЭЖТ — эпикардиальная жировая ткань.
Церамиды являются субстратом для образования более сложного сфинголипида — SM под действием фермента SMS. У SMS существует несколько изоформ, в настоящем исследовании определяли экспрессию генов SMS1 и -2 (SGMS1 и SGMS2).
При ИБС экспрессия SGMS1 в ЭЖТ была выше, чем в ПЖТ (р=0,0013) и ПВЖТ (р=0,0011), в отличие от группы ППС (рис. 4). Генная экспрессия SGMS1 в ЭЖТ пациентов с ИБС была выше, чем у лиц с пороками сердца (р=0,0011). Уровень мРНК SGMS2 значимо превышал SGMS1 у пациентов обеих групп и был максимальным в адипоцитах ПЖТ и ПВЖТ по сравнению с ЭЖТ (р=0,0011, р=0,0011) в группе ИБС и в ПВЖТ (р=0,0011, р=0,0011) в группе ППС (рис. 5). При этом при наличии коронарогенной патологии отмечалась высокая экспрессия SGMS2 в подкожных (р=0,013) и эпикардиальных (р=0,0013) адипоцитах.
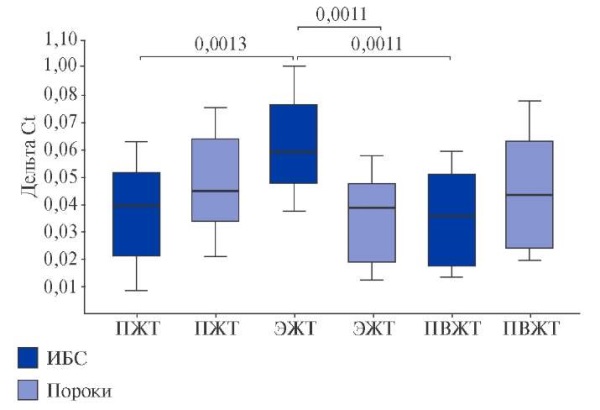
Рис. 4. Экспрессия гена SMS1 (SGMS1) в ЖТ сердца и сосудов пациентов с ССЗ.
Сокращения: ИБС — ишемическая болезнь сердца, ПВЖТ — периваскулярная жировая ткань, ПЖТ — подкожная жировая ткань, ЭЖТ — эпикардиальная жировая ткань.
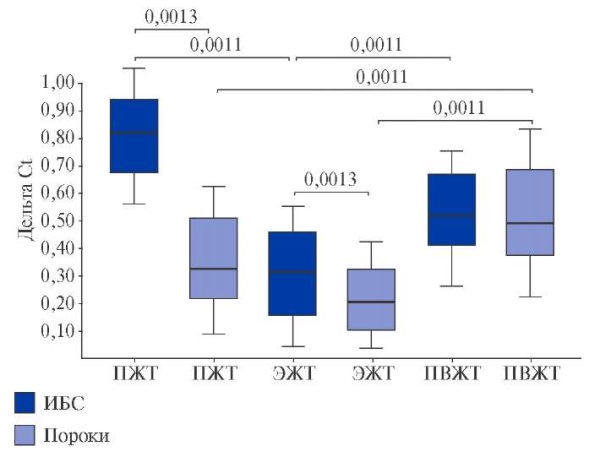
Рис. 5. Экспрессия гена SMS2 (SGMS2) в ЖТ сердца и сосудов пациентов с ССЗ.
Сокращения: ИБС — ишемическая болезнь сердца, ПВЖТ — периваскулярная жировая ткань, ПЖТ — подкожная жировая ткань, ЭЖТ — эпикардиальная жировая ткань.
Определение уровня белков, кодируемых генами ферментов сфингомиелиназного пути синтеза церамидов и их деградации в ЖТ различной локализации (ПЖТ, ЭЖТ, ПВЖТ) у пациентов с ССЗ. Для получения информации об особенностях белковой экспрессии ферментов синтеза церамидов из SM были оценены уровни aSMase1 и nSMase3 с использованием иммуноблоттинга (вестерн-блоттинг). Обнаружено, что уровни изучаемых белков статистически значимо не различались между группами. Кроме того, были изучены ферменты утилизации церамидов. У пациентов с ИБС экспрессия фермента ASAH1 значительно ниже в сравнении с пороками сердца в подкожных и эпикардиальных адипоцитах (р<0,05). Пациенты с ИБС характеризовались более высоким уровнем активности SMS1 в ЭЖТ, чем лица с пороками сердца. Экспрессия SMS2 также была значительно выше при ИБС в адипоцитах ПЖТ (р<0,05). Анализ уровня ферментов метаболизма церамидов в адипоцитах ЖТ пациентов с ССЗ показал сходную картину, полученную при изучении экспрессии генов с использованием количественной полимеразной цепной реакции (рис. 6).

Рис. 6. Изменение экспрессии ферментов метаболизма церамидов в сравнении с экспрессией белка "домашнего хозяйства" (β-Tubulin в качестве контроля внутренней загрузки) в ЖТ сердца и сосудов пациентов с ССЗ.
Примечание: A — вестерн-блоттинг, B — денситометрическое количественное определение уровня ферментов. За единицу была взята группа сравнения (пациенты с ППС). * — р<0,05 — уровень статистической значимости между двумя группами.
Сокращения: ИБС — ишемическая болезнь сердца, ПВЖТ — периваскулярная жировая ткань, ПЖТ — подкожная жировая ткань, ППС — приобретенный порок сердца, ЭЖТ — эпикардиальная жировая ткань, ASAH1 — кислая церамидаза, SMS — сфингомиелинсинтаза, aSMase — кислая сфингомиелиназа, nSMase — плазматической мембраны сфингомиелиназа.
Таким образом, коронарогенная патология ЖТ сердца (преимущественно эпикардиальной локализации) характеризуется не только повышенной экспрессией ферментов синтеза церамидов из SM, но и активацией утилизации церамидов по пути образования сфингозина, что, в свою очередь, может способствовать еще большей аккумуляции церамидов и SM, который ассоциирован с атеросклеротическими процессами.
Обсуждение
Ранее проведенные клинические и экспериментальные исследования продемонстрировали роль церамидов в развитии атеросклероза [14][15]. Недавно была показана важная роль SMase в физиологии и патофизиологии сердечно-сосудистой системы [3]. Их активация в различных типах клеток сердечно-сосудистой системы, а именно в кардиомиоцитах, эндотелиальных и гладкомышечных клетках сосудов приводит к высвобождению церамидов и других биоактивных липидов (сфингозин и сфингозин-1-фосфат), обладающих специфической сигнальной способностью. ЭЖТ и ПВЖТ, расположенные в непосредственной близости к очагу поражения, являются активными источниками церамидов и представляет собой специфический липидомный признак ИБС, демонстрируя повышенное содержание атерогенных церамидов [16].
Сфингомиелиназный путь образования церамидов протекает преимущественно в плазматической мембране, но ферменты идентифицированы в лизосомах и эндоплазматическом ретикулуме (ЭПР) [17]. Сфингомиелиназный путь образования церамидов включает в себя один субстрат — SM и единственный фермент — SMase, гидролизующий фосфодиэфирную связь SM с образованием церамида и фосфохолина [7]. Существует три основных типа SMase в соответствии с их оптимальным pH: aSMase (лизосомальная и плазматическая), нейтральная SMase ЭПР/ядра и плазматической мембраны (nSMase) и щелочная SMase (alk-SMase), присутствующая в желудочно-кишечном тракте и желчи, поэтому она в данном исследовании не оценивалась. SMase локализованы в адипоцитах, макрофагах, но экспрессия их генов (SMPD1 и SMPD3) наиболее выражена в кровеносных сосудах и внеклеточных областях, окружающих сосуды в ЖТ [3]. Показано, что ингибирование синтеза церамидов у мышей предотвращает атеросклероз и развитие сердечной недостаточности [18].
В проведенном исследовании уровень мРНК aSMase (SMPD1) в эпикардиальных адипоцитах пациентов с ИБС был выше по сравнению с адипоцитами ПЖТ, ПВЖТ и аналогичными показателями лиц с пороками сердца. В связи с чем можно предположить, что в ЖТ эпикардиальной локализации активируется сфингомиелиназный путь биосинтеза церамидов, которые могут участвовать в атерогенезе. Аналогичные данные о повышенной экспрессии SMase SMPD1 в висцеральной ЖТ относительно ПЖТ у пациентов с ожирением показали Kolak M, et al. (2012) [19].
Активаторами SMase в эндотелиальных клетках сосудов, пораженных атеросклерозом, являются ишемический/реперфузионный стресс и провоспалительные цитокины, высокий уровень которых ассоциирован с атеросклерозом (фактор некроза опухоли-α, интерлейкин-1β и интерферон-γ). В результате повышается уровень церамидов в клетках, что, вероятно, может быть реализовано и в адипоцитах ЖТ сердца и коронарных артерий [3]. Увеличение уровня мРНК провоспалительных адипоцитокинов в ЭЖТ было продемонстрировано в ранее проведенных исследованиях [8]. Усиленный биосинтез церамидов под действием aSMase может быть опосредован Toll-like рецепторами (TLR) 4. Так, активация TLR4 экзогенным С2 церамидом способствует гидролизу SM с образованием церамидов [20]. Помимо инициации воспаления нами было выявлено увеличение размеров ЭЖТ у пациентов с ИБС, что при дислипидемии может вызывать локальную гипоксию и активацию факторов, индуцируемых гипоксией, таких как HIFs [8]. Показано, что HIF-1α в адипоцитах повышает экспрессию SMase, стимулируя образование церамидов из SM, ассоциированных с развитием и прогрессированием атеросклероза [21].
Активность aSMase, который является геном "домашнего хозяйства" в лизосомах, обнаруживается во всех тканях сердца крыс, мышей и людей. Экспериментально показано, что применение ингибитора аSMase перед ишемическим повреждением снижает индуцированную ишемией гибель клеток [22]. У мышей, крыс и кроликов продемонстрировано увеличение уровня церамидов при ишемии/реперфузии, aSMase и nSMase в зоне ИМ, а у пациентов с острым коронарным синдромом выявлена связь с дестабилизацией атеросклеротических бляшек [23].
Для подержания клеточного гомеостаза и функциональной активности клетки, в т.ч. адипоцита, необходим баланс ферментов синтеза и утилизации церамидов. Дефицит ферментов катаболизма может приводить к накоплению церамидов в клетке. Усиление деградации церамидов обладает благоприятными кардиометаболическими эффектами, что важно для профилактики и лечения ССЗ [4][24]. Поэтому нами было проведено изучение уровня ферментов катаболизма церамидов.
Согласно полученным результатам, при ИБС максимальный уровень мРНК ASAH1 наблюдался в ЭЖТ, в то время как при ППС экспрессия ASAH1 была значимо выше в ЭЖТ и ПВЖТ. В лизосомах активность ASAH1 зависит от небольшого белка, сапозина D [25]. Дефицит сапозина D вызывает накопление церамидов в тканях, т.е. сапозин D является положительным модулятором ASAH1. Учитывая, что экспрессия церамидазы в адипоцитах ЖТ сердца и сосудов пациентов с пороками сердца значительно превышала таковую лиц с ИБС, можно высказать предположение, что при некоронарогенной патологии сердца наблюдается не только активация ферментов синтеза церамидов, но и ферментов утилизации, например, лизосомальной церамидазы. Лизосомальная церамидаза деацилирует церамиды, образующиеся при деградации сфинголипидов плазматической мембраны. ASAH1 гидролизует в основном ненасыщенные коротко- и длинноцепочечные церамиды [26]. Несмотря на сниженную по сравнению с ППС экспрессию ASAH1, этот путь катаболизма церамидов реализуется и в ЭЖТ пациентов с ИБС. Таким образом, фермент наилучшим образом работает в ЖТ пациентов с пороками сердца. Высокая экспрессия фермента кислой церамидазы в ЭЖТ лиц с коронарогенной патологией может свидетельствовать о том, что церамиды, накапливаемые в результате сфингомиелиназного пути в ЭЖТ, утилизируются за счет активности фермента кислой церамидазы. Образующийся сфингозин может фосфорилироваться сфингозинкиназой в сфингозин-1-фосфат, обладающий свойствами, противоположными церамидам. В то же время сфингозин является субстратом для CERS и может повторно включаться в биосинтез церамидов de novo [27].
Церамиды являются субстратом для образования SM, который обнаруживается в атеросклеротических бляшках людей [2]. SМ является основным сфинголипидом в атерогенных апоВ-содержащих липопротеинах, таких как липопротеиды очень низкой плотности, липопротеиды низкой плотности (ЛНП) и хиломикроны. При этом ЛНП бляшек содержат намного больше SM, чем ЛНП плазмы [28]. Показано, что содержание SM в стенке аорты и в плазме ассоциировано с атеросклерозом, поскольку SM накапливается в атеромах людей. Плазменный уровень SM считается независимым фактором риска ИБС и ассоциирован с риском развития ИМ [29]. Имеются сведения, что содержание SM в атеросклеротических бляшках гораздо больше, чем ЛНП плазмы. Сочетание дефицита SMS1+2 с нокаутом ApoE или рецептора ЛНП уменьшает атеросклеротические проявления [28].
Синтез SM в клетках протекает при участии фермента SMS, имеющей несколько изоформ: SMS1 локализована в аппарате Гольджи, SMS2 — преимущественно в плазматической мембране. Церамиды, образуемые в ЭПР, посредством везикулярного и невезикулярного транспорта переносятся в аппарат Гольджи, где метаболизируются в сложные сфинголипиды, в т.ч. в SM [26].
Согласно полученным нами данным, высокая экспрессия SMS1 в ЭЖТ пациентов с ИБС сочеталась с максимальной экспрессией SMS2 в ПЖТ и ПВЖТ, превышающими аналогичные показатели лиц с ППС. Вероятно, при коронарогенной патологии активированы пути синтеза SM не только внутри адипоцита, но и в большей степени в плазматической мембране адипоцита.
Ограничения исследования. Исследование имеет определенные ограничения. Во-первых, это одноцентровое исследование, во-вторых, размер выборки небольшой. В-третьих, необходимо липидомное профилирование жировых депо сердца и коронарных сосудов больных с ССЗ, что является частью плана дальнейшей работы.
Заключение
Таким образом, при коронарогенной патологии в ЖТ сердца (преимущественно эпикардиальной локализации) отмечается усиление экспрессии ферментов синтеза церамидов по сфингомиелиназмому пути. Эти изменения могут способствовать аккумуляции церамидов, запуская многие патологические процессы, ассоциированные с атеросклерозом. Наблюдаемое увеличение экспрессии генов ферментов может быть обусловлено рядом причин: избыток жирных кислот, гипоксия, воспаление, активация TLR4-рецепторов на адипоцитах. Кроме повышенной экспрессии ферментов биосинтеза церамидов, в ЭЖТ пациентов с ИБС выявлено увеличение уровня мРНК ферментов катаболизма церамидов. Регуляция метаболизма за счет экспрессии ферментов их синтеза и распада представляет собой привлекательную терапевтическую стратегию уменьшения уровня церамидов в плазме и периферических тканях, в т.ч. в сердце и сосудах, и имеет огромные перспективы для лечения широкого спектра сердечно-сосудистых патологий.
Отношения и деятельность. Исследование выполнено за счет гранта Российского научного фонда № 22-15-20007 "Церамидный профиль локальных жировых депо сердца: клинико-патогенетическое значение и терапевтический потенциал" https://rscf.ru/project/22-15-20007/ и средств Министерства науки и высшего образования Кузбасса.
Список литературы
1. Брель Н. К., Груздева О. В., Коков А. Н. и др. Взаимосвязь кальциноза коронарных артерий и локальных жировых депо у пациентов с ишемической болезнью сердца. Комплексные проблемы сердечно-сосудистых заболеваний. 2022;11(3):51-63. doi:10.17802/2306-1278-2022-11-3-51-6.
2. Zietzer A, Düsing P, Reese L, et al. Ceramide Metabolism in Cardiovascular Disease: A Network With High Therapeutic Potential. Arterioscler Thromb Vasc Biol. 2022;42(10). doi:10.1161/ATVBAHA.122.318048.
3. Pavoine C, Pecker F. Sphingomyelinases: their regulation and roles in cardiovascular pathophysiology. Cardiovasc Res. 2009;82(2):175-83. doi:10.1093/cvr/cvp030.
4. Shu H, Peng Y, Hang W, et al. Emerging Roles of Ceramide in Cardiovascular Diseases. Aging Dis. 2022;13(1):232-45. doi:10.14336/AD.2021.0710.
5. Груздева О. В., Дылева Ю. А., Белик Е. В. и др. Сравнительная оценка экспрессии ферментов пути синтеза церамидов de novo в жировой ткани сердца и сосудов пациентов с сердечно-сосудистыми заболеваниями. Российский кардиологический журнал. 2022;27(12):5281. doi:10.15829/1560-4071-2022-5281.
6. Tippetts TS, Holland WL, Summers SA. Cholesterol — the devil you know; ceramide — the devil you don’t. Trends Pharmacol Sci. 2021;42(12):1082-95. doi:10.1016/j.tips.2021.10.001.
7. Ying L, Tippetts TS, Chaurasia B. Ceramide dependent lipotoxicity in metabolic diseases. Nutrition and Healthy Aging. 2019;5(1):1-12. doi:10.3233/NHA-170032.
8. Gruzdeva OV, Dyleva YA, Belik EV, et al. Relationship between Epicardial and Coronary Adipose Tissue and the Expression of Adiponectin, Leptin, and Interleukin 6 in Patients with Coronary Artery Disease. J Pers Med. 2022;12(2):129. doi:10.3390/jpm12020129.
9. Iacobellis G. Epicardial adipose tissue in contemporary cardiology. Nat Rev Cardiol. 2022;19(9):593-606. doi:10.1038/s41569-022-00679-9.
10. Chaurasia B, Tippetts TS, Monibas RM, et al. Targeting a ceramide double bond improves insulin resistance and hepatic steatosis. Science. 2019;365:386-92. doi:10.1126/science.aav3722.
11. Hadas Y, Vincek AS, Youssef E, et al. Altering Sphingolipid Metabolism Attenuates Cell Death and Inflammatory Response After Myocardial Infarction. Circulation. 2020;141:91630. doi:10.1161/CIRCULATIONAHA.119.041882.
12. Yu Z, Peng Q, Huang Y. Potential therapeutic targets for atherosclerosis in sphingolipid metabolism. Clin Sci (Lond). 2019;133(6):763-76. doi:10.1042/CS20180911.
13. van Eijk M, Aten J, Bijl N, et al. Reducing glycosphingolipid content in adipose tissue of obese mice restores insulin sensitivity, adipogenesis and reduces inflammation. PLoS One. 2009;4(3):e4723. doi:10.1371/journal.pone.0004723.
14. Hammerschmidt P, Brüning JC. Contribution of specific ceramides to obesity-associated metabolic diseases. Cell Mol Life Sci. 2022;79(8):395. doi:10.1007/s00018-022-04401-3.
15. Park TS, Panek RL, Rekhter MD, et al. Modulation of lipoprotein metabolism by inhibition of sphingomyelin synthesis in ApoE knockout mice. Atherosclerosis. 2006;189(2):264-72. doi:10.1016/j.atherosclerosis.2005.12.029.
16. Barchuk M, Ancel P, Miksztowicz V, et al. Epicardial Adipose Tissue Ceramides Are Related to Lipoprotein Lipase Activity in Coronary Artery Disease: Unfolding a Missing Link. Arterioscler Thromb Vasc Biol. 2022;42(8):e242-e251. doi:10.1161/ATVBAHA.122.317840.
17. Hussain MM, Jin W, Jiang XC. Mechanisms involved in cellular ceramide homeostasis. Nutr Metab (Lond). 2012;9(1):71. doi:10.1186/1743-7075-9-71.
18. Park T-S, Rosebury W, Kindt EK, et al. Serine palmitoyltransferase inhibitor myriocin induces the regression of atherosclerotic plaques in hyperlipidemic ApoE-deficient mice. Pharmacol Res. 2008;58:45-51. doi:10.1016/j.phrs.2008.06.005.
19. Kolak M, Gertow J, Westerbacka J, et al. Expression of ceramide-metabolising enzymes in subcutaneous and intra-abdominal human adipose tissue. Lipids Health Dis. 2012;11:115. doi:10.1186/1476-511X-11-115.
20. Cuschieri J, Bulger E, Billgrin J, et al. Acid sphingomyelinase is required for lipid Raft TLR4 complex formation. Surg Infect (Larchmt). 2007;8(1):91-106. doi:10.1089/sur.2006.050.
21. Wang P, Zeng G, Yan Y, et al. Disruption of adipocyte HIF-1α improves atherosclerosis through the inhibition of ceramide generation. Acta Pharm Sin B. 2022;12(4):1899-912. doi:10.1016/j.apsb.2021.10.001.
22. Argaud L, Prigent AF, Chalabreysse L, et al. Ceramide in the antiapoptotic effect of ischemic preconditioning. Am J Physiol Heart Circ Physiol. 2004;286(1):H246-51. doi:10.1152/ajpheart.00638.2003.
23. Pan W, Yu J, Shi R, et al. Elevation of ceramide and activation of secretory acid sphingomyelinase in patients with acute coronary syndromes. Coron Artery Dis. 2014;25(3):230-5. doi:10.1097/MCA.0000000000000079.
24. Li Y, Talbot CL, Chaurasia B. Ceramides in Adipose Tissue. Front Endocrinol (Lausanne). 2020;11:407. doi:10.3389/fendo.2020.00407.
25. Parveen F, Bender D, Law SH, et al. Role of Ceramidases in Sphingolipid Metabolism and Human Diseases. Cells. 2019;8(12):1573. doi:10.3390/cells8121573.
26. Gault CR, Obeid LM, Hannun YA. An overview of sphingolipid metabolism: from synthesis to breakdown. Adv Exp Med Biol. 2010;688:1-23. doi:10.1007/978-1-4419-6741-1_1.
27. Choi RH, Tatum SM, Symons JD, et al. Ceramides and other sphingolipids as drivers of cardiovascular disease. Nat Rev Cardiol. 2021;18(10):701-11. doi:10.1038/s41569021-00536-1.
28. Li Z, Chiang YP, He M, et al. Effect of liver total sphingomyelin synthase deficiency on plasma lipid metabolism. Biochim Biophys Acta Mol Cell Biol Lipids. 2021;1866(5):158898. doi:10.1016/j.bbalip.2021.158898.
29. Park JY, Lee SH, Shin MJ, et al. Alteration in metabolic signature and lipid metabolism in patients with angina pectoris and myocardial infarction. PLoS One. 2015;10(8):e0135228. doi:10.1371/journal.pone.0135228.
Об авторах
О. В. ГруздеваРоссия
Груздева Ольга Викторовна — доктор медицинских наук, доцент, профессор РАН, заведующий лабораторией исследований гомеостаза отдела экспериментальной медицины
Кемерово
Конфликт интересов:
Конфликт интересов не заявляется
Е. В. Белик
Россия
Белик Екатерина Владимировна — кандидат медицинских наук, н.с. лаборатории исследований гомеостаза отдела экспериментальной медицины
Кемерово
Конфликт интересов:
Конфликт интересов не заявляется
Ю. А. Дылева
Россия
Дылева Юлия Александровна — кандидат медицинских наук, старший научный сотрудник лаборатории исследований гомеостаза отдела экспериментальной медицины
Кемерово
Конфликт интересов:
Конфликт интересов не заявляется
Е. Г. Учасова
Россия
Учасова Евгения Геннадьевна — кандидат медицинских наук, старший научный сотрудник лаборатории исследований гомеостаза отдела экспериментальной медицины
Кемерово
Конфликт интересов:
Конфликт интересов не заявляется
А. В. Понасенко
Россия
Понасенко Анастасия Валериевна — кандидат медицинских наук, заведующая лабораторией геномной медицины отдела экспериментальной медицины
Кемерово
Конфликт интересов:
Конфликт интересов не заявляется
А. Г. Кутихин
Россия
Кутихин Антон Геннадьевич — доктор медицинских наук, заведующий лабораторией молекулярной, трансляционной и цифровой медицины
Кемерово
Конфликт интересов:
Конфликт интересов не заявляется
В. Е. Маркова
Россия
Маркова Виктория Евгеньевна — младший научный сотрудник лаборатории молекулярной, трансляционной и цифровой медицины
Кемерово
Конфликт интересов:
Конфликт интересов не заявляется
Е. Е. Горбатовская
Россия
Горбатовская Евгения Евгеньевна — лаборант-исследователь лаборатории исследований гомеостаза отдела экспериментальной медицины
Кемерово
Конфликт интересов:
Конфликт интересов не заявляется
Е. В. Фанаскова
Россия
Фанаскова Елена Викторовна — кандидат медицинских наук, заведующий трансфузиологическим кабинетом
Кемерово
Конфликт интересов:
Конфликт интересов не заявляется
С. В. Иванов
Россия
Иванов Сергей Васильевич — доктор медицинских наук, ведущий научный сотрудник лаборатории реконструктивной хирургии мультифокального атеросклероза
Кемерово
Конфликт интересов:
Конфликт интересов не заявляется
А. Н. Стасев
Россия
Стасев Александр Николаевич — кандидат медицинских наук, н.с. лаборатории пороков сердца
Кемерово
Конфликт интересов:
Конфликт интересов не заявляется
М. Г Зинец
Россия
Зинец Максим Григорьевич — врач-кардиохирург отделения кардиохирургии, лаборатория рентгенэндоваскулярной и реконструктивной хирургии сердца и сосудов
Кемерово
Конфликт интересов:
Конфликт интересов не заявляется
Т. А. Cлесарева
Россия
Cлесарева Тамара Александровна — врач клинической лабораторной диагностики
Кемерово
Конфликт интересов:
Конфликт интересов не заявляется
О. Л. Барбараш
Россия
Барбараш Ольга Леонидовна — доктор медицинских наук, профессор, академик РАН, директор
Кемерово
Конфликт интересов:
Конфликт интересов не заявляется
Дополнительные файлы
Рецензия
Для цитирования:
Груздева О.В., Белик Е.В., Дылева Ю.А., Учасова Е.Г., Понасенко А.В., Кутихин А.Г., Маркова В.Е., Горбатовская Е.Е., Фанаскова Е.В., Иванов С.В., Стасев А.Н., Зинец М.Г., Cлесарева Т.А., Барбараш О.Л. Особенности экспрессии ферментов метаболизма церамидов в жировых депо различной локализации при сердечно-сосудистых заболеваниях. Российский кардиологический журнал. 2023;28(4):5390. https://doi.org/10.15829/1560-4071-2023-5390
For citation:
Gruzdeva O.V., Belik E.V., Dyleva Yu.A., Uchasova E.G., Ponasenko A.V., Kutikhin A.G., Markova V.E., Gorbatovskaya E.E., Fanaskova E.V., Ivanov S.V., Stasev A.N., Zinets M.G., Slesareva T.A., Barbarash O.L. Gene expression of ceramide metabolism enzymes in fat depots of different localization in cardiovascular diseases. Russian Journal of Cardiology. 2023;28(4):5390. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5390
JATS XML

















































