Перейти к:
Нарушения биомеханики восходящего отдела аорты при пограничном расширении и аневризме
https://doi.org/10.15829/1560-4071-2023-5365
Аннотация
Цель. Сравнительный анализ нарушений биомеханики восходящего отдела аорты (ВА) при пограничном расширении и аневризме с помощью посегментной ультразвуковой оценки деформационных характеристик аортальной стенки.
Материал и методы. Обследованы 15 больных с пограничным расширением (40-49 мм) ВА и 17 больных с аневризмой (≥50 мм) ВА. Контрольную группу составили 11 здоровых добровольцев (ВА <40 мм). Всем обследованным выполнена 2D мультиплановая чреспищеводная эхокардиография с визуализацией грудного отдела аорты (ГА) на всем протяжении. С помощью технологии 2D speckle-tracking рассчитывали глобальный пиковый систолический циркумференциальный стрейн (GCS, %), GCS, нормализованный к пульсовому артериальному давлению (ПАД) (GCS/ПАД) и β2 индекс жесткости аортальной стенки на четырёх уровнях ГА: синусы Вальсальвы, синотубулярное соединение, средний сегмент ВА и нисходящая аорта.
Результаты. У лиц контрольной группы при диаметре ГА 26,6 мм (25,2; 28,4) выявлена однонаправленная равномерная деформация GCS 9,7% (8,4; 11,7), GCS/ПАД 18,4 (14,9; 20,6) и равномерная жесткость β2 5,9 (4,8; 6,7) аортальной стенки во всех сегментах ГА. У больных с пограничным расширением и аневризмой ВА происходило пропорционально значимое снижение показателей деформации вплоть до отрицательных значений и увеличение жесткости аортальной стенки по направлению от фиброзного кольца аортального клапана к нисходящему отделу ГА с максимумом в зоне наибольшей дилатации. Показатели деформации и жесткости аортальной стенки во всех сегментах ГА у больных с пограничным расширением и аневризмой ВА не различались (p>0,05). Диаметр ВА в зоне максимальной дилатации у больных с аневризмой был статистически значимо выше, чем у больных с пограничным расширением, составляя 52 мм (51; 55) и 47 мм (45; 48), p<0,001, соответственно. Выявлена обратная корреляция между диаметром ВА в зоне максимальной дилатации и показателями деформации (GCS: r=-0,61; p<0,001 и GCS/ПАД: r=-0,62; p<0,001) и прямая корреляция с β2 индексом жесткости аортальной стенки (r=0,56; p<0,05).
Заключение. Оценка биомеханики стенки аорты наряду с диаметром ВА имеет самостоятельное диагностическое значение при выборе индивидуальной хирургической стратегии у больных с пограничным расширением и аневризмой ВА.
Ключевые слова
Для цитирования:
Врублевский А.В., Панфилов Д.С., Козлов Б.Н., Саушкин В.В., Сазонова С.И. Нарушения биомеханики восходящего отдела аорты при пограничном расширении и аневризме. Российский кардиологический журнал. 2023;28(5):5365. https://doi.org/10.15829/1560-4071-2023-5365
For citation:
Vrublevsky A.V., Panfilov D.S., Kozlov B.N., Saushkin V.V., Sazonova S.I. Disturbances of the ascending aorta biomechanics in moderate dilatation and aneurysm. Russian Journal of Cardiology. 2023;28(5):5365. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5365
Острое расслоение и разрыв аортальной стенки часто являются фатальными осложнениями, профилактика которых возможна только при своевременном хирургическом вмешательстве. В настоящее время во всех клинических руководствах и рекомендациях в качестве критерия принятия решения о резекции аневризмы используется диаметр восходящей аорты (ВА), превышающий 5,5 см [1][2]. В то же время следует отметить, что аневризмы с диаметром, превышающим этот хирургический порог, могут длительно оставаться стабильными, и наоборот, при диаметре дилатированной ВА <4,5 см известны случаи разрыва аортальной стенки, частота которых, по данным литературы, составляет ~40% [3-5]. В связи с этим, по мнению многих исследователей, необходим поиск новых дополнительных критериев для выявления больных, подверженных риску расслоения или разрыва аортальной стенки [4-8].
Аневризма ВА — это постоянно эволюционирующая структура, т.к. и геометрия, и свойства ткани аортальной стенки изменяются по мере роста аневризмы. Гистологические исследования показали, что аневризмы ВА возникают в результате патологического ремоделирования стенки сосуда, при котором наиболее часто происходит активация матриксных металлопротеиназ, истончение и фрагментация эластических пластин, апоптоз гладкомышечных клеток, отложение коллагена и накопление внеклеточных гликозаминогликанов [3][5]. Тканевое ремоделирование прогрессирует с увеличением диаметра аорты и изменяет биомеханические свойства аортальной стенки, приводя к утрате эластико-тонических свойств и повышению жесткости [3][5][6][8]. Разрыв и расслоение аорты происходят в результате полной утраты механической прочности аортальной стенки [3][5]. Ряд исследователей считают, что нарушение биомеханики стенки аорты, в частности, способности к деформации, может быть информативным маркером её гистологической целостности [3-8]. Согласно их мнению, биомеханические характеристики аортальной стенки могут являться более чувствительным показателем риска аорто-ассоциированных осложнений, чем только размер аорты [3-8].
Длительный период времени основным ограничением для использования показателей биомеханики в прогнозировании риска аорто-ассоциированных осложнений аневризм ВА являлось отсутствие неинвазивного метода измерения биомеханических свойств стенки аорты in vivo. В последние годы наблюдается интерес к оценке биомеханики стенки ВА в клинических условиях благодаря внедрению новой технологии 2D (двухмерной) speckle-tracking чреспищеводной эхокардиографии (ЧПЭхоКГ), позволяющей рассчитывать циркумференциальный стрейн ткани (деформацию по окружности) [8][9]. Speckle-tracking ("след пятна") — это эхокардиографический метод визуализации, который позволяет измерять движение миокарда, используя естественные спекл-паттерны в ткани, создаваемые ультразвуковым лучом во время серошкальной визуализации сердца. Движение спеклов во время систолы и диастолы позволяет рассчитать деформацию миокарда в продольном, радиальном и циркумференциальном направлениях. Для оценки глобальной деформации по окружности сосудистой стенки была экстраполирована ультразвуковая модель оценки циркумференциального и радиального стрейна миокарда левого желудочка (ЛЖ) по короткой оси, которая хорошо изучена и апробирована в клинических условиях в течение длительного времени [10]. Кроме того, в экспериментальном исследовании Petrini J, et al. [11] получены данные о высокой точности 2D speckle-tracking ЧПЭхоКГ в количественной оценке деформационных характеристик аортальной стенки при сравнении с сономикрометрией.
Суммируя вышеизложенное, мы предположили, что 2D ЧПЭхоКГ с использованием технологии speckle-tracking может быть использована для оценки циркумференциального стрейна стенки ВА во время сердечного цикла. Вероятно, это исследование будет первым шагом к определению возможности использования показателей деформации аортальной стенки, полученных при эхокардиографическом отслеживании спеклов, в качестве дополнительного критерия при стратификации риска осложнений у больных с аневризмами ВА и принятии решения о необходимости хирургического лечения.
Целью исследования являлся сравнительный анализ нарушений биомеханики восходящего отдела аорты при пограничном расширении и аневризме с помощью посегментной ультразвуковой оценки деформационных характеристик аортальной стенки.
Материал и методы
В исследование включено 43 человека (28 мужчин и 15 женщин): 1 группа — 11 здоровых добровольцев, все мужчины (средний возраст 39 (37; 47) лет, диаметр ВА <40 мм), у которых при обследовании не выявлено факторов риска и признаков сердечно-сосудистых заболеваний; 2 группа — 15 больных с пограничным расширением ВА (средний возраст 62 (57; 69) лет, диаметр ВА 40-49 мм) и 3 группа — 17 больных с аневризмой ВА без признаков расслоения аортальной стенки (средний возраст 67 (60; 72) лет, диаметр ВА ≥50 мм). Клиническая характеристика больных представлена в таблице 1.
Мультиплановая 2D ЧПЭхоКГ выполнена в соответствии со стандартами надлежащей клинической практики, принципами Хельсинкской декларации и одобрена комитетом по биомедицинской этике (протокол № 213 от 12.05.2021г). Все больные и лица контрольной группы дали письменное информированное согласие на участие в исследовании. Критериями исключения являлись абсолютные противопоказания к выполнению ЧПЭхоКГ, фибрилляция предсердий, частая экстрасистолия, стеноз аортального клапана, аортальная регургитация >2 степени, кардиомиопатии, фракция выброса ЛЖ <50% и отказ больного от исследования.
Мультиплановую 2D ЧПЭхоКГ выполняли натощак на ультразвуковой диагностической системе экспертного класса Epiq 7G (Philips) с помощью матричного чреспищеводного датчика X8-2t. Интубацию пищевода осуществляли в положении пациента лежа на левом боку после местной анестезии слизистой ротоглотки (лидокаин 10%, спрей). Визуализировали восходящий отдел, доступные для локации участки дуги и весь нисходящий отдел грудной аорты (ГА) в продольном и поперечном сечениях по стандартному протоколу, применяя технологию сканирования xPlane [12]. Оценивали анатомическое строение аортального клапана и степень (1-4) аортальной регургитации. В импульсно-волновом допплеровском режиме регистрировали кровоток в выносящем тракте ЛЖ. Ход исследования записывали в виде серии видеоклипов на жесткий диск прибора с последующей off-line обработкой на рабочей станции QLab, версия 15.5 (Philips). Во время исследования синхронно регистрировали электрокардиограмму во II модифицированном отведении и измеряли систолическое артериальное давление (АД) (САД, мм рт.ст.) и диастолическое АД (ДАД, мм рт.ст.) на правом плече осциллометрическим методом автоматическим сфигмоманометром M2 Basic (Omron). Пульсовое АД (ПАД, мм рт.ст.) рассчитывали как ПАД = САД — ДАД.
Для выполнения 2D speckle-tracking исследования получали четкие серошкальные поперечные срезы ВА на уровне синусов Вальсальвы, синотубулярного соединения, бифуркации легочной артерии, а также поперечный срез нисходящего отдела ГА в стандартной точке на глубине 25-30 см от резцов. Все ультразвуковые срезы ГА получены на оптимальной частоте кадров (55-60 Гц), имели четкие контуры комплекса интима-медия и адвентиции и были записаны вне зоны атеросклеротических бляшек.
Измеряли диаметр (мм) ВА на уровне фиброзного кольца аортального клапана, синусов Вальсальвы, синотубулярного соединения, бифуркации легочной артерии и нисходящей аорты в проксимальном сегменте, который индексировали к площади поверхности тела. Рассчитывали глобальный пиковый систолический циркумференциальный стрейн Лагранжа (Global circumference strain, GCS, %) в ВА на уровне фиброзного кольца аортального клапана, синотубулярного соединения, бифуркации легочной артерии и в проксимальном сегменте нисходящей аорты, применяя апробированную модель для ЛЖ по короткой оси (рис. 1). При этом выполнялась максимально точная трассировка внутреннего контура зоны интереса по поверхности комплекса интима-медия, а внешнего контура — по наружной границе адвентиции. Согласно данной модели, поперечный срез аорты делился на 6 условных сегментов, в каждом из которых программный модуль рассчитывал локальный стрейн с последующей суммацией и предоставлением информации о глобальном стрейне по всей окружности. Допплерографически рассчитанное время закрытия аортального клапана по спектру кровотока в выносящем тракте ЛЖ выставляли в программе вручную. Программное обеспечение автоматически рассчитывало время достижения пикового систолического циркумференциального стрейна (Time to peak, TTP, мс) и изменение площади поперечного сечения аорты (Fraction area change, FAC, %) в течение сердечного цикла. Затем рассчитывали GCS, нормализованный к ПАД (GCS/ПАД∙100), и индекс жесткости β2 аортальной стенки, предложенный Oishi Y, et al. [13], по формуле: ln(САД/ДАД)/GCS∙100.
Статистическую обработку полученных данных выполняли с помощью пакета прикладных программ STATISTICA, версия 10.0 (StatSoft Inc.). Вид распределения выборки оценивали с помощью критерия Шапиро-Уилка. Учитывая отсутствие нормального распределения выборки, данные представляли как медиана и квартили — Me [Q1; Q3]. Для оценки межгрупповых различий применяли критерий Краскела-Уоллиса. Апостериорные попарные групповые сравнения проводили с помощью критерия Данна с поправкой Холма. Взаимосвязь между диаметром ВА в зоне максимальной дилатации с показателями глобального циркумференциального стрейна и жесткости аортальной стенки оценивали с помощью корреляционного анализа, который проводился путем расчета коэффициентов корреляции Спирмена. Различия считали статистически значимыми при p<0,05.
Результаты
У здоровых добровольцев (группа 1) не выявлено отклонений от нормальных значений размеров ГА на всем протяжении и наблюдался однонаправленный равномерный циркумференциальный стрейн аортальной стенки во всех сегментах, составляя 9,7% (8,4; 11,7) и 18,4 (14,9; 20,6) при нормализации показателя к уровню ПАД (табл. 2). Также у здоровых лиц наблюдалось равномерное изменение площади поперечного сечения всех сегментов ГА на протяжении сердечного цикла и более низкий показатель жесткости аортальной стенки при сравнении с больными с пограничным расширением (группа 2) и аневризмой ВА (группа 3), соответственно.
Из 32 обследованных больных с дилатацией и аневризмой ВА у 8 (25%) основным диагнозом была дисплазия соединительной ткани, у 18 (56%) — ишемическая болезнь сердца, у 6 (19%) — гипертоническая болезнь. Установлено, что у больных в группах 2 и 3 показатели деформации (GCS, GCS/ПАД) аортальной стенки и изменения площади поперечного сечения (FAC) в зоне максимальной дилатации ВА были статистически значимо ниже, чем у здоровых добровольцев (табл. 2). Аналогичная тенденция наблюдалась при межгрупповом сравнении показателей деформации аортальной стенки и изменения площади поперечного сечения в нисходящем отделе ГА и их средних значений по всем сегментам ГА. При внутригрупповом анализе у 3 (21%) больных группы 2 и у 7 (41%) больных группы 3 выявлен отрицательный GCS аортальной стенки в зоне максимальной дилатации ВА, а у 2 (6%) больных отрицательный GCS аортальной стенки наблюдался и в нисходящем отделе ГА. Следует отметить, что больные в группах 2 и 3 демонстрировали скачкообразное понижение деформационных характеристик стенки аорты по направлению от фиброзного кольца аортального клапана с максимумом в зоне наибольшего расширения, включая и умеренно дилатированный нисходящий отдел ГА. Статистически значимого различия между показателями деформации и жесткости аортальной стенки во всех сегментах ГА в группах 2 и 3 не выявлено. При этом диаметр в зоне максимальной дилатации ВА у больных группы 3 был статистически значимо выше, чем в группе 2. Проведенный корреляционный анализ выявил статистически значимую обратную взаимосвязь между диаметром ВА в зоне максимальной дилатации и показателями деформации аортальной стенки, составившую для GCS: r= -0,61; p<0,001 и GCS/ПАД: r=-0,62; p<0,001, соответственно, и прямую взаимосвязь с индексом жесткости β2 аортальной стенки (r=0,56; p<0,05).
Таблица 1
Клиническая характеристика обследованных больных
|
Показатель |
Пограничное расширение восходящей аорты |
Аневризма восходящей аорты |
|
Объем выборки, (n) |
15 |
17 |
|
Мужчины, (n, %) |
12 (80) |
5 (29) |
|
Женщины, (n, %) |
3 (20) |
12 (71) |
|
Средний возраст, годы |
62 (57; 69) |
67 (60; 72) |
|
Дисплазия соединительной ткани, (n, %) |
2 (13) |
6 (35) |
|
Ишемическая болезнь сердца, (n, %) |
8 (53) |
10 (59) |
|
Постинфарктный кардиосклероз, (n, %) |
2 (13) |
2 (12) |
|
Стентирование коронарных артерий в анамнезе, (n, ٪) |
5 (33) |
1 (6) |
|
Шунтирование коронарных артерий в анамнезе, (n, ٪) |
3 (20) |
– |
|
Артериальная гипертензия (АД >140/90 мм рт.ст.), (n, %) |
15 (100) |
15 (88) |
|
Инсульт или транзиторная ишемическая атака в анамнезе, (n, ٪) |
1 (7) |
2 (12) |
|
Хроническая болезнь почек, 3-5 стадия (клиренс креатинина <60 мл/мин/м2), (n, %) |
1 (7) |
5 (29) |
|
Ожирение (ИМТ ≥30 кг/м2), (n, %) |
5 (33) |
4 (23) |
|
Сахарный диабет, тип 2 или нарушение толерантности к глюкозе, (n, ٪) |
1 (7) |
3 (17) |
|
Курение, (n, %) |
10 (66) |
5 (29) |
|
Дислипидемия, (n, %) |
13 (86) |
5 (29) |
|
Атеросклеротические бляшки в грудном отделе аорты: высота <3 мм (n, %) высота >3 мм (n, %) |
6 (40) 7 (46) |
10 (59) 2 (12) |
|
Стенозы сонных артерий <50% (n, %) |
13 (86) |
7 (41) |
|
Стенозы сонных артерий ≥50٪ (n, %) |
– |
1 (6) |
|
Стенозы бедренных артерий <50% (n, %) |
9 (60) |
6 (35) |
|
Стенозы бедренных артерий ≥50٪ (n, %) |
1 (7) |
– |
|
Диаметр восходящей аорты в зоне максимальной дилатации, мм |
47 (45; 48) |
52 (51; 55) |
|
Аортальный клапан: двухстворчатый, (n, %) трехстворчатый, (n, %) |
3 (20) 12 (80) |
6 (35) 11 (65) |
|
Трансаортальный градиент давления: пиковый, мм рт.ст. средний, мм рт.ст. |
8 (7; 12) 4 (4; 6) |
15 (11; 18) 8 (5; 10) |
|
Аортальная регургитация: степень 0, (n, ٪) степень 1, (n, ٪) степень 2, (n, ٪) |
3 (20) 9 (60) 3 (20) |
3 (17) 9 (53) 5 (29) |
|
Фракция выброса левого желудочка, ٪ |
62 (60; 64) |
65 (61; 68) |
Сокращения: АД — артериальное давление, ИМТ — индекс массы тела.
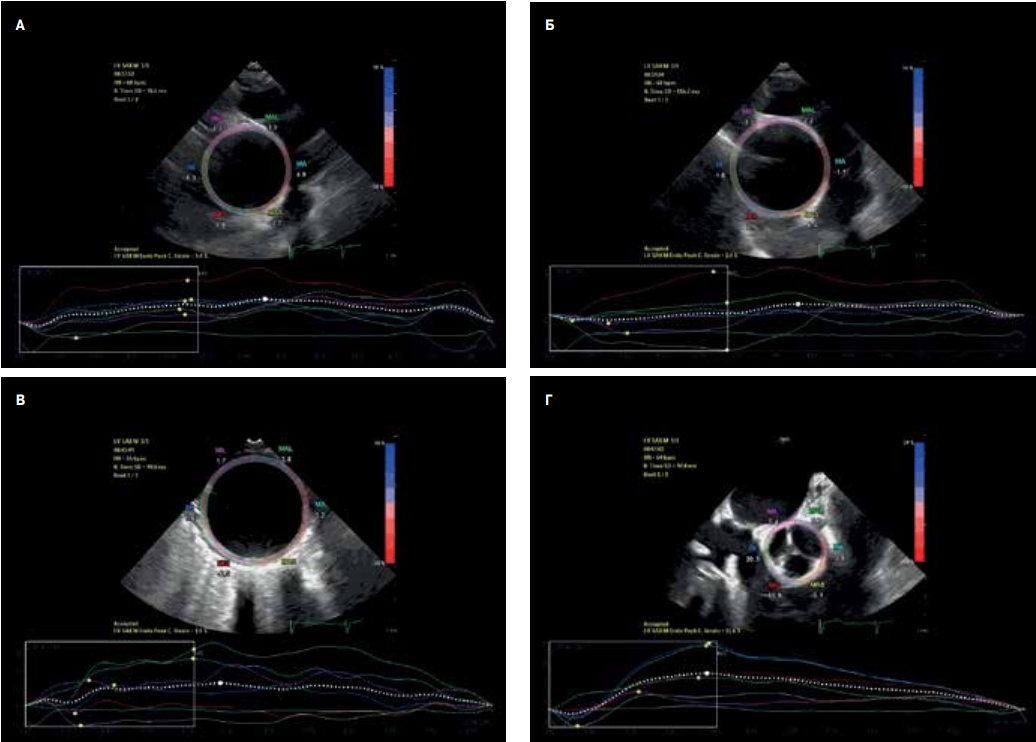
Рис. 1. Пример посегментного анализа глобального циркумференциального стрейна (GCS) аортальной стенки у больной Т., 67 лет с аневризмой ВА при 2D speckle-tracking ЧПЭхоКГ. А — синусы Вальсальвы: диаметр 33 мм, GCS =11%; Б — синотубулярное соединение: диаметр 47 мм, GCS =5,4%; В — максимальная дилатация ВА (уровень бифуркации легочной артерии): диаметр 60 мм, GCS =2,0%; Г — проксимальный сегмент нисходящего отдела ГА: диаметр 31 мм, GCS =1,5%.
Таблица 2
Показатели системного АД, морфометрии, деформации и жесткости восходящего отдела ГА у здоровых лиц и больных с пограничным расширением и аневризмой при ЧПЭхоКГ
|
Ультразвуковые срезы грудного отдела аорты |
Группа 1 (n=11) |
Группа 2 (n=15) |
Группа 3 (n=17) |
Критерий Краскела-Уоллиса |
Апостериорные сравнения по критерию Данна с поправкой Холма |
|||
|
p1-2 |
p1-3 |
p2-3 |
||||||
|
Фиброзное кольцо аортального клапана |
Диаметр, мм |
20 (19; 21) |
22 (20; 24) |
21 (20; 22) |
H=5,24; p=0,073 |
=0,024 |
=0,138 |
=0,406 |
|
Синусы Вальсальвы |
Диаметр, мм |
32 (29; 36) |
40 (36; 45) |
39 (37; 42) |
H=14,25; p<0,001 |
<0,001 |
<0,001 |
=0,623 |
|
GCS, % |
12,2 (9,9; 13,4) |
8,7 (5,7; 12;9) |
8,9 (6,6; 11,7) |
H=4,36; p=0,112 |
=0,069 |
=0,066 |
=0,651 |
|
|
GCS/ПАД |
20,2 (17; 28,6) |
12,7 (9,5; 18,2) |
12,5 (10,6; 20,5) |
H=8,38; p=0,015 |
=0,003 |
=0,032 |
=0,664 |
|
|
FAC, % |
24,3 (17,9; 27,6) |
5,8 (1,4; 15,3) |
7,5 (3,7; 12,7) |
H=14,12; p<0,001 |
=0,002 |
<0,001 |
=0,484 |
|
|
TTP, мсек |
125,7 (80,6; 202,3) |
122,8 (76,3; 161,1) |
115,7 (78,2; 137,3) |
H=0,355; p=0,837 |
=0,659 |
=0,655 |
=0,664 |
|
|
β2 индекс жесткости по Oishi T [13] |
4,8 (3,6; 5,3) |
6,5 (4,6; 9,3) |
7,3 (5,1; 8,1) |
H=6,71; p=0,035 |
=0,021 |
=0,023 |
=0,955 |
|
|
Синотубулярное соединение |
Диаметр, мм |
29 (26; 30) |
41 (39; 44) |
42 (40; 47) |
H=25,16; p<0,001 |
<0,001 |
<0,001 |
=0,086 |
|
GCS, % |
8,4 (5,6; 10) |
4,6 (2,9; 7,2) |
8,3 (4,9; 9,5) |
H=5,93; p=0,092 |
=0,016 |
=0,605 |
=0,086 |
|
|
GCS/ПАД |
14,7 (10,9; 18,6) |
8,2 (4,5; 11,6) |
9,6 (8,2; 12,2) |
H=11,46; p=0,003 |
=0,001 |
=0,024 |
=0,136 |
|
|
FAC, % |
20,1 (13,1; 22,5) |
9,1 (4,7; 14,1) |
2,9 (1,5; 16,2) |
H=9,87; p=0,007 |
<0,001 |
=0,023 |
=0,438 |
|
|
TTP, мсек |
119,4 (74,9; 214,3) |
129,9 (96,5; 181,4) |
116,8 (54,9; 157,3) |
H=2,45; p=0,294 |
=0,979 |
=0,196 |
=0,181 |
|
|
β2 индекс жесткости по Oishi T |
6,7 (5,6; 8,3) |
10,7 (7,4; 17,5) |
9,4 (7,1; 13,5) |
H=7,73; p=0,021 |
=0,007 |
=0,041 |
=0,375 |
|
|
Восходящий отдел (уровень бифуркации легочной артерии) |
Диаметр, мм |
29 (28; 33) |
47 (45; 48) |
52 (51; 55) |
H=37,25; p<0,001 |
<0,001 |
<0,001 |
<0,001 |
|
GCS, % |
8,6 (7,6; 11,7) |
2,4 (1,2; 3,6) |
1,8 (-2,9; 2,9) |
H=21,29; p<0,001 |
<0,001 |
<0,001 |
=0,406 |
|
|
GCS/ПАД |
18,0 (12,1; 20,2) |
3,9 (1,5; 5,8) |
1,7 (-4,2; 2,9) |
H=21,59; p<0,001 |
<0,001 |
<0,001 |
=0,206 |
|
|
FAC, % |
17,7 (16; 22,6) |
7 (5,2; 11) |
6,2 (2,8; 7) |
H=23,33; p<0,001 |
<0,001 |
<0,001 |
=0,126 |
|
|
TTP, мсек |
96,1 (69,7; 154,9) |
151,7 (115,3; 207) |
160,8 (88,9; 196,6) |
H=4,33; p=0,115 |
=0,046 |
=0,095 |
=0,806 |
|
|
β2 индекс жесткости по Oishi T |
5,6 (4,6; 8,1) |
15,7 (9,1; 34,2) |
7,5 (-20,5; 31,5) |
H=3,33; p=0,189 |
=0,021 |
=0,655 |
=0,508 |
|
|
Нисходящий отдел |
Диаметр, мм |
22 (21; 23) |
27 (26; 30) |
27 (24; 31) |
H=16,05; p<0,001 |
<0,001 |
=0,002 |
=0,851 |
|
GCS, % |
10,4 (7; 11,2) |
3,3 (2,2; 5,3) |
3 (2,7; 4,7) |
H=21,77; p<0,001 |
<0,001 |
<0,001 |
=0,879 |
|
|
GCS/ПАД |
17,2 (14,1; 21,5) |
4,1 (3,4; 7,7) |
4,4 (2,6; 8,2) |
H=23,51; p<0,001 |
<0,001 |
<0,001 |
=0,806 |
|
|
FAC, % |
17,5 (15; 21,5) |
6,1 (1; 9,5) |
3,2 (1; 7,8) |
H=23,06; p<0,001 |
<0,001 |
<0,001 |
=0,417 |
|
|
TTP, мсек |
33,3 (24; 51,6) |
94,3 (53,3; 163,3) |
87,4 (60,9; 138,5) |
H=13,11; p=0,002 |
=0,002 |
=0,002 |
=0,895 |
|
|
β2 индекс жесткости по Oishi T |
5,6 (4,6; 7,4) |
16,1 (9,8; 22,4) |
19,5 (10,8; 26,2) |
H=18,37; p=0,001 |
<0,001 |
<0,001 |
=0,395 |
|
|
Усредненные показатели по всем сегментам грудной аорты |
Диаметр, мм |
26,6 (25,2; 28,4) |
35,6 (33,8; 37,8) |
36,4 (35,6; 38,2) |
H=25,71; p<0,001 |
<0,001 |
<0,001 |
=0,082 |
|
GCS, % |
9,7 (8,4; 11,7) |
4,5 (3,8; 6) |
5,4 (3,5; 6,7) |
H=19,02; p<0,001 |
<0,001 |
<0,001 |
=0,584 |
|
|
GCS/ПАД |
18,4 (14,9; 20,6) |
6,6 (6,1; 9,7) |
8,1 (6,2; 9,7) |
H=23,01; p<0,001 |
<0,001 |
<0,001 |
=0,748 |
|
|
FAC, % |
18,8 (17,6; 22,3) |
7,3 (6,4; 10,6) |
7,5 (4,8; 10,6) |
H=24,16; p<0,001 |
<0,001 |
<0,001 |
=0,597 |
|
|
TTP, мсек |
114,6 (82,7; 137,2) |
137,5 (108; 151,4) |
129,1 (92,9; 144,2) |
H=3,59; p=0,158 |
=0,052 |
=0,249 |
=0,417 |
|
|
β2 индекс жесткости по Oishi T |
5,9 (4,8; 6,7) |
10,2 (8,1; 17,7) |
13,1 (5,4; 18,1) |
H=8,33; p=0,015 |
=0,001 |
=0,057 |
=0,925 |
|
|
САД, мм рт.ст. ДАД, мм рт.ст. ПАД, мм рт.ст. ЧСС, уд./мин |
137 (125; 143) |
163 (136; 167) |
151 (129; 168) |
H=6,28; p=0,043 |
=0,008 |
=0,099 |
=0,558 |
|
|
75 (74; 84) |
88 (78; 95) |
74 (66; 80) |
H=12,42; p=0,002 |
=0,011 |
=0,212 |
=0,002 |
||
|
59 (50; 65) |
66 (58; 82) |
69 (54; 105) |
H=4,35; p=0,114 |
=0,046 |
=0,095 |
=0,571 |
||
|
64 (54; 67) |
64 (57; 70) |
64 (61; 69) |
H=0,31; p=0,859 |
=0,755 |
=0,621 |
=0,734 |
||
Сокращения: ДАД — диастолическое артериальное давление, ПАД — пульсовое артериальное давление, САД — систолическое артериальное давление, ЧСС — частота сердечных сокращений, FAC — изменение площади поперечного сечения аорты, GCS — глобальный циркумференциальный стрейн, TTP — время достижения пикового систолического циркумференциального стрейна.
Обсуждение
Современные клинические руководства и рекомендации указывают на наличие "критического" диаметра аорты >5,5 см, при котором риск расслоения или разрыва аорты в результате выраженного тканевого ремоделирования и полной утраты механической прочности аортальной стенки резко возрастает [1][2]. Безусловно, расширение ВА является основным маркером аневризмы, в то же время он не отражает функции ткани аортальной стенки, в частности, напряжения, жесткости и, в конечном итоге, способности к деформации. По мнению многих исследователей поиск новых дополнительных критериев стратификации риска аорто-ассоциированных осложнений и принятия решения о хирургическом лечении, отражающих помимо диаметра аневризмы нарушение функции аортальной стенки, является актуальной задачей современных методов медицинской визуализации [4][5][7][8].
Потому представляет интерес неинвазивная оценка биомеханических свойств аортальной стенки с помощью 2D speckle-tracking мультиплановой ЧПЭхоКГ, позволяющей в клинических условиях, не подвергая больного лучевой нагрузке, количественно рассчитать деформацию аортальной стенки, используя серошкальные ультразвуковые срезы различных сегментов ГА по короткой оси [8][9]. В основе методики заложена экстраполяция известной и апробированной в клинике ультразвуковой модели оценки циркумференциального и радиального стрейна миокарда ЛЖ по короткой оси, позволяющей в данном случае рассчитать интегральную деформацию аортальной стенки по всей окружности за счет ее усреднения в 6 различных сегментах [10]. Преимуществом данной ультразвуковой методики также является и то, что высокочастотный матричный датчик устанавливается в пищеводе в стандартных точках на глубине 20-30 см от резцов в анатомической близости от исследуемой структуры — стенки аорты, благодаря чему удается получить серошкальные срезы восходящей и нисходящей аорты по короткой оси высокого качества. Метод хорошо воспроизводим и успешно валидирован в экспериментальных условиях на фантоме аорты [11].
В данном исследовании был проведен сравнительный анализ биомеханики восходящего отдела аорты в норме, при пограничном расширении и аневризме с помощью посегментной ультразвуковой оценки деформационных характеристик аортальной стенки, применяя технологию 2D speckle-tracking ЧПЭхоКГ. У здоровых добровольцев при нормальных размерах ГА на протяжении сердечного цикла мы наблюдали равномерную однонаправленную деформацию и равномерную жесткость аортальной стенки во всех исследуемых сегментах ГА по направлению от фиброзного кольца аортального клапана к нисходящему отделу, что обусловлено нормальным функционированием эластичной аортальной компрессионной камеры, выполняющей роль демпфера пульсовой волны. У больных с пограничным расширением и аневризмой ВА на фоне увеличения диаметра аорты мы наблюдали прогрессирующее скачкообразное снижение показателей деформации вплоть до отрицательных значений и увеличение жесткости аортальной стенки по направлению от фиброзного кольца аортального клапана к нисходящему отделу с максимумом в зоне наибольшей дилатации. Следует подчеркнуть, что статистически значимого различия показателей деформации и жесткости аортальной стенки между группами больных с пограничным расширением и аневризмой ВА нами не было выявлено, несмотря на разницу в диаметрах в зоне максимальной дилатации. Это свидетельствует о том, что нарушение деформационных характеристик и увеличение жесткости аортальной стенки в результате ремоделирования происходит пропорционально значимо как при пограничном расширении, так и при аневризме и, по нашему мнению, может рассматриваться как дополнительный критерий оценки механической прочности аортальной ткани помимо диаметра. В этой ситуации с позиций механики кровообращения возникает порочный круг. Согласно теореме Бернулли [14] снижение способности к деформации и увеличение жесткости аортальной стенки приводит к быстрому пассивному расширению ВА, замедлению кровотока и увеличению бокового давления. Одновременно с этим согласно закону Лапласа [14] с увеличением диаметра аневризмы возрастает напряжение на стенку аорты со стороны кровотока, которая становится еще более жесткой, что ограничивает возможности ее растяжимости и деформации и способствует дальнейшей дилатации аорты. Подтверждением вышеописанных механизмов является выявленная нами обратная корреляционная взаимосвязь диаметра ВА с показателями деформации и прямая взаимосвязь с индексом жесткости аортальной стенки. Кроме того, исследования Alreshidan M, et al. [8] и Emmott A, et al. [5] подтвердили высокую корреляцию между значениями модулей жесткости, рассчитанными в эксперименте при анализе интраоперационно полученных фрагментов ткани стенки аневризмы ВА с индексом жесткости β2, рассчитанным в клинических условиях на основании показателей деформации с помощью 2D speckle-tracking ЧПЭхоКГ. Это подтверждает высокую диагностическую ценность показателей деформации и индекса жесткости аортальной стенки, рассчитанного на основе показателей системного АД и циркумференциального стрейна в качестве вспомогательных критериев для оценки механической прочности стенки ВА при пограничном расширении и аневризме.
В выполненном нами исследовании следует обратить особое внимание на показатели деформации и жесткости стенки нисходящего отдела ГА, которые, по всей вероятности, могут рассматриваться как интегральные характеристики функциональной несостоятельности аортальной ткани вышерасположенных сегментов ГА и, возможно, в перспективе быть маркером восстановления работы аортальной компрессионной камеры после протезирования. Однако это требует дополнительных исследований.
Суммируя вышеизложенное, следует отметить, что, по нашему мнению, посегментный ультразвуковой анализ деформационных характеристик и жесткости стенки ГА по направлению от фиброзного кольца аортального клапана к нисходящему отделу во время мультиплановой 2D speckle-tracking ЧПЭхоКГ может иметь самостоятельное диагностическое значение при оценке функциональной несостоятельности аортальной ткани наряду с показателями диаметра. При этом показатели циркумференциального стрейна и жесткости аортальной стенки в зоне максимальной дилатации могут рассматриваться в качестве вспомогательного критерия при выборе индивидуальной хирургической стратегии у больных с пограничным расширением и аневризмой ВА.
Ограничения исследования. Выполненное исследование имело определенные ограничения. Так, мы вынуждены были исключить из исследования лиц, у которых нечетко визуализировался поперечный срез ВА на уровне бифуркации легочной артерии из-за "слепой" зоны — столб воздуха в трахее и левом магистральном бронхе. Кроме того, ограничением исследования являлась интерпретация изменений времени достижения пикового систолического циркумференциального стрейна и индекса жесткости аортальной стенки в группах 2 и 3 в связи с разнонаправленной деформацией отдельных сегментов аортальной стенки. Нельзя исключить влияние на показатели деформации аортальной ткани структур, рядом расположенных со стенками ГА, а именно трахеи, бифуркации легочной артерии и левого предсердия.
Заключение
- В норме эластико-тонические свойства аортальной стенки обеспечивают однонаправленный равномерный циркумференциальный стрейн и равномерную жесткость аортальной стенки во всех сегментах восходящего отдела ГА.
- При пограничном расширении и аневризме ВА происходит пропорционально значимое скачкообразное понижение показателей деформации вплоть до отрицательных значений и увеличение жесткости аортальной стенки по направлению от фиброзного кольца аортального клапана к нисходящему отделу ГА с максимумом в зоне наибольшей дилатации.
- Одним из механизмов дилатации ВА является ограничение способности к деформации и увеличение жесткости аортальной стенки.
- Применение технологии 2D speckle-tracking при мультиплановой ЧПЭхоКГ позволяет неинвазивно проводить комплексный посегментный анализ нарушений биомеханики аортальной стенки при дилатации различного генеза, результаты которого наряду с диаметром аорты могут иметь самостоятельное диагностическое значение при выборе индивидуальной хирургической стратегии у больных с пограничным расширением или аневризмой ВА.
Отношения и деятельность. Исследование выполнено в НИИ кардиологии Томского НИМЦ РАН за счет гранта Российского научного фонда № 21-15-00160 "Исследование механизмов изменения эластико-тонических свойств грудного отдела аорты при дилатации различного генеза с помощью экспериментальных, клеточно-молекулярных и лучевых методов исследования", https://rscf.ru/project/21-15-00160/.
Список литературы
1. Isselbacher EM, Preventza O, Hamilton Black III J, et al. 2022 ACC/AHA Guideline for the Diagnosis and Management of Aortic Disease: A Report of the American Heart Association/American College of Cardiology Joint Committee on Clinical Practice Guidelines. Circulation. 2022 Dec; 146(24): e334-e482. doi:10.1161/CIR.0000000000001106.
2. Erbel R, Aboyans V, Boileau C, et al. 2014 ESC Guidelines on the diagnosis and treatment of aortic diseases. Document covering acute and chronic aortic diseases of the thoracic and abdominal aorta of the adult The Task Force for the Diagnosis and Treatment of Aortic Diseases of the European Society of Cardiology (ESC). European Heart Journal. 2014; 35:2873–2926. doi:10.1093/eurheartj/ehu281.
3. Davis FM, Luo Y, Avril S, et al. Local mechanical properties of human ascending thoracic aneurysms. Journal of the Mechanical Behavior of Biomedical Materials. 2016 Aug; 61:235-249. doi:10.1016/j.jmbbm.2016.03.025.
4. Саушкин В.В., Панфилов Д.С., Врублевский А.В. и др. Роль лучевых методов диагностики в выборе тактики лечения синдрома мегааорты. Хирургия. Журнал им. Н.И. Пирогова. 2022; 2:67–74. doi:10.17116/hirurgia202202167.
5. Emmott A, Alzahrani H, Alreshidan M, et al. Transesophageal echocardiographic strain imaging predicts aortic biomechanics: Beyond diameter. The Journal of Thoracic and Cardiovascular Surgery. 2018; 156(2):503-512.e1. doi:10.1016/j.jtcvs.2018.01.107.
6. Sokolis DP. Effects of aneurysm on the directional, regional, and layer distribution of residual strains in ascending thoracic aorta. Journal of the Mechanical Behavior of Biomedical Materials. 2015 Jun; 46:229-243. doi:10.1016/j.jmbbm.2015.01.024.
7. Сандриков В.А., Белов Ю.В., Кулагина Т.Ю., и др. Векторное картирование деформации и потоков крови у пациентов с аневризмой восходящей аорты. Ангиология и сосудистая хирургия. 2019; 25(2): 40-46. doi:10.33529/ANGIO2019224.
8. Alreshidan M, Shahmansouri N, Chung J, et al. Obtaining the biomechanical behavior of ascending aortic aneurysm via the use of novel speckle tracking echocardiography. 2017 Apr;153(4):781-788. doi:10.1016/j.jtcvs.2016.11.056.
9. Rong LQ., Kim J, Gregory AG. Speckle tracking echocardiography: imaging insights into the aorta. Current Opinion in Cardiology. 2020 Mar; 35(2):116-122. doi:10.1097/HCO.0000000000000706.
10. Cameli M, Mandoli G, Sciaccaluga C, Mondillo S. More than 10 years of speckle tracking echocardiography: Still a novel technique or a definite tool for clinical practice? Echocardiography. 2019 May;36(5):1–13. doi:10.1111/echo.14339.
11. Petrini J, Eriksson MJ, Caidahl K, Larsson M. Circumferential strain by velocity vector imaging and speckle-tracking echocardiography: validation against sonomicrometry in an aortic phantom. Clinical Physiology and Functional Imaging. 2018 Mar; 38(2):269-277. doi:10.1111/cpf.12410.
12. Goldstein S, Evangelista A, Abbara S, et al. Multimodality Imaging of Diseases of the Thoracic Aorta in Adults: From the American Society of Echocardiography and the European Association of Cardiovascular Imaging Endorsed by the Society of Cardiovascular Computed Tomography and Society for Cardiovascular Magnetic Resonance. Journal of the American Society of Echocardiography. 2015 Feb; 28(2):119-82. doi:10.1016/j.echo.2014.11.015.
13. Oishi Y, Mizuguchi Y, Miyoshi H, et al. A Novel Approach to Assess Aortic Stiffness Related to Changes in Aging Using a Two-Dimensional Strain Imaging. Echocardiography. 2008 Oct; 25(9): 941-945.
14. Каро К., Педли Т., Шротер Р., Сид У. Механика кровообращения. – М.: Мир, 1981. – 624 с.
Об авторах
А. В. ВрублевскийРоссия
Врублевский Александр Васильевич — доктор медицинских наук, старший научный сотрудник отделения атеросклероза и хронической ишемической болезни сердца
Томск
Д. С. Панфилов
Россия
Панфилов Дмитрий Сергеевич — доктор медицинских наук, старший научный сотрудник отделения сердечно-сосудистой хирургии
Томск
Б. Н. Козлов
Россия
Козлов Борис Николаевич — доктор медицинских наук, заведующий отделением сердечно-сосудистой хирургии
Томск
В. В. Саушкин
Россия
Саушкин Виктор Вячеславович — кандидат медицинских наук, старший научный сотрудник отдела лучевой диагностики
Томск
С. И. Сазонова
Россия
Сазонова Светлана Ивановна — доктор медицинских наук, ведущий научный сотрудник отдела лучевой диагностики
Томск
Дополнительные файлы
Рецензия
Для цитирования:
Врублевский А.В., Панфилов Д.С., Козлов Б.Н., Саушкин В.В., Сазонова С.И. Нарушения биомеханики восходящего отдела аорты при пограничном расширении и аневризме. Российский кардиологический журнал. 2023;28(5):5365. https://doi.org/10.15829/1560-4071-2023-5365
For citation:
Vrublevsky A.V., Panfilov D.S., Kozlov B.N., Saushkin V.V., Sazonova S.I. Disturbances of the ascending aorta biomechanics in moderate dilatation and aneurysm. Russian Journal of Cardiology. 2023;28(5):5365. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5365
JATS XML

















































