Перейти к:
Интегрированное решение для пациентов очень высокого сердечно-сосудистого риска. Окончательные результаты
https://doi.org/10.15829/1560-4071-2023-5358
Аннотация
Меры вторичной профилактики следует активно внедрять на всех этапах лечения и реабилитации пациентов после перенесенного острого коронарного синдрома (ОКС). Перспективна интеграция в клиническую практику удаленного наблюдения пациентов с телеметрической передачей витальных и лабораторных данных.
Цель. Оценка клинической и пациент-ориентированной эффективности разработанной и внедренной схемы комбинированного очного и телемедицинского наблюдения пациентов, недавно перенесших ОКС, на протяжении 12 мес.
Материал и методы. Для заключительного анализа использованы данные 84 (из 100 включенных) пациентов (медиана возраста 56 (50;61) лет, 70 мужчин) с артериальной гипертензией и/или сахарным диабетом тип 2, которые в течение 12 предшествующих месяцев перенесли ОКС и эндоваскулярную реваскуляризацию, при этом их уровень холестерина липопротеидов низкой плотности (ХС-ЛНП) находился выше отметки в 2,4 ммоль/л. Стандартная практика ведения пациентов была дополнена телемедицинской программой, функционал которой включал электронные дневники самоконтроля артериального давления (АД) и липидограммы, а также сервис текстовых телеконсультаций с врачом. Обязательные очные визиты проводились через 3 и 12 мес. от даты включения. Основная конечная точка — ∆ХС-ЛНП. Оценены дополнительные клинические и пациент-ориентированные конечные точки.
Результаты. Выявлено значимое снижение ХС-ЛНП на 1,6 (-2,3;-0,9) ммоль/л к концу наблюдения. Кроме изначального уровня ХС-ЛНП, с его снижением были связаны: а) высокая приверженность пациентов к ведению дневников самоконтроля АД и липидограммы (β=0,7), б) количество отправленных врачом текстовых сообщений в 1-й мес. наблюдения (β=0,04). У более приверженных пациентов ∆ХС-ЛНП была выше на 0,49 ммоль/л (95% доверительный интервал (ДИ) -1,2; -0,1), после поправки на основные количественные ковариаты. У 35 пациентов (42%) удалось добиться целевого ХС-ЛНП, у 60 пациентов (71%) — снижения на ≥1 ммоль/л. При этом приверженные пациенты вдвое чаще достигали целевого ХС-ЛНП (отношение шансов 2,2; 95% ДИ (0,6; 3,8)), нежели неприверженные. В положительную сторону изменились и другие индикаторы липидограммы. Показано снижение офисного систолического АД на 5,8 мм рт.ст. (р=0,03). Количество сообщений врача пациенту превышало таковое от пациентов к врачу (медианы 143 и 111 консультаций на пациента в год, соответственно). Качество жизни улучшилось, но только в части эмоционального компонента. Оценка удовлетворенности программой оставалась высокой на всех этапах исследования.
Заключение. Показана эффективность комбинированного типа оказания медицинской помощи (с интеграцией телемониторинга) у пациентов после перенесенного ОКС. Приверженность к самоконтролю АД, а также активная консультативная поддержка на первых этапах реабилитации, способствует дополнительному динамическому контролю показателей липидного спектра, своевременной коррекции гиполипидемической терапии с достижением целевого уровня ХС-ЛНП. Большинство пациентов не испытывало трудностей при использовании программы, и готовы рекомендовать такой путь наблюдения другим пациентам.
Ключевые слова
Для цитирования:
Усова Е.И., Ионов М.В., Алиева А.С., Авдонина Н.Г., Яковлев А.Н., Звартау Н.Э. Интегрированное решение для пациентов очень высокого сердечно-сосудистого риска. Окончательные результаты. Российский кардиологический журнал. 2023;28(2):5358. https://doi.org/10.15829/1560-4071-2023-5358
For citation:
Usova E.I., Ionov M.V., Alieva A.S., Avdonina N.G., Yakovlev A.N., Zvartau N.E. Integrated solution for patients of a very high cardiovascular risk. Final results. Russian Journal of Cardiology. 2023;28(2):5358. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5358
Очевидны достижения в сфере вторичной профилактики сердечно-сосудистых осложнений (ССО) у пациентов после перенесенных крупных сосудистых катастроф, в особенности, острого коронарного синдрома (ОКС). Новые фармацевтические препараты, их комбинации и совершенствование аппаратных методик лечения охватывают практически все группы таких пациентов.
Кроме чисто процедурных и анатомических особенностей, риск повторных коронарных событий у пациентов, перенесших ОКС, определяют модифицируемые факторы риска (ФР), такие как уровень систолического артериального давления (АД) и холестерина липопротеидов низкой плотности (ХС-ЛНП), в особенности — их сосуществование. При активном контроле этих факторов 10-летний риск повторных ССО удается снизить до <10% в половине случаев [1].
Однако на практике основные терапевтические цели зачастую остаются не достигнуты [2], отчасти из-за низкой приверженности пациентов и терапевтической инертности [3]. Если контроль АД вполне легко можно достичь за счет обширной палитры вполне безопасных антигипертензивных препаратов и их фиксированных комбинаций, то снижение ХС-ЛНП — задача более трудная. Ограниченный арсенал препаратов, некоторые из которых дорогостоящи и труднодоступны, отсутствие доступного и простого маркера для мониторирования с целью сохранения приверженности, предубеждения пациентов (и, что намного серьезнее, некоторых врачей) насчет основной фармакологической группы, ингибиторов 3-гидрокси-3-метилглютарил-кофермент А редуктазы (статинов), — все это препятствует реализации мер вторичной профилактики [4].
Из этого следует, что есть очевидная потребность в подходах, способных оптимизировать и персонализировать программы наблюдения. Ранее, в основном в странах Западной и Северной Европы, были разработаны различные общенациональные проекты по вторичной профилактике [5][6], однако их масштабы и горизонт планирования не гарантируют стремительного достижения практически ощутимых результатов, а иногда характеризуются ограниченным кругом или даже отсутствием бенефициаров [7][8]. В основном программы следуют по одинаковому треку — формирование "дорожной карты" для пациента, увеличение числа временных точек для динамической оценки состояния, соответственно, визитов к врачу, вовлечение в процесс других медицинских специалистов.
Рост информатизации и автоматизации процессов оказания медицинской помощи сулит все более широкие перспективы для использования телемедицины (ТМ), уже зарекомендовавшей себя в сфере первичной профилактики [9] и у пациентов с хронической сердечной недостаточностью [10]. Более того, ТМ отлично встраивается в процесс длительного наблюдения пациентов, циклы помощи по типу Internet of Medical Things уже описаны для пациентов с артериальной гипертензией (АГ) [11]. Очевиден интерес исследователей и практиков к ТМ и среди пациентов, перенесших ОКС, находящихся на своего рода "развилке" сердечно-сосудистого континуума. Однако пока подобных исследований не так много, что приводит к пробелам в доказательной базе ТМ для данной группы пациентов.
Ранее нами был запущен проект по формированию программы интегрированного индивидуализированного врачебного наблюдения (с внедрением гибридного ТМ решения) пациентов после ОКС. Цель заключалась в улучшении клинических и пациент-ориентированных исходов на раннем этапе кардиореабилитации. В данной работе представлены окончательные результаты этой 12-мес. программы.
Материал и методы
Исследование можно охарактеризовать как открытое проспективное одноцентровое, в одной группе; проводилось в ФГБУ "Национальный медицинский исследовательский центр им. В. А. Алмазова" Минздрава России, в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и положениями Хельсинкской декларации (2013г пересмотра). Протокол исследования, индивидуальная регистрационная карта пациента, информационный листок и форма информированного согласия пациента были одобрены локальным этическим комитетом (номер заседания 11-20 от 16.11.2020г).
Процедуры скрининга, отбора, включения и последующего наблюдения пациентов были подробно описаны ранее [12]. Вкратце, отбор в исследование проводился среди пациентов старше 18 лет, которые за последние 12 мес. перенесли ОКС (любая клиническая форма) с эндоваскулярной реваскуляризацией в ходе данной экстренной госпитализации, чей исходный уровень ХС-ЛНП превышал 2,4 ммоль/л. Наличие в анамнезе АГ и/или сахарного диабета 2 типа также было обязательным критерием включения. Критериями исключения стали: отзыв пациентом информированного согласия, а также длительное (>1 мес.) отсутствие активности пациента по передаче витальных/лабораторных показателей врачу при условии двух телефонных звонков от врача, выполненных с разницей в 7 дней. Исключенный из исследования пациент мог свободно продолжить амбулаторное наблюдение и реабилитацию в рамках повседневной клинической практики.
В практику врачей-кардиологов (исследователей) было интегрировано гибридное телемедицинское решение, реализованное на рабочих персональных компьютерах, с мобильным приложением (только для пациента). Функционал этого программного продукта был в подробностях описан ранее [13]. Необходимо особо отметить, что представлен он был разделом электронных дневников самоконтроля (ЭДС) АД, липидного спектра, а также дополнялся сервисом текстовых плановых консультаций (экстренные консультации исключены).
В исследовании предусматривалось 3 очных визита: начальный, через 3 мес. и через 12 мес. На всех очных визитах выполнялось измерение офисных показателей АД и частоты сердечных сокращений. Коррекция проводимой антигипертензивной, антиишемической и липидснижающей терапии проводилась как в очном порядке (в основном, назначение новых или замена ранее назначенных препаратов), так и с помощью телемедицинской программы (титрация доз, замена препаратов внутри одного класса). Суррогатным маркером приверженности к проводимой терапии было корректное и своевременное заполнение ЭДС.
Пациентам предлагалось заполнить на первом и на заключительном визитах 2 опросника: 1) русскоязычный вариант опросника по качеству жизни для пациентов с ишемической болезнью сердца (ИБС) — HeartQol [14] и 2) специально разработанную для данного исследования "Анкету удовлетворенности программой" [13]. Кроме этого, на заключительном визите задавался дополнительный вопрос: "Насколько Вы готовы рекомендовать участие в программе другим людям, перенесшим такое же заболевание?" с рейтинговой шкалой ответов (0 — совсем не готов(а) рекомендовать, 10 — точно готов(а) рекомендовать).
Статистический анализ. Количественные переменные представлены в виде среднего и среднеквадратичного отклонения, медианы и 25-й, 75-й квартили. Проверка согласия распределения количественных показателей с нормальным (Гауссовым) проводилась при помощи критериев Шапиро-Уилка и Колмогорова-Смирнова.
В случае соответствия распределения нормальному, различия средних количественных показателей были проверены с помощью t-теста Стьюдента между группами и внутри групп. В противном случае использованы непараметрические аналоги указанного критерия (U-критерий Манна-Уитни, Уилкоксона). Категориальные переменные представлены в виде абсолютных значений с долями в виде процентов. Сравнения категориальных переменных выполнялись с использованием χ2-теста и теста Мак-Немара (для связанных выборок). Сравнение между 3 и более группами были проведены с помощью однофакторного дисперсионного анализа (ANOVA) или тестов Крускала-Уоллиса/Фридмана, в зависимости от типа распределения данных. Пропущенные данные исключались попарно.
Первичной и основной конечной точкой стала динамика ХС-ЛНП спустя 12 мес. после включения. Анализ многофакторной линейной регрессии проведен для поиска возможных предикторов динамики ХС-ЛНП (после выявления отдельных влияющих ковариат и факторов в рамках однофакторного регрессионного анализа (не показан в тексте); факторы и ковариаты были выбраны на основании их клинической значимости и корреляционных матриц (не показаны в тексте)). Одномерный дисперсионный анализ (ANCOVA) проводился с целью оценки динамики ХС-ЛНП между различными подгруппами пациентов (фиксированные факторы) независимо от вероятной основной ковариаты (исходный уровень ХС-ЛНП и иных, выявленных при регрессионном анализе). Анализ биномиальной логистической регрессии был проведен для поиска возможных предикторов достижения целевого уровня ХС-ЛНП через 12 мес. после коррекции на выявленные количественные ковариаты. Оценена площадь под кривой сформированной лог-регрессионной модели для оценки ее пригодности и предсказательной точности.
Дополнительно оценивалась динамика ХС-ЛНП на основных временных отрезках исследования; динамика показателей офисного и домашнего АД, а также пациент-ориентированные конечные точки, такие как изменения балльной оценки по опросникам HeartQoL, анкете удовлетворенности программой.
Двухсторонний критерий значимости различий был установлен на уровне 0,05. Все этапы статистической обработки данных были проведены с использованием программного пакета SPSS Statistics ver. 23.0 (IBM Corp., США) и программы jamovi ver. 1.6 (the jamovi project, https://www.jamovi.org).
Результаты
Прошли отбор в исследование и подписали форму информированного согласия 100 пациентов. В дальнейшем 16 пациентов были исключены: основными причинами стал отказ от дальнейшего участия в исследовании с отзывом информированного согласия или прекращение активного ведения ЭДС, несмотря на активные врачебные напоминания (рис. 1).
Окончательный анализ проведен на основе данных, полученных от 84 пациентов (медиана возраста 56 лет, 70 мужчин), совершивших заключительный визит в Центр через 12 мес. после включения. Подробная характеристика этой группы пациентов представлена в таблице 1.
Как в целом, так и по отдельным параметрам финальная группа пациентов незначимо отличалась от изначально включенных и прошедших промежуточный визит 50 больных [13]. Как и ранее, для более чем 50% пациентов ОКС стал дебютом заболевания, но для пятой части пациентов это ССО стало вторым по счету (ранее перенесенные инфаркт миокарда или острое нарушение мозгового кровообращения). Треть пациентов поступила в стационар с ОКС с подъемом сегмента ST. Более, чем в половине случаев, несмотря на большое количество ситуаций с двух- (43%) и трех- (16%) сосудистым поражением, в результате экстренного чрескожного вмешательства был достигнут оптимальный ангиографический результат. Однако в итоге у половины всех включенных в исследование сформировалось трансмуральное повреждение миокарда, хотя в дальнейшем признаки и симптомы сердечной недостаточности развились только в 20% случаев. В основном пациенты были включены спустя 1 мес. после наступления сосудистого события. В большинстве случаев сопутствующая патология была представлена АГ, в меньшей степени — сахарным диабетом 2 типа. Большинство пациентов получали в качественном отношении оптимальную медикаментозную терапию после законченного случая госпитализации.
Всем пациентам рекомендован прием высокоинтенсивной терапии ингибиторами 3-гидрокси-3-метилглютарил-кофермента А редуктазы (статины); в основном аторва- или розувастатин. 47 пациентам (56%) потребовалась комбинированная липидснижающая терапия с добавлением эзетимиба в стандартной дозе 10 мг. Троим пациентам из общей группы и одному пациенту, уже принимающему полнодозовую комбинированную терапию, потребовалось назначение ингибиторов пропротеиновой конвертазы субтилизин-кексинового типа 9 (PCSK9) для достижения целевого уровня ХС-ЛНП и предотвращения прогрессии атеросклеротического процесса.
Промежуточный визит был проведен в среднем через 70 (±19) дней, а заключительный — через 308 (±83) дней после изначального. Медиана количества выполненных лабораторных тестов для оценки липидограммы составляла 4 (минимум — 3 и максимум — 10). Было выявлено статистически значимое снижение показателей ХС-ЛНП между изначальным его уровнем и всеми временными отрезками (рис. 2): к моменту проведения промежуточного визита уровень этого показателя составил 2,1 (1,7;2,7) ммоль/л, продолжая снижаться и в дальнейшем, составив к заключительному визиту 1,9 (1,5;2,3) ммоль/л. Таким образом, медиана снижения ХС-ЛНП между начальным и заключительным визитом составила -1,6 (-2,3;-0,9) ммоль/л.
Ожидаемо, исходный уровень ХС-ЛНП влиял на дельту снижения ХС-ЛНП (R2=0,21; p<0,001). Однако наблюдалось улучшение согласованности модели при включении в нее других количественных (количество сообщений от пациента к врачу и от врача-пациенту через 1 мес., возраст на момент включения) и категориальных переменных (предшествующий анамнез ИБС, высокая приверженность к регулярному ведению ЭДС) — R2=0,35. Учитывая эффект Wilder [15], при исключении исходного уровня ХС-ЛНП (при этом согласованность модели снижалась до R2=0,19) значимыми предикторами снижения этого показателя оставались приверженность к ведению ЭДС (β=-0,7 (в случае высокой степени приверженности); p=0,04) и количество сообщений от врача-пациенту через 1 мес. (β=0,04; p=0,01). При подгрупповом анализе после коррекции, проведенной по количественным ковариатам, перечисленным выше, у приверженных пациентов дельта ХС-ЛНП была ниже на 0,45 ммоль/л к концу наблюдения (95% доверительный интервал (ДИ) -1,2; -0,1 ммоль/л), чем у пациентов, которые вели ЭДС не столь прилежно. Также более приверженные пациенты чаще достигали целевого уровня ХС-ЛНП, вне зависимости от изначальных значений ХС-ЛНП и после поправки на количество отправленных врачом сообщений за первый месяц (отношение шансов 2,2; 95% ДИ 0,6; 3,8). Площадь под кривой (AUC) модели составила 0,74, что говорит об удовлетворительной предсказательной точности модели. Стоит заметить, что 36 (43%) пациентам потребовались дополнительные звонки для повышения приверженности, которые были успешны в подавляющем большинстве случаев. Другие подгрупповые сравнения не проводили по причине отсутствия значимости категориальных переменных в регрессионном анализе.
Согласно ранее полученным результатам, небольшая доля изначально включенных 50 пациентов, с которыми был проведен промежуточный визит, достигла целевых значений ХС-ЛНП [13]. Столь же незначительна осталась эта группа и после завершения набора в исследование. Однако в дальнейшем почти у половины из тех, кто не достиг целевых показателей ХС-ЛНП на 3-мес. визите, удалось добиться снижения ХС-ЛНП <1,4 ммоль/л или хотя бы на 50% от исходного. Таким образом, 35 пациентов (42%) к концу годичного наблюдения пришли к оптимальному результату (рис. 3). Исходный уровень ХС-ЛНП у этих пациентов был значимо выше, чем у других 49 пациентов, так и не достигших целевых показателей (в среднем на 0,43 (0,04;0,8) ммоль/л, p=0,03). Все остальные переменные не играли статистически значимой роли при сравнении этих подгрупп.
Хотя среди более чем половины пациентов так и не удалось достичь снижения ХС-ЛНП ниже заданных порогов, практически у всех из них через 2 мес. удалось добиться снижения показателя (рис. П1). Только у 3 пациентов показатели ХС-ЛНП оказались выше изначальных, еще у 21 пациента они изменились незначительно; у остальных 60 (71%) удалось добиться снижения уровня ХС-ЛНП как минимум на 1 ммоль/л (рис. 4).
Что касается остальных показателей липидного спектра, то наблюдались положительные изменения общего холестерина сыворотки крови вплоть до 3,6 ммоль/л (размер эффекта 0,9; p<0,001) и триглицеридов сыворотки — до 1,2 ммоль/л (размер эффекта 0,52; p<0,001). Спустя 12 мес. наблюдалось увеличение уровня липопротеидов высокой плотности до 1,15 ммоль/л (размер эффекта +0,56, p<0,001). Изменений в динамике липопротеидов очень низкой плотности не наблюдалось.
Все пациенты получали антигипертензивную терапию, подавляющее большинство получали препараты из групп ингибиторов ренин-ангиотензин-альдостероновой системы. Схемы антигипертензивной терапии соответствовали рекомендованным, в основном назначались фиксированные комбинации основных классов препаратов. Практически все пациенты получали бета-адреноблокаторы в качестве средств вторичной профилактики или в рамках антиангинальной терапии. Спустя 3 мес. после включения показатели офисного систолического АД (САД) существенно не отличались от исходных. Не было найдено различий и между офисным САД на промежуточном и заключительном визитах. Однако динамика показателей офисного САД достигла статистической значимости при сравнении исходного и заключительного показателей (-5,8 мм рт.ст., р=0,03). Несмотря на отсутствие различий количественных показателей САД на промежуточных этапах, в течение всего исследования наблюдался постепенный рост числа пациентов с целевым офисным АД, начиная с изначальных 49 (58%), до 69 (82%) и 72 (86%), соответственно (p<0,001 для всех групп сравнения). Ощутимых различий не было найдено между показателями систолического домашнего АД, оцениваемого каждые 3 мес. по ЭДС (p=0,11, рис. П2), медиана домашнего САД не покидала диапазона в 120-125 мм рт.ст. При сравнении групп пациентов с целевым САД и целевыми значениями ХС-ЛНП через 12 мес. наблюдения, между ними не было найдено сходств (χ2 -1,6; p=0,26), так же как не было найдено зависимости между динамикой ХС-ЛНП и офисного САД. Было также достигнуто постепенное (на 4 мм рт.ст. к 3 мес., p=0,03) и устойчивое (+0,1 мм рт.ст., p=1) снижение офисного диастолического АД, составившее на момент окончания наблюдения 77±9 мм рт.ст. Показатели частоты сердечных сокращений остались неизменными спустя 12 мес. (69 vs 66 уд./мин к концу наблюдения, р=0,06), так же как и домашние показатели диастолического АД (p=0,79).
В течение всех 12 мес. пациенты активно пользовались встроенным сервисом удаленных консультаций. При этом количество запросов, поступающих от пациентов, значимо увеличивалось: если спустя 1 мес. медиана вопросов составляла 7 (4;11), то к третьему месяцу их было 23 (15;39), а к концу наблюдения — 111 (70;175). Максимальное количество вопросов за все время наблюдения было 377, минимальное — 33. Однако от врача пациенту поступало еще больше сообщений (медиана от 13 сообщений в 1 мес. и 143 — к концу наблюдения нарастающим итогом). Основными направлениями консультаций, как и ранее, стали жалобы по поводу основного или сопутствующих заболеваний, уточняющие вопросы по симптомам-предвестникам (64%); по назначенному лечению (26%) или обследованию (10%). Стоит отметить, что итоговое количество проведенных консультаций к моменту визита 3 и 12 мес. (отраженное количеством отправленных пациентом и врачом друг другу сообщений) не повлияло на динамику ХС-ЛНП.
Показатели качества жизни, оцениваемые по эмоциональной подшкале опросника HeartQoL, оказались к концу наблюдения значимо выше (2,5 vs 2,8 баллов, p=0,004). Однако отсутствие динамики по физической подшкале (2,4 vs 2,5 баллов, p=0,5) привело к нивелированию общего эффекта, поэтому усредненный балл оказался практически таким же, как и в начале наблюдения (2,3 vs 2,5 баллов, p=0,1).
За время проведения исследования не зарегистрировано смертельных исходов, 28 (33%) пациентам (с двух- и трехсосудистым поражением коронарного русла или без оптимального результата индексной реваскуляризации) были выполнены эндоваскулярные вмешательства по поводу реваскуляризации ранее пораженных ОКС-несвязанных коронарных артерий, двоим из них — в экстренном порядке из-за развития нестабильной (прогрессирующей) стенокардии напряжения. По остальным количественным или качественным параметрам (включая ∆ХС-ЛНП) эти пациенты не отличались от общей группы. Также плановая реваскуляризация потребовалась 4 пациентам, исключенным на разных этапах исследования, и не включенным в окончательный анализ.
Безопасность лечения оставалась на высоком уровне. Ни одному из пациентов не была отменена или на длительный срок приостановлена липидснижающая терапия. Мышечных симптомов не наблюдалось. Изменений в показателях печеночных трансаминаз, а также гликемии натощак отмечено не было. Вновь выявленных случаев сахарного диабета за время наблюдения пациентов выявлено не было.
Пациенты высоко оценили функциональность интегрированного телемедицинского решения: средний балл по анкете удовлетворенности программой находился на отметке в 9,76 баллов. По сравнению с промежуточным визитом балльная оценка вопроса о готовности рекомендовать схожую программу другим пациентам значимо выросла с 8,84 до 9,63 баллов (+0,8 баллов, 95% ДИ 0,15; 1,44).
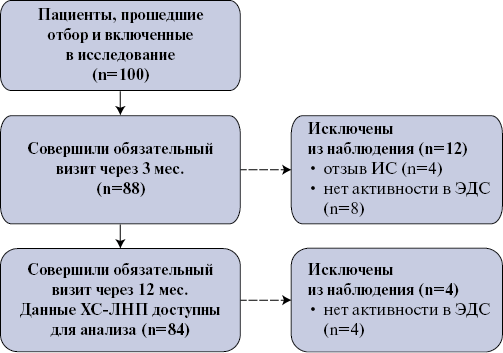
Рис. 1. Ход исследования (диаграмма CONSORT).
Сокращения: ИС — информированное согласие, ХС-ЛНП — холестерин липопротеидов низкой плотности, ЭДС — электронный дневник самоконтроля.
Таблица 1
Базовая клинико-демографическая характеристика
|
Параметр |
Показатель |
|
Параметр |
Показатель |
|
Возраст (годы) (Me, Q1;Q3) |
56 (50;61) |
|
Мужской пол (n, %) |
70 (83%) |
|
Пациент включен в исследование <۱ мес. после ОКС (n, %) |
32 (38%) |
|
Наследственный анамнез ранних ССО (n, %) |
38 (45%) |
|
Активный курильщик (n, %) |
23 (27%) |
|
Соблюдение гиполипидемической диеты (n, %) |
6 (7%) |
|
Гиподинамия (n, %) |
68 (81%) |
|
ИМТ (кг/м2) |
28,3 (26,2;30,5) |
|
САД (мм рт.ст.) |
135±17 |
|
ДАД (мм рт.ст.) |
82±10 |
|
ЧСС (уд./мин) (Me, Q1;Q3) |
70±۱۰ |
|
Усредненный балл по опроснику HeartQol 9 (Me, Q1;Q3) — Физический компонент (Me, Q1;Q3) — Эмоциональный компонент (Me, Q1;Q3) |
2,2 (1,8;2,6) 2,3 (1,7;2,7) 2,5 (1,5;2,8) |
|
Сопутствующая патология |
|
|
Артериальная гипертензия (n, %) |
83 (99%) |
|
Сахарный диабет тип 2 (n, %) |
10 (12%) |
|
Ожирение (n, %) |
26 (31%) |
|
Хроническая сердечная недостаточность (n, %) — Фракция выброса левого желудочка (٪) (Me, Q1;Q3) |
18 (21%) 55 (46;60) |
|
Перенесенное острое нарушение мозгового кровообращения (n, %) |
4 (5%) |
|
Доказанный факт атеросклероза брахиоцефальных артерий (n, %) |
28 (33%) |
|
Доказанный факт атеросклероза артерий нижних конечностей (n, %) |
2 (2%) |
|
Хроническая болезнь почек (n, %) |
1 (1%) |
|
Особенности заболевания |
|
|
Клинический вариант ОКС при поступлении: — нестабильная стенокардия |
40 (48%) |
|
— ОКСпST |
30 (35%) |
|
— ОКСбпST |
14 (17%) |
|
Инфаркт миокарда с формированием зубца Q |
30 (39%) |
|
ОКС как дебют заболевания (n, %) |
53 (63%) |
|
Известный анамнез ИБС до госпитализации (n, %) |
32 (38%) |
|
Перенесенный в прошлом инфаркт миокарда (n, %) |
15 (18%) |
|
Известный анамнез перенесенной реваскуляризации миокарда (n, %) |
15 (18%) |
|
Лабораторные показатели |
|
|
рСКФ (по формуле CKD-EPI), мл/мин/1,73 м2 |
87,3±16,9 |
|
Глюкоза венозной крови натощак (ммоль/л) (Me, Q1;Q3) |
5,8 (5,4;6,4) |
|
Общий холестерин сыворотки (ммоль/л) (Me, Q1;Q3) |
5,22 (4,62;6,03) |
|
ХС-ЛНП (ммоль/л) (Me, Q1;Q3) |
3,47 (2,81;4,20) |
|
ХС-ЛВП (ммоль/л) (Me, Q1;Q3) |
1,02 (0,88;1,15) |
|
Триглицериды (ммоль/л) (Me, Q1;Q3) |
1,67 (1,27;2,06) |
|
ХС-ЛОНП (ммоль/л) (Me, Q1;Q3) |
0,77 (0,58;0,96) |
|
Особенности исходной терапии |
|
|
Статины (n, %) |
84 (100%) |
|
Эзетимиб (n, %) |
5 (6%) |
|
Фибраты (n, %) |
7 (8%) |
|
Ингибиторы АПФ (n, %) |
58 (69%) |
|
Блокаторы рецепторов ангиотензина II (n, %) |
22 (26%) |
|
Диуретики (n, %) |
22 (26%) |
|
β-адреноблокаторы (n, %) |
82 (98%) |
|
Блокаторы медленных кальциевых каналов (n, %) |
20 (24%) |
|
Пероральная сахароснижающая терапия (n, %) — Метформин (n, %) |
11 (13%) 9 (11%) |
|
Двойная антитромботическая терапия (n, %) |
82 (98%) |
|
Тройная антитромботическая терапия (n, %) |
2 (2%) |
Сокращения: АПФ — ангиотензинпревращающий фермент, ДАД — офисное диастолическое артериальное давление, ИБС — ишемическая болезнь сердца, ИМТ — индекс массы тела, ОКС — острый коронарный синдром, ОКСбпST — острый коронарный синдром без подъема сегмента ST, ОКСпST — острый коронарный синдром с подъемом сегмента ST, рСКФ — расчетная скорость клубочковой фильтрации, САД — офисное систолическое артериальное давление, ССО — сердечно-сосудистое осложнение, ХСН — хроническая сердечная недостаточность, ЧСС — частота сердечных сокращений, ХС-ЛВП — холестерин липопротеидов высокой плотности, ХС-ЛНП — холестерин липопротеидов низкой плотности, ХС-ЛОНП — холестерин липопротеидов очень низкой плотности.

Рис. 2. Динамика усредненных значений ХС-ЛНП на момент включения, через 3 и 12 мес.
Сокращение: ХС-ЛНП — холестерин липопротеидов низкой плотности.
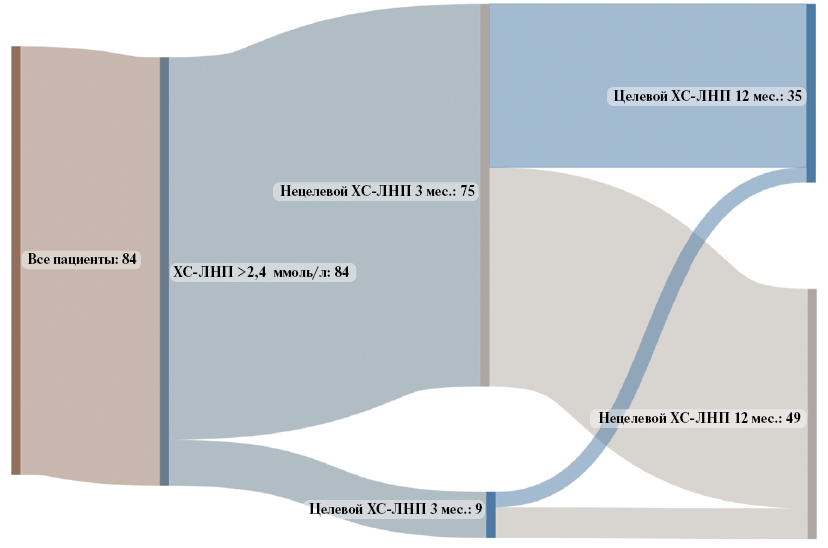
Рис. 3. Межгрупповые переходы пациентов в зависимости от факта достижения целевых показателей ХС-ЛНП на разных этапах проведения исследования (диаграмма Sankey).
Сокращение: ХС-ЛНП — холестерин липопротеидов низкой плотности.
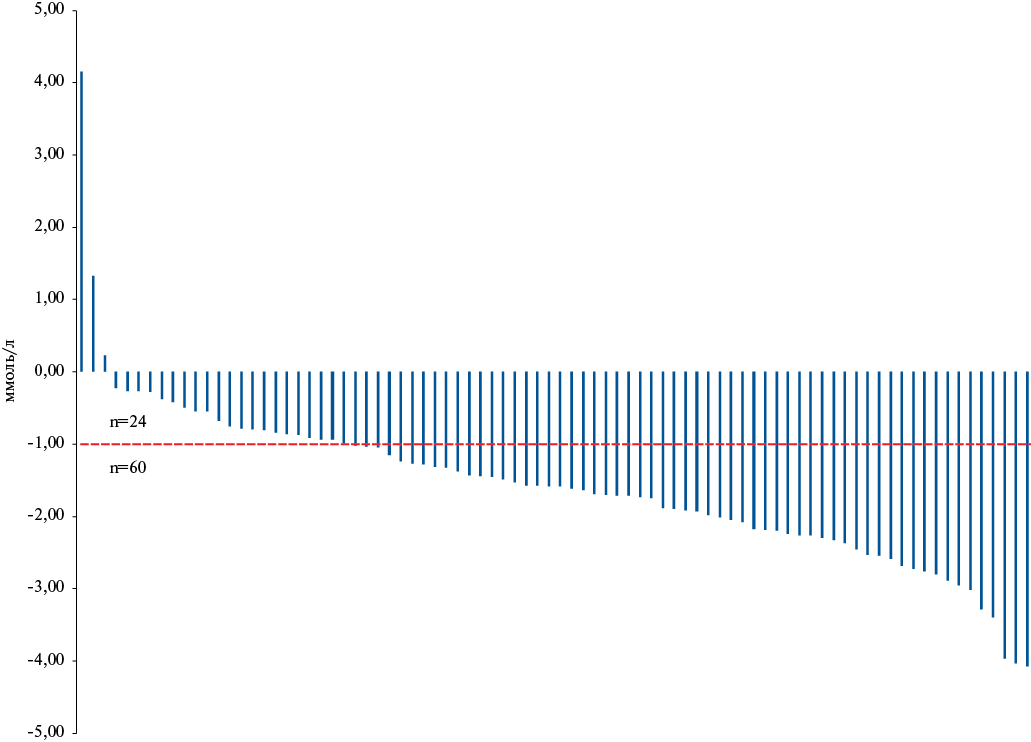
Рис. 4. Дельта (начальный-финальный результаты) ХС-ЛНП.
Примечание: пунктирной линией показан клинически значимый порог снижения ХС-ЛНП в 1,0 ммоль/л, ассоциированный с 21-38% снижением риска ССО у пациентов, перенесших ОКС [16].
Сокращения: ОКС — острый коронарный синдром, ССО — сердечно-сосудистое осложнение, ХС-ЛНП — холестерин липопротеидов низкой плотности.
Обсуждение
Несомненно, кардиореабилитация пациента с ОКС начинается уже во время пребывания в палате интенсивной терапии. Однако действительно трудным этапом и для пациента, и для системы здравоохранения является амбулаторный [17]. Участие в программах кардиологической реабилитации в рамках диспансерного наблюдения — важный компонент профилактики повторных сердечно-сосудистых событий, обеспечивающий контроль ФР, приверженность медикаментозной терапии и повышение качества жизни пациентов.
Своевременное выявление пациентов, нуждающихся в интенсификации гиполипидемической терапии, зависит от систематического контроля показателей липидного спектра. Четкий порядок оценки лабораторных показателей описан и в Европейских [18] и в Национальных [19] клинических рекомендациях. Для выполнение этих рекомендаций необходимо преодолеть терапевтическую инертность и повысить приверженность пациентов. Опубликован ряд исследований, подтверждающих закономерность: чем чаще проводился лабораторный контроль, тем чаще увеличивались дозы липидснижающих препаратов [20]. Помимо этого, частый мониторинг липидов связан с лекарственным комплайнсом [21][22]. В отличие от контролируемых условий, частота мониторинга липидограммы ограничена в повседневной практике. Поэтому ТМ — практичный инструмент для преодоления существующих барьеров. Однако стоит учитывать, что опубликованные научные данные о применимости ТМ могут быть ограничены длительностью проведения исследований и выбором суррогатных конечных точек. Ярким примером является исследование MyCor (Myokardinfarkt und Koronarstent Programm in Tirol) [23], в котором по истечении 4,5 мес. ТМ наблюдения 25 пациентов с ИБС с передачей витальных показателей были отмечены определенные преимущества в отношении изменения образа жизни и повышения приверженности лечению, но не была продемонстрирована связь с ССО. Результаты нашего, более долгосрочного исследования, показали еще одно доказательство связи между приверженностью к совместному мониторингу АД и липидного спектра и отдаленными клиническими результатами. Телеметрическая передача ключевых витальных и лабораторных параметров, телеконсультирование обеспечивают "бесшовный" и непрерывный процесс реабилитации, способствуя повышению приверженности пациентов к контролю ключевых ФР и снижению терапевтической инертности [24].
Результаты внедренной нами интегрированной программы годичного наблюдения пациентов зрелого возраста после ОКС свидетельствуют о значительном улучшении показателей липидограммы, особенно, у больных приверженных к своевременному внесению данных и при раннем начале активной поддержки от врача. Кроме этого, изменения лабораторных показателей произошли у большинства пациентов значительно позже первых 12 нед. наблюдения. Наряду с этим показатели АД, наоборот, улучшились именно на первоначальном этапе реабилитации (что отразилось на количестве пациентов с контролируемой АГ). Исследуемый тип программы положительно воспринят пациентами, их эмоциональное состояние значительно улучшилось к концу наблюдения.
Окончательные результаты подтвердили ранее полученные данные в отношении динамики ХС-ЛНП: наблюдалось последовательное и значимое снижение показателя вплоть до окончательного визита. Результаты метаанализа 4 рандомизированных клинических исследований (РКИ), включивших пациентов со стабильной ИБС, которые использовали ТМ программу, подтвердили снижение показателей ХС-ЛНП по сравнению с исходными [25]. Число пациентов с целевым ХС-ЛНП значимо увеличилось по сравнению с промежуточным визитом. Здесь можно привести в пример 12-мес. исследование Dorje T, et al., в котором участвовали 312 пациентов (61 год, 81% мужчин) с ИБС после плановой реваскуляризации. В группе пациентов, которые использовали мобильное приложение с рекомендациями по изменению образа жизни, контролю ФР, и возможностью телеконсультаций, значимое, по сравнению и начальным, снижение ХС-ЛНП было достигнуто только к концу наблюдения, но не через 6 мес. [26]. Наши результаты, а также описанные выше примеры говорят о том, что следует рассмотреть возможность расширения временных рамок непрерывного участия пациентов с ОКС в программах кардиореабилитации, и не ограничиваться текущими рекомендациями в 8-12 нед. [27]. Вдобавок к проведённым исследованиям, крупный метаанализ 30 небольших РКИ (n=7283) показал эффективность ТМ-программ на целый ряд ФР, среди которых был и уровень ХС-ЛНП, но только в среднесрочной и в долгосрочной перспективе [28]. В противовес этому стоит сказать, что если ТМ-программы нацелены на повышение контролируемости АГ у пациентов, недавно перенесших ОКС, то рекомендуемая на данный момент продолжительность активного сопровождения обоснована: в первые 3 мес. удается стабилизировать показатели АД и добиться контроля АГ у большинства больных. В этом ключе нынешнее исследование совпадает с результатами ранее проведенного нашей группой ТМ-вмешательства у пациентов умеренного-высокого риска с неконтролируемой АГ [29].
Окончательный анализ данных, полученных в процессе реализации программы, еще раз подчёркивает важность тесного взаимодействия между врачом и пациентом, особенно, в случае реализации мер вторичной профилактики. Пациенты, подавляющее большинство из которых не испытывали трудностей с ТМ приложением, активно пользовались всем доступным функционалом непосредственно после установки приложения, что подтверждается достаточно большим количеством запросов на консультации в первый месяц. Однако еще более важным стало активное участие врача в этих диалогах. Врачи отправили больше сообщений пациентам на всех оцениваемых временных точках (в среднем на 30 сообщений на 1 пациента за год), и это напрямую повлияло на степень снижения ХС-ЛНП в долгосрочной перспективе (в среднем снижение ХС-ЛНП на 0,04 ммоль/л при отправке одного дополнительного сообщения пациенту). Поэтому мы считаем, что возможность телеконсультаций критична для разрабатываемых ТМ приложений. В одном из РКИ с участием пациентов после ОКС (СМС-сообщения) через 12 мес. в активной группе ХС-ЛНП стал значительно ниже исходного уровня, однако степень снижения между группами была незначимой, говоря об отсутствии эффекта от подобного вида односторонней консультативной помощи [30]. Снижения уровня атерогенных липидов не наблюдалось и в РКИ CHAT (Cardiovascular Health And Text messaging), где в качестве меры дополнительной поддержки пациентов также использовались СМС-сообщения [31]. Опыт пациента, который участвует в программе ТМ реабилитации, не только напрямую зависит от удобства программного продукта, но и от самого процесса получения помощи. В небольшом РКИ (78 пациентов, перенесших ОКС), участники сообщали, что разработанная для них программа (контроль ритма сердца, других физиологических данных; образовательные и сеансы "спроси эксперта"; чат с медсестрой или специалистом по лечебной физкультуре и диетологом) — доступна, удобна и эффективна. Показатели общего холестерина сыворотки и качество рациона питания также улучшились к концу наблюдения [32].
Несмотря на то, что мы не выявили статистически значимой связи между количеством сообщений, которыми обменялись врач и пациент в процессе лечения, и степенью приверженности последнего, можно предположить если и не улучшение, то по крайней мере обеспечение стабильно высокого ее уровня у 64 пациентов к ведению ЭДС. Хотя проблема приверженности хорошо известна особенно у пациентов, участвующих в программах первичной профилактики (прежде всего, АГ) [33], факт комплайнса становится критически важным у пациентов, перенесших ОКС, напрямую влияя на заболеваемость и смертность [34]. Данные проведенных исследований с ТМ программами приверженности, однако, противоречивы: в исследовании TEXTMEDS (Text Messages to Improve Medication Adherence and Secondary Prevention After Acute Coronary Syndrome) телефонные звонки или СМС-сообщения не привели к значимому повышению приверженности к проводимой терапии, хотя и оказали умеренный эффект на характеристики изменения образа жизни [35]. С другой стороны, в РКИ Text4Heart (СМС-сообщения и вебсайт) показан ощутимый эффект по повышению приверженности и к терапии и поведенческие изменения через 3 мес. после начала проекта; с другой стороны, эффект не был стойким, нивелируясь к 6 мес. наблюдения [36].
Хотя в отличие от окончательной ∆АД, нами не было зарегистрировано значимого снижения показателя через 3 мес. наблюдения, прирост участников с контролируемой АГ был наиболее ощутим именно на первом этапе реализации программы. Здесь стоит заметить факт того, что у более чем половины пациентов на момент включения уровень АД находился ниже порогового (<140 мм рт.ст.). Причины этому могут быть в адекватно подобранной терапии еще на этапе стационарного лечения, а также сниженной интенсивности физической нагрузки в первые недели после перенесенного события. Однако при грамотно построенной программе наблюдения удалось не только не "потерять", но увеличить количество контролируемых гипертензивных пациентов. Интересен факт отсутствия какой-либо динамики показателей домашнего САД за весь период наблюдения. Это дает основания предполагать высокую распространенность феномена "белого халата" в этой группе. Тем не менее, согласно клиническим рекомендациям по ведению пациентов с АГ, даже при условии наличия АГ "белого халата", таким пациентам (т.е. очень высокого риска) необходимо продолжение интенсивной антигипертензивной терапии [37]. Кроме этого, в отсутствие возможности подтверждения факта контролируемости АГ с помощью суточного мониторирования АД, возрастает важность структурированного и длительного самоконтроля АД. Тем более что за счет организации самоконтроля гемодинамических параметров, объединенного с телеметрической передачей данных, удалось добиться снижения лабораторных показателей. Упоминавшееся исследование MyCor [23] здесь можно еще раз привести в пример: регулярная передача данных АД не всегда линейно взаимосвязана с ∆ показателя, но может влиять на иные параметры (такие как увеличение физической активности и прочее). Хотя усредненные значения домашнего АД оказались идентичными на разных этапах оценки, динамика офисного АД заставляет задуматься о дополнительных параметрах вариабельности АД и кумулятивного АД, недавно вновь оказавшихся на научной авансцене [38]. Как было показано в нашем недавнем исследовании, доля измерений домашнего САД в рамках условного терапевтического диапазона, превышающая 50%, хотя и в незначительной степени согласуется с конвенциональными целями лечения, но является значимым независимым предиктором устойчивого контроля АГ [39]. Более того, в большинстве проектов по активному наблюдению пациентов с ИБС, при использовании ТМ решений отмечалось значимое снижение показателей АД через 6 или 12 мес. наблюдения [26, 30]. Учитывая полученные нами результаты, в дальнейших исследования стоит уделять внимания более обоснованным с научной точки зрения методам контроля АД (суточное мониторирование) и при невозможности его выполнения — оценивать дополнительные кумулятивные параметры домашнего АД, такие как время нахождения или долю измерений в целевом диапазоне.
Самооценка качества жизни пациентами на момент включения соответствовала таковым в российской популяции больных, перенесших ИМ, в валидационном исследовании опросника HeartQoL [14]. Хотя значимой динамики по усредненному баллу всех вопросов не отметилось, эмоциональный фон пациентов к концу 12 мес. наблюдения стал значительно более позитивным. В РКИ MoodCare с ТМ поддержкой (структурированное наблюдение пациентов с телефонными сессиями и веб-порталом для врача) среди пациентов после ОКС с депрессивными симптомами, был достигнут заметный прогресс в улучшении психологических симптомов [40]. Схожего эффекта удалось достичь той же исследовательской группе, но уже используя ТМ решение для снижения тревожности у пациентов, перенесших инфаркт миокарда [41]. Проекты, в которых изучалась экономическая эффективность телереабилитации у пациентов после ОКС, оказались успешны, однако значимых изменений качества жизни, оцениваемого по опросникам EuroQoL-5D, не было [42][43].
Ограничения исследования. У данного исследования есть очевидные ограничения. Во-первых, это отсутствие группы сравнения, во-вторых — небольшой объем выборки наблюдаемых, довольно высокий уровень выпадения участников. Также мы напрямую не оценивали приверженность к проводимой терапии (к примеру, опросники или подсчет таблеток), однако стоит отметить, что даже суррогатный маркер приверженности в виде оценки степени правильности и регулярности заполнения ЭДС продемонстрировал свою важность для прогнозирования эффективности лечения.
В то же время длительность ведения этой особой группы пациентов, тщательная оценка взаимосвязи различных параметров, дополнительных пациент-ори-
ентированных конечных точек, на наш взгляд являются преимуществами проведенного исследования.
Заключение
Показана эффективность комбинированного типа оказания медицинской помощи (с интеграцией телемониторинга) у пациентов после перенесенного ОКС. Систематический, длительный мониторинг АД и обе-
спечение активной консультативной поддержки от медицинских специалистов способствует дополнительному динамическому контролю показателей липидного спектра, своевременной коррекции гиполипидемической терапии с достижением целевого уровня ХС-ЛНП. Большая часть пациентов не испытывала трудностей при использовании программы, и готова рекомендовать такой путь наблюдения другим пациентам. Данное исследование — первый и гипотеза-образующий опыт. Следует продолжать изучение интегрированного лечебного подхода у пациентов с другими сердечно-сосудистыми событиями, в идеале, в рамках РКИ.
Благодарности. Авторский коллектив выражает благодарность Орбеладзе Н. В., клиническому ординатору очной формы обучения по специальности "кардиология" ФГБУ "НМИЦ им. В. А. Алмазова" Минздрава России, за помощь в отборе пациентов, а также Ходыревой А. А., врачу-методисту ФГБУ "НМИЦ им. В. А. Алмазова" Минздрава России, за помощь в подготовке базы данных для проведения анализа пациент-ориентированных конечных точек.
Отношения и деятельность. Материал подготовлен в рамках Договора о сотрудничестве между ФГБУ "НМИЦ им. В. А. Алмазова" Минздрава России и АО "Санофи Россия" от 18.04.2019г. Сбор и анализ данных в проекте с последующей их публикацией осуществляется ФГБУ "НМИЦ им. В. А. Алмазова" Минздрава России независимо и без участия компании Санофи.
Приложение
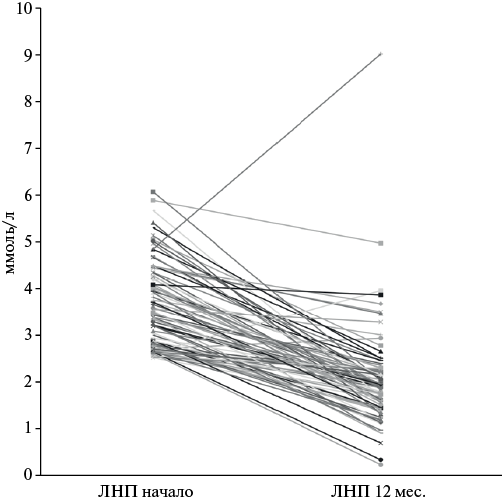
Рис. П1. Линейная диаграмма, отражающая индивидуальную динамику показателей ХС-ЛНП.
Сокращение: ЛНП — липопротеиды низкой плотности.

Рис. П2. Динамика усредненных трехмесячных показателей домашнего САД.
Сокращение: САД — систолическое артериальное давление.
Список литературы
1. Zafeiropoulos S, Farmakis I, Kartas A, et al. Risk for Recurrent Cardiovascular Events and Expected Risk Reduction With Optimal Treatment 1 Year After an Acute Coronary Syndrome. Am J Cardiol. 2020;133:7-14. doi:10.1016/j.amjcard.2020.07.046.
2. Kotseva K, Wood D, De Bacquer D, et al. EUROASPIRE IV: A European Society of Cardiology survey on the lifestyle, risk factor and therapeutic management of coronary patients from 24 European countries. Eur J Prev Cardiol. 2016;23:636-48. doi:10.1177/2047487315569401.
3. Hoedemaker NPG, Damman P, Ottervanger JP, et al. Trends in optimal medical therapy prescription and mortality after admission for acute coronary syndrome: a 9-year experience in a real-world setting. Eur Heart J Cardiovasc Pharmacother. 2018;4:102-10. doi:10.1093/ehjcvp/pvy005.
4. Butalia S, Lee-Krueger RCW, McBrien KA, et al. Barriers and Facilitators to Using Statins: A Qualitative Study With Patients and Family Physicians. CJC Open. 2020;2:530-8. doi:10.1016/j.cjco.2020.07.002.
5. Jernberg T, Hasvold P, Henriksson M, et al. Cardiovascular risk in post-myocardial infarction patients: nationwide real world data demonstrate the importance of a long-term perspective. Eur Heart J. 2015;36:1163-70. doi:10.1093/eurheartj/ehu505.
6. Eijsvogels TMH, Maessen MFH, Bakker EA, et al. Association of Cardiac Rehabilitation With All-Cause Mortality Among Patients With Cardiovascular Disease in the Netherlands. JAMA Netw Open. 2020;3:e2011686. doi:10.1001/jamanetworkopen.2020.11686.
7. Rauch B, Davos CH, Doherty P, et al. The prognostic effect of cardiac rehabilitation in the era of acute revascularisation and statin therapy: A systematic review and meta-analysis of randomized and non-randomized studies — The Cardiac Rehabilitation Outcome Study (CROS). Eur J Prev Cardiol. 2016;23:1914-39. doi:10.1177/2047487316671181.
8. West RR, Jones DA, Henderson AH. Rehabilitation after myocardial infarction trial (RAMIT): multi-centre randomised controlled trial of comprehensive cardiac rehabilitation in patients following acute myocardial infarction. Heart Br Card Soc. 2012;98:637-44. doi:10.1136/heartjnl-2011-300302.
9. Ионов М. В., Конради А. О. Телемедицинское наблюдение пациентов с артериальной гипертензией: кому, как и как долго? Артериальная Гипертензия. 2022;28(2):108-25. doi:10.18705/1607-419X-2022-28-2-108-125.
10. Мареев Ю. В., Зинченко А. О., Мясников Р. П. и др. Применение телеметрии у больных с хронической сердечной недостаточностью. Кардиология. 2019;59(9S):4-15. doi:10.18087/cardio.n530.
11. Khan NA, Stergiou GS, Omboni S, et al. Virtual management of hypertension: lessons from the COVID-19 pandemic-International Society of Hypertension position paper endorsed by the World Hypertension League and European Society of Hypertension. J Hypertens. 2022;40:1435-48. doi:10.1097/HJH.0000000000003205.
12. Павлюк Е. И., Ионов М. В., Алиева А. С. и др. Интегрированное решение для пациентов очень высокого сердечно-сосудистого риска. Обоснование и дизайн пилотного исследования. Российский кардиологический журнал. 2021;26(7):4608. doi:10.15829/1560-4071-2021-4608.
13. Usova EI, Ionov MV, Alieva AS, et al. An integrated approach for very high cardiovascular risk patients. Intermediate results. Russian Journal of Cardiology. 2022;27(1):4839. (In Russ.) Усова Е. И., Ионов М. В., Алиева А. С. и др. Интегрированное решение для пациентов очень высокого сердечно-сосудистого риска. Промежуточные результаты. Российский кардиологический журнал. 2022;27(1):4839. doi:10.15829/1560-4071-2022-4839.
14. Pogosova NV, Boycharov IH, Sokolova OYu, Vygodin VA. The New European Questionnaire for Assessment of Quality of Life of Patients With Ischemic Heart Disease: HeartQoL. Kardiologiia. 2016;56(8):66-72. (In Russ.) Погосова Н. В., Байчоров И. Х., Соколова О. Ю., Выгодин В. А. Новый европейский опросник HeartQol для оценки качества жизни больных ишемической болезнью сердца. Кардиология. 2016;56(8):66-72.
15. Messerli FH, Bangalore S, Schmieder RE. Wilder’s principle: pre-treatment value determines post-treatment response. Eur Heart J. 2015;36:576-9. doi:10.1093/eurheartj/ehu467.
16. Mihaylova B, Emberson J, Blackwell L, et al. The effects of lowering LDL cholesterol with statin therapy in people at low risk of vascular disease: meta-analysis of individual data from 27 randomised trials. Lancet Lond Engl. 2012;380:581-90. doi:10.1016/S0140-6736(12)60367-5.
17. Sunamura M, ter Hoeve N, van den Berg-Emons HJG, et al. OPTImal CArdiac REhablitation (OPTICARE) following Acute Coronary Syndromes: Rationale and design of a randomised, controlled trial to investigate the benefits of expanded educational and behavioural intervention programs. Neth Heart J. 2013;21:324-30. doi:10.1007/s12471-013-0422-y.
18. Mach F, Baigent C, Catapano AL, et al. 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk: The Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and European Atherosclerosis Society (EAS). European Heart Journal. 2020;41(1):111-88. doi:10.1093/eurheartj/ehz455.
19. Кухарчук В. В., Ежов М. В.., Сергиенко И. В. и др. Атеросклероз и дислипидемии. Диагностика и коррекция нарушений липидного обмена с целью профилактики и лечения атеросклероза. Российские рекомендации, VII пересмотр. 2020;1(38):7-42. doi:10.34687/2219-8202.JAD.2020.01.0002.
20. Jia X, Ramsey DJ, Rifai MA, et al. Impact of Lipid Monitoring on Treatment Intensification of Cholesterol Lowering Therapies (from the Veterans Affairs Healthcare System). Am J Cardiol. 2020;125(6):874-9. doi:10.1016/j.amjcard.2019.12.030.
21. Jia X, Al Rifai M, Ramsey DJ, et al. Association Between Lipid Testing and Statin Adherence in the Veterans Affairs Health System. Am J Med. 2019;132(9):e693-e700. doi:10.1016/j.amjmed.2019.04.002.
22. Tran C, Vo V, Taylor P, et al. Adherence to lipid monitoring and its impact on treat intensification of LDL-C lowering therapies at an urban academic medical center. J Clin Lipidol. 2022;16(4):491-7. doi:10.1016/j.jacl.2022.05.003.
23. Ammenwerth E, Woess S, Baumgartner C, et al. Evaluation of an Integrated Telemonitoring Surveillance System in Patients with Coronary Heart Disease. Methods Inf Med. 2015;54(5):388-97. doi:10.3414/ME15-02-0002.
24. Visseren FLJ, Mach F, Smulders YM, et al. 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice. Eur Heart J. 2021;42:3227-337. doi:10.1093/eurheartj/ehab484.
25. Xu Y, Ye H, Zhu Y, et al. The efficacy of mobile health in alleviating risk factors related to the occurrence and development of coronary heart disease: A systematic review and meta-analysis. Clin Cardiol. 2021;44:609-19. doi:10.1002/clc.23596.
26. Dorje T, Zhao G, Tso K, et al. Smartphone and social media-based cardiac rehabilitation and secondary prevention in China (SMART-CR/SP): a parallel-group, single-blind, randomised controlled trial. Lancet Digit Health. 2019;1:e363-74. doi:10.1016/S2589-7500(19)30151-7.
27. Барбараш О. Л., Дупляков Д. В., Затейщиков Д. А. и др. Острый коронарный синдром без подъема сегмента ST электрокардиограммы. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(4):4449. doi:10.15829/1560-4071-2021-4449.
28. Jin K, Khonsari S, Gallagher R, et al. Telehealth interventions for the secondary prevention of coronary heart disease: A systematic review and meta-analysis. Eur J Cardiovasc Nurs. 2019;18(4):260-71. doi:10.1177/1474515119826510.
29. Ionov MV, Zhukova OV, Yudina YS, et al. Value-based approach to blood pressure telemonitoring and remote counseling in hypertensive patients. Blood Press. 30(1):20-30. doi:10.1080/08037051.2020.1813015.
30. Blasco A, Carmona M, Fernández-Lozano I, et al. Evaluation of a telemedicine service for the secondary prevention of coronary artery disease. J Cardiopulm Rehabil Prev. 2012;32:25-31. doi:10.1097/HCR.0b013e3182343aa7.
31. Zheng X, Spatz ES, Bai X, et al. Effect of Text Messaging on Risk Factor Management in Patients With Coronary Heart Disease: The CHAT Randomized Clinical Trial. Circ Cardiovasc Qual Outcomes. 2019;12(4):e005616. doi:10.1161/CIRCOUTCOMES.119.005616.
32. Lear SA, Singer J, Banner-Lukaris D, et al. Improving access to cardiac rehabilitation using the internet: a randomized trial. Stud Health Technol Inform. 2015;209:58-66.
33. Lee EKP, Poon P, Yip BHK, et al. Global Burden, Regional Differences, Trends, and Health Consequences of Medication Nonadherence for Hypertension During 2010 to 2020: A Meta‐Analysis Involving 27 Million Patients. J Am Heart Assoc. 2022;11:e026582. doi:10.1161/JAHA.122.026582.
34. Ho PM, Spertus JA, Masoudi FA, et al. Impact of medication therapy discontinuation on mortality after myocardial infarction. Arch Intern Med. 2006;166:1842-7. doi:10.1001/archinte.166.17.1842.
35. Chow CK, Klimis H, Thiagalingam A, et al. Text Messages to Improve Medication Adherence and Secondary Prevention After Acute Coronary Syndrome: The TEXTMEDS Randomized Clinical Trial. Circulation. 2022;145:1443-55. doi:10.1161/CIRCULATIONAHA.121.056161.
36. Pfaeffli Dale L, Whittaker R, Jiang Y, et al. Text Message and Internet Support for Coronary Heart Disease Self-Management: Results From the Text4Heart Randomized Controlled Trial. J Med Internet Res. 2015;17:e237. doi:10.2196/jmir.4944.
37. Williams B, Mancia G, Spiering W, et al. 2018 ESC/ESH Guidelines for the management of arterial hypertension. Eur Heart J. 2018;39:3021-104. doi:10.1093/eurheartj/ehy339.
38. Schutte AE, Gnanenthiran SR. Toward a Better Understanding of Why Cumulative Blood Pressure Is Such a Strong Predictor of Cardiovascular Outcomes. Hypertens Dallas Tex 1979. 2021;78:1267-9. doi:10.1161/HYPERTENSIONAHA.121.18156.
39. Ionov M, Usova E, Egorov M, et al. Home blood pressure in target range as an additional therapeutic goal in hypertensive patients: a telemonitoring-based analysis. Connect Health. 2022;1:101-11. doi:10.20517/ch.2022.12.
40. O’Neil A, Taylor B, Sanderson K, et al. Efficacy and feasibility of a tele-health intervention for acute coronary syndrome patients with depression: results of the "MoodCare" randomized controlled trial. Ann Behav Med Publ Soc Behav Med. 2014;48:163-74. doi:10.1007/s12160-014-9592-0.
41. O’Neil A, Hawkes AL, Atherton JJ, et al. Telephone-delivered health coaching improves anxiety outcomes after myocardial infarction: the "ProActive Heart" trial. Eur J Prev Cardiol. 2014;21:30-8. doi:10.1177/2047487312460515.
42. Brouwers RWM, van der Poort EKJ, Kemps HMC, et al. Cost-effectiveness of Cardiac Telerehabilitation With Relapse Prevention for the Treatment of Patients With Coronary Artery Disease in the Netherlands. JAMA Netw Open. 2021;4:e2136652. doi:10.1001/jamanetworkopen.2021.36652.
43. Bhardwaj V, Spaulding EM, Marvel FA, et al. Cost-effectiveness of a Digital Health Intervention for Acute Myocardial Infarction Recovery. Med Care. 2021;59:1023-30. doi:10.1097/MLR.0000000000001636.
Об авторах
Е. И. УсоваРоссия
Врач-кардиолог, младший научный сотрудник НИЛ нарушений липидного обмена и атеросклероза.
Санкт-Петербург
Конфликт интересов:
нет
М. В. Ионов
Россия
Врач-кардиолог, кандидат медицинских наук, научный сотрудник НИЛ патогенеза и терапии артериальной гипертензии Института сердца и сосудов.
Санкт-Петербург
Конфликт интересов:
нет
А. С. Алиева
Россия
Врач-кардиолог, кандидат медицинских наук, зав. НИЛ нарушений липидного обмена и атеросклероза НЦМУ "Центр персонализированной медицины", руководитель Центра Атеросклероза и нарушений липидного обмена.
Санкт-Петербург
Конфликт интересов:
нет
Н. Г. Авдонина
Россия
Врач-кардиолог, заведующий отделом информационного обеспечения и телемедицины.
Санкт-Петербург
Конфликт интересов:
нет
А. Н. Яковлев
Россия
Кандидат медицинских наук, начальник службы по развитию регионального здравоохранения Управления по реализации федеральных проектов, зав. НИЛ технологий прогнозирования риска развития сердечно-сосудистых осложнений НЦМУ "Центр персонализированной медицины", доцент кафедры факультетской терапии Лечебного факультета Института медицинского образования.
Санкт-Петербург
Конфликт интересов:
нет
Н. Э. Звартау
Россия
Кандидат медицинских наук, доцент, заместитель генерального директора по работе с регионами, доцент кафедры факультетской терапии Лечебного факультета Института медицинского образования.
Санкт-Петербург
Конфликт интересов:
нет
Рецензия
Для цитирования:
Усова Е.И., Ионов М.В., Алиева А.С., Авдонина Н.Г., Яковлев А.Н., Звартау Н.Э. Интегрированное решение для пациентов очень высокого сердечно-сосудистого риска. Окончательные результаты. Российский кардиологический журнал. 2023;28(2):5358. https://doi.org/10.15829/1560-4071-2023-5358
For citation:
Usova E.I., Ionov M.V., Alieva A.S., Avdonina N.G., Yakovlev A.N., Zvartau N.E. Integrated solution for patients of a very high cardiovascular risk. Final results. Russian Journal of Cardiology. 2023;28(2):5358. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5358
JATS XML

















































