Перейти к:
Оценка деформации левого предсердия с помощью спекл-трекинг эхокардиографии для прогнозирования послеоперационной фибрилляции предсердий после коронарного шунтирования: систематический обзор и метаанализ
https://doi.org/10.15829/1560-4071-2023-5349
Аннотация
Цель. Исследование направлено на проведение систематического обзора и метаанализа с целью изучения прогностической роли оценки деформации левого предсердия (ЛП) с помощью спекл-трекинг эхокардиографии (STE) для прогнозирования впервые возникшей послеоперационной фибрилляции предсердий (ПОФП) у пациентов, перенесших коронарное шунтирование (КШ).
Материал и методы. Мы провели поиск в базах данных PubMed (Medline) и Google Scholar для исследований, в которых изучались показатели деформации ЛП, полученные с помощью STE в качестве предикторов ПОФП у пациентов после КШ. Для определения разницы средневзвешенных показателей деформации ЛП был проведен анализ показателей глобальной деформации ЛП, показателей деформации ЛП в фазу резервуара (PALS — peak atrial longitudinal strain), кондуита (LACS — left atrial conduit strain) и сокращения (LACtS — left atrial contractile strain). Значения отношения шансов (ОШ) были извлечены из многофакторных моделей, сообщающих об ассоциации PALS и ПОФП, и описаны как объединенные оценки с 95% доверительными интервалами (ДИ).
Результаты. Для данного систематического обзора и метаанализа было отобрано 12 исследований из 404 публикаций. Всего в анализ было включено 1093 пациента, средний возраст составил 60,5 лет. Метаанализ показал, что пациенты с ПОФП имели более низкие значения показателей глобальной деформации ЛП, чем у пациентов без развития ПОФП (разница средневзвешенных значений — 5,03%; 95% ДИ: от -6,89 до -3,16; p<0,001). Кроме того, пациенты с ПОФП имели более низкие значения показателей деформации ЛП в фазу резервуара (PALS), кондуита (LACS) и сокращения (LACtS). Так, разница средневзвешенных значений составила 9,90% (95% ДИ: от -12,95 до -6,85; p<0,001), 4,17% (95% ДИ: от -6,05 до -2,29; p<0,001) и 6,17% (95% ДИ: от -12,01 до -0,33; р=0,04), соответственно. Более того, по результатам объединенного анализа отношения шансов (ОШ), PALS оказалась независимым предиктором развития ПОФП (ОШ: 0,88 на каждый 1% увеличения PALS; 95% ДИ: 0,82-0,94; p<0,0001).
Заключение. Оценка деформации ЛП с помощью STE обеспечивает важной дополнительной информацией для прогнозирования впервые возникшей ПОФП у пациентов, перенесших изолированное КШ.
Ключевые слова
Для цитирования:
Голухова Е.З., Булаева Н.И., Мрикаев Д.В., Александрова С.А., Кудряшова Е.Н., Джидзалова Д.Х., Моллаева Д.Д., Бердибеков Б.Ш. Оценка деформации левого предсердия с помощью спекл-трекинг эхокардиографии для прогнозирования послеоперационной фибрилляции предсердий после коронарного шунтирования: систематический обзор и метаанализ. Российский кардиологический журнал. 2023;28(7):5349. https://doi.org/10.15829/1560-4071-2023-5349
For citation:
Golukhova E.Z., Bulaeva N.I., Mrikaev D.V., Aleksandrova S.A., Kudryashova E.N., Dzhidzalova D.Kh., Mollaeva D.D., Berdibekov B.Sh. Evaluation of left atrial strain using speckle-tracking echocardiography to predict postoperative atrial fibrillation after coronary artery bypass grafting: a systematic review and meta-analysis. Russian Journal of Cardiology. 2023;28(7):5349. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5349
Фибрилляция предсердий (ФП) является наиболее частой аритмией после операций на сердце у взрослых, составляя примерно 80% послеоперационных аритмий. Частота ФП в послеоперационном периоде колеблется от 15% до 40% [1].
Патогенез послеоперационной ФП (ПОФП) является многофакторным и связан как с основным субстратом в предсердиях (включая структурно-функциональные особенности предсердий), так и влиянием острого воспаления, окислительного стресса, ассоциированных с хирургическим вмешательством на сердце [2][3].
ПОФП связана с более длительным пребыванием в стационаре и более высокими затратами. Кроме того, несмотря на то, что данная аритмия чаще всего в послеоперационном периоде имеет непродолжительный характер, она ассоциирована с долгосрочными неблагоприятными клиническими исходами, включая инсульт, сердечную недостаточность, повторную госпитализацию и смерть [4][5].
Пожилой возраст, мужской пол, сахарный диабет, систолическая дисфункция левого желудочка (ЛЖ), увеличение длительности пережатия аорты и времени искусственного кровообращения во время операций коронарного шунтирования (КШ) являются одними из основных факторов риска, повышающих вероятность развития ПОФП. Продолжается поиск адекватных маркеров прогнозирования риска ПОФП, в т.ч. с помощью предоперационной оценки структурно-функциональных изменений левого предсердия (ЛП).
Тканевая миокардиальная допплер-эхокардиография (ЭхоКГ) (TDI — tissue doppler imaging) и спекл-трекинг ЭхоКГ (STE — speckle tracking echocardiography) используются чаще всего для оценки функции ЛП. Однако технология STE в отличие от TDI в большей степени не зависит от угла сканирования и направления движения миокарда. Оценка деформации миокарда с помощью STE основана на технологии отслеживания движения пятен серой шкалы в двухмерном изображении. При этом величина деформации (положительная или отрицательная деформация) выражается в процентах (%). Положительные значения деформации описывают утолщение, отрицательные значения описывают укорочение данного сегмента миокарда относительно его исходной длины. В свою очередь, скорость деформации (SR) — это скорость, с которой происходит деформация (деформация за единицу времени), и выражается она в единицах, обратных секунде (сек-1) [6].
Необходимо отметить, что в изображении кривых деформации ЛП большое значение имеет точка, принятая за референтную, а именно — зубец Р или комплекс QRS на электрокардиограмме. При использовании комплекса QRS нулевой точкой является конец диастолы ЛЖ, и пиковая положительная продольная деформация (εs) соответствует фазе накопления ЛП, тогда как деформация во время ранней и поздней диастолы (εe и εa) соответствует фазе протекания и насоса. Как видно из рисунка 1, все показатели деформации предсердий в этом случае имеют положительные значения. Если используется зубец Р, нулевой точкой является конец предсердной диастолы, и первый отрицательный пик продольной деформации (εneg) представляет фазу насоса ЛП, тогда как положительный пик ε (εpos) соответствует фазе протекания, а их абсолютная сумма (εtotal) представляет фазу накопления. При оценке SR во время систолы ЛЖ, ранней и поздней диастолы (SR-S, SR-E, SR-A, соответственно) может быть получена дополнительная информация относительно фазы накопления, протекания и насоса ЛП [7].
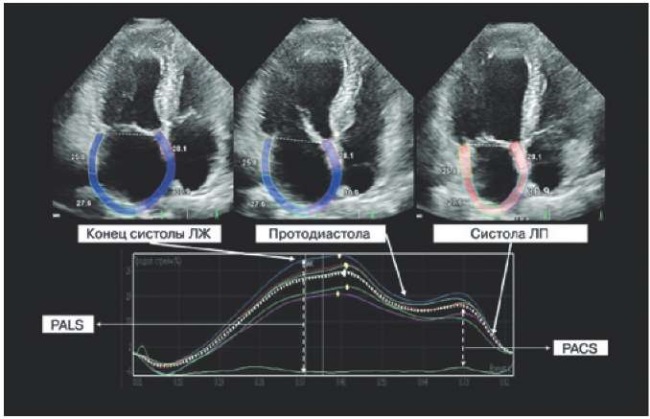
Рис. 1. Оценка деформации ЛП по методу speckle tracking.
Примечание: конец систолы ЛЖ соответствует фазе резервуара,
протодиастола — фазе кондуита, систола ЛП — насосной фазе.
Цветное изображение доступно в электронной версии журнала.
Сокращения: ЛЖ — левый желудочек, ЛП — левое предсердие,
PALS — пиковая продольная деформация левого предсердия,
PACS — пиковая деформация предсердий в фазу сокращения.
Однако в настоящее время использование этих новых эхокардиографических маркеров ПОФП ограничивается только небольшими одноцентровыми обсервационными клиническими исследованиями, с небольшими размерами выборок. В свете этих недостатков мы провели систематический обзор и метаанализ исследований, в которых изучались показатели деформации ЛП, полученные с помощью STE в качестве предикторов ПОФП у пациентов после КШ.
Материал и методы
Поиск публикаций и отбор исследований. Алгоритм поиска информации был разработан в соответствии с требованиями и положениями отчетности для систематических обзоров и метаанализов (PRISMA) в базе данных PubMed (Medline) и Google Scholar. Последний поиск данных для включения в данный анализ был проведен 23 января 2023г. Для поиска исследований в базе данных PubMed мы использовали следующие ключевые слова: ((atrial fibrillation) OR (POAF) OR (atrial fibrillation recurrence) OR (AF recurrence)) AND ((left atrial strain) OR (strain) OR (left atrial function)) AND ((CABG) OR (coronary artery bypass grafting)). Для поиска в базе данных Google Scholar использовали запрос: POAF, atrial fibrillation recurrence, speckle tracking echocardiography, left atrial strain, CABG. Для отбора подходящих исследований для включения в этот систематический обзор и метаанализ двое авторов независимо друг от друга изучили абстракты и полнотекстовые отчеты на соответствие критериям включения.
Критерии включения/исключения. Критериями включения первичных исследований в систематический обзор с последующим метаанализом были: исследования с доступом к полным текстам; все участники были взрослыми (18 лет и старше), которым проводилось КШ; все пациенты должны были иметь синусовый ритм перед операцией; исследования с адекватно представленными исходными данными, главным образом, данными описания предоперационных показателей деформации ЛП по данным STE. Кроме того, основным критерием исключения являлось отсутствие в анамнезе нарушений ритма сердца в виде ФП. Статьи на других языках кроме английского и русского, описания отдельных случаев, доклинические исследования, обзоры и мнения экспертов исключались из метаанализа.
Оценка методологического качества. Качество исследований определялось по шкале оценки качества когортных исследований Ньюкасл-Оттава [8]. Оценка исследований проводилась на основе определения следующих основных критериев: отбор исследовательских групп; сопоставимость групп; и установка интересующего исхода. Все несоответствия устранялись путем обсуждения авторами работы.
Статистический анализ. Статистическая обработка данных выполнялась в программах Review Manager (RevMan), версия 5.4.1 (The Cochrane Collaboration, 2020) и Comprehensive Meta-Analysis 3.0 (Biostat, США). Метаанализ проводился по модели случайных эффектов, с применением метода обратной дисперсии. Графически основные результаты представлены в виде "форест" диаграммы (forest plot). Проверка статистической неоднородности исследований осуществлялась с помощью Q-теста на основе χ2, а также индекса гетерогенности I2. Интерпретация оценки статистической гетерогенности согласно индексу I2 проводилась по рекомендациям Кокрановского сообщества, согласно которому I2 =0-40% соответствует незначительной гетерогенности; 30-60% — умеренной гетерогенности; 50-90% — значительной гетерогенности; 75-100% — высокой гетерогенности. Модель случайных эффектов была принята при Р<0,1 в тесте χ2 и I2 >40%, модель фиксированного эффекта при Р≥0,1 в тесте χ2 и I2 ≤40%. Метаанализ различий средних значений показателей деформации ЛП в исследуемой и контрольной группах выполнялся по данным о средних значениях со стандартными отклонениями с учетом числа исследуемых в сравниваемых группах. В качестве исходных значений для метаанализа также использовались значения скорректированного (полученного для многофакторной модели, adjusted) отношения шансов (ОШ), определенного для изменения пиковой продольной деформации ЛП (PALS — peak atrial longitudinal strain) на 1%. Эффект считался статистически значимым при p<0,05. Оценка публикационного смещения проводилась с помощью визуального осмотра воронкообразных диаграмм (Funnel plot), а также при проведении теста Эггера.
Результаты
Результаты поиска литературы. В результате поиска по ключевым словам в базе данных PubMed и Google Scholar всего найдено 404 публикаций. Число публикаций после удаления дубликатов составило 391. После анализа заголовков и их аннотаций поставленной цели соответствовали 39 публикаций. Наиболее частыми причинами исключения статей были несоответствие поставленной цели, отсутствие заданных данных, а также исключались обзорные статьи, обсуждения и доклады. Полнотекстовый скрининг прошла 21 публикация. Основной причиной исключения публикаций из окончательного анализа после полнотекстового скрининга являлось отсутствие заданных данных оценки деформации ЛП с помощью STE, поскольку в данных исследованиях деформация ЛП оценивалась с помощью TDI [9-14]. Таким образом, окончательно в наш обзор было включено 12 исследований, процесс отбора релевантных исследований показан на рисунке 2.
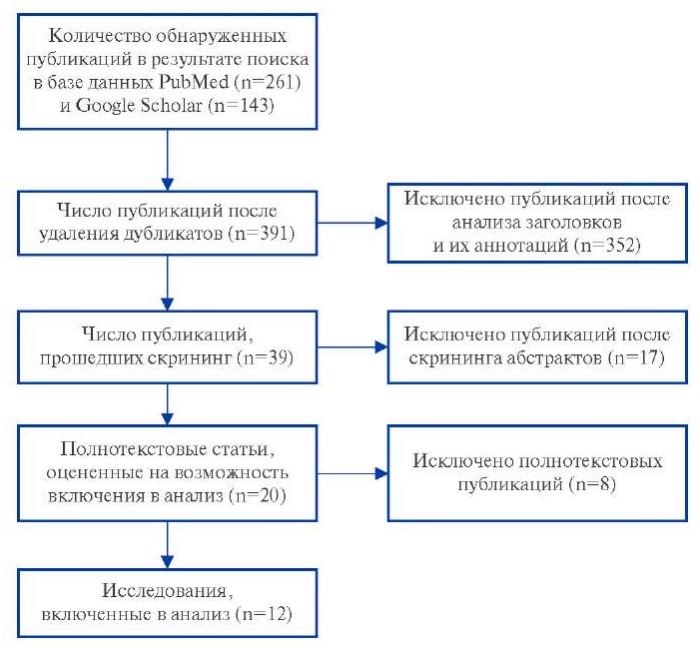
Рис. 2. Блок-схема отбора включенных в обзор исследований.
Общая характеристика исследований
Общее количество перенесших КШ пациентов, включенных в данный анализ, составило — 1093. Всем пациентам перед КШ проводилась оценка деформации ЛП по данным STE. Средний возраст пациентов составил 60,5 лет. Данные об исходных характеристиках пациентов обобщены в таблице 1.
Таблица 1
Синопсис исследований, включенных в систематический обзор
|
Автор, год |
Группы |
Пациенты, n |
Мужчины (%) |
Возраст±SD |
ИМТ (кг/м2) |
АГ (%) |
СД (%) |
ББ |
Статины, % |
Койко-дни в стационаре |
|
Gabrielli, 2011 [15] |
ПОФП (-) |
52 |
73 |
62±2 |
26±2 |
46 |
21 |
NR |
NR |
NR |
|
ПОФП (+) |
18 |
66 |
70±2 |
25±2 |
50 |
27 |
NR |
NR |
NR |
|
|
Her, 2013 [16] |
ПОФП (-) |
40 |
NR |
64±10 |
24±2 |
14 (35) |
7 (18) |
32 (80) |
33 (83) |
16,0±9,0 |
|
ПОФП (+) |
13 |
NR |
71±5 |
24±3 |
5 (38) |
6 (46) |
11 (85) |
10 (77) |
17,3±6,0 |
|
|
Başaran, 2016 [17] |
ПОФП (-) |
67 |
82 |
58,7±10,1 |
NR |
37 |
25 |
91 |
NR |
NR |
|
ПОФП (+) |
23 |
69 |
64,3±7,4 |
NR |
43 |
26 |
60 |
NR |
NR |
|
|
Ozben, 2016 [18] |
ПОФП (-) |
35 |
31 (88,6) |
60,5±9,2 |
NR |
34 (97,1) |
17 (48,6) |
34 (97,1) |
17 (48,6) |
NR |
|
ПОФП (+) |
13 |
8 (61,5) |
64,5±7,7 |
NR |
13 (100) |
8 (61,5) |
12 (92,3) |
6 (46,2) |
NR |
|
|
Rizvi, 2020 [19] |
ПОФП (-) |
56 |
16 (66,7) |
67,3±10,7 |
NR |
43 (76,7) |
26 (46,4) |
56 (100) |
NR |
NR |
|
ПОФП (+) |
34 |
24 (77,4) |
72,4±10,8 |
NR |
28 (82,3) |
15 (44,1) |
34 (100) |
NR |
NR |
|
|
Kislitsina, 2020 [20] |
ПОФП (-) |
47 |
42 (89) |
66,1±9,3 |
28,9±5,0 |
NR |
NR |
NR |
NR |
5 [4-6] |
|
ПОФП (+) |
47 |
42 (89) |
66,3±9,3 |
28,5±5,0 |
NR |
NR |
NR |
NR |
6 [5-8] |
|
|
Mohamed Sabry, 2020 [21] |
ПОФП (-) |
78 |
52 (66,66) |
54,5±6,7 |
28,8±0,97 |
52 (66,66) |
44 (56,41) |
44 (56,41) |
78 (100) |
NR |
|
ПОФП (+) |
22 |
16 (72,72) |
65,3±5,3 |
28,8±0,83 |
17 (77,27) |
12 (54,54) |
9 (40,90) |
22 (100) |
NR |
|
|
Rukmani, 2021 [22] |
ПОФП (-) |
152 |
NR |
58,4±9,74 |
NR |
NR |
NR |
NR |
NR |
NR |
|
ПОФП (+) |
48 |
NR |
68,5±9,05 |
NR |
NR |
NR |
NR |
NR |
NR |
|
|
Abdelrazek, 2021 [23] |
ПОФП (-) |
61 |
40 (65,6) |
55,0±6,4 |
31,5±4,1 |
38 (62,3) |
28 (45,9) |
50 (82) |
46 (75,4) |
10,4±2,3 |
|
ПОФП (+) |
28 |
18 (64,3) |
58,7±9,2 |
33,0±3,1 |
20 (71,4) |
18 (64,3) |
20 (71,4) |
19 (67,9) |
11,5±1,8 |
|
|
Darweesh, 2021 [24] |
ПОФП (-) |
60 |
68 |
56,6±7,0 |
30,5±3,1 |
NR |
NR |
NR |
NR |
NR |
|
ПОФП (+) |
24 |
61,0±5,9 |
29,9±2,28 |
NR |
NR |
NR |
NR |
NR |
||
|
Ganaev, 2022 [25] |
ПОФП (-) |
50 |
42 (84) |
63,2±8,4 |
28,0±3,2 |
45 (90) |
15 (30) |
NR |
NR |
NR |
|
ПОФП (+) |
20 |
14 (70) |
66,9±7,7 |
28,0±2,8 |
17 (85) |
7 (35) |
NR |
NR |
NR |
|
|
Doshmangir, 2022 [26] |
ПОФП (-) |
81 |
66 (81,5) |
59,14±10,8 |
NR |
55 (67,9) |
23 (28,4) |
75 (92,6) |
76 (93,8) |
15,41±4,88 |
|
ПОФП (+) |
24 |
19 (79,2) |
64,04±9,2 |
NR |
19 (79,2) |
10 (41,7) |
21 (87,5) |
22 (91,7) |
17,58±6,11 |
Сокращения: АГ — артериальная гипертензия,
ББ — бета-блокаторы, ИМТ — индекс массы тела,
ПОФП — послеоперационная фибрилляция предсердий,
СД — сахарный диабет.
Эхокардиографические данные
ЭхоКГ получали на ультразвуковых системах экспертного класса (General Electric, PHILIPS и Toshiba). В большинстве исследований (5 исследований) постобработка данных проводилась на рабочих станциях EchoPAC (GE) [15-18][25], в двух исследованиях Philips Q lab 10 software [23][24] и в одном исследовании Toshiba Analysis Software [19], позволяющих проводить автономный полуавтоматический анализ изображений. Деформация миокарда ЛЖ оценивалась с помощью 2D и 3D технологии STE. Основные характеристики ЭхоКГ оборудования и программного обеспечения представлены в таблице 2. Данные результатов ЭхоКГ-параметров представлены в таблице 3 и 4.
Таблица 2
Характеристика (спецификация) ультразвукового оборудования
|
Исследование (первый автор) |
УЗ система |
Рабочая станция |
Частота кадров, кадр/сек |
|
Gabrielli, 2011 [15] |
VIVID 7, GE |
EchoPAC; GE Healthcare |
NR |
|
Her, 2013 [16] |
VIVID 7, GE |
EchoPAC; GE Healthcare |
>60 |
|
Başaran, 2016 [17] |
VIVID 7, GE |
EchoPAC; GE Healthcare |
>40 |
|
Ozben, 2016 [18] |
VIVID 7, GE |
EchoPAC; GE Healthcare |
NR |
|
Rizvi, 2020 [19] |
Toshiba |
Toshiba Analysis Software |
NR |
|
Kislitsina, 2020 [20] |
NR |
NR |
NR |
|
Mohamed Sabry, 2020 [21] |
Philips iE33 |
NR |
50-90 |
|
Rukmani, 2021 [22] |
NR |
NR |
NR |
|
Abdelrazek, 2021 [23] |
Philips iE33 |
Philips Q lab 10 software |
NR |
|
Darweesh, 2021 [24] |
Philips EPIQ 7 |
Philips Q lab 10 software |
60-80 |
|
Ganaev, 2022 [25] |
VIVID Е9, GE |
EchoPAC; GE Healthcare |
NR |
|
Doshmangir, 2022 [26] |
Philips EPIQ 7 |
NR |
60-80 |
Сокращение: УЗ — ультразвуковая.
Таблица 3
Характеристика ЭхоКГ-параметров
|
Автор, год |
Группы |
ФВЛЖ, % |
ИММЛЖ (г/м2) |
E/A |
ИОЛП (мл/м2) |
E/e´ |
|
Gabrielli, 2011 [15] |
ПОФП (-) |
65±6 |
120±5 |
1,0±0,1 |
23±1 |
1,1±1 |
|
ПОФП (+) |
61±4 |
128±8 |
1,4±0,1 |
30±4 |
1,5±2 |
|
|
Her, 2013 [16] |
ПОФП (-) |
56,4±14,5 |
111,0±18,6 |
0,8±0,3 |
27,3±7,2 |
14,0±4,2 |
|
ПОФП (+) |
63,5±10,8 |
97,5±23,3 |
0,7±0,1 |
32,6±5,1 |
12,4±3,3 |
|
|
Başaran, 2016 [17] |
ПОФП (-) |
63,0 [ 50,1-72,2] |
26,4±8,4 |
NR |
NR |
NR |
|
ПОФП (+) |
62,0 [ 55,4-70,5] |
34±11,3 |
NR |
NR |
NR |
|
|
Ozben, 2016 [18] |
ПОФП (-) |
56,6±5,9 |
NR |
0,90±0,29 |
32,6±9,0 |
8,6±2,7 |
|
ПОФП (+) |
54,5±5,8 |
NR |
0,91±0,47 |
41,1±9,2 |
10,2±1,7 |
|
|
Rizvi, 2020 [19] |
ПОФП (-) |
58,3±9,4 |
NR |
1,18±0,80 |
33,39±10,69 |
NR |
|
ПОФП (+) |
55,4±11,5 |
NR |
1,04±0,42 |
35,56±12,43 |
NR |
|
|
Kislitsina, 2020 [20] |
ПОФП (-) |
55,3±11,3 |
NR |
NR |
24,9±9,9 |
9,6±2,9 |
|
ПОФП (+) |
59,4±9,4 |
NR |
NR |
29,8±10,5 |
9,8±3,2 |
|
|
Mohamed Sabry, 2020 [21] |
ПОФП (-) |
60±6 |
NR |
NR |
NR |
7,4±2,3 |
|
ПОФП (+) |
56±7 |
NR |
NR |
NR |
9,8±2,1 |
|
|
Rukmani, 2021 [22] |
ПОФП (-) |
NR |
NR |
NR |
NR |
NR |
|
ПОФП (+) |
NR |
NR |
NR |
NR |
NR |
|
|
Abdelrazek, 2021 [23] |
ПОФП (-) |
61,8±7,9 |
NR |
1,07±0,35 |
NR |
10,6±2,8 |
|
ПОФП (+) |
61,5±5,3 |
NR |
0,89±0,38 |
NR |
11,2±3,2 |
|
|
Darweesh, 2021 [24] |
ПОФП (-) |
58,3±7,9 |
110,5±24,6 |
0,98±0,50 |
26,87±6,98 |
8,26±3,02 |
|
ПОФП (+) |
51,2±10,8 |
108,3±22,3 |
1,15±0,44 |
32,22±7,13 |
12,85±3,15 |
|
|
Ganaev, 2022 [25] |
ПОФП (-) |
56,2±6,9 |
NR |
NR |
27,2±2,8 |
NR |
|
ПОФП (+) |
56,2±7,0 |
NR |
NR |
29,1±5,6 |
NR |
|
|
Doshmangir, 2022 [26] |
ПОФП (-) |
49,1±10 |
NR |
0,89±0,41 |
29,1±7,5 |
8,9±2,3 |
|
ПОФП (+) |
46,7±7,6 |
NR |
0,83±0,24 |
33,6±9,0 |
8,9±2,5 |
Сокращения: ИММЛЖ — индекс массы миокарда левого желудочка,
ИОЛП — индексированный объем левого предсердия,
ПОФП — послеоперационная фибрилляция предсердий,
ФВЛЖ — фракция выброса левого желудочка.
Таблица 4
Показатели деформации ЛП,
включенные в систематический обзор публикаций
|
Исследование |
ЭхоКГ параметры деформации ЛП |
ПОФП (-) |
n |
ПОФП (+) |
n |
|
Gabrielli, 2011 [15] |
PALS, % |
24±1 |
52 |
10±1 |
18 |
|
LASRs, sec-1 |
1,2±0,1 |
0,6±0,1 |
|||
|
LASRa, sec-1 |
-1,8±0,1 |
-0,6±0,1 |
|||
|
Her, 2013 [16] |
Глобальная деформация ЛП, % |
36,8±7,6 |
40 |
25,4±10,4 |
13 |
|
LASRs, sec-1 |
1,6±0,8 |
1,2±0,6 |
|||
|
LASRe, sec-1 |
-1,8±0,8 |
-1,4±0,8 |
|||
|
Başaran, 2016 [17] |
LACtS, % |
40,3±12,0 |
67 |
38,6±10,0 |
23 |
|
LACS, % |
25,6±11,5 |
24,1±9,3 |
|||
|
PALS, % |
31,7±9,6 |
24,2±5,8 |
|||
|
Ozben, 2016 [18] |
PALS, % |
30,0±12,8 |
35 |
20,8±6,9 |
13 |
|
LACS, % |
14,6±7,0 |
11,1±3,8 |
|||
|
Rizvi, 2020 [19] |
Глобальная деформация ЛП, % |
10,9±0,93 |
56 |
6,9±0,69 |
34 |
|
Kislitsina, 2020 [20] |
PALS, % |
32,8±11,2 |
47 |
22,9±8,3 |
47 |
|
LACtS, % |
18,5±6,7 |
11,4±5,3 |
|||
|
Mohamed Sabry, 2020 [21] |
Глобальная деформация ЛП, % |
22,1±1,9 |
78 |
20,4±1,7 |
28 |
|
Rukmani, 2021 [22] |
Глобальная деформация ЛП, % |
36,3+4,85 |
162 |
29,7+3,69 |
48 |
|
Abdelrazek, 2021 [23] |
PALS, % |
32,9±5,9 |
61 |
25,6±6,1 |
28 |
|
LASRs, sec-1 |
1,90±0,71 |
1,27±0,56 |
|||
|
LASRe, sec-1 |
-1,69±0,60 |
-1,00±0,45 |
|||
|
LASRa, sec-1 |
-2,21±0,59 |
-1,21±0,48 |
|||
|
Darweesh, 2021 [24] |
PALS, % |
46,91±5,76 |
60 |
30,30±4,95 |
24 |
|
LACS, % |
32,15±4,20 |
27,15±4,09 |
|||
|
LACtS, % |
37,00±3,35 |
23,93±4,19 |
|||
|
Ganaev, 2022 [25] |
PALS, % |
27,8±3,0 |
50 |
20,4±3,1 |
20 |
|
LACS, % |
11,8±1,7 |
8,50±1,5 |
|||
|
LACtS, % |
-1,0±1,0 |
-0,2±0,7 |
|||
|
Doshmangir, 2022 [26] |
PALS, % |
26,97±6,87 |
81 |
20,46±4,27 |
24 |
|
LACtS, % |
14,98±3,68 |
12,76±3,72 |
|||
|
Глобальная деформация ЛП, % |
24,28±6,57 |
17,71±4,11 |
Сокращения: ЛП — левое предсердие, ЛЖ — левый желудочек,
LACS — left atrial conduit strain
(деформация левого предсердия в фазу кондуита),
LACtS — left atrial contractile strain
(деформация левого предсердия в фазу сокращения),
PALS — peak atrial longitudinal strain
(деформация левого предсердия в фазу резервуара),
LASRs — left atrial systolic strain rate
(скорость деформации левого предсердия
во время систолы левого желудочка),
LASRe — left atrial early diastolic strain rate
(скорость деформации левого предсердия
во время ранней диастолы левого желудочка),
LASRa — left atrial late diastolic strain rate
(скорость деформации левого предсердия
во время поздней диастолы левого желудочка).
Глобальная деформация ЛП
Средние значения показателей глобальной деформации ЛП (LA global strain) в зависимости от развития ПОФП были представлены в пяти исследованиях (табл. 4) [16][19][21][22][26]. Общая частота развития ПОФП в данных исследованиях составила 26,0% (147/564 пациентов). Нами был выполнен метаанализ разности средних значений глобальной деформации ЛП у пациентов c развитием ПОФП и без таковой (рис. 3). Как следует из рисунка 3, пациенты с ПОФП имели показатели глобальной деформации ЛП хуже по сравнению с пациентами без ПОФП. Так, средневзвешенная разница значений глобальной деформации ЛП составила — 5,03% (95% доверительный интервал (ДИ): -6,89; -3,16%), данные различия были статистически значимыми (р<0,001). Следует отметить, что при оценке однородности исследований с использованием критерия хи-квадрат Пирсона был получен статистически значимый результат (хи-квадрат Пирсона =61,1 при степени свободы 4, p<0,001); а также индекс гетерогенности I2=93%, что предполагает высокую несогласованность в целом по всем исследованиям и указывает на необходимость осторожной интерпретации объединенной оценки разности средних значений для всех исследований.
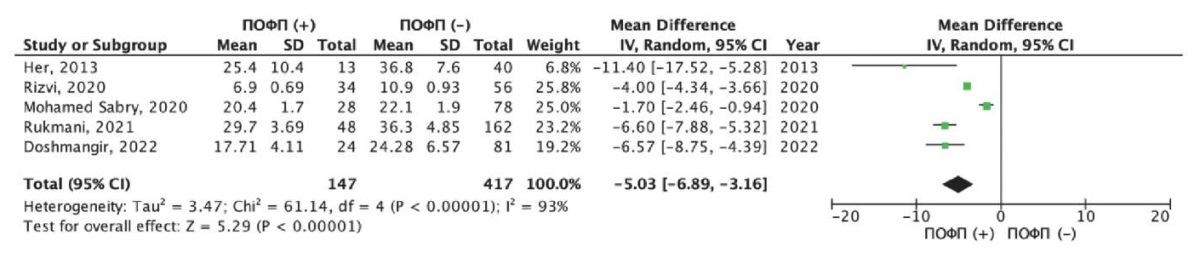
Рис. 3. Результаты метаанализа разности
средних значений глобальной деформации ЛП
в группе с ПОФП и без ПОФП.
Примечание: зеленые квадраты показывают взвешенный размер эффекта
для каждого конкретного исследования
(размер зеленых квадратов соответствует весу исследований),
черные отрезки — 95% ДИ, черный ромб отражает средневзвешенное значение
разности средних значений глобальной деформации ЛП.
Цветное изображение доступно в электронной версии журнала.
Сокращения: ДИ — доверительный интервал, ЛП — левое предсердие,
ПОФП — послеоперационная фибрилляция предсердий.
Деформация ЛП в фазу резервуара
Средние значения показателей деформации ЛП в фазу резервуара или так называемой PALS в зависимости от развития ПОФП были представлены в 8 исследованиях [15][17][18][20][23-26]. Общая частота развития ПОФП в данных исследованиях составила 30,3% (197/650 пациентов). Нами был выполнен метаанализ разности средних значений PALS у пациентов c развитием ПОФП и без таковой (рис. 4). Как следует из рисунка 4, пациенты с ПОФП имели более низкие показатели PALS, по сравнению с пациентами без ПОФП. Так, средневзвешенная разница значений PALS составила — 9,90% (95% ДИ: -12,95; -6,85%), данные различия были статистически значимыми (р<0,001). Следует отметить, что при оценке однородности исследований с использованием критерия хи-квадрат Пирсона был получен статистически значимый результат (хи-квадрат Пирсона =117,3 при степени свободы 7, p<0,001); а также индекс гетерогенности I2=94%, что предполагает высокую несогласованность в целом по всем исследованиям.
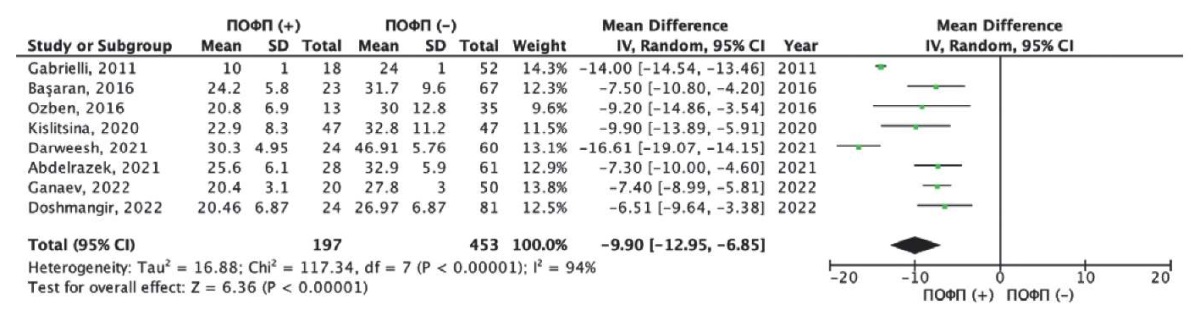
Рис. 4. Результаты метаанализа разности
средних значений PALS в группе с ПОФП и без ПОФП.
Примечание: зеленые квадраты показывают взвешенный размер эффекта
для каждого конкретного исследования
(размер зеленых квадратов соответствует весу исследований),
черные отрезки — 95% ДИ, черный ромб отражает средневзвешенное значение
разности средних значений PALS.
Цветное изображение доступно в электронной версии журнала.
Сокращения: ДИ — доверительный интервал,
ПОФП — послеоперационная фибрилляция предсердий,
PALS — peak atrial longitudinal strain
(деформация левого предсердия в фазу резервуара).
Деформация ЛП в фазу кондуита
Средние значения показателей деформации ЛП в фазу протекания или кондуита (LACS — left atrial conduit strain) в зависимости от развития ПОФП были представлены в четырех исследованиях [17][18][24][25]. Общая частота развития ПОФП в данных исследованиях составила 27,4% (80/292 пациентов). Нами был выполнен метаанализ разности средних значений LACS у пациентов c развитием ПОФП и без таковой (рис. 5). Как следует из рисунка 5, пациенты с ПОФП имели более низкие показатели LACS, по сравнению с пациентами без ПОФП. Так, средневзвешенная разница значений LACS составила — 4,17% (95% ДИ: -6,05; -2,29%), данные различия были статистически значимыми (р<0,001). При оценке однородности исследований с использованием критерия хи-квадрат Пирсона был получен статистически незначимый результат (хи-квадрат Пирсона =7,03 при степени свободы 3, p=0,07); однако индекс гетерогенности I2 составил 57%, что предполагает умеренную несогласованность в целом по всем исследованиям.
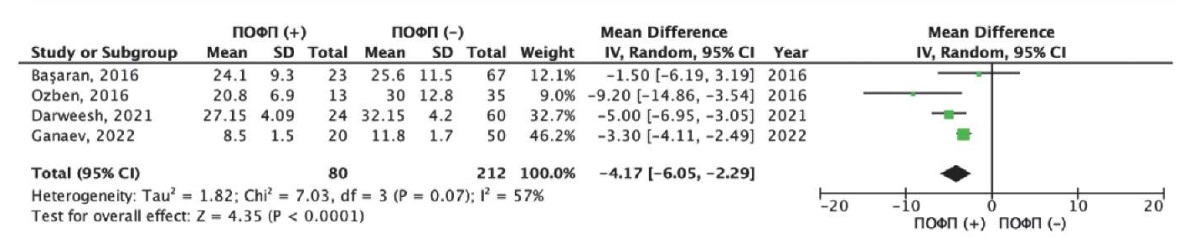
Рис. 5. Результаты метаанализа разности
средних значений LACS в группе с ПОФП и без ПОФП.
Примечание: зеленые квадраты показывают взвешенный размер эффекта
для каждого конкретного исследования
(размер зеленых квадратов соответствует весу исследований),
черные отрезки — 95% ДИ, черный ромб отражает средневзвешенное значение
разности средних значений LACS.
Цветное изображение доступно в электронной версии журнала.
Сокращения: ДИ — доверительный интервал,
ПОФП — послеоперационная фибрилляция предсердий,
LACS — left atrial conduit strain
(деформация левого предсердия в фазу кондуита).
Деформация ЛП в фазу насоса
Средние значения показателей деформации ЛП в фазу насоса или сокращения (LACtS — left atrial contractile strain) в зависимости от развития ПОФП были представлены в четырех исследованиях [17][20][24][26]. Общая частота развития ПОФП в данных исследованиях составила 31,6% (118/373 пациентов). Нами был выполнен метаанализ разности средних значений LACtS у пациентов c развитием ПОФП и без таковой (рис. 6). Как следует из рисунка 6, пациенты с ПОФП имели показатели LACtS хуже по сравнению с пациентами развития ПОФП. Так, средневзвешенная разница LACtS составила — 6,17% (95% ДИ: -12,01; -0,33%), данные различия были статистически значимыми (р=0,04). Однако при оценке однородности исследований с использованием критерия хи-квадрат Пирсона также был получен статистически значимый результат (хи-квадрат Пирсона =75,1 при степени свободы 3, p<0,001); а также индекс гетерогенности I2=96%, что предполагает крайне высокую несогласованность в целом по всем исследованиям и указывает на необходимость осторожной интерпретации объединенной оценки разности средних значений для всех исследований.
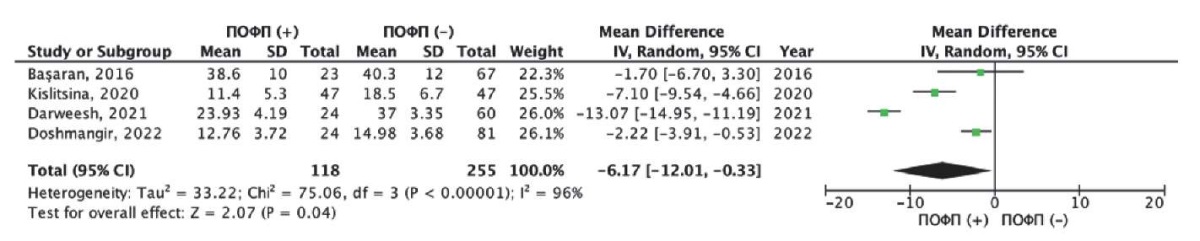
Рис. 6. Результаты метаанализа разности
средних значений LACtS в группе с ПОФП и без ПОФП.
Примечание: зеленые квадраты показывают взвешенный размер эффекта
для каждого конкретного исследования
(размер зеленых квадратов соответствует весу исследований),
черные отрезки — 95% ДИ,
черный ромб отражает средневзвешенное значение
разности средних значений LACtS.
Цветное изображение доступно в электронной версии журнала.
Сокращения: ДИ — доверительный интервал,
ПОФП — послеоперационная фибрилляция предсердий,
LACtS — left atrial contractile strain
(деформация левого предсердия в фазу сокращения).
Роль оценки параметров деформации ЛП для прогнозирования ПОФП после КШ
В большинстве исследований оценка риска ПОФП проводилась при помощи метода логистической регрессии. В таблице 5 отражены данные, полученные в результате многофакторной логистической регрессии в исследованиях, включенных в систематический обзор. В 5 исследованиях представлены данные значений ОШ для PALS в качестве предиктора ПОФП. Общая частота развития ПОФП в данных исследованиях составила 31,7% (135/426 пациентов). Следует отметить, что лишь в 2 исследованиях PALS показала себя в качестве независимого фактора риска развития ПОФП [17][23], однако по результатам объединенного анализа 5 исследований PALS оказалась независимым предиктором развития ПОФП (ОШ: 0,88 на каждый 1% увеличения PALS; 95% ДИ: 0,82-0,94; p<0,0001) (рис. 7). При оценке однородности исследований был получен статистически незначимый результат (Q-value=3,18; df(Q)=4; р=0,529), а также индекс гетерогенности I2=0%, что предполагает низкую гетерогенность включенных в данный анализ исследований.
Таблица 5
Показатели деформации ЛП,
включенные в многофакторную логистическую регрессию
|
Исследование (первый автор) |
Предиктор |
ОШ; 95% ДИ |
Ковариаты в многофакторной модели |
Cut-off |
|
Gabrielli, 2011 [15] |
LASRs, sec-1 |
6,1; 1,3-15,2 |
Объем ЛП; возраст старше 65 лет |
– |
|
LASRa, sec-1 |
2,4; 1,1-19,6 |
– |
||
|
Her, 2013 [16] |
Глобальная деформация ЛП, % |
1,12; 1,00-1,24 |
Возраст; ИОЛП; Mitral E DT |
27,7 |
|
LASRs, sec-1 |
1,09; 0,94-1,20 |
– |
||
|
LASRe, sec-1 |
1,00; 0,90-1,16 |
– |
||
|
Başaran, 2016 [17] |
PALS, % |
0,839; 0,730-0,963 |
Возраст, отсутствие приема ББ, NT-proBNP, ИОЛП, UntwV, LVtw |
– |
|
Ozben, 2016 [18] |
PALS, % |
0,94; 0,83-1,08 |
ИОЛП, ФВЛЖ, фиброз, возраст, женский пол |
– |
|
Rizvi, 2020 [19] |
– |
– |
– |
– |
|
Kislitsina, 2020 [20] |
PALS, % |
0,90; 0,74-1,09 |
Возраст, женский пол, диабет, прием иАПФ, LV-GLS, ФВЛЖ, LACtS, ИОЛП |
– |
|
Mohamed Sabry, 2020 [21] |
Глобальная деформация ЛП, % |
1,111; 1,003-1,230 |
– |
≤23,1 |
|
Rukmani, 2021 [22] |
– |
– |
– |
– |
|
Abdelrazek, 2021 [23] |
PALS |
0,770; 0,627-0,946 |
Возраст, прием нитратов |
≤29,8 |
|
LASRs, sec-1 |
0,855; 0,151-4,829 |
≤1,6 |
||
|
LASRe, sec-1 |
0,434; 0,009-19,856 |
≤-1,36 |
||
|
LASRa, sec-1 |
3,476; 1,207-12,186 |
≤-1,67 |
||
|
Darweesh, 2021 [24] |
– |
– |
Возраст, Mitral E DT, E velocity, LATEF, диаметр ЛП |
– |
|
Ganaev, 2022 [25] |
PALS, % |
– |
– |
23,0 |
|
Doshmangir, 2022 [26] |
PALS, % |
0,90; 0,75-1,07 |
ИОЛП |
– |
|
LACtS, % |
1,23; 0,97-1,57 |
– |
||
|
Глобальная деформация ЛП, % |
0,80; 0,65-0,97 |
– |
Сокращения: ББ — бета-блокаторы, ДИ — доверительный интервал,
ИОЛП — индексированный объем левого предсердия,
иАПФ — ингибиторы ангиотензинпревращающего фермента,
ЛЖ — левый желудочек, ЛП — левое предсердие,
ОШ — отношение шансов, ФВЛЖ — фракция выброса левого желудочка,
DT — deceleration time,
LV-GLS — left ventricular global longitudinal strain,
LACtS — left atrial contractile strain
(деформация левого предсердия в фазу сокращения),
LASRs — left atrial systolic strain rate
(скорость деформации левого предсердия
во время систолы левого желудочка),
LASRe — left atrial early diastolic strain rate
(скорость деформации левого предсердия
во время ранней диастолы левого желудочка),
LASRa — left atrial late diastolic strain rate
(скорость деформации левого предсердия
во время поздней диастолы левого желудочка),
LATEF — LA total emptying fraction,
LVtw — left ventricular twist,
NT-proBNP — N-концевой промозговой натрийуретический пептид,
PALS — peak atrial longitudinal strain
(деформация левого предсердия в фазу резервуара),
UntwV — left ventricular peak untwisting velocity.
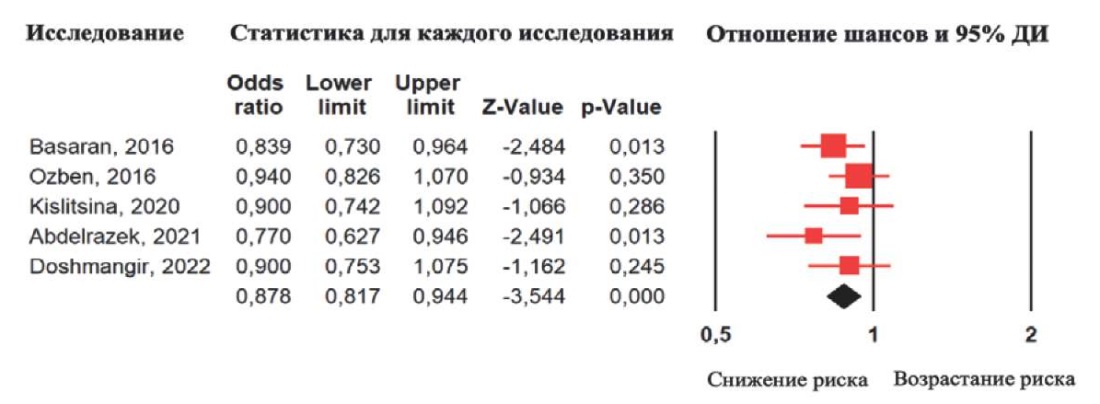
Рис. 7. Результаты метаанализа ОШ развития ПОФП
при увеличении PALS на 1%
по данным многофакторной логистической регрессии.
Примечание: красные квадраты показывают взвешенный размер эффекта
для каждого конкретного исследования
(размер красных квадратов соответствует весу исследований),
красные отрезки — 95% ДИ, чёрный ромб отражает средневзвешенное значение ОШ.
Цветное изображение доступно в электронной версии журнала.
Сокращения: ДИ — доверительный интервал,
PALS — peak atrial longitudinal strain
(деформация левого предсердия в фазу резервуара),
OR — odds ratio (ОШ — отношение шансов).
Оценка публикационного смещения
Для качественной оценки наличия систематической ошибки метаанализа включающих ≥5 исследований были построены воронкообразные диаграммы (Funnel plot). При визуальной оценке воронкообразной диаграммы при анализе разности средних значений (Std diff means) PALS обнаружено наличие выраженной асимметрии (рис. 8 А). Данное заключение было подтверждено количественными результатами теста Эггера: t=5,29; df=6,0; p<0,001. В то время как при оценке воронкообразной диаграммы при анализе значений ОШ (Log odds ratio) наличие выраженной асимметрии обнаружено не было (рис. 8 Б). Данное заключение было также подтверждено количественными результатами теста Эггера: t=0,94; df=3,0; p=0,208. При оценке теста Эггера для глобальной деформации ЛП и LACS также получены статистически незначимые результаты — t=1,45; p=0,12; и t=0,74; p=0,26, соответственно. Однако для LACtS согласно тесту Эггера получен статистически значимый результат t=2,25; p=0,08.
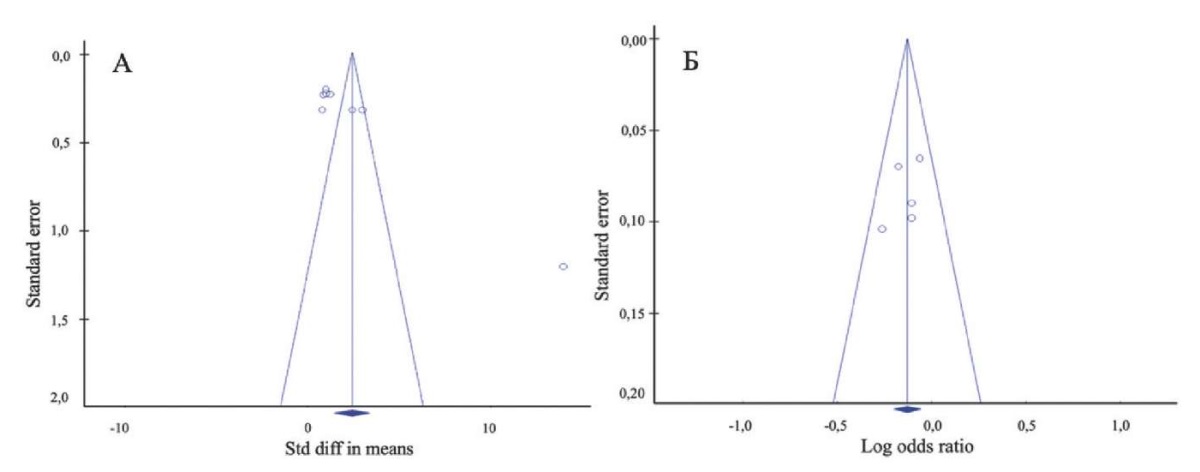
Рис. 8. Воронкообразные диаграммы (Funnel plot)
для оценки систематической ошибки.
Обсуждение
ФП является частым осложнением после операции на сердце, которая может быть ассоциирована с неблагоприятными исходами как в раннем послеоперационном, так и в отдаленном периоде. Текущие данные исследований указывают на то, что сочетание исходных структурно-функциональных изменений предсердий с интраоперационными и послеоперационными факторами способствует инициации ПОФП [3]. Этот каскад событий опосредуется окислительным стрессом в предсердиях, воспалением, фиброзом, апоптозом и электрическим ремоделированием предсердий [2][3]. Многочисленные исследования показывают, что изменения функции ЛП, определяемые с помощью STE, являются полезными инструментами для стратификации риска развития ФП, в т.ч. после КШ [17][23]. Недавний метаанализ показал, что пациенты с ПОФП имели более низкие значения PALS по сравнению с пациентами без ПОФП (19,4% vs 29,1%, соответственно) [27]. Кумулятивный коэффициент Коэна, полученный в результате метаанализа, составил 1,4 (1,0-1,8). Однако в данный метаанализ при оценке PALS было включено лишь 5 исследований, кроме того, в объединенный анализ в данной работе входили и исследования, включающие пациентов как перенесших КШ, так и пациентов, перенесших вмешательства на аортальном и/или митральном клапанах сердца. Насколько нам известно, это первый систематический обзор и метаанализ роли предоперационной оценки деформации ЛП с помощью STE для прогнозирования ПОФП у пациентов, перенесших изолированное КШ. Мы обнаружили, что все основные параметры деформации ЛП, такие как глобальная деформация ЛП, деформация ЛП в фазу резервуара (PALS), кондуита (LACS) и насоса (LACtS), были статистически значимо снижены в группе пациентов с ПОФП. Кроме того, PALS продемонстрировала себя в качестве независимого фактора риска развития ПОФП. Таким образом, оценка параметров деформации ЛП и с помощью STE может использоваться как эффективный инструмент для стратификации риска ПОФП у пациентов, перенесших КШ. Выявление групп пациентов с более высоким риском развития ПОФП после КШ может помочь в разработке профилактических стратегий и адаптации терапии контроля ритма после операций на сердце [28-30].
Ограничения исследования. Во-первых, в наш систематический обзор и метаанализ включено небольшое количество исследований. Кроме того, как и в случае любого метаанализа обсервационных исследований, различия в критериях включения и конечных точках являются потенциальными источниками неоднородности исследований. Во-вторых, существенным недостатком текущего использования STE является разница в аппаратах различных производителей, кроме того, различались соответственно и программные обеспечения для постобработки данных. Требуется расширение возможностей перекрестного сравнения данных, хранящихся в растровом цифровом формате или в формате DICOM от различных фирм производителей ЭхоКГ оборудования и программного обеспечения. Кроме того, как было указано, в изображении кривых деформации ЛП большое значение имеет точка, принятая за референтную, а именно, зубец Р или комплекс QRS на электрокардиограмме. Но в большинстве исследований не были представлены данные о референтной точке, мы при анализе данных исходили из того, что все показатели деформации ЛП в случае использования комплекса QRS в качестве нулевой точки имеют положительные значения, в случае принятия зубца Р в качестве референтной точки фаза насоса ЛП отражается в виде отрицательного пика продольной деформации. Также следует отметить, что для оценки деформации миокарда крайне важное значение имеет качество ЭхоКГ визуализации и соответствующих настроек визуализации (например, частота кадров от 50 до 70 кадров/с). Указанные факторы вероятнее всего и привели к высокой гетерогенности при анализе разности средних значений показателей деформации ЛП.
Заключение
Оценка деформации ЛП с помощью STE обеспечивает важной дополнительной информацией для прогнозирования ПОФП у пациентов, перенесших изолированное КШ. PALS является независимым фактором риска развития ПОФП. Необходимы проспективные многоцентровые исследования с участием большой популяции пациентов, также существует потребность в создании единых протоколов оценки деформации ЛП для обеспечения стандартизации, валидизации полученных результатов и оценки возможности внедрения в практику для принятия клинических решений.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Greenberg JW, Lancaster TS, Schuessler RB, et al. Postoperative atrial fibrillation following cardiac surgery: a persistent complication. Eur J Cardiothorac Surg. 2017;52(4):665-72. doi:10.1093/ejcts/ezx039.
2. Maesen B, Nijs J, Maessen J, et al. Post-operative atrial fibrillation: a maze of mechanisms. Europace. 2012;14(2):159-74. doi:10.1093/europace/eur208.
3. Sánchez FJ, Pueyo E, Diez ER. Strain Echocardiography to Predict Postoperative Atrial Fibrillation. Int J Mol Sci. 2022;23(3):1355. doi:10.3390/ijms23031355.
4. Lin MH, Kamel H, Singer DE, et al. Perioperative/Postoperative Atrial Fibrillation and Risk of Subsequent Stroke and/or Mortality. Stroke. 2019;50(6):1364-71. doi:10.1161/STROKEAHA.118.023921.
5. Eikelboom R, Sanjanwala R, Le ML, et al. Postoperative Atrial Fibrillation After Cardiac Surgery: A Systematic Review and Meta-Analysis. Ann Thorac Surg. 2021;111(2):544-54. doi:10.1016/j.athoracsur.2020.05.104.
6. Сохибназарова В. Х., Саидова М.А., Терещенко С. Н., Белевская А.А. Оценка деформации левого желудочка и левого предсердия, а также ротационных свойств левого желудочка у больных ХСН по данным эхокардиографической технологии недопплеровского изображения миокарда в двумерном и трехмерном режимах. Евразийский Кардиологический Журнал. 2018;(2):4-15.
7. Моллаева Д.Д., Машина Т.В., Мрикаев Д.В. и др. Современные ультразвуковые методы оценки структурно-функциональных изменений левого предсердия у пациентов с фибрилляцией предсердий. Креативная кардиология. 2021;15(1):48-60. doi:10.24022/1997-3187-2021-15-1-48-60.
8. Stang A. Critical evaluation of the Newcastle-Ottawa scale for the assessment of the quality of nonrandomized studies in meta-analyses. Eur J Epidemiol. 2010;25(9):603-5. doi:10.1007/s10654-010-9491-z.
9. Haffajee JA, Lee Y, Alsheikh-Ali AA, et al. Pre-operative left atrial mechanical function predicts risk of atrial fibrillation following cardiac surgery. JACC Cardiovasc Imaging. 2011;4(8):833-40. doi:10.1016/j.jcmg.2011.03.019.
10. Hidayet Ş, Yağmur J, Bayramoğlu A, et al. Prediction of postoperative atrial fibrillation with left atrial mechanical functions and NT-pro ANP levels after coronary artery bypass surgery: A three-dimensional echocardiography study. Echocardiography. 2018;35(5):661-6. doi:10.1111/echo.13833.
11. Parsaee M, Moradi B, Esmaeilzadeh M, et al. New onset atrial fibrillation after coronary artery bypasses grafting; an evaluation of mechanical left atrial function. Arch Iran Med. 2014;17(7):501-6.
12. Tayyareci Y, Yildirimtürk O, Aytekin V, et al. Preoperative left atrial mechanical dysfunction predicts postoperative atrial fibrillation after coronary artery bypass graft operation — a velocity vector imaging-based study. Circ J. 2010;74(10):2109-17. doi:10.1253/circj.cj-10-0197.
13. Verdejo HE, Becerra E, Zalaquet R, et al. Atrial Function Assessed by Speckle Tracking Echocardiography Is a Good Predictor of Postoperative Atrial Fibrillation in Elderly Patients. Echocardiography. 2016;33(2):242-8. doi:10.1111/echo.13059.
14. Sánchez FJ, Gonzalez VA, Farrando M, et al. Atrial Dyssynchrony Measured by Strain Echocardiography as a Marker of Proarrhythmic Remodeling and Oxidative Stress in Cardiac Surgery Patients. Oxid Med Cell Longev. 2020;2020:8895078. doi:10.1155/2020/8895078.
15. Gabrielli L, Corbalan R, Córdova S, et al. Left atrial dysfunction is a predictor of postcoronary artery bypass atrial fibrillation: association of left atrial strain and strain rate assessed by speckle tracking. Echocardiography. 2011;28(10):1104-8. doi:10.1111/j.1540-8175.2011.01518.x.
16. Her AY, Kim JY, Kim YH, et al. Left atrial strain assessed by speckle tracking imaging is related to new-onset atrial fibrillation after coronary artery bypass grafting. Can J Cardiol. 2013;29(3):377-83. doi:10.1016/j.cjca.2012.06.006.
17. Başaran Ö, Tigen K, Gözübüyük G, et al. Predictive role of left atrial and ventricular mechanical function in postoperative atrial fibrillation: a two-dimensional speckletracking echocardiography study. Turk Kardiyol Dern Ars. 2016;44(1):45-52. doi:10.5543/tkda.2015.11354.
18. Ozben B, Akaslan D, Sunbul M, et al. Postoperative Atrial Fibrillation after Coronary Artery Bypass Grafting Surgery: A Two-dimensional Speckle Tracking Echocardiography Study. Heart Lung Circ. 2016;25(10):993-9. doi:10.1016/j.hlc.2016.02.003.
19. Rizvi F, Mirza M, Olet S, et al. Noninvasive biomarker-based risk stratification for development of new onset atrial fibrillation after coronary artery bypass surgery. Int J Cardiol. 2020;307:55-62. doi:10.1016/j.ijcard.2019.12.067.
20. Kislitsina ON, Cox JL, Shah SJ, et al. Preoperative left atrial strain abnormalities are associated with the development of postoperative atrial fibrillation following isolated coronary artery bypass surgery. J Thorac Cardiovasc Surg. 2022;164(3):917-24. doi:10.1016/j.jtcvs.2020.09.130.
21. Mohamed Sabry AS, El-Kader Mansour HA, Abo El-Azm TH, et al. Clinical and Echocardiographic Predictors of Atrial Fibrillation after Coronary Artery Bypass Grafting. J Atr Fibrillation. 2020;13(4):2320. doi:10.4022/jafib.2320.
22. Rukmani Prabha V, Rajeshwari N, Jenifer J. Role of LA strain assessed by speckle tracking echocardiography in predicting patients who develop POAF after a coronary artery bypass surgery. Eur Heart J. 42(S1):328. doi:10.1093/eurheartj/ehab724.0328.
23. Abdelrazek G, Mandour K, Osama M, et al. Strain and strain rate echocardiographic imaging predict occurrence of atrial fibrillation in post-coronary artery bypass grafting patients. Egypt Heart J. 2021;73(1):62. doi:10.1186/s43044-021-00188-z.
24. Darweesh RM, Baghdady YK, El Hossary H, et al. Importance of left atrial mechanical function as a predictor of atrial fibrillation risk following cardiac surgery. Int J Cardiovasc Imaging. 2021;37(6):1863-72. doi:10.1007/s10554-021-02163-w.
25. Ганаев К.Г., Власова Э.Е., Авалян А.А. и др. Первый опыт применения технологии спекл-трекинг эхокардиографии в двумерном режиме для оценки связи нарушения деформации левого предсердия с фибрилляцией предсердий после коронарного шунтирования. Российский кардиологический журнал. 2022;27(7):5026. doi:10.15829/1560-4071-2022-5026.
26. Doshmangir L. Conventional and Two-dimensional Strain Echocardiography in Predicting Postoperative Atrial Fibrillation after Coronary Artery Bypass Grafting Surgery in Shahid Madani Hospital of Tabriz, Iran. J Complement Altern Med Res. 2022;20(2):1-11. doi:10.9734/JOCAMR/2022/v20i2408.
27. Kawczynski MJ, Gilbers M, Van De Walle S, et al. Role of pre-operative transthoracic echocardiography in predicting post-operative atrial fibrillation after cardiac surgery: a systematic review of the literature and meta-analysis. Europace. 2021;23(11):1731-43. doi:10.1093/europace/euab095.
28. Shvartz V, Le T, Enginoev S, et al. Colchicine in Cardiac Surgery: The COCS Randomized Clinical Trial. J Cardiovasc Dev Dis. 2022;9(10):363. doi:10.3390/jcdd9100363.
29. Петракова Е.С., Савина Н.М., Молочков А.В. Фибрилляция предсердий после операций аортокоронарного шунтирования: факторы риска, профилактика и лечение. Кардиология. 2020;60(9):134-48. doi:10.18087/cardio.2020.9.n1074.
30. Джиоева О. Н., Драпкина О. М. Послеоперационная фибрилляция предсердий как фактор риска сердечно-сосудистых осложнений при внесердечных хирургических вмешательствах. Кардиоваскулярная терапия и профилактика. 2020;19(4):2540. doi:10.15829/1728-8800-2020-2540.
Об авторах
Е. З. ГолуховаРоссия
Голухова Елена Зеликовна — академик РАН, доктор медицинских наук, профессор, директор, заведующий кафедрой кардиологии и функциональной диагностики с курсом детской кардиологии
Москва
Н. И. Булаева
Россия
Булаева Наида Ибадулаевна — кандидат биологических наук, старший научный сотрудник, руководитель отдела координации и сопровождения научно-исследовательской деятельности и проведения тематических мероприятий, заведующий лабораторией аритмогенеза, доцент кафедры кардиологии и функциональной диагностики с курсом детской кардиологии
Москва
Д. В. Мрикаев
Россия
Мрикаев Давид Валерьевич — кандидат медицинских наук, научный сотрудник, доцент кафедры кардиологии и функциональной диагностики с курсом детской кардиологии
Москва
С. А. Александрова
Россия
Александрова Светлана Александровна — кандидат медицинских наук, старший научный сотрудник, доцент кафедры кардиологии и функциональной диагностики с курсом детской кардиологии
Москва
Е. Н. Кудряшова
Россия
Кудряшова Елена Николаевна — врач-кардиолог отделения неинвазивной аритмологии и хирургического лечения комбинированной патологии
Москва
Д. Х. Джидзалова
Россия
Джидзалова Диана Хазбиевна — врач-кардиолог отделения неинвазивной аритмологии и хирургического лечения комбинированной патологии, аспирант
Москва
Д. Д. Моллаева
Россия
Моллаева Джамиля Дахировна — врач-кардиолог отделения неинвазивной аритмологии и хирургического лечения комбинированной патологии
Москва
Б. Ш. Бердибеков
Россия
Бердибеков Бектур Шукурбекович — младший научный сотрудник отдела координации и сопровождения научно-исследовательской деятельности и проведения тематических мероприятий, врач-кардиолог отделения неинвазивной аритмологии и хирургического лечения комбинированной патологии
Москва
Дополнительные файлы
Рецензия
Для цитирования:
Голухова Е.З., Булаева Н.И., Мрикаев Д.В., Александрова С.А., Кудряшова Е.Н., Джидзалова Д.Х., Моллаева Д.Д., Бердибеков Б.Ш. Оценка деформации левого предсердия с помощью спекл-трекинг эхокардиографии для прогнозирования послеоперационной фибрилляции предсердий после коронарного шунтирования: систематический обзор и метаанализ. Российский кардиологический журнал. 2023;28(7):5349. https://doi.org/10.15829/1560-4071-2023-5349
For citation:
Golukhova E.Z., Bulaeva N.I., Mrikaev D.V., Aleksandrova S.A., Kudryashova E.N., Dzhidzalova D.Kh., Mollaeva D.D., Berdibekov B.Sh. Evaluation of left atrial strain using speckle-tracking echocardiography to predict postoperative atrial fibrillation after coronary artery bypass grafting: a systematic review and meta-analysis. Russian Journal of Cardiology. 2023;28(7):5349. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5349
JATS XML

















































