Перейти к:
Ремоделирование левых отделов сердца как фактор риска развития фибрилляции предсердий у пациентов после коррекции приобретенных пороков сердца
https://doi.org/10.15829/1560-4071-2023-5323
Аннотация
Цель. Выявить факторы риска фибрилляции предсердий (ФП) у пациентов с аортальными и митральными пороками после хирургической коррекции.
Материал и методы. Обследовано 112 пациентов с аортальными и митральными пороками (за исключением пациентов с митральным стенозом): 90 мужчин и 22 женщины в возрасте от 18 до 72 лет (медиана возраста — 51 (35;57) год). Пациенты обследованы исходно до и после операции (в сроки 8-14 дней и через 12-36 мес.). Пиковый предсердный продольный стрейн (peak atrial longitudinal strain) (PАLS) левого предсердия (ЛП) определялся в резервуарную стадию цикла ЛП. В качестве конечных точек выбраны наличие ФП и трепетания предсердий (ТП) в раннем и отдаленном периоде после операции, повторная госпитализация по поводу нарушений ритма сердца (НРС). Пациенты разделены на группы. Группа 1 — больные с благоприятным прогнозом, группа 2 — больные с ФП и ТП после операции. Средние значения показателей сопоставлялись по критерию Стьюдента (t) для независимых выборок, суммы рангов — по критерию Манна-Уитни (MU), использовался ROC анализ.
Результаты. Исходный индексированный объём ЛП (ИОЛП) >44,4 мл/м2 увеличивал риск развития ФП после операции (AUC =0,6±0,07, р<0,05, относительный риск (RR) =2,34 (доверительный интервал (ДИ): 0,8-6,88). Объёмы ЛП были в пределах нормы в группе без НРС. Снижение исходного порогового уровня PАLS ЛП <27,5% повышало риск развития ФП как в раннем, так и в отдаленном послеоперационном периоде (AUC =0,659±0,08, р<0,01, RR =1,19 (ДИ: 3,38-31,4). В группе ФП PALS снизился после операции и не увеличился в отдаленном периоде (28±7,5% исходно, 19±6,2% после операции, 21±8,3% в отдаленный период (р=0,04 и р=0,23, соответственно)). Фракция выброса левого желудочка влияла на развитие ФП только в раннем периоде после операции (AUC =0,71±0,049, р<0,008, RR =2,21 (ДИ: 1,27-3,87)).
Заключение. На развитие ФП влияли ИОЛП, PALS ЛП, в раннем периоде после операции — фракция выброса.
Ключевые слова
Для цитирования:
Аверина И.И., Мироненко М.Ю., Глушко Л.А., Донаканян С.А., Бокерия Л.А. Ремоделирование левых отделов сердца как фактор риска развития фибрилляции предсердий у пациентов после коррекции приобретенных пороков сердца. Российский кардиологический журнал. 2023;28(7):5323. https://doi.org/10.15829/1560-4071-2023-5323
For citation:
Averina I.I., Mironenko M.Yu., Glushko L.A., Donakanyan S.A., Bokeria L.A. Left heart remodeling as a risk factor for atrial fibrillation in patients after surgery of acquired heart defects. Russian Journal of Cardiology. 2023;28(7):5323. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5323
Структурно-геометрическое ремоделирование левого предсердия (ЛП) с реактивным фиброзом и прогрессирующим увеличением объема в ответ на различные этиологические факторы, приводящие к повышению объёма или давления в ЛП, диастолической (ДД) и систолической дисфункции левого желудочка (ЛЖ), нарушению функции митрального клапана (МК), приводит к формированию синдрома жесткого ЛП, компонентом которого становится длительно существующая фибрилляция предсердий (ФП). Причем от степени ремоделирования ЛП зависят переход ФП в постоянную форму и неэффективность методов поддержания синусового ритма. Тахиформа ФП может вызывать или увеличивать степень сердечной недостаточности (СН), непосредственно влиять на ремоделирование ЛЖ и ЛП.
Миопатия ЛП приводит к нарушению резервуарной, кондуитной и сократительной функции ЛП, потенцируя застой в малом круге, развитие легочной гипертензии, дисфункцию правого желудочка, появление одышки, снижение переносимости нагрузок. В настоящее время для оценки геометрии ЛП используются размеры, объем ЛП: минимальный объем ЛП определяется в начале систолы желудочков (0% интервала R-R сердечного цикла), максимальный объем ЛП определяется в начале протодиастолы желудочков, перед открытием МК (40% интервала R-R сердечного цикла), объем ЛП в начале систолы предсердий определяется в середину диастолы желудочков (75% интервала R-R). Для оценки функции ЛП используется продольная деформация или пиковый предсердный продольный стрейн (peak atrial longitudinal strain) (PАLS) ЛП, измеряемый в резервуарную фазу. Деформация ЛП служит биомаркером наличия исходов сердечно-сосудистых заболеваний, особенно, для пациентов с различными сценариями развития ДД и ФП [1].
По мере снижения деформации ЛП и увеличения объёма растет вероятность аритмий [2][3]. PALS ЛП является важным диагностическим критерием СН с сохранной фракцией выброса (ФВ), начальным проявлением ДД, отражающим нарастание давления в ЛП из-за повышенной жесткости, уменьшение объёма наполнения ЛЖ [1][4][5]. Увеличение индекса объема ЛП коррелирует с фиброзом ЛП, что также влияет на прогноз СН и аритмогенез [6-8].
В настоящее время в НМИЦ ССХ им. А. Н. Бакулева проводится исследование, позволяющее оценить структурно-функциональное ремоделирование ЛП после радиочастотной аблации (РЧА), в т.ч. с применением катетера, чувствительного к силе контакта (smart touch) [9].
По данным исследований, проведенных в нашей стране, не выявлено эффекта обратного ремоделирования ЛП после процедуры РЧА и улучшения показателей деформации ЛП у больных с рецидивом ФП после РЧА [10]. Опираясь на значения параметров механической функции ЛП и отсутствие тромбообразования в ушке ЛП, при сохранении синусового ритма, возможна отмена антикоагулянтной терапии через 6 мес. после вмешательства [11]. В исследовании Табиной А. Е. проведен анализ структурно-функциональных и электрофизиологических особенностей ремоделирования предсердий при пароксизмальной ФП, с незначительно увеличенными размерами ЛП (4,11±0,45 см) и сопутствующими артериальной гипертонией или ишемической болезнью сердца, где было отмечено снижение показателей деформации ЛП по сравнению с группами изолированной ФП и контроля [12].
Таким образом, клиническим проявлением механической и эндокринной дисфункции ЛП становится ФП. PALS ЛП предоставляет количественный объективный показатель функции миокарда, который можно использовать в качестве раннего индикатора или предиктора нарушений ритма, маркера позитивного ремоделирования, прогноза и контроля лечения. Поэтому целью нашего исследования стала оценка ремоделирования (геометрии) и функции ЛП как фактора риска развития ФП у пациентов после коррекции приобретенных пороков сердца.
Материал и методы
Перед обследованием у пациентов были получены добровольные информированные согласия на проведение исследований. Обследовано 112 пациентов с аортальными и митральными пороками (за исключением пациентов с митральным стенозом): 90 мужчин и 22 женщины в возрасте от 14 до 70 лет (медиана возраста — 51 (35;57)). Критерии включения в исследование: пациенты с аортальной недостаточностью 2-4 ст., аортальным стенозом, больные со стенозом и недостаточностью (>1 ст.) аортального клапана, больные с митральной недостаточностью 2-4 ст. Критериями исключения из исследования было наличие у пациентов сопутствующей хронической почечной недостаточности, ишемической болезни сердца, нарушений функции щитовидной железы, противопоказаний к проведению операции с искусственным кровообращением, наличие зафиксированного пароксизма ФП и трепетания предсердий (ТП) в анамнезе >30 сек. Пациентам проводилось протезирование аортального, протезирование или пластика МК, при необходимости пластика трикуспидального клапана.
Всем больным при поступлении проводилось общеклиническое обследование по стандартной методике, рентгенография, электрокардиография (ЭКГ), эхокардиография с тканевым допплером, метод слежения частиц Speckle tracking (ST). Проводилось холтеровское мониторирование ЭКГ, коронаро- и ангиография.
В послеоперационном периоде проводилось наблюдение за ритмом с помощью мониторирования ЭКГ в течение первых 3 сут. после операции, ежедневной регистрации ЭКГ и холтеровского мониторирования ЭКГ на 5-6 сут. после операции и при симптомах аритмии. Нарушения ритма — ФП была зафиксирована на ЭКГ или по данным холтеровского мониторирования продолжительностью >30 сек. в раннем и отдаленном периоде после операции у 33 человек.
Общеклиническое обследование, ЭКГ, эхокардиография с тканевым допплером и ST выполнялись также через 8-14 дней и через 12-36 мес. после хирургической коррекции порока. Анализировался максимальный индексированный объём ЛП (ИОЛП). PАLS ЛП определялся в резервуарную стадию цикла ЛП. В качестве исходов или конечных точек выбраны наличие ФП и ТП в раннем и отдаленном периоде после операции, повторная госпитализация по поводу нарушений ритма сердца (НРС). Пациенты разделены на группы (табл. 1). Группа 1 — больные с благоприятным прогнозом (n=79), группа 2 — больные с ФП и ТП после операции в ранний и отдаленный период (n=33, 29%). Исходно пациенты 2 группы были с синусовым ритмом, ФП после операции была зафиксирована у них впервые.
Таблица 1
Сравнение исходных клинических и эхокардиографических характеристик
у пациентов с благоприятным течением и развитием ФП после операции
|
Параметр |
Благоприятное течение после операции, n=79 (70,5%) |
Послеоперационная ФП, n=33 (29,5%) |
p |
|
Возраст, годы |
43±10 |
50±16 |
0,06 |
|
Женщины, n (%) |
9 (11) |
13 (39) |
0,32 |
|
Артериальная гипертензия, n (%) |
45 (56) |
7 (77) |
0,06 |
|
Сахарный диабет 2 типа, n (%) |
6 (8) |
2 (22) |
0,319 |
|
ФП, n (%) |
0 (0%) |
33 (30%) |
0,03* |
|
ПБЛНПГ, n (%) |
2 (2) |
1 (3) |
0,145 |
|
ФК ХСН |
|||
|
II, n (%) |
25 (31) |
10 (30) |
0,697 |
|
III, n (%) |
42 (53) |
20 (60) |
0,511 |
|
IV, n (%) |
12 (15) |
3 (9) |
0,290 |
|
Недостаточность митрального клапана, n (%) |
6 (8) |
10 (30) |
0,06 |
|
Недостаточность аортального клапана, n (%) |
12 (15) |
11 (33) |
0,16 |
|
Стеноз аортального клапана, n (%) |
27 (34) |
4 (12) |
0,019* |
|
Недостаточность и стеноз аортального клапана, n (%) |
23 (29) |
5 (15) |
0,023* |
|
Данные эхокардиографии |
|||
|
E/e´ МЖП |
14±6,0 |
19±7,0 |
0,05* |
|
Индексированный объем ЛП, мл/м2 |
34±16,0 |
50±29 |
0,01* |
|
ММЛЖ, г/м2 |
292±111 |
301±106 |
0,7 |
|
GLSt ЛЖ, % |
-12,9±4,5 |
-12,7±4,1 |
0,9 |
|
ФВ ЛЖ, % |
63±9,0 |
60±10,0 |
0,08 |
|
Легочная гипертензия, n (%) |
13 (16) |
5 (15) |
0,23 |
|
PALS, % |
37,5±11,7% |
28±9,9% |
0,004* |
|
Интраоперационные данные |
|||
|
Время ИК, мин |
123,0±43 |
132,0±39 |
0,4 |
|
Время пережатия аорты, мин |
77±22 |
75±25 |
0,7 |
|
Антеградная перфузия, n (%) |
19 (24) |
12 (36) |
0,629 |
|
Ретроградная перфузия, n (%) |
43 (54) |
15 (45) |
0,464 |
|
Смешанная перфузия, n (%) |
2(3) |
2 (6) |
0,737 |
|
Клиника после операции |
|||
|
Продленное пребывание в ОРИТ после операции, n (%) |
2 (3) |
5 (15) |
0,018* |
|
Одышка после операции, n (%) |
1 (1) |
3 (9) |
0,011* |
|
Повторная госпитализация, n (%) |
4 (5) |
17 (51) |
<0,001* |
Примечание: данные представлены в виде M±SD, где M — среднее значение, SD — стандартное отклонение, и в виде n (%), где n — число больных. * — p<0,05 — различия статистически достоверны.
Сокращения: ИК — искусственное кровообращение, ЛЖ — левый желудочек, ЛП — левое предсердие, ММЛЖ — масса миокарда левого желудочка, ОРИТ — отделение реанимации и интенсивной терапии, ПБЛНПГ — полая блокада левой ножки пучка Гиса, ФВ — фракция выброса, ФК ХСН — функциональный класс хронической сердечной недостаточности, ФП — фибрилляция предсердий, МЖП — межжелудочковая перегородка, E/е´ МЖП — отношение скорости митрального потока к скорости движения митрального кольца в области межжелудочковой перегородки, GLSt ЛЖ — глобальная продольная деформация левого желудочка, PALS — пиковый предсердный продольный стрейн.
Ультразвуковое исследование проводилось на аппарате "Vivid 7" фирмы General Electric (США) и на системе эхокардиографии iE33 фирмы Philips двумя специалистами. Метод 2D отслеживания частиц (2D Speckle tracking imaging) проводился с помощью программного обеспечения для количественного анализа QLAB фирмы Philips.
ДД определялась с помощью следующих параметров: септальная скорость фиброзного кольца (ФК) МК es <7 см/с, латеральная или скорость боковой части ФК eб <10 см/с, среднее отношение ранней скорости митрального потока к скорости движения ФК МК, отношение E/e >14, ИОЛП >34 мл/м2, пиковая трикуспидальная скорость регургитации >2,8 м/с и по отношению Е/A соответственно типам ДД. Кроме того, по данным 2D ST определялся средний глобальный продольный стрейн (GLSt) ЛЖ, PALS ЛП и правого желудочка.
Для проведения статистического анализа данных использовались следующие статистические методы: критерий Колмогорова-Смирнова для проверки на нормальность распределений наблюдаемых признаков; для определения различий между группами — t-критерий Стьюдента, непараметрические статистические методы (критерий Манна-Уитни); проверка гипотезы о равенстве распределения дихотомических показателей в группах осуществлялась с помощью критерия Хи-квадрат, корреляционный анализ Пирсона или Спирмена, проводилось построение регрессионных моделей Кокса, использовался ROC анализ.
Результаты
При сравнении исходных данных пациенты в группах с благоприятным течением и развитием послеоперационной ФП значимо отличались по ИОЛП (34±16 и 50±29, соответственно, р=0,01), PALS ЛП (37,5±11,7% и 28,0±9,9%, р=0,01), длительности пребывания в реанимации, частоте госпитализаций, клинике одышки (табл. 1). В остальном различий межу группами не было.
ИОЛП >44,4 мл/м2 увеличивал риск развития ФП после операции (AUC =0,60±0,07, р<0,05, чувствительность к неблагоприятным исходам — 47%, специфичность — 80%, относительный риск (RR) — 2,34 (доверительный интервал (ДИ): 1,27-3,87).
В группе с ФП значения ИОЛП были выше, чем в группе контроля и уменьшались в динамике: исходно 50±29 (группа с ФП) и 34±16 мл/м2 (контроль) (р=0,01), в ранний период — 40±18 (группа с ФП) и 29±17 мл/м2 в группе контроля (p=0,05), в отдаленном периоде — 39±18 (группа ФП) и в контроле 31±13 мл/м2 (p=0,12). В динамике ИОЛП были в пределах нормы в контрольной группе и не менялись после операции. В группе с ФП была отмечена тенденция к снижению ИОЛП с 50±29 мл/м2 исходно до 40±18 мл/м2 в ранний период (р=0,06) без динамики в отдаленном периоде (табл. 2, 3). Отсутствие значимого снижения ИОЛП способствовало появлению ФП после операции.
Таблица 2
Сравнение ИОЛП в контрольной группе и группе с развитием ФП
в разные сроки наблюдения
|
Индексированный объём ЛП, мл/м2 |
Группа благоприятного течения (n=79) |
Группа с ФП (n=33) |
p |
|
До операции |
34±16 мл/м2 |
50±29 мл/м2 |
0,01 |
|
10 дней после операции |
29±17 мл/м2 |
40±18 мл/м2 |
0,05 |
|
12 мес. после операции |
31±13 мл/м2 |
39±17 мл/м2 |
0,05 |
Сокращения: ЛП — левое предсердие, ФП — фибрилляция предсердий.
Таблица 3
Динамика ИОЛП в группе с благоприятным течением и группе с ФП
в разные сроки
|
Индексированный объём ЛП, мл |
Группа благоприятного течения (n=79) |
p |
Группа ФП (n=33) |
p |
|
До операции |
34±16 мл/м2 |
50±29 мл/м2 |
||
|
10 дней после операции |
29±17 мл/м2 |
0,1 |
40±18 мл/м2 |
0,06 |
|
12 мес. после операции |
31±13 мл/м2 |
0,3 |
39±17 мл/м2 |
0,12 |
Сокращения: ЛП — левое предсердие, ФП — фибрилляция предсердий.
По данным ROC анализа PALS ЛП обладал хорошей прогностической значимостью для ФП в послеоперационном периоде (AUC =0,66±0,08, р<0,01, чувствительность к неблагоприятным исходам — 68%, специфичность — 66%, RR — 1,19 (ДИ: 3,38-31,4). Точкой разделения стало значение PALS ЛП 27,5%, прогностическая значимость параметра сохранялась в течение всего времени наблюдения после операции (рис. 1).
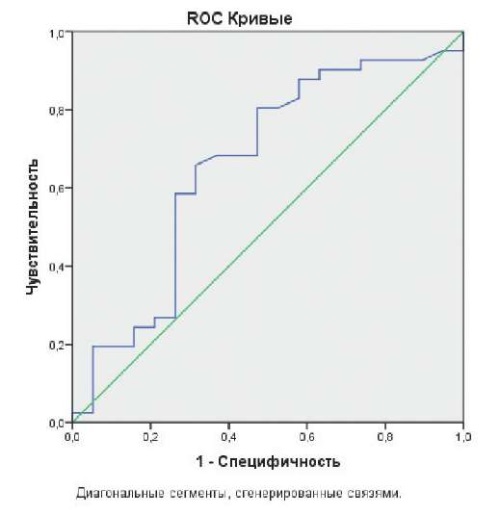
Рис. 1. Влияние PALS ЛП 27,5% на прогноз развития ФП после операции.
Примечание: ROC кривая PALS ЛП (AUC =0,659±0,08, р<0,01, RR — 1,19 (ДИ: 3,38-31,4).
Сокращения: ДИ — доверительный интервал, ЛП — левое предсердие,
PALS — пиковый предсердный продольный стрейн, RR — относительный риск.
Таким образом, по данным ROC анализа снижение исходного порогового уровня PАLS ЛП <27,5% повышало риск развития ФП как в раннем, так и в отдаленном послеоперационном периоде. Исходно группа с ФП и группа без НРС имели тенденцию к различию по PALS ЛП (28±7,5% и 38±8,7%, соответственно, р=0,08). В послеоперационном периоде эта разница становилась значимой как в раннем, так и отдаленном периоде (в группе ФП — 21±8,3% и без ФП — 43±12%, р=0,002) (табл. 4).
Таблица 4
Сравнение PALS ЛП, % между группами
с благоприятным течением и с ФП в разные сроки наблюдения
|
PALS ЛП % |
Группа благоприятного течения (n=79) |
Группа ФП (n=33) |
p |
|
До операции |
38±8,7% |
28±7,5% |
0,08 |
|
10 дней после операции |
29±11% |
19±6,2% |
0,01 |
|
12 мес. после операции |
43±12% |
21±8,3% |
0,002 |
Сокращения: ЛП — левое предсердие, ФП — фибрилляция предсердий, PALS — пиковый предсердный продольный стрейн.
В группе ФП PALS снизился после операции и не увеличился в отдаленном периоде (28±7,5% исходно, 19±6,2% после операции, 21±8,3% в отдаленный период, р=0,04, р=0,23, соответственно).
Таким образом, в динамике у больных не происходило восстановление PALS ЛП, что, возможно, стало триггером развития ФП на фоне структурной перестройки ЛП (табл. 5).
Таблица 5
Динамика ремоделирования ЛП внутри групп (изменение PALS ЛП
в группе с благоприятным течением и ФП в разные сроки)
|
PALS ЛП, % |
Группа благоприятного течения (n=79) |
p |
Группа ФП (n=33) |
p |
|
До операции |
38±8,7% |
28±7,5 |
||
|
10 дней после операции |
29±11% |
0,02 |
19±6,2 |
0,04 |
|
12 мес. после операции |
43±12 |
0,05 |
21±8,3 |
0,230 |
Сокращения: ЛП — левое предсердие, ФП — фибрилляция предсердий,
PALS — пиковый предсердный продольный стрейн.
В группе контроля PALS увеличился до нормы (р=0,05) (табл. 5). Исходно в группе с ФП выявлено повышение конечного диастолического давления в ЛЖ как проявление ДД: отношение Е/е составило 19±7,0 (группа ФП) и 14,4±7,0 (группа контроля) р=0,05 (табл. 1), в отдаленном периоде Е/е снизился до нормы. Сниженная сократительная функция ЛЖ по данным GLSt ЛЖ и ФВ не влияли значимо на прогноз ФП в нашем исследовании. ФВ ЛЖ влияла на развитие ФП (рис. 2) только в раннем периоде после операции (точка отсечения 57,0%, AUC =0,71±0,049, р<0,008, чувствительность к неблагоприятным исходам — 54%, специфичность — 76%, RR — 2,21 (ДИ: 1,27-3,87)). Таким образом, ФП чаще возникала у больных с нормальной ФВ (рис. 2). Выявлена корреляция PALS с ДД (r=-0,4989, р=0,0001), с возникновением ФП после операции (r=-0,4123, р=0,002).
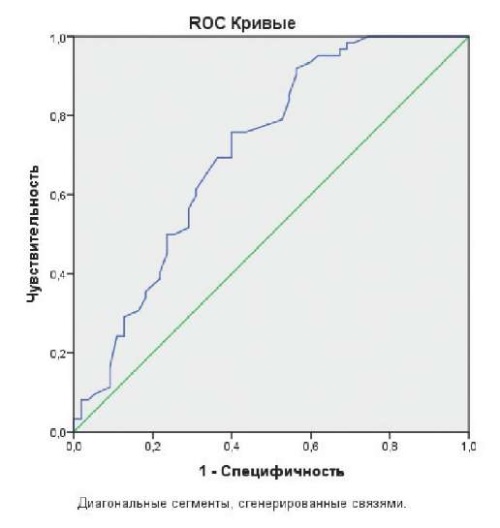
Рис. 2. ФВ ЛЖ значимо влияла на развитие ФП
только в раннем периоде после операции.
Примечание: точка отсечения 57,0%, AUC =0,71±0,049, р<0,008,
чувствительность к неблагоприятным исходам — 54%,
специфичность — 76%, RR — 2,21 (ДИ: 1,27-3,87).
Сокращения: ДИ — доверительный интервал, RR — относительный риск.
Прогноз возникновения послеоперационной ФП был связан с исходно увеличенным объёмом ЛП, снижением его продольной сократимости по данным деформации PALS ЛП, развитием ДД ЛЖ, с ФВ ЛЖ в раннем периоде после операции и снижением торсион (рис. 3).
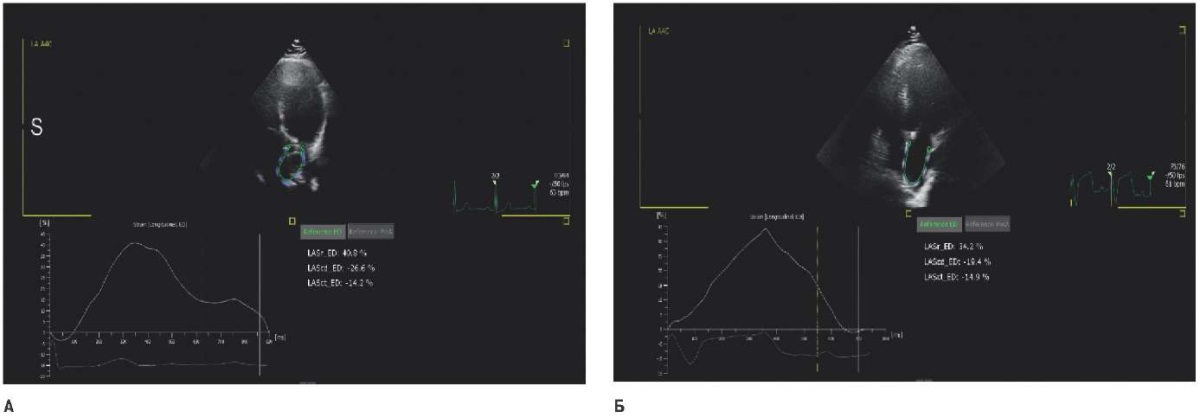
Рис. 3. PALS ЛП пациентки Ч., 53 года с аортальным стенозом.
Примечание: А — 40,8% исходно,
Б — 34,2% в раннем периоде после протезирования АК.
LASr_ED — продольный стрейн ЛП в резервуарную фазу,
равен LAScd_ED + LASct_ED,
LAScd_ED — стрэйн в кондуитную фазу,
LASct_ED — стрейн в контрактильную фазу активности ЛП.
Цветное изображение доступно в электронной версии журнала.
Сокращения: АК — аортальный клапан, ЛП — левое предсердие.
Обсуждение
Нарушение функции ЛП является компенсаторной реакцией на дисфункцию ЛЖ, является зеркалом развития СН. На ранних стадиях развития СН компенсаторное увеличение активного вклада ЛП в наполнение ЛЖ (функция насоса) способствует поддержанию сердечно-сосудистой гемодинамики, сердечного выброса, нейрогуморального баланса. ЛП выполняет рефлекторный контроль кровообращения и осуществляет регуляцию секреции вазопрессина. Однако при прогрессивной дисфункции ЛЖ увеличивается преднагрузка и постнагрузка на ЛП, что приводит к повышению давления и дилатации ЛП, в итоге, механической недостаточности, дисфункции ЛП. Механическая недостаточность ЛП сопровождается эндокринной: происходит повреждение синтеза предсердного натрийуретического пептида (ANP), возникает резистентность к ANP и регуляторная недостаточность ЛП (доминирование механизмов возбуждения симпатической нервной системы, повышение секреции ренин-ангиотензиновой системы). Сосуществование механической, эндокринной и регуляторной недостаточности (глобальная недостаточность ЛП) на фоне воспалительных и фиброзных изменений предсердного миокарда повышает риск ФП, вызывает снижение толерантности к физической нагрузке, увеличивает частоту госпитализаций, заболеваемость и смертность. Накопление данных указывает на то, что терапевтические вмешательства, связанные с улучшением функции ЛП, могут снизить заболеваемость и смертность у пациентов с СН [9][10][13].
В нашем исследовании показано, что основной показатель геометрии ЛП — исходный ИОЛП >44,4 мл/м2 увеличивал риск развития ФП после операции. В динамике ИОЛП были в пределах нормы в контрольной группе и не менялись после операции. В группе с ФП отмечена тенденция к снижению ИОЛП с 50±29 мл/м2 исходно до 40±18 мл/м2 в ранний период (р=0,06), без динамики в отдаленном периоде.
Патофизиология развития НРС включает окислительный стресс, перегрузку кальцием, работу микро-РНК, воспаление и активацию миофибробластов. Фиброз вместе с нарушением электрических связей между мышечными пучками может привести к укорочению рефрактерности предсердий, механизму повторного входа re-entry, неоднородностям локальной проводимости как основы возникновения и поддержания аритмии [14].
Таким образом, ремоделирование ЛП включает геометрические (расширение), структурные (фиброз) и функциональные (механическая и электрическая дисфункция) изменения, которые происходят в ответ на стрессоры, такие как тахикардия и перегрузка объемом/давлением. Петли положительной обратной связи между многими факторами усугубляют картину заболевания и ДД [15]. Возникновение ФП, в свою очередь, приводит к снижению PALS ЛП [16].
По данным Европейской ассоциации специалистов по сердечно-сосудистой визуализации и Европейской ассоциации по нарушениям ритма сердца, PALS ЛП <30% указывает на нарушение резервуарной функции и свидетельствует о неблагоприятном прогнозе. В документе указано на прогностическую роль деформации предсердий, скорости кровотока в ушке ЛП для оценки риска кардиоэмболического инсульта. Показано, что PALS ЛП <15,4% позволяет прогнозировать риск системной эмболии и превосходит общепринятую шкалу риска инсульта CHA2DS2-VASc [17].
В нашем исследовании по данным ROC анализа снижение исходного порогового уровня PАLS ЛП <27,5% повышало риск развития ФП как в раннем, так и в отдаленном послеоперационном периоде. Исходно группа с ФП и группа без НРС имели тенденцию к различию по PALS ЛП (28±7,5% и 38±8,7%, соответственно, р=0,08). В послеоперационном периоде эта разница становилась значимой как в раннем, так и отдаленном периоде (в группе ФП — 21±8,3% и без ФП — 43±12%, р=0,002). Таким образом, на определенном этапе механическое ремоделирование переходит в электрическое, что происходит по нашим данным при PАLS ЛП <27,5% и ИОЛП >44,4 мл/м2. В дальнейшем у этих пациентов в послеоперационном периоде возникают пароксизмы ФП, требующие лекарственной или электрической кардиоверсии, а в отдаленном периоде — госпитализации. Причем у этих пациентов не происходит обратного ремоделирования ЛП, значимого уменьшения объёма и увеличения PАLS ЛП в динамике после операции.
В одном из исследований было показано, что ИОЛП >34 мл/м2, диаметр ЛП >39 мм и PALS <31% свидетельствуют о двух- и четырехкратном, соответственно, увеличении перехода пароксизмальной ФП в постоянную [18]. Интересно, что резервуарная и кондуитная функции ЛП снижаются еще до появления ДД и сопровождаются одышкой во время физической нагрузки [19].
Прогрессирование ДД происходит одновременно с дилатацией ЛП. По нашим данным исходно в группе с ФП выявлена выраженная ДД: отношение скорости раннего митрального потока к скорости движения межжелудочковой перегородки Е/е´ составило 19±7,0 (группа ФП) и 14,4±7,0 (группа контроля), р=0,05, в отдаленном периоде Е/е´ снизился до нормы. ФВ ЛЖ влияла на развитие ФП только в раннем периоде после операции. ФП чаще возникала у больных с нормальной ФВ. Выявлена корреляция PALS с ДД (r=-0,4989, р=0,0001), с возникновением ФП после операции (r=-0,4123, р=0,002).
Таким образом, наибольший интерес представляют данные о полученной взаимосвязи развития послеоперационной ФП с ДД, что было отражено корреляцией с ИОЛП и деформацией ЛП, отношением E/e´, нормальной ФВ ЛЖ, при этом торсион был также нарушен у больных с ФП.
Снижение пиковой продольной деформации PALS ЛП (p=0,002), увеличение ИОЛП, и отношения Е/е´ ЛЖ по данным допплерографии (p=0,05), развитие ДД ЛЖ с нормальной ФВ ЛЖ оказывали максимальное влияние на прогноз ФП в раннем периоде после операции по данным многофакторного анализа. PALS ЛП у больных с ФП поле операции не восстанавливался, значимо не увеличивался в динамике, а объём ЛП был достоверно выше, чем у больных без ФП во всех точках наблюдения.
Таким образом, ЛП играет важную роль в поддержании сердечно-сосудистого гомеостаза при СН. При прогрессирующей дисфункции ЛЖ развиваются дилатация ЛП и его механическая недостаточность, которые часто приводят к развитию легочной гипертензии и завершаются электрическим ремоделированием с развитием ФП на последних стадиях болезни.
Заключение
На всем протяжении наблюдения на развитие ФП влияли три показателя: ИОЛП, PALS ЛП и торсион ЛЖ. В раннем периоде после операции фактором риска становилась ФВ. Прогноз ФП в большей степени зависел от функции (деформации) ЛП, коррелировал с диастолической функцией ЛЖ. В динамике в группе с ФП не отмечено восстановления или улучшение PALS ЛП, индексированные объёмы не снижались значимо, что говорит о выраженном исходно и в дальнейшем необратимом ремоделировании ЛП при сохранной ФВ и наличии ДД. Исследование подчеркивает важность и взаимосвязь нарушения функции ЛП, механического и электрического ремоделирования ЛП, ДД ЛЖ в прогнозе ФП.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Freed BH, Daruwalla V, Cheng JY, et al. Prognostic Utility and Clinical Significance of Cardiac Mechanics in Heart Failure With Preserved Ejection Fraction: Importance of Left Atrial Strain. Circ Cardiovasc Imaging. 2016;9(3):10.1161/CIRCIMAGING.115.003754e003754. doi:10.1161/CIRCIMAGING.115.003754.
2. Cameli M, Lisi M, Righini FM, et al. Novel echocardiographic techniques to assess left atrial size, anatomy and function. Cardiovasc Ultrasound. 2012;10:4. doi:10.1186/1476-7120-10-4.
3. Donal E, Galli E, Schnell F. Left Atrial Strain: A Must or a Plus for Routine Clinical Practice? Circ Cardiovasc Imaging. 2017;10(10):e007023. doi:10.1161/CIRCIMAGING.117.007023.
4. Cameli M, Mandoli GE, Loiacono F, et al. Left atrial strain: a new parameter for assessment of left ventricular filling pressure. Heart Fail Rev. 2016;21(1):65-76. doi:10.1007/s10741-015-9520-9.
5. Khan MS, Memon MM, Murad MH, et al. Left atrial function in heart failure with preserved ejection fraction: a systematic review and meta-analysis. Eur J Heart Fail. 2020;22(3):472- 85. doi:10.1002/ejhf.1643.
6. Buggey J, Hoit BD. Left atrial strain: measurement and clinical application. Curr Opin Cardiol. 2018;33(5):479-85. doi:10.1097/HCO.0000000000000537.
7. Ersbøll M, Andersen MJ, Valeur N, et al. The prognostic value of left atrial peak reservoir strain in acute myocardial infarction is dependent on left ventricular longitudinal function and left atrial size. Circ Cardiovasc Imaging. 2013;6(1):26-33. doi:10.1161/CIRCIMAGING.112.978296.
8. Luis SA, Pellikka PA. Is Speckle Tracking Imaging Ready for Prime Time in Current Echo Clinical Practice? Prog Cardiovasc Dis. 2018;61(5-6):437-45. doi:10.1016/j.pcad.2018.11.001.
9. Моллаева Д. Д., Машина Т.В., Мрикаев Д.В. и др. Современные ультразвуковые методы оценки структурнофункциональных изменений левого предсердия у пациентов с фибрилляцией предсердий. Креативная кардиология. 2021;15(1):48-60. doi:10.24022/1997-3187-2021-15-1-48-60.
10. Мусин Т.И., Багманова З.А., Гареев Д.А. и др. Прогнозирование контроля синусового ритма после радиочастотной аблации у больных с фибрилляцией предсердий с помощью технологии спекл-трекинг и динамика структурно-функциональных показателей левого предсердия. Российский кардиологический журнал. 2021;26(2S):4256. doi:10.15829/1560-4071-2021-4256.
11. Хажбиева С.М., Темботова Ж.Х., Сергуладзе С.Ю. и др. Оценка параметров геометрического, функционального и механического ремоделирования левого предсердия после хирургического лечения изолированной фибрилляции предсердий. Анналы аритмологии. 2018;15(1):12-23. doi:10.15275/annaritmol.2018.1.2.
12. Жолбаева Ф.З., Табина А. Е., Голухова Е.З. Молекулярные механизмы фибрилляции предсердий: в поиске "идеального" маркера. Креативная кардиология. 2015;9(2):40-53. doi:10.15275/kreatkard.2015.02.04.
13. Telles F, Nanayakkara S, Evans S, et al. Impaired left atrial strain predicts abnormal exercise haemodynamics in heart failure with preserved ejection fraction. Eur J Heart Fail. 201921(4):495-505. doi:10.1002/ejhf.1399.
14. Dzeshka MS, Lip GY, Snezhitskiy V, et al. Cardiac Fibrosis in Patients With Atrial Fibrillation: Mechanisms and Clinical Implications. J Am Coll Cardiol. 2015;66(8):943-59. doi:10.1016/j.jacc.2015.06.1313.
15. Jalife J, Kaur K. Atrial remodeling, fibrosis, and atrial fibrillation. Trends Cardiovasc Med. 2015;25(6):475-84. doi:10.1016/j.tcm.2014.12.015.
16. Leung M, Abou R, van Rosendael PJ, et al. Relation of Echocardiographic Markers of Left Atrial Fibrosis to Atrial Fibrillation Burden. Am J Cardiol. 2018;122(4):584-91. doi:10.1016/j.amjcard.2018.04.047.
17. Nagueh SF, Smiseth OA, Appleton CP, et al. Recommendations for the Evaluation of Left Ventricular Diastolic Function by Echocardiography: An Update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr. 2016;29(4):277-314. doi:10.1016/j.echo.2016.01.011.
18. Obokata M, Reddy YNV, Pislaru SV, et al. Evidence Supporting the Existence of a Di - stinct Obese Phenotype of Heart Failure With Preserved Ejection Fraction. Circulation. 2017;136(1):6-19. doi:10.1161/CIRCULATIONAHA.116.026807.
19. Yoon YE, Oh IY, Kim SA, et al. Echocardiographic Predictors of Progression to Persistent or Permanent Atrial Fibrillation in Patients with Paroxysmal Atrial Fibrillation (E6P Study). J Am Soc Echocardiogr. 2015;28(6):709-17. doi:10.1016/j.echo.2015.01.017
Об авторах
И. И. АверинаРоссия
Аверина Ирина Ивановна — доктор медицинских наук, старший научный сотрудник отделения хирургического лечения интерактивной патологии, профессор кафедры кардиологии и функциональной диагностики Института ПКВКиПО
Москва
М. Ю. Мироненко
Россия
Мироненко Марина Юрьевна — кандидат медицинских наук, заведующий отделением ультразвуковой диагностики института кардиохирургии им. В.И. Бураковского
Москва
Л. А. Глушко
Россия
Глушко Людмила Александровна — кандидат медицинских наук, заведующий группой легочных проб и мониторинга газообмена, врач функциональной диагностики, врач-кардиолог I категории, доцент кафедры кардиологии и функциональной диагностики Института ПКВКиПО
Москва
SPIN 682580
С. А. Донаканян
Россия
Донаканян Сергей Агванович — доктор медицинских наук, профессор, руководитель отделения хирургического лечения интерактивной патологии
Москва
Конфликт интересов:
Конфликт интересов отсутствует
Л. А. Бокерия
Россия
Бокерия Лео Антонович — академик РАН, профессор, доктор медицинских наук, президент
Москва
Дополнительные файлы
Рецензия
Для цитирования:
Аверина И.И., Мироненко М.Ю., Глушко Л.А., Донаканян С.А., Бокерия Л.А. Ремоделирование левых отделов сердца как фактор риска развития фибрилляции предсердий у пациентов после коррекции приобретенных пороков сердца. Российский кардиологический журнал. 2023;28(7):5323. https://doi.org/10.15829/1560-4071-2023-5323
For citation:
Averina I.I., Mironenko M.Yu., Glushko L.A., Donakanyan S.A., Bokeria L.A. Left heart remodeling as a risk factor for atrial fibrillation in patients after surgery of acquired heart defects. Russian Journal of Cardiology. 2023;28(7):5323. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5323
JATS XML

















































