Перейти к:
"Festina lente" — многоцентровое исследование по изучению результатов каротидной эндартерэктомии в зависимости от скорости выполнения сосудистого шва
https://doi.org/10.15829/1560-4071-2023-5309
Аннотация
Цель. Анализ госпитальных и отдаленных результатов классической каротидной эндартерэктомии (КЭЭ) в зависимости от скорости выполнения сосудистого шва.
Материал и методы. В настоящее проспективное многоцентровое исследование за период с 01.03.2017 по 01.10.2020 было включено 2366 пациентов, которым выполнялась классическая КЭЭ с пластикой зоны реконструкции заплатой. В зависимости от времени, требующегося на наложение 1 стежка, было сформировано 4 группы пациентов: 1 группа (n=471; 19,9%) — 1 стежок в 2 сек; 2 группа (n=865; 36,5%) — 1 стежок в 3 сек; 3 группа (n=692; 29,2%) — 1 стежок в 4 сек; 4 группа (n=338; 14,3%) — 1 стежок в 5 сек. Под термином "стежок" понималось расстояние между двумя вколами иглы. Период наблюдения за пациентами в послеоперационном периоде составил 18,5±11,0 мес.
Результаты. В госпитальном послеоперационном периоде летальных исходов и инфарктов миокарда (ИМ) зафиксировано не было. В 1 группе статистически чаще развивалось кровотечение по ходу анастомоза (n=93; 19,7%; р<0,0001) и острое нарушение мозгового кровообращения (ОНМК) (n=3; 0,63%; р=0,02) ввиду развития тромбоза внутренней сонной артерии (ВСА). В отдаленном периоде наблюдения статистически значимых различий по частоте летальных исходов, ИМ получено не было. Однако рестеноз ВСА, потребовавший повторной КЭЭ (n=37; 7,85%; р<0,0001) и обусловленные им ОНМК/транзиторная ишемическая атака (n=13; 2,8%; р=0,0001) чаще диагностировались в 1 группе больных. По данным анализа кривых Каплана-Мейера развитие рестеноза чаще всего было визуализировано через 6 мес. после КЭЭ во всей выборке.
Заключение. 1. Выполнение сосудистого шва со скоростью 1 стежок в 2 сек сочетается с повышенным риском интраоперационного тромбоза ВСА, кровотечения по ходу анастомоза, ОНМК, а также рестеноза и обусловленных им ОНМК в отдаленном периоде наблюдения. 2. Выполнение сосудистого шва со скоростью 1 стежок в 5 сек. не сопровождается увеличением частоты госпитальных ОНМК, несмотря на максимальное время пережатия ВСА относительно других групп пациентов. 3. Выполнение сосудистого шва со скоростью 1 стежок в 3 или 4 сек характеризуется наименьшей частотой развития всех осложнений на госпитальном и отдаленном этапах послеоперационного наблюдения.
Ключевые слова
Для цитирования:
Саутина М.С., Соколова А.С., Буторина А.С., Пучнина Л.И., Рыльский Р.М., Шматов Д.В., Коротких А.В., Лебедев О.В., Артюхов С.В., Мухторов О.Ш., Лидер Р.Ю., Ван Ш., Рошковская Л.В., Хетагуров М.А., Унгурян В.М., Чернявин М.П., Багдавадзе Г.Ш., Палагин П.Д., Сироткин А.А., Казанцев А.Н. "Festina lente" — многоцентровое исследование по изучению результатов каротидной эндартерэктомии в зависимости от скорости выполнения сосудистого шва. Российский кардиологический журнал. 2023;28(2):5309. https://doi.org/10.15829/1560-4071-2023-5309
For citation:
Sautina M.S., Sokolova A.S., Butorina A.S., Puchnina L.I., Rylsky R.M., Shmatov D.V., Korotkikh A.V., Lebedev O.V., Artyukhov S.V., Mukhtorov O.Sh., Leader R.Yu., Wang Sh., Roshkovskaya L.V., Khetagurov M.A., Unguryan V.M., Chernyavin M.P., Bagdavadze G.Sh., Palagin P.D., Sirotkin A.A., Kazantsev A.N. "Festina lente" — a multicenter study on the outcomes of carotid endarterectomy, depending on vessel suturing speed. Russian Journal of Cardiology. 2023;28(2):5309. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5309
Реконструктивные вмешательства на сонных артериях разнообразны и многовариантны. Тем не менее "золотым стандартом" хирургической коррекции стеноза внутренней сонной артерии (ВСА) стала каротидная эндартерэктомия (КЭЭ) [1-5]. Основоположником отечественной каротидной хирургии А. В. Покровским были опубликованы две легендарные работы, ставшие кладезем современной ангиологии [6][7]. В них он подробнейшим образом описал ход и главные нюансы выполнения классической и эверсионной техник КЭЭ. Основные положения, вынесенные в этих статьях, легли в "стандарты качества" реализации данной операции [8-12].
В последующем, с созданием национальных рекомендаций, разработанные постулаты были значительно расширены. Подход к направлению пациента на КЭЭ стал более точным [13]. Показания к операции значительно углубились от сугубо морфологической составляющей до личных предпочтений и общих обстоятельств здоровья пациента. Основной упор был сделан на персонифицированный подход к выбору стратегии лечения [13]. Стали известны и допустимые пределы внутригоспитальной летальности, частоты послеоперационных ишемических инсультов для каждого конкретного учреждения, которое занимается хирургической реваскуляризацией головного мозга [13]. Во многих вопросах была поставлена точка с высоким уровнем доказательности [13]. И, казалось бы, последние рекомендации доведены до уровня совершенства, но в мировой литературе появились работы, которые продемонстрировали некоторые слабые стороны представленных руководств. В частности, оставалось не ясным, какой стаж работы сосудистого хирурга является оптимальным для его допуска к реализации КЭЭ. Может ли молодой специалист при равных условиях выполнить данную операцию и сосудистый анастомоз так же качественно, как это сделал бы врач высшей категории [14-16]? Казалось бы, ответ на данный вопрос носит характер аксиомы. Но практика порой показывает обратное. Неоспоримо, что начинающий хирург относительно опытного коллеги в ряде случаев выполняет анастомоз более медленно [14-16]. И в одном из исследований было доказано, что длительное время пережатия ВСА является предиктором развития интраоперационного острого нарушения мозгового кровообращения (ОНМК) [17]. Таким образом, скорость выполнения сосудистого шва будет определяющим фактором в достижении оптимального исхода КЭЭ.
Однако действующие рекомендации не устанавливают стандартов этого направления [13]. Хотя последнее могло бы быть определенным маркером допуска хирурга к реконструктивному вмешательству на ВСА. Остается не ясным, с какой частотой должны выполняться стежки, что будет называться "быстрым", а что "медленным"? И является ли "медленно" = "плохо"?
Целью настоящего многоцентрового исследования "Festina lente"1 (с лат. — торопись не спеша) стал анализ госпитальных и отдаленных результатов КЭЭ в зависимости от скорости выполнения сосудистого шва.
Материал и методы
В настоящее проспективное многоцентровое исследование за период с 01.03.2017 по 01.10.2020 было включено 2366 пациентов, которым выполнялась классическая КЭЭ с пластикой зоны реконструкции заплатой.
Критерии включения: 1. Выполнение классической КЭЭ с пластикой зоны реконструкции заплатой; 2. Применение заплаты длиною 5,5 см (во всех случаях интраоперационно производилось измерение длины артериотомии при помощи линейки, с последующим измерением параметров заплаты также при помощи линейки (рис. 1); 3. Отсутствие необходимости в уменьшении ширины заплаты путем ее иссечения (поперечный размер заплаты равен 0,7 см); 4. Применение полипропиленовой сосудистой нити размером 6/0.
Критерии невключения: 1. Наличие противопоказаний для выполнения классической КЭЭ с пластикой зоны реконструкции заплатой; 2. Наличие патологии, лимитирующей наблюдение за пациентом в отдаленном периоде наблюдения.
Во всех случаях засекалось время имплантации заплаты (не время пережатия ВСА). В зависимости от времени, требующегося на наложение 1 стежка, было сформировано 4 группы пациентов:
1 группа (n=471; 19,9%) — 1 стежок в 2 сек;
2 группа (n=865; 36,5%) — 1 стежок в 3 сек;
3 группа (n=692; 29,2%) — 1 стежок в 4 сек;
4 группа (n=338; 14,3%) — 1 стежок в 5 сек.
Методика измерения времени стежка
Так как исследование проспективное, то в каждом конкретном случае во время операции при выполнении анастомоза специальный ассистент включал секундомер и фиксировал с какой скоростью выполняются стежки. В настоящее время нет норм и регламентирующих документов, позволяющих утверждать, какая скорость выполнения стежков и анастомоза является оптимальной. Поэтому хирург самостоятельно, основываясь на своих предпочтениях, выбирал необходимую скорость создания стежков.
Под термином "стежок" понималось расстояние между двумя вколами иглы.
Компенсаторные возможности церебрального кровообращения оценивались путем измерения ретроградного давления во ВСА. При снижении последнего более чем на 60% от системного устанавливался временный шунт.
Период наблюдения за пациентами в послеоперационном периоде составил 18,5±11,0 мес. Конечными точками исследования стали: летальный исход, ОНМК/транзиторная ишемическая атака (ТИА), инфаркт миокарда (ИМ), рестеноз зоны реконструкции, тромбоз зоны реконструкции; кровотечение по ходу сосудистого шва, требующее наложения дополнительных швов; комбинированная конечная точка (летальный исход + ОНМК/ТИА + тромбоз/рестеноз зоны реконструкции).
Все пациенты подписали письменное согласие на использование их данных в научных исследованиях. Работа выполнялась в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации, не противоречила Федеральному закону Российской Федерации от 21.11.2011 № 323-ФЗ "Об основах охраны здоровья граждан в Российской Федерации", приказу Министерства здравоохранения Российской Федерации от 1 апреля 2016г № 200н "Об утверждении правил надлежащей клинической практики".
Статистический анализ. Определение типа распределения осуществлялось с помощью критерия Колмогорова-Смирнова. Сравнение групп проводили с применением критерия хи-квадрат Пирсона и Краскела-Уоллиса. При сравнении групп по парам — хи-квадрат Пирсона с поправкой Йетса. Для постройки кривых выживаемости в отдаленном периоде наблюдения применялся анализ Каплана-Мейера. Для сравнения кривых выполнялся Logrank test. Для идентификации группы, в которой развитие тех или иных осложнений было наиболее вероятно, рассчитывалось отношение рисков (ОР, hazard ratio). Если ОР равнялся 1, вероятность манифестации неблагоприятного события в группах одинакова; при значении >1 — неблагоприятное событие с большей вероятностью развивается в 1 группе; при значении <1 — во второй. Различия оценивались как значимые при р<0,05. Результаты исследований обработаны при помощи пакета прикладных программ Graph Pad Prism (www.graphpad.com) и Med Calc 19.2.1 (www.medcalc.org).
Стаж хирургов. Стаж сосудистых хирургов (всего 42 человека) в зависимости от группы распределился следующим образом. Специалисты, чей опыт оператора достигал 2 лет, чаще всего выполняли 1 стежок в 5 сек. Однако все же некоторые стремились шить со скоростью 1 стежок в 2 сек. С увеличением стажа число хирургов, представляющих 1 (1 стежок в 2 сек) и 4 группу скоростных показателей (1 стежок в 4 сек) сокращалось до минимума. Таким образом, специалисты с максимальным опытом (стаж ≥11 лет) выполняли анастомоз только со скоростью 1 стежок в 3 или в 4 сек (табл. 1).
Характеристики групп. Группы были сопоставимы по всем клинико-анамнестическим показателям. Подавляющее большинство являлось представителями пожилого возраста и мужского пола. Каждый третий перенес ОНМК/ТИА в анамнезе. У каждого пятого был диагностирован мультифокальный атеросклероз с поражением трех артериальных бассейнов (табл. 2).
По результатам ангиографии в каждом десятом случае было визуализировано двустороннее гемодинамически значимое поражения ВСА. При этом стеноз последней чаще всего превышал 80% (табл. 3).
Время имплантации заплаты и время пережатия ВСА было ожидаемо статистически большим в 3 и 4 группах (табл. 3).
Результаты
В госпитальном послеоперационном периоде летальных исходов и ИМ зафиксировано не было. В 1 группе статистически чаще развивалось кровотечение по ходу анастомоза (р<0,0001) и ОНМК (р=0,02) ввиду развития тромбоза ВСА. Таким образом, комбинированная конечная точка показала наибольшие значения в этой когорте больных (табл. 4).
В отдаленном периоде наблюдения статистически значимых различий по частоте летальных исходов, ИМ получено не было. Однако рестеноз ВСА, потребовавший повторной КЭЭ, и обусловленные им ОНМК/ТИА чаще диагностировались в 1 группе больных. Таким образом, комбинированная конечная точка также показала наибольшие значения в этой когорте пациентов (табл. 5).
По данным анализа кривых Каплана-Мейера развитие рестеноза чаще всего было визуализировано через 6 мес. после КЭЭ во всей выборке. При этом по данным Logrank test, во 2, 3 и 4 группах потеря просвета сосуда визуализировалась статистически реже (р<0,0001) (рис. 2).
При проведении анализа ОР выявлено, что наибольший риск развития рестеноза ВСА в отдаленном периоде наблюдения более характерен для 1 группы пациентов (табл. 6).
Ввиду того, что причина всех ОНМК/ТИА в отдалённом периоде наблюдения была обусловлена развитием рестеноза ВСА, по данным анализа кривых Каплана-Мейера и Logrank test (р=0,0001) статистически чаще данное осложнение развивалось в 1 группе больных (рис. 3).
Соответственно, при проведения анализа ОР наблюдался такой же тренд: наибольший риск развития ОНМК/ТИА в отдаленном периоде был более характерен для 1 группы пациентов (табл. 7).
В результате представленных исходов, по совокупности осложнений, комбинированная конечная точка на основе анализа кривых Каплана-Мейера и Logrank test (р<0,0001) показала наибольшие значения в 1 группе пациентов (рис. 4).
При расчете ОР развития комбинированной конечной точки, последняя стала наиболее вероятной также для 1 группы больных (табл. 8).
Обсуждение
Несмотря на то, что в 4 группе пациентов наблюдались самые большие временные показатели имплантации заплаты и пережатия ВСА, на частоту послеоперационного ОНМК/ТИА это не повлияло. Во многом такое обстоятельство обусловлено рутинным применением метода измерения ретроградного давления во ВСА как показателя компенсаторных возможностей головного мозга. Однако результаты исследования под руководством академика РАН Барбараш Л. С. показали, что пережатие ВСА >30 мин является предиктором развития летального исхода в данной когорте больных [17]. Это значение было превышено только в 4 группе больных (34,1±2,7 мин), что демонстрирует высокий риск развития ишемических событий при скорости выполнения сосудистого анастомоза, равной 1 стежку в 5 сек.
С одной стороны, проблему риска интраоперационного инсульта, обусловленного длительным пережатием ВСА, можно было бы исключить рутинным применением временного шунта [18-22]. И действующие рекомендации не ограничивают возможность использовать последний в таком режиме [13]. Однако по данным ряда публикаций установка временного шунта часто сопровождается развитием дистальной эмболии, не всегда с явным неврологическим дефицитом [18][20-23]. В такой ситуации речь идет о "немых" ОНМК, получивших особенно детальное изучение в работе Виноградова Р. А. и др. [24]. При этом последующий перифокальный отек подобных образований все-таки может индуцировать легкую неврологическую симптоматику, которая в ряде случаев остается не замеченной [24-26]. Поэтому установка временного шунта является небезопасной манипуляцией и должна реализовываться только сугубо селективно, при наличии сниженных показателей компенсаторных возможностей коллатерального кровообращения головного мозга [20-24][26].
Анализируя госпитальные результаты, следует учесть, что все 3 ОНМК в 1 группе (с максимальными скоростными показателями выполнения анастомоза) произошли по причине тромбоза ВСА. Генез последнего был обусловлен отслойкой интимы за зоной эндартерэктомии. Во всех случаях была выполнена ревизия области реконструкции с открытой тромбэктомией и пуском кровотока. Отсутствие подобных осложнений в других группах, при равных характеристиках поражения сосудов, демонстрирует вероятные технические погрешности выполнения эндартерэктомии [27].
Другой особенностью выполнения имплантации заплаты со скоростью 1 стежок в 2 сек является не всегда прямолинейный шов. Так, несмотря на то, что рестеноз зоны реконструкции по данным послеоперационного цветного дуплексного сканирования не выявляется, операторы могут допускать различный захват размера заплаты при выполнении стежка. В такой ситуации вид границы анастомоза приобретает форму восьмерки (рис. 5).
Такая деформация в любом случае может быть рассмотрена как техническая погрешность, что повлияет на особенности гемодинамики зоны реконструкции, с созданием зоны застоя и турбулентности. В конечном итоге финалом подобной реконструкции станет гиперплазия неоинтимы и рестеноз ВСА [28-30].
Еще одним интраоперационным осложнением при выполнении 1 стежка в 2 сек, которое обращает на себя внимание, является статистически более высокая частота кровотечения по ходу анастомоза после пуска кровотока. Данное событие является предиктором развития ОНМК/ТИА в 30-дневном послеоперационном периоде. Авторы объясняют эту закономерность более высоким риском развития рестеноза ВСА после наложения вторичных швов по ходу анастомоза [31]. Данная особенность обусловлена тем, что хирург, предпочитая сохранять определенную скорость выполнения шва, не стремится выполнять шов поперечно-перпендикулярно краю стенки артерии, добиваясь "меньшего временного результата пережатия артерий". Следовательно, анастомоз становится негерметичным и требует наложения вторичных швов (рис. 6).
Подобная манипуляция будет также деформировать зону реконструкции и, без формирования рестеноза в раннем послеоперационном периоде создаст, по вышеперечисленным причинам, условия для риска потери просвета сосуда по причине гиперплазии неоинтимы уже через полгода [28-30]. Как показали результаты отдаленного наблюдения пациентов, именно в 1 группе больных наблюдаются статистически более высокие показатели рестеноза ВСА, требующего повторной операции и ОНМК/ТИА, обусловленных данным состоянием (табл. 5).
Нужно отметить, что в каждом десятом случае (n=47) при наложении анастомоза со скоростью 1 стежок в 2 сек было зафиксировано прорезывание шва "на носике" заплаты с формированием дефекта стенки артерии. Причина данной технической погрешности заключалась в широком захвате стенки артерии (>2 мм) с последующим натягом нити при выполнении шва. Во всех случаях (n=12), когда накладывался вторичный поперечный шов на созданный дефект, в отдаленном периоде наблюдения был зафиксирован гемодинамически значимый рестеноз ВСА в области "носика заплаты", несмотря на то, что по результатам послеоперационного цветного дуплексного сканирования данных за потерю просвета сосуда получено не было. Этот факт также объясняется гиперплазией неоинтимы по уже перечисленным выше причинам [28-30]. В 35 случаях на место дефекта была имплантирована дополнительная мини-заплата, что не сопровождалось формированием рестеноза в среднеотдаленном и отдаленном периодах наблюдения (рис. 7).
Таким образом, подобная манипуляция стала превентивным фактором, позволяющим предотвращать изменение гемоциркуляции зоны реконструкции в результате сужения просвета артерии путем наложения вторичных швов "на носике" заплаты [32].
Необходимо отметить, что при дополнительном (анонимном) опросе 6 хирургов, выполняющих сосудистый шов со скоростью 1 стежок в 2 сек, было выявлено, что причиной данного темпа чаще всего являются личные амбиции оператора "показать, что я оперирую быстрее всех". Такое поведение не может соответствовать интересам пациента и должно быть идентифицировано психологическим тестированием хирургического персонала с целью дальнейших управленческих решений по поводу отстранения/дополнительного обучения персонала (рис. 8).
Другой причиной стремления оперировать "быстро", которая обращает на себя внимание, является личный дискомфорт оператора, обусловленный излишним потоотделением со лба и всего тела ввиду высокого психологического напряжения. На подобные ситуации также необходимо обращать внимание с целью введения вспомогательной влаговпитывающей амуниции, а также дополнительного осмотра хирурга медицинской комиссией с целью определения профессиональной пригодности.
Таким образом, это первое исследование, проанализировавшее результаты КЭЭ в зависимости от скорости выполнения анастомоза. Является вполне логичным тот факт, что чем дольше будет пережата ВСА, тем дольше головной мозг будет находиться в условиях неполноценной гемоциркуляции [33-37]. Соответственно, риск развития интраоперационного ишемического события будет также возрастать [38-40]. Однако мы доказали, что длительное пережатие ВСА не сопровождается повышением частоты формирования ОНМК/ТИА. Напротив, максимально быстрые скоростные показатели "технического мастерства" (1 стежок в 2 сек) характеризуются такими неблагоприятными событиями, как тромбоз ВСА, кровотечение, рестеноз зоны реконструкции и обусловленные им ОНМК/ТИА. В конечном итоге подобный подход является совершенно неоправданным. И, как следует из наших наблюдений, высокая скорость выполнения анастомоза совершенно не связана с возрастными показателями хирурга, а чаще всего характеризуются личными психологическими "домыслами" и амбициями оператора, которые должны быть идентифицированы и вовремя ликвидированы. Опытные же сосудистые хирурги (стаж ≥11 лет) стремятся выполнять анастомоз со средними скоростями — 1 стежок в 3 или 4 сек, что сопровождается наименьшей частотой осложнений и может быть рекомендовано как эталон.
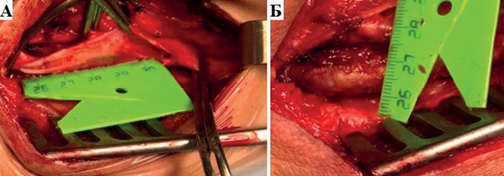
Рис. 1. Интраоперационное измерение линейкой: А — длина артериотомии; Б — поперечный размер заплаты.
Таблица 1
Стаж сосудистого хирурга
|
Показатель |
Группы |
p |
|||
|
1 стежок в 2 сек, n (%) |
1 стежок в 3 сек, n (%) |
1 стежок в 4 сек, n (%) |
1 стежок в 5 сек, n (%) |
||
|
n=6 |
n=16 |
n=13 |
n=7 |
||
|
Стаж 1-2 года |
3 (50) |
0 |
1 (7,7) |
6 (85,7) |
<0,0001 |
|
Стаж 3-5 лет |
2 (33,3) |
4 (25) |
4 (30,7) |
1 (14,3) |
0,84 |
|
Стаж 6-10 лет |
1 (16,6) |
7 (43,7) |
3 (23,1) |
0 |
0,14 |
|
Стаж ≥11 лет |
0 |
5 (31,2) |
5 (48,5) |
0 |
0,1 |
Таблица 2
Сравнительная клинико-анамнестическая характеристика групп пациентов
|
Показатель |
Группы |
р |
|||
|
1 стежок в 2 сек, n (%) |
1 стежок в 3 сек, n (%) |
1 стежок в 4 сек, n (%) |
1 стежок в 5 сек, n (%) |
||
|
n=471 |
n=865 |
n=692 |
n=338 |
||
|
Возраст, М±m, лет |
67,5±4,7 |
65,8±5,4 |
66,1±6,0 |
65,4±6,1 |
0,27 |
|
Мужской пол, n (%) |
314 (66,7) |
553 (63,9) |
449 (64,9) |
221 (65,4) |
0,79 |
|
ПИКС, n (%) |
23 (4,9) |
51 (5,9) |
37 (5,3) |
20 (5,9) |
0,86 |
|
СД, n (%) |
22 (4,7) |
46 (5,3) |
35 (5,0) |
18 (5,3) |
0,41 |
|
ХОБЛ, n (%) |
5 (1,1) |
11 (1,3) |
8 (1,15) |
4 (1,2) |
0,98 |
|
ХПН, n (%) |
11 (2,3) |
19 (2,2) |
17 (2,4) |
9 (2,6) |
0,96 |
|
МФА, n (%) |
92 (19,5) |
187 (21,6) |
146 (21,1) |
77 (22,8) |
0,70 |
|
Реваскуляризация миокарда в анамнезе, n (%) |
19 (4,0) |
39 (4,5) |
30 (4,3) |
14 (4,1) |
0,97 |
|
ОНМК/ТИА в анамнезе, n (%) |
141 (29,9) |
285 (32,9) |
206 (29,7) |
104 (30,7) |
0,51 |
Сокращения: МФА — мультифокальный атеросклероз, ОНМК — острое нарушение мозгового кровообращения, ПИКС — постинфарктный кардиосклероз, СД — сахарный диабет, ТИА — транзиторная ишемическая атака, ХОБЛ — хроническая обструктивная болезнь легких, ХПН — хроническая почечная недостаточность.
Таблица 3
Ангиографические и периоперационные характеристики
|
Показатель |
Группы |
р |
|||
|
1 стежок в 2 сек, n (%) |
1 стежок в 3 сек, n (%) |
1 стежок в 4 сек, n (%) |
1 стежок в 5 сек, n (%) |
||
|
n=471 |
n=865 |
n=692 |
n=338 |
||
|
% стеноза ВСА |
85,5±7,1 |
84,5±6,8 |
85,0±5,4 |
81,8±6,3 |
0,27 |
|
Двусторонние стенозы ВСА, n (%) |
45 (9,5) |
93 (10,7) |
76 (11,0) |
37 (10,9) |
0,87 |
|
Время имплантации заплаты, мин |
11,5±2,3 |
16,2±3,6 |
22,0±2,5 |
26,9±3,4 |
0,01 Р1-3=0,01 Р1-4=0,001 Р2-4=0,02 |
|
Время пережатия ВСА, мин |
19,7±2,9 |
23,2±3,4 |
28,4±3,2 |
34,1±2,7 |
0,001 Р1-3=0,04 Р1-4=0,001 Р2-4=0,01 |
|
Установка временного шунта |
23 (4,9) |
40 (4,6) |
34 (4,9) |
16 (4,7) |
0,99 |
Сокращение: ВСА — внутренняя сонная артерия.
Таблица 4
Госпитальные результаты
|
Показатель |
Группы |
р |
ОШ |
95% ДИ |
|||
|
1 стежок в 2 сек, n (%) |
1 стежок в 3 сек, n (%) |
1 стежок в 4 сек, n (%) |
1 стежок в 5 сек, n (%) |
||||
|
n=471 |
n=865 |
n=692 |
n=338 |
||||
|
Летальный исход, n (%) |
0 |
0 |
0 |
0 |
– |
– |
– |
|
ИМ, n (%) |
0 |
0 |
0 |
0 |
– |
– |
– |
|
ОНМК/ТИА, n (%) |
3 (0,63) |
0 |
0 |
1 (0,3) |
Робщ=0,02 Р1-2=0,08 Р1-3=0,13 Р1-4=0,86 Р2-4=0,62 Р3-4=0,71 |
12,93 10,35 2,16 0,13 0,16 |
0,66-251,1 0,53-200,9 0,22-20,87 0,005-3,20 0,006-4,00 |
|
Кровотечение по ходу сосудистого шва, требующее наложение дополнительных швов, n (%) |
93 (19,7) |
28 (3,2) |
13 (1,9) |
2 (0,6) |
Робщ<0,0001 Р1-2<0,0001 Р1-3<0,0001 Р1-4<0,0001 Р2-3=0,13 Р2-4=0,01 Р3-4=0,17 |
7,35 12,85 41,33 1,74 5,62 3,21 |
4,73-11,42 7,09-23,27 10,1-169,1 0,89-3,40 1,33-23,73 0,72-14,34 |
|
Тромбоз ВСА, n (%) |
3 (0,63) |
0 |
0 |
0 |
Робщ=0,0071 Р1-2=0,08 Р1-3=0,13 Р1-4=0,37 |
12,93 10,35 5,05 |
0,66-251,1 0,53-200,9 0,26-98,31 |
|
Комбинированная конечная точка, n (%) |
6 (1,3) |
0 |
0 |
1 (0,3) |
Робщ=0,0002 Р1-2=0,003 Р1-3=0,01 Р1-4=0,27 Р2-4=0,62 Р3-4=0,71 |
24,17 19,34 4,34 0,13 0,16 |
1,35-430,3 1,08-344,4 0,52-36,31 0,005-3,20 0,006-4,00 |
Сокращения: ВСА — внутренняя сонная артерия, ДИ — доверительный интервал, ИМ — инфаркт миокарда, ОНМК — острое нарушение мозгового кровообращения, ОШ — отношение шансов, ТИА — транзиторная ишемическая атака.
Таблица 5
Отдаленные результаты
|
Показатель |
Группы |
р |
ОШ |
95% ДИ |
|||
|
1 стежок в 2 сек, n (%) |
1 стежок в 3 сек, n (%) |
1 стежок в 4 сек, n (%) |
1 стежок в 5 сек, n (%) |
||||
|
n=471 |
n=865 |
n=692 |
n=338 |
||||
|
Летальный исход, n (%) |
2 (0,42) |
2 (0,23) |
1 (0,14) |
1 (0,3) |
Робщ=0,82 Р1-2=0,09 Р1-3=0,73 Р1-4=0,77 Р2-3=0,84 Р2-4=0,65 Р3-4=0,81 |
1,84 2,94 1,43 1,60 0,78 0,48 |
0,25-13,0 0,26-32,61 0,12-15,92 0,14-17,71 0,07-8,64 0,03-7,82 |
|
ИМ, n (%) |
2 (0,42) |
3 (0,34) |
3 (0,43) |
2 (0,6) |
Робщ=0,95 Р1-2=0,80 Р1-3=0,66 Р1-4=0,86 Р2-3=0,89 Р2-4=0,92 Р3-4=0,89 |
1,22 0,97 0,71 0,79 0,58 0,73 |
0,20-7,36 0,16-5,88 0,10-5,11 0,16-3,97 0,09-3,51 0,12-4,40 |
|
ОНМК/ТИА, n (%) |
13 (2,8) |
5 (0,6) |
2 (0,3) |
3 (0,9) |
Робщ=0,0001 Р1-2=0,002 Р1-3=0,0007 Р1-4=0,10 Р2-3=0,64 Р2-4=0,84 Р3-4=0,41 |
4,88 9,79 3,17 2,00 0,64 0,32 |
1,72-13,78 2,19-43,61 0,89-11,21 0,38-10,37 0,15-2,73 0,05-1,94 |
|
Рестеноз ВСА (>60%), потребовавший выполнение реКЭЭ, n (%) |
37 (7,85) |
12 (1,4) |
5 (0,72) |
8 (2,4) |
Робщ<0,0001 Р1-2<0,0001 Р1-3<0,0001 Р1-4=0,0014 Р2-3=0,31 Р2-4=0,34 Р3-4=0,05 |
6,06 11,71 3,51 1,93 0,58 0,30 |
3,12-11,74 4,56-30,04 1,61-7,65 0,67-5,51 0,23-1,43 0,09-0,92 |
|
Комбинированная конечная точка, n (%) |
39 (8,3) |
14 (1,6) |
6 (0,86) |
9 (2,7) |
Робщ<0,0001 Р1-2<0,0001 Р1-3<0,0001 Р1-4=0,0014 Р2-3=0,27 Р2-4=0,33 Р3-4=0,04 |
5,48 10,32 3,30 1,88 0,60 0,31 |
2,94-10,22 4,33-24,59 1,57-6,91 0,71-4,92 0,25-1,40 0,11-0,90 |
Сокращения: ВСА — внутренняя сонная артерия, ДИ — доверительный интервал, ИМ — инфаркт миокарда, КЭЭ — каротидная эндартерэктомия, ОНМК — острое нарушение мозгового кровообращения, ОШ — отношение шансов, ТИА — транзиторная ишемическая атака.
Таблица 6
Риск (ОР) развития рестеноза ВСА в каждой группе пациентов, в отдаленном периоде наблюдения
|
Группа |
1 |
2 |
3 |
4 |
|
1 |
– |
0,1717 |
0,08916 |
0,2938 |
|
2 |
5,8238 |
– |
0,5192 |
1,7111 |
|
3 |
11,2162 |
1,9259 |
– |
3,2954 |
|
4 |
3,4036 |
0,5844 |
0,3035 |
– |
Сокращение: ДИ — доверительный интервал.
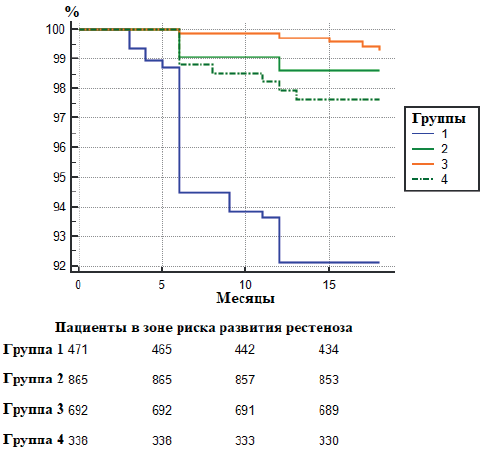
Рис. 2. Выживаемость, свободная от развития рестеноза зоны реконструкции.
Примечание: цветное изображение доступно в электронной версии журнала.
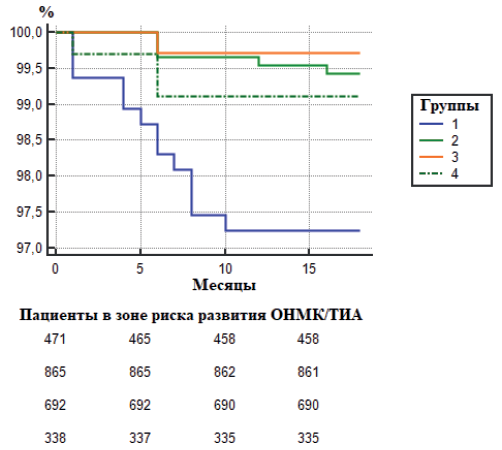
Рис. 3. Выживаемость, свободная от развития ОНМК/ТИА.
Примечание: цветное изображение доступно в электронной версии журнала.
Сокращения: ОНМК — острое нарушение мозгового кровообращения, ТИА — транзиторная ишемическая атака.
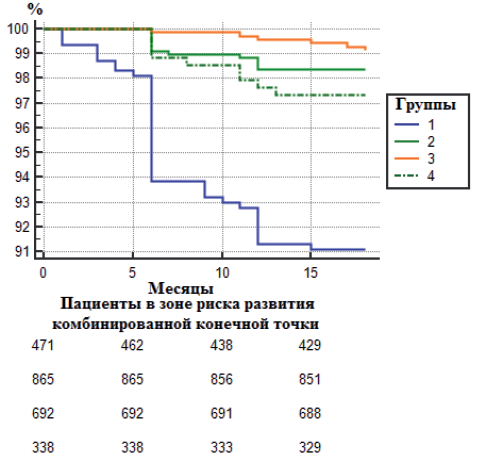
Рис. 4. Выживаемость, свободная от комбинированной конечной точки.
Примечание: цветное изображение доступно в электронной версии журнала.
Таблица 7
Риск (ОР) развития ОНМК/ТИА в каждой группе пациентов, в отдаленном периоде наблюдения
|
Группа |
1 |
2 |
3 |
4 |
|
1 |
– |
0,2070 |
0,1035 |
0,3188 |
|
2 |
4,8313 |
– |
0,4999 |
1,5404 |
|
3 |
9,6648 |
2,0005 |
– |
3,0814 |
|
4 |
3,1365 |
0,6492 |
0,3245 |
– |
Сокращение: ДИ — доверительный интервал.
Таблица 8
Риск (ОР) развития комбинированной конечной точки в каждой группе пациентов,
в отдаленном периоде наблюдения
|
Группа |
1 |
2 |
3 |
4 |
|
1 |
– |
0,1752 |
0,09348 |
0,2891 |
|
2 |
5,7089 |
– |
0,5337 |
1,6502 |
|
3 |
10,6971 |
1,8738 |
– |
3,0920 |
|
4 |
3,4596 |
0,6060 |
0,3234 |
– |
Сокращение: ДИ — доверительный интервал.
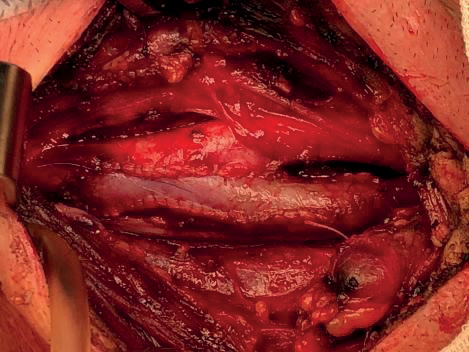
Рис. 5. Техническая погрешность при выполнении анастомоза со скоростью 1 стежок в 2 сек — деформация края заплаты в виде восьмерки.
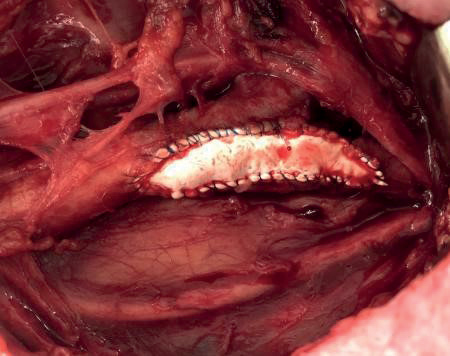
Рис. 6. Негерметичный анастомоз по причине наложения стежков, не перпендикулярных краю стенки, требующий наложения вторичных швов для остановки кровотечения.

Рис. 7. Имплантация мини-заплаты при формировании дефекта артерии "на носике" заплаты.
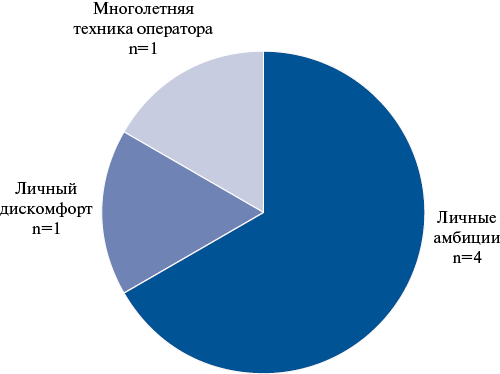
Рис. 8. Причины выполнения сосудистого анастомоза со скоростью 1 стежок в 2 сек по данным анонимного опроса.
Заключение
- Выполнение сосудистого шва со скоростью 1 стежок в 2 сек сочетается с повышенным риском интраоперационного тромбоза ВСА, кровотечения по ходу анастомоза, ОНМК/ТИА, а также рестеноза и обусловленных им ОНМК/ТИА в отдаленном периоде наблюдения.
- Выполнение сосудистого шва со скоростью 1 стежок в 5 сек не сопровождается увеличением частоты госпитальных ОНМК/ТИА, несмотря на максимальное время пережатия ВСА относительно других групп пациентов.
- Выполнение сосудистого шва со скоростью 1 стежок в 3 или 4 сек характеризуется наименьшей частотой развития всех осложнений на госпитальном и отдаленном этапах послеоперационного наблюдения.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
1 Прим. ред. Исследование не зарегистрировано. Название условное.
Список литературы
1. Kazantsev AN, Lider RY, Korotkikh AV, et al. Effects of different types of carotid endarterectomy on the course of resistant arterial hypertension. Vascular. 2022:17085381221140620. doi:10.1177/17085381221140620.
2. Вачёв А. Н., Фролова Е. В., Севрюкова В. Н. и др. Артериальная гипертензия после каротидной эндартерэктомии и стентирования внутренней сонной артерии. Ангиология и сосудистая хирургия. 2022;28(3):68-76. doi:10.33029/1027-6661-2022-28-3-68-76.
3. Казанцев А. Н., Хасанова Д. Д., Алпацкая А. Д. и др. CAROTIDSCORE.RU — стратификация риска осложнений после каротидной эндартерэктомии. Российский кардиологический журнал. 2022;27(5):5031. doi:10.15829/1560-4071-2022-5031.
4. Яриков А. В., Шпагин М. В., Мухин А. С. и др. Ближайшие и отдаленные результаты двух способов эверсионных каротидных эндартерэктомий. Вестник неврологии, психиатрии и нейрохирургии. 2022;8:615-26. doi:10.33920/med-01-2208-06.
5. Покровский А. В., Белоярцев Д. Ф., Адырхаев З. А. и др. Влияет ли способ каротидной реконструкции на непосредственные результаты вмешательства? Ангиология и сосудистая хирургия. 2012;18(3):81-91.
6. Покровский А. В., Белоярцев Д. Ф. Значение каротидной эндартерэктомии в предупреждении ишемических повреждений головного мозга. Журнал неврологии и психиатрии им. C. C. Корсакова. 2015;115(9-2):4-14. doi:10.17116/jnevro2015115924-14.
7. Алекян Б. Г., Покровский А. В., Карапетян Н. Г. и др. Госпитальные результаты хирургического, эндоваскулярного и комбинированного методов лечения пациентов с сочетанным поражением коронарных и внутренних сонных артерий. Эндоваскулярная хирургия. 2020;7(1):34-43. doi:10.24183/2409-4080-2020-7-1-34-43.
8. Гавриленко А. В., Кравченко А. А., Куклин А. В. Хирургическая профилактика прогрессирования ишемии головного мозга у пациентов после инсульта. Хирургия. Журнал им. Н. И. Пирогова. 2022;2:45-9. doi:10.17116/hirurgia202202145.
9. Казанцев А. Н., Черных К. П., Лидер Р. Ю. и др. Сравнительные результаты классической и эверсионной каротидной эндартерэктомии. Кардиология и сердечно-сосудистая хирургия. 2020;13(6):550-5. doi:10.17116/kardio202013061550.
10. Чернявский А. М., Столяров М. С., Стародубцев В. Б. и др. Сравнительные долгосрочные результаты операций каротидной эндартерэктомии с пластикой заплатами из ксеноперикарда, обработанного диэпоксисоединениями, и аутовены. Патология кровообращения и кардиохирургия. 2007;4:46-50.
11. Белов Ю. В., Казанцев А. Н., Виноградов Р. А. и др. Десятилетние отдаленные результаты классической и эверсионной каротидной эндартерэктомии. многоцентровое исследование. Российский кардиологический журнал. 2021;26(12):4742. doi:10.15829/1560-4071-2021-4742.
12. Белов Ю. В., Казанцев А. Н., Виноградов Р. А. и др. Отдаленные результаты каротидной эндартерэктомии и каротидной ангиопластики со стентированием у пациентов с высоким расположением бифуркации общей сонной артерии. результаты многоцентрового исследования.Вопросы нейрохирургии им. Н. Н. Бурденко. 2022;86(3):6-16. doi:10.17116/neiro2022860316.
13. Belov YV, Kazantsev AN, Kravchuk VN, et al. Features of Carotid Endarterectomy in Russia. How do we Resolution Issues? Curr Probl Cardiol. 2022;47(9):101272. doi:10.1016/j.cpcardiol.2022.101272.
14. Россейкин Е. В., Воеводин А. Б., Раджабов Д. А. и др. Аутотрансплантация внутренней сонной артерии у пациентов с высоким распространением атеросклеротической бляшки. Ангиология и сосудистая хирургия. 2017;23(1):104-10.
15. Казанцев А. Н., Виноградов Р. А., Ерофеев А. А. и др. Проблема выбора метода реваскуляризации при сочетанном поражении коронарных и сонных артерий. обзор действующих рекомендаций и серии статей. Неотложная медицинская помощь. Журнал им. Н. В. Склифосовского. 2022;11(1):147-57. doi:10.23934/2223-9022-2022-11-1-147-157.
16. Казанцев А. Н., Бурков Н. Н., Борисов В. Г. и др. Компьютерное моделирование гемодинамических показателей в бифуркации сонных артерий после каротидной эндартерэктомии. Ангиология и сосудистая хирургия. 2019;25(3):107-12. doi:10.33529/ANGIO2019311.
17. Малева О. В., Трубникова О. А., Сырова И. Д. и др. Частота развития послеоперационной когнитивной дисфункции после симультанной операции на коронарных и внутренних сонных артериях при асимптомном течении церебрального атеросклероза. Журнал неврологии и психиатрии им. C. C. Корсакова. 2020;120(3-2):5-12. doi:10.17116/jnevro20201200325.
18. Бокерия Л. А., Бахметьев А. С., Коваленко В. И. и др. Выбор метода каротидной эндартерэктомии при атеросклеротическом поражении внутренней сонной артерии. Анналы хирургии. 2017;22(5):265-71. doi:10.18821/1560-9502-2017-22-5-265-271.
19. Казанцев А. Н., Виноградов Р. А., Артюхов С. В. и др. Гибридная реваскуляризация головного мозга и миокарда: какая каротидная эндартерэктомия предпочтительна? Анналы клинической и экспериментальной неврологии. 2021;15(4):15-26. doi:10.54101/ACEN.2021.4.2.
20. Гавриленко А. В., Куклин А. В., Фомина В. В. Классическая и эверсионная каротидная эндартерэктомия у пациентов со стенозом внутренней сонной артерии. Хирургия. Журнал им. Н. И. Пирогова. 2018;2:87-92. doi:10.17116/hirurgia2018287-92.
21. Казанцев А. Н., Черных К. П., Виноградов Р. А. и др. Многоцентровое исследование: исходы каротидной эндартерэктомии в зависимости от конфигурации Виллизиева круга. Российский медико-биологический вестник имени академика И. П. Павлова. 2021;29(3):397-409. doi:10.17816/PAVLOVJ61088.
22. Казанцев А. Н., Виноградов Р. А., Ерофеев А. А. и др. Протяженное поражение внутренней сонной артерии: шесть видов реконструкции. результаты многоцентрового исследования. Кардиология и сердечно-сосудистая хирургия. 2021;14(5):354-69.
23. Казанцев А. Н., Черных К. П., Лидер Р. Ю. и др. Гломус-сберегающая каротидная эндартерэктомия по А. Н. Казанцеву. Госпитальные и среднеотдаленные результаты. Патология кровообращения и кардиохирургия. 2020;24(3):70-9. doi:10.21688/1681-3472-2020-3-70-79.
24. Виноградов Р. А., Матусевич В. В. Результаты применения гломуссохраняющих каротидных эндартерэктомий. Медицинский вестник Северного Кавказа. 2017;12(4):467-8.
25. Казанцев А. Н., Черных К. П., Лидер Р. Ю. и др. Экстренная гломус-сберегающая каротидная эндартерэктомия по А. Н. Казанцеву. Неотложная медицинская помощь. Журнал им. Н. В. Склифосовского. 2020;9(4):494-503. doi:10.23934/2223-9022-2020-9-4-494-503.
26. Казанцев А. Н., Тарасов Р. С., Бурков Н. Н. и др. Каротидная эндартерэктомия: трехлетние результаты наблюдения в рамках одноцентрового регистра. Ангиология и сосудистая хирургия. 2018;24(3):101-8.
27. Лысенко А. В., Белов Ю. В., Катков А. И. и др. Хирургическое лечение ложной аневризмы внутренней сонной артерии после каротидной эндартерэктомии. Хирургия. Журнал им. Н. И. Пирогова. 2016;7:80-4. doi:10.17116/hirurgia2016780-84.
28. Фокин А. А., Куватов А. В., Роднянский Д. В. и др. Сравнительные непосредственные результаты использования расширяющей заплаты из различных материалов при каротидной эндартерэктомии. Вестник экспериментальной и клинической хирургии. 2011;4(1):140-2.
29. Казанцев А. Н., Тарасов Р. С., Бурков Н. Н. и др. Прогрессирование прецеребрального атеросклероза и предикторы ишемических осложнений у пациентов кардиохирургического профиля. Хирургия. Журнал им. Н. И. Пирогова. 2020;7:31-8. doi:10.17116/hirurgia202007131.
30. Казанцев А. Н., Черных К. П., Заркуа Н. Э. и др. Эверсионная каротидная эндартерэктомия: транспозиция внутренней сонной артерии над подъязычным нервом. Хирургия. Журнал им. Н. И. Пирогова. 2021;6:63-71. doi:10.17116/hirurgia202106163.
31. Данилович А. И., Тарасов Р. С. Чрескожное коронарное вмешательство и каротидная эндартерэктомия в гибридном и поэтапном режиме: описание клинических наблюдений (клиническое наблюдение). Диагностическая и интервенционная радиология. 2020;14(3):73-80. doi:10.25512/DIR.2020.14.3.08.
32. Казанцев А. Н., Черных К. П., Заркуа Н. Э. и др. Выбор оптимального метода реваскуляризации при полном стил-синдроме. Кардиология и сердечно-сосудистая хирургия. 2021;14(2):195-201. doi:10.17116/kardio202114021195.
33. Казанцев А. Н., Хубулава Г. Г., Кравчук В. Н. и др. Эволюция каротидной эндартерэктомии. Обзор литературы. Патология кровообращения и кардиохирургия. 2020;24(4):22-32. doi:10.21688/1681-3472-2020-4-22-32.
34. Казанцев А. Н., Виноградов Р. А., Ерофеев А. А. и др. Многоцентровое исследование по изучению результатов каротидной эндартерэктомии в разных возрастных группах с анализом предикторов осложнений. Кардиология и сердечно-сосудистая хирургия. 2021;14(4):280-91. doi:10.17116/kardio202114041280.
35. Казанцев А. Н., Черных К. П., Заркуа Н. Э. и др. "Чик-чирик" каротидная эндартерэктомия. Бюллетень НЦССХ им. А. Н. Бакулева РАМН. Сердечно-сосудистые заболевания. 2020;21(4):414-28. doi:10.24022/1810-0694-2020-21-4-414-428.
36. Казанцев А. Н., Тарасов Р. С., Бурков Н. Н. и др. Госпитальные результаты чрескожного коронарного вмешательства и каротидной эндартерэктомии в гибридном и поэтапном режимах. Ангиология и сосудистая хирургия. 2019;25(1):101-7. doi:10.33529/angio2019114.
37. Чернявский М. А., Иртюга О. Б., Янишевский С. Н. и др. Российский консенсус по диагностике и лечению пациентов со стенозом сонных артерий. Российский кардиологический журнал. 2022;27(11):5284. doi:10.15829/1560-4071-2022-5284.
38. Тарасов Р. С., Казанцев А. Н., Иванов С. В. и др. Факторы риска неблагоприятного исхода различных хирургических стратегий лечения пациентов с сочетанным поражением коронарного русла и сонных артерий в 30-дневном послеоперационном периоде. Патология кровообращения и кардиохирургия. 2018;22(1):36-48. doi:10.21688/1681-3472-2018-1-36-48.
39. Казанцев А. Н., Чернявский М. А., Виноградов Р. А. и др. Имплантация длинной биологической заплаты во время классической каротидной эндартерэктомии при протяженном атеросклеротическом поражении. отдаленные результаты. Вестник трансплантологии и искусственных органов. 2021;23(1):112-24. doi:10.15825/1995-1191-2021-1-112-124.
40. Казанцев А. Н., Виноградов Р. А., Захаров Ю. Н. и др. Прогнозирование рестеноза после каротидной эндартерэктомии методом компьютерного моделирования. Неотложная медицинская помощь. Журнал им. Н. В. Склифосовского. 2021;10(2):401-7. doi:10.23934/2223-9022-2021-10-2-401-407.
Об авторах
М. С. СаутинаРоссия
Саутина Мария С. — студент.
Санкт-Петербург
Конфликт интересов:
нет
А. С. Соколова
Россия
Соколова Алина С. — студент.
Санкт-Петербург
Конфликт интересов:
нет
А. С. Буторина
Россия
Буторина Александра С. — студент.
Санкт-Петербург
Конфликт интересов:
нет
Л. И. Пучнина
Россия
Пучнина Лада Ивановна — студент.
Санкт-Петербург
Конфликт интересов:
нет
Р. М. Рыльский
Россия
Ростислав Максимович Рыльский — студент.
Санкт-Петербург
Конфликт интересов:
нет
Д. В. Шматов
Россия
Доктор медицинских наук, профессор, заместитель главного врача по сердечно-сосудистой хирургии.
Санкт-Петербург
Конфликт интересов:
нет
А. В. Коротких
Россия
Коротких Александр В. — главный врач.
Благовещенск
Конфликт интересов:
нет
О. В. Лебедев
Россия
Лебедев Олег В. — кандидат медицинских наук, заместитель главного врача по лечебной работе.
Кострома, Ярославль
Конфликт интересов:
нет
С. В. Артюхов
Россия
Артюхов Сергей В. — кандидат медицинских наук, заместитель главного врача, зав. операционным блоком.
Санкт-Петербург
Конфликт интересов:
нет
О. Ш. Мухторов
Россия
Мухторов Отабек Ш. — сердечно-сосудистый хирург.
Кострома
Конфликт интересов:
нет
Р. Ю. Лидер
Россия
Лидер Роман Ю. — студент.
Кемерово
Конфликт интересов:
нет
Ш. Ван
Россия
Ван Шовэнь — ординатор.
Москва
Конфликт интересов:
нет
Л. В. Рошковская
Россия
Рошковская Людмила В. — кандидат медицинских наук, заместитель главного врача по неврологии.
Санкт-Петербург
Конфликт интересов:
нет
М. А. Хетагуров
Россия
Хетагуров Михаил А. — кандидат медицинских наук, главный хирург.
Кострома
Конфликт интересов:
нет
В. М. Унгурян
Россия
Унгурян Владимир М. — кандидат медицинских наук, главный врач.
Кострома
Конфликт интересов:
нет
М. П. Чернявин
Россия
Чернявин Максим П. — кандидат медицинских наук, сердечно-сосудистый хирург.
Москва
Конфликт интересов:
нет
Г. Ш. Багдавадзе
Россия
Багдавадзе Годерзи Ш. — сердечно-сосудистый хирург.
Санкт-Петербург
Конфликт интересов:
нет
П. Д. Палагин
Россия
Палагин Петр Д. — сердечно-сосудистый хирург, ORCID: 0000-0002-8922-2456,
Санкт-Петербург
Конфликт интересов:
нет
А. А. Сироткин
Россия
Сироткин Алексей А. — сердечно-сосудистый хирург.
Кострома
Конфликт интересов:
нет
А. Н. Казанцев
Россия
Антон Николаевич Казанцев — заведующтй отделением сосудистой хирургии, главный внештатный сердечно-сосудистый хирург Костромской области.
Кострома
Конфликт интересов:
нет
Дополнительные файлы
Рецензия
Для цитирования:
Саутина М.С., Соколова А.С., Буторина А.С., Пучнина Л.И., Рыльский Р.М., Шматов Д.В., Коротких А.В., Лебедев О.В., Артюхов С.В., Мухторов О.Ш., Лидер Р.Ю., Ван Ш., Рошковская Л.В., Хетагуров М.А., Унгурян В.М., Чернявин М.П., Багдавадзе Г.Ш., Палагин П.Д., Сироткин А.А., Казанцев А.Н. "Festina lente" — многоцентровое исследование по изучению результатов каротидной эндартерэктомии в зависимости от скорости выполнения сосудистого шва. Российский кардиологический журнал. 2023;28(2):5309. https://doi.org/10.15829/1560-4071-2023-5309
For citation:
Sautina M.S., Sokolova A.S., Butorina A.S., Puchnina L.I., Rylsky R.M., Shmatov D.V., Korotkikh A.V., Lebedev O.V., Artyukhov S.V., Mukhtorov O.Sh., Leader R.Yu., Wang Sh., Roshkovskaya L.V., Khetagurov M.A., Unguryan V.M., Chernyavin M.P., Bagdavadze G.Sh., Palagin P.D., Sirotkin A.A., Kazantsev A.N. "Festina lente" — a multicenter study on the outcomes of carotid endarterectomy, depending on vessel suturing speed. Russian Journal of Cardiology. 2023;28(2):5309. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5309
JATS XML

















































