Перейти к:
Современные подходы к диагностике и лечению саркоидоза сердца: результаты когортного исследования
https://doi.org/10.15829/1560-4071-2023-5301
Аннотация
Цель. Провести анализ клинико-инструментальных данных у пациентов с документированным саркоидозом сердца, обозначив ключевые моменты диагностики и выбора оптимального метода лечения.
Материал и методы. За период с 2016 по 2021гг в когортное исследование по обращаемости включено 63 пациента (50,4±14,1 лет). На основании стандартного обследования выделено 15 пациентов (41±13 лет), которые продолжили обследование для подтверждения диагноза "саркоидоз сердца". Магнитно-резонансная томография (МРТ) сердца с контрастным усилением выполнена 10 пациентам, эндомиокардиальная биопсия 7 пациентам. Всем пациентам выполнена позитронно-эмиссионная томография (ПЭТ) с 18F фтордезоксиглюкозой.
Результаты. Наиболее частым электрокардиографическим феноменом, который встречался в 53% случаев, была блокада правой ножки пучка Гиса. Желудочковые нарушения ритма и атриовентрикулярные-блокады высоких градаций регистрировались в основном у пациентов с документированной активностью. Зоны региональных нарушений сократительной способности преимущественно выявлялись у пациентов с кардиальным фиброзом. Отсроченное контрастирование по данным МРТ сердца регистрировалось преимущественно интрамурально в области межжелудочковой перегородки и субэпикардиальных зонах боковой стенки левого желудочка (ЛЖ). При анализе результатов ПЭТ нами установлено преимущественное накопление радиофармпрепарата в межжелудочковой перегородке (56%), боковой (44%) и передней (33%) стенках ЛЖ. Существенного улучшения глобальной сократительной способности ЛЖ на фоне иммуносупрессивной терапии, особенно, у пациентов со сниженной фракцией выброса, получено не было: исходно 49,2±10,1% vs 46,9±14,9% на фоне терапии (р=0,658).
Заключение. Определенная настороженность врача и соблюдение алгоритма ранней диагностики саркоидоза сердца позволяет минимизировать риски, связанные с развитием фатальных сердечно-сосудистых осложнений. Напротив, в случае поздней диагностики даже применение агрессивной иммуносупрессивной терапии не приводит к улучшению глобальной сократительной способности миокарда, а зоны фиброза могут быть причиной развития жизнеугрожающих брадиаритмий и желудочковых нарушений ритма.
Для цитирования:
Майрина С.В., Рыжкова Д.В., Митрофанова Л.Б., Рыжков А.В., Муртазалиева П.М., Моисеева О.М. Современные подходы к диагностике и лечению саркоидоза сердца: результаты когортного исследования. Российский кардиологический журнал. 2023;28(5):5301. https://doi.org/10.15829/1560-4071-2023-5301
For citation:
Mairina S.V., Ryzhkova D.V., Mitrofanova L.B., Ryzhkov A.V., Murtazalieva P.M., Moiseeva O.M. Modern approaches to the diagnosis and treatment of cardiac sarcoidosis: results of a cohort study. Russian Journal of Cardiology. 2023;28(5):5301. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5301
Саркоидоз — это системное гранулематозное заболевание, поражающее преимущественно легкие (в 90% случаев), а также лимфатические узлы (10-20%), кожу (15%), глаза (10-30%), печень (20-30%) и ряд других органов, в т.ч. сердце [1]. Несмотря на неуклонно растущее за последние десятилетия количество публикаций, посвященных саркоидозу, этиология и патофизиология этого заболевания остаются мало изучены. Наряду с аутоиммунной природой саркоидоза, все чаще обсуждается роль дисрегуляции иммунного ответа, нарушений процессов аутофагии и участия инфламмасом в патогенезе заболевания, которые активно рассматриваются в качестве дополнительных мишеней для терапевтического воздействия [2].
Саркоидоз сердца как один из вариантов гигантоклеточного миокардита относится к редким воспалительным заболеваниям миокарда с крайне неблагоприятным прогнозом и вариабельным дебютом заболевания, что затрудняет его диагностику. Наличие ранее диагностированных экстракардиальных проявлений саркоидоза при соблюдении алгоритма обследования и определенной настороженности врача существенно упрощает диагностику вовлечения сердца в патологический процесс1.
Поражение сердца, выявляемое у 20-25% больных с саркоидозом, как правило, бывает бессимптомным или малосимптомным. Клинически значимые кардиальные проявления встречаются в 5% случаев и связаны с развитием жизнеугрожающих желудочковых нарушений ритма (ЖНР), нарушений проводимости высоких градаций, сердечной недостаточности (СН) и внезапной сердечной смерти, что подчеркивает важность своевременной диагностики данной патологии, особенно, при изолированных вариантах саркоидоза сердца [1][3].
Цель настоящей работы — провести анализ клинико-инструментальных данных у пациентов с документированным саркоидозом сердца, обозначив ключевые моменты диагностики и выбора оптимального метода лечения.
Материал и методы
За период с 2016 по 2021гг в когортное исследование по обращаемости включено 63 пациента в возрасте 21-74 (50,4±14,1) лет, из которых 65% женщин (n=43). Все исследования с участием пациентов были выполнены в соответствии с нормами Хельсинкской декларации, после подписания информированного согласия.
Диагноз саркоидоза подтверждался в соответствии с клиническими рекомендациями Министерства здравоохранения России (2019). Диагностика саркоидоза сердца проводилась на основании диагностических критериев, предложенных Японским циркуляторным обществом [4].
На основании диагностических критериев с помощью стандартного электрокардиографического (ЭКГ) и эхокардиографического (ЭхоКГ) обследования (Vivid 7, GE, США) из общей выборки выделено 15 пациентов (средний возраст 41±13 лет), которые продолжили обследование для подтверждения диагноза "саркоидоз сердца". Среди включенных в исследование 73% больных были направлены врачами других специальностей и имели в анамнезе морфологически подтвержденный внекардиальный саркоидоз. Четверо пациентов были госпитализированы в НМИЦ в связи с развитием жизнеугрожающих нарушений ритма и/или проводимости. Магнитно-резонансная томография (МРТ) сердца с контрастным усилением (гадовист Gd-DO3A 0,2 мл/кг массы тела) на высокопольном Magnetom Trio A Tim 3,0 Т (Siemens) выполнена 10 пациентам. Позитронно-эмиссионная томография (ПЭТ) с 18F-фтордезоксиглюкозой (ФДГ) проводилась в 15 случаях, эндомиокардиальная биопсия (ЭМБ) — у 7 пациентов. Клинико-демографическая характеристика включенных в исследование пациентов представлена в таблице 1.
Описательная статистика использовалась для учета демографических и клинических характеристик. Непрерывные переменные представлены как среднее значение и стандартное отклонение или как медиана и межквартильный диапазон в зависимости от типа распределения, тогда как категориальные данные были выражены в виде частот и процентов. Сравнение исходных данных пациентов было выполнено с помощью U-критерия Манна-Уитни для непрерывных переменных и точного критерия Фишера для категориальных переменных. Для сравнения данных двух зависимых выборок использован тест Уилкоксона. Значения р<0,05 считались статистически значимыми. Статистический анализ был выполнен с помощью пакета статистического программного обеспечения Statistica 10.0 (Statsoft, США).
Результаты
Проводя анализ клинико-инструментальных данных пациентов с документированным саркоидозом сердца, мы попытались выявить ряд специфичных признаков, знание которых помогло бы практикующему врачу в своевременной постановке диагноза.
Представители женского пола превалировали среди всех пациентов с саркоидозом, но их число было максимальным в подгруппе с активной формой заболевания (табл. 2). Наименьший интервал времени от дебюта заболевания до постановки диагноза был выявлен в подгруппе с активным саркоидозом сердца.
Наиболее частым ЭКГ феноменом, который встречался в 53% случаев (n=8), была блокада правой ножки пучка Гиса, наиболее часто выявляемая (n=6,67%) у пациентов с активным воспалительным процессом. Напротив, блокада левой ножки пучка Гиса была представлена только у 3 из 6 пациентов (50%), у которых в дальнейшем активность не была подтверждена с помощью ПЭТ с 18F-ФДГ. Атриовентрикулярные (АВ) блокады высоких градаций зарегистрированы только у 3 пациентов, причем у 2 на фоне активности специфического процесса. Аналогичная ситуация наблюдалась и в отношении ЖНР, которые регистрировались в основном у пациентов с документированной активностью (табл. 2).
ЭхоКГ традиционно используется в качестве основного скринингового метода диагностики сердечного саркоидоза. ПЭТ-негативные пациенты имели не только большую длительность заболевания, но и более выраженные структурно-функциональные изменения как левых, так и правых камер сердца. Зоны региональных нарушений сократительной способности преимущественно выявлялись у пациентов с кардиальным фиброзом по сравнению с пациентами, имевшими документированную активность: 100% vs 55,6%, соответственно, p=0,103.
В соответствии с МРТ критериями, предложенными экспертами Европейского общества кардиологов, диагноз воспалительного заболевания миокарда наиболее вероятен, если присутствуют отек миокарда на Т2-взвешенных изображениях (Т2-ВИ) и отсроченное контрастирование (LGE) [5]. У всех пациентов с документированным саркоидозом сердца подтверждено наличие LGE(+), преимущественно локализованного интрамурально в области межжелудочковой перегородки (МЖП) и субэпикардиальных зонах боковой стенки левого желудочка (ЛЖ). Только у ПЭТ-позитивных пациентов зоны LGE(+) совпадали с отеком миокарда на Т2-ВИ, образуя за счет повышения интенсивности сигнала своеобразные узлы в базальной части МЖП (рис. 1).
В пяти клинических случаях на основании выявления лимфоцитарно-макрофагальной инфильтрации и типичных штампованных гранулем c эпителиоидными многоядерными клетками в биоптатах миокарда подтвержден диагноз активного гранулематозного миокардита (рис. 2). У 2 пациентов, которым выполнялась ЭМБ, выявлена рубцовая стадия гранулемы с заместительным фиброзом и незначительным количеством инфильтрирующих лимфоцитов.
ПЭТ с 18F-ФДГ широко используется для диагностики саркоидоза сердца и других более редких вариантов мультиорганного поражения [6]. При анализе ПЭТ преимущественное накопление радиофармпрепарата выявлено в МЖП (56%), боковой (44%) и передней (33%) стенках ЛЖ (рис. 3). В соответствии с рекомендациями общества ядерной медицины и молекулярной визуализации стандартизированные значения поглощения (SUV) 18F-ФДГ могут выступать в качестве индикатора активности саркоидоза, но реальные пороговые значения данного показателя для диагностики саркоидоза пока не определены. Вместе с тем получены убедительные доказательства, что ПЭТ с 18F-ФДГ, наряду с несомненной диагностической ценностью, имеет важное прогностическое значение и может быть использована для оценки эффективности проводимой терапии [7].
Все пациенты с верифицированным диагнозом саркоидоза сердца получали стандартную терапию СН: бета-адреноблокаторы — 80%, ингибиторы ангиотензинпревращающего фермента/ангиотензиновых рецепторов и неприлизина ингибитор — 86%, антагонисты альдостерона — 53%, петлевые диуретики — 53%. Терапия преднизолоном в дозе 0,5-1 мг/кг веса в зависимости от степени тяжести основного заболевания проводилась в стероид-сберегающем режиме, т.е. в сочетании с метотрексатом в дозе 15 мг/нед. Снижение дозы преднизолона начинали через 2-6 нед. в зависимости от клинической ситуации и в дальнейшем определяли путем повторных ПЭТ исследований, проводимых с интервалом в 3-6 мес. После получения ПЭТ-негативных результатов терапия метотрексатом отменялась, и пациенты оставались на поддерживающей дозе преднизолона 5-10 мг/сут. Попытка отменить поддерживающую терапию преднизолоном у 2 пациентов привела к рецидиву заболевания. Пациентам со сниженной ≤35% фракцией выброса (ФВ), жизнеугрожающими ЖНР и/или брадиаритмиями имплантация кардиовертера-дефибриллятора (ИКД) проводилась параллельно с инициацией иммуносупрессивной терапии (n=4). У 6 пациентов купирование воспалительного процесса не привело к снижению частоты ЖНР, что потребовало проведения радиочастотной аблации в "холодном" периоде. Существенного улучшения глобальной сократительной способности ЛЖ на фоне иммуносупрессивной терапии, особенно, у пациентов с исходно сниженной ФВ, получено не было: 49,2±10,1% vs 46,9±14,9% (р=0,658) на фоне терапии.
Таблица 1
Клинико-инструментальная характеристика пациентов с саркоидозом сердца
|
Показатели |
Пациенты с саркоидозом сердца, n=15 |
|
Возраст, лет |
41,0±13,0 |
|
Женский пол, n (%) |
9 (60%) |
|
Индекс массы тела, кг/м2 |
27,9±4,4 |
|
Анамнез экстракардиального саркоидоза — легкие — внутригрудные лимфатические узлы — саркоидоз кожи — печень/селезенка — почки — костный или суставной саркоидоз |
11 (73%) 10 (67%) 8 (53%) 2 (13%) 1 (7%) 1 (7%) |
|
Длительность заболевания, лет |
7 (4; 8) |
|
Время от момента развития заболевания до постановки диагноза саркоидоза сердца, лет |
2,0 (0,5; 6,0) |
|
Варианты дебюта саркоидоза сердца — ЖНР, n (%) — в т.ч. устойчивая ЖТ, n (%) — АВ-блокады 2-3 степени, n (%) — сердечная недостаточность III-IV ФК, n (%) |
11 (73%) 9 (60%) 3 (20%) 9 (60%) |
|
Методы оценки активности саркоидоза сердца — МРТ сердца, n (%) — ПЭТ с 18F-ФДГ, n (%) — ЭМБ, n (%) |
10 (67%) 15 (100%) 7 (47%) |
Сокращения: АВ — атриовентрикулярный(ая), ЖНР — желудочковые нарушения ритма, ЖТ — желудочковая тахикардия, МРТ — магнитно-резонансная томография, ПЭТ — позитронно-эмиссионная томография, ФДГ — фтордезоксиглюкоза, ФК — функциональный класс, ЭМБ — эндомиокардиальная биопсия.
Таблица 2
Клинико-инструментальные данные и результаты морфологических исследований в зависимости от активности гранулематозного процесса
|
Показатели |
Активное воспаление в миокарде, n=9 |
Данных за активный процесс в миокарде нет, n=6 |
Достоверность различий |
|
Возраст |
38 (32; 47) |
37,5 (32; 63) |
0,776 |
|
Женский пол, n (%) |
7 (78%) |
2 (33%) |
0,119 |
|
Индекс массы тела, кг/м2 |
27,9±4,9 |
28,0±4,0 |
0,864 |
|
Анамнез экстракардиального саркоидоза |
4 (44%) |
5 (83%) |
0,168 |
|
Время от момента развития заболевания до постановки диагноза саркоидоза сердца, лет |
1 (0,5; 3,0) |
2,5 (2,0; 6,0) |
0,388 |
|
ЖНР, в т.ч. устойчивая ЖТ, n (%) |
8 (73%) |
1 (17%) |
0,011 |
|
АВ-блокады 2-3 степени, n (%) |
2 (22%) |
1 (17%) |
0,659 |
|
Блокады ножек пучка Гиса, n (%) |
7 (78%) |
4 (67%) |
0,538 |
|
СН III-IV ФК, n (%) |
5 (56%) |
4 (67%) |
0,545 |
|
Эхокардиография, n=15 |
|||
|
Диаметр ЛП, мм |
38,5 (37; 40,5) |
43,5 (36; 48) |
0,345 |
|
КДР ЛЖ, мм |
51,5 (47,5; 56) |
63 (56; 66) |
0,059 |
|
КСР ЛЖ, мм |
33 (29; 43) |
52 (37; 55) |
0,093 |
|
ФВ ЛЖ, ٪ |
52 (38,5; 58,5) |
41 (26; 48) |
0,228 |
|
МЖП, мм |
11,5 (10; 13,5) |
9,5 (8; 10,0) |
0,142 |
|
Ve/Va |
1,08±0,32 |
1,35±0,73 |
0,639 |
|
Размер ПЖ парастернальный, мм |
29 (24; 33) |
38 (34; 39) |
0,030 |
|
Магнитно-резонансная томография сердца, n=10 |
|||
|
n=5 |
n=5 |
||
|
LGE(+) + Т2-ВИ (+), n (%) |
5 (100%) |
1 (20%) |
0,024 |
|
LGE(+), n (%) |
5 (100%) |
5 (100%) |
|
|
ПЭТ с 18F-фтордезоксиглюкозой, n=15 |
|||
|
Накопление РФП в миокарде, n (%) |
9 (60%) |
6 (40%) |
<0,0001 |
|
Терапия |
|||
|
иАПФ/АРНИ, n (%) |
8 (88,9%) |
5 (83,3%) |
0,657 |
|
Амиодарон, n (%) |
6 (66,7%) |
1 (16,7%) |
0,084 |
|
ИКД, n (%) |
5 (55,6%) |
1 (16,7%) |
0,238 |
|
Глюкокортикостероиды, n (%) |
9 (100%) |
2 (33,3%) |
0,011 |
Сокращения: АВ — атриовентрикулярный(ая), иАПФ — ингибиторы ангиотензинпревращающего фермента, АРНИ — ангиотензиновых рецепторов и неприлизина ингибитор, ЖНР — желудочковые нарушения ритма, ЖТ — желудочковая тахикардия, ИКД — имплантируемый кардиовертер-дефибриллятор, КДР — конечно-диастолический размер, КСР — конечно-систолический размер, КТ — компьютерная томография, ЛЖ — левый желудочек, ЛП — левое предсердие, МЖП — межжелудочковая перегородка, ПЭТ — позитронно-эмиссионная томография, РФП — радио-фарм препарат, СН — сердечная недостаточность, Т2-ВИ — Т2 взвешенное изображение, ФВ — фракция выброса, ФК — функциональный класс, ЭМБ — эндомиокардиальная биопсия, Ve/Va — соотношение скоростей раннего пассивного и позднего предсердного наполнения, LGE — отсроченное контрастирование.
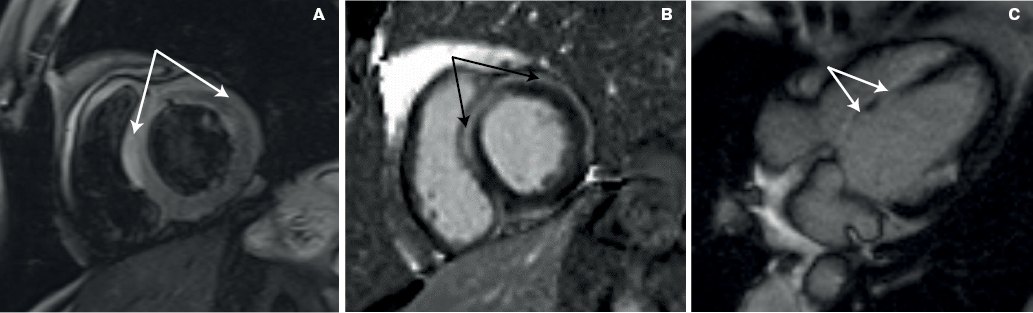
Рис. 1. МРТ пациента с изолированным саркоидозом сердца: А. TIRM импульсная последовательность, отек миокарда в области МЖП и в субэпикардиальных отделах боковой стенки; B. Накопление контрастного вещества интрамурально в МЖП и субэпикардиальных отделах боковой стенки; С. Зоны повышения интенсивности сигнала в МЖП за счет совпадения зон отсроченного контрастирования с отеком миокарда.
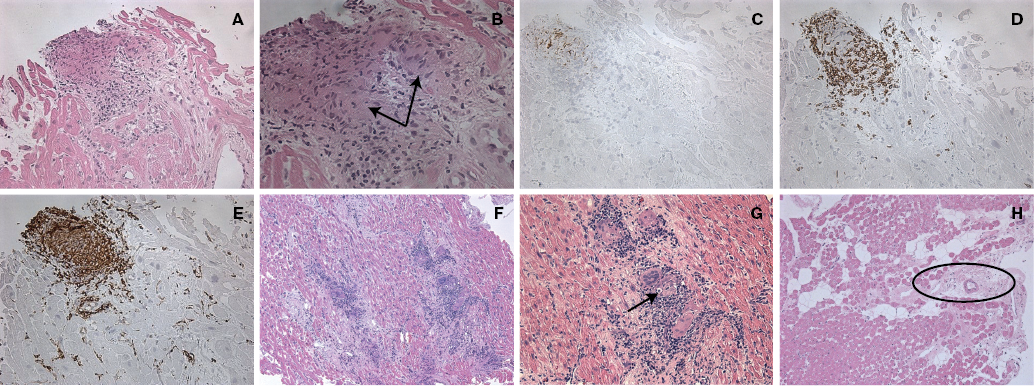
Рис. 2. ЭМБ пациентов с саркоидозом сердца. А-Е. Больная Р., 33 года. А. Гранулема без некроза; окраска гематоксилином и эозином; х200. B. Гранулема в центре представлена гигантскими многоядерными клетками (отмечены стрелками), эпителиоидными клетками, а по периферии — лимфоцитами; окраска гематоксилином и эозином; х400. С. Экспрессия CD68 в эпителиоидных клетках, макрофагах и гигантских многоядерных клетках; D. Экспрессия CD3 на лимфоцитах по периферии гранулемы; E. Экспрессия HLA-DR на клетках гранулемы и капиллярах; х200. F-G. Больной Б., 55 лет. Гранулематозный миокардит. F. Штампованные гранулемы с гигантскими многоядерными клетками; х100. G. Тельца Шауманна и астероидные тельца (указано стрелкой) в гигантских многоядерных клетках гранулемы; х200. H. Больной Г. Фиброзированная гранулема (обведена овалом); гематоксилин и эозин; х100.
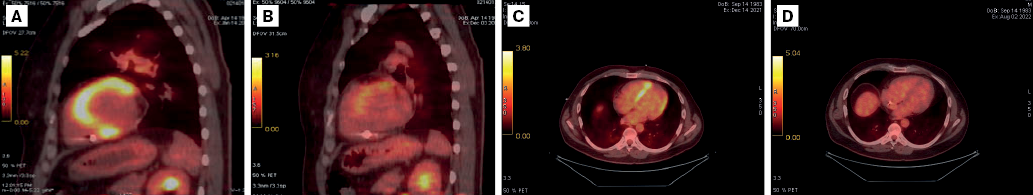
Рис. 3. ПЭТ сердца с 18F-ФДГ: пациент 1 А — исходные данные, В — признаки активности воспалительного процесса на фоне лечения глюкокортикостероидами в течение 6 мес.; пациент 2 С — исходные данные, D — отсутствие данных за активность специфического процесса через 6 мес. на фоне комбинированной иммуносупрессивной терапии (преднизолон + метотрексат).
Обсуждение
Среди включенных в исследование преобладали пациенты женского пола как в общей группе документированного саркоидоза, так и группе саркоидоза сердца. По данным университета Цинциннати (США) пациенты женского пола имели в 2 раза меньшую частоту поражения сердца по сравнению с мужчинами [8], тогда как в Японии саркоидоз сердца в большей степени распространен среди женщин среднего и старшего возраста [4]. Открытым остается вопрос, обусловлены ли гендерные различия в нашей выборке особенностями российской популяции или они связаны с ограниченным числом наблюдений?
Несмотря на большое количество исследований, до сих пор не сформировано единое представление об алгоритме диагностики саркоидоза сердца. По мнению ряда экспертов, все пациенты с экстракардиальным саркоидозом должны проходить скрининг на вовлечение сердца в патологический процесс, т.к. риск развития сердечно-сосудистых осложнений при этой патологии значительно превышает общепопуляционные показатели [9]. В настоящее время существует несколько клинических сценариев, которые позволяют предположить диагноз саркоидоза сердца. У пациентов c ранее диагностированным экстракардиальным саркоидозом появление перебоев в работе сердца, обморочных состояний, изменений на ЭКГ в виде желудочковых, реже суправентрикулярных нарушений ритма, нарушений проводимости (блокада правой ножки пучка Гиса, АВ-блокады) и ЭхоКГ феноменов, таких как региональные и глобальные нарушения сократительной способности, требует дополнительного обследования для исключения поражения сердца. Таким образом, примененный в нашем исследовании скрининговый алгоритм, включающий анализ клинико-анамнестических данных, результатов ЭКГ, в т.ч. суточного мониторирования ЭКГ, и ЭхоКГ данных, позволил выявить пациентов с сердечным саркоидозом. Наибольшие трудности в плане диагностики поражения сердца представляют пациенты без предшествующего анамнеза саркоидоза. Поэтому у пациентов, особенно ≤60 лет, с жизнеугрожающими ЖНР, картиной недавно возникшей СН и АВ-блокадами высоких градаций при проведении дифференциального диагноза должен исключаться изолированный саркоидоз сердца. Неожиданным для нас было отсутствие различий по данным ЭКГ, ЭхоКГ между пациентами с изолированным саркоидозом сердца и поражением сердца на фоне экстракардиальных проявлений. Вероятно, подобное сходство обусловлено различиями в длительности заболевания, которое предопределяет трансформацию активных гранулем в очаговый фиброз и, наряду с активным воспалением, самостоятельно может быть причиной прогрессирования СН, возникновения нарушений ритма и проводимости.
По мнению экспертов Японского циркуляторного общества, наибольшую специфичность (100%) для саркоидоза сердца имеет истончение МЖП (≤4 мм на расстоянии 10 мм от фиброзного кольца аортального клапана). Однако чувствительность данного феномена остается крайне низкой (12,6%) [4]. В подтверждение низкой его чувствительности свидетельствует и тот факт, что ни у одного из обследованных нами пациентов он не обнаружен. Напротив, у ряда пациентов наблюдалась гипертрофия МЖП в базальных отделах, что, вероятно, связно с активным воспалением и отеком миокарда. Глобальные (ФВ <50%) и региональные нарушения сократительной способности миокарда вследствие неравномерного распределения гранулем, а также формирование аневризм ЛЖ, сегодня приняты в качестве больших ЭхоКГ критериев диагностики саркоидоза сердца, наряду с истончением МЖП [4]. Дилатация правых камер сердца, выявляемая в нашем исследовании в основном у пациентов с неактивной формой заболевания, также может указывать на специфический генез поражения миокарда.
ЭМБ остается "золотым стандартом" диагностики саркоидоза сердца [10]. Однако очаговый гранулематозный процесс в миокарде ассоциирован с низкой диагностической ценностью ЭМБ (<25%). Выявление неказеозных эпителиоидноклеточных гранулём в биоптатах миокарда, как правило, указывает на диффузный характер поражения миокарда и, соответственно, на неблагоприятный прогноз. Об этом свидетельствуют и результаты нашего исследования, в котором не выявлено прироста ФВ на фоне проводимой терапии.
Внедрение современных методов неинвазивной диагностики, таких как МРТ сердца и ПЭТ с 18F-ФДГ, способствовало более раннему выявлению саркоидоза сердца. Хотя LGE при проведении МРТ сердца и не является специфическим признаком, его появление в интрамуральных и/или эпикардиальных зонах в сочетании с субэндокардиальным накоплением в базальных отделах МЖП и боковой стенки может повышать специфичность диагностики саркоидоза сердца. Метаанализ клинико-морфологических сопоставлений 649 клинических случаев показал, что МРТ сердца обладает 93% чувствительностью и 85% специфичностью для диагностики данной патологии [11]. Интерпретация данных МРТ сердца у пациентов с подозрением на саркоидоз должна включать оценку аномалий движения миокарда, увеличения толщины или фокального истончения стенки ЛЖ, а также расположения и степени выраженности LGE и отека миокарда. Однако LGE не позволяет отличить активное воспаление от фиброзных изменений. Поэтому только высокая интенсивность сигнала на Т2-ВИ говорит об активности воспалительного процесса. Повторная МРТ сердца может выявить уменьшение размера и/или тяжести LGE-позитивных зон по мере того, как на фоне лечения будет уменьшаться отек миокарда. Тем не менее целесообразность выполнения парных МРТ для подтверждения эффективности проводимой терапии пока не подтверждена [4].
Согласно рекомендациям по диагностике саркоидоза сердца, ПЭТ с 18F-ФДГ имеет чувствительность 89% и специфичность 78% [4]. Однако в более поздних публикациях при анализе 13 исследований, где результаты ПЭТ сопоставлялись с ЭМБ, чувствительность метода в диагностике активного воспаления при саркоидозе варьировала 89 до 100% [6]. В связи с гетерогенностью исследуемой популяции, о чем свидетельствуют и результаты нашего исследования, истинная специфичность ПЭТ с 18F-ФДГ явно недооценена. Для саркоидоза сердца характерна метаболическая активность в базальных (91%) и срединных (35,8%) отделах ЛЖ, а также в области верхушки (11,9%). Накопление радиофармпрепарата в правом желудочке встречается крайне редко (9%). Хотя SUV 18F-ФДГ не имеют диагностической ценности, максимальные значения SUV >5,4 и средние >4,9 ассоциированы с увеличение частоты сердечно-сосудистых осложнений, таких как желудочковая тахикардия, полная АВ-блокада, потребность в ИКД и СН III-IV функционального класса [12]. В связи с высокой воспроизводимостью метода серийные ПЭТ принято использовать для оценки эффективности проводимой терапии. В частности, в нашем исследовании отрицательные результаты ПЭТ-сканирования были основанием для редукции иммуносупрессивной терапии.
Учитывая высокий риск фатальных сердечно-сосудистых осложнений при саркоидозе сердца, имплантация ИКД рекомендуется пациентам с ФВ ≤35% в качестве первичной профилактики (I класс рекомендаций), а в качестве вторичной профилактики — при наличии устойчивой желудочковой тахикардии (I класс рекомендаций) или полной АВ-блокады (IIa класс рекомендаций) даже в условиях активного воспалительного процесса (ПЭТ или ЭМБ-позитивные пациенты) [13]. Напротив, у ПЭТ-негативных пациентов ИКД должна обсуждаться даже при ФВ >35% в случаях выявления LGE по данным МРТ сердца или индуцибельной устойчивой желудочковой тахикардии (IIa класс рекомендаций). У пациентов с ИКД проведение радиочастотной аблации в специализированных центрах может обсуждаться при устойчивой желудочковой тахикардии или развитии электрического шторма (IIb класс рекомендаций).
Эксперты Японского циркуляторного общества рекомендуют глюкокортикостероиды в качестве первой линии терапии при саркоидозе сердца в стартовой дозе преднизолона 0,5-1 мг/кг веса с последующим снижением на 5 мг ежемесячно до достижения поддерживающей дозы 5-10 мг в день к 6 мес. терапии [4]. Однако тяжесть клинических проявлений может потребовать назначения и более высоких доз стероидов. Поэтому раннее добавление стероид-сберегающего агента, в качестве которого часто используется метотрексат в дозе 10-20 мг/нед., позволяет минимизировать побочные эффекты стероидной терапии и в более короткие сроки достигнуть ремиссии [14]. В связи с тяжестью клинических проявлений заболевания в нашем исследовании все пациенты с активным саркоидозом получили комбинированную иммуносупрессивную терапию. Однако при снижении дозы преднизолона мы руководствовались принципами лечения больных с гранулематозным миокардитом [5].
Ограничения исследования. Ограниченный объем выборки не позволил оценить диагностическую и прогностическую ценность различных методов обследования пациентов с подозрением на саркоидоз сердца. Поэтому данное исследование носит в основном описательный характер.
Заключение
Определенная настороженность врача и соблюдение алгоритма ранней диагностики саркоидоза сердца позволяют минимизировать риски, связанные с развитием фатальных сердечно-сосудистых осложнений. Напротив, в случае поздней диагностики даже применение агрессивной иммуносупрессивной терапии не приводит к улучшению глобальной сократительной способности миокарда, а зоны фиброза могут быть причиной развития жизнеугрожающих брадиаритмий и ЖНР.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
1. Рекомендации Министерства здравоохранения Российской Федерации по ведению больных с саркоидозом, 2022.
Список литературы
1. Valeyre D, Prasse A, Nunes H, et al. Sarcoidosis. Lancet. 2014;383:1155-67. doi:10.1016/S0140-6736(13)60680-7.
2. Drent M, Crouser ED, Grunewald J. Challenges of Sarcoidosis and Its Management. N Engl J Med. 2021;385:1018-32. doi:10.1056/NEJMra2101555.
3. Воронкова О. О., Цветкова О. А., Авдеев С. Н. и др. Саркоидоз с поражением сердца и моноклональной гаммапатией. Кардиология. 2020;60(4):151-6. doi:10.18087/cardio.2020.4.n712.
4. Terasaki F, Azuma A, Anzai T, et al. JCS 2016 Guideline on Diagnosis and Treatment of Cardiac Sarcoidosis — Digest Version. Circ J. 2019;83:2329-88. doi:10.1253/circj.CJ-19-0508.
5. Caforio AL, Pankuweit S, Arbustini E, et al. Current state of knowledge on aetiology, diagnosis, management, and therapy of myocarditis: a position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur Heart J. 2013;34:2636-48. doi:10.1093/eurheartj/eht210.
6. Vender RJ, Aldahham H, Gupta R. The role of PET in the management of sarcoidosis. Curr Opin Pulm Med. 2022;28:485-91. doi:10.1097/MCP.0000000000000892.
7. Elwazir MY, Bois JP, Abou Ezzeddine OF, Chareonthaitawee P. Imaging and Quan¬tification of Cardiac Sarcoidosis. Semin Nucl Med. 2020;50:283-94. doi:10.1053/j.semnuclmed.2020.03.005.
8. Zhou Y, Lower EE, Li HP, et al. Cardiac Sarcoidosis: The Impact of Age and Implanted Devices on Survival. Chest. 2017;151:139-48. doi:10.1016/j.chest.2016.08.1457.
9. Yafasova A, Fosbøl EL, Schou M, et al. Long-Term Adverse Cardiac Outcomes in Patients with Sarcoidosis. J Am Coll Cardiol. 2020;76:767-77. doi:10.1016/j.jacc.2020.06.038.
10. Gilotra NA, Griffin JM, Pavlovic N, et al. Sarcoidosis-Related Cardiomyopathy: Current Knowledge, Challenges, and Future Perspectives State-of-the-Art Review. J Card Fail. 2022;28:113-32. doi:10.1016/j.cardfail.2021.06.016.
11. Zhang J, Li Y, Xu Q, et al. Cardiac Magnetic Resonance Imaging for Diagnosis of Cardiac Sarcoidosis: A Meta-Analysis. Can Respir J. 2018;2018:7457369. doi:10.1155/2018/7457369.
12. Flores RJ, Flaherty KR, Jin Z, Bokhari S. The prognostic value of quantitating and localizing F-18 FDG uptake in cardiac sarcoidosis. J Nucl Cardiol. 2020;27:2003-10. doi:10.1007/s12350-018-01504-y.
13. Zeppenfeld K, Tfelt-Hansen J, de Riva M, et al. 2022 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death. Eur Heart J. 2022;43:3997-4126. doi:10.1093/eurheartj/ehac262.
14. Giblin GT, Murphy L, Stewart GC, et al. Cardiac Sarcoidosis: When and How to Treat Inflammation. Card Fail Rev. 2021;7:e17. doi:10.15420/cfr.2021.16.
Об авторах
С. В. МайринаРоссия
Младший научный сотрудник научно-исследовательского отдела некоронарогенных заболеваний сердца
Санкт-Петербург
Конфликт интересов:
нет конфликта интерсов
Д. В. Рыжкова
Россия
Доктор медицинских наук, профессор, зав. кафедрой ядерной медицины и радиационных технологий, главный научный сотрудник научно-исследовательского отдела ядерной медицины
Санкт-Петербург
Конфликт интересов:
нет конфликта интересов
Л. Б. Митрофанова
Россия
Доктор медицинских наук, главный научный сотрудник НИЛ патоморфологии
Санкт-Петербург
Конфликт интересов:
нет конфликта интересов
А. В. Рыжков
Россия
Заведующий отделением магнитно-резонансной томографии
Санкт-Петербург
Конфликт интересов:
нет конфликта интересов
П. М. Муртазалиева
Россия
Младший научный сотрудник научно-исследовательского отдела некоронарогенных заболеваний сердца
Санкт-Петербург
Конфликт интересов:
нет конфликта интересов
О. М. Моисеева
Россия
Доктор медицинских наук, главный научный сотрудник, руководитель научно-исследовательского отдела некоронарогенных заболеваний сердца
Санкт-Петербург
Конфликт интересов:
нет конфликта интересов
Дополнительные файлы
Рецензия
Для цитирования:
Майрина С.В., Рыжкова Д.В., Митрофанова Л.Б., Рыжков А.В., Муртазалиева П.М., Моисеева О.М. Современные подходы к диагностике и лечению саркоидоза сердца: результаты когортного исследования. Российский кардиологический журнал. 2023;28(5):5301. https://doi.org/10.15829/1560-4071-2023-5301
For citation:
Mairina S.V., Ryzhkova D.V., Mitrofanova L.B., Ryzhkov A.V., Murtazalieva P.M., Moiseeva O.M. Modern approaches to the diagnosis and treatment of cardiac sarcoidosis: results of a cohort study. Russian Journal of Cardiology. 2023;28(5):5301. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5301

















































