Перейти к:
Новые возможности снижения уровня холестерина липопротеидов низкой плотности: сравнительные характеристики PCSK9-таргетной терапии
https://doi.org/10.15829/1560-4071-2022-5271
Аннотация
Распространение сердечно-сосудистых заболеваний носит характер эпидемии, в основе которой лежат нарушения липидного профиля, проявляющиеся гиперхолестеринемией. Многочисленные традиционные фармакологические инструменты снижения содержания холестерина, связанного с липопротеидами низкой плотности, не обеспечивают достижения целевых значений у многих категорий пациентов. Ингибирование пропротеинконвертазы субтилизина/кексина типа 9 (PCSK9) является перспективным направлением в ведении пациентов с атеросклеротическими заболеваниями и включает два основных инструмента — моноклональные антитела (алирокумаб и эволокумаб) и препарат, работающий по технологии малых интерферирующих РНК, инклисиран. Представленный обзор посвящен сравнительному анализу эффективности и безопасности препаратов указанных групп.
Для цитирования:
Зырянов С.К., Бутранова О.И. Новые возможности снижения уровня холестерина липопротеидов низкой плотности: сравнительные характеристики PCSK9-таргетной терапии. Российский кардиологический журнал. 2022;27(11):5271. https://doi.org/10.15829/1560-4071-2022-5271
For citation:
Zyryanov S.K., Butranova O.I. New opportunities for lowering low-density lipoprotein cholesterol: comparative characteristics of PCSK9-targeted therapy. Russian Journal of Cardiology. 2022;27(11):5271. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5271
Современная медицина использует большое количество инструментов, направленных на своевременную диагностику, лечение и профилактику сердечно-сосудистых заболеваний (ССЗ). Тем не менее, несмотря на интенсивные усилия, ССЗ остаются лидирующей причиной смертности и заболеваемости во всем мире. Согласно отчету о глобальном бремени заболеваний в мире (Global Burden of Disease), динамически обновляющемуся многонациональному проекту, отмечено, что распространенность общего числа случаев ССЗ почти удвоилась в период с 1990 по 2019гг: с 271 млн (95% интервал неопределенности (UI): 257-285 млн) до 523 млн (95% UI: 497-550 млн); число смертей от ССЗ выросло с 12,1 млн (95% UI: 11,4-12,6 млн) в 1990г до 18,6 млн (95% UI: 17,1-19,7 млн) в 2019г [1]. В основе роста распространенности ССЗ лежат низкие показатели здоровья сердечно-сосудистой системы: по данным американской национальной программы "Национальное обследование здоровья и питания" (National Health and Nutrition Examination Survey) до 70% основных сердечно-сосудистых событий связаны именно с его низким уровнем [2]. Значимый вклад в снижение данных параметров вносят такие показатели, как общий холестерин и холестерин, связанный с липопротеидами низкой плотности (ХС-ЛНП), при этом высокий уровень ХС-ЛНП входит в топ-20 факторов риска смертности в США [2]. Среди пациентов с высокими значениями ХС-ЛНП отдельного внимания заслуживают пациенты с семейной гиперхолестеринемией (СГХС), в чьем случае показатели могут составлять >5 ммоль/л (190 мг/дл). В исследовании Perak AM, et al. (2016) была обнаружена связь СГХС со значительно повышенным 30-летним риском заболеваний коронарных сосудов (отношение рисков (ОР) — 5,0; 95% доверительный интервал (ДИ): 1,1-21,7), а также с общим риском атеросклеротических ССЗ (АССЗ) (ОР: 4,1; 95% ДИ: 1,2-13,4) [3].
Современные клинические рекомендации заявляют ХС-ЛНП в качестве основной мишени фармакотерапии, эффективное воздействие на которую может реально снижать риск АССЗ [4][5]. Опубликованы данные, свидетельствующие об эффективности и безопасности интенсивного снижения уровня ХС-ЛНП ниже заявленных в клинических рекомендациях значений, в частности, было отмечено последовательное снижение относительного риска (RR) крупных сосудистых событий при снижении медианного значения ХС-ЛНП в популяции с 1,6 ммоль/л (63 мг/дл) до 0,5 ммоль/л (21 мг/дл) [6].
Стандартным инструментом фармакотерапии, направленным на снижение ХС-ЛНП, являются статины. Согласно Virani SS, et al. (2018) [7] анализ данных 49447 пациентов с ХС-ЛНП ≥4,9 ммоль/л (190 мг/дл), зарегистрированных в регистре кардиологических практик ACC NCDR PINNACLE (2013-2016гг), обнаружил, что 58,5% из них получали статины, 31,9% — высокоинтенсивную терапию статинами, 34,6% — любую гиполипидемическую терапию, нацеленную на снижение уровня ХС-ЛНП на ≥50%, 8,5% — эзетимиб, еще 8,5% — ингибиторы пропротеинконвертазы субтилизина/кексина типа 9 (PCSK9). Несмотря на доминирование статинов среди назначений гиполипидемической терапии, их назначение сопряжено с рядом проблем. Так, по данным исследования PALM (n=5693) женщины реже мужчин получали должные режимы терапии статинами (36,7% vs 45,2%; р<0,001); также женщины с большей вероятностью никогда не получали лечение статинами, несмотря на наличие к ним показаний [8]. Стратегией гиполипидемической терапии является достижение целевых уровней ХС-ЛНП в соответствии с категорией сердечно-сосудистого риска (ССР), что является проблемой в условиях исходно высокого ХС-ЛНП у пациентов с высоким и очень высоким ССР. В США достижение целевых значений ХС-ЛНП в популяции взрослых пациентов с повышенным риском сахарного диабета (СД) типа 2 отмечается лишь в 49,3% случаев (ХС-ЛНП <2,6 ммоль/л (100 мг/дл) у лиц без АССЗ и ХС-ЛНП <1,8 ммоль/л (70 мг/дл) у лиц с АССЗ) [2]. Согласно российским данным, полученным в исследовании DYSIS, достижение целевых значений ХС-ЛНП у пациентов с очень высоким ССР отмечается лишь у 12% больных [9]. Результаты отечественного исследования ЭССЕ-РФ свидетельствуют о том, что повышенный уровень ХС-ЛНП (>4,9 ммоль/л) отмечается у 7,7% взрослого населения [10]. Потенциально неполный охват пациентов терапией статинами или ее недостаточная интенсивность являются не единственным фактором недостижения целевых значений ХС-ЛНП. Так, по данным Мультинационального исследования атеросклероза, несмотря на прием статинов, показатели АССЗ на 1 тыс. человеко-лет для мужчин и женщин составили, соответственно, 19,1 и 14,2 для группы высокого риска, 35,6 и 26,7 для группы очень высокого риска, что по сути ставит вопрос о поиске качественно иных молекул, влияющих на альтернативные ГМККоА-редуктазе мишени [11].
Сохраняющаяся актуальность проблемы эффективной борьбы с высоким уровнем ХС-ЛНП привела к созданию новых групп гиполипидемических препаратов [12], механизмы действия которых можно свести к следующим:
- блокирование синтеза PCSK9,
- связывание циркулирующей фракции PCSK9,
- ингибирование синтеза аполипопротеина В,
- ингибирование микросомального белка-переносчика триглицеридов для блокирования образования атерогенных липопротеинов,
- ингибирование аденозинтрифосфатцитратлиазы,
- ингибирование синтеза липопротеина (а),
- ингибирование аполипопротеина С-III,
- ингибирование белка-переносчика эфира холестерина.
PCSK9 — важный регулятор метаболизма холестерина, повышение активности которого ведет к росту ХС-ЛНП; определенные мутации PCSK9 вызывают аутосомно-доминантную форму СГХС, сопровождающуюся чрезвычайно высокими уровнями холестерина. Статины не могут ингибировать эффекты PCSK9, более того, было обнаружено, что для них характерна способность индуцировать экспрессию PCSK9, что, вероятно, может опосредовать рост показателей ХС-ЛНП на фоне терапии статинами [13]. Проведенные исследования показали, что ингибирование PCSK9 приводит к эффективному снижению уровня ХС-ЛНП и ССР [14]. Новый подход к ингибированию активности PCSK9 — использование технологий малых интерферирующих РНК (ми-РНК), одного из наиболее перспективных высокотехнологичных направлений современной медицины. Действие препаратов, основанных на ми-РНК, заключается в блокаде экспрессии определенных генов путем взаимодействия с мРНК перед ее трансляцией. Препараты ми-РНК обладают исключительным потенциалом, позволяющим обеспечить максимальный уровень эффективности и безопасности фармакотерапии. Среди современных гиполипидемических препаратов в данном ряду можно отметить инклисиран, зарегистрированный в государственном реестре лекарственных средств Российской Федерации в апреле 2022г1. Настоящий обзор посвящен анализу эффективности и безопасности инклисирана у пациентов с высокими значениями ХС-ЛНП.
Роль PCSK9 в повышении уровня ХС-ЛНП и пути ингибирования PCSK9
Стартом изучения роли PCSK9 в генезе гиперхолестеринемии послужили работы, в которых сообщалось о мутациях в гене PCSK9, приводящих к повышению функциональной активности данной пропротеинконвертазы и являющихся одной из причин аутосомно-доминантной гиперхолестеринемии — значимого фактора риска ССЗ [15][16]. Напротив, мутации, выключающие функции PCSK9, сопровождаются низким уровнем ХС-ЛНП (14 мг/дл) и оказывают защитное действие в отношении развития АССЗ [17-19].
PCSK9 представляет собой белок, включающий домены, обнаруживаемые в семействе пропротеинконвертазы сериновых протеаз (N-концевой сигнальный пептид и продомен, за которым следуют каталитический домен и C-концевой домен, богатый цистеином). Инициаторами экспрессии гена PCSK9 являются фактор транскрипции белка 2, связывающего стерол-регулирующие элементы (SREBP-2), и ядерный фактор 1 альфа гепатоцитов (HNF1A); транскрипция и последующий сплайсинг приводят к образованию мРНК PCSK9 [20]. В результате трансляции образуется ранний предшественник, pre-pro-PCSK9, далее в эндоплазматическом ретикулуме образуется более зрелый предшественник, proPCSK9, поступающий в аппарат Гольджи, где путем гликозилирования и удаления продомена PCSK9 образуется окончательная зрелая форма (рис. 1) [21-23].

Рис. 1. Синтез белка PCSK9 в эндоплазматическом ретикулуме [24].
Сокращение: PCSK9 — пропротеинконвертаза субтилизина/кексина типа 9.
PCSK9 включает один пептид (аминокислоты 1-30), продомен (аминокислоты 31-152), каталитический домен (аминокислоты 153-452) и С-концевой домен, богатый цистеином-гистидином (аминокислоты 453-692). В эндоплазматическом ретикулуме происходит автокаталитическое расщепление proPCSK9 с отщеплением продомена и выходом зрелой PCSK9.
PCSK9 повышает уровень циркулирующего ХСЛНП путем снижения числа рецепторов к ЛНП в гепатоцитах (рис. 2). Связывание PCSK9 и рецептора ЛНП происходит благодаря взаимодействию с доменом подобного эпидермальному фактору роста повтора А (EGF-A), что ведет к последующей интернализации и деградации рецептора. Аффинитет PCSK9 по отношению к рецептору ЛНП определяет длительность и выраженность повышения уровней ХСЛНП в сыворотке крови [25].

Рис. 2. Механизм действия PCSK9.
Сокращения: ЛНП — липопротеиды низкой плотности, PCSK9 — пропротеинконвертаза субтилизина/кексина типа 9.
В таблице 1 представлены различные пути ингибирования эффектов PCSK9. Среди фармакологических инструментов, прошедших клинические испытания у пациентов с гиперхолестеринемией и зарегистрированных для применения у пациентов с высокими уровнями ХС-ЛНП, необходимо отметить достаточно долго присутствующую на фармацевтическом рынке группу препаратов полностью человеческих моноклональных антител (МАТ) (эволокумаб и алирокумаб) и абсолютно новый препарат, основанный на технологии ми-РНК — инклисиран.
Таблица 1
Пути ингибирования PCSK9

Сокращения: ЛНП — липопротеиды низкой плотности, РНК — рибонуклеиновая кислота, РФ — Российская Федерация, CRISPR — clustered regularly interspaced short palindromic repeats — короткие палиндромные повторы, регулярно расположенные группами, EGF-A — эпидермальный фактор роста домена А, FDA — Управление по санитарному надзору за качеством пищевых продуктов и медикаментов в США, IgG — иммуноглобулин G, PCSK9 — пропротеинконвертаза субтилизина/кексина типа 9.
Фармакологические характеристики ингибиторов PCSK9
МАТ
В мировой клинической практике используется два препарата — эволокумаб и алирокумаб — полностью человеческие МАТ. Особенности строения выгодно их отличают от ранее изучавшегося бокоцизумаба (химерного антитела с 3% мышиных последовательностей), от которого производители отказались на поздней стадии разработки из-за частых случаев образования антител против самого препарата [43].
МАТ связываются исключительно с циркулирующей фракцией PCSK9, выключая способность последней к взаимодействию с рецептором ЛНП. В итоге в гепатоците не происходит PCSK9-опосредованной деградации рецептора ЛНП; после стадии погружения в эндосому он выходит обратно на поверхность клетки, сохраняя активность и обеспечивая эффективный захват ЛНП из крови, что в итоге приводит к снижению уровня холестерина. Тем не менее синтез PCSK9 не останавливается, и для эффективного снижения ХС-ЛНП требуется поддерживать постоянный уровень концентрации МАТ в системном кровотоке.
Эволокумаб — человеческий моноклональный иммуноглобулин G, IgG2 [44], алирокумаб — IgG1 [45]. После однократного подкожного введения максимальное ингибирование свободного циркулирующего PCSK9 достигается за 4-8 ч в случае алирокумаба (доза 75 мг или 150 мг, ответ дозозависимый) [46] и за 4 ч в случае эволокумаба [47].
Рекомендованный режим дозирования алирокумаба: начальная доза 75 мг 1 раз в 2 нед. подкожно, далее в зависимости от ответа возможно повышение до 150 мг 1 раз в 2 нед. (по данным исследований повышение дозы необходимо 43,4% пациентов) [46].
Эволокумаб оказывает равно эффективный эффект при следующих режимах: 140 мг подкожно 1 раз в 2 нед. или 420 мг подкожно 1 раз в мес. [47].
Эффективность МАТ на фоне патологии почек, как было показано в исследованиях, включавших в т.ч. и пациентов, находившихся на гемодиализе, не снижалась [48-50]. Гепатотоксичность не характерна для МАТ, т.к. они не образуют потенциально опасных метаболитов2, 3.
Инклисиран
Принципиальным отличием инклисирана от МАТ является его способность выключать синтез PCSK9 в гепатоцитах, что обеспечивает непосредственное устранение основной причины развития гиперхолестеринемии. Как было отмечено в таблице 1, инклисиран представляет собой препарат, действие которого основано на технологии малых интерфирирующих РНК и направлено на сайленсинг генов, отвечающих за образование PCSK9. Сайленсинг генов — отрицательная регуляция их экспрессии — включает процессы, ингибирующие транскрипцию генов (метилирование ДНК), а также посттранскрипционные процессы (деградация мРНК с помощью РНК интерференции) [51].
Инклисиран представляет собой синтетическую, химически модифицированную короткоцепочечную ми-РНК длительного действия, специфически связывающуюся с мРНК-предшественником белка PCSK9 и вызывающую его последующую деградацию. Молекула инклисирана состоит из двух комплементарных цепей рибонуклеиновой кислоты: направляющей и сопровождающей цепей. Сопровождающая цепь конъюгирована с трехантенным N-ацетилгалактозаминовым (GalNAc) лигандом, служащим для специфического связывания с асиалогликопротеиновым рецептором (ASGPR) гепатоцитов; сродство с гепатоцитами оказывается настолько велико, что через 24 ч после внутривенного введения препарата в сыворотке крови его не обнаруживается [52]. После проникновения в гепатоцит инклисиран поступает внутрь эндосом, где формируется депо препарата, из эндосом он медленно высвобождается обратно в цитоплазму, где его направляющая цепь связывается с РНК-индуцируемого комплекса выключения гена (RISC — рибонуклеопротеиновый комплекс, служащий матрицей для распознавания комплементарной мРНК-мишени, активации РНКазы и расщепления мРНК-мишени) [53]. Гибридизация с комплементарной мРНК для PCSK9 вызывает ее деградацию, итоговое ограничение трансляции приводит к подавлению синтеза и секреции PCSK9 (рис. 3). Интересно, что RISC остается активным даже после деградации мРНК, что вносит вклад в долгосрочные эффекты инклисирана, заключающиеся в эффективном снижении и внутриклеточной, и внеклеточной фракции PCSK9, повышении активности рецепторов ЛНП и снижении ХС-ЛНП [54-56].
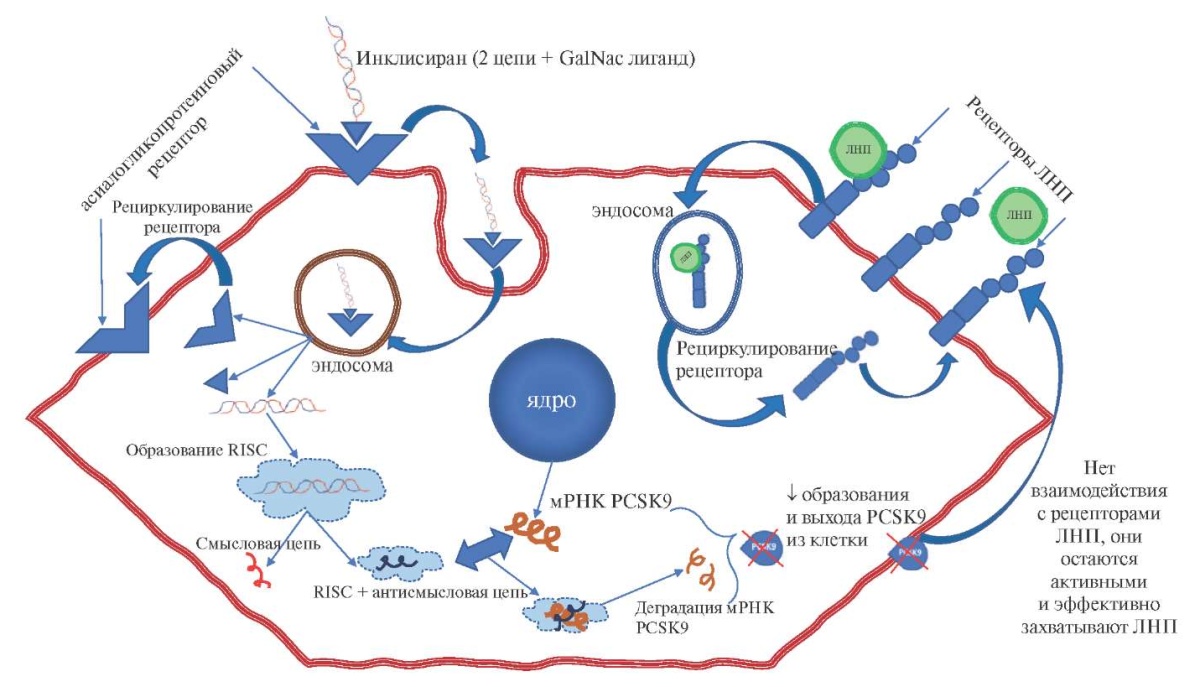
Рис. 3. Механизм действия инклисирана.
Сокращения: ЛНП — липопротеиды низкой плотности, PCSK9 — пропротеинконвертаза субтилизина/кексина типа 9.
Важно отметить, что инклисиран обеспечивает именно локальное выключение образования PCSK9 в клетках печени и не влияет на его синтез во внепеченочных тканях [57], что определяет как эффективность, так и высокий профиль безопасности данного препарата [58]. В животных моделях было продемонстрировано, что PCSK9 может влиять на секрецию инсулина [59], дефицит PCSK9 на уровне кардиомиоцитов вносил вклад в развитие сердечной недостаточности с сохранённой фракцией выброса [60]. Таргетное выключение секреции PCSK9 в гепатоцитах отличает механизм действия инклисирана от механизма действия МАТ, полностью связывающих всю циркулирующую фракцию PCSK9 [61][62]. Неизбирательное действие МАТ рассматривается некоторыми авторами как потенциально вызывающее вопросы в отношении возможности развития эффектов, не связанных с контролем уровня ХС-ЛНП [57].
Установленный период полувыведения инклисирана составляет 9 ч, что меньше показателей МАТ. Короткий период полувыведения отражает быстрое снижение концентраций препарата в крови за счет его быстрого проникновения внутрь гепатоцитов. Собственно длительность действия инклисирана значительно превосходит таковую для МАТ и среди доступных PCSK9-таргетных препаратов является максимальной. В связи с длительно персистирующими эффектами инклисирана рекомендован следующий режим дозирования: 284 мг вводится подкожно исходно, затем через 3 мес., после чего переходят на введение 284 мг каждые 6 мес. [63]. После однократного введения инклисирана в течение 6 мес. наблюдается стабильное выраженное снижение PCSK9, более того, исследование продемонстрировало, что снижение сохраняется и далее. По данным Wright RS, et al. (2021) на 510 день снижение PCSK9 составляло 80,9% (95% ДИ: 83,8-78,0%; p<0,001) [64]. Указанное снижение PCSK9 коррелирует со стабильным снижением ХС-ЛНП и приводит к выраженному клиническому ответу.
Оценка фармакокинетических и фармакодинамических параметров инклисирана у пациентов с патологией печени обнаружила, что несмотря на повышение концентрации препарата на фоне печеночной недостаточности легкой и средней степени тяжести, отсутствует необходимость в коррекции режима дозирования, параметры эффективности и безопасности препарата не меняются [65]. В случае почечной недостаточности легкой, средней и тяжелой степени аккумуляции препарата не наблюдалось, эффективность и безопасность препарата не имели отличий от таковых у пациентов с нормальной функцией почек, что позволяет его применять у больных, находящихся на гемодиализе [66].
Инклисиран разрушается под действием эндонуклеаз и не является ни субстратом, ни индуктором, ни ингибитором ферментов системы цитохрома Р450, что является основой отсутствия рисков лекарственных взаимодействий в случае комбинированной терапии.
Инновационный механизм действия инклисирана приковывает внимание к вопросам безопасности его применения. Обширные данные, полученные как в доклинических, так и в клинических исследованиях, свидетельствуют об отсутствии любых иных изменений со стороны клеток и генетического материала за исключением целевого выключения синтеза PCSK9 в гепатоцитах. Не было отмечено и изменений лабораторных показателей (анализировались данные печеночных проб, креатинфосфокиназы, С-реактивного белка, гематологические показатели), а также изменений концентраций и фракций различных цитокинов (интерферонов α и γ, интерлейкинов 6 и 12, фактора некроза опухоли α и гранулоцитарного колониестимулирующего фактора) [67].
Эффективность и безопасность PCSK9-таргетной терапии: данные клинических исследований
Инклисиран появился на фармацевтическом рынке позже, чем МАТ, его исследования I/II фазы проводились в 2014-2018гг, III фазы — в 2017-2019гг, в 2020г препарат был разрешен к применению в США и Европе, в 2021г — в США, в 2022г — в России. Информация об основных клинических исследованиях представлена в таблице 2.
Таблица 2
Основные клинические исследования инклисирана

Сокращения: АССЗ — атеросклеротические сердечно-сосудистые заболевания, ГеСГ — гетерозиготная семейная гиперхолестеринемия, ГоСГ — гомозиготная семейная гиперхолестеринемия, СГХС — семейная гиперхолестеринемия, ССЗ — сердечно-сосудистые заболевания, ФШР — Фрамингемская шкала риска, ХС-ЛНП — холестерин липопротеидов низкой плотности.
5 https://www.healio.com/news/cardiology/20190518/orion3-inclisiran-safely-reduces-ldl-by-more-than-50
6 A Randomized Trial Assessing the Effects of Inclisiran on Clinical Outcomes Among People With Cardiovascular Disease (ORION-4). ClinicalTrials.gov Identifier: NCT03705234. Available from: http://clinicaltrials.gov/ct2/show/NCT03705234
7 https://clinicaltrials.gov/ct2/history/NCT03851705?V_12&embedded=true
8 https://clinicaltrials.gov/ct2/show/NCT03814187
9 https://clinicaltrials.gov/ct2/show/results/NCT03399370.
10 https://clinicaltrials.gov/ct2/show/NCT04659863.
11 https://clinicaltrials.gov/ct2/show/NCT04652726.
Завершенные исследования, реализованные в программе ORION, свидетельствуют о высоком уровне эффективности инклисирана в отношении снижения ХС-ЛНП и подавления синтеза PCSK9. Важно отметить, что выраженный эффект в отношении ХС-ЛНП сохраняется спустя длительный промежуток времени, на что указывают значения, продемонстрированные в исследованиях на 240 и 510 дни. Объединенный анализ исследований ORION-9, 10 и 11 (всего 3660 пациентов (n=482, n=1561 и n=1617, соответственно, для каждого из исследований) показал, что на 510 день после приема инклисирана скорректированное на плацебо снижение ХС-ЛНП составило 50,7% (95% ДИ: 52,9-48,4%; p<0,0001), аналогичный показатель для периода с 90 по 540 день составил 50,5% (95% ДИ: 52,1-48,9%; p<0,0001). При этом анализ нежелательных явлений (НЯ) обнаружил высокий уровень безопасности; единственными НЯ, достоверно чаще возникавшими при применении инклисирана в сравнении с плацебо, были местные, преимущественно легкие, реакции в месте инъекции (5,0% vs 0,7%) [64]. По данным ORION-10 снижение уровня аполипопротеина В (АпоВ) составило 43,1%, триглицеридов — 12,6%, липопротеина (а) — 25,6%, при этом повышение уровня холестерина липопротеидов высокой плотности составило 5,1% по сравнению с плацебо [72]. В исследовании ORION-11 снижение соответствующих параметров составило 38,9%, 7,0% и 18,6%, при этом повышение холестерина липопротеидов высокой плотности было равно 6,1% [72].
Метаанализ 3 рандомизированных клинических исследований (РКИ) продемонстрировал, что инклисиран по сравнению с плацебо снижал уровень ХС-ЛНП на 51% (p<0,001), уровень триглицеридов — на 37%, аполипопротеина B — на 41% (p<0,001). Также было установлено, что инклисиран ассоциировался со снижением на 24% частоты серьезных нежелательных сердечно-сосудистых событий. Профиль безопасности в итоге был охарактеризован как высокий: различия в НЯ, нарушениях показателей функции печени или уровнях креатинкиназы между группами инклисирана и плацебо отсутствовали, единственными НЯ, характерными для препарата, были легкие местные НЯ, возникавшие в месте инъекции [73].
В настоящее время доступны результаты обзоров и метаанализов, сравнивающих эффективность инклисирана, МАТ и других гиполипидемических препаратов. Так, систематический обзор и сетевой метаанализ Huang YT, et al. (2022) включал 22 исследования (n=42786), посвященных эффективности применения ингибиторов PCSK9 у пациентов с гиперхолестеринемией на фоне терапии статинами [74]. Результаты продемонстрировали выраженную эффективность и инклисирана, и МАТ в снижении ХСЛНП, уровня аполипопротеина В и липопротеина (а) в сравнении с эзетимибом или плацебо. Интересны результаты еще одного систематического обзора и сетевого метаанализа 2022г, оценивавшего эффективность добавления ингибиторов PCSK9 к максимально переносимым дозам статинов (48 РКИ длительностью ≥12 нед.) [75]. Его результаты обнаружили превосходство инклисирана и МАТ в отношении снижения ХС-ЛНП по сравнению с различными дозами бемпедоевой кислоты и эзетимибом.
Аналогичные тенденции были продемонстрированы в сетевом метаанализе Burnett H, et al. (2022), обнаружившем, что инклисиран, эволокумаб и алирокумаб значительно превосходили плацебо, бемпедоевую кислоту и эзетимиб в снижении уровня ХС-ЛНП. При этом эффективность инклисирана была сопоставима с алирокумабом (средняя разница: 0,78%; 95% ДИ: -8,35-9,88). Средняя разница эффективности между эволокумабом и инклисираном составила 8,16% (95% ДИ: -1,82-18,49) [76].
По данным метаанализа Talasaz AH, et al. (2021) эффективность инклисирана и МАТ в снижении ХСЛНП у пациентов с ССЗ была установлена на уровне 51% (95% ДИ: 61-41%) [77]. Также было установлено, что все указанные ингибиторы PCSK9 способствовали снижению рисков комбинированных исходов инфаркта миокарда, инсульта и смерти от ССЗ (ОР: 0,80; 95% ДИ: 0,73-0,87).
Помимо изучения количественных изменений параметров липидного профиля с участием МАТ и инклисирана были выполнены и исследования, позволяющие оценить отдалённые исходы у пациентов с гиперхолестеринемией и ССЗ. Инклисиран подтвердил свою эффективность в метаанализе Khan SA, et al. (2020) РКИ ORION-9, 10, 11, где было установлено снижение конечной точки MACE, которая включала в себя кардиальную смерть и любые симптомы остановки сердца, нефатальный инфаркт миокарда или инсульт на 24% [73]. Влияние препаратов на возможное снижение смертности от всех причин было продемонстрировано в метаанализе Wang X, et al. (2022) [78], включавшем 9 исследований и 54311 пациентов (5 исследований — алирокумаб vs контроля, 2 исследования — эволокумаб vs контроля, 2 — инклисиран vs контроля). Анализ продемонстрировал следующие значения RR смертности от всех причин по сравнению с контролем: алирокумаб — 0,83 (95% ДИ: 0,72-0,95), инклисиран — 1,00 (95% ДИ: 0,58-1,73), эволокумаб — 1,04 (95% ДИ: 0,91-1,18). Для повышения достоверности результатов авторами были проведены расчеты после исключения из анализа данных пациентов с гетерозиготной СГХС (ODYSSEY LONG TERM).
Полученные результаты ОР смертности от всех причин продемонстрировали значения, близкие с теми, что были получены в общем анализе. ОР возникновения серьезных НЯ обнаружил минимальное значение в случае инклисирана (табл. 3).
Таблица 3
RR смертности от всех причин и серьезных НЯ при приеме МАТ и инклисирана [78]

Сокращения: ДИ — доверительный интервал, НЯ — нежелательные явления, RR — относительный риск.
Место МАТ и инклисирана в клинической практике
Необходимость в дополнительных инструментах гиполипидемической терапии привела к достаточно быстрому включению МАТ и инклисирана в существующие режимы ведения пациентов с первичной гиперхолестеринемией, смешанной гиперхолестеринемией, а также у пациентов с АССЗ. Важным условием начала применения указанных препаратов является недостижение пациентами целевых значений ХС-ЛНП при приеме максимально переносимых доз статинов. Также одним из показаний может быть непереносимость статинов или возникновение на фоне их приема НЯ, требующих отмены препарата. В таблице 4 представлены рекомендации Европейского медицинского агентства, ЕМА, Национального института здравоохранения и передового опыта, NICE (Великобритания) и Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA), отражающие место инклисирана в клинической практике.
Таблица 4
Показания к применению инклисирана

Сокращения: АССЗ — атеросклеротические сердечно-сосудистые заболевания, ГеСГ — гетерозиготная семейная гиперхолестеринемия, ХС-ЛНП — холестерин липопротеидов низкой плотности.
12 https://www.ema.europa.eu/en/medicines/human/EPAR/leqvio.
13 https://www.nice.org.uk/guidance/ta733.
14 https://www.fda.gov/drugs/news-events-human-drugs/fda-approves-add-therapy-lower-cholesterol-among-certain-high-risk-adults.
Сравнительные показания, противопоказания и режимы дозирования МАТ и инклисирана представлены в таблице 5.
Таблица 5
Характеристики МАТ и инклисирана

Сокращения: АССЗ — атеросклеротические сердечно-сосудистые заболевания, ГоСГ — гомозиготная семейная гиперхолестеринемия, МАТ — моноклональные антитела, ХС-ЛНП — холестерин липопротеидов низкой плотности.
15 https://www.ema.europa.eu/en/documents/product-information/praluent-epar-product-information_en.pdf.
16 Общая характеристика лекарственного препарата Пралуэнт. ЛП-000321-160522 (РГ-RU).
17 https://www.ema.europa.eu/en/documents/product-information/repatha-epar-product-information_en.pdf.
18 Инструкция по медицинскому применению препарата Репата. ЛП-003574-031121.
19 https://www.ema.europa.eu/en/documents/assessment-report/leqvio-epar-public-assessment-report_en.pdf.
20 Общая характеристика лекарственного препарата Сибрава. РУ ЛП-№(000689)-(РГ-RU).
21 https://www.accessdata.fda.gov/drugsatfda_docs/label/2021/214012lbl.pdf.
22 https://www.repathahcp.com/about-repatha.
В отношении противопоказаний для применения инклисирана и МАТ существует единственное — гиперчувствительность. Имеющиеся данные указывают на несколько большую частоту аллергических реакций при применении алирокумаба. Следующим важным параметром безопасности, имеющим в свою очередь влияние на эффективность, является возможность образования антител против лекарственного препарата, максимально выраженная в случае алирокумаба (5,1%) [79]. Образование подобных антител может иметь потенциал для снижения эффективности препарата или возникновение специфических иммунологических НЯ при его длительном регулярном и относительно частом использовании (инъекции 1 в 2 нед. или 1 в мес., в случае МАТ) [80].
Обсуждение
Ингибирование PCSK9 предоставляет дополнительные возможности эффективного снижения ХС-ЛНП. "Золотой стандарт" гиполипидемической терапии — статины — не всегда позволяют достичь целевых значений параметров липидного спектра, даже при условии применения в максимально переносимых дозах. В то же время максимальные дозы статинов несут определенный риск возникновения ряда НЯ, в т.ч. серьезных. Согласно данным метаанализа 62 РКИ (n=120456, период наблюдения в среднем 3,9 лет) прием статинов ассоциировался с повышенным риском мышечных симптомов (21 исследование, отношение шансов (ОШ): 1,06; 95% ДИ: 1,01-1,13), нарушений функций печени (21 исследование, ОШ: 1,33; 95% ДИ: 1,12-1,58), почечной недостаточности (8 исследований, ОШ: 1,14; 95% ДИ: 1,01-1,28), глазными симптомами (6 исследований, ОШ: 1,23; 95% ДИ: 1,04-1,47) [81]. В метаанализе 84 РКИ (n=246706) было выполнено сравнение параметров безопасности статинов, эзетимиба и ингибиторов PCSK9, результаты обнаружили повышение рисков НЯ именно при приеме статинов: значительное увеличение уровней аланинаминотрансферазы (ОШ: 1,89; 95% ДИ: 1,42-2,51) и креатинкиназы (ОШ: 1,45; 95% ДИ: 1,09-1,93). Также данный метаанализ выявил возрастание риска развития СД при приеме статинов (ОШ: 1,13; 95% ДИ: 1,02-1,26) [82]. Установлено, что профиль безопасности ингибиторов PCSK9 значительно превосходит таковой для статинов; наиболее распространенными НЯ являются местные, связанные с подкожным введением препаратов. Их частота при применении алирокумаба по разным данным составляет от 3,8% [49] до 16% согласно данным реальной клинической практики [82]; для эволокумаба — от 2,2% [83] до 12% [82]; для инклисирана — от 3% [56] до 8,2% [82].
Эффективность МАТ в снижении ХС-ЛНП, выраженная в средней разнице между исходным значением и конечным, для алирокумаба составляет 51,29%, для эволокумаба — 53,99% [84]. Эти данные были получены в метаанализе 45 РКИ длительностью от 8 до 134 нед. В работах, посвященных инклисирану, стоит отметить объединенный анализ исследований ORION-9, 10 и 11, каждое из которых оценивало разницу между исходным ХС-ЛНП и его значением на 510 день. Степень гомогенности объединенной выборки в данном случае была большей, чем в работах, посвященных МАТ, а результаты продемонстрировали снижение ХС-ЛНП, равное 50,7% (95% ДИ: 52,9-48,4%; p<0,0001) [65]. Согласно объединенному анализу результатов исследований ORION-10 и 11 доля пациентов, у которых снижение ХС-ЛНП составило >50%, в случае инклисирана была равна 86,6% [65], в случае применения МАТ результаты вариабельны, так, в работе Raal F (2012) снижение ХС-ЛНП ≥50% отмечалось лишь у 52% пациентов, принимавших эволокумаб [85], по данным же исследования FOURIER данный показатель составлял ~90% [86].
Важно отметить, что как МАТ, так и инклисиран в большинстве случаев рекомендуют использовать в комбинации с максимально переносимыми дозами статинов. В случае назначения двух и более препаратов врач всегда должен оценивать возможный риск возникновения лекарственных взаимодействий. Ни МАТ, ни инклисиран не являются ни субстратами, ни индукторами, ни ингибиторами изоферментов системы цитохрома Р450 или транспортных белков (MDR1, BCRP, OAT1, OAT3, OCT1, OCT2, OCT3, OATP1B1, OATP1B3, MATE1, MATE2k и BSEP), соответственно, риск фармакокинетических взаимодействий является практически близким к нулю. Но с точки зрения фармакодинамических лекарственных взаимодействий стоит отметить возможное снижение эффективности МАТ в случае их применения вместе со статинами. Объяснением является способность статинов индуцировать экспрессию PCSK9, вследствие чего возможно снижение системного воздействия МАТ, вводимых в терапевтических дозах. Так, по сравнению с монотерапией алирокумабом его применение в комбинации со статинами приводило к снижению системного воздействия на 40%, в комбинации с фибратами — на 35%4. Определенный повод для беспокойства представляет опубликованный в 2022г случай снижения эффективности эволокумаба после введения второй дозы мРНК вакцины от новой коронавирусной инфекции (COVID-19) [87].
В отношении отдаленных исходов, таких как смертность от всех причин и смертность от ССЗ, ингибиторы PCSK9 продемонстрировали положительное воздействие. Согласно последним данным, среди отдаленных исходов в популяции пациентов, принимающих гиполипидемические препараты, необходимо учитывать риск развития СД. В работе Mansi I, et al. (2015) сравнивался риск развития СД у пациентов, использовавших статины для первичной профилактики, и у не принимавших эти препараты, период оценки — с 2005г по 2012г [88]. Результаты обнаружили более высокий риск возникновения СД (ОШ: 1,87; 95% ДИ: 1,67-2,01), СД с осложнениями (ОШ: 2,50; 95% ДИ: 1,88-3,32), а также ожирения на фоне приема статинов (ОШ 1,14; 95% ДИ: 1,04-1,25). Позднее выполненный систематический обзор, включивший данные почти 2 млн пациентов, получавших аторвастатин, также предположил наличие связи между приемом данного статина и возникновением СД [89]. Сетевой анализ 10 баз данных реальной клинической практики (2022г) обнаружил, что больший риск возникновения СД был связан с приемом аторвастатина, либо розувастатина, меньший — с приемом питавастатина [90]. В метаанализе 23 РКИ (n=65957), посвященных оценке рисков развития СД при приеме МАТ, существенных отличий по отношению к контролю продемонстрировано не было [91]. В случае инклисирана опубликованные данные не обнаружили риска развития СД; более полная информация по отдаленным исходам ожидается после публикации результатов исследования ORION-4. Тем не менее полученные за 18 мес. непрерывного использования препарата сведения (ORION-11) свидетельствуют о его безопасности в отношении рисков развития СД: в группе инклисирана СД развился в 10,9% случаев, в группе плацебо — в 11,7% (ОР: 0,9; 95% ДИ: 0,7-1,2) [92].
Важным параметром, определяющим эффективность терапии, является приверженность пациента выполнению врачебных назначений. Среди гиполипидемических препаратов наименьшая приверженность терапии характерна для статинов: около половины всех пациентов не придерживаются необходимого режима назначений, либо вообще прекращают прием препаратов в течение 1 года [93]. Режим введения МАТ — введение 1 раз в 2 нед. подкожно — является достаточно удобным, но, как показывает клиническая практика, приверженность пациентов в данном случае все равно остается достаточно серьезной проблемой: по данным Hines DM, et al. 42,6% пациентов прекращают прием алирокумаба или эволокумаба в течение 180 дней после начала терапии [94]. Режим введения инклисирана в долгосрочной перспективе — 1 раз в 6 мес. — может стать ключом к достижению практически 100% приверженности пациента гиполипидемической терапии; в данном случае возможно обеспечить более качественный контроль за выполнением врачебных назначений, совмещая регулярные визиты к лечащему врачу и выполнение подкожной инъекции [95].
Заключение
Подавление синтеза PCSK9 в гепатоцитах, осуществляемое инклисираном, представляет дополнительные возможности достижения целевых значений ХС-ЛНП, улучшая прогнозы пациентов с гиперхолестеринемией. Инклисиран позволяет обеспечить стойкое снижение ХС-ЛНП на ≥50% к достигнутому ранее эффекту на статинах у абсолютного большинства пациентов, приближая значения параметров липидного профиля к целевым. Сравнительный анализ МАТ и инклисирана позволяет предположить большую степень безопасности последнего. Режим дозирования инклисирана 1 раз в 6 мес. может способствовать достижению максимально высоких значений приверженности пациентов гиполипидемической терапии. Таким образом, инклисиран может быть рекомендован к широкому применению у пациентов, не достигающих целевых значений ХСЛНП на фоне применения стандартной гиполипидемической терапии.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
1. https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=7c1c7058-9bb742e4-88fc-a9063efc5190&t=.
2. LiverTox: Clinical and Research Information on Drug-Induced Liver Injury [Internet]. Bethesda (MD): National Institute of Diabetes and Digestive and Kidney Diseases; 2012. Evolocumab. [Updated 2018 Feb 19]. Available from: https://www.ncbi.nlm.nih.gov/books/NBK548469/.
3. LiverTox: Clinical and Research Information on Drug-Induced Liver Injury [Internet]. Bethesda (MD): National Institute of Diabetes and Digestive and Kidney Diseases; 2012. Alirocumab. [Updated 2018 Feb 19]. Available from: https://www.ncbi.nlm.nih.gov/books/NBK548190/.
4. https://www.ema.europa.eu/en/documents/product-information/praluenteparproduct-information_en.pdf.
Список литературы
1. Roth GA, Mensah GA, Johnson CO, et al. GBD-NHLBI-JACC Global Burden of Cardiovascular Diseases Writing Group. Global Burden of Cardiovascular Diseases and Risk Factors, 1990-2019: Update From the GBD 2019 Study. J Am Coll Cardiol. 2020;76(25):2982-3021. doi:10.1016/j.jacc.2020.11.010.
2. Tsao CW, Aday AW, Almarzooq ZI, et al. Heart Disease and Stroke Statistics-2022 Update: A Report From the American Heart Association. Circulation. 2022;145(8):e153-e639. doi:10.1161/CIR.0000000000001052.
3. Perak AM, Ning H, de Ferranti SD, et al. Long-Term Risk of Atherosclerotic Cardiovascular Disease in US Adults With the Familial Hypercholesterolemia Phenotype. Circulation. 2016;134(1):9-19. doi:10.1161/CIRCULATIONAHA.116.022335.
4. Grundy SM, Stone NJ, Bailey AL, et al. 2018 AHA/ACC/AACVPR/AAPA/ABC/ACPM/ ADA/AGS/APhA/ASPC/NLA/PCNA Guideline on the Management of Blood Cholesterol: Executive Summary: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. J Am Coll Cardiol. 2019;73(24):3168-209. doi:10.1016/j.jacc.2018.11.002.
5. Arnett DK, Blumenthal RS, Albert MA, et al. 2019 ACC/AHA Guideline on the Primary Prevention of Cardiovascular Disease: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Circulation. 2019;140(11):e596-e646. doi:10.1161/CIR.0000000000000678.
6. Sabatine MS, Wiviott SD, Im K, et al. Efficacy and Safety of Further Lowering of LowDensity Lipoprotein Cholesterol in Patients Starting With Very Low Levels: A Meta-analysis. JAMA Cardiol. 2018;3(9):823-8. doi:10.1001/jamacardio.2018.2258.
7. Virani SS, Kennedy KF, Akeroyd JM, et al. Variation in lipid-lowering therapy use in patients with low-density lipoprotein cholesterol ≥190 mg/dL: insights from the National Cardiovascular Data Registry-Practice Innovation and Clinical Excellence Registry. Circ Cardiovasc Qual Outcomes. 2018;11:e004652. doi:10.1161/CIRCOUTCOMES.118.004652.
8. Nanna MG, Wang TY, Xiang Q, et al. Sex Differences in the Use of Statins in CommunityPractice. Circ Cardiovasc Qual Outcomes. 2019;12(8):e005562. doi:10.1161/CIRCOUTCOMES.118.005562.
9. Оганов Р. Г., Кухарчук В. В., Арутюнов Г. П. и др. Сохраняющиеся нарушения показателей липидного спектра у пациентов с дислипидемией, получающих статины, в реальной клинической практике в Российской Федерации (российская часть исследования DYSIS). Кардиоваскулярная терапия и профилактика. 2012;11(4):70-8. doi:10.15829/1728-8800-2012-4-70-78.
10. Мешков А. Н., Ершова А. И., Деев А. И. и др. Распределение показателей липидного спектра у мужчин и женщин трудоспособного возраста в Российской Федерации: результаты исследования ЭССЕ-РФ за 2012-2014 гг. Кардиоваскулярная терапия и профилактика. 2017;16(4):62-7. doi:10.15829/1728-8800-2017-4-62-67.
11. Wong ND, Zhao Y, Quek RGW, et al. Residual atherosclerotic cardiovascular disease risk in statin-treated adults: The Multi-Ethnic Study of Atherosclerosis. J Clin Lipidol. 2017;11(5):1223-33. doi:10.1016/j.jacl.2017.06.015.
12. Barter PJ, Rye KA. New Era of Lipid-Lowering Drugs. Pharmacol Rev. 2016;68(2):458-75. doi:10.1124/pr.115.012203.
13. Dong B, Wu M, Li H, et al. Strong induction of PCSK9 gene expression through HNF1alpha and SREBP2: mechanism for the resistance to LDL-cholesterol lowering effect of statins in dyslipidemic hamsters. J Lipid Res. 2010;51(6):1486-95. doi:10.1194/jlr.M003566.
14. Wilson PWF, Polonsky TS, Miedema MD, et al. Systematic review for the 2018 AHA/ ACC/AACVPR/AAPA/ABC/ACPM/ADA/AGS/APhA/ASPC/NLA/PCNA guideline on the management of blood cholesterol: a report of the American College of Cardiology/ American Heart Association Task Force on Clinical Practice Guidelines. Circulation. 2019;139:e1144-e1161. doi:10.1016/j.jacc.2018.11.004.
15. Abifadel M, Varret M, Rabès JP, et al. Mutations in PCSK9 cause autosomal dominant hypercholesterolemia. Nat Genet. 2003;34(2):154-6. doi:10.1038/ng1161.
16. Poirier S, Mayer G, Benjannet S, et al. The proprotein convertase PCSK9 induces the degradation of low density lipoprotein receptor (LDLR) and its closest family members VLDLR and ApoER2. J Biol Chem. 2008;283(4):2363-72. doi:10.1074/jbc.M708098200.
17. Zhao Z, Tuakli-Wosornu Y, Lagace TA, et al. Molecular characterization of loss-of-function mutations in PCSK9 and identification of a compound heterozygote. Am J Hum Genet. 2006;79(3):514-23. doi:10.1086/507488.
18. Сohen J, Pertsemlidis A, Kotowski IK, et al. Low LDL cholesterol in individuals of African descent resulting from frequent nonsense mutations in PCSK9. Nat Genet. 2005;37(2):161-5. doi:10.1038/ng1509.
19. Berge KE, Ose L, Leren TP. Missense mutations in the PCSK9 gene are associated with hypocholesterolemia and possibly increased response to statin therapy. Arterioscler Thromb Vasc Biol. 2006;26(5):1094-100. doi:10.1161/01.ATV.0000204337.81286.1c.
20. Kuzmich N, Andresyuk E, Porozov Y, et al. PCSK9 as a Target for Development of a New Generation of Hypolipidemic Drugs. Molecules. 2022;27(2):434. doi:10.3390/molecules27020434.
21. Strom TB, Tveten K, Leren TP. PCSK9 acts as a chaperone for the LDL receptor in the endoplasmic reticulum. Biochem. J. 2014;457:99-105. doi:10.1042/BJ20130930.
22. Norata GD, Tavori H, Pirillo A, et al. Biology of proprotein convertase subtilisin kexin 9: Beyond low-density lipoprotein cholesterol lowering. Cardiovasc. Res. 2016;112:429-42. doi:10.1093/cvr/cvw194.
23. Han B, Eacho PI, Knierman MD, et al. Isolation and characterization of the circulating truncated form of PCSK9. J. Lipid Res. 2014;55:1505-14. doi:10.1194/jlr.M049346.
24. Nishikido T, Ray KK. Non-antibody Approaches to Proprotein Convertase Subtilisin Kexin 9 Inhibition: siRNA, Antisense Oligonucleotides, Adnectins, Vaccination, and New Attempts at Small-Molecule Inhibitors Based on New Discoveries. Front Cardiovasc Med. 2019;5:199. doi:10.3389/fcvm.2018.00199.
25. Pandit S, Wisniewski D, Santoro JC, et al. Functional analysis of sites within PCSK9 responsible for hypercholesterolemia. J Lipid Res. 2008;49(6):1333-43. doi:10.1194/jlr.M800049-JLR200.
26. Ma N, Fan L, Dong Y, et al. New PCSK9 inhibitor miR-552-3p reduces LDL-C via enhancing LDLR in high fat diet-fed mice. Pharmacol Res. 2021;167:105562. doi:10.1016/j.phrs.2021.105562.
27. Xu X, Dong Y, Ma N, et al. MiR-337-3p lowers serum LDL-C level through targeting PCSK9 in hyperlipidemic mice. Metabolism. 2021;119:154768. doi:10.1016/j.metabol.2021.154768.
28. Dong J, He M, Li J, et al. microRNA-483 ameliorates hypercholesterolemia by inhibiting PCSK9 production. JCI Insight. 2020;5(23):e143812. doi:10.1172/jci.insight.143812.
29. Chaudhary R, Garg J, Shah N, et al. PCSK9 inhibitors: A new era of lipid lowering therapy. World J Cardiol. 2017;9(2):76-91. doi:10.4330/wjc.v9.i2.76.
30. Rekić D, Azarov I, Knöchel J, et al. AZD8233 antisense oligonucleotide targeting PCSK9 does not prolong QT interval. Br J Clin Pharmacol. 2022. doi:10.1111/bcp.15425.
31. Gennemark P, Walter K, Clemmensen N, et al. An oral antisense oligonucleotide for PCSK9 inhibition. Sci Transl Med. 2021;13(593). doi:10.1126/scitranslmed.abe9117.
32. Tombling BJ, Lammi C, Lawrence N, et al. Engineered EGF-A Peptides with Improved Affinity for Proprotein Convertase Subtilisin/Kexin Type 9 (PCSK9). ACS Chem Biol. 2021;16(2):429-39. doi:10.1021/acschembio.0c00991.
33. Cariou B, Dijk W. EGF-A peptides: A promising strategy for PCSK9 inhibition. Atherosclerosis. 2020;292:204-6. doi:10.1016/j.atherosclerosis.2019.11.010.
34. Valenti V, Noto D, Giammanco A, et al. PCSK9-D374Y mediated LDL-R degradation can be functionally inhibited by EGF-A and truncated EGF-A peptides: An in vitro study. Atherosclerosis. 2020;292:209-14. doi:10.1016/j.atherosclerosis.2019.09.009.
35. Mitchell T, Chao G, Sitkoff D, et al. Pharmacologic profile of the Adnectin BMS-962476, a small protein biologic alternative to PCSK9 antibodies for low-density lipoprotein lowering. J Pharmacol Exp Ther. 2014;350(2):412-24. doi:10.1124/jpet.114.214221.
36. Stein EA, Kasichayanula S, Turner T, et al. LDL cholesterol reduction with BMS-962476, an adnectin inhibitor of PCSK9: results of a single ascending dose study. J Am Coll Cardiol. 2014;63:A1372. doi:10.1016/S0735-1097(14)61372-3.
37. Katzmann JL, Cupido AJ, Laufs U. Gene Therapy Targeting PCSK9. Metabolites. 2022;12(1):70. doi:10.3390/metabo12010070.
38. Wang L, Smith J, Breton C, et al. Meganuclease targeting of PCSK9 in macaque liver leads to stable reduction in serum cholesterol. Nat Biotechnol. 2018;36(8):717-25. doi:10.1038/nbt.4182.
39. Wang L, Breton C, Warzecha CC, et al. Long-term stable reduction of low-density lipoprotein in nonhuman primates following in vivo genome editing of PCSK9. Mol Ther. 2021;29(6):2019-29. doi:10.1016/j.ymthe.2021.02.020.
40. Ye Y, Liu X, Wu N, et al. Efficacy and Safety of Berberine Alone for Several Metabolic Disorders: A Systematic Review and Meta-Analysis of Randomized Clinical Trials. Front Pharmacol. 2021;12:653887. doi:10.3389/fphar.2021.653887.
41. Momtazi-Borojeni AA, Jaafari MR, Badiee A, et al. Therapeutic effect of nanoliposomal PCSK9 vaccine in a mouse model of atherosclerosis. BMC Med. 2019;17(1):223. doi:10.1186/s12916-019-1457-8.
42. Momtazi-Borojeni AA, Jaafari MR, Banach M, et al. Pre-Clinical Evaluation of the Nanoliposomal antiPCSK9 Vaccine in Healthy Non-Human Primates. Vaccines (Basel). 2021;9(7):749. doi:10.3390/vaccines9070749.
43. Ridker PM, Revkin J, Amarenco P, et al. SPIRE Cardiovascular Outcome Investigators. Cardiovascular efficacy and safety of bococizumab in high-risk patients. N Engl J Med. 2017;376:1527-39. doi:10.1056/NEJMoa1701488.
44. Kasichayanula S, Grover A, Emery MG, et al. Clinical Pharmacokinetics and Pharmacodynamics of Evolocumab, a PCSK9 Inhibitor. Clin Pharmacokinet. 2018;57(7):769-79. doi:10.1007/s40262-017-0620-7.
45. Manniello M, Pisano M. Alirocumab (Praluent): First in the New Class of PCSK9 Inhibitors. P T. 2016;41(1):28-53.
46. Langslet G, Hovingh GK, Guyton JR, et al. Regional Variations in Alirocumab Dosing Patterns in Patients with Heterozygous Familial Hypercholesterolemia During an Open-Label Extension Study. Cardiovasc Drugs Ther. 2020;34(4):515-23. doi:10.1007/s10557-020-06984-0.
47. Wasserman SM, Sabatine MS, Koren MJ, et al. Comparison of LDL-C Reduction Using Different Evolocumab Doses and Intervals: Biological Insights and Treatment Implications. J Cardiovasc Pharmacol Ther. 2018;23(5):423-32. doi:10.1177/1074248418774043.
48. East C, Bass K, Mehta A, et al. Alirocumab and Lipid Levels, Inflammatory Biomarkers, Metabolomics, and Safety in Patients Receiving Maintenance Dialysis: The ALIrocumab in DIALysis Study (A Phase 3 Trial to Evaluate the Efficacy and Safety of Biweekly Alirocumab in Patients on a Stable Dialysis Regimen). Kidney Med. 2022;4(7):100483. doi:10.1016/j.xkme.2022.100483.
49. Tuñón J, Steg PG, Bhatt DL, et al. ODYSSEY OUTCOMES Investigators. Effect of alirocumab on major adverse cardiovascular events according to renal function in patients with a recent acute coronary syndrome: prespecified analysis from the ODYSSEY OUTCOMES randomized clinical trial. Eur Heart J. 2020;41(42):4114-23. doi:10.1093/eurheartj/ehaa498.
50. Charytan DM, Sabatine MS, Pedersen TR, et al. FOURIER Steering Committee and Investigators. Efficacy and Safety of Evolocumab in Chronic Kidney Disease in the FOURIER Trial. J Am Coll Cardiol. 2019;73(23):2961-70. doi:10.1016/j.jacc.2019.03.513. Erratum in: J Am Coll Cardiol. 2019;74(8):1162-6.
51. Weinberg MS, Morris KV. Transcriptional gene silencing in humans. Nucleic Acids Res. 2016;44(14):6505-17. doi:10.1093/nar/gkw139.
52. Nishikido T, Ray KK. Inclisiran for the treatment of dyslipidemia. Expert Opinion on Investigational Drugs. 2018;27:287-94. doi:10.1080/13543784.2018.1442435.
53. Pratt AJ, MacRae IJ: The RNA-induced silencing complex: a versatile gene-silencing machine. J Biol Chem. 2009;284(27):17897-901. doi:10.1074/jbc.R900012200.
54. Dyrbuś K, Gąsior M, Penson P, et al. Inclisiran-New hope in the management of lipid disorders? J Clin Lipidol. 2020;14(1):16-27. doi:10.1016/j.jacl.2019.11.001.
55. Brandts J, Ray KK. Small interfering RNA to proprotein convertase subtilisin/kexin type 9: transforming LDL-cholesterol-lowering strategies. Curr Opin Lipidol. 2020;31(4):182-6. doi:10.1097/MOL.0000000000000691.
56. Merćep I, Friščić N, Strikić D, et al. Advantages and Disadvantages of Inclisiran: A Small Interfering Ribonucleic Acid Molecule Targeting PCSK9-A Narrative Review. Cardiovasc Ther. 2022;2022:8129513. doi:10.1155/2022/8129513.
57. Sundararaman SS, Döring Y, van der Vorst EPC. PCSK9: A Multi-Faceted Protein That Is Involved in Cardiovascular Biology. Biomedicines. 2021;9(7):793. doi:10.3390/biomedicines9070793.
58. Pirillo A, Catapano AL. Inclisiran: How Widely and When Should We Use It? Curr Atheroscler Rep. 2022;24(10):803-11. doi:10.1007/s11883-022-01056-0.
59. Da Dalt L, Ruscica M, Bonacina F, et al. PCSK9 deficiency reduces insulin secretion and promotes glucose intolerance: the role of the low-density lipoprotein receptor. Eur Heart J. 2019;40(4):357-68. doi:10.1093/eurheartj/ehy357.
60. Da Dalt L, Castiglioni L, Baragetti A, et al. PCSK9 deficiency rewires heart metabolism and drives heart failure with preserved ejection fraction. Eur Heart J. 2021;42(32):3078-90. doi:10.1093/eurheartj/ehab431
61. Rosenson RS, Hegele RA, Fazio S, et al. The Evolving Future of PCSK9 Inhibitors. J Am Coll Cardiol. 2018;72(3):314-29. doi:10.1016/j.jacc.2018.04.054.
62. Warden BA, Fazio S, Shapiro MD. The PCSK9 revolution: Current status, controversies, and future directions. Trends Cardiovasc Med. 2020;30(3):179-85. doi:10.1016/j.tcm.2019.05.007.
63. Tomlinson B, Chow E, Chan P, et al. An evaluation of the pharmacokinetics of inclisiran in the treatment of atherosclerotic cardiovascular disease. Expert Opin Drug Metab Toxicol. 2021;17(12):1353-61. doi:10.1080/17425255.2021.2029402.
64. Wright RS, Ray KK, Raal FJ, et al. ORION Phase III Investigators. Pooled PatientLevel Analysis of Inclisiran Trials in Patients With Familial Hypercholesterolemia or Atherosclerosis. J Am Coll Cardiol. 2021;77(9):1182-93. doi:10.1016/j.jacc.2020.12.058.
65. Kallend D, Stoekenbroek R, He Y, et al. Pharmacokinetics and pharmacodynamics of inclisiran, a small interfering RNA therapy, in patients with hepatic impairment. J Clin Lipidol. 2022;16(2):208-19. doi:10.1016/j.jacl.2022.01.001.
66. Wright RS, Collins MG, Stoekenbroek RM, et al. Effects of Renal Impairment on the Pharmacokinetics, Efficacy, and Safety of Inclisiran: An Analysis of the ORION-7 and ORION-1 Studies. Mayo Clin Proc. 2020;95(1):77-89. doi:10.1016/j.mayocp.2019.08.021.
67. Fitzgerald K, Frank-Kamenetsky M, Shulga-Morskaya S, et al. Effect of an RNA Interference Drug on the Synthesis of Proprotein Convertase Subtilisin/Kexin Type 9 (PCSK9) and the Concentration of Serum LDL Cholesterol in Healthy Volunteers: A Randomised, SingleBlind, Placebo-Controlled, Phase 1 Trial. Lancet. 2014;383:60-8. doi:10.1016/S0140-6736(13)61914-5.
68. Ray KK, Landmesser U, Leiter LA, et al. Inclisiran in Patients at High Cardiovascular Risk with Elevated LDL Cholesterol. N Engl J Med. 2017;376(15):1430-40. doi:10.1056/NEJMoa1615758.
69. Hovingh GK, Lepor NE, Kallend D, et al. Inclisiran Durably Lowers Low-Density Lipoprotein Cholesterol and Proprotein Convertase Subtilisin/Kexin Type 9 Expression in Homozygous Familial Hypercholesterolemia: The ORION-2 Pilot Study. Circulation. 2020;141(22):1829-31. doi:10.1161/CIRCULATIONAHA.119.044431.
70. Kosmas CE, Muñoz Estrella A, Skavdis A, et al. Inclisiran for the Treatment of Cardiovascular Disease: A Short Review on the Emerging Data and Therapeutic Potential. Ther Clin Risk Manag. 2020;16:1031-7. doi:10.2147/TCRM.S230592.
71. Raal FJ, Kallend D, Ray KK, et al. ORION-9 Investigators. Inclisiran for the Treatment of Heterozygous Familial Hypercholesterolemia. N Engl J Med. 2020;382(16):1520-30. doi:10.1056/NEJMoa1913805.
72. Ray KK, Wright RS, Kallend D, et al. ORION-10 and ORION-11 Investigators. Two Phase 3 Trials of Inclisiran in Patients with Elevated LDL Cholesterol. N Engl J Med. 2020;382(16):1507-19. doi:10.1056/NEJMoa1912387.
73. Khan SA, Naz A, Qamar Masood M, Shah R. Meta-Analysis of Inclisiran for the Treatment of Hypercholesterolemia. Am J Cardiol. 2020;134:69-73. doi:10.1016/j.amjcard.2020.08.018.
74. Huang YT, Ho LT, Hsu HY, et al. Efficacy and Safety of Proprotein Convertase Subtilisin/ Kexin Type 9 Inhibitors as Adjuvant Treatments for Patients with Hypercholesterolemia Treated with Statin: A Systematic Review and Network Meta-analysis. Front Pharmacol. 2022;13:832614. doi:10.3389/fphar.2022.832614.
75. Toth PP, Bray S, Villa G, et al. Network Meta-Analysis of Randomized Trials Evaluating the Comparative Efficacy of Lipid-Lowering Therapies Added to Maximally Tolerated Statins for the Reduction of Low-Density Lipoprotein Cholesterol. J Am Heart Assoc. 2022;11(18):e025551. doi:10.1161/JAHA.122.025551.
76. Burnett H, Fahrbach K, Cichewicz A, et al. Comparative efficacy of non-statin lipidlowering therapies in patients with hypercholesterolemia at increased cardiovascular risk: a network meta-analysis. Curr Med Res Opin. 2022;38(5):777-84. doi:10.1080/03007995.2022.2049164.
77. Talasaz AH, Ho AJ, Bhatty F, et al. Meta-analysis of clinical outcomes of PCSK9 modulators in patients with established ASCVD. Pharmacotherapy. 2021;41(12):1009-23. doi:10.1002/phar.2635.
78. Wang X, Wen D, Chen Y, et al. PCSK9 inhibitors for secondary prevention in patients with cardiovascular diseases: a bayesian network meta-analysis. Cardiovasc Diabetol. 2022;21(1):107. doi:10.1186/s12933-022-01542-4.
79. Roth EM, Goldberg AC, Catapano AL, et al. Antidrug Antibodies in Patients Treated with Alirocumab. N Engl J Med. 2017;376(16):1589-90. doi:10.1056/NEJMc1616623.
80. Cai T, Abel L, Langford O, et al. Associations between statins and adverse events in primary prevention of cardiovascular disease: systematic review with pairwise, network, and doseresponse meta-analyses. BMJ. 2021;374:n1537. doi:10.1136/bmj.n1537.
81. Zhao Z, Du S, Shen S, et al. Comparative efficacy and safety of lipid-lowering agents in patients with hypercholesterolemia: A frequentist network meta-analysis. Medicine (Baltimore). 2019;98(6):e14400. doi:10.1097/MD.0000000000014400.
82. Gürgöze MT, Muller-Hansma AHG, Schreuder MM, et al. Adverse Events Associated With PCSK9 Inhibitors: A Real-World Experience. Clin Pharmacol Ther. 2019;105(2):496-504. doi:10.1002/cpt.1193.
83. Sabatine MS, Giugliano RP, Keech AC, FOURIER Steering Committee and Investigators, et al. Evolocumab and clinical outcomes in patients with cardiovascular disease. N Engl J Med. 2017;376(18):1113-22.
84. Geng Q, Li X, Sun Q, Wang Z. Efficacy and safety of PCSK9 inhibition in cardiovascular disease: a meta-analysis of 45 randomized controlled trials. Cardiol J. 2022;29(4):574-81. doi:10.5603/CJ.a2021.0110.
85. Raal F, Scott R, Somaratne R, et al. Low-density lipoprotein cholesterol-lowering effects of AMG 145, a monoclonal antibody to proprotein convertase subtilisin/kexin type 9 serine protease in patients with heterozygous familial hypercholesterolemia: the Reduction of LDL-C with PCSK9 Inhibition in Heterozygous Familial Hypercholesterolemia Disorder (RUTHERFORD) randomized trial. Circulation. 2012;126(20):2408-17. doi:10.1161/CIRCULATIONAHA.112.144055.
86. Qamar A, Giugliano RP, Keech AC, et al. Interindividual Variation in Low-Density Lipoprotein Cholesterol Level Reduction With Evolocumab: An Analysis of FOURIER Trial Data. JAMA cardiology. 2019;4(1):59-63. doi:10.1001/jamacardio.2018.4178.
87. Park BJ, Makaryus JN, Hirsh B, Boutis LS. Evolocumab treatment failure following COVID-19 MRNA vaccination. J Am Coll Cardiol. 2022;79(9):2390. doi:10.1016/S0735-1097(22)03381-2.
88. Mansi I, Frei CR, Wang CP, Mortensen EM. Statins and New-Onset Diabetes Mellitus and Diabetic Complications: A Retrospective Cohort Study of US Healthy Adults. J Gen Intern Med. 2015;30(11):1599-610. doi:10.1007/s11606-015-3335-1.
89. Angelidi AM, Stambolliu E, Adamopoulou KI, Kousoulis AA. Is Atorvastatin Associated with New Onset Diabetes or Deterioration of Glycemic Control? Systematic Review Using Data from 1.9 Million Patients. Int J Endocrinol. 2018;2018:8380192. doi:10.1155/2018/8380192.
90. Seo WW, Seo SI, Kim Y, et al. Impact of pitavastatin on new-onset diabetes mellitus compared to atorvastatin and rosuvastatin: a distributed network analysis of 10 real-world databases. Cardiovasc Diabetol. 2022;21(1):82. doi:10.1186/s12933-022-01524-6.
91. Chen Q, Wu G, Li C, et al. Safety of Proprotein Convertase Subtilisin/Kexin Type 9 Monoclonal Antibodies in Regard to Diabetes Mellitus: A Systematic Review and Metaanalysis of Randomized Controlled Trials. Am J Cardiovasc Drugs. 2020;20(4):343-53. doi:10.1007/s40256-019-00386-w.
92. Lappin J, Llano A. Inclisiran. Practical diabetes. 2021;38(2):41-3. doi:10.1002/pdi.2333.
93. Zhang H, Plutzky J, Skentzos S, et al. Discontinuation of statins in routine care settings. Ann Intern Med. 2013;158(7):526. doi:10.7326/0003-4819-158-7-201304020-00004.
94. Hines DM, Rane P, Patel J, et al. Treatment patterns and patient characteristics among early initiators of PCSK9 inhibitors. Vasc Health Risk Manag. 2018;14:409-18. doi:10.2147/VHRM.S180496.
95. Cupido AJ, Kastelein JJP. Inclisiran for the treatment of hypercholesterolaemia: implications and unanswered questions from the ORION trials. Cardiovasc Res.
Об авторах
С. К. ЗыряновРоссия
Сергей Кенсаринович Зырянов — доктор медицинских наук, профессор, заведующий кафедрой общей и клинической фармакологии, заместитель главного врача.
Москва
Конфликт интересов:
нет
О. И. Бутранова
Россия
Ольга Игоревна Бутранова — кандидат медицинских наук, доцент кафедры общей и клинической фармакологии Медицинского института.
Москва
Конфликт интересов:
нет
Рецензия
Для цитирования:
Зырянов С.К., Бутранова О.И. Новые возможности снижения уровня холестерина липопротеидов низкой плотности: сравнительные характеристики PCSK9-таргетной терапии. Российский кардиологический журнал. 2022;27(11):5271. https://doi.org/10.15829/1560-4071-2022-5271
For citation:
Zyryanov S.K., Butranova O.I. New opportunities for lowering low-density lipoprotein cholesterol: comparative characteristics of PCSK9-targeted therapy. Russian Journal of Cardiology. 2022;27(11):5271. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5271
JATS XML

















































