Перейти к:
Неблагоприятные сердечно-сосудистые события у пациентов с коронарной микроваскулярной дисфункцией: результаты 12-месячного наблюдения с группой контроля
https://doi.org/10.15829/1560-4071-2023-5269
Аннотация
Цель. Оценить развитие неблагоприятных сердечно-сосудистых событий у пациентов с необструктивным поражением коронарных артерий (КА) и коронарной микроваскулярной дисфункцией (КМД), выявленной по данным динамической однофотонной эмиссионной томографии (ОФЭКТ) миокарда, в течение 12 мес. наблюдения, в сравнении с пациентами без КМД.
Материал и методы. В исследование включено 118 пациентов (70 мужчин, средний возраст 62,0 (58,0; 69,0) лет) с сохраненной фракцией выброса левого желудочка (62 (59; 64)%) и необструктивным поражением КА. Оценку сывороточных уровней N-концевого промозгового натрийуретического пептида выполняли исходно с помощью иммуноферментного анализа. Резерв коронарного кровотока (CFR) оценивали по данным динамической ОФЭКТ. CFR ≤2 являлся маркером КМД.
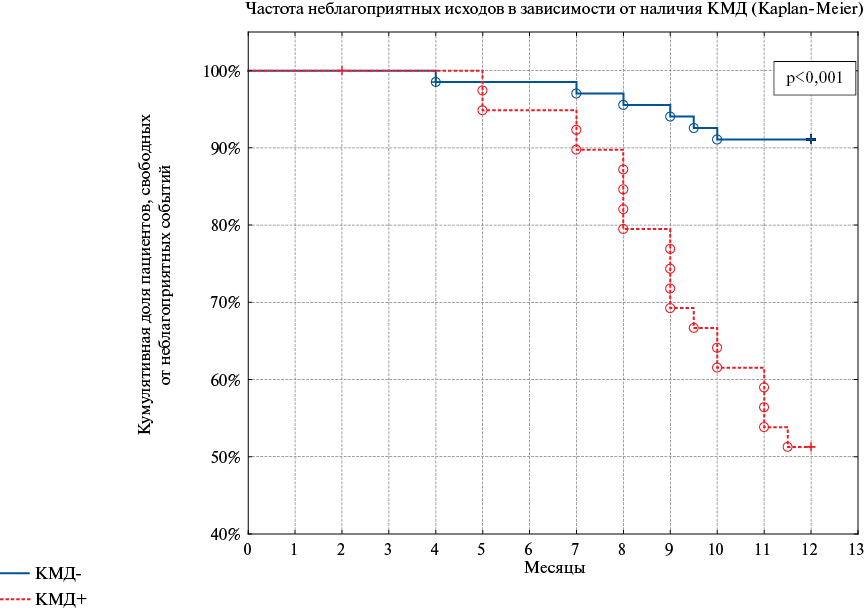
Результаты. Шесть пациентов выбыли из исследования по причине утери контакта с ними, остальные были разделены на группы в зависимости от наличия КМД: группа 1 включала больных с КМД (CFR ≤2; n=42), а группа 2 составила группу контроля и включала больных без КМД (CFR >2; n=70). В течение 12 мес. наблюдения у 25 пациентов зарегистрированы неблагоприятные события. По результатам анализа по Каплану-Майеру выявлено, у пациентов с КМД частота неблагоприятных сердечно-сосудистых событий была выше (45,2%, n=19), чем у пациентов без нее (8,6%, n=6) (p<0,001). По данным многофакторного регрессионного анализа наличие КМД (отношение шансов (ОШ) 2,42; 95% доверительный интервал (ДИ): 1,26-5,85; p<0,001) и диастолической дисфункции (ДД) (ОШ 3,27; 95% ДИ: 2,26-5,64; p<0,001) являлись независимыми предикторами неблагоприятных исходов. Сочетание КМД с ДД более чем в 5 раз увеличивало риск неблагоприятных событий (ОШ 5,18; 95% ДИ: 3,61-11,84; p<0,001).
Заключение. Установлено, что у пациентов с необструктивным поражением КА наличие КМД, выявленной по данным динамической ОФЭКТ миокарда, было связано с более высоким риском развития неблагоприятных сердечно-сосудистых событий в течение 12-мес. периода наблюдения, чем у пациентов без КМД. При этом сочетание КМД с ДД более чем в 5 раз увеличивало риск неблагоприятных исходов.
Ключевые слова
Для цитирования:
Копьева К.В., Мальцева А.Н., Мочула А.В., Гракова Е.В., Завадовский К.В. Неблагоприятные сердечно-сосудистые события у пациентов с коронарной микроваскулярной дисфункцией: результаты 12-месячного наблюдения с группой контроля. Российский кардиологический журнал. 2023;28(3):5269. https://doi.org/10.15829/1560-4071-2023-5269
For citation:
Kopyeva K.V., Maltseva A.N., Mochula A.V., Grakova E.V., Zavadovsky K.V. Adverse cardiovascular events in patients with coronary microvascular dysfunction: results of a 12-month follow-up with a control group. Russian Journal of Cardiology. 2023;28(3):5269. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5269
Распространенность хронической сердечной недостаточности (СН) составляет ~2% населения всего мира и продолжает неуклонно расти, с прогнозируемым общим увеличением на 46% к 2030г, что составит >8 млн человек [1]. Кроме того, на СН с сохраненной фракцией выброса (СНсФВ) приходится примерно половина случаев, а смертность, связанная с данной патологией, сравнима с уровнем смертности от некоторых видов негематологического рака [2].
В последнее время появляется все больше данных, указывающих на коронарную микроваскулярную дисфункцию (КМД) как основную детерминанту патологического каскада, приводящего к развитию и прогрессированию СНсФВ, в частности, у больных без стенозирующего поражения коронарных артерий (КА) [3]. Сопутствующие заболевания, такие как метаболический синдром, ожирение, артериальная гипертония, сахарный диабет (СД), хроническая болезнь почек и т.д., могут инициировать системную воспалительную реакцию, которая способствует развитию оксидативного стресса в эндотелиальных клетках, ухудшению их функции и снижению биодоступности оксида, запуская сложные молекулярные пути, которые, в конечном итоге, приводят к секреции коллагена и как следствие развитию миокардиального фиброза, повышенной ригидности и диастолической дисфункции (ДД) [4].
Резерв коронарного кровотока (coronary flow reserve, CFR), количественно определяемый как отношение гиперемированного миокардиального кровотока к кровотоку в покое, является функциональной мерой ишемии крупных и мелких сосудов, а при отсутствии окклюзирующего поражения субэпикардиальных КА отражает наличие КМД [5]. В настоящее время позитронно-эмиссионная томография сердца является "золотым стандартом" для оценки микроваскулярной перфузии, однако ее применение не распространено в реальной клинической практике ввиду сложности и высокой стоимости процедуры [6]. Другим методом определения абсолютных показателей перфузии является динамическая однофотонная эмиссионная компьютерная томография (ОФЭКТ) миокарда [4]. Эта методика появилась относительно недавно, с появлением нового класса гамма-камер, оснащенных полупроводниковыми кадмий-цинк-теллуровыми детекторами (Cadmium-Zinc-Telluride, CZT), которые позволяют количественно определять CFR и миокардиальный кровоток посредством динамической визуализации с хорошей точностью и корреляцией [4]. Тем не менее влияние КМД, полученной по данным динамической ОФЭКТ миокарда, на развитие неблагоприятных сердечно-сосудистых событий у пациентов c необструктивным поражением КА и сохраненной фракцией выброса (ФВ) левого желудочка (ЛЖ) до сих пор не анализировалось.
Целью данного исследования являлась оценка развития неблагоприятных сердечно-сосудистых событий у пациентов с КМД, выявленной по данным динамической ОФЭКТ, в течение 12 мес. наблюдения в сравнении с пациентами без КМД.
Материал и методы
Набор пациентов осуществлялся на базе Научно-исследовательского института кардиологии, Томского национального исследовательского медицинского центра Российской академии наук. Исследование было одобрено локальным этическим комитетом данного научно-исследовательского института (протокол № 204 от 18 ноября 2020г). Информированное письменное согласие получено от всех пациентов до начала процедур исследования.
С декабря 2020г по сентябрь 2021г последовательно было включено 118 пациентов с сохраненной ФВ ЛЖ (62 (59; 64)%) и необструктивным поражением КА (70 мужчин; средний возраст 62,0 (58,0; 69,0) лет), соответствующих критериям включения/исключения.
Критерии включения: 1) необструктивное (<50%) поражение КА по данным коронарной компьютерной томографической ангиографии; 2) документированная по данным эхокардиографии (ЭхоКГ) ФВ ЛЖ ≥50%; 3) синусовый ритм; 4) подписанное информированное согласие.
Критерии исключения: 1) перенесенный ранее инфаркт миокарда; 2) планируемая коронарная реваскуляризация и/или предшествующая реваскуляризация КА; 3) систолическое артериальное давление >160 мм рт.ст.); 4) симптоматическая гипотензия со средним систолическим артериальным давлением <90 мм рт.ст.; 5) атриовентрикулярная блокада II-III степени, синдром слабости синусового узла; 6) персистирующая или хроническая форма фибрилляции и/или трепетания предсердий; 7) недостаточность или стеноз клапанов сердца ≥2 степени; 8) гипертрофическая и дилатационная кардиомиопатии; 9) перенесенная ранее тромбоэмболия легочной артерии с высокой легочной гипертензией (систолическое давление в правом желудочке ≥45 мм рт.ст.); 10) тяжелая форма бронхиальной астмы и/или хроническая обструктивная болезнь легких; 11) патология щитовидной железы; 12) скорость клубочковой фильтрации (CKD-EPI) <50 мл/мин/1,73 м2; 13) печеночная недостаточность класса С по Чайлд-Пью; 14) острые и хронические воспалительные заболевания сердца; 15) уровень гемоглобина <100 г/дл; 16) инсульт или транзиторная ишемическая атака в течение 90 дней до включения в исследование; 17) индекс массы тела >35 кг/м2; 18) желудочковая экстрасистолия III-V градации (по Lown).
ЭхоКГ. Для выполнения двухмерной (2D, B-real time) трансторакальной ЭхоКГ использовали ультразвуковой сканер с улучшенной визуализацией Philips Affiniti 70. Все исследования были выполнены одним высококвалифицированным специалистом. Выявление ДД ЛЖ основывалось на оценке шести показателей: пик Е, отношение E/A, lateral e’, среднее отношение E/e’, индексированный объем левого предсердия (ЛП) и пиковая скорость трикуспидальной регургитации. ДД ЛЖ диагностировалась при наличии ≥3 ненормальных значений показателей [7].
Динамическая ОФЭКТ. За 24 ч до исследования пациентам отменяли прием бета-адреноблокаторов, нитратов, антагонистов кальциевых каналов, кофеина и производных метилксантина. Исследования выполняли в утренние часы, натощак, на фоне синусового ритма, по двухдневному протоколу "покой-нагрузка" с использованием радиофармпрепарата 99mTc-метокси-изобутил-изотнитрил (99mTc-МИБИ), который вводили внутривенно болюсно в дозировке 260-444 МБк. Для выполнения исследования в состоянии нагрузки использовали стресс-агент аденозинтрифосфат, который вводили внутривенно при помощи инфузомата в дозировке 160 мкг/кг/мин в течение 4 мин.
Для коррекции аттенюации выполняли низкодозовую компьютерную томографию органов грудной клетки. Все исследования были выполнены на гибридном компьютерном томографе Discovery NM/CT 570с (GE Healthcare, США), оснащенном гамма-камерой с высокочувствительными полупроводниковыми CZT-детекторами. Общая эффективная лучевая нагрузка исследования составила ~6,25 мЗв.
Полученные сцинтиграфические изображения обрабатывали на специализированной рабочей станции Xeleris II (GE Healthcare, Израиль). Определяли стандартные полуколичественные индексы нарушения миокардиальной перфузии: Summed Stress Score — сумма баллов при нагрузке, Summed Rest Score — сумма баллов в покое, Summed Difference Score — разница между нагрузкой и покоем, а также количественные показатели: Stress Myocardial Blood Flow (stress-MBF) — миокардиальный кровоток при нагрузке, Rest Myocardial Blood Flow (rest-MBF) — миокардиальный кровоток в покое, CFR. Динамическая ОФЭКТ являлась критерием диагностики КМД — при отсутствии окклюзирующего поражения субэпикардиальных КА CFR ≤2 являлся маркером КМД.
Коронарная компьютерная томографическая ангиография. Подготовка к исследованию проводилась по стандартному протоколу, перед каждым сканированием оценивали частоту сердечных сокращений и артериальное давление. Все пациенты получали 0,5 мг нитроглицерина сублингвально. Для контрастного усиления использовали 70-90 мл неионогенного контрастного вещества (йопамидол 370 мг, Bracco Diagnostics, Италия), который вводили внутривенно через кубитальный катетер. Согласно модифицированной классификации Ассоциации кардиологов КА подразделялись на 16 сегментов [8].
Биохимический анализ. Забор крови осуществлялся путем венепункции, а образцы сыворотки, полученные после центрифугирования, хранились при температуре -240 C с одним циклом замораживания-оттаивания. Уровни N-концевого промозгового натрийуретического пептида (NT-proBNP) в сыворотке крови определяли с помощью иммуноферментного анализа (Biomedica, Австрия).
Неблагоприятные сердечно-сосудистые события и динамическое наблюдение. Неблагоприятными сердечно-сосудистыми событиями являлись смертельные исходы и госпитализации по поводу декомпенсации СНсФВ, прогрессирование СН на 1 и более функциональный класс (ФК) по NYHA, переход в более тяжелую стадию СН (по классификации Н. Д. Стражеско, В. Х. Василенко, 1935г), интенсификация пероральной диуретической терапии (увеличение дозы диуретика на ≥50%) и впервые диагностированная СНсФВ в соответствии с рекомендациями ESC 2021г по диагностике и лечению острой и хронической СН [1]. Всем больным после выявления необструктивного поражения КА и сохраненной ФВ ЛЖ >50% и включения в исследование проводились ОФЭКТ, ЭхоКГ, забор крови. Учитывая то, что СНсФВ у пациентов была выявлена впервые, большинство из них не получали оптимальную медикаментозную терапию. В этих случаях на данном этапе, при необходимости, выполнялась модификация лечения и, согласно клиническим рекомендациям, проводилась коррекция факторов риска и назначалась оптимальная медикаментозная терапия. После проведенной коррекции лечения начинался период наблюдения (12 мес.), в течение которого пациенты обследовались и лечились амбулаторно. Через 12 мес. посредством телефонного контакта или визита в клинику собирались и анализировались данные о наличии неблагоприятных событий и времени их наступления, изменениях медикаментозной терапии за этот срок, клиническом статусе больных.
Статистический анализ. Статистическая обработка результатов исследования проводилась с помощью программ STATISTICA 10.0 и MedCalc 11.5.0.0. Для проверки статистических гипотез при сравнении 2 не- зависимых групп использовали критерий Манна-Уитни. При анализе качественных признаков проводили анализ таблиц сопряженности с использованием критерия χ2 Пирсона. Данные представляли в виде медианы (Me) и межквартильного интервала (Q — 25-й и 75-й процентили). Однофакторный регрессионный анализ с расчетом отношения шансов (ОШ) с 95% доверительным интервалом (ДИ) использовали для оценки влияния параметров на риск развития неблагоприятных сердечно-сосудистых событий. В многофакторный регрессионный анализ были включены исходные параметры, которые являлись клинически значимыми или имели унивариантную взаимосвязь с неблагоприятными исходами, и не обладали высокой степенью коллинеарности (r≥0,7): пол, возраст, индекс массы тела, наличие СД, хронической обструктивной болезни легких, фибрилляции предсердий, хронической СН, значения скорости клубочковой фильтрации, NT-proBNP, С-реактивного белка (СРБ), фибриногена, гликированного гемоглобина, калия, параметров липидного спектра, ФВ ЛЖ, конечные систолический и диастолический объемы, индексированный объем ЛП, пиковая скорость трикуспидальной регургитации, отношение E/e’, наличие КМД. Взаимосвязь между КМД и неблагоприятными исходами оценивалась по данным анализа по Каплану-Майеру. Критический уровень значимости p-value для всех используемых процедур анализа принимали равным 0,05.
Результаты
Шесть пациентов выбыли из исследования по причине утери контакта с ними, остальные были разделены на группы в зависимости от наличия КМД: группа 1 включала больных с КМД (CFR ≤2; n=42), а группа 2 составила группу контроля и включала больных без КМД (CFR >2; n=70). Исходно СНсФВ I-III ФК (по NYHA) была диагностирована у 58 пациентов (51,8%) в соответствии с рекомендациями ESC 2021 по диагностике и лечению острой и хронической СН [1]. При этом у больных в группе 1 СНсФВ была выявлена только в 34,3% случаев, тогда как у больных в группе 2 СНсФВ была диагностирована в 80,9% случаев (р<0,001). Пациенты с КМД чаще имели в анамнезе СД 2 типа (р<0,001) и чаще являлись курильщиками (р=0,012), чем пациенты без КМД. В группе 1 уровни NT-proBNP были выше в 2,6 раз (р=0,004), а концентрация высокочувствительного СРБ — в 1,8 раз (р=0,011) по сравнению с группой 2. Остальные исходные клинико-демографические характеристики пациентов не различались между группами (табл. 1). На момент включения в исследование больные не получали оптимальной медикаментозной терапии, в дальнейшем проводилась коррекция лечения согласно клиническим рекомендациям, а также оценивалась терапия через 12 мес. наблюдения (табл. 2). По частоте приема основных групп препаратов не было выявлено значимых различий, за исключением метформина (p=0,003), частота назначаемости которого была выше в группе с КМД за счет превалирования СД 2 типа.
У пациентов с КМД частота и выраженность ДД была выше, чем у пациентов без нее. Значения lateral е’ были ниже в группе 1 (р=0,008) на 35%, чем в группе 2. Пиковая скорость трикуспидальной регургитации была больше на 12,4% (р=0,009), отношение Е/е’ на 21,4% (р=0,041) и индексированный объем ЛП на 51,2% (р=0,038) в группе 1, чем в группе 2. Другие эхокардиографические параметры значимо не различались между группами (табл. 3).
Были проанализированы параметры CFR и MBF в зависимости от наличия КМД (табл. 4). У больных с КМД значения CFR были ниже на 47,4% (р<0,001), чем у больных без нее. В группе 1 rest-MBF был выше на 30,7% (р<0,001), а stress-MBF был ниже на 31,7% (p<0,001) по сравнению с группой 2. Стандартные полуколичественные индексы нарушения миокардиальной перфузии не отличались между группами.
Уровни CFR и rest-MBF коррелировали с уровнями NT-proBNP (r=-0,368; p=0,007 и r=0,354; p=0,042, соответственно). Значения CFR также коррелировали с индексированным объемом ЛП (r=-0,464; p=0,001) и septal e’ (r=0,314, p=0,012), а rest-MBF — с E/e’ (r=0,512; p=0,002).
В течение 12 мес. наблюдения у 25 пациентов были выявлены неблагоприятные сердечно-сосудистые события (рис. 1). У одного (0,9%) пациента зарегистрирована внезапная сердечная смерть, у 5 (4,5%) больных была впервые диагностирована СНсФВ, у 11 (9,8%) выявлено прогрессирование СН на 1 и более ФК (по NYHA), одному (0,9%) больному потребовалась интенсификация диуретической терапии (увеличение дозировки торасемида с 5 до 10 мг), еще у двух (1,8%) больных зарегистрирован переход из I во IIа стадию хронической СН, а 5 (4,5%) пациентам потребовалась госпитализация в стационар связи с декомпенсацией СНсФВ. По результатам анализа по Каплану-Майеру установлено, что частота неблагоприятных исходов значимо (p<0,001) различалась между группами (рис. 2). У пациентов с КМД частота неблагоприятных исходов была выше (45,2%, n=19), чем у пациентов без нее (8,6%, n=6).
Однофакторный регрессионный анализ выявил, что наличие СД 2 типа (ОШ 1,87; 95% ДИ: 1,12-3,95; p=0,018), хронической СН (ОШ 2,18; 95% ДИ: 1,74-4,12; р=0,002), ДД (ОШ 3,01; 95% ДИ: 2,54-7,18; р<0,001), курения (ОШ 2,13; 95% ДИ: 1,23-2,97; р=0,039), КМД (ОШ 2,72; 95% ДИ: 1,65-6,03; р<0,001), гиперэкспрессия NT-proBNP ≥760,5 пг/мл (ОШ 1,98; 95% ДИ: 1,09-3,98; р=0,028), высокочувствительного СРБ ≥2,7 г/л (ОШ 1,63; 95% ДИ: 0,98-2,54; р=0,013) были связаны с развитием неблагоприятных сердечно-сосудистых событий (табл. 5). При проведении многофакторного регрессионного анализа наличие КМД (ОШ 2,42; 95% ДИ: 1,26-5,85; AUC 0,86; точность 80,4%; p<0,001) и ДД (ОШ 3,27; 95% ДИ: 2,26-5,64; AUC 0,74; точность 70,5%; p<0,001) являлись независимыми предикторами неблагоприятных исходов. При этом сочетание КМД с ДД более чем в 5 раз увеличивало риск неблагоприятных событий в течение 12 мес. наблюдения у пациентов с необструктивным поражением КА (ОШ 5,18; 95% ДИ: 3,61-11,84; AUC 0,89; точность 89,3%; p<0,001). Другие исходные клинические параметры и показатели визуализирующих методов исследования не улучшали стратификацию риска развития неблагоприятных исходов.
Таблица 1
Исходная клинико-демографическая характеристика пациентов
|
Параметр |
Группа 1/КМД+, n=42 |
Группа 2/КМД-, n=70 |
p-value |
|
Возраст, годы |
61,5 (55,0; 66,0) |
62,0 (60,0; 67,0) |
0,124 |
|
Мужчины, n (%) |
26 (61,9) |
44 (62,8) |
0,919 |
|
ИМТ, кг/м2 |
29,7 (27,6; 32,0) |
30,1 (27,7; 34,1) |
0,254 |
|
ГБ, n (%) |
37 (88,1) |
43 (61,4) |
0,061 |
|
Сахарный диабет 2 типа, n (٪) |
11 (26,2) |
5 (7,1) |
0,003 |
|
COVID-19 в анамнезе, n (%) |
7 (16,7) |
12 (17,1) |
0,312 |
|
ХОБЛ, n (٪) |
6 (14,3) |
13 (18,6) |
0,718 |
|
Пароксизмальная форма ФП, n (%) |
7 (16,7) |
11 (15,7) |
0,761 |
|
ХСН, n (٪) |
34 (80,9) |
24 (34,3) |
<0,001 |
|
Курение, n (٪) |
11 (26,2) |
4 (5,7) |
0,012 |
|
СКФ (мл/мин/1,73 м2) |
76,8 (63,0; 81,0) |
78,0 (64,0; 87,0) |
0,476 |
|
Общий холестерин, ммоль/л |
4,65 (3,67; 5,25) |
4,34 (3,54; 4,98) |
0,932 |
|
ХС ЛНП, ммоль/л |
3,13 (2,15; 3,51) |
2,99 (2,25; 3,87) |
0,856 |
|
ХС ЛВП, ммоль/л |
1,07 (0,85; 1,31) |
1,06 (0,96; 1,26) |
0,889 |
|
Триглицерида, ммоль/л |
1,78 (1,23; 1,97) |
1,67 (1,22; 1,92) |
0,870 |
|
Гемоглобин, г/дл |
134 (121; 143) |
137 (128; 142) |
0,464 |
|
Калий, ммоль/л |
4,67 (4,12; 5,01) |
4,87 (4,43; 5,21) |
0,517 |
|
Фибриноген, г/л |
3,27 (3,14; 3,14) |
3,10 (2,86; 3,43) |
0,767 |
|
HbA1c, % |
5,9 (5,1; 6,9) |
5,8 (5,1; 6,4) |
0,098 |
|
NT-proBNP, пг/мл |
404,2 (249,5; 1533,4) |
156,3 (135,26; 274,7) |
0,004 |
|
вчСРБ, г/л |
4,1 (3,0; 11,4) |
2,3 (1,1; 8,7) |
0,011 |
Сокращения: вчСРБ — высокочувствительный С-реактивный белок, ГБ — гипертоническая болезнь, ИМТ — индекс массы тела, КМД — коронарная микроваскулярная дисфункция, СКФ — скорость клумбочкой фильтрации, ФП — фибрилляция предсердий, ХОБЛ — хроническая обструктивная болезнь легких, ХС ЛВП — холестерин липопротеидов высокой плотности, ХС ЛНП — холестерин липопротеидов низкой плотности, ХСН — хроническая сердечная недостаточность, COVID-19 — новая коронавирусная инфекция 2019, HbA1c — гликированный гемоглобин, NT-proBNP — N-концевой промозговой натрийуретический пептид.
Таблица 2
Частота принимаемых лекарственных препаратов
|
Препарат |
Исходно |
Через 12 мес. |
|||||||
|
На момент включения |
После коррекции терапии |
||||||||
|
Группа 1 КМД+, n=42 |
Группа 2 КМД-, n=70 |
p-value |
Группа 1 КМД+, n=42 |
Группа 2 КМД-, n=70 |
p-value |
Группа 1 КМД+, n=42 |
Группа 2 КМД-, n=70 |
p-value |
|
|
БРА/иАПФ, n (%) |
12 (28,6) |
24 (34,3) |
0,412 |
33 (78,6) |
43 (61,4) |
0,112 |
35 (83,3) |
51 (72,9) |
0,488 |
|
Статины, n (٪) |
7 (16,7) |
11 (15,7) |
0,871 |
42 (100,0) |
70 (100,0) |
1,000 |
39 (92,9) |
67 (95,7) |
0,976 |
|
АК, n (٪) |
3 (7,1) |
7 (10,0) |
0,523 |
7 (16,7) |
12 (17,1) |
0,891 |
6 (14,3) |
10 (14,3) |
0,998 |
|
β-блокаторы, n (%) |
5 (11,9) |
12 (17,1) |
0,717 |
11 (26,2) |
19 (27,1) |
0,871 |
11 (26,2) |
19 (27,1) |
0,871 |
|
Амиодарон, n (٪) |
3 (7,1) |
7 (10,0) |
0,651 |
3 (7,1) |
7 (10,0) |
0,745 |
3 (7,1) |
7 (10,0) |
0,745 |
|
Дезагреганты, n (%) |
11 (26,2) |
23 (32,8) |
0,487 |
36 (85,7) |
53 (75,7) |
0,231 |
36 (85,7) |
52 (74,3) |
0,217 |
|
Диуретики, n (%) |
5 (11,9) |
8 (11,4) |
0,981 |
11 (26,1) |
15 (21,4) |
0,801 |
11 (26,2) |
14 (20,0) |
0,726 |
|
АМКР, n (٪) |
2 (4,8) |
3 (4,3) |
0,916 |
2 (4,8) |
4 (5,7) |
0,965 |
2 (4,8) |
4 (5,7) |
0,965 |
|
НОАК, n (٪) |
4 (9,5) |
6 (8,6) |
0,821 |
4 (9,5) |
6 (8,6) |
0,871 |
4 (9,5) |
6 (8,6) |
0,871 |
|
Бигуаниды, n (%) |
8 (19,0) |
5 (7,1) |
0,098 |
11 (26,2) |
5 (7,1) |
0,003 |
11 (26,2) |
5 (7,1) |
0,003 |
|
ДПП-4, n (%) |
1 (2,4) |
3 (4,3) |
0,172 |
3 (7,1) |
6 (8,6) |
0,716 |
3 (7,1) |
6 (8,6) |
0,716 |
|
иНГКТ-2, n (%) |
1 (2,4) |
2 (2,8) |
0,787 |
1 (2,4) |
2 (2,8) |
0,787 |
1 (2,4) |
2 (2,8) |
0,787 |
Сокращения: АК — антагонисты кальция, АМКР — антагонисты минералокортикоидных рецепторов, БРА — блокаторы рецепторов ангиотензина II, ДПП-4 — ингибиторы дипептидилпептидазы-4, иАПФ — ингибиторы ангиотензинпревращающего фермента, иНГКТ-2 — ингибиторы натрий-глюкозного котранспортера 2 типа, КМД — коронарная микроваскулярная дисфункция, НОАК — новые пероральные антикоагулянты.
Таблица 3
Эхокардиографические данные пациентов
|
Параметр |
Группа 1/КМД+, n=42 |
Группа 2/КМД-, n=70 |
p-value |
|
ФВ ЛЖ, % |
62 (58,5; 65,0) |
63 (61; 66) |
0,183 |
|
Конечно-систолический размер, мм |
40 (38; 43) |
38,5 (36,5; 41,5) |
0,524 |
|
Конечно-диастолический размер, мм |
51,0 (48,7; 53,0) |
50,5 (47,5; 52,5) |
0,307 |
|
ИММЛЖ, г/м2 |
98,0 (88,5; 114,5) |
92 (85,5; 106,5) |
0,276 |
|
Отношение Е/А |
1,04 (0,79; 1,3) |
0,97 (0,74; 1,2) |
0,516 |
|
Lateral e’, см/с |
5,56 (4,78; 6,45) |
8,56 (8,01; 9,14) |
0,008 |
|
TRV, м/с |
2,98 (2,95; 3,01) |
2,61 (2,3; 2,76) |
0,009 |
|
Отношение E/e’ |
14 (13,5; 15,0) |
11 (10; 12) |
0,041 |
|
ЛПОИ, мл/м2 |
38,3 (35,7; 51,1) |
29,7 (27,5; 47,9) |
0,038 |
|
Диастолическая дисфункция, n (%) |
37 (88,1) |
26 (37,1) |
<0,001 |
Сокращения: ИММЛЖ — индекс массы миокарда левого желудочка, КМД — коронарная микроваскулярная дисфункция, ЛЖ — левый желудочек, ЛПОИ — индексированный объем левого предсердия, ФВ — фракция выброса, E/e’ — отношение трансмитрального Е пика к тканевому миокардиальному допплеровскому е’, E/A — отношение максимальной скорости потока крови в фазу быстрого наполнения к максимальной скорости потока в систолу предсердий, Lateral e’ — ранняя диастолическая скорость движения боковой стенки левого желудочка, TRV — пиковая скорость трикуспидальной регургитации.
Таблица 4
Параметры CFR и миокардиального кровотока
|
Параметр |
Группа 1/КМД+, n=42 |
Группа 2/КМД-, n=70 |
p-value |
|
Показатели динамической ОФЭКТ |
|||
|
Stress-MBF, мл/мин/г |
1,12 (0,67; 1,49) |
1,61 (1,19; 1,83) |
<0,001 |
|
Rest-MBF, мл/мин/г |
0,75 (0,54; 0,99) |
0,52 (0,40; 0,69) |
<0,001 |
|
CFR |
1,41 (1,11; 1,71) |
2,68 (2,5; 3,8) |
<0,001 |
|
Стандартные полуколичественные индексы нарушения миокардиальной перфузии |
|||
|
SSS |
3 (0,5; 4) |
2,5 (0; 5) |
0,753 |
|
SRS |
2 (0; 3) |
0 (0; 2) |
0,537 |
|
SDS |
2 (0; 3) |
2 (0; 4) |
0,975 |
Сокращения: КМД — коронарная микроваскулярная дисфункция, ОФЭКТ — однофотонная эмиссионная компьютерная томография, CFR — резерв коронарного кровотока, MBF — миокардиальный кровоток, SDS — разница между нагрузкой и покоем, SSS — сумма баллов при нагрузке, SRS — сумма баллов в покое.
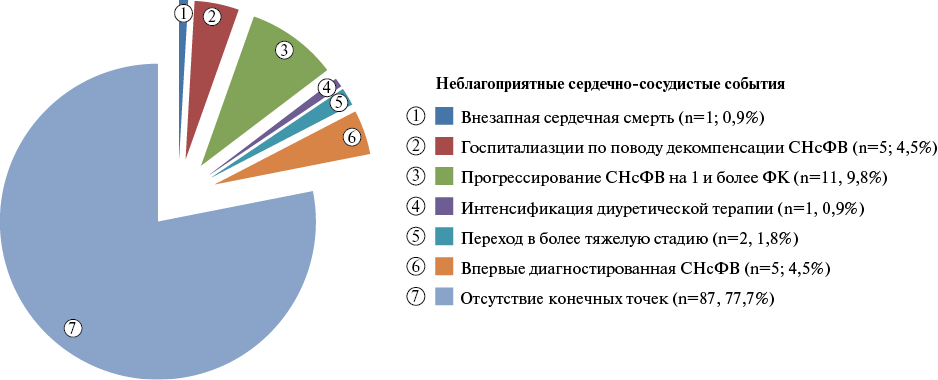
Рис. 1. Структура неблагоприятных событий, зарегистрированных в течение 12 мес. наблюдения.
Сокращения: СНсФВ — сердечная недостаточность с сохраненной фракцией выброса, ФК — функциональный класс.
|
No.at risk |
Месяцы наблюдения |
|||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
|
|
КМД- |
70 |
70 |
70 |
69 |
69 |
69 |
68 |
67 |
66 |
64 |
64 |
64 |
|
КМД+ |
42 |
42 |
42 |
42 |
4 |
40 |
38 |
34 |
30 |
27 |
24 |
23 |
Рис. 2. Частота развития неблагоприятных исходов в течение 12 мес. наблюдения в зависимости от наличия КМД.
Сокращение: КМД — коронарная микроваскулярная дисфункция.
Таблица 5
Результаты однофакторного и многофакторного регрессионного анализа
|
Однофакторный регрессионный анализ |
|||
|
Фактор |
ОШ |
95% ДИ |
p-value |
|
СД 2 типа |
1,87 |
1,12-3,95 |
0,018 |
|
Хроническая СН |
2,18 |
1,74-4,12 |
0,002 |
|
NT-proBNP (<760,5/≥760,5 пг/мл) |
1,98 |
1,09-3,98 |
0,028 |
|
вчСРБ (<2,7/≥2,7 г/л) |
1,63 |
0,98-2,54 |
0,013 |
|
ДД |
3,01 |
2,54-7,18 |
<0,001 |
|
Курение |
2,13 |
1,23-2,97 |
0,039 |
|
КМД |
2,72 |
1,65-6,03 |
<0,001 |
|
Многофакторный регрессионный анализ |
|||
|
КМД |
2,42 |
1,26-5,85 |
<0,001 |
|
ДД |
3,27 |
2,26-5,64 |
<0,001 |
|
КМД+ДД |
5,18 |
3,61-11,84 |
<0,001 |
Сокращения: вчСРБ — высокочувствительный С-реактивный белок, ДД — диастолическая дисфункция, ДИ — доверительный интервал, КМД — коронарная микроваскулярная дисфункция, ОШ — отношение шансов, СД — сахарный диабет, СН — сердечная недостаточность, NT-proBNP — N-концевой промозговой натрийуретический пептид.
Обсуждение
Результаты международных исследований с применением инвазивных или неинвазивных методов диагностики подтверждают гипотезу о том, что КМД встречается значительно чаще, чем считалось ранее, в т.ч. у больных с СНсФВ. Murthy VL, et al. установили, что у 53% пациентов с необструктивным поражением КА и клиническими проявлениями ангинозных болей были диагностированы признаки индуцируемой ишемии миокарда [9]. Согласно данным метаанализа 56 исследований, включавших 14427 пациентов, доля больных с КМД в общей популяции составляла 41%, а среди пациентов с СНсФВ ее распространенность возрастала до 75-85% [10].
В настоящее время наиболее признанная гипотеза о патогенезе КМД дает основание считать, что сопутствующие заболевания, такие как метаболический синдром, ожирение, артериальная гипертония, СД, хроническая болезнь почек и т.д., могут инициировать системную воспалительную реакцию, которая способствует развитию оксидативного стресса в эндотелиальных клетках, ухудшению их функции и снижению биодоступности оксида азота либо за счет непосредственного воздействия, либо гиперэкспрессии эндотелина-1. Эндотелий играет ключевую роль в предотвращении агрегации тромбоцитов и адгезии лейкоцитов, регулировании пролиферации клеток и модулировании сосудистого тонуса путем синтеза и высвобождения эндотелиальных вазодилатирующих компонентов, включая простагландины, оксид азота и эндотелий-зависимые факторы гиперполяризации. Таким образом, с одной стороны, нарушения как в миоцитарном, так и немиоцитарном компартментах эндотелия на фоне хронического системного воспаления вызывают адгезию и инфильтрацию моноцитов и стимуляцию интегрированных макрофагов, что приводит к дифференцировке миофибробластов и, в конечном итоге, секреции коллагена и как следствие развитию миокардиального фиброза, повышенной ригидности и ДД [4, 7]. С другой стороны, данные патофизиологические механизмы опосредуют прогрессирование гипоксии в тканях, что локально инициирует высвобождение воспалительных цитокинов, которые, в свою очередь, способствуют формированию периваскулярного фиброза, тем самым запуская патологический круг микроциркуляторных изменений в миокарде [8][9]. В нашем исследовании было установлено, что пациенты с КМД чаще в анамнезе имели СД 2 типа (р=0,003) и были курильщиками (р=0,012), что, с одной стороны, подтверждает вклад коморбидной патологии в развитие данного состояния, а значимое повышение уровня СРБ (р=0,011), вероятно, является одним из проявлений хронического провоспалительного состояния. С другой стороны, выступает значимым ограничением настоящего исследования, т.к. неоднородная выборка больных полностью не исключает возможности вклада другой патологии в развитие неблагоприятных сердечно-сосудистых событий, а многофакторный анализ рисков на малой неоднородной выборке не всегда дает адекватные результаты.
Первое международное исследование COVADIS предоставило новые доказательства того, что КМД является важной проблемой и значительным риском развития неблагоприятных сердечно-сосудистых событий [11]. Schroder J, et al. показали, что КМД, оцененная с помощью допплер-ЭхоКГ как резерв скорости коронарного кровотока передней нисходящей артерии, также была связана с повышенным риском повторных госпитализаций по поводу стенокардии и смертности от всех причин [12]. Kato S, et al. получили и проанализировали значения CFR, полученных по данным магнитно-резонансной томографии у 163 пациентов с СНсФВ (73±9 лет, 86 женщин). Установлено, что уровни CFR были значительно ниже у больных СНсФВ с нежелательными явлениями по сравнению с пациентами без них (1,93±0,38 vs 2,67±0,52, p<0,001) и являлись предиктором сердечно-сосудистой смерти и госпитализаций по поводу декомпенсации СН [13]. При этом были обнаружены значимые отрицательные корреляции между CFR и глобальной окружной деформацией (r=-0,29, p<0,001), глобальной продольной деформацией (r=-0,33, p<0,001), продольной деформацией правого желудочка (r=-0,26, p<0,001) и уровнями натрийуретического пептида в сыворотке (r=-0,32, p<0,001) [13]. В исследовании, включавшем пациентов с подозрением на ишемическую болезнь сердца с сохраненной ФВ ЛЖ, наличие КМД по данным позитронно-эмиссионной томографии ассоциировалось с параметрами ДД и высоким риском госпитализаций по причине прогрессирования СНсФВ [4]. Снижение CFR было независимо связано с наличием ДД (ОШ 2,58, 95% ДИ: 1,22-5,48) и неблагоприятными сердечно-сосудистыми исходами (ОШ 2,47, 95% ДИ: 1,09-5,48).
Нами также было продемонстрировано, что у пациентов с КМД частота встречаемости СНсФН была выше, чем у пациентов без КМД, а наличие КМД являлось независимым предиктором неблагоприятных исходов (ОШ 2,42; 95% ДИ: 1,26-5,85; AUC 0,86; точность 80,4%; p<0,001). Другим ограничением данного исследования являлись довольно короткий период наблюдения для оценки частоты наступления комбинированного события (смерть и госпитализации из-за декомпенсации СН) в данной когорте пациентов (n=6), что не позволило провести статистический анализ отдельно по "жестким" и "мягким" конечным точкам, поэтому мы оценивали их комбинацию как неблагоприятное течение СН. При этом значения CFR коррелировали с уровнями NT-proBNP (r=-0,368; p=0,007) и параметрами ДД: с индексированным объемом ЛП (r=-0,464; p=0,001) и septal e’ (r=0,314, p=0,012), тогда как коронарный кровоток в покое был связан с отношением E/e’ (r=0,512; p=0,002) и уровнями NT-proBNP (r=0,354; p=0,042). Это свидетельствует о том, что повреждение кардиомиоцитов у пациентов с КМД может ухудшать миокардиальную механику и повышать риск неблагоприятных исходов даже при необструктивном поражении КА. В частности, КМД приводит к снижению биодоступности оксида азота, а усиление передачи сигналов профибротических цитокинов может способствовать уменьшению коронарного микрососудистого разрежения и усилению миокардиального фиброза [4]. Данные патологические изменения могут приводить к ригидности сосудов и повышенной жесткости миокарда желудочков, которые, как считается, занимают центральное место в патофизиологии СНсФВ [7]. Все это находит свое отражение и в параметрах миокардиального кровотока. В отличие от пациентов с обструктивным поражением КА, у которых stress-MBF снижается из-за ограничения кровотока, а rest-MBF остается нормальным, у пациентов с КМД, stress-MBF снижается в следствие периваскулярного фиброза и микрососудистого разрежения на фоне хронического системного воспаления, а rest-MBF повышается из-за диффузного фиброза миокарда, который приводит к компенсаторному эндотелий-зависимому повышению периферического сосудистого сопротивления и увеличению кровотока в покое [14]. Корреляция динамических показателей ОФЭКТ с биохимическими маркерами объемной перегрузки и показателями диастолической функции указывает на более тесную ассоциацию между этими процессами, что, в частности, свидетельствует о патогенезе СНсФВ [15].
Ограничения исследования. Основными ограничениями исследования являлись: 1) относительно небольшая и неоднородная выборка больных, что не исключает возможности вклада другой патологии в развитие неблагоприятных исходов; 2) в течение 12 мес. после установления диагноза СНсФВ КМД не была ассоциирована с повышением частоты комбинированного события (смерть и госпитализации из-за декомпенсации СН) в данной когорте пациентов. Учитывая короткий срок наблюдения, необходимо проведение дальнейших исследований, с включением большего количества пациентов и более длительным периодом наблюдения, для оценки роли КМД в развитии серьезных неблагоприятных сердечно-сосудистых событий.
Заключение
Таким образом, данные настоящего исследования впервые продемонстрировали, что у пациентов с необструктивным поражением КА наличие КМД, выявленной по данным динамической ОФЭКТ миокарда, было связано с высоким риском развития неблагоприятных сердечно-сосудистых событий в течение 12-мес. периода наблюдения. При этом сочетание КМД с ДД более чем в 5 раз увеличивало риск неблагоприятных исходов.
Отношения и деятельность. Грант Президента Российской Федерации № MK-4257.2022.3.
Список литературы
1. McDonagh TA, Metra M, Adamo M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: Developed by the Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) With the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J. 2021;42(36):3599-726. doi:10.1093/eurheartj/ehab368.
2. Wintrich J, Kindermann I, Ukena C, et al. Therapeutic approaches in heart failure with preserved ejection fraction: past, present, and future. Clin Res Cardiol. 2021;109:1079-98. doi:10.1007/s00392-020-01633-w.
3. D’Amario D, Migliaro S, Borovac JA, et al. Microvascular Dysfunction in Heart Failure With Preserved Ejection Fraction. Front Physiol. 2019;10:1347. doi:10.3389/fphys.2019.01347.
4. Мочула А. В., Копьева К. В., Мальцева А. Н. и др. Резерв коронарного кровотока у пациентов с хронической сердечной недостаточностью с сохраненной фракцией выброса левого желудочка. Российский кардиологический журнал. 2022;27(2):4743. doi:10.15829/1560-4071-2022-4743.
5. Taqueti VR, Di Carli MF. Clinical significance of noninvasive coronary flow reserve assessment in patients with ischemic heart disease. Curr Opin Cardiol. 2016;31(6):662-9. doi:10.1097/HCO.0000000000000339.
6. Driessen RS, Raijmakers PG, Stuijfzand WJ, Knaapen P. Myocardial perfusion imaging with PET. Int J Cardiovasc Imaging. 2017;33:1021-31. doi:10.1007/s10554-017-1084-4.
7. Nagueh SF, Smiseth OA, Appleton CP. Recommendations for the evaluation of left ventricular diastolic function by echocardiography: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging. 2016;17:1321-60. doi:10.1016/j.echo.2016.01.011.
8. Austen WG, Edwards JE, Frye RL, et al. A reporting system on patients evaluated for coronary artery disease. Report of the Ad Hoc Committee for Grading of Coronary Artery Disease, Council on Cardiovascular Surgery, American Heart Association. Circulation. 1975;51:5-40. doi:10.1161/01.cir.51.4.5.
9. Murthy VL, Naya M, Taqueti VR, et al. Effects of sex on coronary microvascular dysfunction and cardiac outcomes. Circulation. 2014;129:2518-27. doi:10.1161/CIRCULATIONAHA.113.008507.
10. Mileva N, Nagumo S, Mizukami T, et al. Prevalence of Coronary Microvascular Disease and Coronary Vasospasm in Patients With Nonobstructive Coronary Artery Disease: Systematic Review and Meta‐Analysis. Journal of the American Heart Association. 2022;11:e023207. doi:10.1161/JAHA.121.023207.
11. Shimokawa H, Suda A, Takahashi J, et al. Clinical characteristics and prognosis of patients with microvascular angina: an international and prospective cohort study by the Coronary Vasomotor Disorders International Study (COVADIS) Group. Eur Heart J. 2021;42(44):4592-600. doi:10.1093/eurheartj/ehab282.
12. Schroder J, Michelsen MM, Mygind ND, et al. Coronary flow velocity reserve predicts adverse prognosis in women with angina and no obstructive coronary artery disease: results from the iPOWER study. Eur Heart J. 2021;42(3):228-39. doi:10.1093/eurheartj/ehaa944.
13. Kato S, Fukui K, Kodama S, et al. Cardiovascular magnetic resonance assessment of coronary flow reserve improves risk stratification in heart failure with preserved ejection fraction. J Cardiovasc Magn Reson. 2021;23;112. doi:10.1186/s12968-021-00807-3.
14. Filali Y, Kesäniemi A, Ukkola O. Soluble ST2, a biomarker of fibrosis, is associated with multiple risk factors, chronic diseases and total mortality in the OPERA study. Scand J Clin Lab Invest. 2021;81(4):324-31. doi:10.1080/00365513.2021.1904518.
15. Zavadovsky KV, Mochula AV, Boshchenko AA, et al. Absolute myocardial blood flows derived by dynamic CZT scan vs invasive fractional flow reserve: correlation and accuracy. J Nucl Cardiol. 2021;28:1:249-59. doi:10.1007/s12350-019-01678-z.
Об авторах
К. В. КопьеваРоссия
Копьева Кристина Васильевна — кандидат медицинских наук, научный сотрудник отделения патологии миокарда.
Томск
Конфликт интересов:
Нет
А. Н. Мальцева
Россия
Мальцева Алина Николаевна — аспирант лаборатории радионуклидных методов исследования.
Томск
Конфликт интересов:
Нет
А. В. Мочула
Россия
Мочула Андрей Викторович — кандидат медицинских наук, старший научный сотрудник лаборатории радионуклидных методов исследования.
Томск
Конфликт интересов:
Нет
Е. В. Гракова
Россия
Гракова Елена Викторовна — доктор медицинских наук, ведущий научный сотрудник отделения патологии миокарда.
Томск
Конфликт интересов:
Нет
К. В. Завадовский
Россия
Завадовский Константин Валерьевич — доктор медицинских наук, заведующий отделом лучевой диагностики.
Томск
Конфликт интересов:
Нет
Дополнительные файлы
Рецензия
Для цитирования:
Копьева К.В., Мальцева А.Н., Мочула А.В., Гракова Е.В., Завадовский К.В. Неблагоприятные сердечно-сосудистые события у пациентов с коронарной микроваскулярной дисфункцией: результаты 12-месячного наблюдения с группой контроля. Российский кардиологический журнал. 2023;28(3):5269. https://doi.org/10.15829/1560-4071-2023-5269
For citation:
Kopyeva K.V., Maltseva A.N., Mochula A.V., Grakova E.V., Zavadovsky K.V. Adverse cardiovascular events in patients with coronary microvascular dysfunction: results of a 12-month follow-up with a control group. Russian Journal of Cardiology. 2023;28(3):5269. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5269

















































