Перейти к:
Возможности первичной медикаментозной профилактики кардиотоксичности противоопухолевой терапии у онкологических больных
https://doi.org/10.15829/1560-4071-2022-5258
Аннотация
Цель. Поиск ранних признаков кардиотоксичности у онкологических больных, получающих противоопухолевую терапию, и оценка эффективности кардиопротекции ингибитором ангиотензинпревращающего фермента, бета-адреноблокатором и миокардиальным цитопротектором.
Материал и методы. В исследование включено 98 пациентов с высоким и очень высоким риском кардиотоксичности по шкале клиники Мayo (США). Онкологическим пациентам с артериальной гипертензией было предложено кардиопротективное лечение фиксированной комбинацией периндоприла и бисопролола, а больным с очень высоким риском и сопутствующей ишемической болезнью сердца дополнительно — триметазидин. Пациенты были разделены на 2 группы: основную (n=50), пациентам которой была назначена кардиопротективная терапия, и контрольную (n=48), которую составили пациенты, отказавшиеся или имеющие противопоказания к кардио протекции. Всем пациентам проводилось обследование, включающее сбор жалоб и анамнеза, физикальное обследование, электрокардиография и эхокардио графия с оценкой глобальной продольной деформации левого желудочка (ЛЖ) до химиотерапевтического лечения и через 1, 3, 6, 9 и 12 мес. после начала противоопухолевой терапии.
Результаты. У больных контрольной группы к завершению наблюдения достоверно увеличились индексированный объем левого предсердия и индексированный конечно-диастолический объем ЛЖ. В основной группе эти показатели значимо не изменились. В контрольной группе к финальному визиту достоверно снизилась фракция выброса ЛЖ в сравнении с исходной величиной и значением в основной группе. В контрольной группе через 6, 9 и 12 мес. отмечено достоверное снижение глобальной продольной деформации ЛЖ, в основной группе этот показатель оставался в пределах нормальных величин. Количество летальных исходов в контрольной группе достоверно выше (15% vs 2% в основной). В основной группе кардиотоксические осложнения возникли у 28%, в контрольной у 78% больных.
Заключение. В исследовании продемонстрирована существенная значимость кардиомониторинга и первичной медикаментозной профилактики кардиотоксичности противоопухолевой терапии у онкологических больных. Показано достоверное ухудшение параметров систолической функции ЛЖ у пациентов высокого и очень высокого риска кардиотоксичности, не получающих кардиопротективную терапию, и ее высокая эффективность у пациентов основной группы.
Ключевые слова
Для цитирования:
Васюк Ю.А., Шупенина Е.Ю., Новосел Е.О., Выжигин Д.А., Носова А.Г., Жукова Л.Г., Филоненко Д.А., Хатькова Е.И. Возможности первичной медикаментозной профилактики кардиотоксичности противоопухолевой терапии у онкологических больных. Российский кардиологический журнал. 2022;27(12):5258. https://doi.org/10.15829/1560-4071-2022-5258
For citation:
Vasyuk Yu.A., Shupenina E.Y., Novosel E.O., Vyzhigin D.A., Nosova A.G., Zhukova L.G., Filonenko D.A., Khatkova E.I. Potential of primary drug prevention of cardiotoxicity in the context of anticancer therapy. Russian Journal of Cardiology. 2022;27(12):5258. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5258
С 1990-х годов в результате эффективной противоопухолевой терапии наблюдается прогрессивное снижение смертности от рака и увеличение количества пациентов, достигших стойкой ремиссии [1][2]. Однако при этом большое значение приобретают различные осложнения, связанные с проведением противоопухолевой терапии. Одним из самых распространенных видов побочных явлений противоракового лечения являются сердечно-сосудистые осложнения.
С ростом количества новых химио- и таргетных препаратов для терапии злокачественных новообразований понимание термина кардиотоксичность трансформировалось вместе с расширением спектра сердечно-сосудистых осложнений этого лечения. Ранее кардиотоксичностью считали снижение фракции выброса (ФВ) левого желудочка (ЛЖ), индуцированное противоопухолевой терапией с последующим развитием хронической сердечной недостаточности. Современные схемы лечения злокачественных опухолей могут провоцировать не только формирование систолической и/или диастолической дисфункции миокарда, но и индуцировать развитие ишемической болезни сердца (ИБС), тромбозов, инсультов, артериальную гипертензию (АГ), вызывать нарушения ритма сердца [3][4], кровотечения. Возникновение подобных осложнений неблагоприятно отражается на течении основного заболевания и качестве жизни больных, в т.ч. и в связи с отказом от наиболее эффективных схем противоопухолевой терапии. По этой причине кардиотоксичность в настоящее время является одной из ведущих причин смертности онкобольных, не связанной с течением основного заболевания.
Предотвратить, своевременно выявлять и скорректировать кардиотоксические осложнения противоопухолевого лечения позволяет комплексная, современная клинико-инструментальная оценка структурно-функционального состояния сердечнососудистой системы онкологических пациентов и их первичная медикаментозная профилактика до, во время и после завершения противоопухолевой терапии [5][6].
С целью выбора оптимального режима наблюдения онкологических пациентов до начала их лечения необходима их стратификация на группы риска развития кардиотоксичности. Оптимальным моментом для выбора стратегии кардиомониторинга больного является постановка диагноза злокачественного новообразования и выбор онкологом планируемой схемы противоопухолевого лечения. При этом важно, чтобы оценка степени риска не стала причиной задержки начала химиотерапевтического лечения больного.
Согласно современным представлениям, вероятность развития кардиотоксических осложнений повышается при повреждении миокарда, связанном с воздействием противоопухолевых агентов, а также при наличии у пациента сопутствующих сердечнососудистых заболеваний и факторов риска их развития. Данная гипотеза была описана в работах сотрудников клиники Мауо (США) в начале текущего столетия и получила название "гипотеза множественных повреждений" [7][8]. Риск развития сердечно-сосудистых осложнений на фоне проведения противоопухолевой терапии или после нее условно складывается из двух компонентов: 1 — риск, обусловленный соматическим статусом пациента; 2 — риск, связанный со схемой планируемого лечения и входящими в него препаратами.
В августе 2022г на конгрессе Европейского общества кардиологов (ESC) были представлены новые клинические рекомендации по кардиоонкологии [9]. Согласно этим рекомендациям для некоторых пациентов степень риска развития кардиотоксичности рассчитывалась с учетом ряда дополнительных факторов, при этом был сделан акцент на широкий спектр возможных кардио- и вазотоксических реакций в ответ на противоопухолевое лечение. Однако концепция базовой стратификации риска кардиотоксичности для всех онкологических больных осталась неизменной.
Отдельно выделены критерии субклинической кардиотоксичности. Кардио- и вазотоксические осложнения, протекающие бессимптомно, также требуют своевременной коррекции и пересмотра схемы противоопухолевого лечения.
Для выявления субклинической кардиотоксичности у всех пациентов требуется детальный анализ жалоб, подробный сбор анамнестических данных, тщательное физикальное обследование, последующее длительное наблюдение и комплексное клинико-инструментальное, а также лабораторное обследование на протяжении всего лечения и после его окончания [10].
Целью данного исследования являлся поиск ранних признаков кардиотоксичности у онкологических больных высокого и очень высокого риска кардиотоксичности, а также оценка эффективности кардиопротективной терапии ингибитором ангиотензинпревращающего фермента (иАПФ), бета-адреноблокатором (БАБ) и миокардиальным цитопротектором в процессе противоопухолевого лечения пациентов с АГ и ИБС.
Материал и методы
Проспективное наблюдательное нерандомизированное исследование проведено на базе кафедры госпитальной терапии № 1 ФГБОУ ВО МГМСУ им. А. И. Евдокимова Минздрава России. В исследование было включено 98 пациентов с верифицированным диагнозом злокачественного новообразования, которым была назначена потенциально кардиотоксичная химиотерапия антрациклинами и таргетная терапия трастузумабом.
Критериями включения в исследование были: наличие морфологически верифицированного онкологического заболевания, предполагающего назначение химиотерапии, высокий или очень высокий риск развития кардиотоксичности, показатель общего состояния пациента по шкале Восточной объединенной группы онкологов (ECOG) от 0 до 3 баллов, подписанное добровольное информированное согласие пациента на включение в исследование.
Критерии невключения: постоянная форма фибрилляции предсердий, тяжелое поражение печени и почек, опухоли и метастазы в центральную нервную систему, неконтролируемая АГ, непереносимость иАПФ и БАБ, показатель общего состояния по шкале Восточной объединенной группы онкологов (ECOG) — 4 балла, отказ пациента от участия в исследовании.
Риск кардиотоксичности оценивали с помощью балльной системы, предложенной специалистами клиники Мауо [7][8]. В зависимости от степени токсичности химиопрепарата, а также наличия у пациента факторов риска и/или сердечно-сосудистых заболеваний, каждому из которых соответствует определенное количество баллов, по сумме этих баллов у больных до начала противоопухолевого лечения был определен суммарный уровень расчетного риска кардиотоксичности. Очень высокий риск кардиотоксичности определялся при сумме баллов >6, высокий уровень определялся при сумме баллов равной 5-6 (табл. 1).
Пациенты были разделены на 2 группы — в основную вошли пациенты (n=50), имеющие в качестве коморбидной патологии ИБС и АГ, высокий и очень высокий риск кардиотоксичности, подписавшие информированное согласие на включение в исследование и согласившиеся дополнительно принимать кардиопротективную терапию в виде фиксированной комбинации иАПФ периндоприла и БАБ бисопролола с последующей титрацией доз до рекомендованных или максимально переносимых. Пациентам с ИБС дополнительно был назначен миокардиальный цитопротектор триметазидин 80 мг/сут. Контрольную группу составили онкологические больные (n=48) с непереносимостью иАПФ, БАБ, триметазидина, c артериальной гипотонией (<110/70 мм рт.ст.), нарушением функции почек (скорость клубочковой фильтрации <60 мл/мин), гиперкалиемией (>5,5 ммоль/л) или отказавшиеся от приема кардиопротективной терапии. Клиникодемографическая характеристика сравниваемых групп больных представлена в таблице 2. Значимых различий между ними выявлено не было за исключением достоверно чаще отмеченного инфаркта миокарда в анамнезе и меньшего количества мужчин среди пациентов основной группы.
Каждый пациент был обследован до начала противоопухолевой терапии, а также через 1, 3, 6, 9 и 12 мес. после начала химиотерапевтического лечения. В исследовании был использован стандартный клинико-анамнестический метод обследования, электрокардиограмма в 12 отведениях, двухмерная эхокардиография (ЭхоКГ) с использованием технологии Speckle tracking и оценкой глобальной продольной деформации (GLS) ЛЖ.
Кардиотоксичность определяли как снижение ФВ ЛЖ на 10% и более от исходного уровня и до уровня <53%, либо при снижении показателя GLS ЛЖ более чем на 15% от значения, зарегистрированного до начала противоопухолевой терапии при сохраненной ФВ ЛЖ.
ФВ ЛЖ определяли при помощи модифицированного метода Симпсона при биплановой оценке в двух- и четырехкамерной позициях из апикального доступа. Исследования проводились на аппарате Vivid E95 (General Electric, США).
Все пациенты подписали добровольное информированное согласие на участие в исследовании, которое было одобрено локальным этическим комитетом МГМСУ им. А.И. Евдокимова. Для статистической обработки результатов использовалась программа Statistica Base, версия 12 (StatSoft, Россия). Статистически значимыми считались различия в анализируемых показателях при р<0,05.
Таблица 1
Оценка риска кардиотоксичности перед противоопухолевой терапией
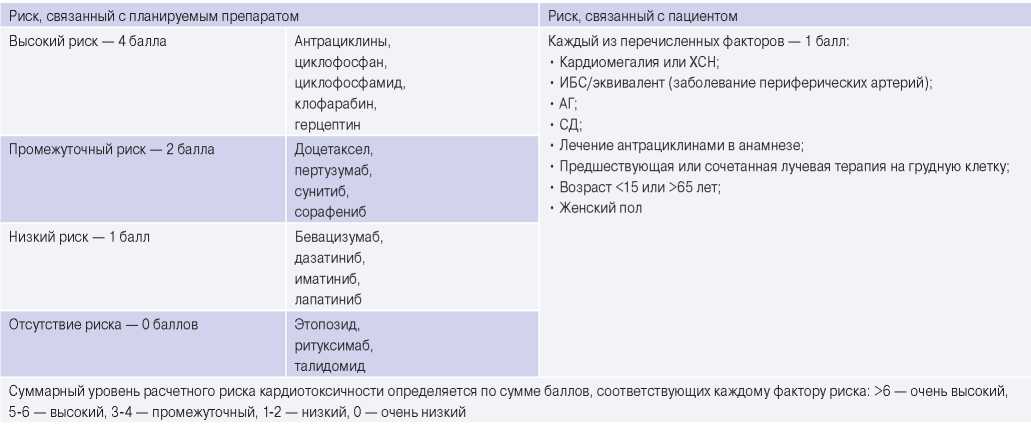
Примечание: адаптировано из [7].
Сокращения: АГ — артериальная гипертензия, ИБС — ишемическая болезнь сердца, СД — сахарный диабет, ХСН — хроническая сердечная недостаточность.
Таблица 2
Сравнительная характеристика онкологических больных, включенных в исследование (n=98)
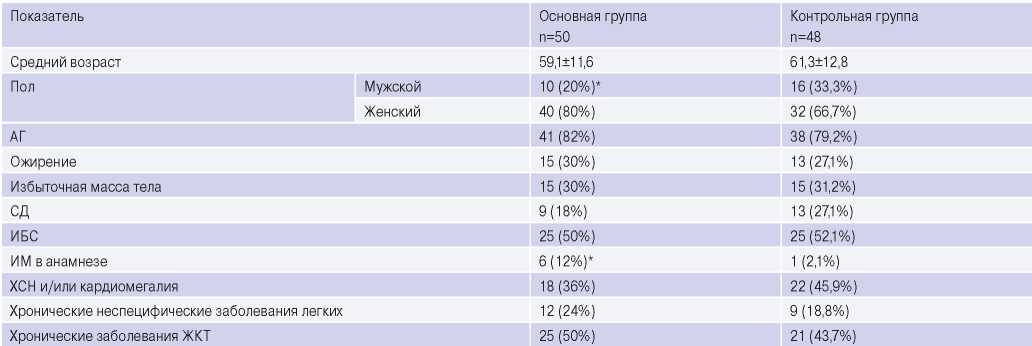
Примечание: * — достоверность различий между группами p<0,05.
Сокращения: АГ — артериальная гипертензия, ЖКТ — желудочно-кишечный тракт, ИБС — ишемическая болезнь сердца, ИМ — инфаркт миокарда, СД — сахарный диабет, ХСН — хроническая сердечная недостаточность.
Результаты
При оценке ЭхоКГ-показателей внутрисердечной гемодинамики в контрольной группе уже через 3 мес. наблюдения отмечались статистически значимые их изменения в сравнении с исходными значениями и при сопоставлении с группой пациентов, получающих кардиопротективную терапию (табл. 3).
Индексированный объем левого предсердия (ЛП) и конечный диастолический объем (КДО) ЛЖ в контрольной группе имели тенденцию к увеличению уже через 3 мес., достигнув статистической значимости к 9 мес. наблюдения. Достоверное увеличение данных показателей сохранялось и на финальном визите. В основной группе отмечена лишь недостоверная тенденция к увеличению индексированного КДО ЛЖ через 12 мес. наблюдения.
Изменение ФВ ЛЖ в сравниваемых группах имело аналогичную тенденцию. В основной группе на фоне приема кардиопротективной терапии уже к 3 мес. наблюдения было отмечено статистически значимое увеличение данного показателя. Через 12 мес. наблюдения положительная динамика ФВ ЛЖ сохранялась. У пациентов контрольной группы отмечена тенденция к снижению ФВ ЛЖ через 3 мес. наблюдения, а достоверное снижение этого показателя по сравнению с исходными значениями было отмечено через 6 и 12 мес. наблюдения. Это привело к возникновению достоверных различий этого интегрального показателя сократимости ЛЖ в сравниваемых группах на заключительном этапе наблюдения.
GLS ЛЖ достоверно снижалась у пациентов контрольной группы уже к 3 мес. наблюдения. В то же время у пациентов основной группы статистически значимого снижения данного показателя отмечено не было. Как следствие, на финальном этапе наблюдения возникли достоверные различия в величине этого показателя в сравниваемых группах.
Динамика индексированной массы миокарда ЛЖ в сравниваемых группах носила разнонаправленный характер. Если в основной группе этот показатель снижался, достигнув значимых различий с исходной его величиной через 6 и 12 мес. лечения кардиопротекторами, то в контрольной группе индексированная масса миокарда ЛЖ значимо возросла уже через 3 мес. после начала противоопухолевой терапии, достигнув максимальных значений к финальному визиту. При этом достоверность различий через 12 мес. наблюдения была отмечена не только в сравнении с исходной ее величиной, но и при сопоставлении с массой миокарда в основной группе на этом же этапе. По мнению некоторых авторов увеличение массы миокарда ЛЖ у онкологических пациентов после химиотерапии также является проявлением ее кардиотоксичности [11].
Индексированный объем правого предсердия (ПП) в контрольной группе также достоверно возрастал в процессе наблюдения на всех его этапах, а в основной группе пациентов, получавших в качестве первичной профилактики кардиотоксичности кардиопротекторы, этот показатель практически не менялся.
Показательно, что у 6 (12,5%) пациентов контрольной группы через 12 мес. наблюдения были зафиксированы проявления кардиотоксичности. У 4 из них (8,3%) кардиотоксичность была клинически выраженной и сопровождалась снижением ФВ ЛЖ ≥10% и до уровня <50%, и еще у 2 пациентов (4,2%) был зафиксирован бессимптомный вариант кардиотоксичности в виде снижения GLS ЛЖ более чем на 15% от исходного значения. Среди пациентов, дополнительно получающих кардиопротективную терапию, случаев кардиотоксичности не зарегистрировано.
Оценка клинического состояния больных по критериям шкалы Объединенной группы восточных онкологов (ECOG) через 6 мес. наблюдения также выявила статистически значимые различия между сравниваемыми группами. В основной группе к полугодовому визиту скончался (ECOG5) только 1 пациент (2%) и 3 пациента (6%) перешли в паллиативный статус (ECOG4), тогда как в контрольной группе зафиксировано 7 (15%) летальных исходов, еще 6 пациентов утратили способность к самообслуживанию и продолжили лечение в отделении паллиативной медицинской помощи (ECOG4) (рис. 1).
При сравнительной количественной оценке кардиотоксических осложнений у онкологических больных на фоне проведенного противоопухолевого лечения также отмечены достоверные различия между сравниваемыми группами. В основной группе у 72% пациентов спустя 12 мес. после начала химиотерапии не наблюдалось признаков кардиотоксичности. В контрольной группе противоопухолевое лечение без осложнений перенесли лишь 22% больных (рис. 2).
Таким образом, можно констатировать, что кардиопротективная терапия сердечно-сосудистыми препаратами у пациентов, имеющих АГ и ИБС, замедляла ремоделирование миокарда пациентов, получающих потенциально кардиотоксичную химиотерапию, и эффективно предотвращала развитие кардиотоксичности.
Таблица 3
Динамика ЭхоКГ показателей пациентов основной и контрольной групп в процессе наблюдения
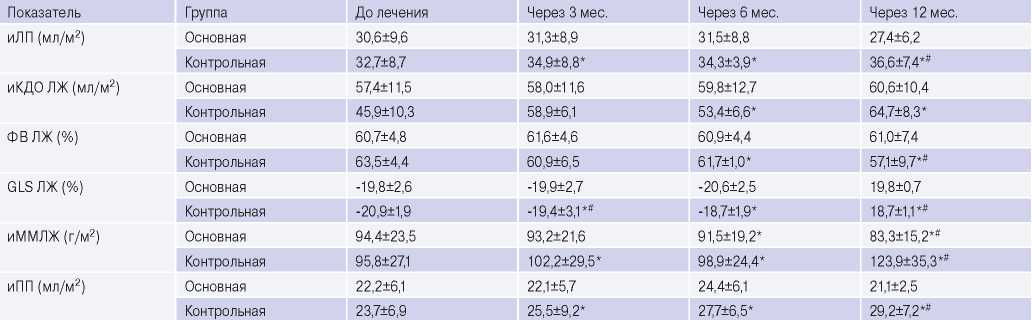
Примечание: * — р<0,05 в сравнении с визитом включения, # — р<0,05 в сравнении с основной группой на аналогичном этапе наблюдения.
Сокращения: иКДО — индексированный конечный диастолический объем, иЛП — индексированный объем левого предсердия, иММЛЖ — индексированная масса миокарда левого желудочка, иПП — индексированный объем правого предсердия, ЛЖ — левый желудочек, ФВ — фракция выброса, GLS — глобальная продольная деформация (Global Longitudinal Strain).
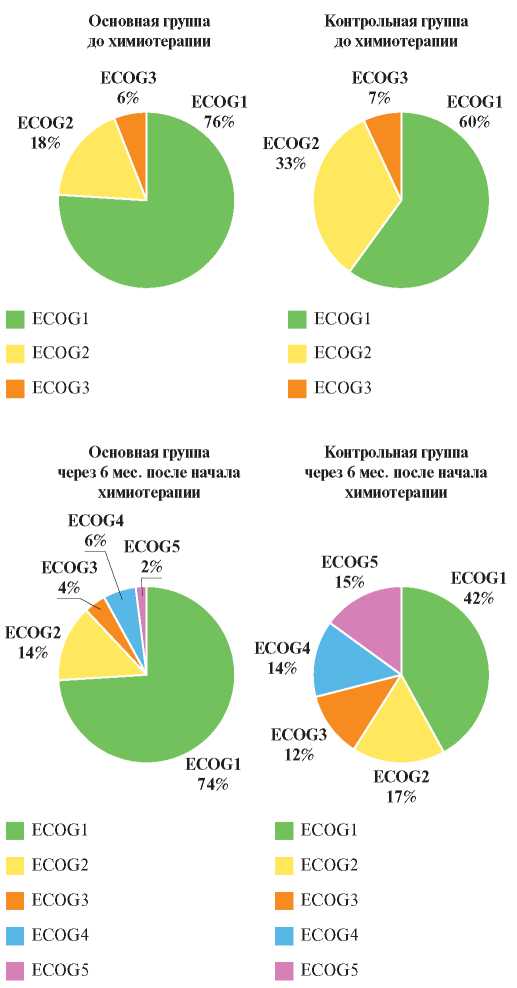
Рис. 1. Оценка клинического состояния онкологических больных основной и контрольной групп по критериям Объединенной группы восточных онкологов (ECOG — Eastern Cooperative Oncology Group) до начала и через 6 мес. после начала полихимиотерапии.
Примечание: ECOG1 — пациент неспособен выполнять тяжелую, но может выполнять легкую или сидячую работу (например, легкую домашнюю или канцелярскую работу, 70-80% по шкале Карновского); ECOG2 — пациент лечится амбулаторно, способен к самообслуживанию, но не может выполнять работу, >50% времени бодрствования проводит активно в вертикальном положении (50-60% по шкале Карновского); ECOG3 — пациент способен лишь к ограниченному самообслуживанию, проводит в кресле или постели >50% времени бодрствования (30-40% по шкале Карновского); ECOG4 — инвалид, совершенно не способен к самообслуживанию, прикован к креслу или постели (10-20% по шкале Карновского); ECOG5 — смерть.
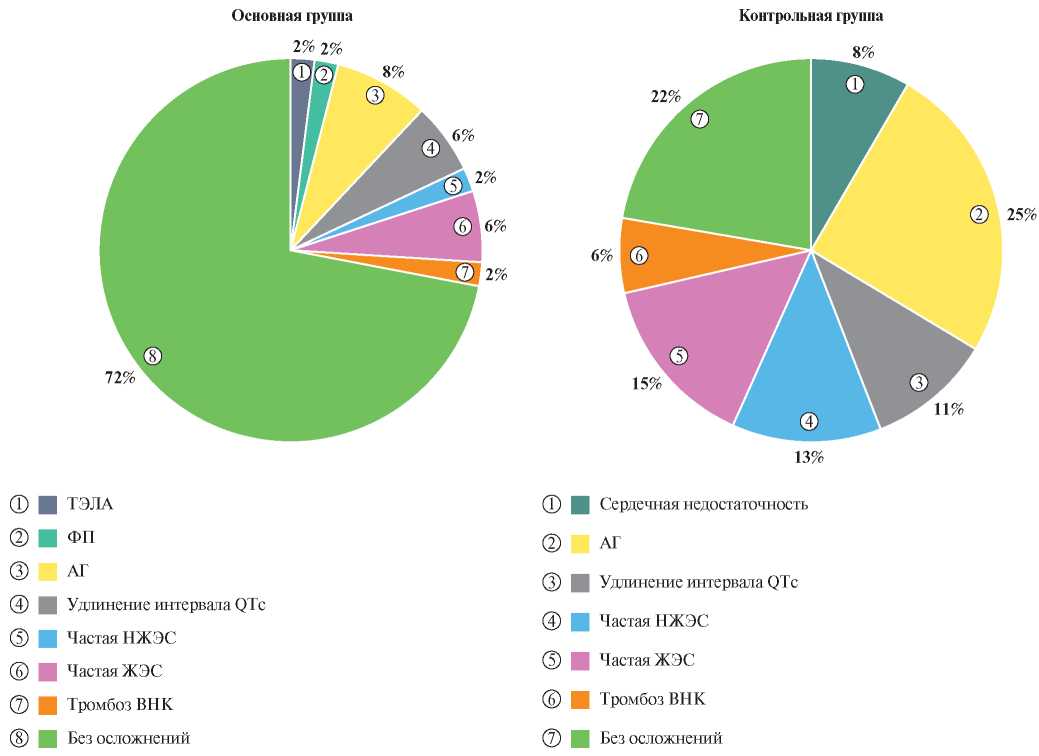
Рис. 2. Осложнения, зарегистрированные у пациентов основной группы и группы сравнения спустя 12 мес. после начала полихимиотерапии.
Сокращения: АГ — артериальная гипертензия, ВНК — вены нижних конечностей, ЖЭС — желудочковая экстрасистолия, НЖЭС — наджелудочковая экстрасистолия, ТЭЛА — тромбоэмболия легочной артерии, ФП — фибрилляция предсердий.
Обсуждение
Согласно данным Национального института рака (США), риск смерти не от прогрессирования опухолевого процесса в настоящее время превышает риск смерти от основного заболевания у онкологических больных. Почти половина онкологических больных умерли не от прогрессирования основного заболевания, а от кардиотоксических осложнений противоопухолевого лечения [12].
В соответствии со стратегией базовой стратификации риска развития кардиотоксичности у онкологических больных, им рекомендовано проводить комплексную клинико-инструментальную оценку соматического статуса до начала противоопухолевого лечения, во время и после него [9]. Последующее наблюдение больных осуществляется с учетом проведенного лечения, а также состояния больного на момент завершения лечения [2][5].
В соответствии с клиническими рекомендациями по кардиоонкологии Европейского общества кардиологов 2022г, разработан оптимальный алгоритм кардиомониторинга пациентов высокого и очень высокого риска кардиотоксических осложнений противоопухолевой терапии, включающий оценку ряда ЭхоКГ-параметров, высокочувствительных тропонинов и натрийуретических пептидов (при возможности их определения в локальной лаборатории) до начала лечения злокачественного новообразования и далее каждые 3 мес. в течение первого года наблюдения больного [9]. Такая частота и объем наблюдения позволяет своевременно выявлять субклинические изменения, требующие незамедлительной медикаментозной коррекции, а также пересмотра схемы и доз противоопухолевого лечения.
Несмотря на удобство использования и распространенность показателя ФВ ЛЖ, рассчитанной с помощью двухмерной ЭхоКГ, данный показатель обладает высокой меж- и внутриисследовательской вариабельностью. Кроме того, снижение ФВ ЛЖ часто выявляется у пациентов отсроченно, когда полноценное восстановление систолической функции ЛЖ ограничено даже при условии незамедлительного начала медикаментозной кардиопротекции.
Из-за низкой чувствительности ряда общепринятых показателей двухмерной ЭхоКГ, в настоящее время предпочтение отдается использованию новых технологий, таких как speckle tracking с определением показателя GLS ЛЖ, рассчитанного при проведении двухмерной, а также трехмерной ЭхоКГ [9][13-15].
Выявление снижения GLS ЛЖ на 15% и более от исходных значений позволяет определять дисфункцию миокарда на субклиническом уровне и диагностировать кардиотоксичность, индуцированную химио- и/или таргетной терапией [9].
Нами изучалось значение эхокардиографических параметров ЛЖ, ЛП и ПП до начала, во время и после противоракового лечения в сопоставлении с клиническими проявлениями кардиотоксичности, а также уточнялись возможности медикаментозного предотвращения и лечения осложнений противоопухолевой терапии.
После химио- и/или таргетной терапии, кардиотоксичность выявлена у 6 (12,5%) пациентов контрольной группы, при этом у 2 из них кардиотоксичность диагностирована по снижению GLS ЛЖ более, чем на 15% от исходного уровня (бессимптомная кардиотоксичность). У пациентов основной группы, которым была назначена кардиопротективная терапия до начала химио- и/или таргетной терапии, случаев клинически выраженной кардиотоксичности за 12 мес. наблюдения не выявлено.
Важно отметить, что у 4 пациентов контрольной группы развилась симптомная кардиотоксичность, которая сопровождалась снижением ФВ ЛЖ более чем на 10% от исходного значения и ниже 53%. При этом снижение показателя GLS ЛЖ было отмечено за 3 мес. до появления клинических проявлений систолической дисфункции ЛЖ.
Полученные результаты демонстрируют клиническую эффективность кардиопротективной терапии иАПФ, БАБ и триметазидином, отмеченную ранее в согласованном мнении Российских экспертов по профилактике, диагностике и лечению сердечно-сосудистой токсичности противоопухолевой терапии [11]. Определение GLS ЛЖ позволяет выявлять дисфункцию миокарда задолго до клинических проявлений кардиотоксичности. Раннее выявление кардиотоксичности имеет важное значение для улучшения качества жизни и отдаленного прогноза выживаемости онкобольных.
Заключение
Результаты настоящего исследования подтверждают эффективность кардиопротективной терапии у онкологических больных высокого и очень высокого риска кардиотоксичности. Назначение комбинации иАПФ, БАБ и триметазидина до начала противоопухолевого лечения антрациклинами и трастузумабом может положительно влиять на функциональное состояние сердечно-сосудистой системы, улучшая систолическую функцию ЛЖ, позволяя контролировать артериальное давление и улучшая общее самочувствие больных с АГ и стабильной ИБС. Проведенное исследование подтверждает возникновение клинически значимых изменений у онкологических больных на фоне химио- и таргетной терапии, не получающих кардиопротективного лечения. Учитывая лавинообразный рост новых химиои таргетных противоопухолевых агентов, необходимо продолжать исследования по разработке эффективных стратегий и программ наблюдения онкологических пациентов высокого и очень высокого риска кардиотоксичности с учетом уже имеющихся данных и результатов проведения новых многоцентровых исследований.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Herrmann J, Lerman A, Sandhu NP, et al. Evaluation and management of patients with heart disease and cancer: cardio-oncology. Mayo Clin Proc. 2014;89(9):1287-306. doi:10.1016/j.mayocp.2014.05.013.
2. Sung H, Ferlay J, Siegel RL, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021;71(3):209-49. doi:10.3322/caac.21660.
3. Васюк Ю. А., Шупенина Е. Ю., Выжигин Д. А. и др. Фибрилляция предсердий у онкологических пациентов: кто под угрозой? Рациональная Фармакотерапия в Кардиологии. 2021;17(6):900-7. doi:10.20996/1819-6446-2021-12-03.
4. Васюк Ю. А., Шупенина Е. Ю., Новосел Е. О. и др. Нарушения ритма и проводимости сердца как проявления кардиотоксичности противоопухолевого лечения — миф или реальность? Сибирский журнал клинической и экспериментальной медицины. 2020;35(1):13-21. doi:10.29001/2073-8552-2020-35-1-13-21.
5. Чазова И. Е., Агеев Ф. Т., Аксенова А. В. и др. Евразийские клинические рекомендации по диагностике, профилактике и лечению сердечно-сосудистых осложнений при противоопухолевой терапии (2022). Евразийский кардиологический журнал. 2022;(1):6-79. doi:10.38109/2225-1685-2022-1-6-79.
6. Гендлин Г. Е., Емелина Е. И., Никитин И. Г. и др. Современный взгляд на кардиотоксичность химиотерапии онкологических заболеваний, включающей антрациклиновые антибиотики. Российский кардиологический журнал. 2017;(3):145-54. doi:10.15829/1560-4071-2017-3-145-154.
7. Larsen CM, Mulvagh SL. Cardio-oncology: what you need to know now for clinical pra ctice and echocardiography. Echo Res Pract. 2017;4(1):R33-R41. doi:10.1530/ERP-17-0013.
8. Herrmann J, Lerman A. An update on cardio-oncology. Trends Cardiovasc Med. 2014;24(7):285-95. doi:10.1016/j.tcm.2014.07.003.
9. Lyon AR, López-Fernández T, Couch LS, et al. 2022 ESC Guidelines on cardio-oncology developed in collaboration with the European Hematology Association (EHA), the European Society for Therapeutic Radiology and Oncology (ESTRO) and the International Cardio-Oncology Society (IC-OS). Eur Heart J. 2022;43(41):4229-361. doi:10.1093/eurheartj/ehac244.
10. Lancellotti P, Suter TM, López-Fernández T, et al. Cardio-Oncology Services: rationale, organization, and implementation. Eur Heart J. 2019;40(22):1756-63. doi:10.1093/eurheartj/ehy453.
11. Васюк Ю. А., Гендлин Г. Е., Емелина Е. И. и др. Согласованное мнение Российских экспертов по профилактике, диагностике и лечению сердечно-сосудистой токсичности противоопухолевой терапии. Российский кардиологический журнал. 2021;26(9):4703. doi:10.15829/15604071-2021-4703.
12. Zaorsky NG, Churilla TM, Egleston BL, et al. Causes of death among cancer patients. Ann Oncol. 2017;28(2):400-7. doi:10.1093/annonc/mdw604.
13. Stoodley PW, Richards DA, Meikle SR, et al. The potential role of echocardiographic strain imaging for evaluating cardiotoxicity due to cancer therapy. Heart Lung Circ. 2011;20(1):3-9. doi:10.1016/j.hlc.2010.09.007.
14. de Baat EC, Naaktgeboren WR, Leiner T, et al. Update in imaging of cancer therapyrelated cardiac toxicity in adults. Open Heart. 2021; 8(1):e001506. doi:10.1136/openhrt2020-001506.
15. Чаулин А. М., Дупляков Д. В. Кардиопротективные стратегии при доксорубицин-индуцированной кардиотоксичности: настоящее и перспективы. Рациональная Фармакотерапия в Кардиологии. 2022;18(1):103-12. doi:10.20996/1819-6446-2022-02-11.
Об авторах
Ю. А. ВасюкРоссия
Юрий Александрович Васюк — доктор медицинских наук, профессор, заведующий кафедрой госпитальной терапии № 1.
Москва
Конфликт интересов:
все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
Е. Ю. Шупенина
Россия
Елена Юрьевна Шупенина — доктор медицинских наук, профессор, кафедра госпитальной терапии № 1.
Москва
Конфликт интересов:
все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
Е. О. Новосел
Россия
Евгения Олеговна Новосел — аспирант третьего года обучения, кафедра госпитальной терапии № 1.
Москва
Конфликт интересов:
все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
Д. А. Выжигин
Россия
Дмитрий Александрович Выжигин — аспирант второго года обучения, кафедра госпитальной терапии № 1.
Москва
Конфликт интересов:
все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
А. Г. Носова
Россия
Анастасия Геннадьевна Носова — старший лаборант, кафедра госпитальной терапии № 1.
Москва
Конфликт интересов:
все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
Л. Г. Жукова
Россия
Людмила Григорьевна Жукова - доктор медицинских наук, член-корр. РАН, зам. директора по онкологии.
Москва
Конфликт интересов:
все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
Д. А. Филоненко
Россия
Дарья Александровна Филоненко — кандидат медицинских наук, заведующий отделением дневным стационаром онкологического профиля.
Москва
Конфликт интересов:
все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
Е. И. Хатькова
Россия
Евгения Игоревна Хатькова — врач-онколог дневного стационара онкологического профиля.
Москва
Конфликт интересов:
все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
Дополнительные файлы
Рецензия
Для цитирования:
Васюк Ю.А., Шупенина Е.Ю., Новосел Е.О., Выжигин Д.А., Носова А.Г., Жукова Л.Г., Филоненко Д.А., Хатькова Е.И. Возможности первичной медикаментозной профилактики кардиотоксичности противоопухолевой терапии у онкологических больных. Российский кардиологический журнал. 2022;27(12):5258. https://doi.org/10.15829/1560-4071-2022-5258
For citation:
Vasyuk Yu.A., Shupenina E.Y., Novosel E.O., Vyzhigin D.A., Nosova A.G., Zhukova L.G., Filonenko D.A., Khatkova E.I. Potential of primary drug prevention of cardiotoxicity in the context of anticancer therapy. Russian Journal of Cardiology. 2022;27(12):5258. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5258
JATS XML

















































