Перейти к:
Особенности протокола трансторакального эхокардиографического исследования у пациентов с ожирением
https://doi.org/10.15829/1560-4071-2022-5243
Аннотация
Нередко при обследовании больных с ожирением и проведении им трансторакального эхокардиографического исследования наблюдаются нормальные показатели внутрисердечной гемодинамики и геометрии сердца. Может ли врач, анализирующий результаты исследования, определить риск сердечнососудистых осложнений и тактику ведения у таких пациентов на основании полученных данных? Действительно ли у многих пациентов с избыточной массой тела нет изменений в работе сердца или их просто не смогли выявить? С помощью новых возможностей трансторакальной эхокардиографии появляется гораздо больше способов выявить нарушения на ранних стадиях заболевания, даже при отсутствии клинических проявлений. Таким образом, включение в стандартный протокол эхокардиографии у больных с ожирением дополнительных параметров позволит наиболее точно определить тактику ведения и прогноз, тем самым снизить риск неблагоприятных исходов.
Ключевые слова
Для цитирования:
Джиоева О.Н., Максимова О.А., Рогожкина Е.А., Драпкина О.М. Особенности протокола трансторакального эхокардиографического исследования у пациентов с ожирением. Российский кардиологический журнал. 2022;27(12):5243. https://doi.org/10.15829/1560-4071-2022-5243
For citation:
Dzhioeva O.N., Maksimova O.A., Rogozhkina E.A., Drapkina O.M. Aspects of transthoracic echocardiography protocol in obese patients. Russian Journal of Cardiology. 2022;27(12):5243. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5243
Нередко при обследовании больных с ожирением и проведении им трансторакального эхокардиографического исследования (ЭхоКГ) наблюдаются нормальные показатели внутрисердечной гемодинамики и геометрии сердца. Может ли врач, анализирующий результаты исследования, определить риск сердечно-сосудистых осложнений (ССО) и тактику ведения у таких пациентов на основании полученных данных? Действительно ли у многих пациентов с избыточной массой тела нет изменений в работе сердца или их просто не смогли выявить?
Известно, что у лиц с избыточной массой тела визуализация ЭхоКГ может быть далека от оптимальной, а полученные стандартные показатели геометрии камер и их сократительной способности не всегда способны в полной мере дать необходимую информацию для оценки прогноза или выбора тактики лечения [1][2].
В настоящее время у лиц с ожирением большое внимание уделяется определению толщины эпикардиальной жировой ткани (ЭЖТ), которая не всегда оценивается в рутинном протоколе исследования. Избыточная ЭЖТ может являться одним из предикторов неблагоприятного прогноза у пациентов с хроническими неинфекционными заболеваниями. Лица с выявленным избыточным количеством ЭЖТ нуждаются в более тщательном наблюдении и проведении мероприятий, направленных на скрининг факторов риска и профилактику ССО.
Также появляется все больше исследований, демонстрирующих наличие систолической дисфункции левого желудочка (ЛЖ) при сохраненной фракции выброса (ФВ) [3-5]. Поэтому для больных с ожирением особенно актуально использовать в повседневной практике такой протокол ЭхоКГ, который включает оценку значимых показателей структуры и функции сердца, позволит провести оценку риска ССО и выявить маркеры субклинической миокардиальной дисфункции.
Особенности структурного ремоделирования и миокардиальной дисфункции у пациентов с ожирением
Ожирение негативно сказывается на работе практически всех органов и систем, но особое внимание привлекают изменения со стороны работы сердца. Доказано, что у пациентов с ожирением риск развития сердечной недостаточности (СН) с сохраненной ФВ (СНсФВ), фибрилляции предсердий (ФП), артериальной гипертензии и других заболеваний значительно выше по сравнению с пациентами с нормальными антропометрическими показателями. Ожирение ассоциировано с развитием изменений геометрии камер сердца без явных клинических признаков СН, что нередко осложняет верификацию этого диагноза, особенно, при нормальных значениях ФВ [6].
При ожирении отмечаются следующие изменения центральной и внутрисердечной гемодинамики: происходит увеличение сердечного выброса за счет гиперволемии и гипердинамического типа кровообращения, что может привести сначала к компенсаторному увеличению левого предсердия (ЛП), в то время как продолжающееся повышение постнагрузки на ЛП способствует развитию патологического ремоделирования и изменения геометрии других камер сердца [6][7]. Изменения геометрии ЛЖ проявляются в различных типах структурного ремоделирования, развивающихся в ответ на повышенное конечное диастолическое давление наполнения ЛЖ. Концентрическое ремоделирование характеризуется нормальными значениями индекса массы миокарда ЛЖ (ИММЛЖ) при повышенном значении относительной толщины стенок ЛЖ (ОТС) >0,42. Концентрическая гипертрофия диагностируется при повышенной ИММЛЖ и повышении ОТС. Эксцентрическая гипертрофия (или дилатация) наблюдается при увеличении ИММЛЖ и нормальных значениях ОТС <0,42 (рис. 1). При этом дальнейшее повышение давления наполнения ЛЖ может привести к изменению геометрических характеристик правого желудочка (ПЖ) в виде гипертрофии и/или дилатации [8][9].
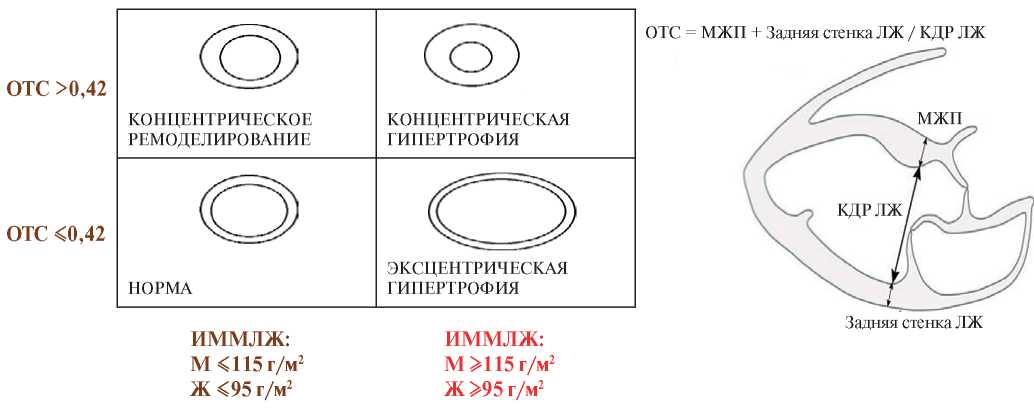
Рис. 1. Определение типов геометрии ЛЖ в зависимости от ОТС и ИММЛЖ.
Сокращения: Ж — женщины, ИММЛЖ — индекс массы миокарда левого желудочка, КДР — конечный диастолический размер, ЛЖ — левый желудочек, М — мужчины, МЖП — межжелудочковая перегородка, ОТС — относительная толщина стенки левого желудочка.
До сих пор продолжается дискуссия о наиболее эффективном методе оценки ИММЛЖ у больных с ожирением. Измерение ИММЛЖ при стандартизации по площади поверхности тела приводит к неэффективной оценке гипертрофии ЛЖ у пациентов с избыточной массой тела, хотя при нормальных значениях индекса массы тела (ИМТ) данный подход стандартизирован. Не все исследователи принимают во внимание, что индексация по росту у пациентов с избыточной массой тела и ожирением является более информативной в определении гипертрофии ЛЖ [10]. Таким образом, оценку типа геометрии ЛЖ у больных с ожирением необходимо проводить с индексацией массы миокарда по росту, а не по площади поверхности тела.
Не всегда структурные изменения геометрии у пациентов с ожирением сопровождаются снижением рутинно измеряемой сократительной способности миокарда. Например, ФВ ЛЖ может сохраняться в пределах референсных значений, но это не исключает наличия систолической дисфункции ЛЖ. Определение показателя ФВ ЛЖ является стандартным в клинической практике, имеет доказанное прогностическое значение, а также является пороговым для определения тактики ведения пациентов, однако оценка данного показателя не дает полноценную информацию о систолической функции сердца. Для оценки систолической функции ЛЖ необходимо знать показатель глобальной продольной деформации или глобальный стрейн ЛЖ (LDS) [6][11][12].
Важную роль в изменении внутрисердечной гемодинамики у пациентов с повышенным ИМТ играет диастолическая дисфункция ЛЖ или повышенное давление наполнения (Е/е’) [13]. Диастолическая дисфункция ЛЖ отражает паттерн, когда для достаточного наполнения ЛЖ и получения адекватного ударного объема в покое или во время нагрузки требуется аномальное повышение диастолического давления наполнения. Основным механизмом развития диастолической дисфункции является повышенная пассивная эластическая жесткость ЛЖ из-за его ремоделирования. В инициации процесса фиброза и увеличения жесткости миокарда ЛЖ важную роль играет избыточное депо висцерального жира, в данном случае ЭЖТ, которая за счет выделения адипоцитами особых цитокинов способствует повышению ригидности миокарда ЛЖ, что, в свою очередь, приводит к повышению давления в ЛП и его структурными и функциональными изменениями [11][12][14][15]. В исследовании Asklepios, проведенном среди нескольких групп с ИМТ <25 кг/м2, ИМТ 25-29,9 кг/м2 и ИМТ ≥30 кг/м2 было описано снижение резервуарной функции ЛП при соответствующем увеличении массы тела [7]. При этом изменения проводниковой и резервуарной функций наблюдалось уже в группе пациентов с ИМТ 25-29,9 кг/м2 [7]. Таким образом, выявление фазовой дисфункции ЛП может идентифицировать неблагоприятное предсердное ремоделирование на ранних этапах при уже незначительном повышении ИМТ [7]. Данные изменения, также выявляемые при оценке продольной деформации или глобального стрейна ЛП (LAS), могут использоваться при ЭхоКГ как наиболее ранние показатели развития предсердной дисфункции. Прогрессирование дисфункции ЛП в дальнейшем способствует развитию легочной гипертензии, нарушению функции ПЖ и развитию правожелудочковой недостаточности [16][17]. У пациентов с ожирением непросто заподозрить СНсФВ, принимая снижение толерантности к нагрузкам как проявление детренированности, особенно если в покое у этих лиц отмечается эуволемия с нормальным уровнем натрийуретического пептида B-типа, который у таких пациентов часто снижен [18-20]. В связи с этим диастолический стресс тест также рекомендуется у этой категории пациентов для ранней диагностики нарушений внутрисердечной гемодинамики и своевременной диагностики СНсФВ.
Клиническая и визуальная оценка ЭЖТ
Жировая ткань представляет собой особый мультифункциональный орган, имеющий важное значение в регуляции основного обмена. Клетки жировой ткани представлены белыми, бежевыми и бурыми адипоцитами. Белые адипоциты располагаются преимущественно под кожей и вокруг внутренних органов, а при избытке оказывают негативное влияние на органы и системы, вырабатывая специфические гормоны — адипокины. Адипокины, в свою очередь, участвуют в метаболизме липидов, регуляции чувствительности к инсулину, артериального давления и энергетического баланса, а также сосудистом гемостазе и развитии воспаления [14].
Висцеральная жировая ткань, в т.ч. и ЭЖТ, представлена белыми адипоцитами. Несмотря на то, что все фенотипы ожирения коррелируют с метаболическими нарушениями, наибольшее значение в аспекте кардиоваскулярного риска имеет избыточное накопление висцеральной жировой ткани [21]. Именно висцеральное ожирение играет важную роль в формировании структурных и функциональных изменений сердечно-сосудистой системы: повышении артериального давления, развитии метаболических нарушений и повышенном риске смерти от всех причин [22]. С учетом того, что висцеральными депо жировой ткани считаются сердце, почки, сосуды и др. органы, распределение метаболически активных жировых клеток в них возможно даже при нормальных значениях окружности талии и ИМТ [22]. При сохранении значений ИМТ у таких пациентов будет наблюдаться воздействие биологически активных адипокинов и изменения со стороны работы внутренних органов.
У пациентов с ожирением и избыточным накоплением ЭЖТ внутри стенки ЛП могут наблюдаться атрофия кардиомиоцитов в связи с гипоадипонектинемией и замещение клеток фиброзной тканью в связи с действием на межклеточный матрикс ангиотензина 2 и лептина, секретируемых адипоцитами [23][24]. Такие патологические изменения ЛП в дальнейшем способны привести к истощению стенки, нарушению работы, электрической диссоциации, неподатливости и расширению [24-27]. В результате накопленного гемодинамического стресса происходят структурные и функциональные изменения, проявляющиеся в первую очередь в виде ремоделирования ЛП. В работах отечественных авторов также продемонстрировано, что толщина эпикардиального жира ассоциирована с послеоперационными рецидивами ФП у больных с метаболическим синдромом [28].
Известно, что ЭЖТ может воздействовать на миокард и коронарную циркуляцию путем паракринных механизмов, приводя к диастолической дисфункции и развитию СНсФВ [27][28]. Данные исследований, проведенных под руководством Чумаковой Г.А., показывают взаимосвязь между толщиной ЭЖТ, измеренной с помощью трансторакальной ЭхоКГ, и развитием диастолической дисфункции ЛЖ [29]. Наличие эпикардиального ожирения у пациентов диагностировалось при толщине слоя ЭЖТ >7 мм [29]. При этом значение толщины ЭЖТ, полученное с помощью трансторакальной ЭхоКГ, расценивалось как один из важных прогностических маркеров развития диастолической дисфункции [29]. Однако нет единого мнения относительно порогового значения толщины ЭЖТ, которое является "патологическим". Так, например, в ходе исследования Дружилова М.А. и Кузнецовой Т.Ю. пороговые значения толщины ЭЖТ определялись в зависимости от возраста пациентов, включенных в исследование: >4,8 мм у лиц от 35 до 45 лет; >5,8 мм у лиц от 46 до 55 лет [30]. Результаты этого исследования также продемонстрировали значимую роль ЭЖТ в прогнозировании течения заболеваний. Более того, по результатам некоторых работ показано, что нормальная толщина слоя ЭЖТ колеблется от 5 до 7 мм [31], но стандартизированных точных референсных значений для оценки ЭЖТ определено не было. При этом в других работах можно отметить еще более широкий разброс значений нормального слоя ЭЖТ (от 3 до 9 мм) как фактора сердечно-сосудистого риска [32].
Существует предположение, что избыточное накопление ЭЖТ может способствовать и нарушениям ритма сердца, приводящим к развитию ФП. Более того, некоторые исследователи продемонстрировали у пациентов с ожирением более высокую вероятность развития ФП, чем у лиц с нормальной массой тела [33]. Не только инфильтрация миокарда адипоцитами может нарушать проведение импульса по предсердиям, но и выделение факторов, способствующих фиброзу (матриксные металлопротеазы и трансформирующие факторы роста) и других местных активных адипоцитокинов, приводящих к негативному воздействию на кардиомиоциты [34]. Кроме того, выявлено негативное влияние ЭЖТ на прогноз у пациентов с СНсФВ [35].
По данным метаанализа 6600 пациентов было обнаружено, что у людей с инфарктом миокарда (ИМ) наблюдались более высокие показатели толщины ЭЖТ по сравнению с пациентами без ИМ, измеренные с помощью трансторакальной ЭхоКГ, компьютерной томографии (КТ) и магнитно-резонансной томографии. При этом эффективность определения толщины жировой клетчатки не зависела от выбранного метода визуализации [36]. Более того, у пациентов с острым ИМ наблюдалось увеличенное количество ЭЖТ по сравнению со здоровыми лицами. Высокий уровень ЭЖТ был связан с более выраженной микрососудистой обструкцией и меньшими изменениями сегмента ST на ЭКГ, а также ассоциировался с размером инфаркта, независимо от демографических особенностей пациентов, ИМТ, локализации инфаркта, эффективности чрескожного коронарного вмешательства и др. [37].
Определение жировой клетчатки с помощью ультразвуковых методов диагностики не позволяет дифференцировать метаболически активную белую и бурую жировую ткань. Однако с учетом особенностей и локализации данные исследования способны выявить патологическое скопления висцеральной жировой ткани, состоящей, как было описано выше, преимущественно из белых адипоцитов. Несмотря на то, что золотым стандартом визуализации жировой клетчатки вокруг внутренних органов считается КТ, эффективность ультразвукового исследования в оценке толщины скопления жировой ткани не уступает КТ и магнитно-резонансной томографии [38-40]. В данных исследованиях, проведённых в последние 15 лет, получены результаты о сопоставимости и высокой корреляции результатов измерения висцерального ожирения с помощью ультразвукового метода и при использовании высокотехнологичных методов лучевой диагностики.
Показательно, что не только для людей с избыточной массой тела и ожирением характерно наличие избытка ЭЖТ, но даже при нормальных значениях ИМТ (18,5-24,9 кг/м2) может наблюдаться значимое скопление висцеральных жировых клеток вокруг сердца, повышающее риск развития ССО и других осложнений. Результаты эпидемиологических исследований, проведенных за последние 30 лет, показали, что висцеральная жировая ткань является независимым маркером риска сердечнососудистых и метаболических заболеваний и смертности. Появляющиеся данные также свидетельствуют о том, что эктопическое отложение жира, включая и ЭЖТ, может способствовать увеличению ССО. В совместном заявлении Международного общества атеросклероза и Международной рабочей группы по кардиометаболическим рискам по висцеральному ожирению обобщаются доказательства того, что висцеральная жировая ткань является фактором риска развития диабета 2 типа, атеросклероза и сердечно-сосудистых заболеваний. Пробелы в знаниях очевидны, поэтому необходимость разработки простых клинически применимых инструментов, позволяющих отслеживать изменения висцерального жира у пациентов, являются важной и необходимой мерой [41].
Ключевые моменты протокола трансторакальной ЭхоКГ у пациентов с ожирением
Измерение ЭЖТ проще и быстрее проводить в процессе трансторакальной ЭхоКГ с помощью секторного датчика из 4-5 межреберья по левой парастернальной линии (в позиции по длинной оси ЛЖ из парастернального доступа) (рис. 2, 3). При визуализации эпикардиальной жировой клетчатки размером ≤5 мм диагностируют отсутствие клинически значимого слоя висцеральной жировой ткани вокруг сердца. Несмотря на расхождение в оценке показателей избытка ЭЖТ, при толщине >5 мм уже можно диагностировать избыточное клинически значимое скопление жировой клетчатки.
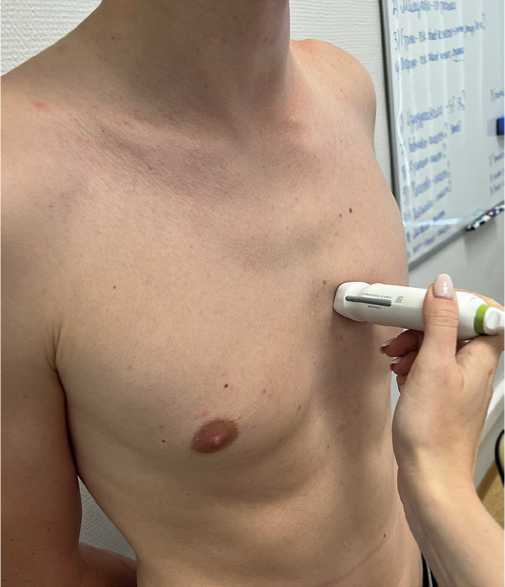
Рис. 2. Положение датчика для выведения позиции по длинной оси из парастернального доступа, позволяющее оценить толщину слоя ЭЖТ.
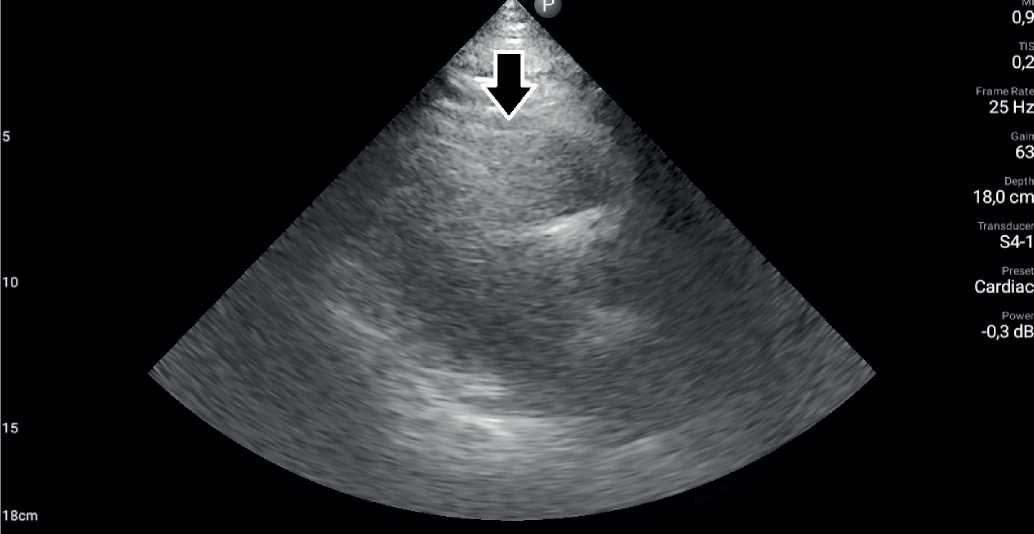
Рис. 3. Трансторакальная ЭхоКГ. Позиция по длинной оси, парастернальный доступ. Стрелкой указана ЭЖТ.
Стоит отметить, что проведение трансторакальной ЭхоКГ у тучных пациентов имеет ряд недостатков. Визуализация у лиц с ожирением может быть затруднена за счет выраженной подкожно-жировой клетчатки, создающей акустическое препятствие при исследовании и не позволяющего в полной мере оценить структуры сердца. И если из апикального доступа нередко не удается получить изображение, то из парастернального доступа это сделать у больных с ожирением несколько проще. В любом случае, ограничения исследования важно описать: если нет возможности получить оптимальные кадры из всех стандартных доступов, опишите лимитированный протокол с указанием позиции и визуализируемых структур. Писать в протоколе "Ожирение. Визуализация отсутствует" не корректно.
Таким образом, у пациентов с избыточной массой тела и ожирением важно оценивать в протоколе трансторакального ЭхоКГ следующие показатели:
1. Рост, вес;
2. ИММЛЖ* (индексация на рост), ОТС (для определения типа геометрии ЛЖ);
3. ФВ ЛЖ % (биплановый метод);
4. Е/е’, систолическое давление в легочной артерии в покое;
5. Продольная деформация ЛЖ (LDS)**, LAS*** для выявления субклинической дисфункции;
6. Определение избытка слоя ЭЖТ (>5 мм).
*Измерение ИММЛЖ с индексацией по росту при ИМТ >25 кг/м2 (>48 г/м2,7, >145 г/м у мужчин; >45 г/м2,7, >120 г/м у женщин) [42].
**Определение показателей стрейна ЛЖ (глобальный продольный стрейн (GLS) при апикальной 4-камерной позиции (A4Ch) -21,6±2,8 у мужчин; -23,2±3 у женщин; при апикальной 2-камерной позиции (A2Ch) -21,1±3,1 у мужчин; -22,0±3,2 у женщин; при апикальной 3-камерной позиции (A3Ch) -22,4±3,1 у мужчин; -23,8±3,3 у женщин; среднее -21,7±2,5 у мужчин; -23±2,7 у женщин) [43].
***Определение показателей стрейна ЛП (резервуарный стрейн (LASr) =38,0-40,8%; кондуитный стрейн (LAScd) =20,7-28,2%; контрактильный стрейн (LASct) =16-19%) [44].
Заключение
С помощью новых возможностей трансторакальной ЭхоКГ появляется гораздо больше способов выявить нарушения на ранних стадиях заболевания, даже при отсутствии клинических проявлений. Таким образом, включение в стандартный протокол ЭхоКГ у больных с ожирением дополнительных параметров позволит наиболее точно определить тактику ведения и прогноз, тем самым снизить риск неблагоприятных исходов.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Задорожная М. П., Разумов В. В. Спорные вопросы эхокардиографического определения массы миокарда левого желудочка и его гипертрофии (аналитический обзор и собственные наблюдения). Современные проблемы науки и образования. 2015;(6):216.EDNVJPSSN.
2. Карев Е. А., Вербило С. Л., Малев Э. Г. и др. Количественная ультразвуковая оценка показателей деформации миокарда: от теории к практике. Трансляционная медицина. 2020;7(6):16-28. doi:10.18705/2311-4495-2020-7-6-16-28.
3. Lang RM, Badano LP, Mor-Avi V, et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr. 2015;28(1):1-39.e14. doi:10.1016/j.echo.2014.10.003.
4. Voigt JU, Pedrizzetti G, Lysyansky P, et al. Definitions for a common standard for 2D speckle tracking echocardiography: consensus document of the EACVI/ASE/Industry Task Force to standardize deformation imaging. J Am Soc Echocardiogr. 2015;28(2):18393. doi:10.1016/j.echo.2014.11.003.
5. Ponikowski P, Voors AA, Anker SD, et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) Developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J. 2016;37(27):2129-200. doi:10.1093/eurheartj/ehw128.
6. Lewis A, Rayner JJ, Abdesselam I, et al. Obesity in the absence of comorbidities is not related to clinically meaningful left ventricular hypertrophy. Int J Cardiovasc Imaging, 2021;37(7):2277-81. doi:10.1007/s10554-021-02207-1.
7. Chirinos JA, Rietzschel ER, De Buyzere ML, et al. Arterial load and ventricular-arterial coupling: physiologic relations with body size and effect of obesity. Hypertension. 2009;54(3):558-66. doi:10.1161/HYPERTENSIONAHA.109.131870.
8. Chirinos JA, Sardana M, Satija V, et al. Effect of Obesity on Left Atrial Strain in Persons Aged 35-55 Years (The Asklepios Study). Am J Cardiol. 2019;123(5):854-61. doi:10.1016/j.amjcard.2018.11.035.
9. Reddy YNV, Carter RE, Obokata M, et al. A Simple, Evidence-Based Approach to Help Guide Diagnosis of Heart Failure With Preserved Ejection Fraction. Circulation. 2018;138(9):861-70. doi:10.1161/CIRCULATIONAHA.118.034646.
10. Lang RM, Bierig M, Devereux RB, et al. Recommendations for chamber quantification: a report from the American Society of Echocardiography’s Guidelines and Standards Committee and the Chamber Quantification Writing Group, developed in conjunction with the European Association of Echocardiography, a branch of the European Society of Cardiology. J Am Soc Echocardiogr. 2005;18(12):1440-63. doi:10.1016/j.echo.2005.10.005.
11. Abduch MC, Alencar AM, Mathias W Jr, Vieira ML. Cardiac mechanics evaluated by speckle tracking echocardiography. Arq Bras Cardiol. 2014;102(4):403-12. doi:10.5935/abc.20140041.
12. Никифоров В. С., Никищенкова Ю. В. Cовременные возможности speckle tracking эхокардиографиии в клинической практике. Рациональная Фармакотерапия в Кардиологии. 2017;13(2):248-55. doi:10.20996/1819-6446-2017-13-2-248-255.
13. Бусленко Н. С., Бузиашвили Ю. И., Кокшенева И. В. и др. Ремоделирование правых отделов сердца у больных ишемической болезнью сердца: клинико-патофизиологические корреляции. Кардиоваскулярная терапия и профилактика. 2005;4(5):23-31. EDN ISWOLV.
14. Trayhurn P, Wood IS. Adipokines: inflammation and the pleiotropic role of white adipose tissue. Br J Nutr. 2004;92(3):347-55. doi:10.1079/bjn20041213.
15. Vieira MJ, Teixeira R, Gonçalves L, Gersh BJ. Left atrial mechanics: echocardiographic assessment and clinical implications. J Am Soc Echocardiogr. 2014;27(5):463-78. doi:10.1016/j.echo.2014.01.021.
16. Митрошина Е. В. Состояние сердца по данным эхокардиографии у лиц с ожирением, манифестировавшим в пубертатный период. Ожирение и метаболизм. 2011;8(3):3845. doi:10.14341/2071-8713-4835.
17. Wang L, Zhao LP, Chen Y, et al. Obesity paradox in pulmonary hypertension due to left ventricular systolic dysfunction. Adipositasparadox bei pulmonaler Hypertonie aufgrund linksventrikulärer systolischer Dysfunktion. Herz. 2021;46(6):575-80. doi:10.1007/s00059-021-05023-4.
18. Cohen LP, Vittinghoff E, Pletcher MJ, et al. Association of Midlife Cardiovascular Risk Factors With the Risk of Heart Failure Subtypes Later in Life. J Card Fail. 2021;27(4):43544. doi:10.1016/j.cardfail.2020.11.008.
19. Di Salvo G, Pacileo G, Del Giudice EM, et al. Abnormal myocardial deformation properties in obese, non-hypertensive children: an ambulatory blood pressure monitoring, standard echocardiographic, and strain rate imaging study. European heart journal. 2006;27(22):2689-95. doi:10.1093/eurheartj/ehl163.
20. El Saiedi SA, Mira MF, Sharaf SA, et al. Left ventricular diastolic dysfunction without left ventricular hypertrophy in obese children and adolescents: a Tissue Doppler Imaging and Cardiac Troponin I Study. Cardiol Young. 2018;28(1):76-84. doi:10.1017/S1047951117001627.
21. Fox CS, Massaro JM, Hoffmann U, et al. Abdominal visceral and subcutaneous adipose tissue compartments: association with metabolic risk factors in the Framingham Heart Study. Circulation. 2007;116(1):39-48. doi:10.1161/CIRCULATIONAHA.106.675355.
22. Nakanishi K, Fukuda S, Tanaka A, et al. Relationships Between Periventricular Epi car dial Adipose Tissue Accumulation, Coronary Microcirculation, and Left Ventricular Diastolic Dysfunction. Can J Cardiol. 2017;33(11):1489-97. doi:10.1016/j.cjca.2017.08.001.
23. Kossaify A, Nicolas N. Impact of overweight and obesity on left ventricular diastolic function and value of tissue Doppler echocardiography. Clin Med Insights Cardiol. 2013;7:43-50. doi:10.4137/CMC.S11156.
24. Negi SI, Jeong EM, Shukrullah I, et al. Association of low plasma adiponectin with early diastolic dysfunction. Congest Heart Fail. 2012;18(4):187-91. doi:10.1111/j.1751-7133.2011.00276.x.
25. Casaclang-Verzosa G, Gersh BJ, Tsang TS. Structural and functional remodeling of the left atrium: clinical and therapeutic implications for atrial fibrillation. J Am Coll Cardiol. 2008;51(1):1-11. doi:10.1016/j.jacc.2007.09.026.
26. Bailey GW, Braniff BA, Hancock EW, Cohn KE. Relation of left atrial pathology to atrial fibrillation in mitral valvular disease. Ann Intern Med. 1968;69(1):13-20. doi:10.7326/00034819-69-1-13.
27. Henry WL, Morganroth J, Pearlman AS, et al. Relation between echocardiographically determined left atrial size and atrial fibrillation. Circulation. 1976;53(2):273-9. doi:10. 1161/01.cir.53.2.273.
28. Ионин В. А., Заславская Е. Л., Бараш кова Е. И. и др. Предикторы рецидива фибрилляции предсердий у пациентов с метаболическим синдромом после радиочастотной изоляции устьев легочных вен. Российский кардиологический журнал. 2022;27(3S):5184. doi:10.15829/1560-4071-20225184.EDNBPOIFI.
29. Чумакова Г. А., Гриценко О. В., Груздева О. В., Затеев А. В. Прогнозирование риска развития диастолической дисфункции левого желудочка при ожирении. Российский кардиологический журнал. 2022;27(4):4811. doi:10.15829/1560-40712022-4811.EDNATRJCZ.
30. Дружилов М. А., Кузнецова Т. Ю. Эпикардиальное висцеральное ожирение как предиктор тяжести течения COVID-19 у пациентов с избыточным весом и ожирением. Российский кардиологический журнал. 2022;27(3):4850. doi:10.15829/15604071-2022-4850.
31. Le Jemtel TH, Samson R, Ayinapudi K, et al. Epicardial Adipose Tissue and Cardiovascular Disease. Current hypertension reports. 2019;21(5):36. doi:10.1007/s11906-019-0939-6.
32. Чумакова Г. А., Веселовская Н. Г. Методы оценки висцерального ожирения в клинической практике. Российский кардиологический журнал. 2016;(4):89-96. doi:10.15829/1560-40712016-4-89-96.
33. Wang TJ, Parise H, Levy D, et al. Obesity and the risk of new-onset atrial fibrillation. JAMA. 2004;292(20):2471-7. doi:10.1001/jama.292.20.2471.
34. Ansaldo AM, Montecucco F, Sahebkar A, et al. Epicardial adipose tissue and cardiovascular diseases. Int J Cardiol. 2019;278:254-60. doi:10.1016/j.ijcard.2018.09.089.
35. Pugliese NR, Paneni F, Mazzola M, et al. Impact of epicardial adipose tissue on cardiovascular haemodynamics, metabolic profile, and prognosis in heart failure. Eur J Heart Fail. 2021;23(11):1858-71. doi:10.1002/ejhf.2337.
36. Hendricks S, Dykun I, Balcer B, et al. Epicardial adipose tissue is a robust measure of increased risk of myocardial infarction — a meta-analysis on over 6600 patients and rationale for the EPIC-ACS study. Medicine (Baltimore). 2021;100(52):e28060. doi:10.1097/MD.0000000000028060.
37. Fisser C, Colling S, Debl K, et al. The impact of epicardial adipose tissue in patients with acute myocardial infarction. Clin Res Cardiol. 2021;110(10):1637-46. doi:10.1007/s00392-021-01865-4.
38. Jung ED, Chung DS, Lee JY. The Correlation Between Visceral Fat Distance Measured by Ultrasonography and Visceral Fat Amount by Computed Tomography in Type 2 Diabetes. Korean Diabetes J. 2008;32(5):418-27. doi:10.4093/kdj.2008.32.5.418.
39. Pimanov S, Bondarenko V, Makarenko E. Visceral fat in different locations assessed by ultrasound: Correlation with computed tomography and cut-off values in patients with metabolic syndrome. Clin Obes. 2020;10(6):e12404. doi:10.1111/cob.12404.
40. Mauad FM, Chagas-Neto FA, Benedeti ACGS, et al. Reproducibility of abdominal fat assessment by ultrasound and computed tomography. Radiol Bras. 2017;50(3):141-7. doi:10.1590/0100-3984.2016.0023.
41. Neeland IJ, Ross R, Després JP, et al. Visceral and ectopic fat, atherosclerosis, and cardiometabolic disease: a position statement. Lancet Diabetes Endocrinol. 2019;7(9):715-25. doi:10.1016/S2213-8587(19)30084-1.
42. Abergel E, Tase M, Bohlender J, et al. Which definition for echocardiographic left ventri cular hypertrophy? Am J Cardiol. 1995;75(7):498-502. doi:10.1016/s0002-9149(99)80589-x.
43. Sugimoto T, Dulgheru R, Bernard A, et al. Echocardiographic reference ranges for normal left ventricular 2D strain: results from the EACVI NORRE study. Eur Heart J Cardiovasc Imaging. 2017;18(8):833-40. doi:10.1093/ehjci/jex140.
44. Pathan F, D’Elia N, Nolan MT, et al. Normal Ranges of Left Atrial Strain by SpeckleTracking Echocardiography: A Systematic Review and Meta-Analysis. J Am Soc Echocardiogr. 2017;30(1):59-70.e8. doi:10.1016/j.echo.2016.09.007.
Об авторах
О. Н. ДжиоеваРоссия
Ольга Николаевна Джиоева — доктор медицинских наук, ведущий научный сотрудник отдела фундаментальных и прикладных аспектов ожирения, руководитель лаборатории кардиовизуализации, вегетативной регуляции и сомнологии, профессор кафедры терапии и профилактической медицины.
Москва
Конфликт интересов:
все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
О. А. Максимова
Россия
Ольга Александровна Максимова — лаборант-исследователь отдела фундаментальных и прикладных аспектов ожирения.
Москва
Конфликт интересов:
все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
Е. А. Рогожкина
Россия
Елизавета Александровна Рогожкина — лаборант-исследователь отдела фундаментальных и прикладных аспектов ожирения.
Москва
Конфликт интересов:
все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
О. М. Драпкина
Россия
Оксана Михайловна Драпкина — академик РАН, доктор медицинских наук, профессор, директор, заведующий кафедрой терапии и профилактической медицины.
Москва
Конфликт интересов:
все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
Дополнительные файлы
Рецензия
Для цитирования:
Джиоева О.Н., Максимова О.А., Рогожкина Е.А., Драпкина О.М. Особенности протокола трансторакального эхокардиографического исследования у пациентов с ожирением. Российский кардиологический журнал. 2022;27(12):5243. https://doi.org/10.15829/1560-4071-2022-5243
For citation:
Dzhioeva O.N., Maksimova O.A., Rogozhkina E.A., Drapkina O.M. Aspects of transthoracic echocardiography protocol in obese patients. Russian Journal of Cardiology. 2022;27(12):5243. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5243
JATS XML

















































