Перейти к:
Прогностическое значение биомаркеров NT-proBNP и sST2 у больных постинфарктной хронической сердечной недостаточностью, перенесших новую коронавирусную инфекцию
https://doi.org/10.15829/1560-4071-2023-5216
EDN: UAHDAW
Аннотация
Цель. Определить прогностическое значение содержания в крови биомаркеров N-концевого промозгового натрийуретического пептида (NT-proBNP) и стимулирующего фактора роста ST2 (sST2) у больных постинфарктной сердечной недостаточностью на фоне новой коронавирусной инфекции (COVID-19).
Материал и методы. Были сформированы 3 группы: у пациентов I группы (основной), которые проходили стационарное лечение по поводу COVID-19, причиной хронической сердечной недостаточности (ХСН) был перенесенный в прошлом Q-инфаркт миокарда; у больных II группы (сравнения), которые не переносили ранее и в момент настоящей госпитализации COVID-19, причиной ХСН также был перенесенный в прошлом Q-инфаркт миокарда; III группа (сравнения) — пациенты с ХСН ишемической этиологии без постинфарктного кардиосклероза и не инфицированные ранее и на момент обследования SARS-CoV-2. Статистическая обработка осуществлялась с помощью пакета программ "IBM SPSS v. 26.0".
Результаты. Пациенты всех трех групп, включенных в настоящее исследование, были сопоставимы между собой. Через 6 мес. в I группе регистрировалось ухудшение клинического течения ХСН. У пациентов I и II группы к 6 мес. наблюдения зафиксировано снижение функционального класса (ФК) ХСН по NYHA со 2 до 3 и 4 ФК, в отличие от пациентов III группы, среди которых количество больных с 3 ФК ХСН сократилось на 25% вследствие их компенсации до 2 ФК. Пациенты исследуемых групп, у которых в сыворотке крови регистрировалось повышенное содержание NT-proBNP и sST2, имели более выраженные структурно-функциональные нарушения миокарда, чем пациенты с нормальным содержанием данных биомаркеров. В развитии неблагоприятных сердечно-сосудистых событий, таких как повторный инфаркт миокарда, развитие острого нарушения мозгового кровообращения, госпитализация в связи с ухудшением течения ишемической болезни сердца, декомпенсация сердечной недостаточности, потребовавшая госпитализации пациента, разработана прогностическая модель с помощью нейронной сети. Наибольшей важностью в структуре разработанной модели преобладали: возраст пациента, уровень NT-proBNP и sST2, а также уровень поражения легких по данным компьютерной томографии.
Заключение. Современные биомаркеры NT-proBNP и sST2 обладают достаточной прогностической ценностью для определения риска развития неблагоприятных событий при ХСН.
Ключевые слова
Для цитирования:
Калашникова Н.М., Зайцев Д.Н., Говорин А.В., Чистякова М.В., Бальжитов Б.Т. Прогностическое значение биомаркеров NT-proBNP и sST2 у больных постинфарктной хронической сердечной недостаточностью, перенесших новую коронавирусную инфекцию. Российский кардиологический журнал. 2023;28(6):5216. https://doi.org/10.15829/1560-4071-2023-5216. EDN: UAHDAW
For citation:
Kalashnikova N.M., Zaitsev D.N., Govorin A.V., Chistyakova M.V., Balzhitov B.T. Prognostic significance of NT-proBNP and sST2 biomarkers in patients with post-myocardial infarction heart failure after a coronavirus infection. Russian Journal of Cardiology. 2023;28(6):5216. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5216. EDN: UAHDAW
Хроническая сердечная недостаточность (ХСН) — одна из частых причин госпитализаций, инвалидизации и смертности, особенно, у перенесших острый инфаркт миокарда (ИМ) больных. В период пандемии новой коронавирусной инфекции (COVID-19) сердечно-сосудистые осложнения явились основной причиной летальности среди пациентов с COVID-19. ХСН имеет высокую распространённость в большинстве стран мира, охватывая >64,3 млн человек, с вероятным нарастанием количества больных в ближайшие годы [1]. Она встречается в среднем у 1-2% населения европейских стран [2][3], 2,5% — в Соединённых Штатах Америки (у лиц старше 18 лет) [4] и у 7-10% в регионах Российской Федерации [5]. В период пандемии COVID-19 сердечно-сосудистые осложнения явились основной причиной летальности среди пациентов с COVID-19 [6][7].
Учитывая высокую смертность больных с сердечно-сосудистыми заболеваниями во время пандемии COVID-19, становится важным выявление лиц с высоким риском неблагоприятных исходов среди этой категории пациентов. Возможность такого прогнозирования можно достичь с помощью изучения в сыворотке крови биомаркеров, которые отражают структурные и функциональные изменения сердечно-сосудистой системы и используются в качестве методов ранней диагностики сердечно-сосудистых событий (ССС) [8]. В настоящее время в клинической практике таким ранним биомаркером ХСН является мозговой натрийуретический пептид, который может использоваться при диагностике бессимптомной дисфункции сердца. Однако содержание данного маркера обладает вариабельностью и зависит от гендерной принадлежности, возраста пациента, наличия заболевания почек и некоторых инфекционных заболеваний. В связи с этим представляется актуальным поиск новых биомаркеров ХСН, способных нивелировать недостатки таких лабораторных маркеров сердечной недостаточности (СН) [2][9].
Стимулирующий фактор роста ST2 (sST2) является представителем семейства Toll-like рецепторов интерлейкин (ИЛ)-1 и имеет две изоформы: трансмембранная форма ST2L, связывается с ИЛ-33, образует комплекс ИЛ-33/ST2L, который имеет кардиопротективное действие и препятствует формированию гипертрофии миокарда, предупреждая его фиброз. В свою очередь, sST2-растворимая форма обладает противоположными эффектами: приводит к гипертрофии и фиброзу миокарда, расширению камер сердца и снижению сократительной способности сердечной мышцы левого желудочка (ЛЖ). sST2 представляет собой клинически значимый биомаркер, отражающий патофизиологические процессы в сердце и обладающий прогностической ценностью при формировании СН [10][11]. Он может рассматриваться как предиктор неблагоприятного прогноза при СН, имея также диагностическое значение как маркер воспаления [12][13]. При совместном определении в крови больных содержания sST2 и натрийуретических пептидов диагностическая и прогностическая значимость этих маркеров может значительно возрастать при формировании ХСН у пациентов, перенесших ИМ.
Цель исследования: определить прогностическое значение содержания в крови биомаркеров N-концевого промозгового натрийуретического пептида (NT-proBNP) и sST2 у больных постинфарктной СН на фоне COVID-19 в развитии неблагоприятных ССС (повторный ИМ, развитие острого нарушения мозгового кровообращения (ОНМК), госпитализация в связи с ухудшением течения ишемической болезни сердца (ИБС), декомпенсация СН, потребовавшая госпитализации пациента).
Материал и методы
В исследование включено 80 пациентов с ХСН, находившихся на лечении в моностационаре Городской клинической больницы № 1 и кардиологическом отделении Краевой клинической больницы. Были сформированы 3 группы: у пациентов I группы (основной), которые проходили стационарное лечение по поводу COVID-19, причиной ХСН был перенесенный в прошлом Q-ИМ (n=40, 50%); у больных II группы (сравнения), которые не переносили ранее и в момент настоящей госпитализации COVID-19, причиной ХСН был перенесенный в прошлом Q-ИМ (n=20, 25%); III группу (сравнения) составили пациенты с ХСН ишемической этиологии без постинфарктного кардиосклероза и не инфицированные ранее и на момент обследования SARS-CoV-2 (n=20, 25%). Основной диагноз был верифицирован на основании признаков постинфарктного кардиосклероза на электрокардиограмме (патологический зубец Q/QS), наличия зон нарушения локальной гипо-, акинезии при эхокардиографии, либо окклюзии ветвей коронарных артерий при проведении коронароангиографии, в сочетании с анамнезом перенесенного ИМ. Оценка функционального класса (ФК) ХСН проводилась с помощью теста с шестиминутной ходьбой. Для выявления возбудителя COVID-19 SARS-CoV-2 использовался материал, полученный при заборе мазка из носоглотки (из двух носовых ходов) и ротоглотки. Этиологическая диагностика COVID-19 проводилась с применением полимеразной цепной реакции методом амплификации нуклеиновых кислот.
После выписки из стационара пациенты наблюдались амбулаторно с обязательным визитом на 180-й день, на котором оценивались клинические симптомы и ФК ХСН. Эхокардиографическое исследование проводилось на аппарате "VividE 95-expert GE" по стандартной методике. В сыворотке крови определялось содержание биомаркеров sST2 и NT-proBNP (исходно в стационаре и через 12 мес.) методом иммуноферментного анализа (ELISA). Через 12 мес. после включения пациентов в исследование устанавливалось наличие/отсутствие неблагоприятных ССС (ухудшение течения ХСН, повторные госпитализации по поводу декомпенсации СН, повторный ИМ, ОНМК, смерть).
Критериями невключения в исследовании считались: острый коронарный синдром давностью <3 мес.; инсульт или транзиторная ишемическая атака в анамнезе давностью <3 мес.; другие, кроме ИБС, причины ХСН; онкологические и другие заболевания в активной стадии; деменция и психические заболевания, препятствующие подписанию информированного согласия пациентом.
Исследование было выполнено в соответствии со стандартами надлежащей клинической практики и принципами Хельсинкской декларации. Протокол исследования был одобрен Этическим комитетом. До включения в исследование у всех участников было получено письменное информированное согласие. Статистическая обработка результатов исследования осуществлялась с помощью пакета программ "IBM SPSS Statistics 26.0" (США). Количественные показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Колмогорова-Смирнова. Количественные показатели, имеющие нормальное распределение, описывались с помощью средних арифметических величин (M) и стандартных отклонений (SD), границ 95% доверительного интервала (ДИ). В случае отсутствия нормального распределения количественные данные описывались с помощью медианы (Me), нижнего и верхнего квартилей (Q1-Q3). Категориальные данные описывались с указанием абсолютных значений и процентных долей. Для сравнения 3 и более групп использовался ранговый анализ вариации Краскела-Уоллиса. Сравнение двух групп по количественному показателю, распределение которого отличалось от нормального, выполнялось с помощью U-критерия Манна-Уитни. Сравнение процентных долей при анализе четырехпольных таблиц сопряженности выполнялось с помощью критерия χ2 Пирсона (при значениях ожидаемого явления >10), точного критерия Фишера (при значениях ожидаемого явления <10). Сравнение процентных долей при анализе многопольных таблиц сопряженности выполнялось с помощью критерия χ2 Пирсона. При сравнении количественных показателей, распределение которых отличалось от нормального в двух связанных группах, использовался критерий Уилкоксона. Статистическая значимость (p) оценивалась исходя из значений 95% ДИ. Наиболее значимые параметры включены в тестовую базу данных, которая легла в основу обучения многослойного персептрона. Диагностическая ценность прогностических моделей, основанных на нейросетевом анализе, определялась путем применения ROC-анализа.
Результаты
Характеристика пациентов представлена в таблице 1. Пациенты всех трех групп, включенных в настоящее исследование, были сопоставимы по возрасту, полу, употреблению алкоголя, наличию таких сопутствующих хронических заболеваний, как сахарный диабет, подагра, хроническая обструктивная болезнь легких, бронхиальная астма, артериальная гипертензия и стенокардия. При этом подавляющая часть пациентов всех групп имели избыточную массу тела, либо ожирение различной степени, которое, как известно, является модифицируемым фактором риска развития ИБС с ХСН, а также более тяжелого течения COVID-19. При анализе картины компьютерной томографии (КТ) у пациентов I группы, находящихся на лечении по поводу COVID-19, установлено, что признаки вирусной пневмонии были у всех больных: КТ1 — у 8 пациентов (20%), КТ2 — у 13 больных (32,5%), КТ3 — у 13 (32,5%), КТ4 — у 6 (15%) больных.
Коронароангиография в анамнезе была проведена у 13 больных (32,5%) I группы, во II группе — у 17 (85%) и в III группе — у 11 (55%) пациентов. Оценивая клинические симптомы ХСН у пациентов исследуемых групп в стационаре и в динамике (через 6 мес.), установлено, что в I группе регистрировалось ухудшение клинического течения ХСН, сопровождающееся снижением толерантности к физической нагрузке. Так, увеличилась выраженность одышки при обычной физической нагрузке и при ходьбе по ровной поверхности. У пациентов I и II группы к 6 мес. наблюдения зафиксировано увеличение ФК ХСН по NYHA со 2 до 3 и 4 ФК, в отличие от пациентов III группы, среди которых количество больных с 3 ФК ХСН сократилось на 25% вследствие их компенсации до 2 ФК. У пациентов I и II группы был значительно снижен уровень физической активности и увеличена частота сердечных сокращений в покое, по сравнению с пациентами без постинфарктного кардиосклероза.
Была проанализирована терапия пациентов с ХСН при поступлении и спустя 6 мес. от момента включения их в исследование. Пациентам I группы в стационаре значительно реже назначались ингибиторы ангиотензинпревращающего фермента (иАПФ) — в 37,5% случаев и антагонисты рецепторов ангиотензина II — в 7,5% случаев (суммарно 45%); а во II и III группе данные препараты назначены практически всем пациентам. Через 6 мес. в III группе отмечается снижение частоты приема иАПФ на 35% (p=0,008), при этом в I группе, напротив, увеличилась частота приема иАПФ/антагонистов рецепторов ангиотензина II (p=0,166 и p=0,011), что связано с низкой частотой назначения данных препаратов пациентам исходно во время их госпитализации по поводу COVID-19, с постепенным возвращением к прежнему режиму терапии после выписки из моностационара. Пациенты с COVID-19 и постинфарктной ХСН в стационаре принимали бета-блокаторы значительно реже (в 7,5% случаев), по сравнению с больными без COVID-19 (100%) и постинфарктного кардиосклероза (в 95% случаев). Через 6 мес. частота приема данной группы препаратов в I группе увеличилась на 30%, а в III группе, наоборот, снизилась в 1,3 раза. Частота назначения петлевых диуретиков и антагонистов минералокортикоидных рецепторов различалась у пациентов всех исследуемых групп, хотя, необходимо отметить, что показания к данной группе были практически у всех больных. В динамике частота назначения данных препаратов на амбулаторном этапе значимо не отличалась (табл. 2).
В соответствии с современными клиническими рекомендациями по ведению и лечению пациентов с ХСН всем больным с предполагаемым диагнозом ХСН рекомендовано исследование уровня мозгового натрийуретического пептида и NT-proBNP в крови.
Нами установлено, что у больных I и II группы содержание NT-proBNP исходно достигало значений 227,3 [ 205-247,3] нг/мл и 233 [ 196-262], что в 2 раза превышало его уровень у пациентов III группы (p<0,001). Через 12 мес. уровень NT-proBNP в I и II группах значительно уменьшился (p<0,001). Так, у пациентов I и II содержание NT-proBNP снизилось в 1,2 раза и в 1,4 раза от исходного, соответственно. Содержание NT-proBNP у больных I и II группы было статистически значимо выше, чем у лиц III группы (p<0,001). В III группе концентрация данного маркера в динамике увеличилась в 1,1 раза. Следует отметить, что исходно более высокая концентрация NT-proBNP зафиксирована у пациентов с постинфарктным кардиосклерозом и COVID-19, что связано не только с непосредственным кардиальным повреждением, но и наличием у данной группы респираторной гипоксии вследствие легочной инфильтрации (табл. 3).
Исходный уровень sST2 у пациентов I группы был более, чем в 1,2 раза выше, по сравнению с больными II и III групп (p<0,001). Через 12 мес. в динамике его содержание в сыворотке крови уменьшилось в 1,4 раза у лиц всех групп (p<0,001). При этом у пациентов всех трех групп его значение не превысило 35 нг/мл. Повышение sST2 у пациентов I группы свидетельствует о вовлечении данного маркера не только в механизмы повреждения и ремоделирования миокарда, но и в процессы клеточной пролиферации, воспаления и аутоиммунные реакции, которые развиваются у пациентов с постинфарктным кардиосклерозом на фоне COVID-19.
Известно, что увеличение содержания NT-proBNP отражает тяжесть ремоделирования миокарда предсердий и желудочков, свидетельствуя о наличии скрытой или клинически значимой ХСН.
Пациенты всех трех групп, у которых в сыворотке крови регистрировалось повышенное содержание NT-proBNP и sST2, имели более выраженные структурно-функциональные нарушения миокарда, чем пациенты с нормальным содержанием данных биомаркеров (табл. 4).
Систолическая функция ЛЖ определялась по величине фракции выброса (ФВ); ФВ <40% встречалась у пациентов с повышенным содержанием NT-proBNP и sST2 — 3,0% и 5,0%, соответственно. У пациентов с повышенным содержанием NT-proBNP ≥125 пг/мл и sST2 >35 нг/мл медианные значения конечного диастолического объёма (КДО) были выше в 1,4 и 1,1 раза, соответственно, медианные значения конечного систолического объёма (КСО) были выше в 1,5 и 1,1 раза, соответственно. При изучении нарушения диастолической дисфункции ЛЖ среди обследованных пациентов у наибольшего числа лиц наблюдалась диастолическая дисфункция ЛЖ по гипертрофическому типу с повышенным содержанием биомаркеров. Объем левого предсердия (ЛП), несмотря на отсутствие статистической значимости изменений, имеет тенденцию к увеличению у пациентов с повышенным содержанием биомаркеров. Объем ЛП был в 3 раза выше у пациентов с повышенным содержанием NT-proBNP и sST2.
При проведении корреляционного анализа установлена взаимосвязь между концентрацией sST2 и некоторыми структурно-функциональными параметрами предсердий и желудочков: умеренная положительная связь с систолическим давлением в легочной артерии (r=0,360, р=0,001), слабая положительная — с объемом ЛП (r=0,229, р=0,041), КДО ЛЖ (r=0,257, p=0,021), КСО ЛЖ (r=0,223, p=0,047). Также установлена взаимосвязь между содержанием NT-proBNP с некоторыми структурно-функциональными параметрами ЛЖ: умеренная положительная — c объемом полости ЛЖ (КДО, r=0,420, p<0,001; КСО, r=0,331, p=0,003); положительная связь с систолическим давлением в легочной артерии (r=0,260, р=0,020); отрицательная связь с ФВ ЛЖ (r=-0,242, p=0,031). Все выявленные взаимосвязи имели заметную тесноту связи по шкале Чеддока. Таким образом, установлено, что концентрация NT-proBNP и sST2 имеет сопоставимый характер и силу корреляционных взаимосвязей с некоторыми структурными и функциональными параметрами сердца.
У пациентов с повышенным содержанием NT-proBNP ≥125 пг/мл установлена положительная корреляционная связь средней силы между уровнем данного биомаркера и sST2 (r=0,36, p=0,002).
Известно, что средняя нормальная концентрация sST2 составляет 18 нг/мл, а показатель >35 нг/мл свидетельствует о повышенном риске развития ССС. Верхняя граница нормы маркера NT-proBNP для пациентов с компенсацией ХСН составляет 125 пг/мл. Данные диагностические значения применяются при ХСН с сохранённой, слегка сниженной и сниженной ФВ. Все пациенты исследуемых групп (основной и двух групп сравнения) были разделены на группы в зависимости от концентрации изучаемых биомаркеров. У пациентов с повышенным содержанием NT-proBNP ≥125 пг/мл на третьем визите (контрольный звонок) за 12 мес. наблюдения были зарегистрированы следующие ССС: повторный ИМ — у 1 пациента (1,4%), ОНМК — у 1 (1,4%), госпитализация в связи с ухудшением течения ИБС — у 9 (12,3%) и декомпенсация СН — 8 пациентов (11%).
У лиц с повышенным содержанием sST2 >35 нг/мл на третьем визите за 12 мес. наблюдения зарегистрированы следующие ССС: повторный ИМ — у 1 пациента (2,7%), ОНМК — у 1 (2,7%), госпитализация в связи с ухудшением течения ИБС — у 8 (21,6%) и декомпенсация СН — 7 пациентов (18,9%).
Учитывая тот факт, что в группе c повышенной концентрацией NT-proBNP и sST2 частота перенесенного ИМ в анамнезе была значительно выше, чем в группе с нормальным уровнем изучаемых биомаркеров (NT-proBNP: χ2=15,08, df=1, p=0,001; sST2: χ2=14,09, df=1, p<0,001), было оценено прогностическое значение данных биомаркеров в развитии неблагоприятных ССС у пациентов с перенесенным в анамнезе ИМ.
Технология прогнозирования неблагоприятных ССС в течение года реализована на базе многослойного персептрона, процент неверных предсказаний в процессе которого составил 1,3%. Исходя из значений нормализованной важности исследуемых показателей, в структуру обучаемой нейронной сети были включены 17 входных нейронов, нейронная сеть содержала один скрытый слой, состоящий из трёх функциональных и двух выходных нейронов. Исходя из значения предсказанной псевдовероятности полученная нейросеть не испытывает затруднений в прогнозировании развития неблагоприятного ССС в течение года от момента обследования (рис. 1).
Высокая информативность разработанной модели подтверждается результатами ROC-анализа: чувствительность и специфичность равны 0,96 (AUC=0,98 (95% ДИ: 0,96-0,99), p<0,001) (рис. 2).
Таблица 1
Сравнительная характеристика пациентов с ХСН
|
Параметры |
Первая группа (n=40) |
Вторая группа (n=20) |
Третья группа (n=20) |
Тестовая статистика* |
|
|
Возраст, лет |
64,8±8,58 |
64,55±9,5 |
66,05±5,52 |
H=0,34 df=2 p=0,85 |
|
|
Пол |
Мужской |
67,5/27 |
50/10 |
50/10 |
χ2=2,53 df=2 p=0,15 |
|
Женский |
32,5/13 |
50/10 |
50/10 |
||
|
Степень ожирения |
Норма |
17,5% 7/40 |
30% 6/20 |
25% 5/20 |
χ2=3,92 df=8 p=0,86 |
|
Избыточная масса тела |
42,5% 17/40 |
35% 7/20 |
50% 10/20 |
||
|
1 степень |
32,5% 13/40 |
25% 5/20 |
25% 5/20 |
||
|
2 степень |
2,5% 1/40 |
5% 1/20 |
0% 0/20 |
||
|
3 степень |
5% 2/40 |
5% 1/20 |
0% 0/20 |
||
|
Сахарный диабет |
27,5% 11/40 |
25% 5/20 |
20% 4/20 |
χ2=0,4 df=2 p=0,82 |
|
|
Хроническая обструктивная болезнь легких |
15% 6/40 |
0% 0/20 |
0% 0/20 |
χ2=6,49 df=2 p=0,04 φ=0,285 V=0,285 |
|
|
Ишемический инсульт |
10% 4/40 |
0% 0/20 |
0% 0/20 |
χ2=4,21 df=2 p=0,12 |
|
|
Атеросклеротическое поражение периферических артерий |
2,5% 1/40 |
0% 0/20 |
0% 0/20 |
χ2=1,01 df=2 p=0,603 |
|
|
Инсульт неуточненной формы |
2,5% 1/40 |
0% 0/20 |
0% 0/20 |
χ2=1,01 df=2 p=0,603 |
|
|
Дисциркуляторная энцефалопатия |
5% 2/40 |
0% 0/20 |
2,5% 2/20 |
χ2=2,051 df=2 p=0,359 |
|
Примечание: * — различия показателей статистически значимы (p<0,017).
Таблица 2
Лекарственная терапия ХСН в исследуемых группах
|
Группа лекарственных препаратов |
Группа |
Этапы наблюдения |
Тестовая статистика |
|
|
При поступлении |
После выписки (через 6 мес.) |
|||
|
Ингибиторы ангиотензинпревращающего фермента |
I (n=40) |
37,5% (15/40) |
50% (20/40) |
0,166 |
|
II (n=20) |
95% (19/20) |
100% (20/20) |
0,317 |
|
|
III (n=20) |
85% (17/20) |
50% (10/20) |
0,008* |
|
|
p |
<0,001* pI группа — II группа<0,001 pII группа — III группа<0,001 |
<0,001* pI группа — II группа<0,001 pI группа — III группа=0,001 |
– |
|
|
Блокаторы рецепторов ангиотензина II |
I (n=40) |
7,5% (3/40) |
27,5% (11/40) |
0,011* |
|
II (n=20) |
5% (1/20) |
5% (1/20) |
0,317 |
|
|
III (n=20) |
10% (2/20) |
25% (5/20) |
0,18 |
|
|
p |
0,035* pI группа — II группа=0,028 pII группа — III группа=0,034 |
0,835 |
– |
|
|
Бета-блокаторы |
I (n=40) |
52,5% (21/40) |
82,5% (33/40) |
0,005* |
|
II (n=20) |
100% (20/20) |
100% (20/20) |
– |
|
|
III (n=20) |
95% (19/20) |
75% (15/20) |
0,102 |
|
|
p |
0,071 |
<0,001* pI группа — II группа<0,001 pI группа — III группа=0,002 |
– |
|
|
Петлевые диуретики |
I (n=40) |
7,5% (3/40) |
10% (4/40) |
0,655 |
|
II (n=20) |
15% (3/20) |
3% (6/20) |
0,083 |
|
|
III (n=20) |
10% (2/20) |
10% (2/20) |
1,0 |
|
|
p |
0,095 |
0,659 |
– |
|
|
Антагонисты альдостерона |
I (n=40) |
20% (8/40) |
25% (10/40) |
0,414 |
|
II (n=20) |
25% (5/20) |
25% (5/20) |
1,0 |
|
|
III (n=20) |
20% (4/20) |
1% (2/20) |
0,157 |
|
|
p |
0,365 |
0,894 |
– |
|
|
Диуретики тиазидоподобные |
I (n=40) |
15% (6/40) |
20% (8/40) |
0,414 |
|
II (n=20) |
5% (1/20) |
5% (1/20) |
1,0 |
|
|
III (n=20) |
20% (4/20) |
20% (4/20) |
1,0 |
|
|
p |
0,289 |
0,367 |
– |
|
Таблица 3
Содержание NT-proBNP и sST2 в сыворотке крови пациентов с ХСН
|
Исследуемые группы |
Первая группа (n=40) |
Вторая группа (n=20) |
Третья группа (n=20) |
p |
|
NT-proBNP (пг/мл) Me [Q1-Q3] |
227,3 [ 205-247,3] |
233 [ 196-262] |
128 [ 124-148] |
H=38,5 df=2 p<0,001* pII группа — I группа<0,001 pI группа — III группа<0,001 |
|
NT-proBNP (пг/мл) через 12 мес. Me [Q1-Q3] |
185,0 [ 175-196] |
167 [ 153-182] |
144 [ 128-160] |
H=16,3 df=2 p<0,013* pIII группа — I группа=0,012 |
|
p |
<0,001* |
<0,001* |
0,475 |
– |
|
sST2 (нг/мл) Me [Q1-Q3] |
37 [ 32,9-45] |
34 [ 32-42] |
31 [ 29-34] |
H=16,9 df=2 p<0,001* pII группа — III группа=0,014 pI группа — III группа<0,001 |
|
sST2 (нг/мл) через 12 мес. Me [Q1-Q3] |
30 [ 21-36] |
29 [ 19-37] |
25 [ 17-35] |
H=3,4 df=2 p=0,476 |
|
p |
<0,001* |
<0,001* |
<0,017* |
– |
Примечание: * — различия показателей статистически значимы (p<0,05).
Сокращения: NT-proBNP — N-концевой промозговой натрийуретический пептид, sST2 — стимулирующий фактор роста ST2.
Таблица 4
Структурно-функциональные параметры миокарда у пациентов с ХСН в зависимости от содержания в сыворотке крови NT-proBNP и sST2
|
Параметры |
Концентрация NT-proBNP, пг/мл |
Тестовая статистика |
Концентрация sST2, нг/мл |
Тестовая статистика |
|||
|
<125 пг/мл, n=7 |
≥125 пг/мл, n=73 |
<35 нг/мл, n=43 |
>35 нг/мл, n=37 |
||||
|
КДР ЛП по длинной оси, мм |
40 [ 35-45] |
43 [ 38-47] |
U=205 Z=-0,861 p=0,389 |
41 [ 36-45] |
44 [ 40-48] |
U=563,0 Z=-2,248 p=0,025* |
|
|
Увеличение объема ЛП (>52 мл) |
0% 0/7 |
9,6% 7/73 |
F=1,0 p=1,0 |
4,7% 2/43 |
13,5% 5/37 |
F=0,2 p=0,24 |
|
|
КДР ПЖ, мм |
25 [ 23-27] |
28 [ 25-31] |
U=145,5 Z=-1,879 p=0,06 |
28 [ 26-30] |
26 [ 24-32] |
U=697,5 Z=-0,949 p=0,343 |
|
|
Толщина МЖП в диастолу, мм |
12 [ 12-13,5] |
12 [ 11-13] |
U=188 Z=-1,177 p=0,239 |
12 [ 11-13] |
12 [ 11-12] |
U=639,0 Z=-1,547 p=0,122 |
|
|
Гипертрофия МЖП, % |
100% 7/7 |
83,6% 61/73 |
F=0,6 p=0,59 |
88,4% 38/43 |
81,1% 30/37 |
F=0,5 p=0,53 |
|
|
Масса миокарда ЛЖ, г |
256 [ 185,5-309] |
227 [ 187-263] |
U=217 Z=-0,656 p=0,512 |
219 [ 166,5-280,5] |
227 [ 194-249] |
U=775 Z=-0,198 p=0,843 |
|
|
Индекс массы миокарда ЛЖ, г/м2 |
122 [ 104-157] |
116 [ 99-137] |
U=215,5 Z=-0,681 p=0,496 |
116 [ 88-144] |
120 [ 104-134] |
U=776 Z=-0,294 p=0,768 |
|
|
Толщина ЗС ЛЖ в диастолу, мм |
11 [ 10-12,5] |
11 [ 10-12] |
U=249 Z=-0,104 p=0,917 |
11 [ 10-12] |
11 [ 10-12] |
U=716,0 Z=-0,784 p=0,433 |
|
|
Гипертрофия толщины ЗС ЛЖ, % |
28,6% 2/7 |
34,2% 25/73 |
F=1,0 p>0,05 |
34,9% 15/43 |
32,4% 12/37 |
χ2=0,053 df=1 p=0,817 |
|
|
КДО ЛЖ, мл |
93 [ 85,5-129,5] |
131 [ 113-145] |
U=155,5 Z=-1,703 p=0,089 |
120 [ 91,5-138] |
136 [ 123-153] |
U=464,0 Z=-3,2 p=0,001* |
|
|
Увеличение КДО, % |
0% 0/7 |
17,8% 13/73 |
F=0,6 p=0,59 |
7% 3/43 |
27% 10/37 |
F=0,03 p=0,03* |
|
|
КСО ЛЖ, мл |
35 [ 22-56] |
53 [ 39-64] |
U=173,5 Z=-1,397 p=0,163 |
48 [ 31-59] |
54 [ 45-73] |
U=546,5 Z=-2,403 p=0,016* |
|
|
Увеличение КСО, % |
28,6% 2/7 |
45,2% 33/73 |
F=0,5 p=0,46 |
39,5% 17/43 |
48,6% 18/37 |
χ2=0,671 df=1 p=0,413 |
|
|
Сохраненная ФВ ЛЖ (>50%) |
85,7% 6/7 |
78,1% 57/73 |
χ2=0,321 df=2 p=0,852 |
86% 37/43 |
70,3% 28/37 |
χ2=4,094 df=2 p=0,129 |
|
|
Умеренно-сниженная ФВ ЛЖ (40-49%) |
14,3% 1/7 |
19,2% 14/73 |
14% 6/43 |
24,3% 12/37 |
|||
|
Сниженная ФВ ЛЖ (<40%) |
0% 0/7 |
2,7% 2/73 |
0% 1/43 |
5,4% 2/37 |
|||
|
Тип диастолической дисфункции ЛЖ |
Нормальная |
14,3% 1/7 |
4,1% 3/73 |
F=0,1 p=0,31 |
7% 3/43 |
2,7% 1/37 |
F=0,6 p=0,62 |
|
Нарушенная |
85,8% 6/7 |
95,9% 70/73 |
93,1% 40/43 |
97,4% 36/37 |
|||
|
СДЛА, мм рт.ст. |
28 [ 28-35,5] |
40 [ 31-45] |
U=106,5 Z=-2,542 p=0,011 |
34 [ 30-39] |
42 [ 36-46] |
U=412,5 Z=-3,704 p<0,001* |
|
|
Повышенный показатель СДЛА, мм рт.ст. (>35 мм рт.ст.) |
29% 2/7 |
56% 42/73 |
F=0,3 p=0,23 |
37,2% 16/43 |
75,7% 28/37 |
χ2=11,89 df=1 p=0,001* |
|
Примечание: * — различия показателей статистически значимы (p<0,05).
Сокращения: ЗС — задняя стенка, КДО — конечный диастолический объём, КДР — конечный диастолический размер, КСО — конечный систолический объём, ЛЖ — левый желудочек, ЛП — левое предсердие, МЖП — межжелудочковая перегородка, ПЖ — правый желудочек, СДЛА — систолическое давление легочной артерии, ФВ — фракция выброса, NT-proBNP — N-концевой промозговой натрийуретический пептид, sST2 — стимулирующий фактор роста ST2.
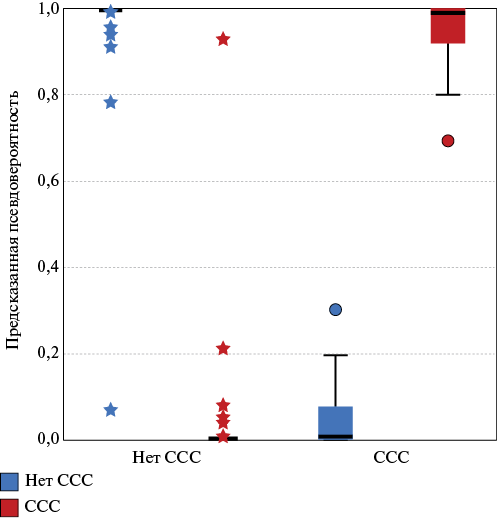
Рис. 1. Оценка предсказанной псевдовероятности развития неблагоприятного ССС в течение года от момента обследования (р<0,001).
Сокращение: ССС — сердечно-сосудистое событие.
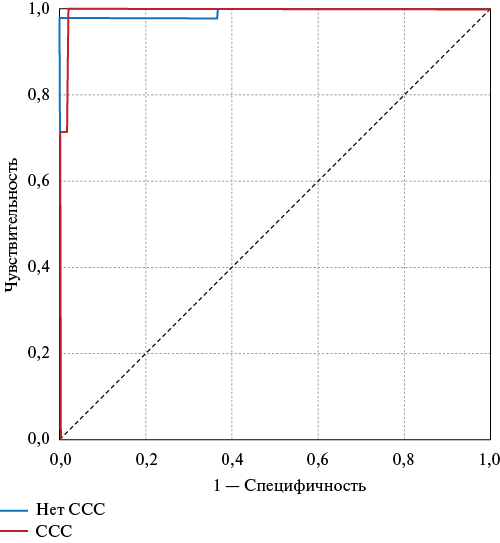
Рис. 2. Оценка информативности нейронной сети, позволяющей прогнозировать развития неблагоприятного ССС в течение года от момента обследования.
Сокращение: ССС — сердечно-сосудистое событие.
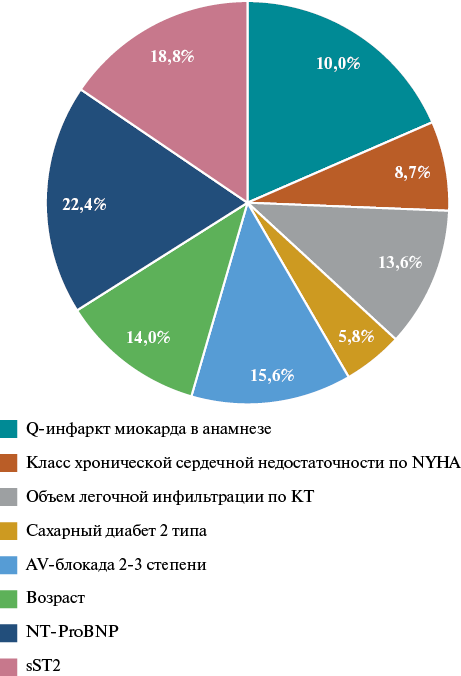
Рис. 3. Структура прогностической модели.
Сокращения: КТ — компьютерная томография, AV — атриовентрикулярный, NT-proBNP — N-концевой промозговой натрийуретический пептид, sST2 — стимулирующий фактор роста ST2.
Обсуждение
Во многих клинических исследованиях прослеживается взаимосвязь между COVID-19 и развитием у пациентов с уже имеющейся СН таких неблагоприятных ССС, как госпитализации и летальные исходы [14]. Пациенты с СН представляют собой когорту пациентов с высоким риском неблагоприятных исходов при COVID-19. По данным исследований, утяжеление симптомов СН у пациентов с COVID-19 связано в т.ч. с респираторной гипоксией и легочной гипертензией, обусловленной массивной инфильтрацией легочной ткани [15][16]. В исследовании Alvarez-Garcia J, et al. [17] были продемонстрированы результаты наблюдения пациентов с ХСН после перенесенной COVID-19, где 30-дневная смертность среди больных ХСН составила 40,0%, через 180 дней смертность достигла 48,7%.
Наступление неблагоприятных ССС в нашем исследовании зафиксировано с большей частотой среди пациентов с повышенным содержанием биомаркеров NT-proBNP и sST2. Всего количество неблагоприятных ССС составило 33%. Исходные концентрации sST2, которые превышали пороговое значение 35 нг/мл, были ассоциированы с увеличением частоты неблагоприятных ССС у пациентов с ХСН и перенесенным ИМ. Растворимый компонент sST2 действует как рецептор-ловушка для ИЛ-33, что приводит к гибели кардиомиоцитов, фиброзу и ремоделированию желудочков. По данным многочисленных исследований sST2 не является признанным диагностическим маркером СН, при этом наибольшую ценность имеет определение концентраций sST2 у больных с ХСН для прогнозирования и стратификации риска развития неблагоприятных ССС. Преимущество sST2 как прогностического маркера было подтверждено в метаанализе Aimo A, et al. [18], где было проанализировано 7 исследований, включающих больных с ХСН. В результате было показано, что биомаркер sST2 продемонстрировал высокую прогностическую точность в оценке риска смерти от ССС. В условиях пандемии sST2 был рассмотрен как маркер воспаления и некоторыми авторами был предложен в качестве прогностического биомаркера в развитии неблагоприятных исходов при COVID-19. По результатам нашего исследования sST2 имеет прогностическую ценность у пациентов с постинфарктной СН.
В ходе исследования на базе многослойного персептрона была построена функциональная модель, позволяющая спрогнозировать развитие неблагоприятного ССС. В структуру модели вошли такие показатели, как пол, возраст, ФК ХСН, наличие в анамнезе перенесённого ИМ, а также уровень биомаркеров NT-proBNP и sST2. Также в структуру модели был внесен показатель — объем легочной инфильтрации. С патофизиологической точки зрения включение в структуру нейросети объема поражения легочной ткани у пациентов с коронавирусной инфекцией может быть связано с непосредственным воздействием вируса SARS-CoV-2 на эндотелий, клетки сосудистой стенки и миокарда, что приводит к острому повреждению кардиомиоцитов, а также утяжелению уже имеющихся ССС и декомпенсации СН. Острое миокардиальное повреждение проявляется повышением уровня кардиоспецифических биомаркеров, что является предиктором развития неблагоприятного ССС. Следовательно, объем поражения легочной ткани у пациентов с COVID-19 может играть индикаторную роль. С помощью данной модели возможно прогнозировать развитие таких неблагоприятных ССС, как обострение ИБС, декомпенсация СН, развитие мозгового инсульта и летальный исход. В качестве функции активации выступал гиперболический тангенс, в выходном слое — Softmax, в качестве функции ошибки — перекрестная энтропия. Наибольшей важностью в структуре разработанной модели обладали: уровень NT-proBNP и sST2 в сыворотке крови, возраст пациента, а также объем поражения легких по данным КТ (рис. 3).
Таким образом, тяжесть течения и неблагоприятные исходы у больных ХСН могут быть обусловлены не только структурной патологией сердца в виде постинфарктного кардиосклероза, но и коморбидной патологией, включая перенесенную COVID-19 через механизмы прямого и опосредованного иммунного воздействия вируса SARS-CoV-2 на миокард. Использование новых биомаркеров СН NT-proBNP и sST2 может служить не только диагностическим тестом, но, в большей степени, определять риск неблагоприятных клинических исходов, что позволяет проводить своевременную адекватную терапию этой категории больных.
Заключение
У пациентов с постинфарктной СН и COVID-19 в ходе динамического наблюдения зарегистрированы более выраженные клинические симптомы ХСН и структурно-функциональные нарушения миокарда по сравнению с больными постинфарктным кардиосклерозом без COVID-19 и лицами с ХСН без COVID-19 и постинфарктного кардиосклероза. Современные биомаркеры NT-proBNP и sST2 обладают достаточной прогностической ценностью для определения риска развития неблагоприятных ССС при ХСН, что способствует реализации персонифицированного подхода к пациентам с постинфарктной СН и позволяет своевременно выбирать более эффективную тактику ведения данной категории пациентов, направленную на улучшение прогноза заболевания.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Groenewegen A, Rutten FH, Mosterd A, et al. Epidemiology of heart failure. Eur J Heart Fail. 2020;22(8):1342-56. doi:10.1002/ejhf.1858.
2. McDonagh TA, Metra M, Adamo M, et al. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. European Heart Journal. 2021;42(36):3599-726. doi:10.1093/eurheartj/ehab368.
3. Benjamin EJ, Muntner P, Alonso A, et al. Heart Disease and Stroke Statistics-2019 Update: A Report From the American Heart Association. Circulation. 2019;139(10):56-528. doi:10.1161/CIR.0000000000000659.
4. Мареев В. Ю., Фомин И. В., Агеев Ф. Т. и др. Клинические рекомендации ОССН-РКО-РНМОТ. Сердечная недостаточность: хроническая (ХСН) и острая декомпенсированная (ОДСН). Диагностика, профилактика и лечение. Кардиология. 2018;58(6S):8-158. doi:10.18087/cardio.2475.
5. Фомин И. В. Хроническая сердечная недостаточность в Российской Федерации: что сегодня мы знаем и что должны делать. Российский кардиологический журнал. 2016;(8):7-13. doi:10.15829/1560-4071-2016-8-7-13.
6. Хроническая сердечная недостаточность. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(11):4083. doi:10.15829/29/1560-4071-2020-4083.
7. Zhou F, Yu T, Du R, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: A retrospective cohort study. Lancet. 2020;395:1054-62. doi:10.1016/S0140-6736(20)30566-3.
8. Хамитова А. Ф., Дождев С. С., Загидуллин Ш. З. Значение сывороточных биомаркеров в прогнозировании развития сердечной недостаточности и смертности. Артериальная гипертензия. 2018;24(1):101-7. doi:10.18705/1607-419X-2018-24-1-101-107.
9. Memon AA, Sundquist K, Pirouzi Fard M, et al. Identification of novel diagnostic biomarkers for deep venous thrombosis. Br.J. Haematol. 2018;181(3):378-85. doi:10.1111/bjh.15206.
10. Wei ZH, Li YY, Huang SQ, et al. Genetic variants in IL-33/ST2 pathway with the susceptibility to hepatocellular carcinoma in a Chinese population. Cytokine. 2019;118:124-9. doi:10.1016/j.cyto.2018.03.036.
11. York MK, Gupta DK, Reynolds CF, et al. B-Type Natriuretic Peptide Levels and Mortality in Patients With and Without Heart Failure. J Am Coll Cardiol. 2018;71(19):2079-88. doi:10.1016/j.jacc.2018.02.071.
12. Miftode RS, Petriș AO, Onofrei AV, et al. The novel perspectives opened by ST2 in the pandemic: a review of its role in the diagnosis and prognosis of patients with heart failure and COVID-19. Diagnostics (Basel). 2021;11(2):175. doi:10.3390/diagnostics11020175.
13. Motloch LJ, Jirak P, Gareeva D, et al. Cardiovascular biomarkers for prediction of in-hospital and 1-year post-discharge mortality in patients with COVID-19 pneumonia. Front. Med (Lausanne). 2022;9:906665. doi:10.3389/fmed.2022.906665.
14. Yonas E, Alwi I, Pranata R, et al. Effect of heart failure on the outcome of COVID-19 A meta analysis and systematic review. Am J Emerg Med. 2021;46:204-11. doi:10.1016/j.ajem.2020.07.009.
15. Huffman MD, Roth GA, Sliwa K, et al. Cardiovascular, respiratory, and related disorders. 3rd ed. Washington: The international bank for reconstruction and development. The World Bank. 2017:173-89. ISBN: 978-1-4648-0519-6.
16. Чистякова М. В., Зайцев Д. Н., Говорин А. В. и др. Морфо-функциональные изменения и нарушения ритма сердца у пациентов с легким и среднетяжелым течением коронавирусной инфекции (COVID-19). ЭНИ Забайкальский медицинский вестник. 2021;(2):76-84. doi:10.52485/19986173_2021_2_76.
17. Alvarez-Garcia J, Lee S, Gupta A, et al. Prognostic impact of prior heart failure in patients hospitalized with COVID-19. J Am Coll Cardiol. 2020;76(20):2334-48. doi:10.1016/j.jacc.2020.09.549.
18. Aimo A, Vergaro G, Passino C, et al. Prognostic value of soluble suppression of tumorigenicity-2 in chronic heart failure. JACC Heart Failure. 2017;5(4):280-6. doi:10.1016/j.jchf.2016.09.010.
Об авторах
Н. М. КалашниковаРоссия
Аспирант кафедры факультетской терапии.
Чита
Конфликт интересов:
нет
Д. Н. Зайцев
Россия
Доктор медицинских наук, доцент, заведующий кафедрой факультетской терапии, ректор.
Чита
Конфликт интересов:
нет
А. В. Говорин
Россия
Профессор, доктор медицинских наук, ведущий специалист по научной работе научного отдела.
Чита
Конфликт интересов:
нет
М. В. Чистякова
Россия
Доктор медицинских наук, доцент кафедры функциональной и ультразвуковой диагностики.
Чита
Конфликт интересов:
нет
Б. Т. Бальжитов
Россия
Врач функциональной и ультразвуковой диагностики.
Чита
Конфликт интересов:
нет
Дополнительные файлы
Рецензия
Для цитирования:
Калашникова Н.М., Зайцев Д.Н., Говорин А.В., Чистякова М.В., Бальжитов Б.Т. Прогностическое значение биомаркеров NT-proBNP и sST2 у больных постинфарктной хронической сердечной недостаточностью, перенесших новую коронавирусную инфекцию. Российский кардиологический журнал. 2023;28(6):5216. https://doi.org/10.15829/1560-4071-2023-5216. EDN: UAHDAW
For citation:
Kalashnikova N.M., Zaitsev D.N., Govorin A.V., Chistyakova M.V., Balzhitov B.T. Prognostic significance of NT-proBNP and sST2 biomarkers in patients with post-myocardial infarction heart failure after a coronavirus infection. Russian Journal of Cardiology. 2023;28(6):5216. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5216. EDN: UAHDAW
JATS XML

















































