Перейти к:
Высокочувствительный тропонин I как предиктор дисфункции левого желудочка при применении кардиотоксичных противоопухолевых препаратов для лечения рака молочной железы у больных с преимущественно низким и промежуточным риском кардиотоксичности
https://doi.org/10.15829/1560-4071-2022-5210
Аннотация
Цель. Изучить значимость мониторинга высокочувствительного тропонина I (hs-сTnI) для прогнозирования антрациклин-индуцированной дисфункции левого желудочка (ЛЖ) при лечении рака молочной железы у пациенток с промежуточным и низким риском кардиотоксичности (Кт).
Материал и методы. В исследовании принимали участие 49 пациенток с раком молочной железы в возрасте 50±10 лет, которым проводилась неоадъювантная или адъювантная химиотерапия (ХТ), включавшая доксорубицин в курсовой дозе 60 мг/м2 и средней кумулятивной дозе 251±60 мг/ м2. Содержание hs-сTnI определяли ультрачувствительным методом до начала ХТ, сразу после каждого цикла антрациклинов (Ац) и у 18 больных также перед введением Ац. Уровень hs-TnI >0,017 нг/мл считали повышенным. Эхокардиография (ЭхоКГ) проводилась до начала ХТ, после окончания Ац и каждые 3 мес. в течение 12 мес. в последующем. Под Кт понимали снижение фракции выброса (ФВ) ЛЖ на ≥10% до <53%/
Результаты. Риск Кт до ХТ оценен как низкий и промежуточный у 96% пациенток. Хотя бы однократное повышение hs-сTnI выявлено у 56,8% больных: до ХТ — у 13,5%, после 1 и 2 курсов Ац — у 13,9%, после 3, 4, 5 и 6 курсов — у 44%, 62%, 71% и 66% пациентов, соответственно. Уровни hs-TnI перед и после введения Ац существенно не различались. Развитие дисфункции ЛЖ наблюдалось у 16,3% пациенток. Прогностическая значимость повышения hs-сTnI на любом сроке ХТ для снижения ФВ ЛЖ составляла: чувствительность — 87,5%, специфичность — 50%, значимость положительного результата — 28%, значимость отрицательного результата — 94,7%. Наиболее тесная связь отмечена между Кт и значением hs-сTnI до начала ХТ (β=0,45, р=0,005) и после 3 курса Aц (β=0,56, р=0,002).
Заключение. Повышение уровня hs-сTnI до и на фоне терапии Ац у пациентов с невысоким риском Кт обладает прогностической значимостью в отношении развития дисфункции ЛЖ. Исследование hs-сTnI целесообразно проводить до начала терапии, и затем начиная с 3 цикла Ац у всех пациентов независимо от риска Кт.
Ключевые слова
Для цитирования:
Лёвина В.Д., Полтавская М.Г., Чомахидзе П.Ш., Мещеряков А.А., Болотина Л.В., Дешкина Т.И., Валиулина Д.С., Герасимов А.Н., Андреева О.В., Шмелёва А.А., Фашафша З., Левшина А.Р., Седов В.П. Высокочувствительный тропонин I как предиктор дисфункции левого желудочка при применении кардиотоксичных противоопухолевых препаратов для лечения рака молочной железы у больных с преимущественно низким и промежуточным риском кардиотоксичности. Российский кардиологический журнал. 2022;27(11):5210. https://doi.org/10.15829/1560-4071-2022-5210
For citation:
Levina V.D., Poltavskaya M.G., Chomakhidze P.Sh., Meshcheryakov A.A., Bolotina L.V., Deshkina T.I., Valiulina D.S., Gerasimov A.N., Andreeva O.V., Shmeleva A.A., Fashafsha Z., Levshina A.R., Sedov V.P. High-sensitivity troponin I as a predictor of left ventricular dysfunction in the use of cardiotoxic anticancer agents for breast cancer in patients with predominantly low and moderate risk of cardiotoxicity. Russian Journal of Cardiology. 2022;27(11):5210. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5210
При лечении рака молочной железы часто применяются кардиотоксичные препараты — в первую очередь антрациклины (Ац) и трастузумаб, которые могут вызывать развитие дисфункции левого желудочка (ЛЖ) и сердечной недостаточности [1][2]. Несмотря на то, что в настоящее время обычно применяются невысокие кумулятивные дозы Ац, распространенность дисфункции ЛЖ по данным метаанализа 2020г составляет 17% [3]. Обычно фракция выброса (ФВ) ЛЖ снижается уже после окончания терапии Ац, что определяет необходимость дополнительных визитов для мониторинга эхокардиографии (ЭхоКГ). Другим недостатком ФВ является ее высокая межысследовательская вариативность [1][4][5].
Наиболее ранним маркером кардиотоксичности (Кт) может быть сердечный тропонин (cTn) I или T, повышение содержания которого в крови свидетельствует о повреждении миокарда и может предсказывать развитие дисфункции ЛЖ с высокой прогностической значимостью отрицательного результата [3][4][6]. Согласно современным рекомендациям, повышение cTn не является основанием для прерывания химиотерапии (ХТ), но указывает на целесообразность более тщательного мониторинга и назначения блокаторов ренинангиотензиновой системы (БРААС) и/ или бета-адреноблокаторов (БАБ) [1][2][6][7]. Вместе с тем анализ на cTn пока не относится к обязательным методам мониторинга Кт. Его прогностическая значимость при применении низких и средних доз Ац не так очевидна, как при применении высоких доз [3][8]. Внедрение высокочувствительных тестсистем значительно увеличивает число тропонинпозитивных пациентов, что отрицательно сказывается на специфичности прогноза [6]. Продолжают обсуждаться показания, оптимальные сроки и кратность исследования. По мнению экспертов, оно полезно в первую очередь при высоком риске Кт [1][6], однако высокий риск, как правило, обусловлен имеющимися сердечно-сосудистыми заболеваниями (ССЗ), либо применением Ац в анамнезе, что само по себе является основанием для назначения кардиопротективной терапии [1][2][9].
Целью исследования являлась оценка значимости мониторинга тропонина I, определяемого высокочувствительным методом (hs-cTnI), на фоне Ац-содержащей терапии рака молочной железы для прогнозирования дисфункции ЛЖ при преимущественно низком и промежуточном риске Кт.
Материал и методы
Проспективное наблюдательное неконтролируемое исследование выполнено на базе кафедры кардиологии, функциональной и ультразвуковой диагностики и отделения функциональной диагностики Университетской клинической больницы № 1 ФГАОУ ВО Первого МГМУ им. И. М. Сеченова, отделений химиотерапии МНИОИ им. П. А. Герцена — филиала ФГБУ "НМИЦ радиологии" и ФГБУ "НМИЦ онкологии им. Н. Н. Блохина" Минздрава России. В исследование включали пациенток старше 18 лет с первично операбельным раком молочной железы перед проведением неоадъювантной или адъювантной ХТ с применением Ац. Критериями исключения были ФВ ЛЖ <50%, несинусовый сердечный ритм, ХТ или лучевая терапия в анамнезе, плохая акустическая доступность при ЭхоКГ. Исследование одобрено комитетом по этике Первого МГМУ им. И. М. Сеченова. Всеми пациентками было подписано информированное согласие.
Осмотр врача-кардиолога и ЭхоКГ выполнялись до начала ХТ, по окончании терапии Ац и затем через 3, 6, 9 и 12 мес. Электрокардиограмму регистрировали до начала и по окончании терапии Ац. Исследование крови на hs-cTnI осуществляли до ХТ, сразу после каждого курса Ац, а у 18 больных — также перед каждым курсом.
Риск Кт оценивали с применением балльной системы, предложенной экспертами Ассоциации специалистов по сердечной недостаточности Европейского общества кардиологов (ЕОК) совместно с Международным обществом кардиоонкологов [9].
Кт определяли как снижение ФВ ЛЖ на ≥10% до уровня <53% [1]. При выявлении Кт назначали БРААС и БАБ с титрацией до целевых или максимально переносимых доз, либо увеличивали дозы, если пациентки принимали их ранее.
ЭхоКГ проводилась на аппарате Vivid 7 (General Electric, США). ФВ ЛЖ определяли по методу Симпсона через апикальный доступ.
Для исследования на тропонин образцы крови центрифугировали со скоростью 3000 об./мин в течение 15 мин, сыворотка хранилась при температуре -20° C не >1 мес. Определение уровня hs-cTnI выполняли на анализаторе Advia Centaur XP (Siemens Healthcare Diagnostics) иммунохемилюминеcцентным сэндвич-методом. Аналитическая чувствительность теста составляет 0,006 нг/мл. Функциональная чувствительность, которая соответствует минимальной концентрации, определяемой с коэффициентом вариации ≤20%, составляет 0,017 нг/мл, а с коэффициентом вариации ≤10% — 0,003 нг/мл. Уровень hscTnI >0,017 нг/мл считали повышенным.
Статистический анализ выполняли при помощи программы IBM Statistical Package for Social Sciences (SPSS) для Windows, версия 22. Значения количественных параметров представлены в виде среднего арифметического ± среднеквадратичное отклонение (Mean±SD), а также медианы и квартилей. Отличие распределения от нормального определяли по коэффициентам асимметрии и эксцесса. При сравнении двух групп для частотных переменных использовали точный вариант теста "хи-квадрат" (χ2), для количественных — критерий Манна-Уитни. Для оценки связи между двумя переменными применяли корреляционный анализ, для прогнозирования — метод линейной регрессии и ROC-анализ. Для всех критериев достоверными считали различия при p≤0,05. Учитывая некомпактность распределения hs-cTnI по величине, небольшой размер когорты, а также пропуски исследований у ряда пациенток, при анализе использовали также нормализованный показатель hs-cTnIсум, полученный с помощью метода нелинейного шкалирования.
Результаты
В исследование включено 49 пациенток в возрасте от 30 до 70 лет, характеристика которых приведена в таблице 1. Курсовая доза доксорубицина составляла 60 мг/м2, кумулятивная доза у 87,7% пациенток — ≤240 мг/м2 и у 16,3% — 360 мг/м2. Риск Кт до начала ХТ оценен как низкий у 33 (67,3%), промежуточный — у 14 (28,6%) и высокий — у 2 (4,1%) пациенток.
Таблица 1
Клинико-демографическая характеристика пациенток
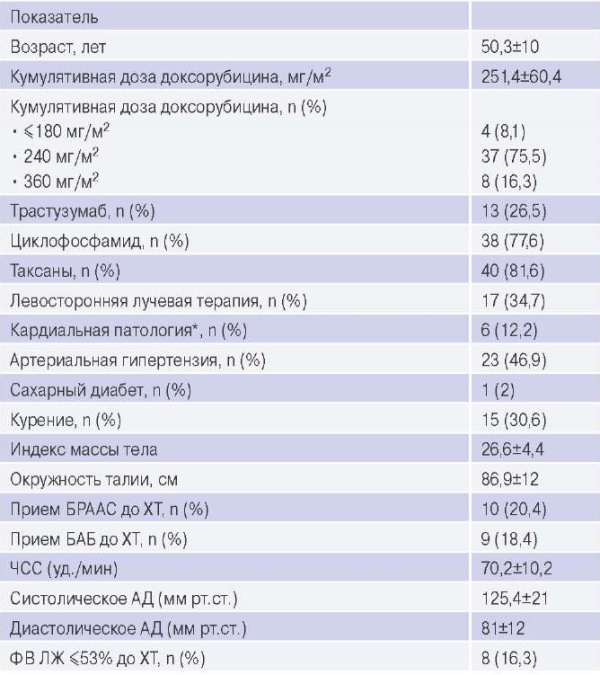
Примечание: * — у 1 пациентки — гипертрофическая кардиомиопатия без обструкции выносящего тракта ЛЖ, у 3 пароксизмальная фибрилляция предсердий, у 1 блокада левой ножки пучка Гиса, у 1 ишемическая болезнь сердца.
Сокращения: АД — артериальное давление, БАБ — бета-адреноблокаторы, БРААС — блокаторы ренинангиотензиновой системы, ЛЖ — левый желудочек, ФВ — фракция выброса, ХТ — химиотерапия, ЧСС — частота сердечных сокращений.
Средний срок наблюдения составил 10,9±4,0 мес. Кт выявлена у 8 (16,3%) пациенток в среднем через 4,7±4,5 мес. по окончании Ац. Им были назначены БРААС и БАБ до окончания наблюдения, в 1 случае приостановлена терапия трастузумабом на 3 нед. и продолжена после восстановления ФВ ЛЖ. У всех пациенток ФВ ЛЖ возросла до ≥53%, у 3 из них — до исходного уровня. Между больными, у которых развилась Кт и теми, у кого ее не было, не выявлено существенных различий по возрасту, кумулятивной дозе доксорубицина, применению циклофосфамида, таксанов и лучевой терапии на левую половину грудной клетки, сердечно-сосудистому анамнезу, традиционным факторам риска ССЗ, частоте фоновой терапии БРААС и БАБ, ФВ ЛЖ и другим показателям ЭхоКГ до начала ХТ, а также по степени риска Кт (табл. 2). Пациентки с Кт значимо отличались от остальных лишь большей частотой назначения трастузумаба (62,5% vs 19,5%, p=0,023) и частотой положительного теста на hs-cTnI до терапии (3 из 8 vs 2 из 41) (табл. 3).
Таблица 2
Риск Кт до ХТ

Сокращения: Кт — кардиотоксичность, н/с — несущественно.
Таблица 3
Сравнение групп пациенток c Кт и без Кт по уровню и частоте повышения hs-cTnI
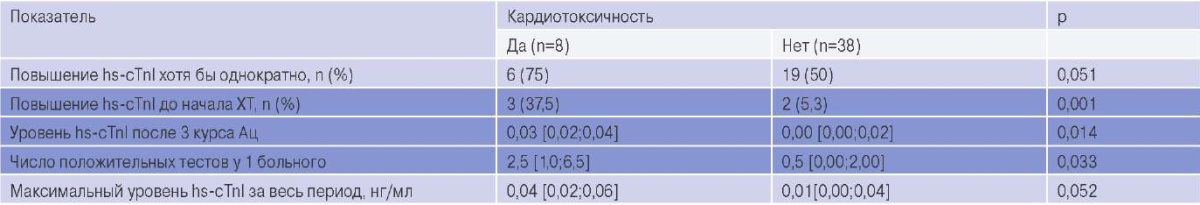
Сокращения: Ац — антрациклины, ХТ — химиотерапия, hs-cTnI — высокочувствительный сердечный тропонин I.
Выполнено 215 исследований hs-cTnI, от 2 до 8 (в среднем — 4,9±2,0) анализов на пациентку. Большинство больных получили 4 курса Ац, поэтому анализы после 5 и 6 курсов выполнены лишь в 8 случаях. Повышение hs-cTnI выявлено ≥1 раза у 25 (56,8%) пациенток: до ХТ — у 5 (13,5%), после первого и второго курсов Ац — у 13,9%, после третьего, четвертого, пятого и шестого курсов — у 44%, 62%, 71% и 66% больных, соответственно. Уровни hs-cTnI перед и после введения доксорубицина тесно коррелировали между собой.
Пациентки с Кт и без Кт существенно различались по распространенности повышенного hscTnI до начала ХТ, уровню hs-cTnI после 3 курса Ац и по числу проб с повышенным hs-cTnI (табл. 3). Выявлена умеренная корреляционная связь между максимальным повышением hs-cTnI и максимальным снижением ФВ за весь период наблюдения (r=0,413, p=0,005), а также между концентрацией hscTnI после третьего и четвертого курсов Ац и величиной снижения ФВ ЛЖ (r≈0,6, p≈0,01).
Значимость повышения hs-cTnI в любой момент времени как предиктора Кт составляла: чувствительность — 87,5%, специфичность — 50%, прогностическая значимость положительного результата — 28%, прогностическая значимость отрицательного результата — 94,7%. По данным ROC-анализа существенная умеренная прогностическая значимость показана для значения hs-cTnI до начала ХТ и начиная с пробы перед 3 курсом Ац на фоне терапии (табл. 4).
Таблица 4
ROC-анализ для прогноза Кт в зависимости от значения hs-cTnI
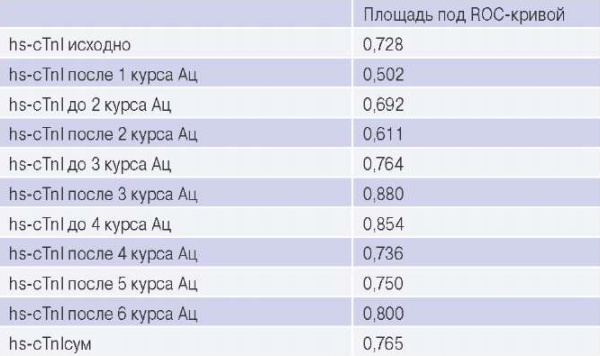
Сокращения: Ац — антрациклины, hs-cTnI — высокочувствительный сердечный тропонин I.
При регрессионном анализе наиболее тесная связь отмечена между Кт и значением hs-сTnI до начала ХТ (β=0,45, р=0,005) и после 3 курса Aц (β=0,56, р=0,002). Аналогичные показатели получены для нормализованной величины hs-cTnIсум: β=0,43, р=0,002. При ROC-анализе прогностическое значение hs-cTnIсум также соответствовало результатам анализа реальных показателей (рис. 1), что дало основания полагать, что при увеличении объема выборки мы получили бы схожие результаты.
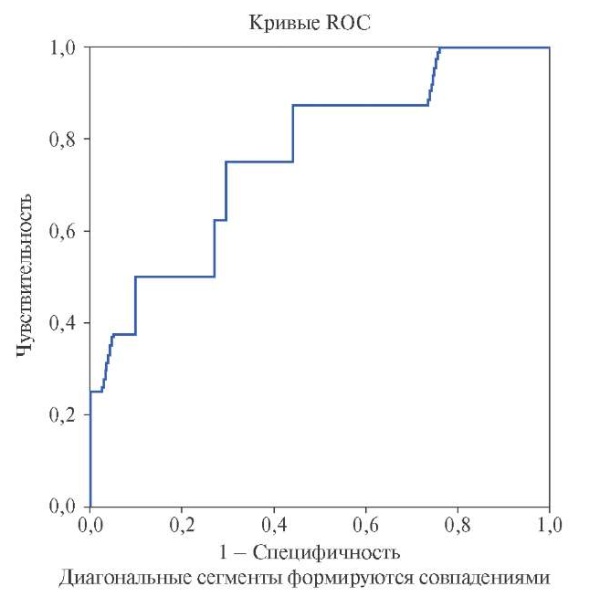
Рис. 1. ROC-кривая для прогноза Кт в зависимости от hs-cTnIсум.
Примечание: площадь под кривой =0,765.
Обсуждение
В целом ряде работ показано, что повышение cTn на фоне ХТ, включающей высокие дозы Ац, может служить предиктором левожелудочковой дисфункции, сердечной недостаточности и других серьезных сердечно-сосудистых осложнений [3][4]. По данным Cardinale D, et al. наиболее значимым было раннее и неоднократное обнаружение повышенного cTn, а наихудший прогноз определялся у пациентов с его персистирующим повышением через месяц после окончания терапии Ац [4]. Назначение таким больным ингибитора ангиотензинпревращающего фермента и/или БАБ позволяло предупреждать развитие дисфункции ЛЖ [4][7]. Тест демонстрировал высокую прогностическую значимость отрицательного результата, что позволяло рекомендовать его для скрининга [4][6].
При лечении низкими и средними дозами Ац, которые применяются в настоящее время у большинства пациентов, связь повышения сТn с развитием дисфункции ЛЖ оказалась менее значимой. В 33% исследований при использовании обычных тест-систем повышение тропонина не было зарегистрировано [3]. Сейчас широко применяются высокочувствительные тесты (hs-сTn) с крайне низким порогом чувствительности (0,003-0,019 нг/мл), обладающие, в частности, прогностическим значением в отношении риска ССЗ у неонкологических пациентов [10]. По данным различных исследований на фоне терапии Ац число пациентов с повышенным уровнем hs-сTn возрастает по мере увеличения кумулятивной дозы [11] и варьирует от 25% до 73% [12-14], однако повышение чувствительности теста сопровождается снижением его специфичности [6][8].
В метаанализе 2020г обобщены результаты исследований cTn у онкологических пациентов с применением тест-систем с различной чувствительностью. Показано, что cTn часто повышается на фоне терапии Ац в кумулятивных дозах как ≥240, так и <240 мг/м2 в пересчете на доксорубицин, без существенных различий между TnT и TnI. В целом доля пациентов с повышенным cTn на фоне/после ХТ составила 22,4%. Тропонин-позитивность связана с развитием дисфункции ЛЖ (отношение рисков =11,9; 95% доверительный интервал 4,4-32,1), и эта связь при применении доз ≥240 мг/м2 значительно сильнее, чем при меньших дозах. Средний уровень cTn при снижении ФВ ЛЖ выше, чем при сохраненной ФВ, но разница эта не очень большая, что является одним из аргументов в пользу высокочувствительных тестов. В целом чувствительность, специфичность и прогностическая значимость отрицательного результата cTn как предиктора дисфункции ЛЖ составила 69%, 83% и 93%, соответственно. Высокочувствительные тесты не продемонстрировали большей прогностической значимости, чем обычные, что могло быть связано с меньшим числом и более молодым возрастом пациентов, а также высокой частотой положительных тестов в исследованиях hsсTn [3].
Многие аспекты мониторинга cTn остаются неясными, в частности, нет единого мнения по поводу показаний, оптимальных сроков и кратности анализов [6]. Так, продемонстрирована прогностическая значимость hs-cTnT, исследованного до и через 3 нед. после первого цикла Ац [12]. Наибольшим прогностическим потенциалом обладает анализ после последнего курса Ац [13]. В работах с серийным измерением сTn наблюдалось его повышение в течение 72 ч после введения Ац [4], однако у гематологических пациентов, получавших небольшие кумулятивные дозы Ац, максимальный уровень отмечался на 21 сут. после введения Ац и был наиболее тесно ассоциирован с развитием дисфункции ЛЖ [15]. Выполнение анализа перед очередным циклом одновременно с необходимыми рутинными тестами наиболее удобно с точки зрения логистики, позволяет избегать дополнительных визитов и венепункций.
Экспертные документы последних лет рекомендуют при возможности исследовать сTn для стратификации риска Кт перед началом терапии кардиотоксичными препаратами, в первую очередь Ац и трастузумабом [1][2][6][7]. Вместе с тем исходно повышенный уровень cTn относят к факторам промежуточной значимости, поэтому он радикально не меняет степень риска Кт, рассчитанную без учета биомаркеров [7].
Большинство рекомендаций также считают полезным мониторинг сTn на фоне и после ХТ. ESMO в 2020г рекомендует рассмотреть возможность исследования сTnT каждые 3-6 нед. или перед каждым циклом ХТ [2]. Эксперты Европейских кардиоонкологических сообществ при низком риске Кт считают исследование во время ХТ необязательным (возможно перед 5 циклом), при промежуточном риске — рекомендуют перед 5, а при высоком — после каждого 2 цикла или более часто при возможности [6]. "Согласованное мнение российских экспертов" 2021г рекомендует при возможности у пациентов с низким риском Кт исследовать сTn в конце последнего цикла Ац, а при более высоких степенях риска — во время ХТ без конкретного указания сроков и кратности [1].
Нами изучалось значение hs-cTnI, измеренного до и на фоне ХТ, включавшей доксорубицин, в качестве предиктора Кт (дисфункции ЛЖ в последующие 12 мес.) у 49 пациенток с раком молочной железы. У 81,6% пациенток кумулятивная доза доксорубицина не превышала 240 мг/м2, а риск Кт был низким у 67%, промежуточным у 28% и высоким лишь у 2 (5%) пациенток (уровень натрийуретического пептида не исследовали, однако при допущении, что он повышен, степень риска Кт не изменялась).
Кт после лечения Ац выявлена у 8 (16,3%) пациенток: 5 — с низким, 2 — с промежуточным и лишь 1 — с высоким риском. Единственное, что их закономерно отличало от пациенток без Кт, было более частое применение трастузумаба.
Повышение hs-сTnI до ХТ определялось у 5 (13,5%) пациенток, трое из которых страдали АГ. На фоне терапии как минимум однократно повышение hs-сTnI выявлено у 56,8% пациенток, в основном начиная с исследования перед 3 циклом, и в дальнейшем доля тропонин-позитивных пациенток увеличивалась с каждым циклом ХТ. Наибольшей прогностической значимостью обладало повышение hs-сTnI до ХТ, а также после 3 введения Ац (уровень непосредственно после введения тесно коррелировал с уровнем до введения доксорубицина и может рассматриваться как остаточный после предыдущего курса). Меньшая значимость hs-сTnI, измеренного при последующих курсах ХТ, может, в частности, объясняться значительным увеличением частоты тропонин-позитивности (>60%), а также малым количеством пациентов, получивших >4 курсов Ац. В целом чувствительность однократного повышения hs-сTnI в любой момент времени как предиктора Кт составила 87,5%, специфичность — 50%, прогностическая значимость положительного результата — 28%, прогностическая значимость отрицательного результата — 94,7%.
Основными ограничениями исследования являлись небольшой объем изученной выборки и пропуск контрольных визитов у ряда пациенток.
Заключение
Частота развития дисфункции ЛЖ в течение 12 мес. после ХТ, включавшей Ац, у пациенток с первично-операбельным раком молочной железы и преимущественно низким и промежуточным риском Кт составила 16,3%. Исследование тропонина высокочувствительным методом до и на фоне терапии Ац позволяло предсказывать дисфункцию ЛЖ с высокой чувствительностью, низкой специфичностью и высокой значимостью отрицательного результата.
Полученные результаты указывают на целесообразность исследования тропонина до начала и в течение терапии Ац, начиная с 3 цикла, у всех пациентов независимо от предполагаемой степени риска Кт.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Васюк Ю. А., Гендлин Г. Е., Емелина Е. И. и др. Согласованное мнение Российских экспертов по профилактике, диагностике и лечению сердечно-сосудистой токсичности противоопухолевой терапии. Российский кардиологический журнал. 2021;26(9):4703. doi:10.15829/15604071-2021-4703.
2. Curigliano G, Lenihan D, Fradley M, et al. Management of cardiac disease in cancer patients throughout oncological treatment: ESMO consensus recommendations. Ann Oncol. 2020;31(2):171-90. doi:10.1016/j.annonc.2019.10.023.
3. Michel L, Mincu RI, Mahabadi AA, et al. Troponins and brain natriuretic peptides for the prediction of cardiotoxicity in cancer patients: a meta-analysis. European Journal of Heart Failure. 2020;22:350-61. doi:10.1002/ejhf.1631.
4. Cardinale D, Biasillo G, Salvatici M, et al. Using biomarkers to predict and to prevent cardiotoxicity of cancer therapy. Expert Review of Molecular Diagnostics. 2017. doi:10.1080/14737159.2017.1283219.
5. Čelutkiene J, Pudil R, López-Fernández V, et al. Role of cardiovascular imaging in cancer patients receiving cardiotoxic therapies: a position statement on behalf of the Heart Failure Association (HFA), the European Association of Cardiovascular Imaging (EACVI) and the Cardio-Oncology Council of the European Society of Cardiology (ESC). Eur J Heart Fail. 2020;(22):1504-24. doi:10.1002/ejhf.1957.
6. Pudil R, Mueller C, Celutkiene J, et al. Role of serum biomarkers in cancer patients receiving cardiotoxic cancer therapies: a position statement from the Cardio-Oncology Study Group of the Heart Failure Association and the Cardio-Oncology Council of the European Society of Cardiology. Eur J Heart Fail. 2020;22:1966-83. doi:10.1002/ejhf.2017.
7. Avila MS, Ayub-Ferreira SM, Wanderley MR de B, et al. Carvedilol for prevention of chemotherapy-related cardiotoxicity: the CECCY trial. J Am Coll Cardiol. 2018;71:2281-90. doi:10.1016/j.jacc.2018.02.049.
8. Tan LL, Lyon AR. Role of biomarkers in prediction of cardiotoxicity during cancer treatment. Curr treat options cardiovasc med. 2018;20:55. doi:10.1007/s11936-018-0641-z.
9. Lyon AR, Dent S, Stanway S, et al. Baseline cardiovascular risk assessment in cancer patients scheduled to receive cardiotoxic cancer therapies: a position statement and new risk assessment tools from the Cardio-Oncology Study Group of the Heart Failure Association of the European Society of Cardiology in collaboration with the International Cardio-Oncology Society. Eur J Heart Fail. 2020;22(11):1945-60. doi:10.1002/ejhf.1920.
10. Everett BM. Cardiac troponin as a novel tool for cardiovascular risk prediction in ambulatory populations. Trends in cardiovascular medicine. 2017;27:41-7. doi:10.1016/j.tcm.2016.06.002.
11. Jones M, O’Gorman P, Kelly C, et al. High-sensitive cardiac troponin-I facilitates timely detection of subclinical anthracycline-mediated cardiac injury. Annals of Clinical Biochemistry. 2017; 54(1):149-157. doi:10.1177/0004563216650464.
12. Mahjoob MP, Sheikholeslami SA, Dadras M, et al. Prognostic value of cardiac biomarkers assessment in combination with myocardial 2D strain echocardiography for early detection of anthracycline-related cardiac toxicity. Cardiovascular & Haematological Disorders-Drug Targets. 2019;19:1-10. doi:10.2174/1871529X19666190912150942.
13. Demissei BG, Hubbard RA, Zhang L, et al. Changes in cardiovascular biomarkers with breast cancer therapy and associations with cardiac dysfunction. J Am Heart Assoc. 2020;9:e014708. doi:10.1161/JAHA.119.014708.
14. Bisoc A, Ciurescu D, Radoi M, et al. Elevations in high-sensitive cardiac Troponin T and N-terminal prohormone Brain Natriuretic Peptide levels in the serum can predict the development of anthracycline-induced cardiomyopathy. American Journal of Therapeutics. 2020;27:e142-e150. doi:10.1097/MJT.0000000000000930.
15. Auner HW, Tinchon C, Linkesch W, et al. Prolonged monitoring of troponin T for the detection of anthracycline cardiotoxicity in adults with hematological malignancies. Ann Hematol. 2003;82:218-22. doi:10.1007/s00277-003-0615-3.
Об авторах
В. Д. ЛёвинаРоссия
Виктория Дмитриевна Лёвина — аспирант кафедры кардиологии, функциональной и ультразвуковой диагностики института клинической медицины, врач-кардиолог клинико-диагностического отделения Городская клиническая больница им. С. С. Юдина департамента здравоохранения города Москвы.
Москва
Конфликт интересов:
конфликт интересов не заявляется
М. Г. Полтавская
Россия
Мария Георгиевна Полтавская — доктор медицинских наук, профессор кафедры кардиологии, функциональной и ультразвуковой диагностики института клинической медицины, врач-кардиолог кардиологического отделения для больных инфарктом миокарда Университетской клинической больницы № 1 КЦ.
Москва
Конфликт интересов:
конфликт интересов не заявляется
П. Ш. Чомахидзе
Россия
Пётр Шавлович Чомахидзе — доктор медицинских наук, профессор кафедры кардиологии, функциональной и ультразвуковой диагностики института клинической медицины, врач-кардиолог отделения функциональной диагностики Университетской клинической больницы № 1 КЦ.
Москва
Конфликт интересов:
конфликт интересов не заявляется
А. А. Мещеряков
Россия
Андрей Альбертович Мещеряков — доктор медицинских наук, зам. генерального директора по лечебной работе.
Москва
Конфликт интересов:
конфликт интересов не заявляется
Л. В. Болотина
Россия
Лариса Владимировна Болотина — доктор медицинских наук, врач-онколог, заведующий отделением химиотерапии.
Москва
Конфликт интересов:
конфликт интересов не заявляется
Т. И. Дешкина
Россия
Татьяна Игоревна Дешкина — кандидат медицинских наук, врач-онколог отделения химиотерапии.
Москва
Конфликт интересов:
конфликт интересов не заявляется
Д. С. Валиулина
Россия
Динар Сандаровна Валиулина — биолог, межклиническая биохимическая лаборатория Центральной лабораторно-диагностической службы КЦ.
Москва
Конфликт интересов:
конфликт интересов не заявляется
А. Н. Герасимов
Россия
Андрей Николаевич Герасимов — доктор физико-математических наук профессор, заведующий кафедрой медицинской информатики и статистики.
Москва
Конфликт интересов:
конфликт интересов не заявляется
О. В. Андреева
Россия
Ольга Владимировна Андреева — аспирант кафедры кардиологии, функциональной и ультразвуковой диагностики института клинической медицины, врач-кардиолог.
Москва
Конфликт интересов:
конфликт интересов не заявляется
А. А. Шмелёва
Россия
Анна Александровна Шмелёва — аспирант кафедры кардиологии, функциональной и ультразвуковой диагностики института клинической медицины, врач-кардиолог.
Москва
Конфликт интересов:
конфликт интересов не заявляется
З.З.А. Фашафша
Россия
Заки З.А. Фашафша — аспирант кафедры кардиологии, функциональной и ультразвуковой диагностики института клинической медицины, научный сотрудник научно-исследовательского центра мирового уровня "Цифровой биодизайн и персонализированное здравоохранение", врач-кардиолог.
Москва
Конфликт интересов:
конфликт интересов не заявляется
А. Р. Левшина
Россия
Анна Романовна Левшина — студентка лечебного факультета.
Москва
Конфликт интересов:
конфликт интересов не заявляется
В. П. Седов
Россия
Всеволод Парисович Седов — доктор медицинских наук, профессор кафедры лучевой диагностики и лучевой терапии, врач-функциональной диагностики отделения функциональной диагностики Университетской клинической больницы № 1 КЦ.
Москва
Конфликт интересов:
конфликт интересов не заявляется
Дополнительные файлы
Рецензия
Для цитирования:
Лёвина В.Д., Полтавская М.Г., Чомахидзе П.Ш., Мещеряков А.А., Болотина Л.В., Дешкина Т.И., Валиулина Д.С., Герасимов А.Н., Андреева О.В., Шмелёва А.А., Фашафша З., Левшина А.Р., Седов В.П. Высокочувствительный тропонин I как предиктор дисфункции левого желудочка при применении кардиотоксичных противоопухолевых препаратов для лечения рака молочной железы у больных с преимущественно низким и промежуточным риском кардиотоксичности. Российский кардиологический журнал. 2022;27(11):5210. https://doi.org/10.15829/1560-4071-2022-5210
For citation:
Levina V.D., Poltavskaya M.G., Chomakhidze P.Sh., Meshcheryakov A.A., Bolotina L.V., Deshkina T.I., Valiulina D.S., Gerasimov A.N., Andreeva O.V., Shmeleva A.A., Fashafsha Z., Levshina A.R., Sedov V.P. High-sensitivity troponin I as a predictor of left ventricular dysfunction in the use of cardiotoxic anticancer agents for breast cancer in patients with predominantly low and moderate risk of cardiotoxicity. Russian Journal of Cardiology. 2022;27(11):5210. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5210
JATS XML

















































