Перейти к:
Полиморфизм генов воспалительного ответа в патогенезе ревматической болезни сердца
https://doi.org/10.15829/1560-4071-2022-5197
Аннотация
Цель. Оценить вклад полиморфных вариантов генов воспалительного ответа в предрасположенность к развитию ревматической болезни сердца (РБС).
Материал и методы. Методом полимеразной цепной реакции в режиме реального времени у 251 пациента с РБС и у 300 условно здоровых доноров проведен анализ частоты встречаемости 18 полиморфных вариантов 8 генов, вовлеченных в воспалительный процесс.
Результаты. Выявлено, что гомозиготные генотипы TT полиморфного варианта rs1800871 (IL10) (p=0,02) и TT rs1800872 (IL10) (p=0,027), а также генотипы ТТ гена CRP (rs1205) (p=0,015) и GG варианта rs375947 (IL12RB) (p=0,037) являются рисковыми и ассоциированы с предрасположенностью к развитию РБС.
Заключение. Ассоциации полиморфных вариантов rs1800871 и rs1800872 гена IL10, rs1205 гена CRP и rs375947 гена IL12RB могут являться важным звеном патогенеза РБС и в дальнейшем могут быть использованы как биологические маркеры для персонифицированной оценки риска развития данной патологии.
Ключевые слова
Для цитирования:
Синицкая А.В., Хуторная М.В., Синицкий М.Ю., Хрячкова О.Н., Асанов М.А., Понасенко А.В. Полиморфизм генов воспалительного ответа в патогенезе ревматической болезни сердца. Российский кардиологический журнал. 2022;27(10):5197. https://doi.org/10.15829/1560-4071-2022-5197
For citation:
Sinitskaya A.V., Khutornaya M.V., Sinitsky M.Yu., Khryachkova O.N., Asanov M.A., Ponasenko A.V. Polymorphism of inflammatory system genes in the pathogenesis of rheumatic heart disease. Russian Journal of Cardiology. 2022;27(10):5197. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5197
Ревматическая болезнь сердца (РБС), вызванная стрептококковой инфекцией, остается одной из причин дисфункции нативных клапанов сердца. Ежегодно во всем мире регистрируется 250 тыс. смертей, вызванных данной патологией, главным образом среди молодого населения [1]. Однако эпидемиологические исследования показывают, что в большей степени от РБС страдает население в возрасте от 65 лет, однако в развивающихся странах наблюдается сдвиг в сторону более молодых людей [2].
Установлено, что РБС развивается вследствие аномальной аутоиммунной реакции на стрептококковую инфекцию группы А у генетически предрасположенного хозяина, сопровождающейся хроническим асептическим процессом воспаления, что играет важную роль в предрасположенности и прогрессировании данного заболевания [2]. В исследованиях отмечается, что хроническое воспаление при РБС способствует развитию фиброза в нативных клапанах сердца, что впоследствии приводит к нарушению функций клапанного аппарата [3]. Патогенез РБС многогранен и требует детального изучения, однако полученные на сегодняшний день данные свидетельствуют о том, что воспалительный процесс является его неотъемлемой частью. При этом цитокины, являющиеся главными медиаторами воспалительного ответа — ключевые молекулы, вовлеченные в развитие данного патологического состояния. Так, ряд литературных данных показывает, что пациенты с РБС имеют более высокие сывороточные уровни цитокинов по сравнению со здоровыми донорами [4][5].
В исследованиях последнего десятилетия подчеркивается роль генетической предрасположенности в развитии РБС [6]. Исследователями установлен ряд генов-кандидатов, которые ассоциированы с предрасположенностью к развитию данной патологии [68]. Однако следует отметить, что имеющиеся на сегодняшний день результаты противоречивы, а также имеют ряд ограничений, которые касаются размера выборки (в среднем в исследования включаются не более 100 пациентов).
Принимая во внимание вышесказанное, сформулирована цель нашего исследования, заключающаяся в оценке роли генов воспалительного ответа в предрасположенности к развитию РБС.
Материал и методы
В исследуемую группу включено 187 женщин и 61 мужчина (всего 251 пациент) с установленным диагнозом "ревматическая болезнь сердца", проходивших лечение на базе Федерального государственного бюджетного научного учреждения "Научно-исследовательский институт комплексных проблем сердечно-сосудистых заболеваний" (Кемерово, Россия) с 2013 по 2019гг. Все пациенты с РБС имели поражение митрального клапана, вследствие чего им была проведена операция по его замене в условиях искусственного кровообращения. В качестве контроля использовали выборку из 300 условно здоровых доноров (190 женщин и 110 мужчин). Средний возраст индивидуумов, включенных в исследуемую и контрольную группы, составил 57 (29; 77) и 53 (21; 80) лет, соответственно. Исследование было одобрено локальным этическим комитетом НИИ КПССЗ, все участники подписывали информированное согласие на участие в исследовании. У всех доноров проводился сбор венозной крови из локтевой вены в пробирку, содержащую K3EDTA. Выделение ДНК проводили методом фенол-хлороформной экстракции. Методом полимеразной цепной реакции в режиме реального времени с использованием TaqMan зондов проанализировано 18 полиморфных вариантов, располагающихся в генах, белковые продукты которых вовлечены в воспалительный ответ (табл. 1).
Таблица 1
Характеристика полиморфных вариантов генов воспалительного ответа
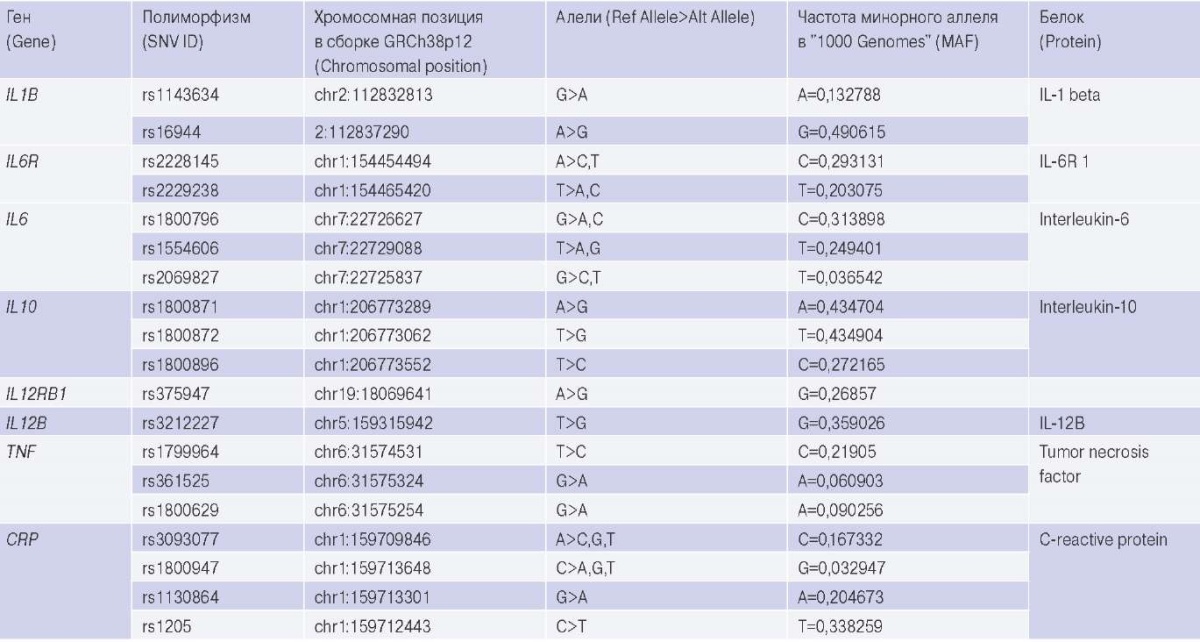
Для статистической обработки данных использовали следующее программное обеспечение: SNPstats и GraphPad Prism. Расчёт нормальности распределения выборки осуществляли методом КраскелаУоллиса. Анализ ассоциаций генотипов с риском развития РБС проводили с использованием хи-квадрата Пирсона с поправкой Йетса на непрерывность или точного критерия Фишера между индивидуумами контрольной и исследуемой групп. Различия считали статистически значимыми при p<0,05.
Результаты
В исследуемых выборках наблюдалось соответствие наблюдаемого распределения генотипов ожидаемому при равновесии Харди-Вайнберга практически для всех полиморфных вариантов, за исключением rs1130864 гена CRР, в связи с чем данный вариант был исключен из дальнейшего анализа. Сравнительный анализ показал, что с риском развития РБС ассоциированы генотипы TT гена IL10 (rs1800871) (p=0,02) и TT гена IL10 (rs1800872) (p=0,027) по кодоминантной модели наследования, а также генотипы ТТ гена CRP (rs1205) (p=0,015) и GG гена IL12RB (rs375947) (p=0,037) — по рецессивной модели наследования (табл. 2). С другими полиморфными вариантами статистически значимых результатов не получено.
Таблица 2
Распределение генотипов генов воспалительного ответа в исследуемой и контрольной группах
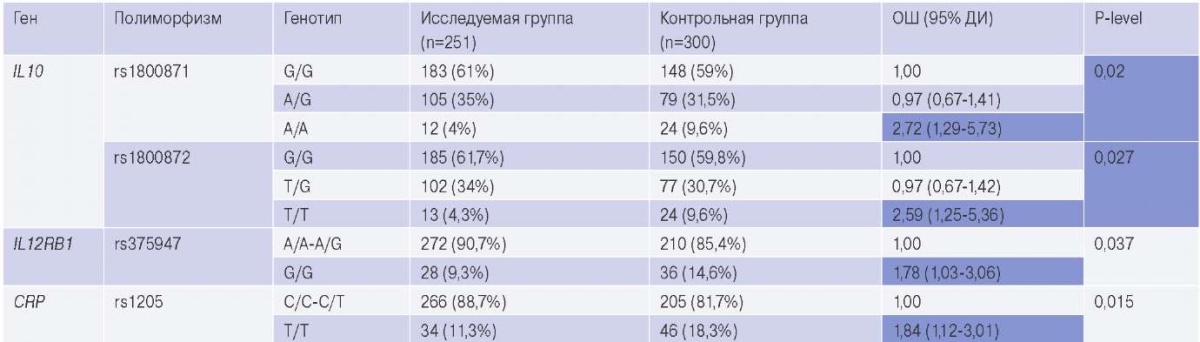
Сокращения: ДИ — доверительный интервал, ОШ — отношение шансов.
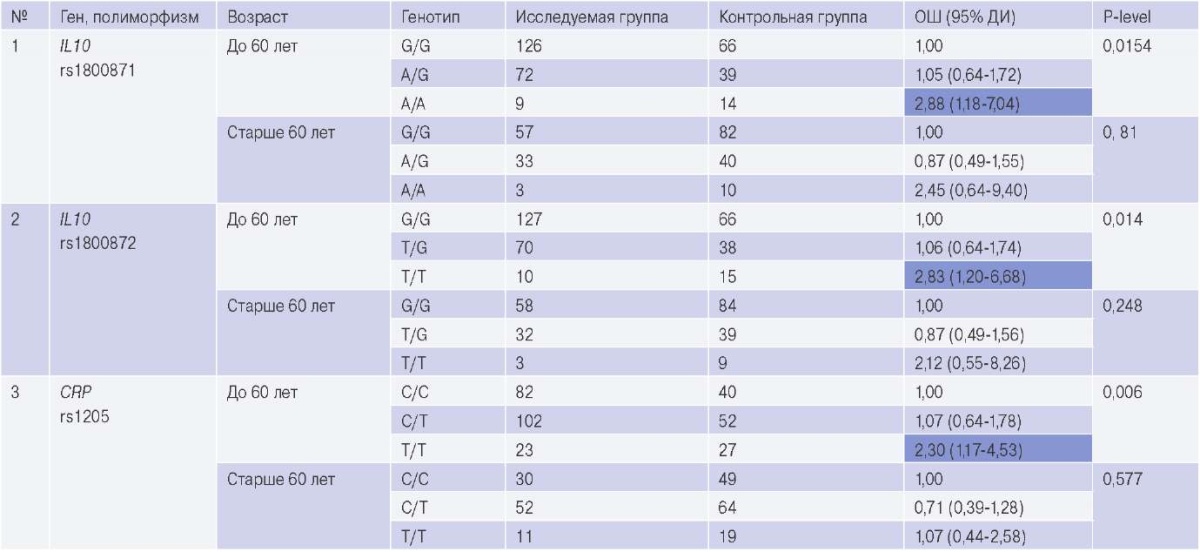
Разделение исследуемой выборки по гендерному признаку не показало статистически значимых различий, однако выявлены некоторые закономерности при стратификации групп по возрасту. Так, показано, что с риском развития РБС в группе пациентов до 60 лет ассоциированы генотипы АА полиморфного варианта rs1800871 гена IL10 (отношение шансов (ОШ) =2,88, 95% доверительный интервал (ДИ) 1,18-7,04), TT полиморфного варианта rs1800872 гена IL10 (ОШ =2,83, 95% ДИ 1,20-6,68) и TT полиморфного варианта rs1205 гена CPR (ОШ =2,30, 95% ДИ 1,174,53) (табл. 3).
Таблица 3
Ассоциации генотипов с предрасположенностью к развитию РБС в зависимости от возраста
Обсуждение
Проведенное нами исследование позволило выявить статистически значимые ассоциации полиморфных вариантов генов воспалительного ответа IL10 (rs1800871 и rs1800872), IL12RB1 (rs2375947) и CRP (rs1205) с предрасположенностью к развитию РБС. РБС — приобретенное хроническое аутоиммунное заболевание с прогрессирующим воспалением, вызывающее нарушение функций клапанов сердца [9]. Как и многие патологии, РБС является многофакторным заболеванием, в патогенез которого вовлечен комплекс генетических, средовых и аутоиммунных факторов [10-12]. Наше исследование продемонстрировало, что гомозиготные генотипы TT полиморфного варианта rs1800871 гена IL10, TT полиморфного варианта rs1800872 гена IL10, а также генотипы ТТ гена CRP (rs1205) и GG гена IL12RB (rs2375947) ассоциированы с повышенным риском развития РБС. Полученные нами данные согласуются с гипотезой о том, что процесс воспаления является неотъемлемой частью инициации и прогрессирования РБС. Принимая во внимание тот факт, что в некоторых случаях клиническое течение РБС может протекать бессимптомно, возникает необходимость поиска молекулярно-генетических маркеров для раннего прогнозирования предрасположенности к развитию данного заболевания.
На сегодняшний день литературные данные свидетельствуют об ассоциации гена IL10 с риском развития РБС, однако имеющиеся исследования имеют ограничения, а полученные результаты достаточно противоречивы. Так, коллектив ученых из Индии показал, что развитие РБС у населения Южной Индии ассоциировано с генотипом A/A гена IL17A (rs2275913), с вариантами генов TNF-α, IFNγ, IL-10 и IL23R значимых взаимосвязей не было установлено [13][14]. Кроме того, продемонстрировано, что варианты rs1800871, rs1800872 и rs1800896 гена IL10 ассоциированы с риском развития РБС у пациентов из Саудовской Аравии [7]. Еще одной научной группой из Пакистана не выявлено статистически значимых различий в частоте встречаемости генотипов варианта rs1800896 гена IL10 у пациентов с РБС [15].
В исследованиях, проведенных российскими учеными, отмечается, что полиморфные варианты гена ADBR1 (Gly389Arg и Gly49Ser) у пациентов с хронической РБС ассоциированы с дилатацией левых отделов сердца [16]. Кроме того, в одном из последних исследований сообщается, что с наибольшими линейными размерами левого желудочка у пациентов с хронической РБС ассоциированы гомозиготные генотипы АА гена TNF-α и АА гена IL17A [17].
В ранее проведённом исследовании мы установили, что генотипы генов IL1RA и IL4 являются рисковыми в отношении развития хронической РБС [17]. У пациентов с тяжелым течением РБС уставлено увеличение концентрации воспалительных цитокинов (IL-6) TNF-α, IL-10 и IL-4,) в сыворотке крови [18]. Сравнение уровней цитокинов (CCL11, CCL2, CCL3, CCL4, CCL5, CXCL10, CXCL8, FGF, G-CSF, GM-CSF, VEGF, PDGF-BB, INF-GAMA, IL-10, IL12, IL-13, IL-15, IL-17, IL1β, IL1ra, IL-2, IL-4, IL-5, IL-6, IL-7, IL-9 и TNF-α) в сыворотке пациентов с латентным и клиническим РБС показало их статистически значимое увеличение у пациентов с клиническим РБС. Данным коллективом авторов также установлено, что гены IL2 и IL4 ассоциированы с клиническим РБС. Логистический анализ показал, что наилучшим предиктивным потенциалом обладали цитокины IL-1Ra, IL-4 и IL-8 [19].
Исследования непосредственно иссечённых клапанов сердца при хирургическом вмешательстве демонстрируют, что клапанные структуры характеризуются повышенным уровнем фактора некроза опухоли (TNF-α), интерферона гамма (INF-γ), а также низким уровнем интерлейкина 4 [4]. Современные методы исследований, такие как массспектрометрия, определяющая протеомный профиль образцов, позволили выявить ряд белковых маркеров (адипонектин, компонент комплемента с7, фибулин-1, фиколин 3 и квисцинсульфгидрилоксидаза 1), которые показали наибольшую статистическую значимость и площадь под ROC кривой [8].
Таким образом, стоит отметить, что в инициацию и развитие воспалительного процесса вовлечено огромное количество молекул различных функциональных классов, структура которых зависит от кодирующих их генов, либо генов, продукты которых вовлечены в данный процесс.
Заключение
Полиморфные варианты генов IL10 (rs1800871 и rs1800872), IL12RB1 (rs2375947) и CRP (rs1205) могут являться важным звеном патогенеза РБС и в дальнейшем использованы как биологические маркеры для персонифицированной оценки риска развития данного патологического состояния. Однако необходимо дальнейшее изучение не только образцов геномной ДНК пациентов, но и иссечённых нативных клапанов сердца, для более детальной расшифровки молекулярно-генетических механизмов развития РБС.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Marijon E, Mirabel M, Celermajer DS, Jouven X. Rheumatic heart disease. Lancet. 2012;379:953-64. doi:10.1016/S0140-6736(11)61171-9.
2. Coffey S, Roberts-Thomson R, Brown A, et al. Global epidemiology of valvular heart disease. Nature Reviews Cardiology. 2021;18(12):853-64. doi:10.1038/s41569-021-00570-z.
3. Yutzey KE, Demer LL, Body SC, et al. Calcific aortic valve disease: a consensus summary from the alliance of investigators on calcific aortic valve disease. Arterioscler Thromb Vasc Biol. 2014;34:2387-93. doi:10.1161/ATVBAHA.114.302523.
4. Diamantino Soares AC, Araújo Passos LS, Sable C, et al. Circulating cytokines predict severity of rheumatic heart disease. International journal of cardiology. 2019;289:107-9. doi:10.1016/j.ijcard.2019.04.063.
5. Понасенко А.В., Хуторная М.В., Головкин А.С. и др. Вклад провоспалительных цитокинов в формирование системного воспалительного ответа после операций протезирования клапанов сердца. Комплексные проблемы сердечно-сосудистых заболеваний. 2013;(4):71-6. doi:10.17802/2306-1278-2013-4-71-76.
6. Muhamed B, Parks T, Sliwa K. Genetics of rheumatic fever and rheumatic heart disease. Nature Reviews Cardiology. 2020;17(3):145-54. doi:10.1038/s41569-019-0258-2.
7. Rehman S, Akhtar N, Saba N, et al. Study on the association of TNF-α(-308), IL-6(-174), IL-10(-1082) and IL-1Ra(VNTR) gene polymorphisms with rheumatic heart disease in Pakistani patients. Cytokine. 2013;61(2):527-31. doi:10.1016/j.cyto.2012.10.020.
8. Salie MT, Yang J, Ramírez Medina CR, et al. Data-independent acquisition mass spectrometry in severe rheumatic heart disease (RHD) identifies a proteomic signature showing ongoing inflammation and effectively classifying RHD cases. Clin Proteomics. 2022;19(1):7. doi:10.1186/s12014-022-09345-1.
9. Watkins DA, Johnson CO, Colquhoun SM, et al. Global, Regional, and National Burden of Rheumatic Heart Disease, 1990-2015. N Engl J Med. 2017;377(8):713-22. doi:10.1056/NEJMoa1603693.
10. Kaushal A, Kumar D, Khare S, Kumar A. speB gene as a specific genetic marker for early detection of rheumatic heart disease in human. Cell Mol Biol (Noisy-le-grand). 2012;58(1):50-4.
11. Roberts K, Colquhoun S, Steer A, et al. Screening for rheumatic heart disease: current approaches and controversies. Nat Rev Cardiol. 2013;10(1):49-58. doi:10.1038/nrcardio.2012.157.
12. Poomarimuthu M, Elango S, Solomon PR, et al. Association of IL17 and IL23R gene polymorphisms with rheumatic heart disease in South Indian population. Immunol Invest. 2018;47(7):754-64. doi:10.1080/08820139.2018.1493053.
13. Poomarimuthu M, Elango S, Solomon PR, et al. Lack of Association between TNF-α, IFN-γ, IL-10 Gene Polymorphisms and Rheumatic Heart Disease in South Indian Population. Fetal Pediatr Pathol. 2018;37(5):309-18. doi:10.1080/15513815.2018.1494232.
14. Abdallah AM, Alnuzha A, Al-Mazroea AH, et al. IL10 Promoter Polymorphisms are Associated with Rheumatic Heart Disease in Saudi Arabian Patients. Pediatr Cardiol. 2016;37(1):99-105. doi:10.1007/s00246-015-1245-y.
15. Петров В.С., Смирнова Е.А. Роль полиморфизма генов ADRB1 у исследуемых с хронической ревматической болезнью сердца. Проблемы социальной гигиены, здравоохранения и истории медицины. 2019;27(6):962-6. doi:10.32687/0869-866X-2019-27-6-962-966.
16. Петров В.С. Влияние полиморфизма генов некоторых цитокинов на эхокардиографические показатели пациентов с хронической ревматической болезнью сердца. Российский кардиологический журнал. 2019;(10):42-7. doi:10.15829/1560-4071-2019-10-42-47.
17. Понасенко А.В., Головкин А.С., Шабалдин А.В. и др. Особенности распределения частот интронных полиморфизмов IL1-raVNTR И IL-4VNTR при ревматических пороках митрального клапана сердца у европеоидов сибири. Медицинская иммунология. 2015;17(2):151-8. doi:10.15789/1563-0625-2015-2-151-158.
18. Faé KC, Palacios SA, Nogueira LG, et al. CXCL9/Mig mediates T cells recruitment to valvular tissue lesions of chronic rheumatic heart disease patients. Inflammation. 2013;36(4):800-11. doi:10.1007/s10753-013-9606-2.
19. Tormin JPAS, Nascimento BR, Sable CA, et al. Cytokine gene functional polymorphisms and phenotypic expression as predictors of evolution from latent to clinical rheumatic heart disease. Cytokine. 2021;138:155370. doi:10.1016/j.cyto.2020.155370.
Об авторах
А. В. СиницкаяРоссия
Синицкая Анна Викторовна — кандидат биологических наук, научный сотрудник лаборатории геномной медицины отдела экспериментальной медицины
Кемерово
М. В. Хуторная
Россия
Хуторная Мария Владимировна — младший научный сотрудник лаборатории геномной медицины отдела экспериментальной медицины
Кемерово
М. Ю. Синицкий
Россия
Синицкий Максим Юрьевич — кандидат биологических наук, старший научный сотрудник лаборатории геномной медицины отдела экспериментальной медицины
Кемерово
О. Н. Хрячкова
Хрячкова Оксана Николаевна — кандидат биологических наук, младший научный сотрудник лаборатории геномной медицины отдела экспериментальной медицины
Кемерово
М. А. Асанов
Асанов Максим Айдарович — младший научный сотрудник лаборатории геномной медицины отдела экспериментальной медицины
Кемерово
А. В. Понасенко
Понасенко Анастасия Валериевна — кандидат медицинских наук, заведующий лабораторией геномной медицины отдела экспериментальной медицины
Кемерово
Дополнительные файлы
Рецензия
Для цитирования:
Синицкая А.В., Хуторная М.В., Синицкий М.Ю., Хрячкова О.Н., Асанов М.А., Понасенко А.В. Полиморфизм генов воспалительного ответа в патогенезе ревматической болезни сердца. Российский кардиологический журнал. 2022;27(10):5197. https://doi.org/10.15829/1560-4071-2022-5197
For citation:
Sinitskaya A.V., Khutornaya M.V., Sinitsky M.Yu., Khryachkova O.N., Asanov M.A., Ponasenko A.V. Polymorphism of inflammatory system genes in the pathogenesis of rheumatic heart disease. Russian Journal of Cardiology. 2022;27(10):5197. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5197

















































