Перейти к:
Воздействие на автономную регуляцию сердечно-сосудистой системы как стратегическое направление лечения артериальной гипертензии, нарушений ритма и сердечной недостаточности
https://doi.org/10.15829/1560-4071-2022-5195
Аннотация
Сердечно-сосудистые заболевания широко распространены и являются ведущей причиной смертности населения в большинстве стран мира, несмотря на создание и совершенствование стратегий снижения сердечно-сосудистого риска. Существенная роль в развитии и эволюции сердечно-сосудистых заболеваний принадлежит повышенной активности симпатической нервной системы, поэтому методы воздействия на нее являются актуальными для профилактики и терапии кардиоваскулярной патологии. В статье рассмотрены современные подходы к интервенционной и медикаментозной регуляции автономной нервной системы и нейромодуляции в профилактике и лечении артериальной гипертензии, хронической сердечной недостаточности, тахиаритмий, и отражено консолидированное экспертное мнение по данным вопросам.
Ключевые слова
Для цитирования:
Шляхто Е.В., Конради А.О., Звартау Н.Э., Недогода С.В., Лопатин Ю.М., Ситникова М.Ю., Михайлов Е.Н., Баранова Е.И., Галявич А.С., Дупляков Д.В., Саласюк А.С., Галагудза М.М. Воздействие на автономную регуляцию сердечно-сосудистой системы как стратегическое направление лечения артериальной гипертензии, нарушений ритма и сердечной недостаточности. Российский кардиологический журнал. 2022;27(9):5195. https://doi.org/10.15829/1560-4071-2022-5195
For citation:
Shlyakhto E.V., Konradi A.O., Zvartau N.E., Nedogoda S.V., Lopatin Yu.M., Sitnikova M.Yu., Mikhailov E.N., Baranova E.I., Galyavich A.S., Duplyakov D.V., Salasyuk A.S., Galagudza M.M. Influence on the autonomic cardiovascular system regulation in the treatment of hypertension, arrhythmias and heart failure. Russian Journal of Cardiology. 2022;27(9):5195. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5195
Сердечно-сосудистые заболевания (ССЗ) попрежнему остаются ведущей причиной смертности населения в большинстве стран мира [1]. В 2010г в мире зарегистрировано 1,39 млрд пациентов с артериальной гипертензией (АГ), что составляло 31,1% взрослого населения Земли [2]. Сердечной недостаточностью (СН) страдают, по данным за 2020г, ~64 млн пациентов, таким образом, распространенность заболевания составляет 8,52 случаев на 1 тыс. населения [3]. При этом, несмотря на разработку и совершенствование стратегий коррекции сердечнососудистого риска, заболеваемость и смертность от болезней системы кровообращения в Российской Федерации остается крайне высокой.
Больные ССЗ представляют собой крайне гетерогенную группу пациентов, которая так или иначе укладывается в концепцию сердечно-сосудистого континуума. Механизмы развития АГ и СН достаточно многообразны и тесно переплетены между собой. Нарушение гуморальной регуляции, эндотелиальная дисфункция, экзогенные влияния, нейрогенная дисфункция и другие важные аспекты составляют основы патогенеза большинства болезней системы кровообращения [4-6]. К настоящему времени международное научное сообщество признало существенную роль симпатической нервной системы (СНС) и автономной дизрегуляции в развитии и эволюции ССЗ. В то же время роль автономной нервной системы и регуляции ее активности с целью терапии ССЗ требует детального экспертного обсуждения. В связи с этим ведущие эксперты России в области терапевтической и интервенционной кардиологии приняли участие в экспертном совете, посвященном этому вопросу. Данная статья является суммацией сделанных докладов, проведенной дискуссии и сформулированных выводов.
Артериальная гипертензия
Роль СНС в патогенезе гипертензии
О повышенной активности СНС у пациентов с АГ известно очень давно. Классические исследования показали, что у пациентов с АГ повышена концентрация норадреналина (НА), при этом наибольшее повышение показателя по сравнению со здоровыми добровольцами отмечено в сердце и почках [7]. В дальнейшем была показана генетическая предрасположенность к гиперсимпатикотонии: у здоровых лиц с отягощенным семейным анамнезом по АГ общий уровень НА повышен по сравнению со здоровыми добровольцами, у которых нет семейной истории повышения артериального давления (АД) [8].
Длительная активация СНС приводит к четырем группам последствий, каждая из которых имеет отношение к становлению и прогрессированию АГ и неизменно вовлекает ренин-ангиотензин-альдостероновую систему (РААС) [9].
1. Гемодинамические эффекты в виде увеличения частоты сердечных сокращений (ЧСС) и вазоконстрикции;
2. Метаболические эффекты в виде формирования инсулинорезистентности, гиперинсулинемии и развития нарушений липидного обмена;
3. Трофические эффекты в виде индукции и дальнейшей стимуляции сердечно-сосудистого ремоделирования, а также эндотелиальной дисфункции;
4. Изменения коагуляции, включающие повышение гематокрита, активацию тромбоцитов, прокоагуляционное действие [9, 10].
Гиперактивность СНС также является спутником ожирения [11]. Патогенез АГ при ожирении сложен, при этом одной из ведущих составляющих является гиперактивность СНС. Основные факторы, продуцируемые жировой тканью, имеющие тесную связь с повышением АД (лептин, свободные жирные кислоты, инсулин), и способствуют активации СНС [11].
Одной из существенных внешних причин повышения активности СНС при АГ является хронический стресс [10]. Однократный стрессорный стимул приводит к повышению объема циркулирующей крови и сердечного выброса, что приводит к увеличению сосудистого сопротивления и подъему уровня АД [11]. Гипертоническая реакция на прессорные раздражители, как и многие другие физиологические и поведенческие адаптации, может стать сенсибилизированной к определенным раздражителям. Исследования на животных моделях показывают, что подобно другим системам ответа, контролируемым мозгом, сенсибилизация гипертонической реакции опосредуется нейропластичностью. Совокупность нейронных связей, участвующих в формировании сенсибилизации гипертонического ответа, контролирует СНС [12]. Механизмы нейропластичности в зонах центральной нервной системы, контролирующих симпатическую регуляцию, приводят к закреплению механизмов регуляции кровообращения на фоне повторяющегося стресса. Помимо этого, хронический стресс стимулирует активацию РААС [13].
В последние 10 лет появляются сообщения о роли иммунной системы и воспалительных процессов в развитии АГ. Воспаление и окислительный стресс приводят к повышению активности иммунокомпетентных клеток, стимулируя хроническое воспаление, гипертрофию сосудистой стенки и вазоконстрикцию, а также задержку воды и электролитов. В результате возможно развитие или ухудшение течения имеющейся у пациента АГ [14, 15]. Кроме того, повышение активности СНС, в свою очередь, может вызывать усиление продукции провоспалительных цитокинов [16].
Обнаружен ряд механизмов, свидетельствующих о вовлечении активности каротидных телец в патогенез АГ. Каротидные тельца представляют собой группы хеморецепторных клеток, которые реагируют на изменения химического состава крови. Например, потребление пищи с высоким содержанием калорий и ожирение ассоциированы с хроническим субклиническим воспалением, повышением концентрации продуктов окисления и инсулина, которые вызывают гиперстимуляцию каротидных телец. Сигнал от каротидных телец приводит к активации СНС и запуску механизмов развития АГ, а также инсулинорезистентности [17, 18].
Таким образом, автономная нервная система играет одну из ведущих ролей в реализации стойкого повышения АД и развитии сердечно-сосудистого ремоделирования. Соответственно, коррекция повышенного тонуса СНС является одной из перспективных патогенетических стратегий для лечения АГ, в особенности больных с ожирением, метаболическим синдромом (МС) или сахарным диабетом (СД).
Подходы к нейромодуляции при АГ
Достижение необходимой нейромодуляции возможно при помощи различных вмешательств, эффективность которых определяется особенностями различных состояний (табл. 1).
Таблица 1
Эффективные методы снижения активности СНС при различных состояниях
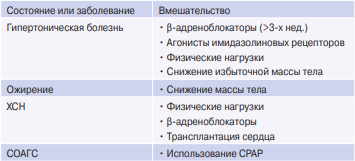
Сокращения: СОАГС — синдром обструктивного апноэ/гипопноэ во сне, ХСН — хроническая сердечная недостаточность, CPAP — искусственная вентиляция лёгких с постоянным положительным давлением (continuous positive airway pressure).
Показано, что физические нагрузки и снижение массы тела, но не диета с ограничением поваренной соли позволяют достичь стойкого снижения активности СНС у пациентов с АГ (рис. 1) [19].
В плацебо-контролируемом исследовании продемонстрировано, что у пациентов с АГ прием моксонидина в дозе 0,4 мг приводил к уменьшению активности мышечного симпатического нерва по сравнению с показателем, который получили на фоне приема плацебо, при этом межгрупповое различие составляло ~40% (p<0,02). В том же исследовании авторы показали, что на фоне снижения тонуса СНС отмечалось снижение ЧСС. Помимо этого, на фоне приема моксонидина наблюдалось уменьшение концентрации НА в плазме крови [20].
У пациентов с ожирением или МС агонисты имидазолиновых рецепторов (АИР) способны оказывать плейотропный эффект. В открытом рандомизироваванном исследовании пациенты с АГ и ожирением получали моксонидин в дозе 0,2 мг/сут. или амлодипин в дозе 5 мг/сут. на протяжении 24 нед. Исходно и после завершения лечения оценивали содержание НА в плазме крови, уровень инсулина натощак и лептина в плазме (рис. 2) [21].
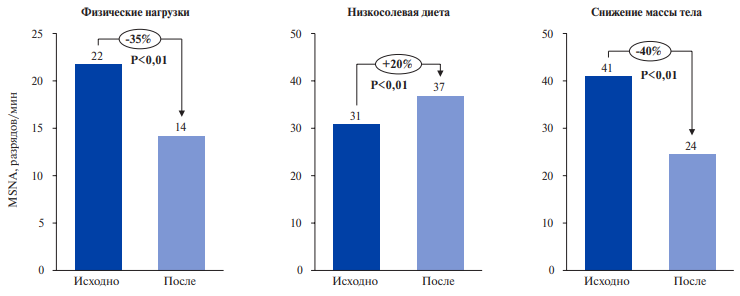
Рис. 1. Влияние нефармакологических вмешательства на активность СНС у пациентов с АГ [19].
Сокращение: MNSA — активность мышечного симпатического нерва, разрядов/мин.
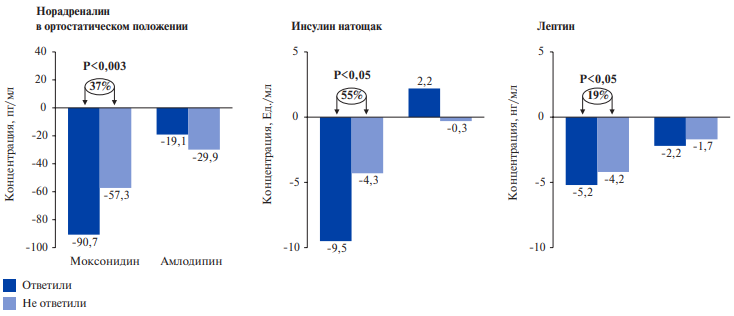
Рис. 2. Изменение уровня НА, инсулина и лептина в плазме крови пациентов с АГ и ожирением, которые получали моксонидин в дозе 0,2 мг/сут. или амлодипин в дозе 5 мг/сут. на протяжении 24 нед. [21].
Терапия моксонидином приводила не только к значительному снижению концентрации НА в плазме крови, но и к уменьшению концентрации инсулина натощак и лептина.
Значимыми исследованиями, подтверждающими и расширяющими данные о влиянии моксонидина на инсулинорезистентность, являются исследования российских ученых под руководством акад. В.А. Алмазова (2000; 2006). В пилотном исследовании [22] было показано, что у пациентов с легкой или умеренной АГ моксонидин снижал уровень инсулина после нагрузки глюкозой аналогично контрольной группе пациентов, получавших метформин [22]. Однако у больных, принимавших метформин, в отличие от группы моксонидина имелась нарушенная толерантность к глюкозе. Поэтому важно было сравнить препараты в сопоставимых группах. На основе этих данных было спланировано и проведено двойное слепое исследование ALMAZ по сравнительной оценке влияния моксонидина и метформина на гликемический контроль у пациентов с избыточной массой тела, мягкой АГ, резистентностью к инсулину и нарушением толерантности к глюкозе или бессимптомным СД, в лечении которого применялась только диета [23]. Исследование было рандомизированным проспективным открытым многоцентровым в параллельных группах со слепой оценкой конечных точек (PROBE-дизайн). Пациенты были разделены на группу моксонидина в суточной дозе 0,4 мг и метформина в дозе 1000 мг/сут., в которых продолжительность терапии составила 16 нед. Популяцию "intention-to-treat" сформировали 193 пациента, "per protocol" — 175 человек. В отношении первичной конечной точки — средней площади под фармакокинетической кривой (AUC) для инсулина было установлено различие между группами: моксонидин статистически значимо снижал AUC инсулина по сравнению с исходным уровнем в популяции "per protocol" (p=0,025); для метформина влияние было небольшим. Статистически значимое различие между группами моксонидина и метформина составило 16,2% (95% доверительный интервал: 0,1-35,0). Изменение средней AUC инсулина было наиболее выражено в подгруппе пациентов с повышенной симпатической активностью (ЧСС >80 уд./ мин). Средние уровни глюкозы в плазме крови натощак и уровни HbA1c практически не изменялись при лечении моксонидином, но значительно снижались при лечении метформином. В итоге как моксонидин, так и метформин значимо повышали индекс чувствительности к инсулину Matsuda: метформин преимущественно за счет влияния на уровень глюкозы, моксонидин в основном за счет снижения концентрации инсулина [23]. В дальнейшем в ряде российских исследований кроме антигипертензивного действия моксонидина как в моно-, так и в комбинированной терапии было доказано положительное влияние на чувствительность к инсулину у пациентов с АГ и метаболическими нарушениями.
В исследовании у женщин в постменопаузе с АГ и МС при достижении нормальных уровней АД через 3 мес. терапии моксонидином наблюдалось повышение функциональной активности β-клеток поджелудочной железы, о чем свидетельствует увеличение индекса НОМА-FB, регистрировалось уменьшение массы тела и индекса массы тела (ИМТ), увеличение уровня липопротеидов высокой плотности [24]. Кроме этого, выявлено уменьшение диаметра и объема левого предсердия (ЛП) и улучшение диастолической функции левого желудочка (ЛЖ) [24].
В открытом последовательном с титрованием доз исследовании у пациентов с АГ и СД 2 типа, терапия которого сохранялась неизменной на протяжении всего исследования, на фоне 16-нед. лечения моксонидином в дозах 0,2-0,6 мг/сут., в зависимости от контроля АД, зарегистрировано снижение величин клинического и суточного АД, нормализация вариабельности систолического и диастолического АД, увеличение пациентов с профилем "dipper" с 33,3% до 64,2% [25]. За время терапии значимо снизился уровень гликемии натощак (∆=-0,69; р<0,05), а также постпрандиальный уровень глюкозы (∆=-0,4; р<0,05) и уровень гликированного гемоглобина на 9,8% (∆=-0,73; р<0,02). Произошло снижение уровня иммуннореактивного инсулина натощак на 29,4% (∆=-6,58; р<0,001), который нормализовался у 66,6% пациентов с исходной базальной гиперинсулинемией. Уровень иммуннореактивного инсулина через 2 часа после завтрака снизился у 39,3% больных с исходной постпрандиальной гиперинсулинемией (∆=-11,85; р<0,001). Индекс НОМА-IR (homeostasis model assessment of insulin resistance) уменьшился на 2,9 (р<0,001) за время терапии, что составило -39,4%. Зарегистрирована положительная динамика липидного спектра: снижение общего холестерина, липопротеидов низкой и очень низкой плотности, триглицеридов, апо-В-белка и повышение липопротеидов высокой плотности [25].
В рандомизированном проспективном открытом исследовании у пациентов с АГ и предиабетом показано преимущество комбинированной терапии периндоприлом, моксонидином и метформином перед терапией периндоприлом, индапамидом SR и метформином в отношении показателей суточного контроля АД, ангиопротективного действия, снижения индекса НОМА-IR и инсулина плазмы натощак [26].
Была проведена оценка эффективности применения нефиксированной комбинации моксонидина и периндоприла для достижения целевых уровней АД у пациентов с АГ и МС, у которых предшествующая двойная антигипертензивная терапия (АГТ) не позволила достичь целевых уровней АД [27]. Исходная двойная АГТ фиксированными и нефиксированными комбинациями была представлена: ингибитор ангиотензинпревращающего фермента (иАПФ) + антагонист кальция (12,5% пациентов); иАПФ + диуретик (30,6%); блокатор рецепторов к ангиотензину II (БРА) + антагонист кальция (18,1%); БРА + диуретик (20,8%); иАПФ + β-адреноблокатор (β-АБ) (5,5%); БРА + β-АБ (12,5%). В исследование включили 72 пациента в возрасте от 18 до 70 лет с АГ 1-2 степени, скоростью пульсовой волны >10 м/с и ИМТ >30 кг/м2. Срок наблюдения составил 24 нед. Неэффективная предшествующая АГТ была заменена на периндоприл в дозе 10 мг/сут. и моксонидин в стартовой дозе 0,4 мг/сут. При достижении целевых уровней АД после 4 нед. вводного периода дозы препаратов не меняли, а больным с АД >130/80 мм рт.ст. дозу моксонидина увеличивали до 0,6 мг/сут. Целевой уровень АД <130/80 мм рт.ст. к 24-й нед. терапии в подгруппе терапии моксонидин 0,4 мг + периндоприл 10 мг зафиксирован у 64,7% пациентов, в подгруппе терапии моксонидин 0,6 мг + периндоприл 10 мг — у 63,6% [27]. Изменение уровня АД сопровождалось существенным снижением НА на 10,8 и 17,6%; дофамина на 14,6 и 14,0%; уровня лептина на 18,0 и 6,7%, индекса НОМА-IR на 7,7 и 4,8%; мочевой кислоты крови на 15,2 и 14,9%, соответственно (p<0,05). Кроме этого, выявлено снижение общего холестерина сыворотки и мочевой кислоты. Динамика метаболических показателей отражена на рисунке 3 [27]. Авторы сделали вывод, что нефиксированная комбинация периндоприл + моксонидин обладает преимуществами перед другими двухкомпонентными комбинациями при АГ и МС в достижении целевого АД, снижении инсулинорезистентности и гиперсимпатикотонии [27].
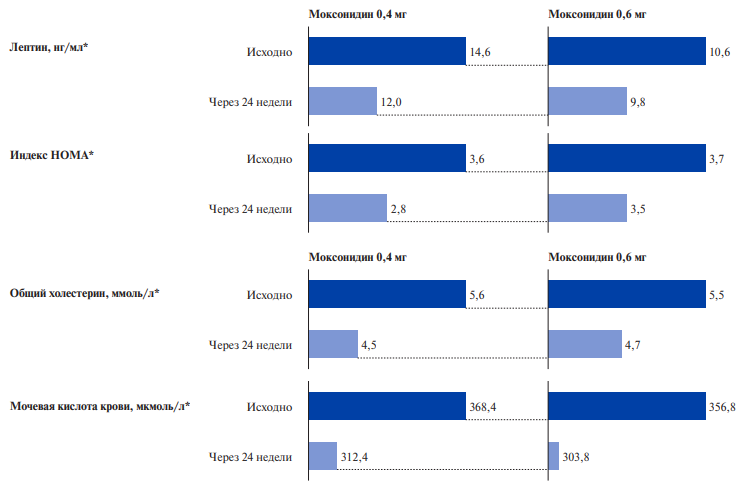
Рис. 3. Динамика метаболических показателей к 24-й нед. терапии у больных с АГ исследуемых групп и МС [27].
Примечание: * — р для всех сравнений с исходными значениями <0,05.
Второй частью работы явилась оценка возможности нефиксированной комбинации периндоприл + моксонидин в достижении дополнительной ангиопротекции у пациентов с АГ и МС, не достигших целевого АД на фоне предшествующей комбинированной двухкомпонентной АГТ [28]. После перевода пациентов на нефиксированную комбинацию периндоприл + моксонидин 0,4 мг или 0,6 мг/сут. отмечено уменьшение скорости пульсовой волны на 25,1% и 22,8%, индекса аугментации — на 17,1% и 15,2% (p<0,05 для всех показателей). Кроме этого, определялся сосудистый возраст с использованием показателей шкалы SCORE [29], который уменьшился в группах на 8,3 года и 7,6 года, соответственно (р<0,05). Авторы исследования расценили влияние моксонидина на показатели жесткости сосудистой стенки и центрального АД как проявление симпатолитического эффекта препарата, уменьшения ЧСС и АД. С другой стороны, уменьшая инсулинорезистентность, моксонидин подавляет активность митоген-активируемой протеинкиназы и как результат пролиферацию гладкомышечных клеток сосудов, а также тормозит индуцированное инсулинорезистентностью ускоренное укорочение теломер в стволовых клетках, препятствуя преждевременному старению сосудов [28]. Было доказано, что у пациенток в постменопаузе с АГ и остеопенией наблюдается повышение активности фермента теломеразы на фоне терапии моксонидином в течение 12 мес. [30].
Результаты исследований с применением моксонидина указывают на его эффективность для терапии АГ в особенности у пациентов с сопутствующими ожирением, МС, предиабетом, СД, в постменопаузе. Препарат неоднократно изучался с точки зрения эффективности на больших группах в рутинной практике. В постмаркетинговом наблюдательном исследовании CAMUS показано, что на фоне применения моксонидина как в моно-, так и в комбинированной терапии (73%) у 4005 пациентов с АГ, избыточной массой тела/ожирением и/или МС в течение 8 нед. происходил контроль АД, также уменьшение массы тела в среднем на 1,4±2,9 кг; ИМТ — на 0,5±1,0 кг/м2. Выраженность снижения веса напрямую зависела от ИМТ. Наибольшее снижение массы тела отмечено у больных с ожирением 3 степени [31].
Другое международное открытое наблюдательное исследование MERSY (2013) продемонстрировало снижение АД на 24,5±14,3/12,6±9,1 мм рт.ст. на фоне терапии моксонидином в виде моно- и комбинированной АГТ в течение 6 мес. у пациентов с АГ и МС [32]. Также отмечалось уменьшение веса тела на 2,1±5,4 кг и ИМТ на — 0,7±2,0 кг/м2; уровня глюкозы натощак и триглицеридов сыворотки крови [32].
В 2020г опубликованы результаты исследования STRAIGHT, в рамках которого специалисты из 7 стран, в т.ч. из России, заполнили опросники об использовании препаратов центрального действия в условиях рутинной практики. В опросе принял участие 281 специалист, из которых 125 — врачи из России. Большинство врачей в России назначали в своей практике препараты центрального действия (97%), в других странах доля положительных ответов составила лишь 49%. Более 90% респондентов в качестве факторов для назначения АИР учитывали сердечно-сосудистый риск, наличие СД, ожирения, нарушения почечной функции; более половины врачей считали необходимым принимать во внимание синдром обструктивного апноэ/гипопноэ во сне [33]. Врачи из России, как и специалисты из других стран, чаще использовали препараты центрального действия в качестве 3-й линии терапии (65% в России и 60% в других странах), при этом препараты назначали в комбинации с иАПФ (55%), в других странах — с БРА (54%). Вместе с тем в России чаще, чем в других странах, использовали препараты центрального действия в качестве первой (15 vs 5%, соответственно) или второй (48 vs 21%, соответственно) линии терапии [34]. Таким образом, врачи России чаще и на более ранних этапах назначали данный класс препаратов для лечения АГ [34]. Антигипертензивная эффективность (в т.ч. при резистентной АГ) и метаболические эффекты были отмечены как основные преимущества терапии. Указанный подход к выбору групп для назначения центральных препаратов, в т.ч. моксонидина, в реальной практике соответствует экспертным рекомендациям [35].
На основании результатов контролируемых исследований и анализа данных рутинной практики можно сделать вывод о дополнительных позитивных эффектах антигипертензивных препаратов центрального действия. Вместе с тем применение данной группы препаратов требует изучения в плане влияния на конечные точки. Важной тенденцией последних лет в медицине является использование для принятия решений не только результатов клинических исследований, но и доказательств, полученных в реальной практике [36]. Исследования в условиях рутинной практики позволят получить данные о влиянии антигипертензивных препаратов центрального действия, обладающих модулирующим влиянием на симпатическую активность, на такие жесткие конечные точки, как частота нефатальных инфарктов миокарда, реваскуляризаций, инсультов, сердечно-сосудистой и общей смертности в реальной популяции, не ограниченной жесткими критериями включения. Помимо этого, данные реальной практики позволят выполнить анализ влияния терапии препаратами центрального действия на фармакоэкономические показатели, необходимые для принятия решений регуляторам и организаторам здравоохранения [37]. Также важно получить дополнительные данные об эффективности, безопасности, риске развития СД и фибрилляции предсердий (ФП) на фоне приема препаратов центрального действия, в т.ч. моксонидина.
Воздействие на симпатические нервы получило широкое распространение в качестве методов инвазивного лечения резистентной АГ. Так, в частности во многих странах широко используется методика ренальной денервации, которая, несмотря на противоречивость данных рандомизированных исследований, становится все более популярной и имеет множество современных модификаций [38]. Более того, предлагается параллельная денервация почек и печени для получения дополнительного метаболического эффекта у пациентов с ожирением [39]. Стимуляция вагуса и каротидного синуса при помощи имплантируемых устройств также активно применяется в некоторых странах [40] с определёнными ограничениями в виде высокой стоимости метода и потенциальными побочными эффектами.
Сердечная недостаточность
Автономная регуляция при СН
Высокая активность СНС у пациентов с СН считается традиционным механизмом компенсации и патогенетическим звеном хронической СН (ХСН). Так, в конце прошлого века было доказано, что у больных с СН повышены плазменные концентрации НА, а также содержание катехоламинов в миокарде [41, 42]. У пациентов с СН наблюдается down-регуляция β1-адренорецепторов миокарда. Уменьшение плотности рецепторов происходит на фоне избыточной симпатической стимуляции [43]. Наличие СН также связано со снижением вариабельности ритма и снижением чувствительности барорефлекса, которое тоже связывают с избыточной активностью СНС [44]. Необходимо отметить, что у пациентов с СН активация СНС тем выше, чем ниже фракция выброса (ФВ) ЛЖ [45].
Применение нейромодуляции у пациентов с СН
Применение медикаментозной нейромодуляции является самым привлекательном подходом в лечении ХСН, что отчетливо показано в отношении β-АБ. Большие надежды возлагались также в этом отношении на центральные препараты. В доклинических исследованиях у крыс с экспериментальной СН введение моксонидина приводило к дозозависимым эффектам: увеличению ФВ ЛЖ, уменьшению выраженности воспаления и апоптоза в миокарде, и, что очень важно — благоприятным изменениям структуры миокарда [46]. В исследовании на сольчувствительных крысах породы Dahl, которые получали 8% хлорид натрия с 7-нед. возраста, вследствие чего у них в возрасте 13 нед. развивалась АГ с гипертрофией миокарда и выраженной СН, применение моксонидина увеличивало общую выживаемость животных на фоне уменьшения ЧСС и АД [47]. Кроме этого, происходило уменьшение массы миокарда ЛЖ, периваскулярного и миокардиального интерстициального фиброза, также улучшение структуры миокарда было представлено еще и уменьшением соотношения коллагена типа I/III [47]. При этом было выполнено лишь одно крупное исследование применения моксонидина для лечения ХСН у человека. У пациентов с ХСН II-IV функционального класса (ФК) по NYHA и ФВ ЛЖ ≤35% без АГ изучалось применение моксонидина замедленного высвобождения в дозе 1,5 мг 2 раза/сут. в рамках рандомизированного двойного слепого плацебо-контролируемого исследования [48]. Доза препарата титровалась в четыре этапа: от стартовой и до 3 мг в сут. с временным промежутком в 1-2 нед. [48]. Первоначальный протокол исключал терапию β-АБ, но позже она была разрешена после того, как в клинических исследованиях уже была продемонстрирована эффективность карведилола, бисопролола и метопролола [48]. Исследование закончилось досрочно из-за увеличения смертности и нежелательных явлений в группе моксонидина. Авторы отметили, что досрочное прекращение исследования не позволило сделать выводы относительно долгосрочных эффектов ингибирования центральной нервной системы при ХСН [48]. С точки зрения современных знаний очевидно, что исследование имело существенные недостатки дизайна: высокая доза препарата, которая в 10 раз больше применяемой для терапии АГ в настоящее время; быстрое принудительное титрование; совместное применение с β-АБ. Данное воздействие, вероятно, привело к срыву ауторегуляции у пациентов со сниженной ФВ ЛЖ. К сожалению, неудача первого исследования надолго отодвинула попытки применения центральных препаратов для лечения ХСН, несмотря на всю критику дизайна данного протокола. На сегодняшний день, среди пациентов с СН превалируют больные с сохранной ФВ (СНсФВ) ЛЖ [49]. Cohen, et al. (2020) показали, что среди больных СНсФВ можно выделить фенотип пациентов с ожирением и другими метаболическим нарушениями [50]. Эксперты предположили, что наиболее перспективной фармакологическая нейромодуляция с использованием АИР станет именно для пациентов с СНсФВ и ожирением, что требует проведения соответствующих исследований.
Другим подходом к нейромодуляции при СН является использование нефармакологических и/или инвазивных методик. Нефармакологическая нейромодулирующая терапия для восстановления симпатовагального баланса при СН вызывает в последние годы все больший интерес. Новые методы лечения в этой области включают стимуляцию блуждающего нерва, стимуляцию спинного мозга, электрическую активацию барорефлекса, денервацию почечных артерий, эктомию звездчатого ганглия, блокаду висцерального нерва и другие.
Эффекты применения большинства перечисленных методик воздействия были изучены в многоцентровых рандомизированных клинических исследованиях. Однако результаты некоторых из них не подтвердили позитивные предпосылки пилотных экспериментов и ранних клинических испытаний (табл. 2).
Таблица 2
Рандомизированные клинические исследования методов инвазивной нейромодуляции при СН
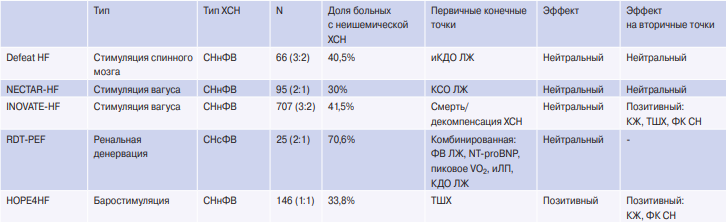
Сокращения: иКДО — индекс конечно-диастолического объема, иЛП — индекс объема левого предсердия, КДО — конечно-диастолический объем, КЖ — качество жизни, КСО — конечно-систолический объем, ЛЖ — левый желудочек, СН — сердечная недостаточность, СНнФВ — сердечная недостаточность с низкой фракцией выброса, СНсФВ — сердечная недостаточность с сохранной фракцией выброса, ТШХ — дистанция прохождения при тесте шестиминутной ходьбы, ФВ — фракция выброса, ФК — функциональный класс, ХСН — хроническая сердечная недостаточность, NT-proBNP — N-терминальный промозговой натрийуретический пептид.
Так, в первых клинических исследованиях эпидуральной стимуляции спинного мозга отмечалось улучшение функционального статуса пациентов, систолической функции ЛЖ, наряду с положительным изменением других эхокардиографических параметров [51]. Однако в многоцентровом исследовании Defeat HF не было выявлено влияния стимуляции спинного мозга на первичную конечную точку — индекс конечно-диастолического объема ЛЖ, у пациентов с СН со сниженной ФВ ЛЖ, равно как и на вторичные конечные точки, включающие ФВ ЛЖ, ФК СН и другие [52].
В исследовании NECTAR-HF изучалась потенциальная роль инвазивной стимуляции блуждающего нерва в коррекции конечно-систолического объема ЛЖ у пациентов с систолической дисфункцией ЛЖ, однако результаты оказались нейтральными, в т.ч. в отношении вторичных конечных точек [53]. В то же время в исследовании INOVATE-HF, включившем 707 пациентов, оценивавшем влияние стимуляции блуждающего нерва на смертность и частоту декомпенсаций СН, не было получено положительных результатов [54]. Тем не менее было отмечено положительное влияние подхода на качество жизни пациентов, дистанцию прохождения при тесте шестиминутной ходьбы, ФК СН.
Инвазивная стимуляция барорецепторов у пациентов с систолической дисфункцией ЛЖ изучалась в исследовании HOPE4HF, в которое было включено 146 пациентов, при этом отмечалось положительное влияние баростимуляции на основные оцениваемые параметры — дистанцию прохождения при тесте шестиминутной ходьбы, а также вторичные конечные точки — качество жизни и ФК СН [55].
Также у пациентов с СНсФВ ЛЖ изучалась роль ренальной денервации в лечении пациентов; первичная конечная точка исследования включала комбинацию следующих параметров: ФВ ЛЖ, уровень N-концевого натрийуретического пептида, пиковое потребление кислорода при кардиореспираторном тесте, индекс объема ЛП, конечно-диастолический объем ЛЖ. В исследование было включено всего 25 пациентов, рандомизированных в соотношении 2:1 в группу ренальной денервации и группу контроля, однако не было выявлено изменений исследуемых параметров [56].
Неинвазивные методы нейромодуляции являются привлекательными с той позиции, что для их применения нет необходимости имплантации электродов и устройств для проведения лечебного воздействия. Чрескожная нервная стимуляция в течение многих лет применяется в неврологии и анестезиологии. В исследованиях физиологов показано, что одна из ветвей блуждающего нерва иннервирует козелок уха, а электрическая чрескожная ушная стимуляция приводит к активации ветки нерва и последовательно эфферентной активации парасимпатических нервных волокон [57]. Роль чрескожной активации парасимпатических волокон блуждающего нерва с помощью подобной элегантной методики изучалась в лечении пациентов с СН с систолической дисфункцией ЛЖ [58]. В группе пациентов из 63 человек проводилась стимуляция, в то время как в группе контроля из 7 пациентов накладывались такие же электроды, но периодическая стимуляция не активировалась. Был выявлен значительный прирост дистанции прохождения при тесте шестиминутной ходьбы в группе стимуляции.
Другим перспективным методом воздействия на автономную нервную систему при ХСН является блокада висцерального нерва. Чрескожная блокада висцерального нерва вызывает депонирование крови в венах брюшной полости. Перераспределение объема крови происходит в течение десятков секунд. В некоторых случаях это позволяет снизить преи постнагрузку на ЛЖ, что сопровождается быстрым повышением АД, в среднем на 10 мм рт.ст., и способствует компенсации состояния пациента с острой СН на короткое время [59]. В пилотном исследовании у пациентов с ХСН показано, что блокада висцерального нерва позволяет изменить периферическое сосудистое сопротивление в положении лежа с нагрузкой в виде поднятия нижних конечностей, что на короткое время способствует повышению сердечного индекса. Длительные эффекты данного подхода и его роль в хронотерапии пока неизвестны [60].
Еще один метод неинвазивной нейромодуляции, изучаемый у пациентов с ХСН, — чрескожная стимуляция спинного мозга. Изначально, высокочастотная модулированная чрескожная электрическая стимуляция спинного мозга была разработана для комплексной реабилитации пациентов с травмой спинного мозга. Однако недавно было показано, что такая стимуляция у относительно здоровых лиц приводит к изменению параметров гемодинамики. У пациентов без структурных заболеваний сердца и показаниями к эндокардиальному электрофизиологическому исследованию оценивались инвазивные показатели гемодинамики до, во время и после чрескожной электрической стимуляции спинного мозга [61]. При стимуляции на уровне сегментов спинного мозга Т1 и Т7 отмечалось повышение систолического АД, диастолического АД и укорочение эффективного рефрактерного периода атриовентрикулярного соединения. В настоящее время проводится изучение потенциальной роли чрескожной стимуляции спинного мозга на АД в ортостазе у пациентов с ортостатической недостаточностью, а также возможность стимуляции повышать АД у пациентов с тяжелой СН на фоне комбинированной медикаментозной терапии.
Тахиаритмии
В патогенезе тахиаритмий выделяют три основных фактора, сочетание которых приводит к индукции и поддержанию тахикардии: электрофизиологический субстрат неоднородного проведения в миокарде (за счет анатомических или первичных электрических изменений), модифицирующие факторы возникновения аритмии (дисбаланс автономной нервной системы, растяжение миокарда за счет перегрузки давлением или объемом и другие), а также триггер, запускающий аритмию.
Известно, что антиаритмическая лекарственная терапия оказывает влияние на автономную нервную активность. Например, эффект β-АБ заключается, прежде всего, в подавлении эффектов СНС. В то же
время такие препараты, как лаппаконитина гидробромид и диэтиламинопропионилэтоксикарбониламинофенотиазин, оказывают холинолитический эффект, что нередко сопровождается увеличением частоты синусового ритма. Пропафенон (IC класс, блокатор натриевых каналов) и препараты III класса (соталол и амиодарон) обладают одновременно и бета-адреноблокирующим эффектом.
Дополнительный антиаритмический эффект моксонидина как подавляющего симпатическую нервную активность средства изучался у пациентов с пароксизмальной формой ФП [62], а также после катетерной аблации ФП [63]. Оба рандомизированных исследования показали значимое преимущество лечения моксонидином у лиц с АГ: у лиц с фармакологической терапией уменьшался показатель "нагрузки" ФП (отношение времени нахождения на аритмии ко времени регистрации электрокардиограммы), а также уменьшалась симптоматика ФП; после катетерной изоляции легочных вен моксонидин уменьшал количество рецидивов ФП в сравнении с плацебо. Предполагается, что наблюдаемый эффект не зависит от антигипертензивного действия препарата.
Парадоксально, но в возникновении некоторых форм ФП значимую роль играет чрезмерная активация парасимпатической нервной системы, а иногда — одновременно и симпатического и парасимпатического нервного влияния, что подтверждено во многих экспериментальных исследованиях. Применительно к лечению ФП у пациентов, одним из дополнительных подходов к предупреждению рецидивов аритмии была предложена аблация ганглионарных сплетений предсердий, в большей степени содержащих парасимпатические ганглии [64]. При этом катетерная аблация ганглионарных сплетений ЛП предлагалась в качестве самостоятельного метода лечения ФП [65] или в дополнение к катетерной изоляции легочных вен [66]. Однако отдаленные результаты воздействия на ганглионарные сплетения для лечения ФП не оправдали больших надежд [67].
Наряду со снижением парасимпатических влияний, коррекция гиперсимпатикотонии также была предложена в качестве фактора, снижающего вероятность рецидивов ФП после катетерной изоляции легочных вен. Предлагалось выполнение ренальной денервации в дополнение к катетерной изоляции легочных вен, что в одноцентровых исследованиях было ассоциировано как со снижением АД у лиц с гипертензией, так и меньшей частотой возобновления ФП [68]. К сожалению, в недавнем многоцентровом исследовании показаны нейтральные результаты дополнительной ренальной денервации в лечении ФП [69].
Среди неинвазивных подходов к модификации автономной нервной активности для лечения ФП обещающим методом является чрескожная стимуляция ушной ветки блуждающего нерва. Очередной парадокс патофизиологии — афферентная активация вагуса вызывает эфферентную его активацию и приводит к заметным коррекциям электрофизиологических свойств миокарда предсердий, в т.ч. удлинению рефрактерных периодов [70]. В пилотных клинических исследованиях подпороговая периодическая стимуляция козелка уха приводила к снижению количества и длительности ФП у пациентов с пароксизмальной формой аритмии [71].
Для лечения возвратных желудочковых тахикардий при структурных поражениях миокарда >40 лет назад была предложена симпатическая денервация сердца. Впоследствии блокада и резекция левого звездчатого ганглия вошла в стандартные методы лечения часто рецидивирующих желудочковых тахикардий у пациентов с синдромом врожденного удлиненного интервала QT, катехоламинергической полиморфной желудочковой тахикардии [72]. В настоящее время существует несколько способов хирургической резекции звездчатого ганглия, в т.ч. наиболее широко применяемый — торакоскопический. В детской популяции пациентов предложен миниинвазивный "задний" доступ для симпатической денервации — со стороны спины выполняется небольшой разрез, с частичной резекцией поперечного отростка позвонка, что открывает ретроплевральный доступ к паравертебральным симпатическим ганглиям [73]. Фармакологическая блокада звездчатого ганглия остается способом купирования желудочковых тахикардий при электрическом шторме, когда каждая минута дорога для спасения жизни пациента. Эффект блокады звездчатого ганглия определяется по развитию синдрома Горнера (птоз, миоз, энофтальм) на стороне блокады. Вырученное время за счет обратимой блокады ганглия и транзиторного купирования желудочковых тахиаритмий может быть использовано для коррекции антиаритмической терапии, проведения необходимых инвазивных вмешательств.
Симпатическая денервация при рецидивирующих желудочковых тахикардиях является зарекомендовавшим себя методом, результаты представлены в большом количестве публикаций, пилотных и регистровых исследований. Однако масштабные рандомизированные исследования трудно провести ввиду особого контингента пациентов с электрическим штормом. У пациентов с тромбозом полостей левых камер сердца, когда противопоказаны эндокардиальные катетерные вмешательства, а возможности симпатической блокады, спинальной анестезии ограничены ввиду жизненно важной антикоагулянтной терапии, ренальная денервация может являться единственным методом "спасения" пациента [74].
Заключение
По результатам экспертного обсуждения роли СНС и нейромодуляции у пациентов с АГ, СН, тахиаритмиями эксперты сформулировали следующие ключевые позиции и перспективные направления:
- Гиперреактивность СНС играет существенную роль в патогенезе АГ и согласуется с современными теориями развития и прогрессирования АГ. Потенциальные преимущества центрального ингибирования СНС при АГ требуют дальнейших исследований. Согласно международному исследованию STRAIGHT, препараты центрального действия — АИР широко назначаются в России на различных этапах АГТ. Исследование нефиксированной комбинации периндоприл + моксонидин обладает преимуществами перед некоторыми другими двухкомпонентными комбинациями при АГ и МС в достижении целевого АД, подавлении инсулинорезистентности и гиперсимпатикотонии. В лечении резистентной АГ могут применяться методики денервации почечных артерий и стимуляции вагуса, что все еще остается предметом научных исследований, а не рутинной практикой.
- С учетом персонифицированной терапии и индивидуализированного подхода, а также по специальным показаниям у пациентов с АГ и метаболическими нарушениями (МС, абдоминальным ожирением, СД, предиабетом) терапия препаратами центрального действия, в т.ч. АИР (моксонидином), возможна на любом этапе терапии артериальной гипертонии, в т.ч. в комбинации с блокатором РААС и антагонистом кальция; или в комбинации с блокатором РААС и тиазидоподобным/тиазидным диуретиком, т.к. помимо антигипертензивного эффекта моксонидин обладает положительным влиянием на чувствительность клеток к инсулину, показатели липидного спектра, а также имеет органопротективное действие и способствует снижению массы тела.
- Возможность дополнительного медикаментозного воздействия моксонидином на вегетативную нервную систему в условиях современной терапии у пациентов с АГ, имеющих сохраненную ФВ ЛЖ, биохимические и эхокардиографические маркеры СН, является потенциальным объектом исследования, что расширит представления об эффективности и безопасности моксонидина при ХСН.
- Фармакологическая и нефармакологическая нейромодуляция при ХСН может быть более эффективна на ранних стадиях развития заболевания, а также для временной коррекции при декомпенсации ХСН, при лечении нарушений ритма сердца, таких как ФП, желудочковая тахикардия и артериальная гипотензия.
- Положительные результаты получены при применении чрескожной активации блуждающего нерва у пациентов с ХСН, а также при пароксизмальной ФП. В процессе изучения — методы физического воздействия на нервную систему при дисфункции ЛЖ. Перспективными методами являются чрескожная стимуляция спинного мозга при гипотензии и блокада висцерального нерва при декомпенсации ХСН.
- Симпатическая денервация сердца вошла в стандарт лечения пациентов с некоторыми видами жизнеугрожающих аритмий: при врождённом синдроме удлиненного интервала QT, у пациентов с катехоламинергической полиморфной желудочковой тахикардией, в некоторых случаях эффективна при структурных заболеваниях сердца. Ренальная денервация может применяться в комплексном лечении рефрактерных желудочковых тахикардий при структурной патологии сердца и СН.
- Медикаментозная и немедикаментозная модуляция автономной нервной активности, современные методы механической поддержки кровообращения открывают новые перспективы улучшения прогноза у больных с ХСН и дожития до трансплантации сердца в случаях, когда она необходима.
Отношения и деятельность. Совещание экспертов проводилось при поддержке компании ООО "Эбботт Лэбораториз" (2021г).
Список литературы
1. WHO. The top 10 causes of death [Electronic resource]. URL: https://www.who.int/newsroom/fact-sheets/detail/the-top-10-causes-of-death (accessed: 23.08.2021).
2. Mills KT, Stefanescu A, He J. The global epidemiology of hypertension. Nat Rev Nephrol. 2020;16(4):223-37.
3. Lippi G, Sanchis-Gomar F. Global epidemiology and future trends of heart failure: 0. AME Medical Journal. AME Publishing Company. 2020;5(0).
4. Foëx P, Sear J. Hypertension: pathophysiology and treatment. Continuing Education in Anaesthesia Critical Care & Pain. 2004;4(3):71-5.
5. Beevers G, Lip GYH, O’Brien E. The pathophysiology of hypertension. BMJ. 2001;322(7291):912-6.
6. Kemp CD, Conte JV. The pathophysiology of heart failure. Cardiovasc Pathol. 2012;21(5):365-71.
7. Esler M, Jennings G, Lambert G. Noradrenaline release and the pathophysiology of primary human hypertension. Am J Hypertens. 1989;2(3) Pt 2:140S-146S.
8. Ferrier C, Cox H, Esler M. Elevated total body noradrenaline spillover in normotensive members of hypertensive families. Clinical Science. 1993;84(2):225-30.
9. Конради А.О. Взаимодействие между симпатической нервной системой и ренин-ангиотензиновой системой. Роль в повышении артериального давления. Артериальная гипертензия. 2012;18(6):577-83. doi:10.18705/1607-419X-2012-18-6-577-583.
10. Шляхто Е.В., Конради А.О. Причины и последствия активации симпатической нервной системы при артериальной гипертензии. Артериальная гипертензия. 2003;9(3):81-8. doi:10.18705/1607-419X-2003-9-3-81-88.
11. Конради А.О. Ожирение, симпатическая гиперактивность и артериальная гипертензия — есть ли связь? Артериальная гипертензия. 2006;12(2):131-40. doi:10.18705/1607-419X-2006-12-2-131-140.
12. Johnson AK, Xue B. Central nervous system neuroplasticity and the sensitization of hypertension. Nat Rev Nephrol. 2018;14(12):750-66.
13. Marrelli M, Gentile S, Palmieri F, et al. Correlation between Surgeon’s experience, surgery complexity and the alteration of stress related physiological parameters. PLoS One. 2014;9(11):e112444. doi:10.1371/journal.pone.0112444.
14. Trott DW, Harrison DG. The immune system in hypertension. Adv Physiol Educ. 2014;38(1):20-4.
15. Harrison DG. The immune system in hypertension. Trans Am Clin Climatol Assoc. 2014;125:130-8; discussion 138-40.
16. Rodriguez-Iturbe B, Pons H, Johnson RJ. Role of the Immune System in Hypertension. Physiol Rev. 2017;97(3):1127-64.
17. Conde SV, Ribeiro MJ, Melo BF, et al. Insulin resistance: a new consequence of altered carotid body chemoreflex? J Physiol. 2017;595(1):31-41. doi:10.1113/JP271684.
18. Paton JFR. Targeting autonomic imbalance in pathophysiology: is the carotid body the new nirvana? J Physiol. 2017;595(1):29-30.
19. Grassi G. Role of the sympathetic nervous system in human hypertension. J Hypertens. 1998;16(12):1979-87.
20. Wenzel RR, Spieker L, Qui S, et al. I1-imidazoline agonist moxonidine decreases sympathetic nerve activity and blood pressure in hypertensives. Hypertension. 1998;32(6):1022-7. doi:10.1161/01.hyp.32.6.1022.
21. Sanjuliani AF, de Abreu VG, Francischetti EA. Selective imidazoline agonist moxonidine in obese hypertensive patients. Int J Clin Pract. 2006;60(5):621-9.
22. Almazov VA, Shlyakhto EV, Blagosklonnaya YV, et al. Insulin resistance and arterial hypertension. The influence of moxonidine and metformin therapy. Journal of Hypertension. 2000;18:S12.
23. Chazova I, Almazov VA, Shlyakhto E. Moxonidine improves glycaemic control in mildly hypertensive, overweight patients: a comparison with metformin. Diabetes Obes Metab. 2006;8(4):456-65. doi:10.1111/j.1463-1326.2006.00606.x.
24. Чубенко Е.А., Беляева О. Д., Баженова Т.Л. и др. Плейотропные эффекты моксонидина. Артериальная гипертензия. 2010;16(4):351-5.
25. Демидова Т.Ю., Аметов А.С., Смагина Л.В. Моксонидин в коррекции метаболических нарушений и эндотелиальной дисфункции у больных сахарным диабетом типа 2, ассоциированным с артериальной гипертензией. Артериальная гипертензия. 2004;10(2):104-9. doi:10.18705/1607-419X-2004-10-2-104-109.
26. Скибицкий В.В., Гутова С.Р., Фендрикова А.В. и др. Антигипертензивная, вазопротективная и метаболическая эффективность комбинированной фармакотерапии у больных артериальной гипертонией с предиабетом. Кардиология и сердечно-сосудистая хирургия. 2021;14(6):490-8. doi:10.17116/kardio202114061490.
27. Недогода С.В., Чумачек Е.В., Ледяева А.А. и др. Возможности нефиксированной комбинации периндоприл + моксонидин в достижении целевого АД при артериальной гипертензии и метаболическом синдроме. Кардиология и сердечнососудистая хирургия. 2021;14(2):20814.
28. Недогода С.В., Чумачек Е.В., Ледяева А.А. и др. Возможности ангиопротекции при артериальной гипертензии и метаболическом синдроме на терапии нефиксированной комбинацией периндоприл + моксонидин. Кардиология и сердечно-сосудистая хирургия. 2021;14(6):499-504. doi:10.17116/kardio202114061499.
29. Cuende JI, Cuende N, Calaveras-Lagartos J. How to calculate vascular age with the SCORE project scales: a new method of cardiovascular risk evaluation. Eur Heart J. 2010;31(19):2351-8. doi:10.1093/eurheartj/ehq205.
30. Dudinskaya E, Tkacheva O, Bazaeva E, et al. Influence of Moxonidine and Bisoprolol on Morphofunctional Condition of Arterial Wall and Telomerase Activity in Postmenopausal Women with Arterial Hypertension and Osteopenia. The Results from a Moscow Randomized Study. Cardiovasc Drugs Ther. 2021. doi:10.1007/s10557-021-07235-6. Epub ahead of print.
31. Sharma AM, Wagner T, Marsalek P. Moxonidine in the treatment of overweight and obese patients with the metabolic syndrome: a postmarketing surveillance study. J Hum Hypertens. 2004;18(9):669-75.
32. Chazova I, Schlaich MP. Improved Hypertension Control with the Imidazoline Agonist Moxonidine in a Multinational Metabolic Syndrome Population: Principal Results of the MERSY Study. Int J Hypertens. 2013;2013:541689. doi:10.1155/2013/541689.
33. Schlaich MP, Almahmeed W, Arnaout S, et al. The role of selective imidazoline receptor agonists in modern hypertension management: an international real-world survey (STRAIGHT). Curr Med Res Opin. 2020;36(12):1939-45. doi:10.1080/03007995.2020.1835852.
34. Конради А.О., Звартау Н.Э., Чазова И.Е. и др. Особенности антигипертензивной терапии и практика назначения селективных агонистов имидазолиновых рецепторов в России по сравнению с другими странами: анализ данных исследования STRAIGHT. Терапевтический архив. 2021;93(4):440-8. doi:10.26442/00403660.2021.04.200818.
35. Carnagarin R, Matthews V, Gregory C, Schlaich MP. Pharmacotherapeutic strategies for treating hypertension in patients with obesity. Expert Opin Pharmacother. 2018;19(7):643- 51. doi:10.1080/14656566.2018.1458092.
36. Suvarna VR. Real world evidence (RWE) — Are we (RWE) ready? Perspect Clin Res. 2018;9(2):61-3.
37. Ali A, Kanth AV, Mohanty R, et al. Real World Evidence: An Overview of its Importance in the Current Scenario. International Journal of Pharmaceutical Sciences Review and Research. 2016;39:251-4.
38. Mahfoud F, Bohm M, Azizi M, et al. Proceedings from the European Clinical Consensus Conference for Renal Denervation: considerations on future clinical trial design. Eur Heart J. 2015;36:2219-27.
39. Kiuchi MG, Ganesan K, Keating J, et al. Combined renal and common hepatic artery denervation as a novel approach to reduce cardiometabolic risk: technical approach, feasibility and safety in a pre-clinical model. Clin Res Cardiol. 2021;110:740-53. doi:10.1007/s00392-021-01814-1.
40. Gierthmuehlen M, Plachta DTT, Zentner J. Implant-Mediated Therapy of Arterial Hypertension. Curr Hypertens Rep. 2020;22(2):16. doi:10.1007/s11906-020-1019-7.
41. Thomas JA, Marks BH. Plasma norepinephrine in congestive heart failure. Am J Cardiol. 1978;41(2):233-43.
42. Hasking GJ, Esler MD, Jennings GL, et al. Norepinephrine spillover to plasma in patients with congestive heart failure: evidence of increased overall and cardiorenal sympathetic nervous activity. Circulation. 1986;73(4):615-21. doi:10.1161/01.cir.73.4.615.
43. Bristow MR, Ginsburg R, Minobe W, et al. Decreased catecholamine sensitivity and betaadrenergic-receptor density in failing human hearts. N Engl J Med. 1982;307(4):205-11. doi:10.1056/NEJM198207223070401.
44. Parati G, Esler M. The human sympathetic nervous system: its relevance in hypertension and heart failure. Eur Heart J. 2012;33(9):1058-66.
45. Badrov MB, Mak S, Floras JS. Cardiovascular Autonomic Disturbances in Heart Failure With Preserved Ejection Fraction. Can J Cardiol. 2021;37(4):609-20.
46. Stabile AM, Aceros H, Stockmeyer K, et al. Functional and molecular effects of imidazoline receptor activation in heart failure. Life Sci. 2011;88(11-12):493-503. doi:10.1016/j.lfs.2011.01.008.
47. Honda N, Hirooka Y, Ito K, et al. Moxonidine-induced central sympathoinhibition improves prognosis in rats with hypertensive heart failure. J Hypertens. 2013;31(11):2300-8; discussion 2308. doi:10.1097/HJH.0b013e328364a2a1.
48. Cohn JN, Pfeffer MA, Rouleau J, et al.; MOXCON Investigators. Adverse mortality effect of central sympathetic inhibition with sustained-release moxonidine in patients with heart failure (MOXCON). Eur J Heart Fail. 2003;5(5):659-67. doi:10.1016/s1388-9842(03)00163-6.
49. Pieske B, Tschöpe C, de Boer RA, et al. How to diagnose heart failure with preserved ejection fraction: the HFA-PEFF diagnostic algorithm: a consensus recommendation from the Heart Failure Association (HFA) of the European Society of Cardiology (ESC). Eur J Heart Fail. 2020;22(3):391-412. doi:10.1002/ejhf.1741.
50. Cohen JB, Schrauben SJ, Zhao L, et al. Clinical Phenogroups in Heart Failure With Preserved Ejection Fraction: Detailed Phenotypes, Prognosis, and Response to Spironolactone. JACC Heart Fail. 2020;8(3):172-84. doi:10.1016/j.jchf.2019.09.009.
51. Tse HF, Turner S, Sanders P, et al. Thoracic Spinal Cord Stimulation for Heart Failure as a Restorative Treatment (SCS HEART study): first-in-man experience. Heart Rhythm. 2015;12(3):588-95. doi:10.1016/j.hrthm.2014.12.014.
52. Zipes DP, Neuzil P, Theres H, et al. Determining the Feasibility of Spinal Cord Neuromodulation for the Treatment of Chronic Systolic Heart Failure: The DEFEAT-HF Study. JACC Heart Fail. 2016;4(2):129-36. doi:10.1016/j.jchf.2015.10.006.
53. Zannad F, De Ferrari GM, Tuinenburg AE, et al. Chronic vagal stimulation for the treatment of low ejection fraction heart failure: results of the NEural Cardiac TherApy foR Heart Failure (NECTAR-HF) randomized controlled trial. Eur Heart J. 2015;36(7):425-33. doi:10.1093/eurheartj/ehu345.
54. Gold MR, Van Veldhuisen DJ, Hauptman PJ, et al. Vagus Nerve Stimulation for the Treatment of Heart Failure: The INOVATE-HF Trial. J Am Coll Cardiol. 2016;68(2):149-58. doi:10.1016/j.jacc.2016.03.525.
55. Abraham WT, Zile MR, Weaver FA, et al. Baroreflex Activation Therapy for the Treatment of Heart Failure With a Reduced Ejection Fraction. JACC Heart Fail. 2015;3(6):487-96. doi:10.1016/j.jchf.2015.02.006.
56. Patel HC, Rosen SD, Hayward C, et al. Renal denervation in heart failure with preserved ejection fraction (RDT-PEF): a randomized controlled trial. Eur J Heart Fail. 2016;18(6):703- 12. doi:10.1002/ejhf.502.
57. Murray A, Mahadi M, Deuchars S, et al. The strange case of the ear and the heart: The auricular vagus nerve and its influence on cardiac control. Autonomic Neuroscience. 2016;199:48-53. doi:10.1016/j.autneu.2016.06.004.
58. Afanasiev SA, Pavliukova EN, Kuzmichkina MA. Nonpharmacological Correction of Hypersympatheticotonia in Patients with Chronic Coronary Insufficiency and Severe Left Ventricular Dysfunction. Ann Noninvasive Electrocardiol. 2016;21(6):548-56. doi:10.1111/anec.12349.
59. Fudim M, Jones WS, Boortz-Marx RL, et al. Splanchnic Nerve Block for Acute Heart Failure. Circulation. 2018;138(9):951-3. doi:10.1161/CIRCULATIONAHA.118.035260.
60. Fudim M, Boortz-Marx RL, Ganesh A, et al. Splanchnic Nerve Block for Chronic Heart Failure. JACC Heart Fail. 2020;8(9):742-52. doi:10.1016/j.jchf.2020.04.010.
61. Mikhaylov EN, Moshonkina TR, Zharova EN, et al. Acute Cardiovascular Effects of NonInvasive Electrical Spinal Cord Stimulation: Results from a Pilot Study in Humans. J. of Cardiovasc. Trans. Res. 2020;13:891-3. doi:10.1007/s12265-020-10014-7.
62. Deftereos S, Giannopoulos G, Kossyvakis C, et al. Effectiveness of moxonidine to reduce atrial fibrillation burden in hypertensive patients. Am J Cardiol. 2013;112(5):684-7. doi:10.1016/j.amjcard.2013.04.049.
63. Giannopoulos G, Kossyvakis C, Efremidis M, et al. Central sympathetic inhibition to reduce postablation atrial fibrillation recurrences in hypertensive patients: a randomized, controlled study. Circulation. 2014;130(16):1346-52. doi:10.1161/CIRCULATIONAHA.114.010999.
64. Stavrakis S, Po S. Ganglionated Plexi Ablation: Physiology and Clinical Applications. Arrhythm Electrophysiol Rev. 2017;6(4):186-90. doi:10.15420/aer2017.26.1.
65. Lemery R, Birnie D, Tang ASL, et al. Feasibility study of endocardial mapping of ganglionated plexuses during catheter ablation of atrial fibrillation. Heart Rhythm. 2006;3(4):387-96. doi:10.1016/j.hrthm.2006.01.009.
66. Katritsis DG, Pokushalov E, Romanov A, et al. Autonomic denervation added to pulmonary vein isolation for paroxysmal atrial fibrillation: a randomized clinical trial. J Am Coll Cardiol. 2013;62(24):2318-25. doi:10.1016/j.jacc.2013.06.053.
67. Mikhaylov E, Kanidieva A, Sviridova N, et al. Outcome of anatomic ganglionated plexi ablation to treat paroxysmal atrial fibrillation: a 3-year follow-up study. Europace. 2011;13(3):362-70. doi:10.1093/europace/euq416.
68. Mujer MT, Abcha AA, Saleh Y, et al. Effect of combined renal denervation and pulmonary vein isolation in atrial fibrillation recurrence in hypertensive patients: A meta-analysis. Pacing Clin Electrophysiol. 2020;43(8):866-74. doi:10.1111/pace.14009.
69. Turagam MK, Whang W, Miller MA, et al. Renal Sympathetic Denervation as Upstream Therapy During Atrial Fibrillation Ablation: Pilot HFIB Studies and Meta-Analysis. JACC Clin Electrophysiol. 2021;7(1):109-23. doi:10.1016/j.jacep.2020.08.013.
70. Stavrakis S, Humphrey MB, Scherlag BJ, et al. Low-level transcutaneous electrical vagus nerve stimulation suppresses atrial fibrillation. J Am Coll Cardiol. 2015;65(9):867-75. doi:10.1016/j.jacc.2014.12.026.
71. Stavrakis S, Stoner JA, Humphrey MB, et al. TREAT AF (Transcutaneous Electrical Vagus Nerve Stimulation to Suppress Atrial Fibrillation): A Randomized Clinical Trial. JACC Clin Electrophysiol. 2020;6(3):282-91. doi:10.1016/j.jacep.2019.11.008.
72. Priori SG, Blomström-Lundqvist C, Mazzanti A, et al. 2015 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: The Task Force for the Management of Patients with Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death of the European Society of Cardiology (ESC). Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC). Eur Heart J. 2015;36(41):2793-867. doi:10.1093/eurheartj/ehv316.
73. Raskin JS, Liu JJ, Abrao A, et al. Minimally invasive posterior extrapleural thoracic sympathectomy in children with medically refractory arrhythmias. Heart Rhythm. 2016;13(7):1381-5. doi:10.1016/j.hrthm.2016.03.041.
74. Vander MA, Fedotov PA, Lyubimtseva TA, et al. Renal artery denervation suppresses intractable ventricular arrhythmia in patients with left heart thrombosis. J Geriatr Cardiol. 2017;14(9):587-9. doi:10.11909/j.issn.1671-5411.2017.09.005.
Об авторах
Е. В. ШляхтоРоссия
Доктор медицинских наук, профессор, академик РАН, генеральный директор, Президент Российского кардиологического общества, Заслуженный деятель науки РФ, главный кардиолог Санкт-Петербурга и Северо-Западного федерального округа
Санкт-Петербург
А. О. Конради
Россия
Доктор медицинских наук, профессор, заведующая кафедрой кардиологии, начальник службы анализа и перспективного планирования
Санкт-Петербург
Н. Э. Звартау
Россия
Кандидат медицинских наук, старший научный сотрудник НИЛ патогенеза и терапии артериальной гипертензии, заместитель генерального директора по работе с регионами, начальник управления по реализации федеральных проектов, доцент кафедры внутренних болезней Института медицинского образования
Санкт-Петербург
С. В. Недогода
Россия
Заведующая кафедрой терапии и эндокринологии факультета усовершенствования врачей
Волгоград
Ю. М. Лопатин
Россия
Доктор медицинских наук, профессор, заведующая кафедрой кардиологии, сердечно-соcудистой и торакальной хирургии Института НМФО, заведующая кардиологическим отделением
Волгоград
М. Ю. Ситникова
Россия
Доктор медицинских наук, профессор, руководитель научно-исследовательского отдела сердечной недостаточности, ведущий научный сотрудник лаборатории высокотехнологичных методов лечения сердечной недостаточности, профессор кафедры внутренних болезней Института медицинского образования
Санкт-Петербург
Е. Н. Михайлов
Россия
Доктор медицинских наук, заместитель директора Института сердца и сосудов по научной работе, руководитель НИЛ нейромодуляции, профессор кафедры сердечно-сосудистой хирургии Института медицинского образования
Санкт-Петербург
Е. И. Баранова
Россия
Доктор медицинских наук, профессор кафедры терапии факультетской с курсом кардиологии, эндокринологии и функциональной диагностики с клиникой, директор НИИ сердечно-сосудистых заболеваний научно-клинического исследовательского центра
Санкт-Петербург
А. С. Галявич
Россия
Доктор медицинских наук, профессор, вице-президент Российского кардиологического общества, заведующая кафедрой кардиологии
Казань
Д. В. Дупляков
Россия
Доктор медицинских наук, профессор, заместитель главного врача по медицинской части
Самара
А. С. Саласюк
Россия
Кандидат медицинских наук, доцент кафедры внутренних болезней
Волгоград
М. М. Галагудза
Россия
Доктор медицинских наук, профессор, член-корр. РАН, директор Института экспериментальной медицины, главный научный сотрудник НИО микроциркуляции и метаболизма миокарда, заведующий кафедрой патологии Института медицинского образования
Санкт-Петербург
Рецензия
Для цитирования:
Шляхто Е.В., Конради А.О., Звартау Н.Э., Недогода С.В., Лопатин Ю.М., Ситникова М.Ю., Михайлов Е.Н., Баранова Е.И., Галявич А.С., Дупляков Д.В., Саласюк А.С., Галагудза М.М. Воздействие на автономную регуляцию сердечно-сосудистой системы как стратегическое направление лечения артериальной гипертензии, нарушений ритма и сердечной недостаточности. Российский кардиологический журнал. 2022;27(9):5195. https://doi.org/10.15829/1560-4071-2022-5195
For citation:
Shlyakhto E.V., Konradi A.O., Zvartau N.E., Nedogoda S.V., Lopatin Yu.M., Sitnikova M.Yu., Mikhailov E.N., Baranova E.I., Galyavich A.S., Duplyakov D.V., Salasyuk A.S., Galagudza M.M. Influence on the autonomic cardiovascular system regulation in the treatment of hypertension, arrhythmias and heart failure. Russian Journal of Cardiology. 2022;27(9):5195. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5195
JATS XML

















































