Перейти к:
Среднеотдаленные результаты хирургической реваскуляризации миокарда с применением коронарной эндартерэктомии при диффузном поражении коронарного русла
https://doi.org/10.15829/1560-4071-2022-5187
Аннотация
Цель. Оценить среднеотдаленные результаты хирургической реваскуляризации миокарда в сочетании с эндартерэктомией из коронарных артерий у больных с диффузным поражением коронарного русла.
Материалы и методы. В когортном, нерандомизированном, ретро-проспективном, продленном исследовании сравнили среднесрочные результаты хирургической реваскуляризации миокарда в сочетании с эндартерэктомией из коронарных артерий у больных с диффузным поражением коронарного русла с результатами хирургической реваскуляризации миокарда без эндартерэктомии у пациентов без признаков диффузного поражения коронарного русла. В исследуемую группу вошло 93 пациента, в контрольную – 99 пациентов. Были оценены среднеотдаленная летальность, заболеваемость, ангиографические результаты хирургической реваскуляризации.
Результаты. Средний период наблюдения составил 46,7±18,5 месяцев. Среднеотдаленная летальность составила 5,5% (n=5) в группе коронарной эндартерэктомии и 3,1% (n=3) в группе изолированного коронарного шунтирования (p=0,486). Рецидив стенокардии отмечен у 14,3% (n=13) больных группы эндартерэктомии и в 14,4% (n=14) случаев в группе изолированного коронарного шунтирования (p=0,977). Стентирование коронарных артерий потребовалось в среднеотдаленном периоде потребовалось у 4,4% (n=4) пациентов группы эндартерэктомии и 4,1% (n=4) (p=1,000) в группе изолированного коронарного шунтирования. Инсульт в среднеотдаленном периоде случился у 1 (1,1%) пациента исследуемой группы и у 3 (3,1%) пациентов контрольной группы (p=0,334). Проходимость шунтов к эндартерэктомированной передней межжелудочковой ветви составила 90,9%, к огибающей ветви – 100%, к правой коронарной артерии - 80,4%. Не получено статистически значимых различий в уровне проходимости шунтов между исследуемой и контрольной группами. Показатели качества жизни существенно не различались между группами в среднеотдаленном периоде.
Заключение. Выполнение коронарной эндартерэктомии не связано с повышением летальности и заболеваемости в среднеотдаленном периоде, сопровождается удовлетворительными показателями ангиографической проходимости шунтов. Не выявлено негативного влияния коронарной эндартерэктомии на качество жизни в среднеотдаленном периоде.
Ключевые слова
Для цитирования:
Вискер Я.Ю., Молчанов А.Н. Среднеотдаленные результаты хирургической реваскуляризации миокарда с применением коронарной эндартерэктомии при диффузном поражении коронарного русла. Российский кардиологический журнал. 2022;27(9):5187. https://doi.org/10.15829/1560-4071-2022-5187
For citation:
Visker Ya.Yu., Molchanov A.N. Mid-term outcomes of surgical myocardial revascularization using coronary endarterectomy in diffuse coronary artery disease. Russian Journal of Cardiology. 2022;27(9):5187. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5187
Диффузное поражение коронарного русла является серьезным препятствием к достижению полной реваскуляризации миокарда ввиду невозможности применения стандартных техник наложения анастомоза при коронарном шунтировании (КШ), что может быть связано с ростом неблагоприятных сердечно-сосудистых событий после КШ [1][2]. В данных ситуациях значительна роль реконструктивных процедур: выполнение коронарной эндартерэктомии (КЭ), протяженных шунт-пластик и пластик заплатами без эндартерэктомии. Выполнение КЭ в сочетании с КШ позволят преодолеть эту проблему, однако данная процедура является технически сложной [3-6]. Несмотря на совершенствование хирургической техники, значительный прогресс в методиках защиты миокарда и периоперационного медикаментозного сопровождения, летальность и частота периоперационных инфарктов после выполнения КЭ превышают аналогичные показатели после изолированного КШ, отсутствует убедительная доказательная база отдаленных клинических и ангиографических результатов данной методики, не определены единые протоколы антикоагулянтной/антиагрегантной терапии, не определены показания и алгоритмы отбора пациентов для каждого типа реконструктивных процедур на коронарных артериях с/без эндартерэктомии.
Цель исследования — оценка среднеотдаленных результатов хирургической реваскуляризации миокарда в сочетании с эндартерэктомией из коронарных артерий у больных с диффузным поражением коронарного русла.
Материал и методы
В исследование включили 192 пациента, прооперированных в кардиохирургическом отделении № 2 Бюджетного учреждения Ханты-Мансийского автономного округа-Югры "Центр диагностики и сердечно-сосудистой хирургии" (г. Сургут) с 2016 по 2018гг. Проведенное исследование носило характер когортного нерандомизированного ретро-проспективного пролонгированного. Клиническое исследование было одобрено локальным этическим комитетом (выписка из протокола заседания от 06.12.2019). Критерии включения: пациенты, страдающие от различных форм стенокардии с диффузным поражением коронарного русла, которым выполнялась КЭ в сочетании с КШ, составившие исследуемую группу; пациенты, страдающие от различных форм стенокардии без признаков диффузного поражения коронарного русла, которым выполнялось изолированное КШ, составившие контрольную группу. Критерии исключения: нестабильная стенокардия; сочетанные операции на сердце; повторные операции; перенесенный инфаркт миокарда (ИМ) давностью <2 мес.
Конечные точки исследования: смерть от всех причин, рецидив стенокардии, повторная госпитализация, повторная реваскуляризация миокарда, инсульт.
В исследуемую группу вошло 93 пациента, в контрольную — 99 пациентов. КЭ выполняли по открытой и закрытой методике. Диагностика, медикаментозное лечение в пред- и послеоперационном периодах проводились согласно стандартам медицинской помощи. В среднеотдаленном периоде проводили осмотр пациентов в условиях поликлиники. Оценка качества жизни выполнялась с помощью опросника MOS SF-36. С целью оценки состояния зон реконструкции коронарных артерий пациентам выполняли визуализацию коронарных артерий и шунтов при помощи мультиспиральной компьютерной томографической коронарошунтографии (МСКТ-КШГ) и/или инвазивной коронарошунтографии (инвКШГ). Исследование проводилось на мультиспиральном компьютерном томографе "Revolution CT" фирмы "General Electric" (США). Коронароангиографическое исследование выполнялось на аппаратном комплексе "GE Healthcare Innova" GE Medical Systems Information Technologis, Inc (США).
Статистический анализ. Статистическую обработку данных проводили с использованием программы IBM SPSS v.23. Нормальность распределения полученных результатов оценивали с помощью критериев Колмогорова-Смирнова с поправкой Лилиефорса, Шапиро-Уилка. Для определения формы распределения показателей использовали метод построения гистограмм. Оценивались величины асимметрии и эксцесса. Данные, не подчиняющиеся нормальному закону распределения, представляли в виде медианы (Me) и интерквартильного размаха (25 и 75 перцентили). Данные, подчиняющиеся нормальному закону распределения, представляли в виде среднего арифметического (M) и среднеквадратичного отклонения (σ). При сравнении количественных признаков двух несвязанных выборок, подчиняющихся нормальному закону распределения и равенстве дисперсий, использовали t-критерий Стьюдента. При сравнении количественных признаков двух несвязанных выборок, не подчиняющихся нормальному закону распределения, использовали критерий Манна-Уитни. При сравнении качественных признаков двух несвязанных выборок применяли критерий χ2 Пирсона, точный критерий Фишера. При сравнении качественных признаков двух связанных выборок использовали критерий Мак-Немара. Отдаленную выживаемость, "свободу" от ишемии, повторных госпитализаций, реинтервенций и сердечно-сосудистых событий оценивали с помощью метода E. Kaplan и P. Meier. Критический уровень значимости статистических гипотез в данном исследовании принимали равным 0,05.
Результаты
Всего в исследование включено 192 пациента, 78,1% (n=150) из них мужского пола. Средний возраст на момент операции составил 59,83±6,99 лет. Среди сопутствующих заболеваний чаще всего встречалась гипертоническая болезнь II/III степени — у 94,6% (n=88) пациентов контрольной группы и у 87,9% (n=87) пациентов исследуемой группы (p=0,1). Реже выявлялся сахарный диабет II типа, который встретился у 32,3% (n=30) прооперированных группы эндартерэктомии и у 24,2% (n=24) прооперированных группы изолированного КШ (p=0,217). Гиперхолестеринемия была распространена у всех больных — 37,6% (n=35) в группе 1 и 42,4% (n=42) в группе 2 (p=0,499). Мультифокальный атеросклероз встречался у пациентов контрольной группы в 23,2% (n=23), у пациентов исследуемой группы в 12,9% (n=12) случаев (p=0,064). По большинству предоперационных характеристик не было получено достоверной разницы. Все пациенты были прооперированы через срединную стернотомию в условиях искусственного кровообращения и кардиоплегии. В послеоперационном периоде пациенты, которым была выполнена КЭ, получали аспирин постоянно и плавикс/брилинту в течение 12 мес. Более подробный анализ непосредственных результатов представлен в ранее опубликованной работе.
Средний период наблюдения составил 46,7±18,5 мес., полнота наблюдения — 91%. В среднеотдаленном периоде проводилось обследование пациентов, которое включало физикальный осмотр и сбор анамнеза, оценку качества жизни, инструментальные исследования: МСКТ-КШГ была выполнена 80% (n=64) пациентам исследуемой группы и 77,4% (n=65) пациентам группы контроля. ИнвКШГ выполнялась реже — 16,3% (n=13) пациентов группы эндартерэктомии и 14,3% (n=12) пациентов группы изолированного КШ.
Большинство пациентов после операции отметили значительное улучшение либо полное исчезновение симптомов стенокардии. Подавляющее число пациентов в обеих группах не страдали стенокардией в среднеотдаленном периоде (табл. 1).
В среднеотдаленном периоде острый ИМ случился у 1 (1%) пациента группы 2 через 40 мес. после операции в бассейне ранее шунтированной артерии и связанный с прогрессированием атеросклеротического процесса, приведший к гибели больного. В исследуемой группе ИМ не было отмечено.
Рецидив стенокардии отмечен у 14,3% (n=13) больных группы КЭ и в 14,4% (n=14) случаев в группе изолированного КШ (p=0,977). У 2 человек стенокардия соответствовала III функциональному классу (ФК) по CCS, во всех остальных случаях (n=25) — I/II ФК по CCS. Рецидив стенокардии возникал в средние сроки 24±19,2 мес. (рис. 1).
18 (19,8%) пациентам из группы 1 и 13 (13,4%) из группы 2 потребовалась госпитализация в отделения кардиологического профиля в различные сроки после операции (p=0,243). В обеих группах в большинстве случаев госпитализации носили плановый характер. Структура причин повторных госпитализаций представлена в таблице 2.
Стентирование коронарных артерий в среднеотдаленном послеоперационном периоде потребовалось у 4,4% (n=4) пациентов группы КЭ. В группе изолированного КШ этот показатель составил 4,1% (n=4) (p=1,000). При этом стентирование, обусловленное дисфункцией шунтов, выполнено у 3 пациентов группы 1 и у 3 пациентов группы 2. В остальных случаях (n=2) стентирование выполнялось по поводу прогрессирования атеросклеротического процесса в ранее не пораженных артериях. Кумулятивная функция свободы от реинтервенций через 12, 24, 36, 48, 60 мес. составила в группе 1 — 99%, 96%, 96%, 94%, 94%, в группе 2 — 99%, 97%, 97%, 94%, 87% (рис. 2).
Инсульт в среднеотдаленном периоде случился у 1 (1,1%) пациента исследуемой группы и у 3 (3,1%) пациентов контрольной группы (p=0,334) в средние сроки 39,8±17,7 мес. У пациентов обеих групп не было зарегистрировано геморрагических осложнений в среднеотдаленном периоде.
В среднеотдаленном периоде умерло 5,5% (n=5) в группе 1 (N=91) и 3,1% (n=3) в группе 2 (N=97) (p=0,486). Госпитальная летальность после выполнения КЭ составила 2,2%, после изолированного КШ — 2% (p=1,000). Всего умерло 7,5% пациентов (n=7) в группе 1 и 5,1% (n=5) в группе 2 (p=0,479). Кумулятивная функция дожития через 12, 24, 36, 48 мес. составила 94%, 94%, 92%, 92% в группе эндартерэктомии и 97%, 97%, 95%, 93% в группе изолированного КШ (рис. 3).
Выполнение КЭ из бассейнов 2 и более артерий (передняя межжелудочковая ветвь (ПМЖВ) и ее ветви, огибающая ветвь (ОВ) и ее ветви, правая коронарная артерия (ПКА) и ее ветви) не повлияло на выживаемость, которая составила 100%. При этом у 12% (n=11; nПМЖВ+ПКА=9; nПМЖВ+ОВ=1; nОВ+ПКА=1) пациентов была выполнена эндартерэктомия из 2 бассейнов и у 2% (nПМЖВ+ОВ+ПКА=2) пациентов эндартерэктомия выполнялась из 3 бассейнов. Выживаемость при выполнении КЭ из 1 сосуда составила 91,3% и 94,9% в группе изолированного КШ (p=0,405). Выживаемость при выполнении эндартерэктомии в зависимости от методики эндартерэктомии также существенно не различалась между группами — 92,3% при открытой КЭ, 92,6% при закрытой КЭ, 94,9% при изолированном КШ (p=0,801).
В среднеотдаленном периоде визуализация коронарных артерий и шунтов (МСКТ-КШГ и/или инвКШГ) была выполнена у 89,9% (n=71) пациентов группы КШ+КЭ и у 83,7% (n=72) пациентов группы изолированного КШ в средние сроки 46,2±11,7 мес. Было оценено 225 шунтов в исследуемой группе и 235 шунтов в контрольной группе. При анализе проходимости шунтов в зависимости от бассейна шунтируемой артерии не было выявлено статистически значимых различий (табл. 3). Была выполнена оценка проходимости 83 эндартерэктомированных артерий и шунтов к ним. Распределение оцененных артерий, подвергшихся эндартерэктомии, и методик КЭ отражено в таблице 4. Открытую эндартерэктомию выполняли чаще из ПМЖВ, закрытую — из системы ПКА.
Было выполнено сравнение проходимости шунтов к отдельным коронарным артериям между группами КЭ и изолированного КШ. Проходимость шунта к эндартерэктомированной ПМЖВ составила 90,9%. Окклюзированы были 2 шунта (1 венозный и 1 во внутренней грудной артерии (ВГА)). В группе контроля 86,1% шунтов к ПМЖВ были проходимы. Окклюзированы были 10 шунтов (1 венозный и 9 маммарных). Статистически значимых различий между группами не выявлено (p=0,726) (рис. 4).
При анализе проходимости шунтов к эндартерэктомированной диагональной ветви (ДВ) функционирующими оказались 2 кондуита из 3 (66,7%), в группе контроля проходимость шунтов к ДВ составила 92,3% — функционировали 24 шунта из 26 (p=0,288). Не было отмечено дисфункции шунтов к эндартерэктомированной ОВ и ее ветвям — все шунты функционировали (n=7, 100%), в группе 2 функционирующими оказались 36 шунтов из 40 (90%) (p=1,000). Анализ шунтов к эндартерэктомированной ПКА не показал достоверной разности в проходимости шунтов между группами (p=0,075). В группе КЭ функционировал 41 шунт из 51 (80,4%), в группе изолированного КШ — 46 шунтов из 49 (93,9%) (рис. 5).
При анализе функции шунтов в зависимости от методики КЭ (табл. 4) были получены данные, что проходимость шунтов к эндартерэктомированной ПМЖВ была сохранена в 89,5% (17/19) случаев после
открытой КЭ и 100% (3/3) после закрытой (p=1,000). При этом окклюзия артерии, подвергшейся реконструкции, была выявлена в 1 случае после открытой КЭ. Шунт к ДВ был окклюзирован в одном случае после открытой эндартерэктомии. В остальных 2 случаях после закрытой КЭ дисфункции шунта не наблюдалось. Шунты к эндартерэктомированной ОВ и ветви тупого края были проходимы в 100% случаев вне зависимости от методики вмешательства. При анализе функции шунтов к ПКА более высокая проходимость зарегистрирована при выполнении открытой методики — 92,3% (12/13), чем при закрытой — 76,3% (29/38), но различия носили статистически незначимый характер (p=0,419). При этом эндартерэктомированная артерия была окклюзирована в 1 случае после открытой КЭ и в 6 случаях после закрытой КЭ (p=0,662).
Суммируя вышеперечисленные данные, дисфункция шунтов чаще встречалась после закрытой эндартерэктомии — в 20,4% случаев (10/49) vs 8,8% случаев (3/34) — после открытой, однако различия были статистически незначимы (p=0,153).
При анализе проходимости шунтов к артериям, подвергшихся эндартерэктомии, в зависимости от типа кондуита, артериальные шунты (ВГА), продемонстрировали лучшую проходимость, чем венозные в сроки 45,4±11,3 мес. — 94,7% vs 81,3%, но различия не достигли статистической значимости (p=0,166).
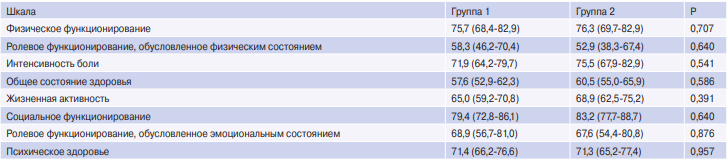
Качество жизни оценивалось в среднеотдаленном периоде в обеих группах с помощью опросника MOS SF-36. При этом не было выявлено статистически значимых различий в качестве жизни у прооперированных пациентов (табл. 5).
Таблица 1
Степень выраженности стабильной стенокардии по классификации Канадской Ассоциации Кардиологов (CCS) в среднеотдаленном периоде (абс. (%))

Сокращения: КШ — коронарное шунтирование, КШ+КЭ — коронарное шунтирование в сочетании с коронарной эндартерэктомией, ФК — функциональный класс, CCS — Canadian Cardiovascular Society.
Таблица 2
Структура причин повторных госпитализаций пациентов после хирургической реваскуляризации миокарда (абс. (%))

Сокращения: КШ — коронарное шунтирование, КШ+КЭ — коронарное шунтирование в сочетании с коронарной эндартерэктомией, ЭКС — электрокардиостимулятор.

Рис. 1. Кумулятивная кривая свободы от стенокардии, построенная методом Каплана-Майера.
Сокращения: АКШ — аортокоронарное шунтирование, КЭ — коронарная эндартерэктомия.

Рис. 2. Кумулятивная кривая свободы от реинтервенций, построенная методом Каплана-Майера.
Сокращения: АКШ — аортокоронарное шунтирование, КЭ — коронарная эндартерэктомия.

Рис. 3. Кумулятивная кривая выживаемости, построенная методом КапланаМайера.
Сокращения: АКШ — аортокоронарное шунтирование, КЭ — коронарная эндартерэктомия.
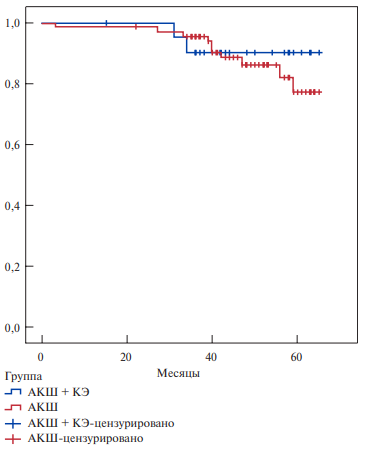
Рис. 4. Кумулятивные кривые проходимости шунтов к ПМЖВ с/без эндартерэктомии, построенные методом Каплана-Майера.
Сокращения: АКШ — аортокоронарное шунтирование, КЭ — коронарная эндартерэктомия.
Таблица 3
Проходимость шунтов в зависимости от бассейна шунтируемой артерии (n (%))

Сокращения: ВГА — внутренняя грудная артерия, ВТК — ветвь тупого края, ДВ — диагональная ветвь, ЗМЖВ — задняя межжелудочковая ветвь, ИМА — интермедиарная артерия, КШ — коронарное шунтирование, КШ+КЭ — коронарное шунтирование в сочетании с коронарной эндартерэктомией, ЛЖВ — левожелудочковая ветвь, ОВ — огибающая ветвь, ПКА — правая коронарная артерия, ПМЖВ — передняя межжелудочковая ветвь.
Таблица 4
Распределение артерий, подвергшихся эндартерэктомии (n)
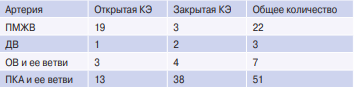
Сокращения: ДВ — диагональная ветвь, ОВ — огибающая ветвь, КЭ — коронарная эндартерэктомия, ПКА — правая коронарная артерия, ПМЖВ — передняя межжелудочковая ветвь.

Рис. 5. Кумулятивные кривые проходимости шунтов к ПКА с/без эндартерэктомии, построенные методом Каплана-Майера.
Сокращения: АКШ — аортокоронарное шунтирование, КЭ — коронарная эндартерэктомия.
Таблица 5
Сравнительная оценка качества жизни исследуемых групп (m (95% доверительный интервал))
Обсуждение
Увеличение продолжительности и качества жизни сопровождается ростом распространенности таких заболеваний, как ишемическая болезнь сердца, гипертоническая болезнь, сахарный диабет, мультифокальный атеросклероз, ожирение. Поражение коронарных артерий зачастую носит диффузный характер, препятствуя достижению полной реваскуляризации. Выполнение КЭ позволяет преодолеть эти трудности, однако сопровождается повышенными рисками летального исхода, периоперационного ИМ. На ранних этапах освоения методики летальность доходила до 58%, частота периоперационных ИМ — 19% [6]. За счет совершенствования хирургической техники, методик защиты миокарда и медикаментозного сопровождения показатели госпитальной летальности после выполнения КЭ в сочетании с КШ постоянно снижаются и в последние годы находятся в пределах 1,25-8,6% [6], а частота периоперационных ИМ — 0-6,4% [6]. По данным литературы, пациенты, которым было выполнено КШ в сочетании с КЭ, имеют хорошие показатели отдаленной выживаемости, составляющие 84% [7]. Госпитальная летальность в нашем исследовании после выполнения КШ+КЭ составила 2,2%, после изолированного КШ — 2% [8]. Полученная нами кумулятивная выживаемость существенно не различалась между группами и составила 92% в группе после КЭ и 93% в группе изолированного КШ в средние сроки 46,7±18,5 мес. (p=0,506). В литературе присутствуют указания на более низкие показатели 5-летней выживаемости после выполнения КЭ по закрытой методике, чем по открытой [7]. Нами не было получено статистически значимых различий в уровне выживаемости в зависимости от методики КЭ — 92,3% при открытой КЭ, 92,6% при закрытой КЭ, 94,9% при изолированном КШ (p=0,801). Также мы не получили статистически значимых различий в уровне выживаемости в зависимости от количества сосудов, подвергшихся эндартерэктомии — 91,3% в группе КЭ из одного сосуда, 100% в группе КЭ из 2 и более сосудов и 94,9% в группе изолированного КШ (p=0,801).
Показатели свободы от рецидива стенокардии после выполнения КЭ колеблются в значительных пределах — от 9% до 35% к 5 годам. В нашем исследовании в группе эндартерэктомии процентное соотношение пациентов, не испытывающих ангинозные боли, увеличилось с 5,4% до 84,6% (p<0,001), в группе изолированного КШ наблюдалась аналогичная динамика — увеличение с 5,1% до 84,5% (p<0,001) при отсутствии значимых межгрупповых различий. Рецидив стенокардии отмечен у 14,3% больных исследуемой группы и в 14,4% случаев в группе контроля в средние сроки 24±19,2 мес. (p=0,977), что согласуется с литературными данными. При этом был отмечен только 1 случай ИМ в контрольной группе. В группе КЭ ИМ в среднеотдаленном периоде не было отмечено.
Продемонстрирована частота реинтервенций в отдаленном периоде после КЭ — <1% [9]. В нашем исследовании стентирование коронарных артерий в среднеотдаленном периоде потребовались в 4,4% случаев исследуемой группы и в 5,2% случаев группы контроля в средние сроки 33,7±20,9 мес. (p=0,791). При этом стентирование в бассейне артерии, подвергшейся эндартерэктомии, потребовалось только в 1 случае (1,1%).
Остается открытым вопрос об ангиографической проходимости сосудов, подвергшихся эндартерэктомии, и шунтов к ним. Уровни отдаленной проходимости шунтов по данным исследований последних лет находятся в пределах от 40,2% до 100%. В метаанализе, посвященном оценке проходимости шунтов, сообщается, что КЭ ассоциирована со сниженной проходимостью шунтов (отношение шансов 0,43), но авторы отмечают, что истинные уровни проходимости могут быть выше, т.к. в большинстве исследований КШГ выполнялись у симптомных пациентов [10]. В нашем исследовании проходимость шунтов к эндартерэктомированной ПМЖВ составила 90,9%. Окклюзированы были 2 шунта (1 венозный и 1 ВГА). В группе контроля 86,1% шунтов к ПМЖВ были проходимы. Окклюзированы были 10 шунтов (1 венозный и 9 маммарных) (p=0,726). При анализе проходимости шунтов к эндартерэктомированной ДВ функционирующими оказались 66,7% шунтов, в группе изолированного КШ проходимость шунтов к ДВ составила 92,3% (p=0,288). Анализ шунтов к эндартерэктомированной ПКА не показал достоверной разности в проходимости шунтов между группами (p=0,075). В группе эндартерэктомии функционировали 80,4% шунтов, в группе изолированного КШ — 93,9%.
По данным литературы, отмечается более высокая проходимость шунтов к артериям после КЭ по открытой методике, чем по закрытой — 93,1% vs 80,6% [7]. Мы наблюдали дисфункцию шунтов чаще после закрытой эндартерэктомии — в 20,4% случаев vs 8,8% случаев, чем после открытой, однако различия были статистически незначимы (p=0,153). Использование артериальных шунтов оказывает благоприятное влияние на отдаленные клинические результаты и на проходимость шунтов. Использование ВГА для пластики артерии предпочтительнее по нескольким причинам: ВГА способна регулировать поток крови в зависимости от состояния "принимающего" русла и имеет лучшее соответствие диаметру коронарной артерии; эндотелий ВГА продуцирует вазодилатирующие факторы; ВГА устойчива к развитию атеросклероза. В метаанализе сообщается, что использование ВГА существенно улучшает проходимость шунтов к артериям, подвергшимся эндартерэктомии, особенно при использовании открытой методики [11]. Нами были получены схожие результаты. При анализе проходимости шунтов к артериям, подвергшимся эндартерэктомии, в зависимости от типа кондуита, артериальные шунты (ВГА), продемонстрировали более высокие уровни проходимости, чем венозные, в сроки 45,4±11,3 мес. — 94,7% vs 81,3% (p=0,166).
Деэндотелизированная поверхность в сосуде после КЭ предрасполагает к развитию тромбоза. Отсутствуют единые протоколы антикоагулянтной и антиагрегантной терапии в послеоперационном периоде после КЭ [12-14]. Мы придерживаемся схемы, основанной на назначении аспирина, гепарина, клопидогрела/тикагрелола. Выбор в пользу тикагрелола делается при недостижении целевых показателей агрегации тромбоцитов на фоне приема клопидогрела. Длительность приема клопидогрела/тикагрелола — 12 мес., аспирина — постоянно. В среднеотдаленном периоде в обеих группах не было отмечено эпизодов кровотечений, потребовавших специализированного лечения.
Одной из целей при хирургической реваскуляризации миокарда является улучшение качества жизни пациентов в отдаленном периоде. Выполнен систематический обзор с метаанализом 34 исследований. Было установлено, что реваскуляризация миокарда вне зависимости от вида (КШ или чрескожное коронарное вмешательство) улучшает качество жизни при сравнении с медикаментозной терапией [15].
Данный параметр был нами оценен в среднеотдаленном периоде при помощи опросника MOS SF36. Наибольшее количество баллов пациенты обеих групп выставили по категориям "Физическое функционирование", "Интенсивность боли", "Социальное функционирование" и "Психическое здоровье", без существенных различий между исследуемой и контрольной группами (табл. 5). Пациенты демонстрировали высокую физическую активность в повседневной жизни, не испытывая при этом значительной боли, не ограничивая свою социальную активность, что в конечном итоге благоприятно отражалось на их психическом состоянии. Таким образом, качество жизни пациентов после КЭ в среднеотдаленном периоде можно оценить как удовлетворительное, и оно сопоставимо по всем показателям с качеством жизни когорты больных без диффузного поражения коронарного русла, которым было выполнено изолированное КШ.
Ограничения исследования. Ограничениями данного исследования явились его ретроспективный характер, отсутствие рандомизации, относительно небольшой объем выборки и период наблюдения, неполное обследование исследуемых групп.
Заключение
Выполнение КЭ при диффузном атеросклеротическом поражении коронарного русла не связано с повышением частоты неблагоприятных клинических исходов (смерть от всех причин, рецидив стенокардии, повторная госпитализация, реинтервенция, инсульт, инфаркт) в среднеотдаленном периоде.
Выполнение КЭ не сопровождалось снижением проходимости шунтов в среднеотдаленном периоде. Закрытая методика эндартерэктомии и использование аутовен не сопровождаются большей частотой дисфункций шунтов в среднеотдаленном периоде.
Качество жизни пациентов в среднеотдаленном периоде, перенесших КШ в сочетании с эндартерэктомией из коронарных артерий, сопоставимо с качеством жизни пациентов без диффузного поражения коронарных артерий, перенесших изолированное КШ.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Курбанов С.К., Власова Э.Е., Васильев В.П. и др. Прогнозирование течения ишемической болезни сердца у больных с диффузным поражением коронарных артерий после коронарного шунтирования. Российский кардиологический журнал. 2022;27(1):4727. doi:10.15829/1560-4071-2022-4727.
2. Тарасов Р.С., Казанцев А.Н., Барбараш Л. С. и др. Результаты целесообразной неполной реваскуляризации миокарда с использованием миниинвазивной и стандартной техники коронарного шунтирования. Российский кардиологический журнал. 2018;(7):47-52. doi:10.15829/1560-4071-2018-7-47-52.
3. Wang J, Gu C, Yu W, et al. Short- and Long-Term Patient Outcomes From Combined Coronary Endarterectomy and Coronary Artery Bypass Grafting: A Meta-Analysis of 63,730 Patients (PRISMA). Medicine (Baltimore). 2015;94(41):e1781. doi:10.1097/MD.0000000000001781.
4. Wang C, Chen J, Gu C, et al. Analysis of survival after coronary endarterectomy combined with coronary artery bypass grafting compared with isolated coronary artery bypass grafting: a meta-analysis. Interact Cardiovasc Thorac Surg. 2019;29(3):393-401. doi:10.1093/icvts/ivz125.
5. Wang C, Chen J, Gu C, et al. Impact of risk factors and surgical techniques in coronary endarterectomy: a network meta-analysis. Interact Cardiovasc Thorac Surg. 2019;29(3):355-64. doi:10.1093/icvts/ivz090.
6. Stavrou A, Gkiousias V, Kyprianou K, et al. Coronary endarterectomy: The current state of knowledge. Atherosclerosis. 2016;249:88-98. doi:10.1016/j.atherosclerosis.2016.03.036.
7. Белаш С.А., Барбухатти К.О., Шевченко С.С. и др. Выбор оптимальной техники эндартерэктомии из передней межжелудочковой артерии при её диффузном атеросклеротическом поражении. Российский кардиологический журнал. 2021;26(8):4397. doi:10.15829/1560-4071-2021-4397.
8. Вискер Я.Ю., Ковальчук Д.Н., Молчанов А.Н. и др. Применение коронарной эндартерэктомии при реваскуляризации миокарда. Российский кардиологический журнал. 2021;26(8):4310. doi:10.15829/1560-4071-2021-4310.
9. Ariyaratnam P, Javangula K, Papaspyros S, et al. Long-term survival from 801 adjunctive coronary endarterectomies in diffuse coronary artery disease. Eur J Cardiothorac Surg. 2012;42(6):e140-5. doi:10.1093/ejcts/ezs510.
10. Song Y, Xu F, Du J, et al. Coronary endarterectomy with coronary artery bypass graft decreases graft patency compared with isolated coronary artery bypass graft: a metaanalysis. Interact Cardiovasc Thorac Surg. 2017;25(1):30-6. doi:10.1093/icvts/ivx045.
11. Soylu E, Harling L, Ashrafian H, et al. Does coronary endarterectomy technique affect surgical outcome when combined with coronary artery bypass grafting? Interact Cardiovasc Thorac Surg. 2014;19(5):848-55. doi:10.1093/icvts/ivu261.
12. Ghatanatti R, Teli A. Coronary Endarterectomy: Recent Trends. J Clin Diagn Res. 2017;11(8):PE01-PE04. doi:10.7860/JCDR/2017/27036.10339.
13. Soylu E, Harling L, Ashrafian H, et al. Adjunct coronary endarterectomy increases myocardial infarction and early mortality after coronary artery bypass grafting: a metaanalysis. Interact Cardiovasc Thorac Surg. 2014;19(3):462-73. doi:10.1093/icvts/ivu157.
14. Белаш С.А., Барбухатти К.О., Порханов В.А. Сравнительный анализ непосредственных результатов реконструктивных процедур на коронарных артериях с эндартерэктомией или без нее при диффузном коронарном атеросклерозе. Грудная и сердечно-сосудистая хирургия. 2019;61(1):45-54. doi:10.24022/0236-2791-2019-61-1-45-54.
15. Takousi MG, Schmeer S, Manaras I, et al. Health-Related Quality of Life after Coronary Revascularization: A systematic review with meta-analysis. Hellenic J Cardiol. 2016:S1109- 9666(16)30145-2. doi:10.1016/j.hjc.2016.05.003.
Об авторах
Я. Ю. ВискерРоссия
Вискер Ярослав Юрьевич — аспирант кафедры кардиологии, сердечно-сосудистый хирург
Сургут
Конфликт интересов:
Конфликт интересов отсутствует
А. Н. Молчанов
Россия
Молчанов Андрей Николаевич — доктор медицинских наук, доцент кафедры кардиологии
Сургут
Конфликт интересов:
Конфликт интересов отсутствует
Дополнительные файлы
Рецензия
Для цитирования:
Вискер Я.Ю., Молчанов А.Н. Среднеотдаленные результаты хирургической реваскуляризации миокарда с применением коронарной эндартерэктомии при диффузном поражении коронарного русла. Российский кардиологический журнал. 2022;27(9):5187. https://doi.org/10.15829/1560-4071-2022-5187
For citation:
Visker Ya.Yu., Molchanov A.N. Mid-term outcomes of surgical myocardial revascularization using coronary endarterectomy in diffuse coronary artery disease. Russian Journal of Cardiology. 2022;27(9):5187. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5187
JATS XML

















































