Перейти к:
Факторы риска развития хронической сердечной недостаточности у пациентов с новой коронавирусной инфекцией
https://doi.org/10.15829/1560-4071-2023-5169
Аннотация
Цель. Установить факторы риска развития хронической сердечной недостаточности (ХСН) у пациентов с новой коронавирусной инфекцией (COVID-19).
Материал и методы. Ретроспективно отобраны истории болезни 151 пациента, находившихся на лечении в моноинфекционном госпитале в период с 03.11.2020 по 10.02.2021 с подтвержденным диагнозом COVID-19. Сбор клинико-анамнестических и лабораторных данных осуществлялся путем анализа электронных историй болезни. Сведения включали информацию о возрасте, поле, индексе массы тела, курении, сопутствующей патологии. Результаты лабораторных исследований включали клинический и биохимический анализ крови, коагулограмму, исследование острофазовых белков (С-реактивный белок (СРБ), ферритин, лактатдегидрогеназа (ЛДГ)), прокальцитонина. Диагноз ХСН был подтвержден наличием признаков и симптомов синдрома, данными эхокардиографии, показателями патологически повышенного уровня N-концевого фрагмента промозгового натрийуретического пептида (NT-proBNP). В качестве конечной точки исследования принимали риск развития ХСН.
Результаты. Исследуемая выборка пациентов была разделена на две группы в зависимости от наличия ХСН: в 1 группу вошли 46 пациентов с ХСН, во 2 группу 105 пациентов без ХСН. Медиана возраста составила 66,2 [50; 92] лет, преобладали женщины — 91 (60,3%) человек. Лабораторные показатели, такие как уровень СРБ, ЛДГ, прокальцитонин, креатинин, билирубин, статистически значимо различались между собой, а медианные значения были выше в группе пациентов с ХСН. Нейтрофильно-лимфоцитарное отношение (NLR) продемонстрировало статистически значимые межгрупповые различия: в группе больных с ХСН медиана составила 4,97% vs 3,62% (р=0,011) в группе больных без ХСН. Наиболее значимыми предикторами, повышающими риск развития ХСН, являются: возраст ≥66 лет (отношение шансов 8,038, p<0,001), уровень прокальцитонина, увеличивающий риск развития ХСН у больных в 3,8 раза (p><0,001), соотношение NLR ≥4,11% (р=0,010), тромбоцитопения ≤220×109/л (р=0,010), наличие хронической болезни почек (ХБП) в анамнезе (р=0,018). Заключение. Установлено, что предикторами риска развития ХСН являются возраст ≥66 лет, уровень прокальцитонина ≥0,09 нг/мл, отношение NLR ≥4,11%, тромбоцитопения ≤220×109/л, наличие ХБП в анамнезе, уровни ЛДГ ≥685 Ед/л и креатинина ≥102 мкмоль/л, международное нормализованное отношение ≥1,19, интервал QTc на электрокардиограмме ≥407,5 мс, билирубин ≤10,7 мкмоль/л. Важно отметить, что наилучшие значения точности демонстрирует алгоритм Random Forest (88,5% на валидационной выборке), однако наиболее чувствительной оказалась математическая модель нейронной сети (90,0% на валидационной выборке). Ключевые слова: новая коронавирусная инфекция, хроническая сердечная недостаточность, прогноз>˂ 0,001), уровень прокальцитонина, увеличивающий риск развития ХСН у больных в 3,8 раза (p<0,001), соотношение NLR ≥4,11% (р=0,010), тромбоцитопения ≤220×109/л (р=0,010), наличие хронической болезни почек (ХБП) в анамнезе (р=0,018). Заключение. Установлено, что предикторами риска развития ХСН являются возраст ≥66 лет, уровень прокальцитонина ≥0,09 нг/мл, отношение NLR ≥4,11%, тромбоцитопения ≤220×109/л, наличие ХБП в анамнезе, уровни ЛДГ ≥685 Ед/л и креатинина ≥102 мкмоль/л, международное нормализованное отношение ≥1,19, интервал QTc на электрокардиограмме ≥407,5 мс, билирубин ≤10,7 мкмоль/л. Важно отметить, что наилучшие значения точности демонстрирует алгоритм Random Forest (88,5% на валидационной выборке), однако наиболее чувствительной оказалась математическая модель нейронной сети (90,0% на валидационной выборке). Ключевые слова: новая коронавирусная инфекция, хроническая сердечная недостаточность, прогноз>˂ 0,001), соотношение NLR ≥4,11% (р=0,010), тромбоцитопения ≤220×109/л (р=0,010), наличие хронической болезни почек (ХБП) в анамнезе (р=0,018).
Заключение. Установлено, что предикторами риска развития ХСН являются возраст ≥66 лет, уровень прокальцитонина ≥0,09 нг/мл, отношение NLR ≥4,11%, тромбоцитопения ≤220×109/л, наличие ХБП в анамнезе, уровни ЛДГ ≥685 Ед/л и креатинина ≥102 мкмоль/л, международное нормализованное отношение ≥1,19, интервал QTc на электрокардиограмме ≥407,5 мс, билирубин ≤10,7 мкмоль/л. Важно отметить, что наилучшие значения точности демонстрирует алгоритм Random Forest (88,5% на валидационной выборке), однако наиболее чувствительной оказалась математическая модель нейронной сети (90,0% на валидационной выборке).
Для цитирования:
Сваровская А.В., Шабельский А.О., Астанин П.А., Левшин А.В. Факторы риска развития хронической сердечной недостаточности у пациентов с новой коронавирусной инфекцией. Российский кардиологический журнал. 2023;28(1):5169. https://doi.org/10.15829/1560-4071-2023-5169
For citation:
Svarovskaya A.V., Shabelsky A.O., ASTANIN P.A., Levshin A.V. Risk factors for heart failure in patients with COVID-19. Russian Journal of Cardiology. 2023;28(1):5169. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5169
Хроническая сердечная недостаточность (ХСН) сохраняет лидирующее место среди причин сердечно-сосудистой смертности и является в современном мире эпидемией среди терапевтических заболеваний [1]. Затраты на лечение данной категории больных очень велики за счет большого числа повторных госпитализаций, возрастающей стоимости медикаментозного лечения и высокой вероятности инвалидизации [2].
В период пандемии новой коронавирусной инфекции, вызванной SARS-CoV-2, доказано, что наличие ХСН значимо ухудшает прогноз как в период заболевания, так и в период ранней реконвалесценции после перенесенной новой коронавирусной инфекции (COVID-19) [3].
Появляется все больше данных о повреждении сердца, тромбозе и дисфункции миокарда, которые способствуют повышению сердечно-сосудистого риска и смертности [4]. Английскими и американскими учеными доказано, что ангиотензинпревращающий фермент 2 (АПФ-2) имеет сродство с S-гликопротеинами некоторых коронавирусов, в частности, SARS-CoV-2. АПФ-2 представляет собой мембраносвязанную экзопептидазу, играющую жизненно важную роль в сердечно-сосудистой и иммунной системах. АПФ-2 участвует в работе сердца, а также способствует развитию артериальной гипертензии и сахарного диабета [5]. Патологический процесс SARS-CoV-2 начинается со связывания spike-белка вируса с АПФ-2, который высоко экспрессируется в сердце и легочной ткани [6][7]. SARS-CoV-2 в основном поражает эпителиальные клетки альвеол, что приводит к острым респираторным заболеваниям, в частности, к пневмонии, нередко ведущей к острому респираторному дистресс-синдрому. Предполагается, что коронавирус SARS-CoV-2 проникает в клетки через рецептор АПФ-2, в связи с чем нарушение в регуляции ренин-ангиотензиновой системы может привести к тяжелому течению COVID-19 [8]. Пациенты с сопутствующей ХСН, у которых часто встречается неадекватная активация ренин-ангиотензиновой системы, могут быть особенно восприимчивы к осложнениям, связанным с COVID-19.
Среди пациентов, госпитализированных с новой коронавирусной инфекцией COVID-19, больные с ХСН представляют собой группу с самым значительным потенциальным риском осложнений из-за высокой распространенности сопутствующих заболеваний, в т.ч. и хронической болезни почек (ХБП) [9].
В настоящее время ни в отечественной, ни в зарубежной литературе нет данных о возможных факторах риска развития сердечной недостаточности у пациентов, госпитализированных с COVID-19, в связи с этим представляется актуальным исследование клинических и биохимических показателей в данной когорте пациентов. Работа является продолжением анализа реальной клинической практики, опубликованной ранее [10].
Цель — установить факторы риска развития ХСН у пациентов с COVID-19.
Материал и методы
Исследование было ретроспективным, неинтервенционным, основанным на данных электронных историй болезни в период с ноября 2020г по февраль 2021г. Критерии включения: пациенты с подтвержденным диагнозом COVID-19 путем обнаружения нуклеиновых кислот SARS-CoV-2 в мазках из зева методом полимеразной цепной реакции и госпитализированные в стационар. Критерии исключения: отказ от участия в исследовании, возраст моложе 18 лет, пациенты с острыми формами ишемической болезни сердца, декомпенсированная ХСН на момент госпитализации в стационар. Пациенты получали терапию в соответствии с действующими на тот момент "Временными методическими рекомендациями. Профилактика, диагностика и лечение новой коронавирусной инфекции (СОVID-19)", версия 9 (26.10.2020г). В исследование включен 151 пациент. Сбор клинико-анамнестических и лабораторных данных осуществляли путем анализа электронных историй болезни. Собираемые сведения включали информацию о возрасте, поле, индексе массы тела, курении. Оценивали наличие сопутствующей патологии: ожирение, артериальная гипертензия, сахарный диабет, ишемическая болезнь сердца, ХСН, ХБП, перенесенный инфаркт миокарда, язвенная болезнь желудка и двенадцатиперстной кишки. Результаты лабораторных исследований включали: клинический и биохимический анализ крови, коагулограмму, исследование острофазовых белков (С-реактивного белка (СРБ), ферритина, лактатдегидрогеназы (ЛДГ)), прокальцитонина. Диагноз ХСН подтверждали наличием признаков и симптомов, показателями патологически повышенного уровня N-концевого фрагмента промозгового натрийуретического пептида (NT-proBNP) и данными эхокардиографии. Обследование пациентов и подтверждение функционального класса ХСН проводили в соответствии с действующими клиническими рекомендациями Минздрава России 2020г [11].
При проведении эхокардиографии оценивали следующие структурно-функциональные показатели миокарда: фракция выброса (ФВ, %) левого желудочка (ЛЖ), размер правого желудочка (мм), продольный размер правого (мм) и левого предсердия (мм), толщина межжелудочковой перегородки (мм) и задней стенки (мм) ЛЖ, конечно-систолический (мм) и конечно-диастолический (мм) размер ЛЖ, объемные показатели ЛЖ — конечно-диастолический (мл) и конечно-систолический (мл) объемы. Масса миокарда ЛЖ (г), индекс массы миокарда ЛЖ (г/м2), относительная толщина стенки ЛЖ (мм) рассчитывались по общепринятым формулам. Диастолическую функцию ЛЖ оценивали по трансмитральному диастолическому кровотоку.
В ходе исследования пациентов разделили на две группы в зависимости от наличия в анамнезе ХСН: 1 группа — 46 пациентов с ХСН, 2 группа — 105 пациентов без ХСН.
В качестве конечной точки исследования принимали риск развития ХСН. Все пациенты подписывали информированное согласие на участие в исследовании и дальнейшее проспективное наблюдение, дающее право на обезличенную обработку данных.
Этические аспекты. Внесение пациентов в базу данных проводили в обезличенном виде. Проведение исследования одобрено Локальным этическим комитетом (Выписка из протокола заседания № 204 от 18.11.2020г).
Статистическая обработка включала проведение оценки нормальности распределения количественных данных. Все статистические операции проводили с использованием программно-прикладного пакета SPSS 23. Для оценки нормальности распределения количественных показателей использовали критерий Шапиро-Уилка. В связи с тем, что практически все количественные показатели не подчинялись закону нормального распределения, для их описания применяли медиану и интерквартильный размах (Me [ Q1; Q3]). Оценку различий между количественными показателями производили с использованием критерия Манна-Уитни. Описание бинарных показателей производили путём расчёта долей (%). Для оценки различий и взаимосвязи между бинарными показателями осуществляли построение таблиц сопряженности с их последующим анализом с использованием точного критерия Фишера. Для поиска взаимосвязей между переменными применяли корреляционный анализ с расчетом коэффициентов корреляции Спирмена. Статистически значимыми считали результаты при уровне значимости p<0,050.
На основе результатов предшествующих статистических оценок отобрали не коррелирующие клинико-лабораторные показатели, предположительно определяющие риск развития ХСН. Для данных показателей осуществляли оценку отношений шансов с определением доверительных интервалов (95%). С использованием основных библиотек языка программирования Python (Sklearn, Imblearn, Pandas) выполняли построение бинарных классификаторов на основе следующих алгоритмов машинного обучения: логистическая регрессия, нейронная сеть и ансамбль решающих деревьев (Random Forest). Путём рандомизированного отбора исследуемую выборку пациентов разделили на две группы. В первую группу (обучающая выборка) вошли 90 человек — для обучения моделей использовали значения показателей пациентов только из данной группы. Остальные пациенты (n=61) вошли во вторую группу (тестовая выборка) для валидизации алгоритма и подтверждения его применимости в клинической практике. Оценку работы моделей производили с использованием таких метрик, как точность, чувствительность и специфичность. Дополнительно осуществляли построение ROC-кривых с последующим определением площади (AUC) под ними. При количественном соответствии значений метрик модели для обучающей и тестовой выборок предполагали, что модель бинарной классификации является валидной и может быть использована для дальнейшего изучения с последующим внедрением в клиническую практику.
Результаты
Клинико-демографическая характеристика представлена в таблице 1. Медиана возраста составила 66,2 [ 50; 92] лет.
Таблица 1
Исходная клинико-анамнестическая характеристика обследованных
Показатель | 1 группа (с ХСН), n=46 | 2 группа (без ХСН), n=105 | P |
Пол (мужской/женский), n (%) | 18 (39,1)/28 (60,9) | 42 (40)/63 (60) | 0,920 |
Возраст, лет | 72,0 [ 66,8; 81,3] | 62,0 [ 57,0; 68,0] | <0,001 |
ИМТ, кг/м2 | 29,3 [ 27,0; 32,9] | 30,1 [ 26,9; 35,6] | 0,588 |
Ожирение, n (%) | 22 (47,8) | 53 (50,5) | 0,764 |
Сахарный диабет, n (%) | 16 (34,8) | 31 (29,5) | 0,521 |
АГ, n (%) | 43 (93,5) | 78 (74,3) | <0,001 |
Онкологические заболевания в анамнезе, n (%) | 4 (8,7) | 6 (5,7) | 0,494 |
Инфаркт миокарда в анамнезе, n (%) | 16 (34,8) | 0 (0) | <0,001 |
Фибрилляция предсердий, n (%) | 22 (47,8) | 1 (1,0) | <0,001 |
Хронические неспецифические заболевания легких, n (%) | 2 (4,3) | 4 (3,8) | 1,000 |
Бронхиальная астма, n (%) | 4 (8,7) | 4 (3,8) | 0,247 |
ОНМК, n (%) | 6 (13) | 8 (7,6) | 0,290 |
Язвенная болезнь желудка и ДПК, n (%) | 6 (13) | 5 (4,8) | 0,091 |
Табакокурение, n (%) | 4 (8,7) | 16 (15,2) | 0,434 |
Хроническая болезнь почек, n (%) | 34 (73,9) | 56 (53,3) | 0,020 |
Анемия, n (%) | 13 (28,3) | 25 (23,8) | 0,562 |
Количество сопутствующих заболеваний | 4 [ 3; 5] | 2 [ 1; 3] | <0,001 |
Сатурация, % | 96,0 [ 93,0; 97,0] | 96,0 [ 93,0; 97,0] | 0,721 |
Сокращения: АГ — артериальная гипертензия, ДПК — двенадцатиперстная кишка, ИМТ — индекс массы тела, ОНМК — острое нарушение мозгового кровообращения, ХСН — хроническая сердечная недостаточность, Ме [ Q1; Q3] — медиана и интерквартильный размах, р — уровень значимости.
Из рекомендуемых лекарственных препаратов практически всем назначали антибиотики (в 94,7% случаев), из них наиболее часто цефалоспорины — 63,9%, а также противовирусные препараты — 87,4% (фавипиравир — у 86,1% больных и комбинированный препарат лопинавир + ритонавир — 13,9%). Кроме того, наиболее часто назначавшейся группой лекарственных препаратов были антикоагулянты — 84,1% (нефракционированный гепарин — 47%, эноксапарин натрия — 37,1%). В дальнейшем пациентов перевели на пероральные антикоагулянты (апиксабан, ривароксабан). Глюкокортикоиды применяли в 69,4% случаев, из них метилпреднизолон — 46,3%, дексаметазон — 23,1%. Статистически значимых различий по частоте назначения лекарственных препаратов не выявлено.
В 1 группе больных отмечалось достоверно более выраженное изменение эхокардиографических показателей, отражающих функцию ЛЖ. Так, ФВ ЛЖ была статистически значимо ниже по сравнению с больными без ХСН, а показатели конечно-диастолического и конечно-систолического объемов выше в этой же группе. Диастолическая дисфункция выявлена у всех пациентов с ХСН.
Значимые различия были выявлены по количеству сопутствующих заболеваний: в 1 группе среднее количество составляло 4 [ 3; 5] по сравнению со 2 группой, где количество заболеваний было в 2 раза меньше (р<0,001). Сопутствующие заболевания регистрировали у большинства пациентов во 2 группе (89,5%) и у всех пациентов в 1. Так, во 2 группе более половины пациентов имели ≥4 сопутствующих заболеваний, в то время как в группе больных без ХСН ни у одного пациента не было зарегистрировано >3 заболеваний (рис. 1).
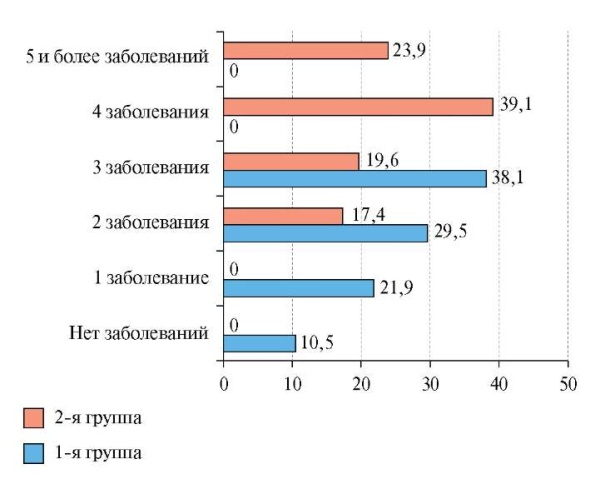
Рис. 1. Количество сопутствующих заболеваний у пациентов.
По результатам лабораторных исследований установили признаки выраженной системной воспалительной реакции: значительное повышение СРБ, ЛДГ прокальцитонина на фоне тромбоцитопении. Также обращало на себя внимание повышение уровня билирубина (р=0,019) и креатинина (р=0,017) (табл. 2).
Таблица 2
Сравнительная характеристика лабораторных показателей в группах пациентов в зависимости от наличия ХСН
Показатель | 1 группа (с наличием ХСН), n=46 | 2 группа (без ХСН), n=105 | р |
Лейкоциты, 109/л | 8,85 [ 6,15; 12,4] | 8,10 [ 6,50; 10,4] | 0,462 |
Гемоглобин, г/л | 132 [ 121; 143] | 132 [ 124; 142] | 0,852 |
Тромбоциты, 109/л | 198 [ 173; 243] | 249 [ 193; 309] | 0,003 |
NLR, % | 4,97 [ 2,70; 8,40] | 3,62 [ 2,26; 5,92] | 0,011 |
СОЭ, мм/ч | 24,0 [ 11,5; 43,0] | 31,0 [ 16,5; 46,0] | 0,130 |
АСТ, ед/л | 32,5 [ 24,0; 46,0] | 33,0 [ 24,0; 43,0] | 0,985 |
АЛТ, ед/л | 32,0 [ 21,0; 52,3] | 33,0 [ 23,0; 46,0] | 0,714 |
Креатинин, мкмоль/л | 110 [ 91,3; 135] | 101 [ 92,0; 117] | 0,017 |
Билирубин, мкмоль/л | 12,8 [ 8,73; 17,4] | 10,3 [ 7,80; 13,0] | 0,019 |
ЛДГ, Ед/л | 731 [ 657; 807] | 678 [ 584; 762] | 0,039 |
СРБ, г/л | 51,3 [ 25,0; 73,0] | 42,0 [ 23,5; 61,0] | 0,036 |
NT-proBNP, пг/мл | 1395 [ 940; 1709] | 78,5 [ 32; 125] | <0,001 |
АЧТВ, сек | 30,0 [ 27,0; 33,0] | 30,0 [ 27,0; 33,0] | 0,543 |
МНО | 1,26 [ 1,16; 1,50] | 1,17 [ 1,09; 1,29] | 0,017 |
Прокальцитонин, нг/мл | 0,22 [ 0,06; 0,81] | 0,08 [ 0,04; 0,16] | <0,001 |
Сокращения: АЛТ — аланинаминотрансфераза, АСТ — аспартатаминотрансфераза, АЧТВ — активированное частичное тромбопластиновое время, ЛДГ — лактатдегидрогеназа, МНО — международное нормализованное отношение, СОЭ — скорость оседания эритроцитов, СРБ — С-реактивный белок, ХСН — хроническая сердечная недостаточность, NLR — нейтрофильно-лимфоцитарное отношение, NT-proBNP — натрийуретический пептид, Ме [ Q1; Q3] — медиана и интерквартильный размах, р — уровень значимости.
При оценке отношений рисков для показателей, статистически значимо различающихся между двумя группами, установили, что наиболее значимыми предикторами, повышающими риск развития ХСН, являются возраст ≥66 лет (отношение шансов 8,038; 95% доверительный интервал 3,405-18,98; p<0,001), уровень прокальцитонина ≥0,09 нг/мл, увеличивающий риск развития ХСН у больных в 3,8 раз (p<0,001), нейтрофильно-лимфоцитарное отношение (NLR) ≥4,11%, тромбоцитопения (≤220×109/л), наличие ХБП в анамнезе. Остальные факторы представлены в таблице 3.
Таблица 3
Оценка отношения шансов
№ | Параметр | Отношение шансов | P |
x1 | Возраст ≥66 лет | 8,038 [ 3,405; 18,98] | <0,001 |
x2 | Тромбоциты ≤220×109/л | 2,528 [ 1,241; 5,147] | 0,010 |
x3 | NLR ≥4,11% | 2,550 [ 1,233; 5,274] | 0,010 |
x4 | МНО ≥1,19 | 2,362 [ 1,143; 4,881] | 0,019 |
x5 | Прокальцитонин ≥0,09нг/мл | 3,778 [ 1,761; 8,104] | <0,001 |
x6 | СРБ ≥48,7 г/л | 1,923 [ 1,018; 3,882] | 0,044 |
x7 | Креатинин ≥102мкмоль/л | 2,227 [ 1,086; 4,565] | 0,027 |
x8 | Билирубин ≤10,7мкмоль/л | 2,063 [ 1,006; 4,227] | 0,046 |
x9 | ЛДГ ≥685 Ед/л | 2,314 [ 1,128; 4,746] | 0,021 |
x10 | QTс ≥407,5 мс | 2,218 [ 1,095; 4,493] | 0,026 |
x11 | Наличие ХБП в анамнезе | 2,479 [ 1,158; 5,310] | 0,018 |
Сокращения: СРБ — С-реактивный белок, ДИ — доверительный интервал, ЛДГ — лактатдегидрогеназа, МНО — международное нормализованное отношение, NLR — нейтрофильно-лимфоцитарное отношение, ХБП — хроническая болезнь почек.
Несмотря на статистическую значимость рассмотренных факторов, для наиболее эффективной оценки риска развития ХСН у пациентов требовался их интегральный учёт с использованием математических моделей.
С использованием основных библиотек языка программирования Python (Sklearn, Imblearn, Pandas) осуществляли построение бинарных классификаторов на основе следующих алгоритмов машинного обучения: логистическая регрессия, нейронная сеть и ансамбль решающих деревьев (Random Forest).
Логистический регрессионный анализ как метод математического моделирования позволяет не только определить предикторы событий, но и построить прогностическую модель, учитывающую несколько параметров. Учитывая то, что в одну прогностическую модель нельзя включать признаки, между которыми имеется статистическая связь, прежде чем создавать математическую модель, включающую более одного предиктора, провели проверку прогностических признаков на коллинеарность — выявили корреляции и ассоциации между признаками.
Корреляционный анализ показал, что наличие ХСН коррелирует с уровнем NT-proBNP (r=0,6; р=0,04) и с ФВ ЛЖ (r=0,7; р=0,002), поэтому их нельзя объединить в одну модель.
Алгоритм оценки риска развития ХСН с использованием модели логистической регрессии включал несколько этапов. Определяли y — значение логистической функции с использованием формулы:
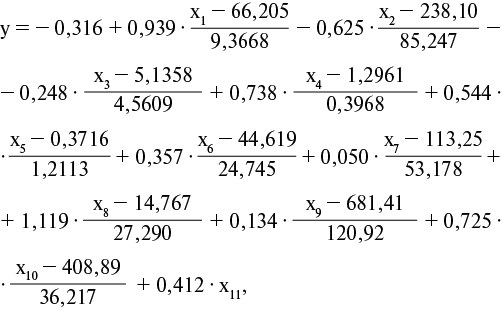
где (-0,316) — константа;
0,936; 0,625; 0,248; 0,738; 0,544; 0,357; 0,050; 1,119; 0,134; 0,725; 0,412 — весовые коэффициенты соответствующих показателей;
66,205; 9,3668; 238,10; 85,247; 5,1358; 4,5609; 1,2961; 0,3968; 0,3716; 1,2113; 44,619; 24,745; 113,25; 53,178; 14,767; 27,290; 681,41; 120,92; 408,89; 36,217 — стандартизованные значения количественных показателей.
При наличии ХБП значение переменной x11 составляет 0,8233. При отсутствии ХБП x11 — -1,2147. Полученное по предыдущей формуле значение использовали для расчёта вероятности риска развития ХСН у пациента по следующей формуле:
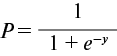
При пороговом значении P, равном 0,5, модель логистической регрессии показала хорошие результаты классификации, о чём свидетельствует высокое значение точности (78,7% на валидационной выборке).
Модели прогнозирования риска развития ХСН с использованием алгоритмов Random Forest и нейронной сети являются более сложными, в связи с чем их ручная пошаговая реализация в статье не представлена. Реализация станет возможна с использованием специализированного программного модуля, разработка которого активно ведётся в настоящий момент. Тем не менее данные модели были апробированы на исследуемой выборке пациентов. Нами были получены хорошие результаты классификации, о чем свидетельствуют значения метрик, рассчитанные для обучающей и валидационной (тестовой) выборок (табл. 4).
Таблица 4
Сравнительная характеристика бинарных классификаторов
№ | Алгоритм машинного обучения | Точность, %/Чувствительность, %/Специфичность, % | |
Обучающая выборка | Валидационная выборка | ||
1 | Логистическая регрессия | 76,2/76,2/76,2 | 78,7/83,7/66,7 |
2 | Ансамбль Random Forest | 87,3/85,1/89,8 | 88,5/80,0/92,7 |
3 | Нейронная сеть | 78,6/92,9/71,4 | 82,0/90,0/80,4 |
Близость значений метрик указывала на отсутствие выраженного переобучения классификаторов и на возможность их применения в клинической практике благодаря репрезентативности и воспроизводимости результатов. Важно отметить, что наилучшие значения точности продемонстрировал алгоритм Random Forest (88,5% на валидационной выборке), однако наиболее чувствительной оказалась математическая модель нейронной сети (90,0% на валидационной выборке).
Хорошее качество бинарной классификации подтверждали результаты ROC-анализа (рис. 2). Для моделей логистической регрессии, Random Forest и нейронной сети AUC составила 0,862, 0,931 и 0,909, соответственно (при оценке работы на валидационной выборке). Близость AUC к единице указывала на высокое качество работы данных классификаторов.
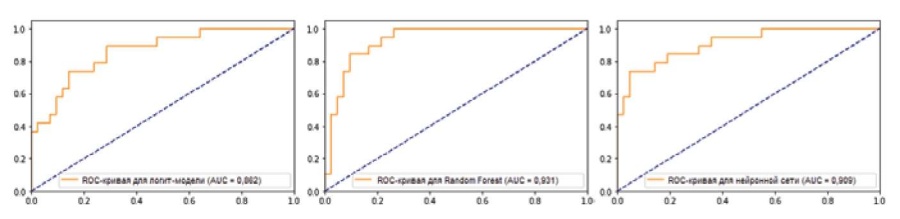
Рис. 2. ROC-кривые для моделей логистической регрессии, Random Forest и нейронной сети (слева направо).
Обсуждение
Взаимосвязь между сердечно-сосудистыми заболеваниями и инфекцией SARS-CoV-2 мало изучена, и механизмы, лежащие в основе этого взаимодействия, остаются неясными. Предполагается, что имеет место двунаправленное влияние между сопутствующими сердечно-сосудистыми заболеваниями и более тяжелыми проявлениями COVID-19 [10].
Нами были проанализированы независимые факторы риска, влияющие на частоту развития ХСН. Результаты показали, что наиболее важными прогностическими факторами являются возраст, уровень прокальцитонина и NLR.
Средний возраст включенных пациентов составил 66 лет (межквартильный интервал 50-92 лет), что было аналогично данным, полученным в других исследованиях [11][12]. Эти данные подтверждают результаты исследований, которые показывают, что возраст является одним из наиболее важных предикторов заболеваемости и смертности. Предполагается, что возрастные изменения иммунологических функций и выработки цитокинов типа 2, по-видимому, приводят к дефициту контроля репликации SARS-CoV-2 и провоспалительным реакциям [13].
Не менее важным биомаркером воспаления при COVID-19-ассоциированной пневмонии является прокальцитонин. По современным данным, прокальцитонин — это белок, состоящий из 116 аминокислот и имеющий молекулярную массу 14,5 кДa. У здорового человека прокальцитонин и кальцитонин обнаруживаются преимущественно в С-клетках щитовидной железы, где в физиологических условиях и происходит их биологический синтез под влиянием кальций-зависимых факторов. В норме синтез прокальцитонина начинается после транскрипции и активации специального гена в С-клетках щитовидной железы. При тяжелой системной инфекции в ответ на воздействие эндотоксинов и определенных бактериальных провоспалительных цитокинов прокальцитонин продуцируется тканями вне щитовидной железы [14]. Кроме того, показано, что лабораторным признаком тромбовоспаления и острого респираторного дистресс-синдрома может быть повышение уровня прокальцитонина. В диагностике и прогнозе течения COVID-19 и ее осложнений имеет значение уровень прокальцитонина. Согласно литературным данным, при концентрации прокальцитонина <0,5 мкг/л это низкий риск бактериальной коинфекции и неблагоприятного исхода, а уровень >0,5 мкг/л — пациенты с высоким риском, и вероятна бактериальная коинфекция [15].
В нашей работе продемонстрировано, что уровень прокальцитонина >0,09 нг/мл, увеличивает риск развития ХСН в 3,8 раз. Это согласуется с данными других исследователей, которые показали, что среди 123 пациентов с COVID-19-ассоциированной пневмонией повышение концентрации прокальцитонина отмечалось в 49,5% случаев. Этими же авторами доказана прямая корреляционная взаимосвязь между уровнем прокальцитонина крови и показателями относительной ширины распределения эритроцитов (r=0,359; p<0,05; r=0,389; p<0,05) и средним объемом тромбоцитов (r=0,342; p<0,05) [16]. Очевидно, что анализ на прокальцитонин при поступлении в стационар является дополнительной информацией для ранней оценки риска и исключения бактериальной инфекции у пациентов с COVID-19.
Анализ литературных данных показал, что динамическое нарастание NLR в периферической крови может служить предиктором неблагоприятного прогноза, в частности летального исхода у пациентов, страдающих дилатационной кардиомиопатией. Для большей части пациентов были характерны лимфоцитопения и повышенное NLR, что свидетельствует о значимом угнетении иммунного ответа [17].
Согласно литературным данным, характерными лабораторными признаками COVID-19 являются лимфопения, повышение уровня D-димера, высокочувствительного СРБ и других маркеров воспаления, снижение уровня альбумина, а также различные отклонения показателей функции почек (повышение уровня креатинина, снижение клиренса креатинина) и функции печени (повышение уровней аспартатаминотрансферазы, аланинаминотрансферазы, ЛДГ) [18], что соотносится с полученными нами результатами.
Так, содержание высокочувствительного СРБ, отражающего активность воспалительного процесса, было значительно повышено у пациентов в группе с ХСН. Также в этой группе установлено повышение прокальцитонина, что свидетельствует о характерной для данного заболевания активации процессов тромбообразования. NLR было подтверждено как потенциальный предиктор неблагоприятного течения COVID-19. Точная взаимосвязь этой корреляции остается пока неясной.
Обнаруженная нами у ряда пациентов дисфункция почек, которую оценивали по уровню креатинина в сыворотке крови и СКФ, может быть обусловлена повреждением клеток почек вирусом SARS-CoV-2, нарушением баланса в ренин-ангиотензиновой системе, активацией воспалительных процессов, свертыванием крови, повреждением эндотелия почечных сосудов, гемодинамической нестабильностью, гипоксемией, окислительным стрессом и снижением уровня вазодилататоров [19].
Выявленные в нашем исследовании у пациентов с COVID-19 изменения уровня общего билирубина, активности ЛДГ, обусловлены высоким тропизмом вируса SARS-CoV-2 к гепатоцитам [20]. Механизмы поражения печени при COVID-19 разнообразны и включают непосредственное повреждение гепатоцитов вирусом SARS-CoV-2, иммунный дисбаланс, обусловленный цитокиновым "штормом", развитие гипоксии и нарушение микроциркуляции [21]. Кроме того, дисфункция печени может быть связана с микроангиопатией и микротромбозами в печеночных сосудах [22]. Согласно данным Boraschi P, et al. (2021) показано, что поражение печени при COVID-19, сопровождающееся повышенными уровнями ферментов и билирубина, в большинстве случаев проявляется легкими и преходящими клиническими симптомами [23].
Установлена тесная взаимосвязь концентрации D-димера с риском развития ХСН. Согласно литературным данным высокие уровни D-димера связаны с 28-дневной смертностью у пациентов с инфекцией или сепсисом, выявленных в отделении неотложной помощи [24].
Механизмы, включающие в себя системные провоспалительные цитокиновые ответы, которые являются медиаторами атеросклероза, непосредственно способствуют разрыву бляшки посредством локального воспаления, индукции прокоагулянтных факторов и гемодинамических изменений, которые предрасполагают к ишемии и тромбозу [25].
Чтобы учесть возможные взаимодействия между клиническими, анамнестическими, лабораторными факторами риска тяжести COVID-19, была предпринята попытка оценить риск развития ХСН у пациентов с COVID-19 с использованием алгоритма машинного обучения. Хотя модель использовала ограниченный размер выборки, результаты ясно показали, что прогностические переменные, такие как возраст, уровень прокальцитонина, отношение NLR ≥4,11%, тромбоцитопения (≤220×109/л), наличие ХБП в анамнезе являются предикторами развития ХСН.
Было предложено несколько прогностических моделей для прогнозирования развития ХСН, и целью настоящего исследования было выявление пациентов, у которых данное осложнение может развиться. Была создана модель машинного обучения, включающая демографические, клинические и лабораторные переменные. Важно отметить, что наилучшие значения точности демонстрирует алгоритм Random Forest (88,5% на валидационной выборке), однако наиболее чувствительной оказалась математическая модель нейронной сети (90,0% на валидационной выборке).
Ограничения исследования. Данное исследование одноцентровое, носит ретроспективный характер. Кроме того, имеет гендерные различия (преобладают женщины) и небольшой объем выборки.
Заключение
Установлено, что предикторами риска развития ХСН являются возраст ≥66 лет, уровень прокальцитонина ≥0,09 нг/мл, отношение NLR ≥4,11%, тромбоцитопения ≤220×109/л, наличие ХБП в анамнезе, уровни ЛДГ ≥685 Ед/л, международное нормализованное отношение ≥1,19, креатинина ≥102 мкмоль/л, интервал QTc на электрокардиограмме ≥407,5 мс, билирубин ≤10,7 мкмоль/л. Важно отметить, что наилучшие значения точности демонстрирует алгоритм Random Forest (88,5% на валидационной выборке), однако наиболее чувствительной оказалась математическая модель нейронной сети (90,0% на валидационной выборке). Предполагается, что полученные данные возможно будет использовать для создания доступного и экономичного метода оценки риска развития ХСН у пациентов с COVID-19 с целью эффективной его реализации в реальной клинической практике.
Благодарности. Авторы выражают благодарность за подготовку данной статьи: Терентьевой Н. В., Склянчук О. Н., Бардышевой А. Л., Завгородней Ю. А., Флигинских Л. Н., Балюк Н. А., Кубаревой Н. В.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Вайсберг А.Р., Фомин И.В., Поляков Д.С. и др. Влияние пандемии СOVID-19 на прогноз пациентов с хронической сердечной недостаточностью III-IV функционального класса. Российский кардиологический журнал. 2022;27(3):4842. doi:10.15829/1560-4071-2022-4842.
2. Тепляков А.Т., Болотская Л.А., Вдовина Т.В. и др. Клинические и иммуномодулирующие влияния полиоксидония для коррекции вторичного иммунодефицита у больных ишемической болезнью сердца, ассоциированной с сахарным диабетом типа 2. Иммунология. 2008;29(1):44-51.
3. Арутюнов Г.П., Тарловская Е.И., Арутюнов А. Г. и др. Международный регистр "Анализ динамики коморбидных заболеваний у пациентов, перенесших инфицирование SARS-CoV-2" (AКТИВ SARS-CoV-2): анализ предикторов неблагоприятных исходов острой стадии новой коронавирусной инфекции. Российский кардиологический журнал. 2021;26(4):4470. doi:10.15829/1560-4071- 2021-4470.
4. Shi S, Qin M, Shen B, et al. Association of cardiac injury with mortality in hospitalized patients with COVID-19 in Wuhan, China. JAMA Cardiol. 2020;5:802-10. doi:10.1001/jamacardio.2020.0950.
5. Donoghue M, Hsieh F, Baronas E, et al. A novel angiotensin-converting enzymerelated carboxypeptidase (ACE2) converts angiotensin I to angiotensin 1-9. Circ Res. 2000;87(5):E1-9. doi:10.1161/01.res.87.5.e1.
6. Ou X, Liu Y, Lei X, et al. Characterization of spike glycoprotein of SARS-CoV-2 on virus entry and its immune cross-reactivity with SARS-CoV. Nat Commun. 2020;11(1):1620. doi:10.1038/s41467-020-15562-9.
7. Wrapp D, Wang N, Corbett KS, et al. Cryo-EM structure of the 2019-nCoV spike in the prefusion conformation. Science. 2020;367(6483):1260-3. doi:10.1126/science.abb2507.
8. Vaduganathan M, Vardeny O, Michel T, et al. Reninangiotensin-aldosterone system inhibitors in patients with Covid-19. N Engl J Med. 2020;382:1653-9. doi:10.1056/NEJMsr2005760.
9. Prabhakaran D, Singh K, Kondal D, et al. Cardiovascular Risk Factors and Clinical Outcomes among Patients Hospitalized with COVID-19: Findings from the World Heart Federation COVID-19 Study. Global Heart. 2022;17(1):40. doi:10.5334/gh.1128.
10. Сваровская А.В., Шабельский А.О., Левшин А.В. Индекс коморбидности Чарлсона в прогнозировании летальных исходов у пациентов с COVID-19. Российский кардиологический журнал. 2022;27(3):4711. doi:10.15829/1560-4071-2022-4711.
11. Petrilli CM, Jones SA, Yang J, et al. Factors associated with hospital admission and critical illness among 5279 people with coronavirus disease 2019 in New York City: prospective cohort study. BMJ. 2020;369:m1966. doi:10.1136/bmj.m1966.
12. Chen T, Wu D, Chen H, et al. Clinical characteristics of 113 deceased patients with coronavirus disease 2019: retrospective study. BMJ. 2020;368:m1091. doi:10.1136/bmj. m1091.
13. Mehra MR, Ruschitzka F. COVID-19 illness and heart failure: a missing link? JACC Heart Fail. 2020;8:512-4. doi:10.1016/j.jchf.2020.03.004.
14. Richardson S, Hirsch JS, Narasimhan M, et al. The Northwell COVID-19 Research Consortium, Barnaby DP, Becker LB, Chelico JD, et al. Presenting characteristics, comorbidities, and outcomes among 5700 patients hospitalized with COVID-19 in the New York City Area. JAMA. 2020;323:2052-9. doi:10.1001/jama.2020.6775.
15. Стулова М.В., Кудряшева И.А., Полунина О.С. и др. Сравнительный клинико-лабораторный анализ COVID-19 ассоциированной пневмонии с внебольничной пневмонией бактериальной этиологии. Современные проблемы науки и образования. 2020;3. doi:10.17513/spno.29905.
16. Муркамилов И.Т., Айтбаев К.А., Фомин В.В. и др. Функциональное состояние почек, уровни Д-димера и прокальцитонина крови при COVID-19. Клиническая нефрология. 2020;4:43-50. doi:10.18565/nephrology.2020.4.43-50.
17. Бахчоян М.Р., Космачева Е.Д., Славинский А.А. Индекс соотношения нейтрофилов к лимфоцитам как предиктор неблагоприятного прогноза у пациентов с сердечной недостаточностью некоронарогенной этиологии. Клиническая практика. 2017;3:48-53.
18. Chen N, Zhou M, Dong X, et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. The Lancet. 2020;395(10223):507-13. doi:10.1016/S0140-6736(20)30211-7.
19. Mohamadi Yarijani Z, Najafi H. Kidney injury in COVID-19 patients, drug development and their renal complications: Review study. Biomedicine and Pharmacotherapy. 2021;142:111966. doi:10.1016/j.biopha.2021.111966.
20. Xu L, Liu J, Lu M, et al. Liver injury during highly pathogenic human coronavirus infections. Liver International. 2020;40(5):998-1004. doi:10.1111/liv.14435.
21. Nardo AD, Schneeweiss-Gleixner M, Bakail M, et al. Pathophysiological mechanisms of liver injury in COVID-19. Liver International. 2021;41(1):20-32. doi:10.1111/liv.14730.
22. McConnell MJ, Kawaguchi N, Kondo R, et al. Liver injury in COVID-19 and IL-6 transsignaling-induced endotheliopathy. Journal of Hepatology. 2021;75(3):647-58. doi:10.1016/j.jhep.2021.04.050.
23. Boraschi P, Giugliano L, Mercogliano G, et al. Abdominal and gastrointestinal manifestations in COVID-19 patients: Is imaging useful? World Journal of Gastroenterology. 2021;27(26):4143-59. doi:10.3748/wjg.v27.i26.4143.
24. Rodelo JR, De la Rosa G, Valencia ML, et al. D-dimer is a significant prognostic factor in patients with suspected infection and sepsis. Am J Emerg Med. 2012;30:1991-9.
25. Davidson JA, Warren-Gash C. Cardiovascular complications of acute respiratory infections: current research and future directions. Expert Rev Anti Infect Ther. 2019;17:939-42.
Об авторах
А. В. СваровскаяРоссия
д.м.н., с.н.с. отдела патологии миокарда,
Томск
А. О. Шабельский
Россия
зам. главного врача по организационно-методической работе,
Асино, Томская область
П. А. Астанин
Россия
аспирант кафедры медицинской кибернетики и информатики, сотрудник (аналитик данных) института цифровой трансформации медицины, м.н.с. лаборатории комплексных проблем оценки риска для здоровья населения и работающих,
Москва
А. В. Левшин
Россия
к.м.н., главный врач,
Асино, Томская область
Дополнительные файлы
Что уже известно о предмете исследования?
- Пациенты с установленным сердечно-сосудистым заболеванием или высоким риском сердечно-сосудистых событий имеют более тяжелое течение новой коронавирусной инфекции (COVID-19) и более высокую смертность.
Что нового?
- Установлены факторы риска развития хронической сердечной недостаточности (ХСН) у пациентов с COVID-19. Выполнено ранжирование выявленных факторов риска по значимости в зависимости от величины отношения шансов, предложены чёткие количественные границы (бинарные точки) принятия решений для каждого фактора.
Возможный вклад в клиническую практику
- Полученные данные возможно будет использовать для создания доступного и экономичного метода оценки риска развития ХСН у пациентов с COVID-19 с целью эффективной его реализации в реальной клинической практике.
Рецензия
Для цитирования:
Сваровская А.В., Шабельский А.О., Астанин П.А., Левшин А.В. Факторы риска развития хронической сердечной недостаточности у пациентов с новой коронавирусной инфекцией. Российский кардиологический журнал. 2023;28(1):5169. https://doi.org/10.15829/1560-4071-2023-5169
For citation:
Svarovskaya A.V., Shabelsky A.O., ASTANIN P.A., Levshin A.V. Risk factors for heart failure in patients with COVID-19. Russian Journal of Cardiology. 2023;28(1):5169. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5169
JATS XML

















































