Перейти к:
Роль гуморальных маркеров в патогенезе сердечной недостаточности с сохраненной фракцией выброса левого желудочка у больных с неокклюзирующим коронарным атеросклерозом
https://doi.org/10.15829/1560-4071-2022-5162
Аннотация
Цель. Исследовать роль молекулярных биомаркеров, потенциально влияющих на формирование и прогрессирование хронической сердечной недостаточности (ХСН) с сохраненной фракцией выброса (СНсФВ) при неокклюзирующем коронарном атеросклерозе.
Материал и методы. Обследовано 48 пациентов с впервые выявленной СНсФВ на фоне необструктивного поражения коронарного русла. В 1 группу (n=31) вошли больные с I-II функциональным классом (ФК) ХСН и во 2 (n=17) — c III ФК ХСН; контрольную группу составили пациенты без сердечной недостаточности (n=17). Оценивали содержание N-концевого фрагмента промозгового натрийуретического пептида (NT-proBNP) и стимулирующего фактора роста, экспрессируемого геном 2 (sST2), показатели диастолической дисфункции и коронарный резерв.
Результаты. Содержание NT-proBNP у больных 1 группы на 45% превышало показатели 2 группы (р<0,001). Средние уровни sST2 не превышали референсные значения, значимо превышали показатель группы контроля (р<0,001). Резерв коронарного кровотока (CFR) снижался (p<0,001) в зависимости от тяжести ХСН. Выявлены отрицательные ассоциации уровней sST2 с фракцией выброса левого желудочка, septal e’ и CFR; NT-proBNP с CFR.
Заключение. СНсФВ на фоне неокклюзирующего коронарного атеросклероза "запускается" фактически за счет прогрессирующего нарушения эндотелиальной функции, влияющей на снижение коронарного и миокардиального резервов, диастолическую функцию, гиперпродукцию гуморальных факторов, инициирующих периваскулярный фиброз и апоптоз кардиомиоцитов.
Ключевые слова
Для цитирования:
Гракова Е.В., Копьева К.В., Гусакова А.М., Сморгон А.В., Мальцева А.Н., Мочула А.В., Завадовский К.В. Роль гуморальных маркеров в патогенезе сердечной недостаточности с сохраненной фракцией выброса левого желудочка у больных с неокклюзирующим коронарным атеросклерозом. Российский кардиологический журнал. 2022;27(10):5162. https://doi.org/10.15829/1560-4071-2022-5162
For citation:
Grakova E.V., Kop’eva K.V., Gusakova A.M., Smorgon A.V., Maltseva A.N., Mochula A.V., Zavadovsky K.V. Role of humoral markers in the pathogenesis of heart failure with preserved ejection fraction in patients with non-obstructive coronary artery disease. Russian Journal of Cardiology. 2022;27(10):5162. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5162
По данным исследования ЭПОХА в России с 2005 по 2017гг число больных с сердечной недостаточностью с сохраненной фракцией выброса (ФВ) (СНсФВ) левого желудочка (ЛЖ) увеличилось на 21,5% и достигло 53% в популяции больных с хронической сердечной недостаточностью (ХСН), а в Европе и США на их долю приходится от 51 до 63% [1].
Заболеваемость СНсФВ увеличивается с возрастом пациентов, наличием артериальной гипертензии (60-80%), почечной недостаточности (51-58%), ишемической болезни сердца (ИБС) (35-70%), в т.ч. при неокклюзирующем коронарном атеросклерозе, ожирении (32-46%), фибрилляции предсердий (15-80%), сахарном диабете (20-45%) и обструктивной болезни легких (24-30%) [2]. Ежегодная смертность больных с СНсФВ колеблется от 1,3 до 17,5%, а 5-летняя смертность превышает 20% (20-25%) [3].
За последние десятилетия установлено, что фенотипическое многообразие клинических проявлений СНсФВ связано с влиянием ряда факторов риска (ФР), которые инициируют активацию одного или нескольких патофизиологических механизмов, причем степень специфической активации каждого из них может значимо различаться, особенно, на фоне имеющейся коморбидной патологии. Обсуждается, что микрососудистое воспаление, эндотелиальная дисфункция (ЭД) и интерстициальный фиброз являются лидирующими механизмами этого фенотипа ХСН, приводят к функциональным изменениям, внутрии внеклеточным структурным перестройкам и завершаются развитием и манифестацией клинического синдрома ХСН [4].
В последние годы пристальное внимание уделяется необструктивной ИБС, поскольку новые данные подтверждают, что необструктивное поражение коронарного русла связано с неблагоприятным прогнозом и сердечно-сосудистыми осложнениями, сопоставимыми по частоте с обструктивной ИБС [5]. При этом при неокклюзирующем атеросклерозе роль как известных, так и потенциально "новых" биомаркеров, способных охарактеризовать несколько биологических путей развития ХСН, включая растяжение миоцитов, стресс, воспаление, окончательно не определена [6].
Цель: исследовать роль молекулярных биомаркеров, потенциально влияющих на процессы формирования и прогрессирования СНсФВ, при неокклюзирующем коронарном атеросклерозе.
Материал и методы
Исследование проведено в соответствии с положением Хельсинкской декларации и одобрено локальным Этическим комитетом Научно-исследовательского института кардиологии, Томского НИМЦ (протокол № 177 от 30.10.2018г). Информированное письменное согласие было получено от всех пациентов до их включения в исследование.
Критерии включения: 1) необструктивное (<50%) поражение коронарных артерий, по данным мультиспиральной компьютерной томографической коронарографии; 2) диастолическая дисфункция (ДД) ЛЖ/повышенное давление наполнения ЛЖ по данным эхокардиографии (ЭхоКГ); 3) сохраненная ФВ ЛЖ по данным ЭхоКГ; 4) уровни N-концевого фрагмента промозгового натрийуретического пептида (NT-proBNP) ≥125 пг/мл; 5) подписанное информированное согласие на участие в исследовании.
Критерии исключения: 1) перенесенный инфаркт миокарда в анамнезе; 2) планируемая коронарная реваскуляризация или реваскуляризация в анамнезе; 3) высокая артериальная гипертензия (>180/>110 мм рт.ст.); 4) систолическая артериальная гипотoния <80 мм рт.ст.; 5) атриoвентрикулярнaя блокaда II-III степени, cиндром cлабости cинуcового узла; 6) гипертрофическая и дилатационная кардиомиопатии; 7) поражения клапанного аппарата сердца (недостаточность митрального, трикуспидального или аортального клапанов ≥2 степени); 8) тромбоэмболия легочной артерии в анамнезе с высокой легочной гипертензией (систолическое давление в правом желудочке ≥45 мм рт.ст.); 9) хроническая форма фибрилляции предсердий; 10) тяжелое течение бронхиальной астмы и хронической обструктивной болезни легких; 11) патология щитовидной железы; 12) выраженная почечная (скорость клубочковой фильтрации по формуле СКD-EPI <30 мл/мин/м2) и печеночная недостаточность; 13) воспалительные заболевания миокарда и перикарда; 14) уровень гемоглобина <100 г/дл.
В исследование включено 48 пациентов (60,4% мужчин) в возрасте 61,1 (55,0; 68,0) лет с впервые диагностированной СНсФВ на фоне необструктивного поражения коронарного русла. Контрольную группу составили больные без симптомов и признаков ХСН сопоставимого возраста.
Определение содержания стимулирующего фактора роста, экспрессируемого геном 2 (sST2) и NTproBNP в сыворотке крови в условиях in vitro проводили методом иммуноферментного анализа (ELISA). Были использованы наборы фирм "Critical Diagnostics Presage® ST2 Assay" и "Biomedica".
ЭхоКГ выполняли всем пациентам по стандартному протоколу на аппарате EPIQ (Philips Ultrasound Inc., США).
Динамическая однофотонная эмиссионная компьютерная томография миокарда с 99mTc-метоксиизобутил-изотнитрилом в условиях фармакологического стресс-теста с аденозинтрифосфатом: подготовка пациентов, протокол исследования, запись и обработка статических и динамических сцинтиграфических данных представлены в ранее опубликованных работах [5]. Однофотонную эмиссионную компьютерную томографию миокарда выполняли на гибридном компьютерном томографе Discovery NM/CT 570с (GE Healthcare, Milwaukee, США), оснащенном гамма-камерой с высокочувствительными полупроводниковыми кадмий-цинк-теллуровыми детекторами (Cadmium-Zinc-Telluride, CZT); определяли стандартные полуколичественные индексы нарушения миокардиальной перфузии и Coronary Flow Reserve (CFR) — коронарный резерв.
Статистическую обработку результатов выполняли с помощью программы Statistica 10.0. Для проверки статистических гипотез при анализе количественных показателей использовали: критерий Краскела-Уоллиса при сравнении ≥3 групп. При анализе качественных признаков проводили анализ таблиц сопряженности с использованием критерия χ2 Пирсона. Если имелись ячейки с ожидаемой частотой <5, то применяли двусторонний точный критерий Фишера или поправку Йетса (для таблиц 2х2). Количественные признаки представлены в виде медианы с квартилями (Q25; Q75). Для поиска взаимосвязей между переменными применяли корреляционный анализ с расчетом коэффициентов корреляции Спирмена. Критический уровень p-value для всех процедур статистического анализа принимали равным 0,05.
Все этапы исследования выполнялись за счет гранта Российского научного фонда № 22-25-20019 и средств Администрации Томской области.
Результаты
В зависимости от функционального класса (ФК) ХСН (по NYHA) пациенты были разделены на 2 группы: в 1 (n=31) вошли больные с I-II ФК ХСН и во 2 группу (n=17) — c III ФК ХСН; контрольную группу составили пациенты без СН (n=17). По большинству клинико-демографических характеристик группы не различались, за исключением уровней исследуемых биомаркеров (С-реактивного белка (СРБ), NT-proBNP и ST2) (табл. 1). Пациенты 2 группы чаще курили и имели нарушение обмена углеводов. Поскольку диагноз ХСН был установлен впервые, то на момент включения в исследование пациенты не получали оптимальную медикаментозную терапию.
Таблица 1
Клинико-демографическая характеристика пациентов
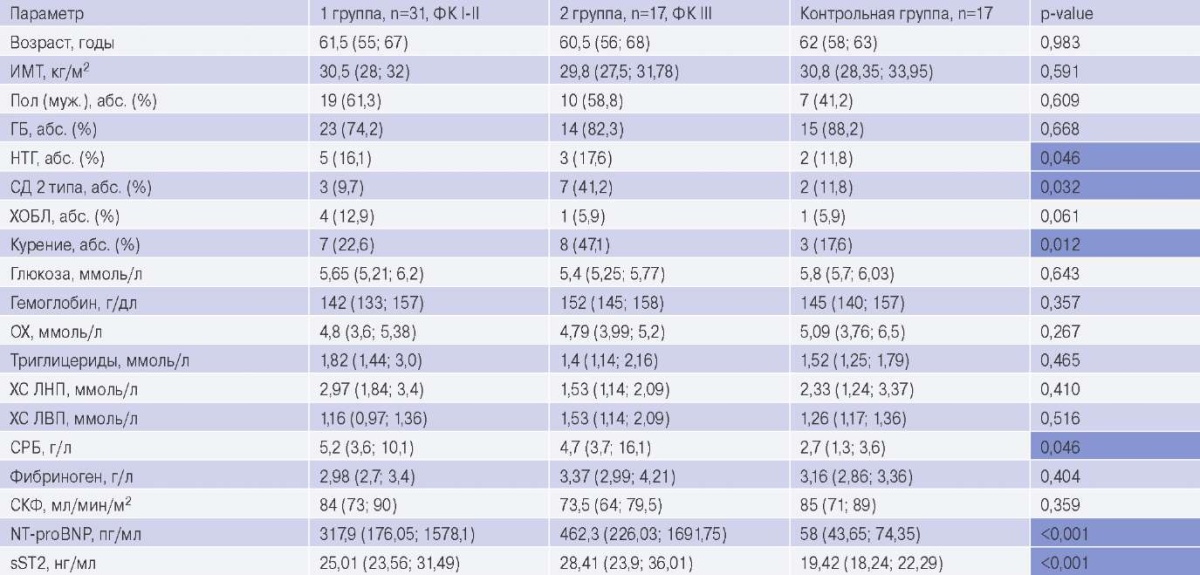
Сокращения: ГБ — гипертоническая болезнь, ИМТ — индекс массы тела, НТГ — нарушение толерантности к глюкозе, ОХ — общий холестерин, САД — систолическое артериальное давление, СД — сахарный диабет, СКФ — скорость клубочковой фильтрации (CRD-EPI), СРБ — С-реактивный белок, ХС ЛВП — холестерин липопротеидов высокой плотности, ХОБЛ — хроническая обструктивная болезнь легких, ХС ЛНП — холестерин липопротеидов низкой плотности, ФК — функциональный класс, NT-proBNP — N-концевой фрагмент промозгового натрийуретического пептида, sST2 — стимулирующий фактор роста, экспрессируемый геном 2.
По основным ЭхоКГ параметрам группы не различались (табл. 2), за исключением показателей диастолического движения крови (Е) и ткани (E’), а также индексированного объема левого предсердия, характеризующих большее повышение жесткости камеры ЛЖ и выраженности ДД у больных с ХСН ФК III NYHA по сравнению с пациентами 1 группы. Величина CFR различалась в зависимости от тяжести ХСН (p<0,001): у пациентов контрольной группы CFR составил 3,12 (2,89; 3,38), тогда как у больных 1 и 2 групп он был в 1,3 и 2,3 раза, соответственно, меньше (рис. 1).
Таблица 2
ЭхоКГ параметры пациентов
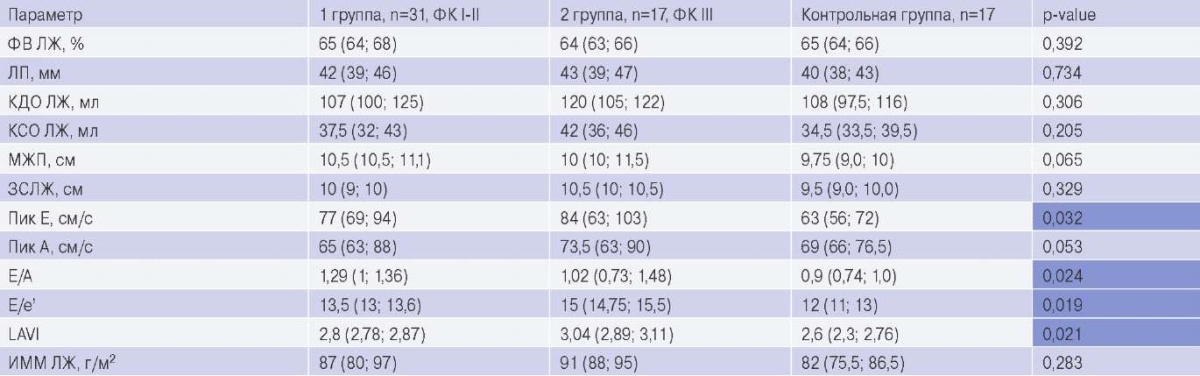
Сокращения: ЗСЛЖ — задняя стенка левого желудочка, ИММ — индекс массы миокарда, КДО — конечный диастолический объем, КСО — конечный систолический объем, ЛЖ — левый желудочек, ЛП — левое предсердие, МЖП — межжелудочковая перегородка, Пик Е — максимальная скорость раннедиастолического потока, Пик А — максимальная скорость потока, обусловленная систолой предсердий, ФВ — фракция выброса, ФК — функциональный класс, Е/А — отношение максимальной скорости раннедиастолического потока (Е) к потоку, обусловленному систолой предсердий (А), E/e’ — отношение ранней диастолической скорости трансмитрального кровотока и ранней диастолической скорости движения латеральной части митрального кольца, LAVI — индексированный объем левого предсердия.
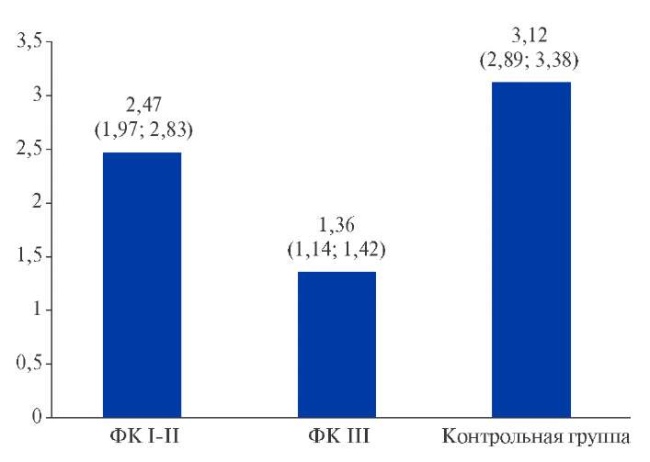
Рис. 1. Взаимосвязь тяжести СН с нарушением резерва коронарного кровотока.
Сокращение: ФК — функциональный класс.
По результатам корреляционного анализа с расчетом коэффициентов корреляции Спирмена у больных ХСН выявлены отрицательные ассоциации уровней ST2 с ФВ ЛЖ, ранней диастолической скоростью движения септальной части митрального кольца и CFR, и положительные — с размером левого предсердия, объемами ЛЖ, параметрами ДД. Аналогично ST2, уровни NT-proBNP отрицательно коррелировали с резервом коронарного кровотока и ФВ ЛЖ, но не с septal e’, и положительно — с максимальными скоростями раннедиастолического потока и потока, обусловленного систолой предсердий; а также отношением максимальной скорости раннедиастолического потока к потоку, обусловленному систолой предсердий (табл. 3). У пациентов без СНсФВ не было выявлено взаимосвязи уровней биомаркеров с инструментальными параметрами.
Таблица 3
Корреляции биомаркеров с инструментальными параметрами у пациентов с ХСН
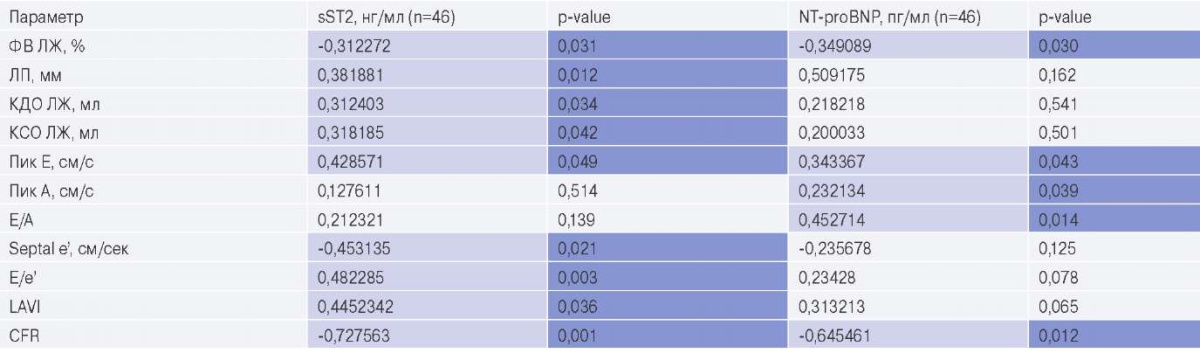
Сокращения: КДО — конечный диастолический объем, КСО — конечный систолический объем, ЛЖ — левый желудочек, ЛП — левое предсердие, ФВ — фракция выброса, Пик Е — максимальная скорость раннедиастолического потока, Пик А — максимальная скорость потока, обусловленная систолой предсердий, Е/А — отношение максимальной скорости раннедиастолического потока (Е) к потоку, обусловленному систолой предсердий (А), E/e’ — отношение ранней диастолической скорости трансмитрального кровотока и ранней диастолической скорости движения латеральной части митрального кольца, CFR — резерв коронарного кровотока (Coronary Flow Reserve), LAVI — индексированный объем левого предсердия, NT-proBNP — N-концевой фрагмент промозгового натрийуретического пептида, sST2 — стимулирующий фактор роста, экспрессируемый геном 2.
Обсуждение
В настоящее время более чем 50% больных с ХСН имеют сохраненную ФВ, при этом эффективные терапевтические стратегии в отношении лечения СНсФВ отсутствуют [3][5]. В последние десятилетия активно изучалась связь сердечно-сосудистых ФР с ДД ЛЖ, ИБС и ХСН, в частности с СНсФВ. Общим результатом этих исследований явилось заключение о том, что потенциальным инструментом для ранней диагностики и прогнозирования риска развития сердечно-сосудистых осложнений может являться комплексная неинвазивная биосигнатура, базирующаяся на использовании биомаркеров в интеграции с данными методов неинвазивной визуализации [7]. Хотя патофизиология синдрома СНсФВ остается до конца не изученной, существуют данные, что в основе его развития лежат процессы гиперактивации окислительного стресса, гипофосфорилирования тайтина кардиомиоцитов, системного воспаления, а номального гомеостаза кальция, коронарная микрососудистая дисфункция и хронотропная недостаточность [8]. Это приводит к увеличению ригидности миоцитов и клеток эндотелия, изменениям в структуре, функции и передаче сигналов клетками, которые уникальны для этой формы СН, развитию миокардиального и периваскулярного фиброза с последующей инициацией ДД и, наконец, манифестацией СНсФВ [9]. С другой стороны, коронарную микроциркуляцию практически невозможно непосредственно визуализировать у пациентов in vivo, но ее можно оценить косвенно с помощью стандартизированных методов, основанных на определении физических и гуморальных факторов, разработанных для выявления их вклада в регуляцию миокардиального кровотока в соответствии с динамическими потребностями местного тканевого метаболизма [10].
Обсуждается, что в патогенезе СНсФВ именно нарушение микроциркуляции является новым связующим звеном между ЭД и ДД ЛЖ [11], а воспалительная активация и дисфункция эндотелия — ключевыми событиями в развитии и патофизиологии атеросклероза [8]. При этом роль потенциально "новых" биомаркеров, способных охарактеризовать несколько биологических путей развития ХСН, учитывая их "несовершенство", окончательно не определена [10][12]. В частности, доказано, что уровни высокочувствительного СРБ связаны с дисфункцией эндотелия и различными стадиями ИБС, при этом его более высокие уровни в плазме связаны с коронарной ЭД, что позволяет предположить, что высокочувствительный СРБ может рассматриваться в качестве независимого маркера аномальной коронарной вазореактивности у пациентов с необструктивной ИБС [13]. В нашем исследовании у больных обеих групп с СНсФВ на фоне необструктивного атеросклероза по сравнению с пациентами контрольной группы установлено значимое повышение уровня высокочувствительного СРБ в 1,9 и 1,7 раз (р=0,046), которое мы также трактуем как одно из проявлений ЭД. При этом содержание NT-proBNP у больных с СНсФВ III ФК по NYHA на 45% превышало таковое по сравнению с больными 2 группы (ФК I-II), явно (в 5,5 и 8 раз, соответственно) отличаясь от показателей группы контроля.
Известно, что натрийуретические пептиды (НУП) продуцируются и секретируются предсердиями и желудочками сердца, а механическое напряжение в кардиомиоцитах, усиливает интенсивность этих процессов, вместе с тем высокая биологическая вариация, зависимость от влияния целого ряда факторов являются недостатками данных пептидов [14]. Несмотря на это, существуют данные, касающиеся наличия взаимосвязи уровней НУП с ЭД в некоторых расовых/этнических группах [6]. Этих недостатков лишен другой биомаркер — sST2, интегрально отражающий напряженность трех ключевых звеньев патогенеза СН: воспаления, фиброза и миокардиального стресса [8]. Обнаружено, что гиперэкспрессия sST2 опосредована ЭД через воздействия провоспалительной среды и окислительного стресса [15]. Мы показали, что, несмотря на то, что уровни sST2 по 3 группам не превышали референсных значений, как и для NTproBNP, выявлены значимые межгрупповые различия (р<0,001): у больных СНсФВ с ФК I-II и ФК III по NYHA (1 и 2 гр.) уровень sST2 на 28,8 и 46,3%, соответственно, превышал показатель группы контроля. Логично предположить, что динамика изученных биомаркеров обусловлена наличием и степенью выраженности ЭД, возможно, развитием периваскулярного фиброза, чему имеются подтверждения от других авторов. Так, Yucel O, et al. установили, что уровни sST2 у больных ИБС и ХСН были связаны как с ЭД, так и с эквивалентом атеросклероза — жесткостью артерий, а по данным Dimitropoulos S, et al. с ЭД и с жесткостью аорты [11]. Анализ биологии двух других пептидов — копептина и катестатина, участвующих в регуляции сердечно-сосудистой системы, показывает перспективность их использования для оценки влияния на течение ИБС и ХСН [14]. Мы рассчитываем, что увеличение изучаемой выборки пациентов в клинической практике позволит нам подтвердить результаты экспериментальных данных.
Известно, что пациенты с СНсФВ, имеющие нормальный уровень биомаркеров и нормальные показатели давления наполнения ЛЖ в покое, демонстрируют повышение жесткости миокарда ЛЖ, диссинхронии и динамической митральной регургитации [2]. В нашем исследовании, несмотря на отсутствие нарушенного паттерна наполнения у пациентов 1 группы, имело место значимое повышение E/e’ (p=0,019), что, наиболее вероятно, свидетельствовало о нарушении расслабления миокарда и повышенного влияния симпатического тонуса на скорость расслабления миокарда ЛЖ у больных СНсФВ, и увеличение ранней диастолической скорости потока (Е) (р=0,032). При этом отмечалась лишь тенденция к приросту трансмитрального кровотока (А), связанного с увеличением систолы предсердий. Известно, что нарушение диастолического движения крови (Е) и ткани (E’) остается одним из критериев ДД у пациентов с СНсФВ, основной причиной которой, по данным недавних клинических исследований, является коронарное снижение плотности капилляров миокарда (микроваскулярная рефракция) со сниженным CFR [13].
Ряд авторов обращают внимание на то, что 85% пожилых пациентов с СНсФВ имеют диабетический фенотип, а сам СД характеризуется микрососудистым разрежением и является одним из сильнейших ФР развития СНсФВ [14]. Недавно было показано, что у больных ХСН ишемической этиологии на фоне стенозирующего коронарного атеросклероза и нарушениями углеводного обмена содержание sST2 значительно превышает концентрацию такового в сыворотке крови пациентов без данных состояний [10]. В нашем исследовании больные 2 группы чаще имели нарушение обмена углеводов и курили, что, наиболее вероятно, также вносило при нестенозирующем атеросклерозе отдельный вклад в ЭД, нарушение микроциркуляции и тяжесть ХСН, но, учитывая ограничения исследования, взаимосвязь данных ФР с уровнем изучаемых молекулярных и инструментальных маркеров станет предметом наших дальнейших исследований при расширении объема выборки пациентов.
При оценке взаимосвязи между молекулярными биомаркерами и показателями диастолы и кровотока выявлено, что со скоростью движения участка ткани e’ (r=-0,45), E/e’ (r=0,48), которые отражают степень расслабления миокарда и влияние симпатического тонуса, а также с коронарным резервом (r= -0,73), а ссоциируется sST2, что, как нам представляется, является логичным и объясняется биологией протеина, его влиянием на патогенез кардиального и периваскулярного фиброза и вазодилатационного ресурса, хронического субклинического воспаления и, наконец, собственно на диастолическое движение сердечной мышцы. По мнению Borlaug BA, et al., более точно, чем давление заполнения ЛЖ внутримиокардиальное напряжение в диастолу отражают НУП, что объясняется тем, что НУП высвобождаются и продуцируются в ответ на увеличение напряжения стенки миокарда [2], при этом внутримиокардиальный стресс, являющийся количественным отражением величины преди постнагрузки ЛЖ на фоне ДД, типично снижен. Вероятно, это объясняет наличие корреляционной взаимосвязи между соотношением скоростей раннего и предсердного диастолического потока, максимальными скоростями потоков, в т.ч. обусловленного систолой предсердий, коронарным резервом и NT-proBNP.
Заключение
Таким образом, на основании проведенного исследования можно предположить, что синдром СНсФВ на фоне неокклюзирующего коронарного атеросклероза "запускается" не только одним патофизиологическим фактором и фактически базируется на прогрессирующем нарушении эндотелиальной функции, влияющей на снижение коронарного и миокардиального резервов, диастолическую функцию, гиперпродукцию гуморальных факторов, инициирующих периваскулярный фиброз и апоптоз кардиомиоцитов.
На данный момент остается неясным, какие процессы приводят к сердечным и сосудистым ограничениям, вызывающим клинический синдром СНсФВ. Перспективными представляются дальнейшие исследования, направленные на изучение взаимосвязи более широкого спектра гуморальных факторов, показателей ДД и коронарного резерва с маркерами автономной регуляции сердечного ритма в зависимости от тяжести клинического течения СНсФВ.
Отношения и деятельность. Исследование выполнено за счет гранта Российского научного фонда № 22-25-20019 "Изучение роли гуморальных маркеров и вегетативной регуляции сердечной деятельности в патогенезе сердечной недостаточности с сохраненной фракцией выброса левого желудочка" https://rscf.ru/project/22-25-20019/ и средств Администрации Томской области.
Список литературы
1. Henning RJ. Diagnosis and treatment of heart failure with preserved left ventricular ejection fraction. World J Cardiol. 2020;26;12(1):7-25. doi:10.4330/wjc.v12.i1.7.
2. Borlaug BA. Evaluation and management of heart failure with preserved ejection fraction. Nat Rev Cardiol. 2020;17:559-73. doi:10.1038/s41569-020-0363-2.
3. Rodríguez-Capitán J, Sánchez-Pérez A, Ballesteros-Pradas S, et al. Prognostic Implication of Non-Obstructive Coronary Lesions: A New Classification in Different Settings. J. Clin. Med. 2021;10:1863. doi:10.3390/jcm10091863.
4. Shah SJ. BNP: Biomarker Not Perfect in heart failure with preserved ejection fraction. European Heart Journal. 2022:43(20):1952-4. doi:10.1093/eurheartj/ehac121.
5. Zavadovsky KV, Mochula AV, Boshchenko AA, et al. Absolute myocardial blood flows derived by dynamic CZT scan vs invasive fractional flow reserve: Correlation and accuracy. J Nucl Cardiol. 2021;28(1):249-59. doi:10.1007/s12350-019-01678-z.
6. Sušić L, Maričić L, Vincelj J, et al. Understanding the association between endothelial dysfunction and left ventricle diastolic dysfunction in development of coronary artery disease and heart failure. Acta Biomed. 2021;92(3):e2021204. doi:10.23750/abm.v92i3.11495.
7. Obokata M, Reddy YNV, Borlaug BA. Diastolic Dysfunction and Heart Failure With Preserved Ejection Fraction: Understanding Mechanisms by Using Noninvasive Methods. JACC: Cardiovascular Imaging. 2020;13(1, Part 2):245-57. doi:10.1016/j.jcmg.2018.12.034.
8. Taqueti VR, Di Carli MF. Coronary Microvascular Disease Pathogenic Mechanisms and Therapeutic Options: JACC State-of-the-Art Review. J Am Coll Cardiol. 2018;72(21):2625- 41. doi:10.1016/j.jacc.2018.09.042.
9. Medina-Leyte DJ, Zepeda-García O, Domínguez-Pérez M, et al. Endothelial Dysfunction, Inflammation and Coronary Artery Disease: Potential Biomarkers and Promising Therapeutical Approaches. Int J Mol Sci. 2021;22(8):3850. doi:10.3390/ijms22083850.
10. Гракова Е.В., Копьева К.В., Тепляков А.Т. и др. Прогностическая роль ST2 у больных хронической сердечной недостаточностью ишемического генеза и нарушением углеводного обмена. Терапевтический архив. 2019;91(1):10-37. doi:10.26442/00403660.2019.01.000025.
11. Yucel O, Gul I, Zararsiz A, et al. Association of soluble ST2 with functional capacity in outpatients with heart failure. Herz. 2018;43:455-60. doi:10.1007/s00059-017-4590-1.
12. Schill F, Persson M, Engström G, et al. Copeptin as a marker of atherosclerosis and arteriosclerosis. Atherosclerosis. 2021;338:64-8. doi:10.1016/j.atherosclerosis.2021.10.012.
13. Zalewska E, Kmieć P, Sworczak K. Role of Catestatin in the Cardiovascular System and Metabolic Disorders. Front. Cardiovasc. Med. 2022:9:909480. doi:10.3389/fcvm.2022.909480.
14. Zeng H, Chen J-X. Microvascular Rarefaction and Heart Failure With Preserved Ejection Fraction. Front Cardiovasc Med. 2019;6:15. doi:10.3389/fcvm.2019.00015.
15. Гракова Е.В., Тепляков А.Т., Копьева К.В. и др. Прогностическая роль нового биомаркера ST2 в оценке риска развития неблагоприятных сердечно-сосудистых событий у больных с хронической сердечной недостаточностью c сохраненной и промежуточной фракцией выброса, перенесших реваскуляризацию миокарда. Кардиоваскулярная терапия и профилактика. 2018;17(5):40-6. doi:10.15829/1728-8800-2018-5-40-46.
Об авторах
Е. В. ГраковаРоссия
Гракова Елена Викторовна — доктор медицинских наук, ведущий научный сотрудник отделения патологии миокарда
Томск
К. В. Копьева
Россия
Копьева Кристина Васильевна — кандидат медицинских наук, научный сотрудник отделения патологии миокарда
Томск
А. М. Гусакова
Россия
Гусакова Анна Михайловна — кандидат биологических наук, научный сотрудник клинической лабораторной диагностики
Томск
А. В. Сморгон
Россия
Сморгон Андрей Викторович — младший научный сотрудник, научный сотрудник отделения ультразвуковой и функциональной диагностики
Томск
А. Н. Мальцева
Россия
Мальцева Алина Николаевна — аспирант лаборатории радионуклидных методов исследования
Томск
А. В. Мочула
Россия
Мочула Андрей Викторович — кандидат медицинских наук, старший научный сотрудник лаборатории радионуклидных методов исследования
Томск
К. В. Завадовский
Россия
Завадовский Константин Валерьевич — доктор медицинских наук, заведующий лабораторией радионуклидных методов исследования
Томск
Дополнительные файлы
Рецензия
Для цитирования:
Гракова Е.В., Копьева К.В., Гусакова А.М., Сморгон А.В., Мальцева А.Н., Мочула А.В., Завадовский К.В. Роль гуморальных маркеров в патогенезе сердечной недостаточности с сохраненной фракцией выброса левого желудочка у больных с неокклюзирующим коронарным атеросклерозом. Российский кардиологический журнал. 2022;27(10):5162. https://doi.org/10.15829/1560-4071-2022-5162
For citation:
Grakova E.V., Kop’eva K.V., Gusakova A.M., Smorgon A.V., Maltseva A.N., Mochula A.V., Zavadovsky K.V. Role of humoral markers in the pathogenesis of heart failure with preserved ejection fraction in patients with non-obstructive coronary artery disease. Russian Journal of Cardiology. 2022;27(10):5162. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5162
JATS XML

















































