Перейти к:
Ассоциация нарушений миокардиального кровотока и резерва с факторами риска сердечно-сосудистых заболеваний у пациентов с необструктивным атеросклеротическим поражением коронарных артерий
https://doi.org/10.15829/1560-4071-2023-5158
Аннотация
Цель. Выявить ассоциацию между нарушениями миокардиального кровотока и резерва, по данным динамической однофотонной эмиссионной компьютерной томографии (ОФЭКТ), с факторами риска сердечно-сосудистых заболеваний (ССЗ) у пациентов с необструктивным атеросклеротическим поражением коронарных артерий (КА).
Материал и методы. В исследование были включены пациенты с подозрением на стабильную ишемическую болезнь сердца и необструктивным атеросклеротическим поражением КА (<50%). По данным опроса, анамнеза, амбулаторных карт и историй болезней был проведен анализ основных факторов риска ССЗ. Всем пациентам провели динамическую ОФЭКТ миокарда и анализ липидного профиля в сыворотке крови в условиях in vitro. В зависимости от значения показателя резерва миокардиального кровотока (РМК), были сформированы две группы: 1. Со сниженным РМК <2,0 (сРМК); 2. С нормальным РМК ≥2,0 (нРМК).
Результаты. В исследование включено 47 пациентов: группу сРМК составили 24 пациента (15 мужчин, возраст 56,3±9,1 лет), группу нРМК — 23 пациента (13 мужчин, возраст 58,4±10,7 лет). Статистически значимого различия в группах по частоте встречаемости факторов риска ССЗ установлено не было, однако у пациентов сРМК несколько чаще выявляли дислипидемию (p=0,053): 58% vs 30%, соответственно. При анализе липидного профиля у пациентов сРМК отмечались значимо более высокие уровни общего холестерина (ОХС) и холестерина липопротеинов низкой плотности (ХС ЛНП). При корреляционном анализе были выявлены значимые отрицательные обратные взаимосвязи между показателями РМК с ОХС (ρ=-0,36, p=0,01) и ХС ЛНП (ρ=-0,38, p=0,009). По данным однофакторного логистического регрессионного анализа, статистически значимыми предикторами сниженного РМК являлись: ОХС (отношение шансов (ОШ) 2,32; 95% доверительный интервал (ДИ) 1,17-4,59; p=0,01) и ХС ЛНП (ОШ 2,16; 95% ДИ 1,04-4,51; p=0,04). По данным пошагового многофакторного логистического регрессионного анализа только ОХС являлся независимым предиктором снижения РМК (ОШ 2,32; 95% ДИ 1,17-4,59; p=0,02).
Заключение. РМК, определенный методом динамической ОФЭКТ, ассоциирован с уровнями ОХС и ХС ЛНП. Уровень ОХС является независимым предиктором снижения РМК.
Ключевые слова
Для цитирования:
Мальцева А.Н., Копьева К.В., Мочула А.В., Гуля М.О., Дымбрылова О.Н., Гракова Е.В., Бощенко А.А., Завадовский К.В. Ассоциация нарушений миокардиального кровотока и резерва с факторами риска сердечно-сосудистых заболеваний у пациентов с необструктивным атеросклеротическим поражением коронарных артерий. Российский кардиологический журнал. 2023;28(2):5158. https://doi.org/10.15829/1560-4071-2023-5158
For citation:
Maltseva A.N., Kop’eva K.V., Mochula A.V., Gulya M.O., Dymbrylova O.N., Grakova E.V., Boshchenko A.A., Zavadovsky K.V. Association of impaired myocardial flow reserve with risk factors for cardiovascular diseases in patients with nonobstructive coronary artery disease. Russian Journal of Cardiology. 2023;28(2):5158. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5158
До недавнего времени необструктивное (<50%) атеросклеротическое поражение коронарных артерий (КА) считали прогностически благоприятным признаком. Однако по данным метаанализа, включающего 48 исследований, было установлено, что пациенты с необструктивным атеросклеротическим поражением КА имеют более высокий риск развития неблагоприятных сердечно-сосудистых событий (НССС), по сравнению с пациентами с неизмененными КА (отношение шансов (ОШ) 3,17; 95% доверительный интервал (ДИ) 2,77-3,63; p<0,05) [1]. Рабочая группа Европейского общества кардиологов предполагает, что у большинства пациентов с необструктивным атеросклеротическим поражением КА прогрессирование ишемической болезни сердца (ИБС) и развитие НССС может быть связано с микроваскулярной дисфункцией (МД) [2].
В настоящее время этиология и патогенез МД до конца не изучены. Пациенты с необструктивным атеросклеротическим поражением КА имеют высокую частоту встречаемости классических факторов риска (ФР) сердечно-сосудистых заболеваний (ССЗ): артериальной гипертензии (АГ) (57,1%), дислипидемии (ДЛП) (56,7%), курения (34,1%), отягощенной наследственности по ССЗ (24,5%), сахарному диабету (СД) (21,8%) и др. [1]. Данные ФР могут выступать катализатором для развития окислительного стресса, который ведет к снижению биодоступности NO, повышению концентрации свободных радикалов и молекул клеток адгезии, что провоцирует формирование МД, однако неясно, какой из этих ФР имеет решающее значение [1][3].
В настоящее время такие радионуклидные методы исследования, как позитронная эмиссионная томография (ПЭТ) и динамическая однофотонная эмиссионная компьютерная томография (ОФЭКТ), позволяют изучать функциональное состояние коронарного русла на микроциркуляторном уровне посредством оценки регионального и глобального миокардиального кровотока (МК) в абсолютных значениях (мл/мин/г) и резерва МК (РМК) [4][5].
Ранее в работе Ferenczi P, et al. была установлена ассоциация между МК и показателями липидного профиля, а также наличием СД [6]. Важно отметить, что более половины включенных в исследование пациентов имели обструктивный атеросклероз, что само по себе может влиять на состояние гемодинамики и показатели МД.
На сегодняшний день имеется ограниченное количество работ, посвященных исследованию пациентов с необструктивным атеросклеротическим поражением КА, в т.ч. во взаимосвязи с ФР ССЗ.
Целью исследования являлось выявление ассоциации между нарушениями МК и резерва, по данным динамической ОФЭКТ, с ФР ССЗ у пациентов с необструктивным атеросклеротическим поражением КА.
Материал и методы
Дизайн исследования. В период с 2020 по 2022гг в проспективное исследование были включены пациенты с подозрением на стабильную ИБС, имеющие показания для проведения мультиспиральной компьютерно-томографической коронарографии (МСКТ-КГ).
Критерии включения: 1. наличие жалоб на боли в левой половине грудной клетки, соответствующих типичной или атипичной стенокардии и/или ее эквиваленту — одышке при физической нагрузке; 2. необструктивное атеросклеротическое поражение КА (<50%), выявленное по данным МСКТ-КГ. Критерии исключения: отсутствие атеросклеротического поражения КА; обструктивное поражение КА (≥50%); фракция выброса левого желудочка <50%; неконтролируемая/резистентная АГ; декомпенсированный СД второго/первого типа; морбидное ожирение (индекс массы тела ≥35 кг/м2); хроническая болезнь почек >2 стадии (скорость клубочковой фильтрации <60 мл/мин/1,73 м2); инфаркт миокарда в анамнезе; состояние после реваскуляризации миокарда; наличие врожденной/приобретенной клапанной патологии; кардиомиопатии; воспалительные заболевания миокарда; противопоказания к введению аденозинтрифосфата.
По данным опроса, анамнеза, амбулаторных карт и историй болезней провели анализ основных ФР ССЗ: АГ, ДЛП, курение, отягощенная наследственность, ожирение, нарушение толерантности к глюкозе, СД. Исследование было проведено в соответствии с положением Хельсинкской декларации и одобрено локальным комитетом по биомедицинской этике (протокол № 204 от 18.11.2020г). Все пациенты дали письменное информированное согласие для участия в исследовании.
В соответствии с протоколом научного исследования, всем пациентам провели динамическую ОФЭКТ миокарда и анализ липидного профиля в сыворотке крови в условиях in vitro. Исследование выполнили с использованием научно-исследовательского оборудования "Медицинская геномика" на базе Центра коллективного пользования.
В зависимости от значения РМК, по данным динамической ОФЭКТ, пациенты были подразделены на группы: 1. Со сниженным РМК <2,0 (сРМК); 2. С нормальным РМК ≥2,0 (нРМК).
Динамическая ОФЭКТ миокарда. Подготовка пациентов, протокол исследования, запись, обработка стандартных и динамических сцинтиграфических данных подробно изложены в предыдущих работах [7][8].
Динамическую ОФЭКТ проводили по двухдневному протоколу "покой-нагрузка" с радиофармацевтическим препаратом 99mTc-метокси-изобутил-изотнитрил; для проведения нагрузочной пробы использовали инфузию аденозинтрифосфата (160 мкг/кг/мин) в течение 4 мин.
Все исследования выполняли на гибридном компьютерном томографе Discovery NM/CT 570с (GE Healthcare, США) с высокочувствительными полупроводниковыми кадмий-цинк-теллуровыми (CZT) детекторами. Для получения абсолютных значений МК использовали модель Net Retention с коррекцией аттенюации.
В результате постпроцессинговой обработки получили стандартные индексы нарушения миокардальной перфузии: SSS, SRS, SDS, а также функции левого желудочка при нагрузке: фракция выброса левого желудочка, конечно-диастолический объем, конечно-систолический объем. По данным динамической ОФЭКТ получили количественные показатели: МК при нагрузке (стресс-МК), МК в покое (покой-МК); РМК: отношение стресс-МК/покой-МК.
Липидный профиль. В сыворотке крови натощак (в день проведения динамической ОФЭКТ) количественно определили содержание общего холестерина (ОХС), триглицеридов (ТГ), холестерин липопротеинов низкой и высокой плотности (ХС ЛНП и ХС ЛВП). Оценку уровня ОХС и ТГ проводили колориметрическим методом ("ДИАКОН-ДС", Россия). Содержание ЛВП определили прямым методом без осаждения (DiaSys Diagnostic Systems GmbH, Германия). Содержание ХС ЛНП (если уровень ТГ <4,5 ммоль/л) рассчитали по формуле Фридвальда: ХС ЛНП = ОХС — (ХС ЛВП + ТГ/2,22). При уровне ТГ ≥4,5 ммоль/л, ХС ЛНП определили при помощи набора реагентов (DiaSys Diagnostic Systems GmbH, Германия). Все исследования проводили на полуавтоматическом биохимическом анализаторе (Clima MC-15, RAL Tecnica para el Laboratorio, Испания).
Статистическая обработка данных. Статистическую обработку результатов выполнили в программах STATISTICA 10.0 (StatSoft Inc, США) и MedCalc version 17.4 (MedCalc Software, Бельгия). Графические изображения формировали в программах Jamovi version 2.2.5.0 (The Jamovi project, Австралия) и JASP version 0.16.2 (JASP Team, Нидерланды). Для проверки нормальности выборочных значений использовали критерий Шапиро-Уилка. При описании количественных показателей использовали среднее значение (M) и стандартное отклонение (SD) для выборок, подчиняющихся нормальному закону распределения; медиану (Me) и межквартильные интервалы (Q25%; Q75%) для выборок, не подчиняющихся закону нормального распределения. Качественные данные представляли абсолютными и относительными частотами. Анализ статистической значимости межгрупповых различий проводили с помощью непараметрического критерия Манна-Уитни для количественных признаков и критериев χ2 Пирсона или Фишера для качественных признаков. Для анализа корреляционных связей использовали коэффициент корреляции Спирмена. Для поиска значимых предикторов снижения РМК выполняли однофакторный и многофакторный логистический регрессионный анализ. Статистически значимыми считали различия при p<0,05.
Результаты
В исследование включено 47 пациентов (28 мужчин, возраст 57,4±9,9 лет), соответствующих критериям включения и исключения. Группу сРМК составили 24 пациента (15 мужчин, возраст 56,3±9,1 лет), группу нРМК — 23 пациента (13 мужчин, возраст 58,4±10,7 лет).
Клинико-демографическая характеристика пациентов представлена в таблице 1. Статистически значимого различия в группах по частоте встречаемости ФР ССЗ установлено не было, однако у пациентов сРМК несколько чаще выявляли ДЛП (p=0,053): 58% vs 30%, соответственно.
Пациенты были сопоставимы по получаемой медикаментозной терапии за исключением бета-адреноблокаторов (БАБ), которые чаще получали пациенты нРМК: 61% vs 21%. БАБ III поколения назначались крайне редко: небиволол принимали 1 пациент из группы сРМК и 2 пациента в группе нРМК. Важно отметить, что в группе сРМК 7 пациентов не достигли целевых уровней ХС ЛНП на фоне приема статинов (низкие дозировки: аторвастатин 20 мг/розувастатин 10-20 мг). 5 пациентов из этой подгруппы также получали БАБ без положительного влияния на микроциркуляцию. В группе нРМК 4 пациента не достигли целевых уровней ХС ЛНП на фоне приема статинов (в низких дозировках), 3 из 4 также принимали БАБ.
По данным МСКТ-КГ, группы статистически значимо не различались между собой. Максимальная степень стенозирования составила 45,0 (25,0; 45,0) и 35,0 (25,0; 45,0)%, индекс коронарного кальция — 0,0 (0,0; 154,0) и 40,0 (3,0; 62,0) ед. Агатстона, в первой и во второй группе, соответственно. В коронарном русле общее количество бляшек составило 3,5 (1,0;5,0): из них мягкотканных 1,0 (0,0;2,0), смешанных 0,0 (0,0;1,0) и 0,5 (0,0;1,0). кальцинированных 0,0 (0,0;3,5) и 1,0 (0,0;2,0), в первой и во второй группе, соответственно.
Показатели стандартной перфузионной сцинтиграфии миокарда не различались между группами, при этом значения стресс-МК и покой-МК в группе сРМК были значимо ниже (табл. 2).
При анализе липидного профиля (табл. 3) было установлено, что по сравнению с группой нРМК, у пациентов сРМК отмечались более высокие уровни ОХС и ХС ЛНП (p<0,05). При корреляционном анализе были выявлены значимые взаимосвязи между показателями РМК с ОХС (ρ=-0,36, p=0,01) и ХС ЛНП (ρ=-0,38, p=0,009) (рис. 1), покой-МК c ХС ЛВП (ρ=0,43, p=0,007), SSS с ХС ЛВП (ρ=-0,33, p=0,045), SDS с ТГ (ρ=0,37, p=0,01) и ХС ЛВП (ρ=
-0,35, p=0,04).
По данным однофакторного логистического регрессионного анализа (табл. 4), статистически значимыми предикторами сниженного РМК являлись: ОХС (ОШ 2,32; 95% ДИ 1,17-4,59; p=0,01) и ХС ЛНП (ОШ 2,16; 95% ДИ 1,04-4,51; p=0,04). При этом наличие ДЛП, рассмотренное как категориальный признак, не было ассоциировано со сниженным РМК (p=0,058).
По данным пошагового многофакторного логистического регрессионного анализа только ОХС являлся независимым предиктором снижения РМК (ОШ 2,32; 95% ДИ 1,17-4,59; p=0,02) (рис. 2).
Обсуждение
В данной работе впервые у пациентов с необструктивным атеросклеротическим поражение КА был выполнен анализ ассоциации ФР ССЗ и нарушений микроциркуляции, по данным динамической CZT ОФЭКТ миокарда. В частности было показано, что ОХС являлся независимым предиктором сниженного РМК (рис. 3, 4).
В недавно опубликованном обзоре литературы были приведены примеры исследований с использованием метода ПЭТ с 82Rb или 13N-NH3, в которых было показано, что сниженный РМК (<1,5-2,0) является предиктором развития НССС независимо от степени стенозирования КА у пациентов с ФР ССЗ (АГ, СД, ожирение) [3]. В многоцентровом исследовании Murthy VL, et al. (n=2783) показали, что проведение ПЭТ с 82Rb способствует правильной классификации пациентов с ИБС по значению РМК на группы низкого (РМК >2,0), пограничного (РМК =1,5-2,0) и высокого риска (РМК <1,5). Группа пациентов со сниженным РМК показала 6-кратное увеличение риска смерти от ССЗ, а показатели смертности составили 4,5-9,1% в зависимости от величины стресс-индуцированных дефектов перфузии в периоде наблюдения 1,4 (0,7-3,2) лет [9].
При проведении исследований с определением РМК существует значимая вариабельность интерпретации полученных результатов, т.к. на сегодняшний день не приняты точные границы нормы для количественных показателей динамической ОФЭКТ. Согласно клиническим критериям МД, РМК считается сниженным при значениях от 2,0 до 2,5 в зависимости от методики определения (для инвазивных или ультразвуковых методов) [10]. В вышеупомянутом обзоре литературы приведены примеры исследований, в которых нижняя граница нормы РМК по данным ПЭТ также варьировала (1,5-2,0) [3]. В исследовании Zavadovsky KV, et al, по данным динамической CZT ОФЭКТ миокарда, значение РМК <1,91 являлось предиктором многососудистого поражения КА [8]. В исследовании Murthy VL, et al., по данным ПЭТ с 82Rb, для группы пациентов с пограничным значением РМК были характерны высокие показатели смертности 1,8-4,2%, в то время как для группы с нормальным РМК эти показатели составили 0,1-2,2% [9]. В настоящем исследовании нами предложено классифицировать группы по значению РМК <2,0, чтобы исключить включение пациентов повышенного риска в группу с нормальным РМК.
На сегодняшний день имеется недостаток данных о возможностях метода динамической ОФЭКТ для диагностики МД у пациентов с необструктивным атеросклеротическим поражением КА, в т.ч. с ДЛП.
В исследовании Сергиенко В. Б. и др. было показано, что количественный индекс неравномерности миокардиальной перфузии имеет прямые ассоциации с ХС ЛНП (ρ=0,44) и индексом массы тела (ρ=0,43) [11].
В исследовании Ferenczi P, et al. характеристики липидного профиля (ОХС, ТГ) коррелировали с покой-МК, по данным динамической CZT ОФЭКТ миокарда, но кроме этого наличие СД имело обратную отрицательную корреляцию со стресс-МК и покой-МК [6]. В нашем исследовании только биомаркеры липидного профиля имели ассоциацию с показателями динамической ОФЭКТ, что диктует необходимость дальнейшего изучения возможностей данного метода.
В связи с отсутствием утвержденных клинических рекомендаций по лечению МД, остается актуальным поиск правильной комбинации лекарственных препаратов и их дозировок. Известно, что липидснижающая терапия (ЛСТ) противодействует развитию окислительного стресса, обладает противовоспалительным действием, восстанавливает дисбаланс между механизмами вазодилатации и вазоконстрикции и тем самым оказывает положительное влияние на эндотелий сосудистой стенки [12].
В исследовании Sampietro T, et al. по данным CZT ОФЭКТ было показано, что у пациентов с семейной гиперхолестеринемией РМК не был снижен 2,04±0,8, однако в динамике лечения после афереза липопротеинов данный показатель значимо увеличивался до 2,32±0,68. При этом в группе пациентов, которым был назначен прием препаратов PCSK9i, начальный уровень РМК был также нормальный 2,56±1,0 и в динамике терапии значимо не изменялся [13].
В небольших исследованиях по оценке влияния антигипертензивной терапии на состояние МК и РМК, по данным ультразвуковых методов или ПЭТ, было показано, что данная группа препаратов может оказывать положительное воздействие на эндотелий сосудов [12]. БАБ I и II поколения показали достаточно противоречивые результаты: на фоне терапии у пациентов происходило увеличение РМК, что было опосредовано снижением покой-МК, вероятно за счет снижения потребности миокарда в кислороде и сократительной способности сердца. БАБ III поколения (небиволол, карведилол) сочетают в себе свойства предыдущих поколений, но также имеют выраженное сосудорасширяющее свойство за счет воздействия на путь L-аргинин/NO и высвобождение NO, а также синтез эндотелина-1. Эти эффекты могут улучшать состояние микроциркуляторного русла [12]. Однако результатов крупных многоцентровых исследований, посвященных применению антигипертензивных препаратов для лечения МД, пока не представлено.
Важным методологическим аспектом исследований, посвященных оценке состояния микроциркуляции, является учет медикаментозной терапии на момент включения в исследование. В исследовании Сергиенко В. Б. и др. критерием включения выступало отсутствие приема ЛСТ и антигипергликемической терапии в течение 6 мес. [11]. В исследовании противовоспалительного действия аторвастатина на морфологию атеросклеротических бляшек, по данным ПЭТ с 18F-ФДГ, допускался прием ЛСТ в низких дозировках на первом этапе обследования пациентов (аторвастатин 10 мг/розувастатин 5 мг) [14]. При оценке коронарного резерва, по данным внутрисосудистого ультразвукового исследования, исключались только пациенты, принимающие ЛСТ в максимальных дозах (аторвастатин 80 мг/розувастатин 40 мг) [15].
В настоящее время проводится крупное рандомизированное многоцентровое исследование WARRIOR, целью которого является сравнение интенсивной и обычной медикаментозной терапии в группе пациентов с необструктивным атеросклерозом КА. Интенсивная терапия включает в себя: статины в высоких дозировках (аторвастатин/розувастатин 80 мг), максимально переносимые антигипертензивные препараты (лизиноприл 20 мг/лозартан 50 мг) и антиагрегантную терапию (аспирин 81 мг) [12]. Результаты данного исследования могут послужить отправной точкой для формирования рекомендаций по лечению пациентов с МД и новым витком для проведения прогностических исследований с использованием радионуклидных методов исследования для оценки динамики клинического состояния и исходов.
Ограничения исследования. Одними из ключевых ограничений данной работы являлись относительно небольшой объем выборки и отсутствие референтной методики оценки МД (ПЭТ, интракоронарное исследование). В данной работе мы исключали из анализа пациентов с неконтролируемой/резистентной АГ, морбидным ожирением, декомпенсированным СД для того, чтобы в исследование вошли пациенты с сопоставимой клинической характеристикой. В исследование включены пациенты, получающие ЛСТ и/или антигипертензивные препараты, что могло отразиться на показателях МК и РМК. В то же время в реальной клинической практике пациенты с необструктивным атеросклеротическим поражением КА чаще всего получают данные группы препаратов.
Таблица 1
Клинико-демографическая характеристика пациентов
|
Показатели |
Все пациенты, n=47 |
I группа: |
II группа: |
p-value |
|
Возраст, годы |
57,4±9,9 |
56,3±9,1 |
58,4±10,7 |
0,26 |
|
Мужской пол, n (%) |
28 (60%) |
15 (63%) |
13 (57%) |
0,45 |
|
Артериальная гипертензия, n (%) |
39 (83%) |
19 (79%) |
20 (87%) |
0,68 |
|
Стаж артериальной гипертензии, годы |
13,0 (5,0; 20,0) |
14,0 (5,0; 18,0) |
12,0 (5,0; 20,0) |
0,93 |
|
САД, мм рт.ст. |
123,5 (120,0; 132,5) |
120,0 (120,0; 130,0) |
130,0 (120,0; 135,0) |
0,21 |
|
ДАД, мм рт.ст. |
80,0 (60,0; 90,0) |
80,0 (70,0; 90,0) |
80,0 (60,0; 90,0) |
0,95 |
|
Дислипидемия, n (%) |
21 (45%) |
14 (58%) |
7 (30%) |
0,053 |
|
Курение, n (%) |
8 (17%) |
2 (1%) |
6 (26%) |
0,10 |
|
Отягощенная наследственность, n (%) |
30 (64%) |
13 (54%) |
17 (74%) |
0,14 |
|
Ожирение (ИМТ ≥30,0 кг/м2), n (%) |
22 (46%) |
10 (42%) |
12 (52%) |
0,55 |
|
ИМТ, кг/м2 |
29,6 (27,4; 32,9) |
29,6 (27,4; 33,4) |
30,1 (27,2; 32,8) |
0,63 |
|
Нарушение толерантности к глюкозе, n (%) |
4 (9%) |
1 (0,4%) |
3 (13%) |
0,26 |
|
Сахарный диабет второго типа, n (%) |
9 (19%) |
5 (21%) |
4 (17%) |
0,71 |
|
Глюкоза, ммоль/л |
5,7 (5,4; 6,1) |
5,7 (5,5; 5,9) |
5,7 (5,4; 6,2) |
0,71 |
|
Данные ЭхоКГ и МСКТ-КГ |
||||
|
ФВ ЛЖ (по данным ЭхоКГ), % |
65,0 (64,0; 67,0) |
65,7 (64,0; 67,0) |
65,0 (64,0; 67,0) |
0,97 |
|
Индекс коронарного кальция, ед. Агатстона |
30,0 (0,0; 62,0) |
0,0 (0,0; 154,0) |
40,0 (3,0; 62,0) |
0,48 |
|
Максимальный стеноз коронарных артерий, ٪ |
42,5 (25,0; 45,0) |
45,0 (25,0; 45,0) |
35,0 (25,0; 45,0) |
0,49 |
|
Медикаментозная терапия |
||||
|
Бета-адреноблокаторы, n (%) |
19 (40%) |
5 (21%) |
14 (61%) |
0,003 |
|
иАПФ, n (%) |
13 (28%) |
6 (25%) |
7 (30%) |
0,66 |
|
БРА II, n (%) |
8 (17%) |
3 (13%) |
5 (22%) |
0,39 |
|
Диуретики, n (%) |
4 (9%) |
3 (13%) |
1 (4%) |
0,28 |
|
Статины, n (%) |
32 (68%) |
15 (63%) |
17 (74%) |
0,49 |
|
Доля больных, достигших целевых значений липидного профиля |
21 (66%) |
8 (53%) |
13 (76%) |
0,31 |
|
Антагонисты кальциевых каналов, n (%) |
8 (17%) |
2 (8%) |
6 (26%) |
0,09 |
Сокращения: БРА II — блокаторы рецепторов ангиотензина, ДАД — диастолическое артериальное давление, иАПФ — ингибиторы ангиотензинпревращающего фермента, ИМТ — индекс массы тела, МСКТ-КГ — мультиспиральная компьютерно-томографическая коронарография, нРМК — нормальный резерв миокардиального кровотока, РМК — резерв миокардиального кровотока, САД — систолическое артериальное давление, сРМК — сниженный резерв миокардиального кровотока, ФВ ЛЖ — фракция выброса левого желудочка, ЭхоКГ — эхокардиография, n — количество пациентов, p-value — уровень статистической значимости.
Таблица 2
Сцинтиграфические показатели динамической ОФЭКТ миокарда
|
Показатели |
Все пациенты, n=47 |
I группа: сРМК (РМК ≤2,0), n=24 |
II группа: нРМК (РМК >2,0), n=23 |
p-value |
|
SSS, баллы |
1,0 (0,0; 2,0) |
1,0 (0,0; 2,0) |
1,0 (0,0; 2,0) |
0,38 |
|
SRS, баллы |
0,0 (0,0; 0,0) |
0,0 (0,0; 0,0) |
0,0 (0,0; 0,0) |
0,99 |
|
SDS, баллы |
2,0 (0,0; 2,0) |
1,0 (0,0; 2,0) |
2,0 (0,0; 2,0) |
0,91 |
|
ФВ ЛЖ, ٪ |
68,0 (66,0; 73,0) |
68,5 (66,0; 73,5) |
68,0 (65,0; 72,0) |
0,61 |
|
КДО, мл |
105,0 (95,0; 116,0) |
106,5 (95,5; 118,0) |
103,0 (92,0; 116,0) |
0,29 |
|
КСО, мл |
31,0 (26,0; 41,0) |
32,0 (26,5; 40,5) |
31,0 (24,0; 43,0) |
0,92 |
|
Стресс-МК, мл/мин/г |
1,24 (1,0; 1,86) |
1,06 (0,82; 1,3) |
1,69 (1,14; 2,17) |
0,002 |
|
Покой-МК, мл/мин/г |
0,67 (0,48; 0,93) |
0,76 (0,55; 1,11) |
0,55 (0,44; 0,8) |
0,04 |
|
РМК |
1,97 (1,41; 2,55) |
1,42 (1,19; 1,61) |
2,91 (2,5; 3,31) |
<0,0001 |
Сокращения: КДО — конечно-диастолический объем, КСО — конечно-систолический объем, нРМК — нормальный резерв миокардиального кровотока, ОФЭКТ — однофотонная эмиссионная компьютерная томография, покой-МК — миокардиальный кровоток в покое, РМК — резерв миокардиального кровотока, сРМК — сниженный резерв миокардиального кровотока, стресс-МК — миокардиальный кровоток при нагрузке, ФВ ЛЖ — фракция выброса левого желудочка, n — количество пациентов, p-value — уровень статистической значимости, SDS — summed difference score, SRS — summed rest score, SSS — summed stress score.
Таблица 3
Липидный профиль
|
Показатели |
Все пациенты, n=47 |
I группа: сРМК (РМК ≤2,0), n=24 |
II группа: нРМК (РМК >2,0), n=23 |
p-value |
|
ОХС, ммоль/л |
4,6 (3,9; 5,4) |
5,1 (4,2; 6,0) |
4,5 (3,6; 5,2) |
0,025 |
|
ТГ, ммоль/л |
1,4 (1,1; 1,9) |
1,4 (1,1; 1,9) |
1,3 (0,9; 1,8) |
0,67 |
|
ХС ЛНП, ммоль/л |
2,6 (1,8; 3,3) |
2,7 (2,3; 3,5) |
2,5 (1,5; 3,0) |
0,046 |
|
ХС ЛВП, ммоль/л |
1,4 (1,2; 1,8) |
1,5 (1,3; 1,8) |
1,4 (1,1; 1,6) |
0,35 |
Сокращения: нРМК — нормальный резерв миокардиального кровотока, ОХС — общий холестерин, РМК — резерв миокардиального кровотока, сРМК — сниженный резерв миокардиального кровотока, ТГ — триглицериды, ХС ЛВП — холестерин липопротеинов высокой плотности, ХС ЛНП — холестерин липопротеинов низкой плотности, n — количество пациентов, p-value — уровень статистической значимости.
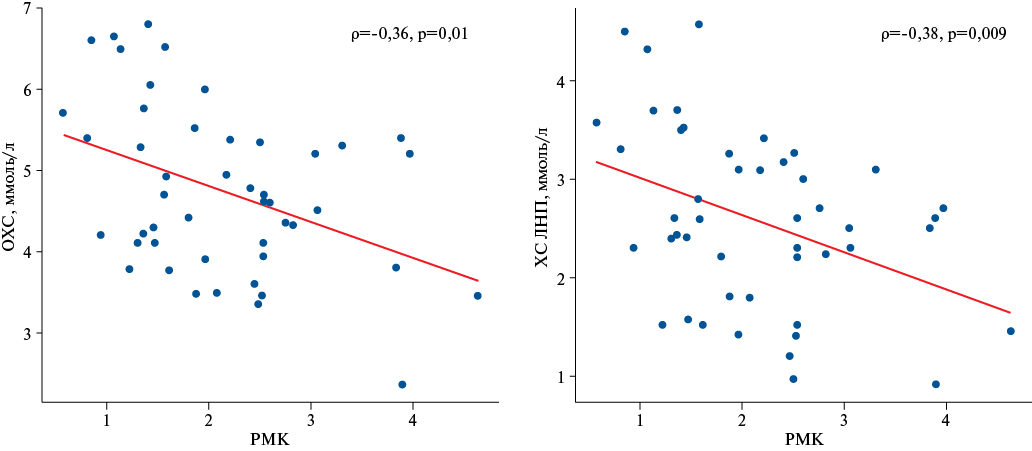
Рис. 1. Корреляционные взаимосвязи РМК и биохимических маркеров ДЛП.
Сокращения: ОХС — общий холестерин, РМК — резерв миокардиального кровотока, ХС ЛНП — холестерин липопротеинов низкой плотности, p-value — уровень статистической значимости, ρ — коэффициент корреляции Спирмена.
Таблица 4
Однофакторный логистический регрессионный анализ: определение предикторов развития снижения РМК
|
Показатели |
ОШ (98٪ ДИ) |
p-value |
|
Возраст |
0,98 (0,92-1,04) |
0,46 |
|
Пол |
0,78 (0,24-2,51) |
0,68 |
|
Артериальная гипертензия |
0,71 (0,14-3,61) |
0,68 |
|
Стаж артериальной гипертензии |
0,98 (0,90-1,07) |
0,67 |
|
САД |
0,99 (0,93-1,04) |
0,61 |
|
ДАД |
1,00 (0,91-1,11) |
0,95 |
|
Курение |
0,26 (0,05-1,49) |
0,13 |
|
Отягощенная наследственность |
0,33 (0,07-1,52) |
0,15 |
|
Ожирение (ИМТ ≥30,0 кг/м2) |
0,71 (0,22-2,25) |
0,56 |
|
ИМТ |
1,08 (0,93-1,26) |
0,32 |
|
Нарушение толерантности к глюкозе |
0,28 (0,03-2,98) |
0,29 |
|
Сахарный диабет 2 типа |
1,32 (0,31-5,71) |
0,71 |
|
Глюкоза |
0,82 (0,48-1,39) |
0,45 |
|
Дислипидемия |
3,2 (0,96-10,66) |
0,058 |
|
ОХС |
2,32 (1,17-4,59) |
0,01 |
|
ТГ |
1,27 (0,55-2,97) |
0,57 |
|
ХС ЛНП |
2,16 (1,04-4,51) |
0,04 |
|
ХС ЛВП |
2,18 (0,33-14,6) |
0,42 |
Сокращения: ДАД — диастолическое артериальное давление, ДИ — доверительный интервал, ИМТ — индекс массы тела, ОХС — общий холестерин, ОШ — отношения шансов, САД — систолическое артериальное давление, ТГ — триглицериды, ХС ЛВП — холестерин липопротеинов высокой плотности, ХС ЛНП — холестерин липопротеинов низкой плотности, p-value — уровень статистической значимости.
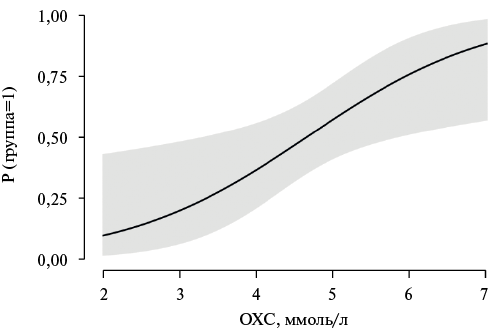
Рис. 2. Логистическая регрессионная кривая, отражающая вероятность снижения РМК в зависимости от уровня ОХС.
Примечание: группы: 1. Со сниженным РМК <2,0; 2. С нормальным РМК ≥2,0.
Сокращения: ОХС — общий холестерин, РМК — резерв миокардиального кровотока.
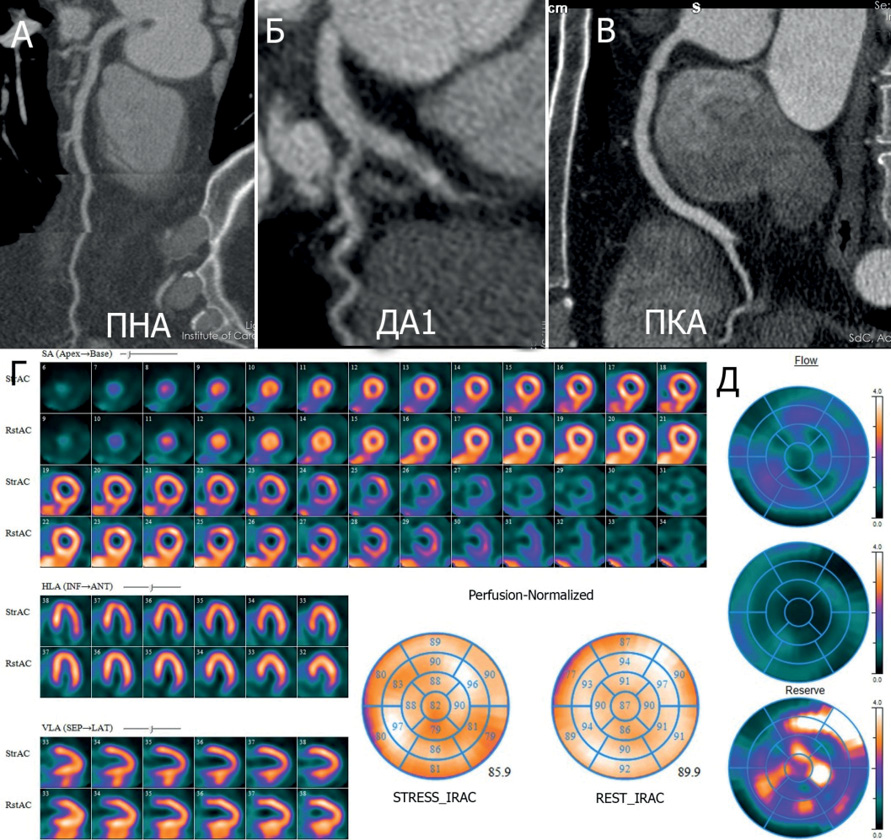
Рис. 3. Клинический пример пациента со сниженным РМК.
Примечание: пациент К., 48 лет, мужчина, ГБ I, АГ контролируемая, ДЛП. Жалобы на ощущение дискомфорта за грудиной. Липидный профиль: ОХС 6,52 ммоль/л, ХС ЛНП 4,58 ммоль/л, ХС ЛВП 1,0 ммоль/л, ТГ 2,05 ммоль/л. МСКТ-КГ (А-В): кальций-scoring 0 ед. Агатстона, мягкотканая бляшка в среднем сегменте ПКА, стеноз 20%. ПСМ (Г): SSS 0 баллов; SRS 0 баллов; SDS 0 баллов. Динамическая ОФЭКТ (Д): глобальный РМК — 1,58. Цветное изображение доступно в электронной версии журнала.
Сокращения: АГ — артериальная гипертензия, ГБ — гипертоническая болезнь, ДА1 — первая диагональная артерия, ДЛП — дислипидемия, МСКТ-КГ — мультиспиральная компьютерно-томографическая коронарография, ОФЭКТ — однофотонная эмиссионная компьютерная томография, ОХС — общий холестерин, ПКА — правая коронарная артерия, ПНА — передняя нисходящая артерия, ПСМ — перфузионная сцинтиграфия миокарда, РМК — резерв миокардиального кровотока, ТГ — триглицериды, ХС ЛВП — холестерин липопротеинов высокой плотности, ХС ЛНП — холестерин липопротеинов низкой плотности, SDS — Summed Difference Score: разница между нагрузкой и покоем, SRS — Summed Rest Score: сумма баллов в покое, SSS — Summed Stress Score: сумма баллов при нагрузке.
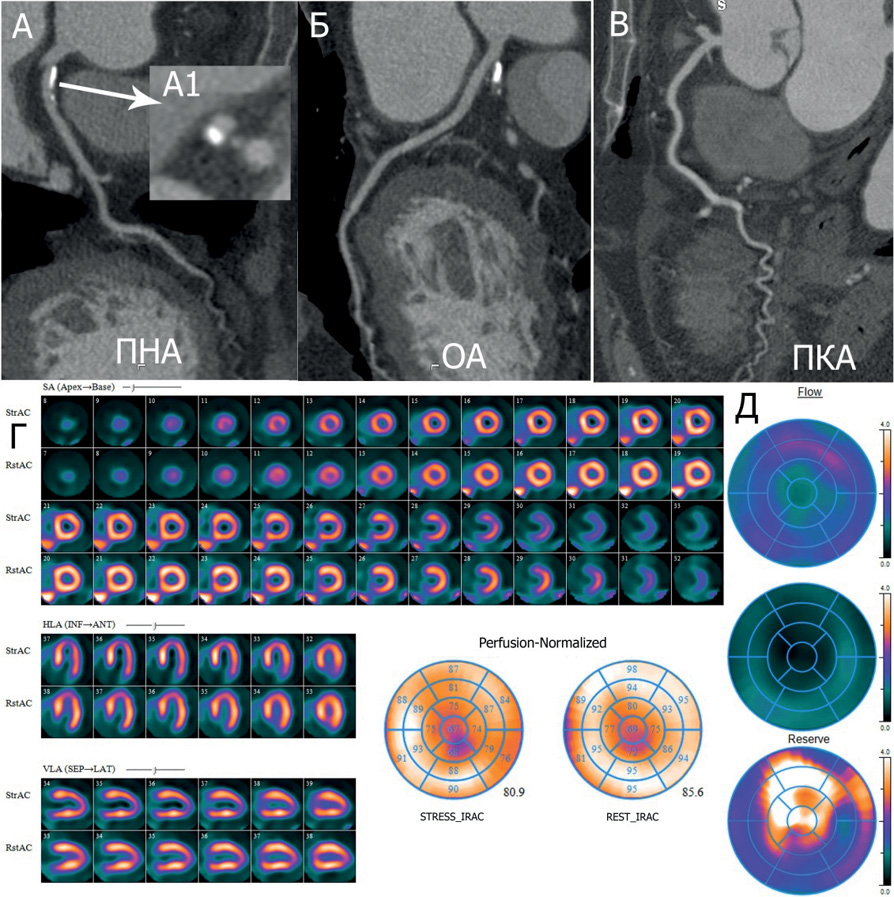
Рис. 4. Клинический пример пациента с нормальным РМК.
Примечание: пациент С., 67 года, женщина, ГБ I, АГ контролируемая. Жалобы на одышку при ФН. Липидный профиль: ОХС 3,45 ммоль/л, ХС ЛНП 1,4 ммоль/л, ХС ЛВП 1,29 ммоль/л, ТГ 1,6 ммоль/л. МСКТ-КГ (А-В): кальций-scoring 115 ед. Агатстона, кальцинированная бляшка в проксимальном сегменте ПНА, стеноз 25%, локальные кальцинаты в дистальном сегменте ПКА, без стенозирования. ПСМ (Г): SSS 0 баллов; SRS 0 баллов; SDS 0 баллов. Динамическая ОФЭКТ (Д): глобальный РМК — 2,53. Цветное изображение доступно в электронной версии журнала.
Сокращения: АГ — артериальная гипертензия, ГБ — гипертоническая болезнь, МСКТ-КГ — мультиспиральная компьютерно-томографическая коронарография, ОА — огибающая артерия, ОФЭКТ — однофотонная эмиссионная компьютерная томография, ОХС — общий холестерин, ПКА — правая коронарная артерия, ПНА — передняя нисходящая артерия, ПСМ — перфузионная сцинтиграфия миокарда, РМК — резерв миокардиального кровотока, ТГ — триглицериды, ФН — физическая нагрузка, ХС ЛВП — холестерин липопротеинов высокой плотности, ХС ЛНП — холестерин липопротеинов низкой плотности, SDS — Summed Difference Score: разница между нагрузкой и покоем, SRS — Summed Rest Score: сумма баллов в покое, SSS — Summed Stress Score: сумма баллов при нагрузке.
Заключение
РМК, определенный методом динамической ОФЭКТ, ассоциирован с уровнями ОХС и ХС ЛНП. Уровень ОХС является независимым предиктором снижения РМК. Проведение динамической ОФЭКТ миокарда в группе пациентов с ДЛП и необструктивным атеросклеротическим поражением КА позволяет идентифицировать наличие МД. Выявление сниженного РМК в когорте пациентов с необструктивным поражением КА может способствовать более интенсивной коррекции модифицируемых ФР и медикаментозной терапии.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Huang FY, Huang BT, Lv WY, et al. The Prognosis of Patients With Nonobstructive Coronary Artery Disease Versus Normal Arteries Determined by Invasive Coronary Angiography or Computed Tomography Coronary Angiography: A Systematic Review. Medicine (Baltimore). 2016;95(11):e3117. doi:10.1097/MD.0000000000003117.
2. Padro T, Manfrini O, Bugiardini R, et al. ESC Working Group on Coronary Pathophysiology and Microcirculation position paper on ‘coronary microvascular dysfunction in cardiovascular disease,. Cardiovasc Res. 2020;116(4):741-55. doi:10.1093/cvr/cvaa003.
3. Мальцева А. Н., Мочула А. В., Копьева К. В. и др. Радионуклидные методы исследования в диагностике микроваскулярной дисфункции при необструктивном атеросклеротическом поражении коронарных артерий. Российский кардиологический журнал. 2021;26(12):4746. doi:10.15829/1560-4071-2021-4746.
4. Zavadovsky KV, Mochula AV, Maltseva AN, et al. The current status of CZT SPECT myocardial blood flow and reserve assessment: Tips and tricks. J Nucl Cardiol. 2022;29(6):3137-3151. doi:10.1007/s12350-021-02620-y.
5. Голухова Е. З., Шавман М. Г., Шурупова И. В. и др. Характеристика миокардиального кровока и коронарного резерва по данным ПЭТ/КТ у пациентов с ИБС с различной степенью стенозов коронарных артерий. REJR. 2021;11(3):67-83. doi:10.21569/2222-7415-2021-11-3-67-83.
6. Ferenczi P, Couffinhal T, Mamou A, et al. Myocardial blood flows and reserves on solid state camera: Correlations with coronary history and cardiovascular risk factors. J Nucl Cardiol. 2022;29(4):1671-1678. doi:10.1007/s12350-021-02659-x.
7. Мочула А. В., Копьева К. В., Мальцева А. Н. и др. Резерв коронарного кровотока у пациентов с хронической сердечной недостаточностью с сохраненной фракцией выброса левого желудочка. Российский кардиологический журнал. 2022;27(2):4743. doi:10.15829/1560-4071-2022-4743.
8. Zavadovsky KV, Mochula AV, Maltseva AN, et al. The diagnostic value of SPECT CZT quantitative myocardial blood flow in high-risk patients. J. Nucl. Cardiol. 2022;29(3):1051-1063. doi:10.1007/s12350-020-02395-8.
9. Murthy VL, Naya M, Foster CR, et al. Improved cardiac risk assessment with noninvasive measures of coronary flow reserve. Circulation. 2011;124(20):2215-24. doi:10.1161/CIRCULATIONAHA.111.050427.
10. Ong P, Camici PG, Beltrame JF, et al. International standardization of diagnostic criteria for microvascular angina. Int J Cardiol. 2018;250:16-20. doi:10.1016/j.ijcard.2017.08.068.
11. Сергиенко В. Б., Аншелес А. А., Сергиенко И. В. и др. Взаимосвязь ожирения, уровня холестерина липопротеидов низкой плотности и перфузии миокарда у пациентов с факторами риска без сердечно-сосудистых заболеваний атеросклеротического генеза. Кардиоваскулярная терапия и профилактика. 2021;20(2):2734. doi:10.15829/1728-8800-2021-2734.
12. Bairey Merz CN, Pepine CJ, Shimokawa H, et al. Treatment of coronary microvascular dysfunction. Cardiovasc Res. 2020;116(4):856-70. doi:10.1093/cvr/cvaa006.
13. Sampietro T, Sbrana F, Dal Pino B, et al. Coronary microcirculatory blood flow significantly increases upon acute and chronic cholesterol lowering: evaluation by cadmium-zinc-telluride cardiac imaging stress test. Eur J Prev Cardiol. 2022;29(8):e272-e274. doi:10.1093/eurjpc/zwac043.
14. Singh P, Emami H, Subramanian S, et al. Coronary Plaque Morphology and the Anti-Inflammatory Impact of Atorvastatin: A Multicenter 18F-Fluorodeoxyglucose Positron Emission Tomographic/Computed Tomographic Study. Circ Cardiovasc Imaging. 2016;9(12):e004195. doi:10.1161/CIRCIMAGING.115.004195.
15. Eshtehardi P, McDaniel MC, Dhawan SS, et al. Effect of intensive atorvastatin therapy on coronary atherosclerosis progression, composition, arterial remodeling, and microvascular function. J Invasive Cardiol. 2012;24(10):522-9.
Об авторах
А. Н. МальцеваРоссия
Алина Николаевна Мальцева — аспирант лаборатории радионуклидных методов исследования.
Томск
Конфликт интересов:
нет
К. В. Копьева
Россия
Кристина Васильевна Копьева — кандидат медицинских наук, научный сотрудник отделения патологии миокарда.
Томск
Конфликт интересов:
нет
А. В. Мочула
Россия
Андрей Викторович Мочула — кандидат медицинских наук, старший научный сотрудник лаборатории радионуклидных методов исследования.
Томск
Конфликт интересов:
нет
М. О. Гуля
Россия
Марина Олеговна Гуля — кандидат медицинских наук, врач-рентгенолог лаборатории радионуклидных методов исследования.
Томск
Конфликт интересов:
нет
О. Н. Дымбрылова
Россия
Очирма Насаковна Дымбрылова — кандидат медицинских наук, младший научный сотрудник отделения клинической лабораторной диагностики.
Томск
Конфликт интересов:
нет
Е. В. Гракова
Россия
Елена Викторовна Гракова — доктор медицинских наук, ведущий научный сотрудник отделения патологии миокарда.
Томск
Конфликт интересов:
нет
А. А. Бощенко
Россия
Алла Александровна Бощенко — доктор медицинских наук, и.о. зам. директора по научной работе, старший научный сотрудник отделения атеросклероза и хронической ишемической болезни сердца.
Томск
Конфликт интересов:
нет
К. В. Завадовский
Россия
Константин Валерьевич Завадовский — доктор медицинских наук, заведующтй отделом лучевой диагностики.
Томск
Конфликт интересов:
нет
Дополнительные файлы
Рецензия
Для цитирования:
Мальцева А.Н., Копьева К.В., Мочула А.В., Гуля М.О., Дымбрылова О.Н., Гракова Е.В., Бощенко А.А., Завадовский К.В. Ассоциация нарушений миокардиального кровотока и резерва с факторами риска сердечно-сосудистых заболеваний у пациентов с необструктивным атеросклеротическим поражением коронарных артерий. Российский кардиологический журнал. 2023;28(2):5158. https://doi.org/10.15829/1560-4071-2023-5158
For citation:
Maltseva A.N., Kop’eva K.V., Mochula A.V., Gulya M.O., Dymbrylova O.N., Grakova E.V., Boshchenko A.A., Zavadovsky K.V. Association of impaired myocardial flow reserve with risk factors for cardiovascular diseases in patients with nonobstructive coronary artery disease. Russian Journal of Cardiology. 2023;28(2):5158. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5158
JATS XML

















































