Перейти к:
Роль гликемического контроля при плановых чрескожных коронарных вмешательствах у пациентов с сахарным диабетом 2 типа
https://doi.org/10.15829/1560-4071-2022-5137
Аннотация
Цель. Оценить ассоциацию гликемического контроля (по достижению индивидуального целевого значения гликированного гемоглобина) с исходами плановых чрескожных коронарных вмешательств (ЧКВ) у пациентов с сахарным диабетом (СД) 2 типа.
Материал и методы. В когортное наблюдательное исследование включено 74 пациента, медиана возраста которых составила 61 (57; 64) год, 49% мужчин — с ранее установленным диагнозом СД 2 типа, которым были определены показания для проведения планового первичного ЧКВ по поводу стабильной ишемической болезни сердца. При включении в исследование и через 1 мес. после его начала определена концентрация глюкозы венозной крови натощак, гликированного гемоглобина (HbA1c), концентрация фруктозамина, сывороточного креатинина. Уровень глюкозы плазмы определяли с помощью гексокиназного метода. Процентное содержание HbA1c в цельной крови определяли иммунотурбидиметрическим методом по конечной точке на автоматическом биохимическом анализаторе Konelab 30i. Концентрация фруктозамина определялась кинетическим колориметрическим методом на автоматическом биохимическом анализаторе Konelab 30i. Статистическая обработка данных осуществлялась с помощью программы Statistica 10.0 компании StatSoft, Inc. (США).
Результаты. На момент включения в исследование у 31% участников отмечено недостижение целевого уровня HbA1c на фоне неоптимальной сахароснижающей терапии в большинстве случаев. Всего в течение 12 мес. после выполнения ЧКВ зарегистрировано 18 (25%) неблагоприятных сердечно-сосудистых событий: у 11 (15%) пациентов отмечено развитие острого коронарного синдрома, среди них у 6 (8%) по данным коронарографии выявлен рестеноз в стенте, у 4 (6%) отмечено прогрессирование атеросклероза, что потребовало выполнения повторного ЧКВ со стентированием другого сосуда, у 2 (3%) отмечено развитие острого нарушения мозгового кровообращения, 3 (4%) пациента были госпитализированы по поводу декомпенсации хронической сердечной недостаточности. Согласно многофакторному логистическому регрессионному анализу, только уровень HbA1c являлся предиктором развития неблагоприятных исходов в течение года после ЧКВ — повышение уровня HbA1c на 1% увеличивало риск неблагоприятных исходов в 1,79 раза (отношение шансов 1,79, 95% доверительный интервал 1,06-3,02, p=0,028). Неудовлетворительный контроль гликемии за 1 мес. до выполнения ЧКВ в 4,04 раза увеличивал риск развития сердечно-сосудистых событий в течение последующего года, нецелевой уровень HbA1c непосредственно перед ЧКВ увеличивал риск неблагоприятных исходов в 4,7 раза, через 5 мес. после ЧКВ — в 7,34 раза.
Заключение. Установлено значение нецелевого уровня гликированного гемоглобина для развития неблагоприятных исходов в течение года после планового ЧКВ на фоне СД 2 типа с увеличением негативного эффекта по мере длительного (после реваскуляризации миокарда) сохранения неудовлетворительного гликемического контроля.
Ключевые слова
Для цитирования:
Каретникова В.Н., Хорлампенко А.А., Осокина А.В., Качергина А.М., Поликутина О.М., Голубовская Д.П., Олейник И.Р., Барбараш О.Л. Роль гликемического контроля при плановых чрескожных коронарных вмешательствах у пациентов с сахарным диабетом 2 типа. Российский кардиологический журнал. 2022;27(12):5137. https://doi.org/10.15829/1560-4071-2022-5137
For citation:
Karetnikova V.N., Kchorlampenko A.A., Osokina A.V., Kochergina A.M., Polikutina O.M., Golubovskaia D.P., Oleinik I.R., Barbarash O.L. Role of glycemic control in elective percutaneous coronary interventions in patients with type 2 diabetes. Russian Journal of Cardiology. 2022;27(12):5137. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5137
Негативное влияние сахарного диабета (СД) 2 типа на течение ишемической болезни сердца (ИБС) и результаты реваскуляризации миокарда убедительно доказано. Выбор оптимальной стратегии реваскуляризации миокарда между коронарным шунтированием (КШ) и чрескожным коронарным вмешательством (ЧКВ) у пациентов с СД 2 типа представляет значительные трудности. Большинство исследований показали, что у пациентов со стабильной ИБС и СД 2 типа, независимо от вида выполненной реваскуляризации, имеется худший прогноз послеоперационного периода по сравнению с пациентами без нарушений углеводного обмена [1]. Наличие СД 2 типа существенно увеличивает риск как ранних, так и поздних осложнений ЧКВ (тромбоза стента, кровотечения, перипроцедурного инфаркта миокарда (ИМ)). Исследование FREEDOM (The Future Revascularization Evaluation in Patients with Diabetes Mellitus: Optimal Management of Multivessel Disease) одно из первых сравнивало стратегии реваскуляризации у пациентов со стабильной ИБС и СД 2 типа с указанием на худшие исходы ЧКВ [2]. Однако и при использовании стентов с лекарственным покрытием второго поколения по данным исследования BEST (Randomized Comparison of Coronary Artery Bypass Surgery and Everolimus-Eluting Stent Implantation in the Treatment of Patients with Multivessel Coronary Artery Disease) получены худшие клинические и ангиографические результаты ЧКВ по сравнению с КШ у пациентов с СД [3]. В качестве одного из ведущих факторов развития неблагоприятных исходов рассматривают хроническую гипергликемию, которая, потенцируя воспалительный ответ, способствует развитию окислительного стресса, усугубляет процесс неоатерогенеза и усиливает склонность к патологической кальцификации [4].
Рядом клинических исследований показана связь периоперационной гипергликемии и повышенного уровня гликированного гемоглобина (HbA 1c) с увеличением числа основных неблагоприятных сердечнососудистых событий (ССС) после эндоваскулярной реваскуляризации миокарда. Напротив, данные другой работы не подтвердили влияние периоперационного уровня HbA 1c на развитие ССС после ЧКВ [5].
Цель исследования: оценить ассоциацию гликемического контроля (по достижению индивидуального целевого значения HbA 1c) с исходами плановых ЧКВ у пациентов с СД 2 типа.
Материал и методы
Проведено когортное обсервационное исследование с одобрением протокола локальным этическим комитетом учреждения. Набор пациентов осуществлен с ноября 2016г по май 2019г. Перед включением в исследование все пациенты подписали добровольное информированное согласие на участие. Всего на основании представленных ниже критериев в исследование было включено 74 пациента с ранее установленным диагнозом СД 2 типа в соответствии с критериями Всемирной организации здравоохранения, которым были определены показания для проведения планового первичного ЧКВ по поводу стабильной ИБС.
Критерии включения: наличие показаний к плановому ЧКВ; установленный диагноз СД 2 типа; подписанное информированное согласие на участие в исследовании.
Критерии невключения: возраст моложе 18 и старше 85 лет, неуспешная попытка ЧКВ, предшествующая реваскуляризация миокарда (КШ и/или ЧКВ), острый коронарный синдром (ОКС) в индексную госпитализацию, ИМ в течение 3 мес., предшествующих исследованию, декомпенсация хронической сердечной недостаточности (ХСН), обострение сопутствующей патологии, протезирование клапанов сердца в анамнезе, наличие клапанных пороков сердца, требующих хирургической коррекции, снижение скорости клубочковой фильтрации (СКФ) по формуле Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI) <45 мл/мин/1,73 м2 (для ограничения влияния почечной дисфункции на исходы ЧКВ).
Основные клинико-анамнестические характеристики пациентов представлены в таблице 1.
До включения в исследование 8% пациентов находились на инсулинотерапии, 65% участников получали терапию пероральными сахароснижающими препаратами (ПССП), 12% получали комбинированную сахароснижающую терапию, включающую инсулин и ПССП, и 15% пациентов придерживались диетотерапии СД (табл. 2, 3).
По поводу ИБС пациенты получали ингибиторы ангиотензинпревращающего фермента/блокаторы рецепторов к ангиотензину II в 78% случаев, бетаблокаторы — в 81%, антиагреганты — в 87%, двойную антиагрегантную терапию — в 12%, статины — в 73%.
У всех пациентов оценены антропометрические показатели (определение индекса массы тела, окружности талии (ОТ), окружности бедер (ОБ), расчет ОТ/ОБ), проводилась запись электрокардиограммы в 16 отведениях, эхокардиографическое исследование, проводился забор венозной крови для оценки лабораторных показателей углеводного обмена (глюкоза, HbA 1c, фруктозамин), липидного обмена (общий холестерин, липопротеины низкой плотности (ЛНП), липопротеины высокой плотности (ЛВП), триглицериды (ТГ)), сывороточного креатинина с расчетом СКФ по формуле CKD-EPI (2009г, модификация 2011г).
Исходно всем пациентам определяли целевой уровень HbA 1c на основании возраста, ожидаемой продолжительности жизни, наличия сердечно-сосудистого заболевания и риска тяжелой гипогликемии. Определение концентрации фруктозамина выполнено в качестве дополнительного краткосрочного маркера гликемического статуса пациентов.
За сутки до и через 48 ч после выполнения ЧКВ определяли уровень сывороточного креатинина с расчетом СКФ по формуле CKD-EPI. Через 1 и 5 мес. после начала исследования определена концентрация глюкозы венозной крови натощак, HbA 1c, концентрация фруктозамина, сывороточного креатинина.
Для профилактики лактат-ацидоза при введении рентгеноконтрастного вещества за 48 ч до проведения ЧКВ пациенты прекращали прием метформина, если таковой ранее был назначен. В период отмены сахароснижающих препаратов гипергликемию корректировали введением инсулина короткого действия под контролем уровней тощаковой и постпрандиальной гликемии. Через 48 ч после рентгеноконтрастной процедуры возобновляли прием отмененных препаратов после контроля уровня сывороточного креатинина и расчета СКФ. Острое повреждение почек, связанное с введением рентгеноконтрастного вещества в соответствии с рекомендациями KDIGO [6], отмечено у 1 (1%) пациента по критерию повышения концентрации креатинина на ≥26,5 мкмоль/л через 48 ч после ЧКВ с нормализацией этого показателя через 72 ч после вмешательства. Пациенту проводилась парентеральная гидратация изотоническим раствором хлорида натрия.
Таблица 1
Основные клинико-анамнестические данные пациентов
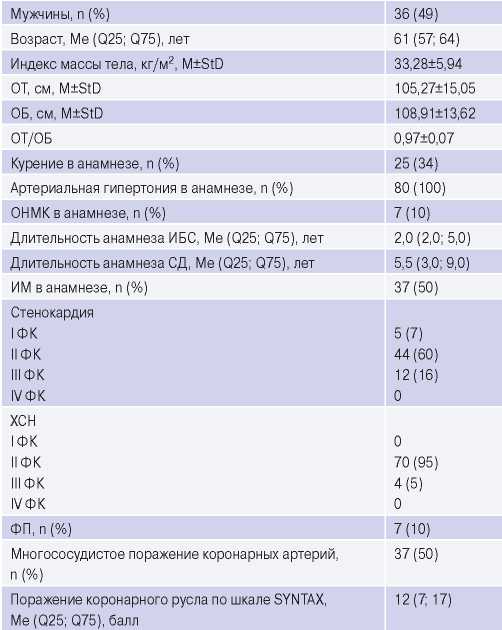
Сокращения: ИБС — ишемическая болезнь сердца, ИМ — инфаркт миокарда, ОБ — окружность бедер, ОНМК — острое нарушение мозгового кровообращения, ОТ — окружность талии, СД — сахарный диабет, ФК — функциональный класс, ФП — фибрилляция предсердий, ХСН — хроническая сердечная недостаточность.
Таблица 2
Лечение СД у пациентов до включения в исследование
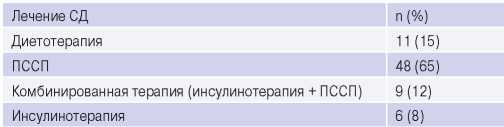
Сокращения: СД — сахарный диабет, ПССП — пероральные сахароснижающие препараты.
Таблица 3
Группы ПССП, используемых до начала исследования
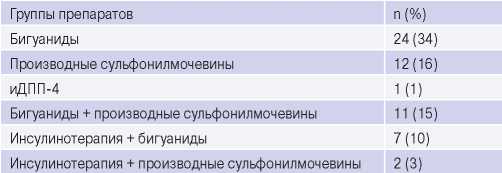
Сокращение: иДПП-4 — ингибиторы дипептидилпептидазы 4-го типа.
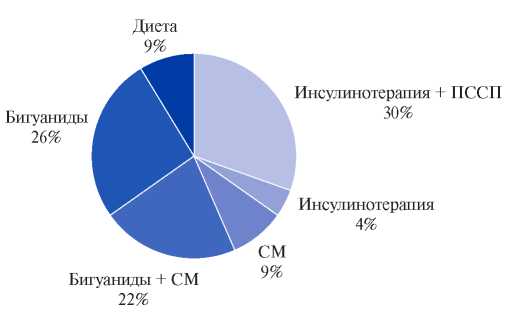
Рис. 1. Лечение СД у пациентов с недостижением целевого HbA 1c до включения в исследование, (%).
Сокращения: ПССП — пероральные сахароснижающие препараты, СМ — сульфонилмочевина.
В госпитальный период все пациенты принимали ацетилсалициловую кислоту в дозе 75-100 мг/сут., а за 6 ч до выполнения ЧКВ больным назначали клопидогрел в нагрузочной дозе 300 мг, а затем в поддерживающей дозе 75 мг/сут. После выполнения коронарного вмешательства всем пациентам без фибрилляции предсердий в анамнезе (91%) был рекомендован прием двойной антитромбоцитарной терапии в течение как минимум 12 мес. после стентирования, а пациентам с фибрилляцией предсердий в анамнезе (10%) — в течение 1-3 мес., с последующим приемом клопидогрела в сочетании с пероральными антикоагулянтами в течение 12 мес. Прием статинов, блокаторов ренин-ангиотензин-альдостероновой системы был рекомендован всем пациентам, 93% — назначены бета-блокаторы. Антигипертензивная, гиполипидемическая, антиагрегантная терапия, назначенная при выписке из стационара, в период исследования коррекции не подвергалась.
Всем пациентам были даны стандартные рекомендации по изменению образа жизни, направленные на снижение веса (ограничение животных жиров, легкоусвояемых углеводов и увеличение физической активности).
В течение периода исследования у всех участников оценивали наличие следующих событий: ОКС, повторной реваскуляризации миокарда (КШ или ЧКВ), острого нарушения мозгового кровообращения (ОНМК), госпитализации по причине декомпенсации ХСН, смерть от сердечно-сосудистых причин.
Уровень глюкозы плазмы определяли с помощью гексокиназного метода.
Процентное содержание HbA 1c в цельной крови определяли иммунотурбидиметрическим методом по конечной точке на автоматическом биохимическом анализаторе Konelab 30i. Нормой считали уровень HbA 1c <6,0%.
Концентрация фруктозамина определялась кинетическим колориметрическим методом на автоматическом биохимическом анализаторе Konelab 30i. Уровень референсного значения составляет ≤285 мкмоль/л.
ЧКВ выполнялось на ангиографическом аппарате INNOVA 3100 (США). В качестве доступа для выполнения процедуры использовали лучевую артерию, при наличии технических сложностей применялся трансфеморальный доступ. Пункцию артерии проводили под местной анестезией по методике Сельдингера с установкой интродьюсера 6-7 Fr. Для визуализации коронарного русла вводили неионные мономерные рентгенконтрастные средства объемом 5-8 мл на одну съемку. ЧКВ со стентированием проводили при наличии гемодинамически значимого сужения просвета коронарной артерии (>70%) и ствола левой коронарной артерии (>50%). Стентирование проводили с применением стентов с лекарственным покрытием.
Статистическая обработка данных осуществлялась с помощью программы Statistica 10.0 компании StatSoft, Inc. (США). Для проверки статистических гипотез о виде распределения использовали критерии Колмогорова-Смирнова с поправкой Лиллиефоса и Шапиро-Уилка. Для описания количественных переменных с нормальным распределением использовали среднее ± стандартное отклонение (М±SD). Количественные переменные с отличным от нормального распределением представлены в виде медианы с указанием межквартильного размаха (Me [Q25; Q75]). Номинальные данные описывались с указанием абсолютных значений и процентных долей (n (%)). Определение различий количественных показателей между двумя независимыми группами проводилось с помощью U-критерия Манна-Уитни. Две зависимые переменные сравнивались с помощью критерия Вилкоксона. Для оценки роли каждого фактора в развитии неблагоприятных ССС рассчитывалось отношение шансов (ОШ) с 95% доверительным интервалом (ДИ). Анализ взаимосвязи между развитием ССС и подмножеством количественных и качественных признаков проводился с использованием прямого пошагового алгоритма линейной логистической регрессии. Величину уровня статистической значимости p принимали равной 0,05.
Результаты
На момент включения в исследование у 31% участников отмечено недостижение целевого уровня HbA 1c.
Терапия пациентов с неэффективным контролем гликемии была представлена следующим образом: 9% участников придерживались диетотерапии, 57% принимали ПССП, из них: 26% бигуаниды в монотерапии и еще 22% в комбинации с производными сульфонилмочевины (СМ), 9% производные СМ, и еще 35% пациентов получали инсулинотерапию (в монотерапии или комбинации) (рис. 1).
Всего в течение 12 мес. после выполнения ЧКВ зарегистрировано 18 (25%) неблагоприятных ССС: у 11 (15%) пациентов отмечено развитие ОКС, среди них у 6 (8%) по данным коронарографии выявлен рестеноз в стенте, у 4 (6%) отмечено прогрессирование атеросклероза, что потребовало выполнения повторного ЧКВ со стентированием другого сосуда, у 2 (3%) пациентов определены показания к повторной реваскуляризации миокарда методом КШ в плановом порядке. У 2 (3%) отмечено развитие ОНМК, 3 (4%) пациентов были госпитализированы по поводу декомпенсации ХСН. Летальные исходы за период наблюдения не зарегистрированы.
Сравнительный анализ групп пациентов с наличием и отсутствием неблагоприятных ССС по клинико-лабораторным характеристикам на момент включения в исследование представлен в таблице 4. Пациенты с наличием неблагоприятных событий имели более высокие показатели ОТ, соотношения ОТ/ОБ, маркеров гликемии (глюкозы натощак, фруктозамина, HbA 1c), ТГ и более низкие концентрации ЛВП, также характеризовались более длительным анамнезом СД.
Для определения предикторов развития ССС проведен однофакторный и многофакторный логистический регрессионный анализ (табл. 5), согласно которому только уровень HbA 1c являлся предиктором развития неблагоприятных исходов в течение года после ЧКВ — повышение уровня HbA 1c на 1% увеличивало риск неблагоприятных исходов в 1,79 раза (ОШ 1,79, 95% ДИ 1,06-3,02, p=0,028).
Неудовлетворительный контроль гликемии за 1 мес. до выполнения ЧКВ в 4,04 раза увеличивал риск развития ССС в течение последующего года, нецелевой уровень HbA 1c непосредственно перед ЧКВ увеличивал риск неблагоприятных исходов в 4,7 раза, через 5 мес. после ЧКВ — в 7,34 раза (табл. 6).
Таблица 4
Клинико-лабораторные характеристики пациентов с наличием и отсутствием неблагоприятных ССС
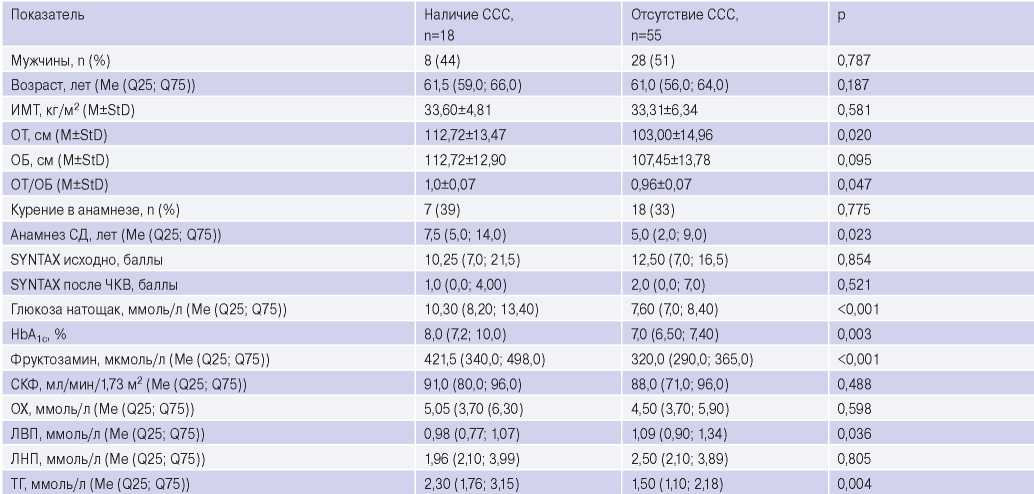
Сокращения: ИМТ — индекс массы тела, ЛВП — липопротеины высокой плотности, ЛНП — липопротеины низкой плотности, ОБ — окружность бедер, ОТ — окружность талии, ОХ — общий холестерин, СД — сахарный диабет, СКФ — скорость клубочковой фильтрации, ССС — сердечно-сосудистое событие, ТГ — триглицериды, ЧКВ — чрескожное коронарное вмешательство, HbA 1c — гликированный гемоглобин.
Таблица 5
Анализ факторов риска возникновения ССС в течение года после выполнения ЧКВ (логистический регрессионный анализ)
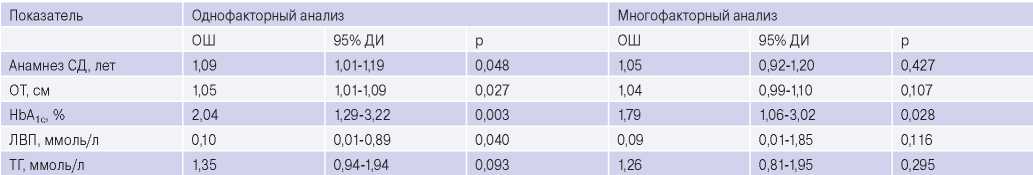
Сокращения: ДИ — доверительный интервал, ЛВП — липопротеины высокой плотности, ОТ — окружность талии, ОШ — отношение шансов, СД — сахарный диабет, ТГ — триглицериды, HbA 1c — гликированный гемоглобин.
Таблица 6
Прогностическая ценность контроля гликемии для оценки риска ССС в течение года после ЧКВ в общей выборке пациентов
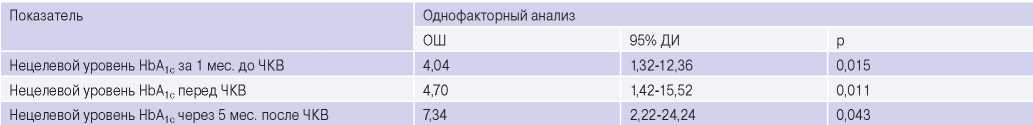
Сокращения: ДИ — доверительный интервал, ОШ — отношение шансов, ЧКВ — чрескожное коронарное вмешательство, HbA 1c — гликированный гемоглобин.
Обсуждение
В проведенном исследовании показана роль неудовлетворительного контроля гликемии в развитии ССС в течение года после эндоваскулярной коронарной реваскуляризации. Так, исходный уровень HbA 1c был статистически значимо выше в группе пациентов с развитием неблагоприятных исходов (8,0 (7,2; 10,0)% vs 7,0 (6,50; 7,40)%, p=0,003), а недостижение целевого HbA 1c за 1 мес. до процедуры реваскуляризации повышало риск развития ССС в течение года после выполнения ЧКВ в 4,04 раза (95% ДИ 1,32- 12,36, p=0,015). Причем важен не только контроль гликемии до выполнения ЧКВ, но также после проведения стентирования коронарных артерий, поскольку недостижение целевого HbA 1c через 5 мес. в настоящем исследовании в большей степени ассоциировалось с повышением риска ССС (ОШ 7,34; 95% ДИ 2,22-24,24, p=0,043).
Следует отметить, что у пациентов с нецелевым HbA 1c чаще развивались неблагоприятные исходы: в основном ОКС, потребовавший выполнения экстренного ЧКВ по поводу рестеноза стента или ЧКВ de novo (p<0,05). Полученные результаты согласуются с данными ряда исследований, в которых показана связь периоперационной гипергликемии, повышенного уровня HbA 1c с увеличением числа основных неблагоприятных событий после эндоваскулярной реваскуляризации миокарда. По данным Kassaian SE, et al. у больных СД с неудовлетворительным контролем гликемии в 2,1 раза выше риск развития сердечно-сосудистых осложнений после выполнения ЧКВ с имплантацией стента, в то время как частота неблагоприятных клинических исходов у пациентов с удовлетворительным контролем гликемии сопоставима с таковой у лиц без диабета [4]. Аналогичные результаты были получены в исследовании Ueda H, et al., в котором повышение уровня HbA 1c на 1% ассоциировалось с увеличением риска неблагоприятных исходов после эндоваскулярной реваскуляризации миокарда (ОШ 1,40; 95% ДИ 1,13-1,74, p=0,002) [7]. Негативное влияние неудовлетворительного гликемического контроля на исходы ЧКВ и дальнейшее течение ИБС связано с реализацией ряда патофизиологических механизмов. Хроническое системное воспаление, инсулинорезистентность, дисфункция эндотелия, оксидативный стресс на фоне хронической гипергликемии рассматриваются в качестве факторов развития и прогрессирования атеросклероза при СД [8]. Гипергликемия сопровождается накоплением активных форм кислорода с дисбалансом в системе про- и антиоксидантов, способствуя развитию оксидативного стресса со снижением выработки оксида азота, нарушением регуляции сосудистого тонуса и прогрессирующей потере физиологических протективных свойств эндотелия. Кроме того, на фоне гипергликемии и инсулинорезистентности существенным изменениям подвергается морфология тромбоцитов с увеличением скорости их продукции и нарушением функции, что на фоне дисбаланса между простациклином и тромбоксаном, способствует резкому увеличению тромбогенного потенциала [9].
Также следует подчеркнуть, что независимо от выбранной стратегии (КШ, ЧКВ или только оптимальная медикаментозная терапия) контроль факторов сердечно-сосудистого риска имеет важное значение, поскольку снижает смертность, а также способствует уменьшению симптомов заболевания. Однако результаты проведённого исследования показали, что подготовка пациента к выполнению планового ЧКВ в амбулаторных условиях не позволяет в полной мере достигать целей, поставленных в соответствии с актуальными клиническими рекомендациями. Так, на момент включения в исследование индивидуальный целевой уровень HbA 1c среди пациентов был достигнут у 69%, целевой уровень ЛНП, соответствующий высокому сердечно-сосудистому риску, — только у 16%, уровень ТГ <1,7 ммоль/л отмечен у 49% больных. Анализ проводимой антидиабетической терапии показал, что только 85% пациентов принимали сахароснижающую терапию, среди них 52% назначена монотерапия различными ПССП, 15% — комбинированная терапия производными СМ и метформина, 20% находились на лечении препаратами инсулина (моно- или в комбинации с ПССП). Из ПССП метформин принимали 57% пациентов, производные СМ — 34%, а ингибиторы дипептидилпептидазы-4 — 1%. При анализе терапии пациентов с неэффективным контролем гликемии обращает на себя внимание, что только 26% пациентов принимали метформин, еще 22% — метформин в комбинации с СМ, 9% пациентов принимали производные СМ, 35% получали лечение инсулином в монотерапии или комбинации, а 9% пациентов придерживались только диетотерапии. Сравнение антидиабетической терапии в группах с наличием и отсутствием неблагоприятных ССС в течение 1 года после ЧКВ выявило лишь тенденцию к более частому назначению инсулина в группе неблагоприятного прогноза, без статистической значимости различия (р=0,06). Согласно рекомендациям по диабету, предиабету и сердечно-сосудистым заболеваниям EASD/ESC 2013г [10], актуальным в период набора материала исследования, метформин рассматривался в качестве терапии первой линии у всех пациентов с СД 2 типа, особенно при наличии ожирения (класс рекомендаций IIa, уровень доказательности B). В то же время назначение производных СМ пациентам с ИБС рекомендуется проводить с осторожностью ввиду риска развития гипогликемий, повышения веса на фоне терапии, а также отсутствия однозначных данных о сердечно-сосудистой безопасности этой группы препаратов [11]. До недавнего времени профилактика развития макрососудистых осложнений у пациентов с СД основывалась на применении антитромбоцитарной и липидснижающей терапии. Однако на сегодняшний день, учитывая результаты исследований EMPA-REG OUTCOME, DECLARE-TIMI 58, LEADER, SUSTAIN-6 [12], назначение современных сахароснижающих препаратов является одним из приоритетных направлений улучшения сердечно-сосудистого прогноза у пациентов с СД, наряду со стандартной терапией ИБС. Следует подчеркнуть, что современные клинические рекомендации Европейского общества кардиологов [13] и отечественный Алгоритм специализированной медицинской помощи больным СД (9-й выпуск) [14] обозначают приоритет современных антидиабетических препаратов (агонистов глюкагоноподобного пептида 1, ингибиторов натрийзависимого глюкозного контраспортера 2 типа), учитывая имеющуюся доказательную базу их высокой эффективности по улучшению исходов ИБС на фоне СД 2 типа, которая требует дальнейшего уточнения в отношении реваскуляризации миокарда в рамках масштабных клинических исследований.
Ограничения исследования. Проведенное когортное исследование с небольшим количество участников установило ассоциацию между уровнем HbA 1c и прогнозом после планового ЧКВ у пациентов с СД 2 типа, для подтверждения гипотезы о повышении эффективности реваскуляризации миокарда путем вмешательств, направленных на гликемический контроль, требуется проведение рандомизированных клинических исследований. Кроме того, в рамках проведенного исследования не оценивалась комплаентность пациентов врачебным рекомендациям по медикаментозной терапии.
Заключение
Таким образом, в течение года после планового ЧКВ у пациентов с СД 2 типа в 24,66% случаев отмечено развитие неблагоприятных ССС: ОКС — у 15,07%, из них в 54,55% с рестенозом в ранее имплантированном стенте, в 36,36% случаях с прогрессированием атеросклероза и вовлечением ранее интактных коронарных артерий (de novo), у 2,74% развитие ОНМК, у 4,11% госпитализация по причине декомпенсации ХСН. При этом нецелевой уровень HbA 1c исходно (за 1 мес. до ЧКВ) увеличивает риск неблагоприятного исхода в 4,04 раза, непосредственно перед процедурой реваскуляризации — в 4,70 раза и неудовлетворительный гликемический контроль через 5 мес. после вмешательства ассоциирован с 7-кратным увеличением риска неблагоприятных ССС в течение года.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Head SJ, Milojevic M, Daemen J, et al. Mortality after coronary artery bypass grafting versus percutaneous coronary intervention with stenting for coronary artery disease: a pooled analysis of individual patient data. Lancet. 2018;391:939-48. doi:10.1016/S01406736(18)30423-9.
2. Farkouh ME, Domanski M, Sleeper LA, et al. FREEDOM Trial Investigators. Strategies for multivessel revascularization in patients with diabetes. N Engl J Med. 2012;367(25):237584. doi:10.1056/NEJMoa1211585.
3. Lee Y, Jin U, Lee WM, et al. Relationship of body mass index and waist circumference with clinical outcomes following percutaneous coronary intervention. PLoS One. 2018;13(12):e0208817. doi:10.1371/journal.pone.0208817.
4. Kassaian SE, Goodarzynejad H, Boroumand MA, et al. Glycosylated hemoglobin (HbA1c) levels and clinical outcomes in diabetic patients following coronary artery stenting. Cardiovasc Diabetol. 2012;11:82. doi:10.1186/1475-2840-11-82.
5. Lemesle G, Bonello L, de Labriolle A, et al. Prognostic value of hemoglobin A1C levels in patients with diabetes mellitus undergoing percutaneous coronary intervention with stent implantation. Am. J. Cardiol. 2009;104(1):41-5.
6. Kidney Disease: Improving Global Outcomes (KDIGO) Acute Kidney Injury Work Group. KDIGO Clinical Practice Guideline for Acute Kidney Injury. Kidney Inter. Suppl. 2012;2(1):1138. doi:10.1038/kisup.2012.1.
7. Ueda H, Mitsusada N, Harimoto K, et al. Glycosylated hemoglobin is a predictor of major adverse cardiac events after drug-eluting stent implantation in patients with diabetes mellitus. Cardiology. 2010;116(1):51-7. doi:10.1159/000314331.
8. Цибулькин Н. А., Тухватуллина Г. В., Цибулькина В. Н. и др. Воспалительные механизмы в патогенезе атеросклероза. Практическая медицина. 2016;4:165-9.
9. Полянцев А. А., Фролов Д. В., Линченко Д. В. и др. Нарушения гемостаза у больных сахарным диабетом. Вестник ВолГМУ. 2017:3(63).
10. Rydén L, J Grant P, D Anker S и др. Рекомендации по диабету, предиабету и сердечно-сосудистым заболеваниям. EASD/ESC. Рабочая группа по диабету, предиабету и сердечно-сосудистым заболеваниям Европейского общества кардиологов (ESC) в сотрудничестве с Европейской ассоциацией по изучению диабета (EASD). Российский кардиологический журнал. 2014;(3):7-61. doi:10.15829/1560-4071-2014-3-7-61.
11. Raghavan S, Liu WG, Saxon DR, et al. Oral diabetes medication monotherapy and shortterm mortality in individuals with type 2 diabetes and coronary artery disease. BMJ Open Diabetes Res Care. 2018;6(1):e000516. doi:10.1136/bmjdrc-2018-000516.
12. Zinman B, Wanner C, Lachin JM, et al. EMPA-REG OUTCOME Investigators. Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes. N Engl J Med. 2015;373(22):2117-28. doi:10.1056/NEJMoa1504720.
13. Cosentino F, Grant PJ, Aboyans V и др. 2019 Рекомендации ЕSC/EASD по сахарному диабету, предиабету и сердечно-сосудистым заболеваниям. Российский кардиологический журнал. 2020;25(4):3839. doi:10.15829/1560-4071-2020-3839.
14. Дедов И. И., Шестакова М. В., Майоров А. Ю. и др. "Алгоритмы специализированной медицинской помощи больным сахарным диабетом" Под редакцией И. И. Дедова, М. В. Шестаковой, А. Ю. Майорова 9-й выпуск. Сахарный диабет. 2019;22(1S1):1-144. doi:10.14341/DM221S1.
Об авторах
В. Н. КаретниковаРоссия
Доктор медицинских наук, профессор кафедры кардиологии и сердечно-сосудистой хирургии КГМУ, заведующий лабораторией патологии кровообращения НИИ КПССЗ.
Кемерово
Конфликт интересов:
нет
А. А. Хорлампенко
Россия
Аспирант кафедры кардиологии и сердечно-сосудистой хирургии.
Кемерово
Конфликт интересов:
нет
А. В. Осокина
Россия
Кандидат медицинских наук, старший научный сотрудник лаборатории патологии кровообращения.
Кемерово
Конфликт интересов:
нет
А. М. Качергина
Россия
Кандидат медицинских наук, ассистент кафедры кардиологии и сердечно-сосудистой хирургии, научный сотрудник лаборатории патологии кровообращения.
Кемерово
Конфликт интересов:
нет
О. М. Поликутина
Россия
Доктор медицинских наук, ведущий научный сотрудник лаборатории лучевых методов диагностики.
Кемерово
Конфликт интересов:
нет
Д. П. Голубовская
Россия
Аспирант кафедры кардиологии и сердечно-сосудистой хирургии.
Кемерово
Конфликт интересов:
нет
И. Р. Олейник
Россия
Аспирант.
Кемерово
Конфликт интересов:
нет
О. Л. Барбараш
Россия
Член-корр. РАН, доктор медицинских наук, профессор, заведующий кафедрой кардиологии и сердечно-сосудистой хирургии, директор.
Кемерово
Конфликт интересов:
нет
Дополнительные файлы
Рецензия
Для цитирования:
Каретникова В.Н., Хорлампенко А.А., Осокина А.В., Качергина А.М., Поликутина О.М., Голубовская Д.П., Олейник И.Р., Барбараш О.Л. Роль гликемического контроля при плановых чрескожных коронарных вмешательствах у пациентов с сахарным диабетом 2 типа. Российский кардиологический журнал. 2022;27(12):5137. https://doi.org/10.15829/1560-4071-2022-5137
For citation:
Karetnikova V.N., Kchorlampenko A.A., Osokina A.V., Kochergina A.M., Polikutina O.M., Golubovskaia D.P., Oleinik I.R., Barbarash O.L. Role of glycemic control in elective percutaneous coronary interventions in patients with type 2 diabetes. Russian Journal of Cardiology. 2022;27(12):5137. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5137

















































