Перейти к:
Современное состояние ядерной кардиологии в Российской Федерации
https://doi.org/10.15829/1560-4071-2022-5134
Аннотация
Статья посвящена анализу современного состояния ядерной кардиологии в Российской Федерации. Приведены данные о количестве структурных подразделений, выполняющих радионуклидные исследования для диагностики и мониторирования лечения сердечно-сосудистых заболеваний, их оснащенности кадрами и аппаратурой. Приведена статистика проведенных исследований по ядерной кардиологии за 2018-2020гг, описаны методы, особенности их проведения и клинико-диагностическая значимость.
Для цитирования:
Завадовский К.В., Веснина Ж.В., Анашбаев Ж.Ж., Мочула А.В., Сазонова С.И., Ильюшенкова Ю.Н., Шипулин В.В., Варламова Ю.В., Аншелес А.А., Асланиди И.П., Валиуллина Н.М., Вахромеева М.Н., Володина В.В., Давыдов Г.А., Дризнер Е.А., Знаменский И.А., Карпов Е.Н., Коков А.Н., Кудряшова Н.Е., Минин С.М., Мирзоянц С.Г., Рыжкова Д.В., Садчиков А.А., Сайфуллина Г.Б., Сергиенко В.Б., Смолярчук М.Я., Старикова Е.В., Сухов В.Ю., Талантов С.В., Темпель М.В., Теффенберг Д.В., Томашевский И.О., Трифонова Т.А., Удодов В.Д., Чернов В.И., Шурупова И.В. Современное состояние ядерной кардиологии в Российской Федерации. Российский кардиологический журнал. 2022;27(12):5134. https://doi.org/10.15829/1560-4071-2022-5134
For citation:
ZavadovskyZavadovsky K.V., Vesnina Zh.V., Anashbaev Zh.Zh., Mochula A.V., Sazonova S.I., Ilyushenkova Yu.N., Shipulin V.V., Varlamova Yu.V., Ansheles A.A., Aslanidi I.P., Valiullina N.M., Vakhromeeva M.N., Volodina V.V., Davydov G.A., Drizner E.A., Znamensky I.A., Karpov E.N., Kokov A.N., Kudryashova N.E., Minin S.M., Mirzoyants S.G., Ryzhkova D.V., Sadchikov A.A., Sayfullina G.B., Sergienko V.B., Smolyarchuk M.Ya., Starikova E.V., Sukhov V.Yu., Talantov S.V., Tempel M.V., Teffenberg D.V., Tomashevsky I.O., Trifonova T.A., Udodov V.D., Chernov V.I., Shurupova I.V. Current status of nuclear cardiology in the Russian Federation. Russian Journal of Cardiology. 2022;27(12):5134. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5134
Ведущей причиной смертности во многих странах мира являются сердечно-сосудистые заболевания (ССЗ), уносящие ежегодно до 17 млн жизней, что соответствует 16% всех смертей [1]. В 2020г заболеваемость ССЗ в Российской Федерации (РФ) составила 2940 на 100 тыс. населения, что почти в 3 раза превышает таковую в странах Европейского союза (1133 на 100 тыс.) [2], а смертность была на уровне 2,3 млн человек. В пересчете на 100 тыс. населения это в 2 раза больше, чем в Европе и в США, в 1,5 раза больше, чем в среднем по миру.
По данным МАГАТЭ, смертность от ССЗ обратно пропорциональна объему использования радионуклидных методов диагностики в кардиологии [3]. Этим фактором определяется социальная значимость такого направления медицинской визуализации, как ядерная кардиология (ЯК), представляющего собой раздел ядерной медицины, направленный на использование методов радионуклидной индикации для диагностики заболеваний сердца. В России координацию деятельности в сфере ЯК осуществляют Российское общество рентгенологов и радиологов, а также Российское общество ядерной медицины.
По мнению Beller GA, методы ЯК за последние 20 лет уже в значительной мере помогли снизить риски неблагоприятных исходов у пациентов высокого риска, благодаря их своевременному выявлению, эффективному терапевтическому ведению или более обоснованному направлению на инвазивные вмешательства [4]. По данным Cedars-Sinai Group (СedarsSinai Medical Center, США) среди всех пациентов, направленных на перфузионную однофотонную эмиссионную томографию (ОЭКТ), доля лиц с выраженной преходящей ишемией миокарда снизилась с 29,6% в 1991г до 5,0% в 2009г [5].
Однако, несмотря на принятую Министерством здравоохранения РФ межведомственную программу "Развитие ядерной медицины в РФ" (разработана во исполнение п. 2 Перечня поручений Президента РФ от 08.05.2010 № Пр-1314), число изотопных исследований на душу населения в РФ существенно ниже по сравнению со странами Европы и США [6]. По данным Росстата за 2012г в РФ функционирует всего 217 отделений радионуклидной диагностики (РНД), оснащенных 282 гамма-камерами и/или томографами (ОЭКТ). При этом в Японии функционируют 3 тыс. ОЭКТ-томографов, в Западной Европе — 4 тыс., в США — 13 тыс. Несмотря на наличие аналитических работ по распространённости методов лучевой диагностики в нашей стране [7], систематизированная информация о современном состоянии ЯК в РФ отсутствует.
Целью данного обзора является анализ состояния ЯК в РФ по данным на 2021г.
Материал и методы
Осенью 2021г в структурные подразделения (кабинеты, лаборатории, отделения РНД) клиник страны были разосланы анкеты, в которых респондентам было предложено ответить на ряд вопросов относительно качественных и количественных показателей работы за период 2018-2020гг. Последующий анализ анкет позволил получить информацию о кадровой оснащённости структурных подразделений штатными единицами (в т.ч. наличие в штате врачейкардиологов или функциональных диагностов), аппаратной оснащенности, используемых РПФ, видах и количестве исследований, использовании нагрузочных тестов, протоколах исследования, программном обеспечении.
Результаты
Всего было собрано 24 анкеты, на основании которых были получены изложенные ниже данные.
Отделения, выполняющие кардиологические исследования
В настоящее время центров РНД, где выполняются исследования для кардиологии, всего 24 (рис. 1). Из них позитронно-эмиссионная томография (ПЭТ) — 3 (1 — в Москве и 2 — в Санкт-Петербурге). Наибольшее число отделений сконцентрировано в г. Москве (7) и Сибирском Федеральном округе (8) (Кемерово — 1, Новосибирск — 2, Омск — 1, Томск — 4). По другим Федеральным округам (ФО): в Северо-Западном ФО — 3 (Санкт-Петербург); в Центральном ФО — 1 (Обнинск); в Уральском ФО — 3 (Екатеринбурги, Тюмень, Челябинск); в Приволжском ФО — 1 (Казань); в Южном — 1 (Волгоград).
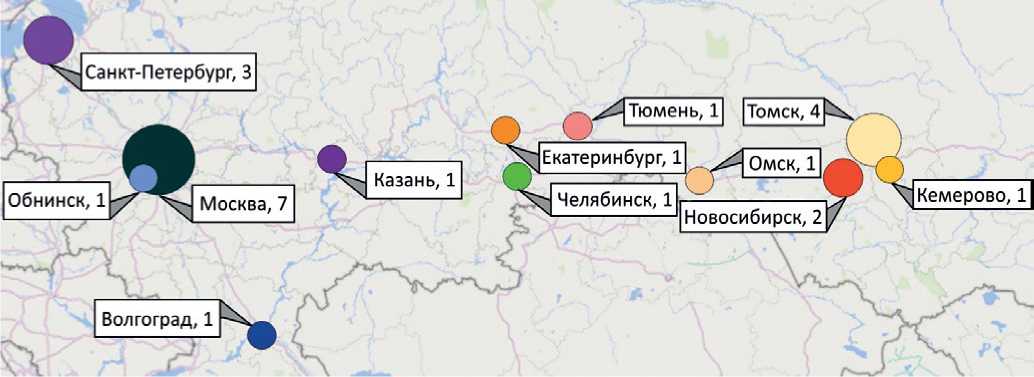
Рис. 1. Количество учреждений, занимающихся кардиологическими радионуклидными исследованиями в городах РФ.
Примечание: текст в указателях: название города, абсолютное количество учреждений.
Приборная база
24 отделения РНД снабжены 34 аппаратами, из них:
— гибридные — 25 (20 — ОЭКТ/компьютерная томография (КТ); 4 — ПЭТ/КТ; 1 — ПЭТ/магнитнорезонансная томография (МРТ));
— моно ОЭКТ гамма-камеры — 9.
При этом старше 10 лет — 25 (31%) аппаратов.
В 5 отделениях РНД имеются только моно гамма-камеры, две из которых 1997 и 1998гг выпуска (в Волгоградском областном клиническом кардиологическом центре и в Межрегиональном клиникодиагностическом центре г. Казани, соответственно).
Спектр исследований
Основные методы РНД для кардиологии включают в себя:
- перфузионную сцинтиграфию миокарда (ПСМ);
- радионуклидную равновесную томовентрикулографию или радионуклидную ангиографию;
- сцинтиграфию миокарда с 99mTc-пирофосфатом (диагностика амилоидоза и воспалительных процессов в сердце);
- сцинтиграфию миокарда с 123I-метайодбензилгуанидином (123I-МИБГ) для визуализации симпатической активности сердца.
- сцинтиграфию миокарда с меченными лейкоцитами;
- ПЭТ исследования сердца с 18F-фтордезоксиглюкозой (18F-ФДГ) (для диагностики метаболизма, воспаления и кардиоонкологии) и 13N-аммонием (для оценки миокардиального кровотока (МК)).
Перфузионная сцинтиграфия миокарда
В России за 2018-2020гг суммарно было проведено 68829 ПСМ, большинство их которых — 26589 (39%) в г. Москве и 25906 (38%) в Северном ФО (рис. 2, табл. 1). Для ОЭКТ-ПСМ все отделения используют аналог 99mTc-сестамиби — 99mTc-технетрил (ООО "Диамед", Россия), в трех отделениях используют также 99mTc-тетрофосмин (Myoview (99mTc), GE Healthcare AC). Используемые для ОЭКТ-ПСМ радиофармацевтические препараты (РФП) и их свойства имеют общую характеристику, заключающуюся в их накоплении в жизнеспособном миокарде пропорционально регионарному кровотоку. Технеций99m — (99mTc)-Сестамиби — был одобрен для использования в США в 1990г, а вскоре после этого был зарегистрирован 99mTc-Тетрофосмин. Для ПЭТПСМ используют 13N-аммоний.
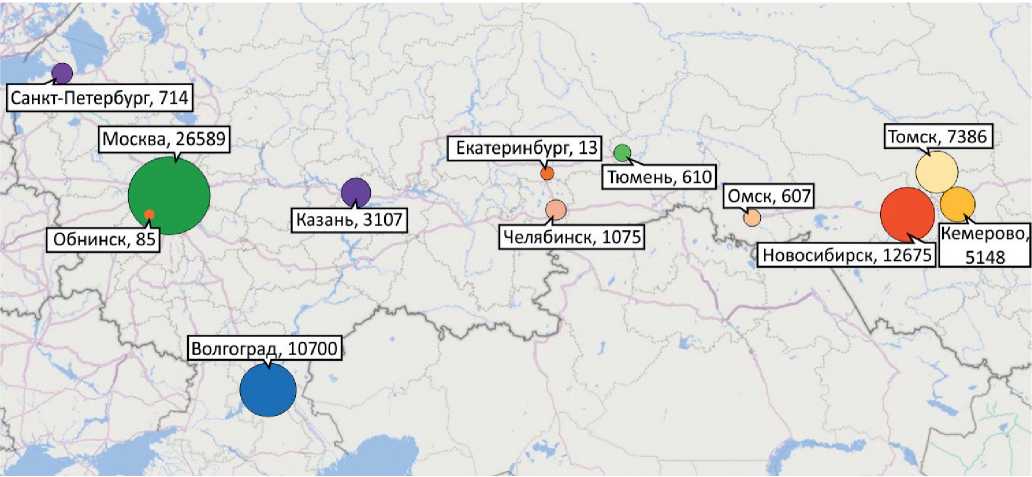
Рис. 2. Абсолютное количество проведенных ПСМ, нагрузка/покой, за период 2018-2020гг.
Таблица 1
Количество ПСМ, выполненных в учреждениях здравоохранения за период 2018-2020гг

ПСМ с помощью ОЭКТ и ПЭТ составляет подавляющее большинство из современных клинических процедур ЯК. Более половины от числа ежегодно выполняемых в США радионуклидных исследований приходится на ПСМ. В 2007г в 20 странах Европы было выполнено исследование, в котором оценивали число выполняющих ПСМ центров, а также число этих процедур [8]. Согласно результатам опроса, в этих странах в среднем выполняется 2300- 2770 ПСМ на 1 млн населения в год. В РФ подобных показателей удалось достичь только в Томской области — 2530. В двух регионах данный показатель на уровне 1500 — в Новосибирской — 1530; и в Волгоградской 1450 областях; в Москве — 701. В остальных регионах ежегодное количество ПСМ в среднем не превышает 300, а в целом по стране составляет 157,6 ПСМ на 1 млн жителей.
Наибольшее количество центров РНД, где проводят исследования по направлению ЯК, сосредоточено в Москве (0,56 на 1 млн жителей) и в Северном ФО (0,96 на 1 млн жителей, при этом в Томской области — 3,7). Средний показатель по странам Европы, вошедшим в исследования Reyes E, et al. на 2007г, составил 0,6 центров на 1 млн населения. Лидером по этому показателю в странах Европы является Норвегия — 3 центра на 1 млн населения, на последнем месте Франция — 0,2 на 1 млн. Средний показатель по РФ — 0,2. Анализируя эту статистику, можно сделать вывод, что данный показатель в РФ обеспечивается Москвой и Северным ФО. Таким образом, данный вид диагностики в РФ представлен точечно и не доступен на большинстве территорий страны.
Использование стресс-тестов
Для выявления стресс-индуцированной ишемии миокарда применяют нагрузочные пробы с физической нагрузкой, фармакологические тесты, их комбинацию [6]. Из 68829 ОЭКТ-ПСМ, проведенных в отделениях РНД РФ в 2018-2020гг, 37654 (54,5%) было выполнено с нагрузочным тестированием.
По данным проведенного нами анализа, в шести отделениях РНД в качестве нагрузочного теста используют только физическую нагрузку (велоэргометрию), только фармакологический стресс-тест — в десяти, комбинированный — в пяти подразделениях. Это обусловлено, вероятно, тем, что стресссистемами оборудованы только 9 (23%) отделений РНД из 23, в которых 3 аппарата имеют срок эксплуатации >10 лет. Следует отметить, что, несмотря на самостоятельную диагностическую ценность нагрузочного тестирования [9], а также возможное развитие неблагоприятных побочных эффектов в процессе его выполнения, в штатном расписании РНД врач-кардиолог присутствует только в 2 подразделениях, а врач функциональной диагностики — в 8. Учитывая вышеизложенное, наличие врача-кардиолога или врача функциональной диагностики в штатном расписании отделения РНД, в котором выполняются нагрузочные исследования, является обязательным. Важно обратить внимание на то, что в настоящее время отсутствуют отвечающие современным требованиям нормативные документы, регламентирующие деятельность отдела лучевой диагностики в отношении радионуклидных методов диагностики при оказании медицинской помощи пациентам с ССЗ.
В качестве фармакологического агента для проведения теста с вазодилататором в основном используют аденозинтрифосфат (АТФ) и дипиридамол. Согласно рекомендациям, АТФ вводят внутривенно, в дозе 140 мкг/кг/мин, в течение 4 или 6 мин с последующим введением РФП на 2-3 мин инфузии. Не все отделения РНД соблюдают рекомендованную дозировку АТФ: в трёх подразделениях вводят 10 мг (1 мл), и в одном — 20 мг (2 мл). Альтернативой cтресс-тесту с вазодилататором является инотропный стресс-тест с добутамином. В качестве стрессагента добутамин используют 5 подразделений, при этом в 3 из них соблюдается ступенчатый характер введения в дозе 5-40 мкг/кг/мин.
Исследования с электрокардиографической синхронизацией
Большинство отделений РНД (19 из 23) проводят ПСМ в электрокардиографическом (ЭКГ)-синхронизированном режиме.
Комментарий. К 2003г в Европе >90% ОЭКТ-ПСМ стали проводить с ЭКГ-синхронизацией, что обеспечивало объективную клиническую оценку перфузии и функции миокарда в состоянии покоя и нагрузки [10]. Выполнение исследований с ЭКГсинхронизацией дает возможность получать информацию о сократимости миокарда, выявлять зоны гипокинезии, акинезии или дискинезии левого желудочка (ЛЖ), получать количественные параметры систолической и диастолической функции.
Использование коррекции аттенюации
В 16 из 18 отделений РНД, оборудованных гибридными томографами, используют КТ для коррекции аттенюации в 100% случаев при проведении ПСМ, за исключением 3 подразделений, в 2 из которых коррекцию аттенюации используют в менее, чем 50% ПСМ, а в 1 не установлено программное обеспечение для обработки исследований сердца с протоколом коррекции аттенюации.
Комментарий. Коррекция аттенюации приводит к уменьшению или полному исчезновению ложных дефектов перфузии нижней стенки (аттенюация диафрагмой), а также передней и передне-боковой областей ЛЖ (аттенюация тканью молочной железы) [11]. В крупном метаанализе, включавшем 86 исследований с участием 10870 пациентов, было установлено, что ОЭКТ, выполнявшаяся без коррекции аттенюации или ЭКГ-синхронизации, имела чувствительность 87% и специфичность 70%. Добавление синхронизации увеличивало специфичность до 78%, а использование коррекции аттенюации сигнала дополнительно повышало специфичность до 81% [12].
Исследование МК и резерва
За 2018-2020гг в РФ проведено 507 исследования резерва МК (РМК) методом ПЭТ (ФГБУ "НМИЦ им. В. А. Алмазова" МЗ РФ, НМИЦ "Сердечнососудистой хирургии им. А. Н. Бакулева" МЗ РФ) и 515 — методом ОЭКТ (НИИ кардиологии Томского НИМЦ) (рис. 3).
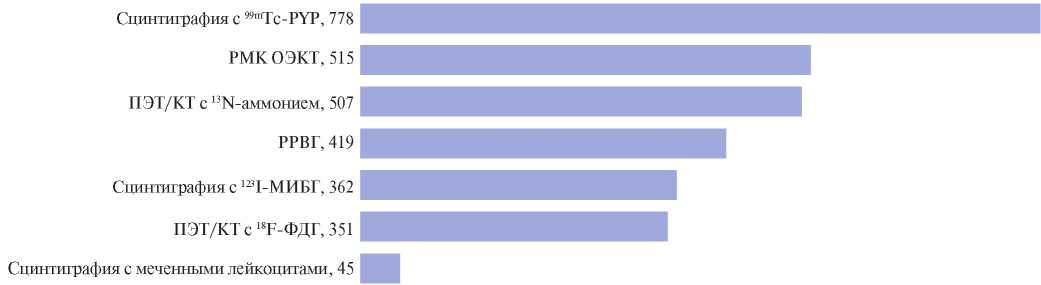
Рис. 3. Абсолютное количество радионуклидных исследований, кроме ПСМ, выполненных в РФ за период 2018-2020гг.
Сокращения: КТ — компьютерная томография, 123I-МИБГ — 123I-метайодбензилгуанидин, ОЭКТ — однофотонная эмиссионная компьютерная томография, ПЭТ — позитронно-эмиссионная томография, РМК — резерв миокардиального кровотока, РРВГ — радионуклидная равновесная вентрикулография, 99mTc-PYP — 99mTc-пирофосфат, 18F-ФДГ — 18F-фтордезоксиглюкоза.
Комментарий. МК представляет собой количественный показатель объема крови, проходящего за минуту в единице объема (чаще всего в 1 или 100 г) миокарда ЛЖ. Отношение значения МК на нагрузке к покою отражает его резерв. В качестве нагрузки чаще всего используются фармакологические вазодилататоры [13]. Золотым стандартом неинвазивной оценки МР и РМК является ПЭТ с 15O-H2O, т.к. этот радиотрейсер демонстрирует линейную зависимость между его экстракцией кардиомиоцитами и объемным кровотоком [14]. Тем не менее разработаны и валидированы математические модели, описывающие скорость экстракции других перфузионных РФП для ПЭТ: 13N-аммония, 82Rb-рубидия хлорида, корректирующие нелинейность их захвата МК. На основе этих математических моделей были созданы программные пакеты расчета МК и коронарного резерва (Corridor 4DM, Carimas), которые используются в 2 ПЭТ-центрах (ФГБУ "НМИЦ им. В.А. Алмазова" МЗ РФ, НМИЦ "Сердечно-сосудистой хирургии им. А.Н. Бакулева" МЗ РФ).
Внедрение в клиническую практику ОЭКТ (или ОЭКТ/КТ) томографов с CZT-детекторами позволило преодолеть технические ограничения стандартного сцинтиграфического исследования и провести количественную оценку МК и РМК с использованием перфузионных РФП [13, 15, 16]. В частности, метод был валидизирован в сравнении с использованием меченных микросфер [17]. Была показана высокая согласованность измерений МК и РМК, выполненных на CZT гамма-камерах, с данными определения фракционного коронарного резерва [18, 19], результатами инвазивной ангиографии [20] и ПЭТ с 15O-H2O [21]. К сожалению, в настоящее время в России функционирует только одна гамма-камера, произведенная с использованием технологии CZT и позволяющая оценивать МК и РМК.
Радионуклидная равновесная вентрикулография
За анализируемый период в отделениях РНД страны было проведено 419 радионуклидных равновесных вентрикулографий (РРВГ) в томографическом режиме (из них 142 — в НИИ кардиологии Томского НИМЦ) (рис. 3).
Комментарий. РРВГ представляет собой метод оценки сократительной функции сердца, основанный на ЭКГ-синхронизированной регистрации радиоактивности кровяного пула сердца. Запись данных может быть выполнена как в планарном, так и томографическом режимах [22]. Методика томографической записи РРВГ показала высокую корреляцию с данными фантомных исследований и МРТ [23]. Отличительными особенностями данного подхода являются его высокая внутри- и межоператорская воспроизводимость [24], а также возможность выполнения у пациентов, имеющих противопоказания и ограничения для МРТ или эхокардиографии. Высокие диагностические возможности метода были показаны в аспекте оценки дисфункции правого желудочка у пациентов с тромбоэмболией лёгочной артерии [25], обнаружении областей эктопической активности сердца при желудочковых аритмиях [26], а также при изучении нарушения функции обоих желудочков сердца при сердечной недостаточности (СН) [27] и сопутствующей патологии [28]. Выполнение РРВГ на фоне фармакологической инотропной стимуляции позволяет идентифицировать сократительный резерв ЛЖ у пациентов с ишемической кардиомиопатией [29], что имеет значение в аспекте прогнозирования неблагоприятного ремоделирования у данной группы пациентов [30].
Исследования сердца с 123I-МИБГ
За 2018-2020гг в РФ проведено 362 исследования сердца с 123I-МИБГ (Москва, Санкт-Петербург, Новосибирск, Томск). Из них 157 в планарном режиме для оценки глобальной симпатической активности миокарда и 205 в режиме ОЭКТ для выявления зон регионарного нарушения симпатической иннервации (рис. 3).
Комментарий. 123I-МИБГ представляет собой меченный йодом-123 аналог норадреналина, широко используемый для оценки симпатической активности сердца у пациентов с хронической СН (ХСН) [31, 32], аритмиями и другой патологией сердечно-сосудистой системы [33]. При ХСН наблюдается снижение поглощения МИБГ миокардом, что имеет тесную связь с вероятностью неблагоприятных сердечных событий [34]. Визуализация сердца с 123I-МИБГ может подтвердить улучшение симпатической активности в ответ на лечение СН нейрогуморальными агентами или с помощью медицинских вспомогательных устройств [32, 35]. Несоответствие между величиной дефекта по данным томографии с МИБГ и дефицитом перфузии миокарда указывает на вероятность нестабильных аритмий, связанных с внезапной сердечной смертью, и необходимость в имплантируемом кардиовертере-дефибрилляторе [36].
Анализируя накопление 123I-МИБГ в предсердиях, представляется возможным локализовать области повышенной симпатической активности, что позволяет провести эффективную радиочастотную аблацию у пациентов с фибрилляцией предсердий [37]. Нарушение накопления 123I-МИБГ в миокарде продемонстрировало тесную связь с тяжестью гипертрофической кардиомиопатии [38] и идиопатической легочной гипертензии [39].
Сцинтиграфия миокарда с 99mTc-пирофосфатом
За 2018-2020гг в РФ проведено 778 исследований с 99mTc-пирофосфатом (99mTc-PYP), преимущественно для диагностики хронического миокардита или транстиретинового (ATTR) амилоидоза сердца (рис. 3). Изначально данный РФП был создан для "позитивной" диагностики острого инфаркта миокарда, однако, в связи с появлением высокочувствительных маркеров лабораторной диагностики, сцинтиграфия с 99mTc-PYP при остром инфаркте миокарда проводится только у больных с повторными и рецидивирующими инфарктами на фоне имеющихся рубцовых изменений и при ферментонегативных инфарктах. Более широкое применение 99mTc-PYP нашел в диагностике миокардита и сердечного амилоидоза.
Комментарий:
Диагностика воспаления (миокардита)
Использование 99mTc-PYP для диагностики миокардита основано на способности РФП фиксироваться в очаге повреждения сердечной мышцы за счет образования фосфатных соединений с ионами кальция, которые в избытке выходят в межклеточное пространство из поврежденных кардиомиоцитов. На сегодняшний день в нескольких исследованиях показана возможность индикации очагов повреждения миокарда у пациентов с хроническим миокардитом [40-43]. Данный подход позволил повысить чувствительность и специфичность 99mTc-PYP в диагностике миокардита до 91% и 100%, соответственно (на основании сопоставления с верифицирующим методом — эндомиокардиальной биопсией) [40].
Диагностика ATTR амилоидоза
РНД ATTR амилоидоза сердца стала применяться в РФ с 2019г и на сегодняшний день проведено 143 исследования (ФГБУ "НМИЦ им. В.А. Алмазова" МЗ РФ, ФГБУ НМИЦ кардиологии МЗ РФ и НИИ кардиологии Томского НИМЦ) (рис. 3).
Отложение амилоида в миокарде приводит к развитию амилоидоза сердца и в последствии к амилоидной кардиомиопатии. Из-за неспецифической клинической картины заболевание, как правило, либо остается нераспознанным, либо диагностируется на поздних стадиях, когда появляются признаки выраженной СН.
В мировой литературе сообщения о возможности визуализации ATTR амилоидоза сердца при использовании фосфатных комплексов технеция-99m появились еще в 1980-х годах. Однако, в связи с отсутствием инструмента для терапевтического воздействия на заболевание, сцинтиграфическая визуализация амилоидоза широко не применялась. В 2019г в США был одобрен первый лекарственный препарат для специфического лечения ATTR амилоидоза сердца, что привело к необходимости его ранней неинвазивной диагностики и повышению интереса к методам ЯК. На сегодняшний день сцинтиграфия с 99mTc-PYP и его аналогами включена в клинические алгоритмы диагностики амилоидоза сердца, где играет ключевую роль [44].
Сцинтиграфия сердца с мечеными лейкоцитами
За 2018-2020гг в РФ проведено 45 исследования (НИИ кардиологии Томского НИМЦ, НИИ скорой помощи им. Н. В. Склифосовского) (рис. 3). Диагностическая точность метода по сравнению с биопсией составляет ~75% [45]. Поскольку метод является трудоемким и дорогостоящим, его целесообразно использовать главным образом для диагностики электродного эндокардита (осложнение имплантации внутрисердечных девайсов), инфекционного эндокардита (ИЭ) на фоне протеза клапана сердца [43], а также инфекционно-воспалительных осложнений кардиохирургических вмешательств.
Широкому внедрению метода в клиническую практику препятствует высокая стоимость РФП для метки лейкоцитов "Ceretec", а также сложности с его регистрацией и ввозом на территорию Российской Федерации.
ПЭТ исследования сердца
За 2018-2020гг в РФ для ПЭТ исследований сердца использовали РФП 18F-ФДГ и 13N-аммоний. Проведено 507 ПЭТ/КТ с 13N-аммонием (для оценки РМК и миокардиальной перфузии, с 18F-ФДГ — 351 исследование (ФГБУ НМИЦ ССХ им. А.Н. Бакулева МЗ РФ и ФГБУ "НМИЦ им. В.А. Алмазова" МЗ РФ).
Комментарий. Основными клиническими сценариями, при которых используется ПЭТ сердца с 18F-ФДГ, являются оценка жизнеспособности миокарда, диагностика воспаления [46] и опухолей сердца [47]. Сохранённый метаболизм глюкозы, по данным ПЭТ с 18F-ФДГ, в областях нарушенной перфузии является классическим признаком жизнеспособности.
В настоящее время диагностика ИЭ в рутинной практике основывается на клинических и анамнестических данных, а также результатах лабораторных и инструментальных исследований. Тем не менее отрицательные посевы крови не исключают наличия инфекционного процесса, а указанные методы лучевой диагностики, несмотря на высокую разрешающую способность, информативны только на стадии выраженных анатомических изменений. ПЭТ, совмещенная с КТ, с использованием 18F-ФДГ обладает высокими значениями информативности и является методом выбора при подозрении на ИЭ [48].
В отдельных клинических ситуациях у пациентов с ХСН и ИБС целесообразна оценка жизнеспособности миокарда перед реваскуляризацией. Метаанализ наблюдений, основанных на радионуклидных или эхокардиографических оценках, в которых участников делили на две группы с сохранением или без сохранения жизнеспособности миокарда, показал, что только у пациентов с достаточно высокой степенью жизнеспособности миокарда наблюдается улучшение выживаемости при коронарном шунтировании по сравнению с медикаментозной терапией [49].
Ограничения исследования. Часть отделений РНД, где выполняются радионуклидные кардиологические исследования, могла остаться за пределами опроса. В то же время это не должно существенно отразиться на общей картине состояния ЯК в РФ. 2020г прошел в условиях пандемии новой коронавирусной инфекции, в связи с чем число кардиологических исследований было ниже по сравнению с предыдущими годами [50], что, безусловно, повлияло на общую статистику.
Заключение
Наиболее распространённым видом кардиологического радионуклидного исследования в РФ является ПСМ. Однако в РФ данный вид диагностики представлен точечно и недоступен на большинстве территорий страны. В настоящее время документы, регламентирующие деятельность отдела лучевой диагностики в отношении радионуклидных методов диагностики при оказании медицинской помощи пациентам с ССЗ, нуждаются в корректировке с учетом современных требований. Более 70% диагностических аппаратов имеют срок эксплуатации >10 лет. Стресс-системами оборудованы только 9 (23%) отделений РНД, что создает сложности в корректном выполнении исследований. Указанные обстоятельства диктуют необходимость обновления приборной базы.
Благодарности. Благодарим исполнительного директора Общества ядерной медицины к.м.н. Е.И. Василенко за помощь в организации анкетирования.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. WHO. Leading causes of death and disability 2000-2019: A visual summary of global and regional trends 2000-2019. WHO’s Global Health Estimates (GHE) 2019. https://www.who.int/data/gho/data/themes/mortality-and-global-health-estimates/ghe-leading-causesof-death.
2. Timmis A, Townsend N, Gale CP, et al. European Society of Cardiology: Cardiovascular Disease Statistics 2019. Eur Heart J. 2020;41(1):12-85. doi:10.1093/eurheartj/ehz859.
3. INTERNATIONAL ATOMIC ENERGY AGENCY, Nuclear Cardiology: Guidance on the Implementation of SPECT Myocardial Perfusion Imaging, IAEA Human Health Series No. 23 (Rev. 1), IAEA, Vienna (2016). p. 101. ISBN 978-92-0-107616-8.
4. Beller GA. Future growth and success of nuclear cardiology. J Nucl Cardiol. 2018; 25(2):375-8. doi:10.1007/s12350-018-1211-1.
5. Rozanski A, Gransar H, Hayes SW, et al. Temporal trends in the frequency of inducible myocardial ischemia during cardiac stress testing: 1991 to 2009. J Am Coll Cardiol. 2013;61(10):1054-65.
6. Аншелес А. А., Сергиенко В. Б. Ядерная кардиология. Издательство ФГБУ "НМИЦ кардиологии" Минздрава России. Москва: 2021. 516 c.
7. Морозов С. П., Смолярчук М. Я., Владзимирский А. В. ПЭТ/КТ в здравоохранении Москвы: оснащенность, используемость, доступность. Российский электронный журнал лучевой диагностики. 2018;8(3):318-24. doi:10.21569/2222-7415-2018-8-3-318-324.EDN YMSOSL.
8. Reyes E, Wiener S, Underwood SR; European Council of Nuclear Cardiology. Myocardial perfusion scintigraphy in Europe 2007: a survey of the European Council of Nuclear Cardiology. Eur J Nucl Med Mol Imaging. 2012;39(1):160-4. doi:10.1007/s00259-011-1923-9.
9. ACC/AHA/ASNC guidelines for the clinical use of cardiac radionuclide imaging — executive summary: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (ACC/AHA/ASNC Committee to Revise the 1995 Guidelines for the Clinical Use of Cardiac Radionuclide Imaging). Circulation. 2003;108:1404-18. doi:10.1161/01.CIR.0000080946.42225.4D.
10. Germano G, Berman DS. Quantification of ventricular function. In: Germano G, Berman DS, eds. Clinical Gated Cardiac SPECT. Oxford, UK: Blackwell Publishing; 2006:93-137.
11. Hayes SW, De Lorenzo A, Hachamovitch R, et al. Prognostic implications of combined prone and supine acquisitions in patients with equivocal or abnormal supine myocardial perfusion SPECT. J Nucl Med. 2003;44:1633-40.
12. Medical Advisory Secretariat. Single photon emission computed tomography for the diagnosis of coronary artery disease: an evidence-based analysis. Ont Health Technol Assess Ser. 2010;10(8):1-64.
13. Zavadovsky KV, Mochula AV, Maltseva AN, et al. The current status of CZT SPECT myocardial blood flow and reserve assessment: Tips and tricks. J Nucl Cardiol. 2021. doi:10.1007/s12350-021-02620-y.
14. Gould KL, Johnson NP, Bateman TM, et al. Anatomic versus physiologic assessment of coronary artery disease: role of CFR, FFR, and PET imaging in revascularization decisionmaking. J Am Coll Cardiol. 2013;62:1639-53. doi:10.1016/j.jacc.2013.07.076.
15. Мочула А. В., Мальцева А. Н., Шипулин В. В. и др. Оценка миокардиального кровотока и резерва — физиологические основы и клиническое значение перфузионной сцинтиграфии в обследовании пациентов с хроническим коронарным синдромом. Российский кардиологический журнал. 2020;25(2):3649. doi:10.15829/1560-4071-2020-2-3649.
16. Минин С. М., Завадовский К. В., Никитин Н. А. и др. Современные возможности кардиовизуализации с использованием гамма-камер, оснащенных czt-детекторами. Патология кровообращения и кардиохирургия. 2020;24(3):11-22. doi:10.21688/1681-3472-20203-11-22.
17. Wells RG, Timmins R, Klein R, et al. Dynamic SPECT measurement of absolute myocardial blood flow in a porcine model. J Nucl Med. 2014;55(10):1685-91. doi:10.2967/jnumed. 114.139782.
18. Miyagawa M, Nishiyama Y, Uetani T, et al. Estimation of myocardial flow reserve utilizing an ultrafast cardiac SPECT: Comparison with coronary angiography, fractional flow reserve, and the SYNTAX score. Int J Cardiol. 2017;244:347-53. doi:10.1016/j.ijcard.2017.06.012.
19. Zavadovsky KV, Mochula AV, Boshchenko AA, et al. Absolute myocardial blood flows derived by dynamic CZT scan vs invasive fractional flow reserve: Correlation and accuracy. J Nucl Cardiol. 2021;28(1):249-59. doi:10.1007/s12350-019-01678-z.
20. Zavadovsky KV, Mochula AV, Maltseva AN, et al. The diagnostic value of SPECT CZT quantitative myocardial blood flow in high-risk patients. J Nucl Cardiol. 2020. doi:10.1007/s12350-020-02395-8.
21. Agostini D, Roule V, Nganoa C, et al. First validation of myocardial flow reserve assessed by dynamic 99mTc-sestamibi CZT-SPECT camera: head to head comparison with 15O-water PET and fractional flow reserve in patients with suspected coronary artery disease. The WATERDAY study. Eur J Nucl Med Mol Imaging. 2018;45(7):1079-90. doi:10.1007/s00259-018-3958-7.
22. Завадовский К. В., Саушкин В. В., Панькова А. Н. и др. Методические особенности выполнения, обработки результатов и интерпретации данных радионуклидной равновесной томовентрикулографиию. Радиология — практика. 2011;6:75-83.
23. Sibille L, Bouallegue FB, Bourdon A, et al. Comparative values of gated blood-pool SPECT and CMR for ejection fraction and volume estimation. Nucl Med Commun. 2011;32(2):121-8. doi:10.1097/MNM.0b013e32834155f1.
24. Sachpekidis C, Sachpekidis V, Kopp-Schneider A, et al. Equilibrium radionuclide angiography: Intraand inter-observer repeatability and reproducibility in the assessment of cardiac systolic and diastolic function. J Nucl Cardiol. 2021;28(4):1304-14. doi:10.1007/s12350-019-01830-9.
25. Zavadovsky KV, Krivonogov NG, Lishmanov YB. The usefulness of gated blood pool scintigraphy for right ventricular function evaluation in pulmonary embolism patients. Ann Nucl Med. 2014;28(7):632-37. doi:10.1007/s12149-014-0861-6.
26. Zavadovsky KV, Saushkin VV, Khlynin MS, et al. Radionuclide Assessment of Cardiac Function and Dyssynchrony in Children with Idiopathic Ventricular Tachycardia. Pacing Clin Electrophysiol. 2016;39(11):1213-24. doi:10.1111/pace.12948.
27. Салтыкова Д. Ф., Мареев В. Ю., Сергиенко В. Б. Сравнительная оценка показателей ремоделирования, объемных скоростей гемодинамики систолы и диастолы правого желудочка у пациентов с ХСН и СН–ССФ по данным 4D-томовентрикулографии. Журнал сердечная недостаточность. 2013;14(5):263-71.
28. Васильева А. Е., Георгадзе З. О., Володина В. А. и др. Изменение сократительной функции миокарда и индекса массы тела у больных ишемической болезнью сердца и сахарным диабетом 2 типа. Кардиоваскулярная терапия и профилактика. 2007;6(4):30-6.
29. Shipulin VV, Andreev SL, Pryakhin AS, et al. Low-dose dobutamine stress gated blood pool SPECT assessment of left ventricular contractile reserve in ischemic cardiomyopathy: a feasibility study. Eur J Nucl Med Mol Imaging. 2022;49(7):2219-2231 doi:10.1007/s00259-022-05714-y.
30. Шипулин В. В., Мишкина А. И., Гуля М. О. и др. Отдаленный прогноз повторного ремоделирования левого желудочка после хирургического лечения ишемической кардиомиопатии: возможности нагрузочной радионуклидной томовентрикулографии. Российский кардиологический журнал. 2020;25(11):3831. doi:10.15829/1560-4071-2020-3831.
31. Travin MI. Cardiac radionuclide imaging to assess patients with heart failure. Semin Nucl Med. 2014;44(4):294-313. doi:10.1053/j.semnuclmed.2014.04.005.
32. Завадовский К. В., Мишкина А. И., Лебедев Д. И. и др. Сцинтиграфия миокарда с 123I-МИБГ в оценке прогноза хронической сердечной недостаточности и эффективности сердечной ресинхронизирующей терапии. Кардиология. 2020;60(2):122-30. doi:10.18087/cardio.2020.2.n324.
33. Prokudina ES, Kurbatov BK, Zavadovsky KV, et al. Takotsubo Syndrome: Clinical Manifestations, Etiology and Pathogenesis. Curr Cardiol Rev. 2021;17(2):188-203. doi:10.2174/1573403X16666200129114330.
34. Flotats A, Carrió I, Agostini D, et al. Proposal for standardization of 123I-meta iodoben zylguanidine (MIBG) cardiac sympathetic imaging by the EANM Cardio vascular Committee and the European Council of Nuclear Cardiology. Eur J Nucl Med Mol Imaging. 2010;37(9):1802-12. doi:10.1007/s00259-010-1491-4.
35. Drakos SG, Athanasoulis T, Malliaras KG, et al. Myocardial sympathetic innervation and long-term left ventricular mechanical unloading. JACC Cardiovasc Imaging. 2010;3(1):6470. doi:10.1016/j.jcmg.2009.10.008.
36. Sazonova SI, Varlamova JV, Nikitin NA, et al. Cardiac 123I-mIBG scintigraphy for prediction of catheter ablation outcome in patients with atrial fibrillation. J Nucl Cardiol. 2021;29(5):2220-2231. doi:10.1007/s12350-021-02658-y.
37. Романов А. Б., Шабанов В. В., Лосик Д. В. и др. Визуализация и радиочастотная абляция очагов симпатической иннервации левого предсердия у пациентов с пароксизмальной формой фибрилляции предсердий. Кардиология. 2019;59(4):33-8. doi:10.18087/cardio.2019.4.10249.
38. Аншелес А. А., Щиголева Я. В., Сергиенко И. В. и др. Особенности перфузии и симпатической иннервации миокарда по данным однофотонной эмиссионной компьютерной томографии у пациентов с гипертрофической кардиомиопатией. Кардиологический вестник. 2016;11(1):24-33.
39. Аншелес А. А., Кузнецова Э. Г., Мартынюк Т. В. и др. Изучение особенностей симпатической активности и перфузии миокарда левого и правого желудочков по данным однофотонной эмиссионной компьютерной томографии миокарда у пациентов с идиопатической легочной гипертензией. Вестник рентгенологии и радиологии. 2018;99(5):244-52. doi:10.20862/0042-4676-2018-99-5-244-252.
40. Ilyushenkova J, Sazonova S, Zavadovsky K, et al. Diagnostic Efficacy of Cardiac Scintigraphy with 99mTc-Pyrophosphate for Latent Myocardial Inflammation in Patients with Atrial Fibrillation. Cardiol Res Pract. 2020. doi:10.1155/2020/5983751.
41. Сазонова С. И., Лишманов Ю. Б., Баталов Р. Е. и др. Возможности однофотонной эмиссионной компьютерной томографии с 99mТс-пирфотехом, совмещенной с перфузионной сцинтиграфией миокарда, в оценке воспалительных изменений сердца у больных с персистирующей формой фибрилляции предсердий. Терапевтический архив. 2014;86(12):10-4. doi:10.17116/terarkh2014861210-14.
42. Ильюшенкова Ю. Н., Сазонова С. И., Баталов Р. Е. Гибридные методы визуализации в диагностике воспалительных процессов в миокарде желудочков у пациентов с фибрилляцией предсердий неясной этиологии. Вестник рентгенологии и радиологии. 2019;100(3):166-74. doi:10.20862/0042-4676-2019-100-3-166-174.
43. Сазонова С. И., Ильюшенкова Ю. Н., Лишманов Ю. Б. Современные возможности однофотонной эмиссионной компьютерной томографии в диагностике инфекционного эндокардита. Российский электронный журнал лучевой диагностики. 2020;10(1):178-90.
44. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. European Heart Journal. 2021;42(36):3599-726. doi:10.1093/eurheartj/ehab368.
45. Сазонова С. И., Ильюшенкова Ю. Н., Баталов Р. Е. и др. Определение эффективности однофотонной эмиссионной компьютерной томографии с лейкоцитами, меченными 99mTc-HMPAO, в диагностике миокардитов: сопоставление результатов сцинтиграфии и данных гистологического исследования. Вестник рентгенологии и радиологии. 2015;4:29-34.
46. Асланиди И. П., Пурсанова Д. М., Мухортова О. В. и др. Возмож ности ПЭТ/КТ С 18F-фтордезоксиглюкозой в диагностике инфекции сосудистых протезов. Хирургия. Журнал им. Н. И. Пирогова. 2021;2:58-66. doi:10.17116/hirurgia202102158.
47. Конради Ю. В., Рыжкова Д. В. Лучевая диагностика опухолей сердца. Трансляционная медицина. 2015;4:28-40.
48. Голухова Е. З., Асланиди И. П., Пурсанова Д. М. и др. Возможности позитронно-эмиссионной томографии, совмещенной с компьютерной томографией, с 18F-фтордезоксиглюкозой в оценке распространенности инфекционного процесса у пациентов с подозрением на инфекционный эндокардит протезированного клапана. Креативная кардиология. 2020;14(3):245-54. doi:10.24022/19973187-2020-14-3-245-254.EDNFPRKMD.
49. Allman KC, Shaw LJ, Hachamovitch R, et al. Myocardial viability testing and impact of revascularization on prognosis in patients with coronary artery disease and left ventricular dysfunction: a meta-analysis. J Am Coll Cardiol. 2002;39(7):1151-8. doi:10.1016/s07351097(02)01726-6.
50. Аншелес А. А., Сергиенко В. Б., Синицын В. Е. и др. Влияние первой волны пандемии новой коронавирусной инфекции (COVID-19) на объемы диагностических исследований кардиологических заболеваний в Российской Федерации: результаты российского сегмента международного исследования INCAPS COVID под эгидой международного агентства по атомной энергии. Российский кардиологический журнал. 2021;26(1):4276. doi:10.15829/1560-4071-2021-4276.EDNKFBDYR.
Об авторах
К. В. ЗавадовскийРоссия
Константин Валерьевич Завадовский — доктор медицинских наук, заведующий отделом лучевой диагностики, SPIN-код: 5081-3495.
Томск
Конфликт интересов:
нет
Ж. В. Веснина
Россия
Жанета Владимировна Веснина — доктор медицинских наук, заведующий лабораторией — врач-радиолог, SPIN-код: 1953-4435.
Томск
Конфликт интересов:
нет
Ж. Ж. Анашбаев
Россия
Жанат Жуманалиевич Анашбаев — врач-радиолог.
Новосибирск
Конфликт интересов:
нет
А. В. Мочула
Россия
Андрей Викторович Мочула — кандидат медицинских наук, старший научный сотрудник, SPIN-код: 7635-6558.
Томск
Конфликт интересов:
нет
С. И. Сазонова
Россия
Светлана Ивановна Сазонова— доктор медицинских наук, ведущий научный сотрудник, SPIN-код: 3787-2774.
Томск
Конфликт интересов:
нет
Ю. Н. Ильюшенкова
Россия
Юлия Николаевна Ильюшенкова — кандидат медицинских наук, старший научный сотрудник, SPIN-код: 4141-1920.
Томск
Конфликт интересов:
нет
В. В. Шипулин
Россия
Владимир Владимирович Шипулин — кандидат медицинских наук, младший научный сотрудник, SPIN-код: 8146-7942.
Томск
Конфликт интересов:
нет
Ю. В. Варламова
Россия
Юлия Вячеславовна Варламова — кандидат медицинских наук, врач-радиолог, SPIN-код: 3209-5535.
Томск
Конфликт интересов:
нет
А. А. Аншелес
Россия
Алексей Аркадьевич Аншелес — доктор медицинских наук, ведущий научный сотрудник, SPIN-код: 7781-6310.
Москва
Конфликт интересов:
нет
И. П. Асланиди
Россия
Ираклий Павлович Асланиди — доктор медицинских наук, профессор, SPIN-код: 3693-4039.
Москва
Конфликт интересов:
нет
Н. М. Валиуллина
Россия
Наиля Миннебаевна Валиуллина — заведующий лабораторией радиоизотопной диагностики — врач-радиолог.
Казань
Конфликт интересов:
нет
М. Н. Вахромеева
Россия
Маргарита Николаевна Вахромеева — доктор биологических наук, профессор, заведующий отделением радионуклидной и функциональной диагностики.
Москва
Конфликт интересов:
нет
В. В. Володина
Россия
Вероника Викторовна Володина — врач-радиолог.
Волгоград
Конфликт интересов:
нет
Г. А. Давыдов
Россия
Герман Анатольевич Давыдов — кандидат медицинских наук, врач-радиолог, SPIN-код: 7775-6343.
Обнинск
Конфликт интересов:
нет
Е. А. Дризнер
Россия
Елизавета Александровна Дризнер — заведующий отделением радионуклидной диагностики — врач-радиолог, SPIN-код: 7775-6343.
Екатеринбург
Конфликт интересов:
нет
И. А. Знаменский
Россия
Игорь Альбертович Знаменский — заведующий отделением радионуклидных методов диагностики — врач-радиолог, SPIN-код: 9835-8594.
Москва
Конфликт интересов:
нет
Е. Н. Карпов
Россия
Евгений Николаевич Карпов — заведующий отделением радионуклидной диагностики — врач-радиолог.
Томск
Конфликт интересов:
нет
А. Н. Коков
Россия
Александр Николаевич Коков — кандидат медицинских наук, заведующий отделением лучевой диагностики, SPIN-код: 8455-4271.
Кемерово
Конфликт интересов:
нет
Н. Е. Кудряшова
Россия
Наталья Евгеньевна Кудряшова — главный научный сотрудник отделения лучевой диагностики, врач-радиолог, SPIN-код: 3914-9935.
Москва
Конфликт интересов:
нет
С. М. Минин
Россия
Станислав Михайлович Минин — кандидат медицинских наук, врач-радиолог, SPIN-код: 1405-8735.
Новосибирск
Конфликт интересов:
нет
С. Г. Мирзоянц
Россия
Сергей Генрихович Мирзоянц — кандидат медицинских наук, руководитель центра ядерной медицины и позитронно-эмиссионной томографии — врач-радиолог.
Москва
Конфликт интересов:
нет
Д. В. Рыжкова
Россия
Дарья Викторовна Рыжкова — доктор медицинских наук, профессор РАН, заведующий кафедрой ядерной медицины и радиационных технологий с клиникой, главный научный сотрудник научно-исследовательской лаборатории ядерной медицины и тераностики, SPIN-код: 7567-6920.
Санкт-Петербург
Конфликт интересов:
нет
А. А. Садчиков
Россия
Артём Александрович Садчиков — заведующий отделением радионуклидной диагностики — врач-радиолог.
Новосибирск
Конфликт интересов:
нет
Г. Б. Сайфуллина
Россия
Гузалия Бариевна Сайфуллина — врач-радиолог, SPIN-код: 4463-9098.
Казань
Конфликт интересов:
нет
В. Б. Сергиенко
Россия
Владимир Борисович Сергиенко — доктор медицинских наук, профессор, SPIN-код: 4918-3443.
Москва
Конфликт интересов:
нет
М. Я. Смолярчук
Россия
Максим Ярославович Смолярчук — зам. главного врача по клинико-экспертной работе, SPIN-код: 3806-8235.
Москва
Конфликт интересов:
нет
Е. В. Старикова
Россия
Елена Валентиновна Старикова — врач-радиолог.
Челябинск
Конфликт интересов:
нет
В. Ю. Сухов
Россия
Вячеслав Юрьевич Сухов — кандидат медицинских наук, заведующий отделом ядерной медицины — врач-радиолог.
Санкт-Петербург
Конфликт интересов:
нет
С. В. Талантов
Россия
Сергей Владимирович Талантов — врач-радиолог, SPIN-код: 3589-8963.
Санкт-Петербург
Конфликт интересов:
нет
М. В. Темпель
Россия
Марина Валерьевна Темпель — заведующий радиологическим отделением — врач-радиолог.
Омск
Конфликт интересов:
нет
Д. В. Теффенберг
Россия
Дмитрий Вадимович Теффенберг — врач-радиолог.
Тюмень
Конфликт интересов:
нет
И. О. Томашевский
Россия
Игорь Остапович Томашевский — кандидат медицинских наук, заведующий отделением радионуклидных методов исследования — врач-радиолог.
Москва
Конфликт интересов:
нет
Т. А. Трифонова
Россия
Татьяна Аркадьевна Трифонова — кандидат медицинских наук, заведующий отделением радионуклидных методов исследования — врач-радиолог, SPIN-код: 9968-8770.
Москва
Конфликт интересов:
нет
В. Дм. Удодов
Россия
Владимир Дмитриевич Удодов — кандидат медицинских наук, заведующий отделением радионуклидной диагностики — врач-радиолог, SPIN-код: 3619-0496.
Томск
Конфликт интересов:
нет
В. И. Чернов
Россия
Владимир Иванович Чернов — членкорр. РАН, доктор медицинских наук, профессор НИИ онкологии, SPIN-код: 6301-3612.
Томск
Конфликт интересов:
нет
И. В. Шурупова
Россия
Ирина Владимировна Шурупова — доктор медицинских наук, ведущий научный сотрудник, SPIN-код: 5430-5570.
Москва
Конфликт интересов:
нет
Дополнительные файлы
Рецензия
Для цитирования:
Завадовский К.В., Веснина Ж.В., Анашбаев Ж.Ж., Мочула А.В., Сазонова С.И., Ильюшенкова Ю.Н., Шипулин В.В., Варламова Ю.В., Аншелес А.А., Асланиди И.П., Валиуллина Н.М., Вахромеева М.Н., Володина В.В., Давыдов Г.А., Дризнер Е.А., Знаменский И.А., Карпов Е.Н., Коков А.Н., Кудряшова Н.Е., Минин С.М., Мирзоянц С.Г., Рыжкова Д.В., Садчиков А.А., Сайфуллина Г.Б., Сергиенко В.Б., Смолярчук М.Я., Старикова Е.В., Сухов В.Ю., Талантов С.В., Темпель М.В., Теффенберг Д.В., Томашевский И.О., Трифонова Т.А., Удодов В.Д., Чернов В.И., Шурупова И.В. Современное состояние ядерной кардиологии в Российской Федерации. Российский кардиологический журнал. 2022;27(12):5134. https://doi.org/10.15829/1560-4071-2022-5134
For citation:
ZavadovskyZavadovsky K.V., Vesnina Zh.V., Anashbaev Zh.Zh., Mochula A.V., Sazonova S.I., Ilyushenkova Yu.N., Shipulin V.V., Varlamova Yu.V., Ansheles A.A., Aslanidi I.P., Valiullina N.M., Vakhromeeva M.N., Volodina V.V., Davydov G.A., Drizner E.A., Znamensky I.A., Karpov E.N., Kokov A.N., Kudryashova N.E., Minin S.M., Mirzoyants S.G., Ryzhkova D.V., Sadchikov A.A., Sayfullina G.B., Sergienko V.B., Smolyarchuk M.Ya., Starikova E.V., Sukhov V.Yu., Talantov S.V., Tempel M.V., Teffenberg D.V., Tomashevsky I.O., Trifonova T.A., Udodov V.D., Chernov V.I., Shurupova I.V. Current status of nuclear cardiology in the Russian Federation. Russian Journal of Cardiology. 2022;27(12):5134. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5134

















































