Перейти к:
Укороченный интервал PQ в дифференциальной диагностике болезни Андерсона-Фабри
https://doi.org/10.15829/1560-4071-2022-5123
Аннотация
В данной статье мы представляем клинический случай пациентки с поздней диагностикой болезни Фабри, вызванной патогенным вариантом нуклеотидной последовательности в гене GLA (с.1287_1288dup), которой неоднократно проводились попытки интервенционного лечения синдрома ВольфаПаркинсона-Уайта ввиду наличия у нее характерной электрокардиографической картины предвозбуждения желудочков и пароксизмальных нарушений ритма сердца. Предлагаемые патогномоничные признаки заболевания позволят обеспечить своевременную постановку диагноза и назначение специфического лечения.
Ключевые слова
Для цитирования:
Злобина П.Д., Калемберг А.А., Мясников Р.П., Харлап М.С., Куликова О.В., Мершина Е.А., Тарасов А.В., Давтян К.В. Укороченный интервал PQ в дифференциальной диагностике болезни Андерсона-Фабри. Российский кардиологический журнал. 2022;27(7):5123. https://doi.org/10.15829/1560-4071-2022-5123
For citation:
Zlobina P.D., Kalemberg A.A., Myasnikov R.P., Kharlap M.S., Kulikova O.V., Mershina E.A., Tarasov A.V., Davtyan K.V. Shortened PQ interval in the differential diagnosis of Anderson-Fabry disease: a case report. Russian Journal of Cardiology. 2022;27(7):5123. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5123
Изменение длительности интервала PQ наряду с гипертрофией миокарда является одним из патогномоничных признаков болезней накопления: при системном амилоидозе (преимущественно AL-типе) отмечается замедление проведения в виде атриовентрикулярной (АВ) блокады 1-3 степени [1], а при болезнях Фабри (БФ), Данона или Помпе ускорение проведения по АВ-соединению.
Этиология укорочения интервала PQ на поверхностной электрокардиограмме (ЭКГ) чаще рассматривается в фокусе синдромов Вольфа-ПаркинсонаУайта (ВПУ) и Клерка-Леви-Кристеско.
В основе синдрома ВПУ лежит наличие дополнительного аномального пути проведения электрического импульса от предсердий к желудочкам. В таком случае фронт возбуждения одновременно проводится на желудочки двумя путями: через АВ-соединение/систему Гиса-Пуркинье и по пучку Кента, причем он может иметь разные электрофизиологические свойства, отличающиеся от АВсоединения.
Чаще пучок Кента не имеет декрементных свойств, в связи с чем проводит электрические импульсы гораздо быстрее, чем АВ-соединение, следовательно, возбуждение желудочков при синдроме ВПУ начинается почти сразу после деполяризации предсердий, что приводит к укорочению интервала PQ (<0,12 с) и появлению характерной дельта-волны возбуждения за счет распространения нетипичным путем.
Такой набор ЭКГ-признаков не несет трудностей при постановке диагноза и позволяет быстро определиться с тактикой ведения пациентов. Однако характерные изменения на ЭКГ для данного синдрома могут мимикрировать под болезни накопления: БФ, Данона или Помпе [2], а также некоторые миодистрофии [3], что может привести к ложному интерпретированию клинических данных, неправильной постановке диагноза и в некоторых случаях назначению нецелесообразного лечения.
Клинический случай
Пациентка 67 лет с жалобами на одышку при бытовой физической нагрузке и приступы учащенного неритмичного сердцебиения длительностью от нескольких часов до суток, сопровождавшиеся общим дискомфортом, слабостью, была госпитализирована в клинику “НМИЦ ТПМ” Минздрава России.
C молодого возраста при обследовании были выявлены критерии гипертрофии миокарда левого желудочка (ЛЖ) (по предоставленным данным — толщина межжелудочковой перегородки (МЖП) 1,5 см, толщина задней стенки ЛЖ 1,3 см) при отсутствии высоких цифр артериального давления.
Впервые в 52 года на ЭКГ зафиксировано укорочение интервала PQ до 100-120 мс и Δ-волна. С того же времени пациентка стала отмечать приступы сердцебиения, которые были верифицированы на ЭКГ как фибрилляция предсердий (ФП) и трепетание предсердий.
В 2014г была выполнена радиочастотная аблация кавотрикуспидального перешейка без существенного клинического эффекта. Далее в 2017г была проведена изоляция устьев легочных вен и попытка деструкции вероятного дополнительного предсердно-желудочкового соединения (ДПЖС), которая не привела к устранению аритмии. Представленные ЭКГ за 2005-2017гг (рис. 1) подтверждали только наличие тахисистолической ФП (2014-2017гг) и неспецифическое расширение QRS по типу преэкзитации как на синусовом ритме, так и во время пароксизмов. На протяжении всего периода наблюдения пациентки врачами предпринимались попытки назначения антиаритмической терапии различными классами препаратов (IC или III класс, бета-адреноблокаторы), которые не имели клинического эффекта.

Рис. 1. ЭКГ в динамике с 2005г по 2020г: отмечается прогрессирование укорочения интервала PQ от 120 мс до 80-100 мс.
Учитывая сохраняющиеся жалобы, в 2020г принято решение о проведении повторного эндокардиального электрофизиологического исследования (эндо-ЭФИ), катетерной деструкции ДПЖС (в случае его выявления) и изоляции устьев легочных вен; пациентка госпитализирована в стационар ФГБУ “НМИЦ ТПМ” Минздрава России.
По данным эхокардиографии выявлено умеренное увеличение полости левого предсердия (41 мм, объем 90 мл), незначительное увеличение полости правого предсердия (45×57 мм, объём 75 мл), выраженная гипертрофия миокарда ЛЖ (толщина задней стенки ЛЖ 16 мм), S-образная деформация МЖП без обструкции выходного тракта ЛЖ (в средней трети 15 мм, в выносящем тракте 20 мм), увеличение индекса массы миокарда ЛЖ до 150 г/м2. По результатам суточного мониторирования ЭКГ по Холтеру в течение суток регистрировался синусовый ритм, персистенция критериев предвозбуждения желудочков (укорочение интервала PQ менее 90 мс), частая наджелудочковая эктопическая активность — 23966.
В целях дифференциальной диагностики укороченного интервала PQ проведено эндо-ЭФИ (рис. 2, 3): базовые интервалы: AH 110 мс и HV 10 мс.
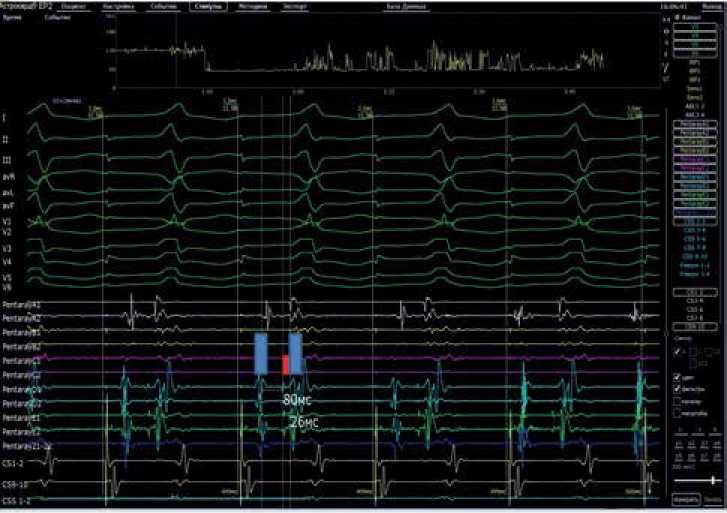
Рис. 2. Эндо-ЭФИ. Стимуляция правого предсердия с ДЦ 500 мс. AH интервал 80 мс, HV интервал 26 мс. Т. Венкебаха составила 190 уд./мин с сохранением морфологии преэкзитации во всех интервалах стимуляции.
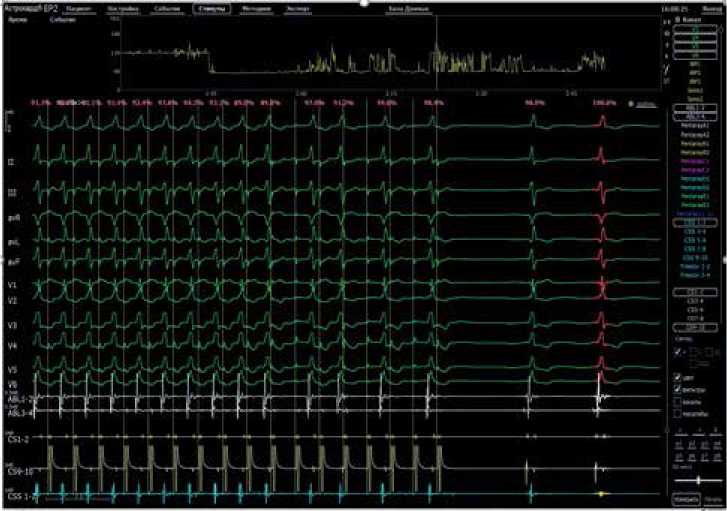
Рис. 3. Эндо-ЭФИ. Частая стимуляция из устья коронарного синуса с ДЦ 320 мс. Сохранение стабильной морфологии QRS на фоне синусового ритма и стимуляции без феномена “Concertina”.
Примечание: красным выделен эталонный комплекс. Над всеми QRS указано % совпадение с эталонным комплексом. Цветное изображение доступно в электронной версии журнала.
При ретроградной стимуляции проведение на предсердия осуществлялось по системе ГисаПуркинье. При антеградной программируемой стимуляции предсердий отмечено прогрессирующее увеличение интервала AH и фиксированным интервалом HV (10 мс) с сохранением преэкзитации желудочков без изменения ее морфологии на всех интервалах сцепления, что изначально было ошибочно воспринято как фасцикуловентрикулярный пучок (т.к. не объясняло прогрессирования укорочения интервала PQ в течение жизни). В ходе индукционных тестов пароксизмальных нарушений ритма спровоцировано не было.
В связи с тем, что фасцикуло-вентрикулярные ДПЖС не сочетаны с повышенным риском внезапной сердечной смерти, в связи с расположением ниже АВ-соединения, и не несут клинической значимости для пациентки, а также учитывая прогрессирование у пациентки пароксизмов ФП, было решено выполнить повторную изоляцию устьев легочных вен, которая была осуществлена методом криобаллонной изоляции. Для регистрации будущих аритмических событий произведена имплантация петлевого регистратора ЭКГ Medtronic Reveal LINQ11. По данным кардиорегистратора за период послеоперационного наблюдения в течение 1 года отмечались 7 пароксизмов ФП длительностью от 32 сек до 8 мин, субъективно пациенткой не ощущаемые.
Данные эхокардиографии, подтверждающие ранее выявляемую гипертрофию миокарда с S-образной деформацией МЖП до 2,0 см и дополнительное фасцикуловентрикулярное волокно могли расцениваться как два независимых заболевания или как следствие единого патологического процесса. С целью более детальной визуализации миокарда была проведена магнитно-резонансная томография сердца с гадолинием (рис. 4), по результатам которой отмечалась ассиметричная гипертрофия МЖП в базальных и средних сегментах до 20 мм, в апикальной до 8 мм, сократимость не снижена — фракция выброса ЛЖ 85%. Участков интрамиокардиального фиброза, рубцового и воспалительного поражения миокарда выявлено не было.
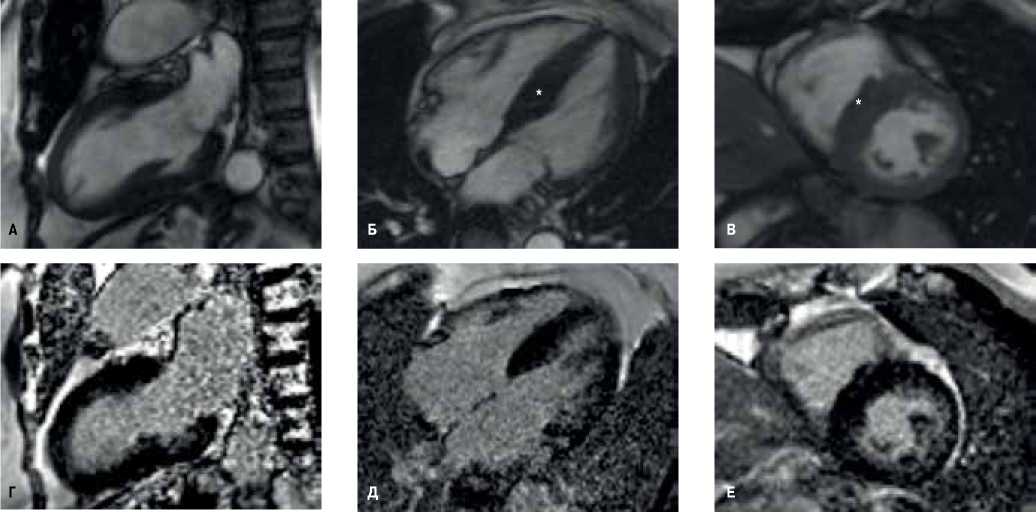
Рис. 4. (А-В) Магнитно-резонансная томография сердца в кино-режиме, SSFP-последовательность.
Примечание: А — длинная ось 2-камерная проекция, Б — длинная ось 4-камерная проекция, В — короткая ось на уровне верхушечных сегментов. Камеры сердца не расширены (индексированный конечно-диастолический объем ЛЖ — 61 мл/м2 (при норме до 92 мл/м2), фракция выброса ЛЖ 85%. * — гипертрофированные до 15-20 мм перегородочные сегменты; миокард передней, боковой и нижней стенок ЛЖ не утолщен. Индексированная масса миокарда ЛЖ не увеличена, составляет 81 г/м2 (при норме до 95 г/м2). (Г-Е) — отсроченное контрастирование, IR-последовательность с подавлением сигнала от миокарда. Участки отсроченного контрастирования миокарда отсутствуют.
Сокращение: ЛЖ — левый желудочек.
При проведении молекулярно-генетического исследования методом массового параллельного секвенирования на NGS — кардиомиопатии: были исследованы таргетные области генов ACTC1, DES, FLNC, GLA, LAMP2, MYBPC3, MYH7, MYL2, MYL3, PLN, PRKAG2, PTPN11, TNNC1, TNNI3, TNNT2, TPM1, TTR.
В гене GLA (OMIM 300644) выявлен нуклеотидный вариант с.1287_1288dup в гетерозиготном состоянии. Согласно базе данных OMIM, мутации в гене GLA описаны у пациентов с БФ, наследуемой по Х-сцепленному типу. Также выявлено повышение концентрации глоботриаозилцерамида (lyso-Gb3) до 4,60 нг/мл при норме <2,1 нг/мл. И снижение активности фермента α-галактозидазы до 0,88 при норме >1,89 мкмоль/л/ч.
Обсуждение
БФ — это Х-сцепленное заболевание (OMIM: 301500) из группы лизосомальных болезней накопления, обусловленное дефицитом фермента αгалактозидазы А. Недостаточность α-галактозидазы А приводит к накоплению в лизосомах различных клеток нерасщепленного субстрата — гликосфинголипидов, в первую очередь, глоботриаозилцерамида (Gb3), что объясняет широкий клинический полиморфизм, наблюдаемый даже среди членов одной семьи и включающий патологию центральной и периферической нервной системы, почек, легочной системы, желудочно-кишечного тракта, органов зрения и сердечно-сосудистой системы. Поражение сердца обычно дебютирует как гипертрофия ЛЖ (ГЛЖ), маскирующаяся под гипертрофическую кардиомиопатию (ГКМП), аритмии, миокардиальный фиброз, сердечную недостаточность. Гетерогенность клинических проявлений болезни часто приводит к задержке постановки диагноза.
При БФ накопление Gb3 влияет на все типы сердечных клеток и ткани, включая миоциты и клетки проводящей системы. Исследования in vitro показывают, что внутрилизосомальный Gb3 нарушает эндоцитоз и аутофагию, вызывает апоптоз и препятствует выработке энергии митохондриями. Истощение энергии и трофические факторы, такие как сфингозин, могут активировать клеточные пути гипертрофии, общие для других ГКМП: исследования кардиомиоцитов, выделенных из биоптатов эндомиокарда, продемонстрировали, что внутриклеточные гликосфинголипиды вызвали дисфункцию и деструкцию саркомерных миофиламентов [4]. Прогрессирующая ГЛЖ с развитием относительной ишемии миокарда и в дальнейшем фиброза, а также вовлечение проводящей ткани являются субстратом для появления желудочковых аритмий и нарушений проводимости сердца.
Однако накопление Gb3 не объясняет весь спектр патофизиологии БФ. Первопричина электрофизиологических изменений до конца остается неясной, но подтверждается короткой продолжительностью зубца P, интервала PR и комплекса QRS, указывающих на повышенную скорость проводимости в предсердных и желудочковых кардиомиоцитах [5].
Наиболее обширное исследование Birket MJ, et al. [6] продемонстрировало возникновение усиления функции натриевых и кальциевых каналов при накоплении субстрата в сердечной мышце и клетках проводящей системы сердца, что приводит к более быстрому возбуждению кардиомиоцитов, чем вероятнее всего и обусловлена ранняя активация желудочков в области пучка Гиса с критериями преэкзитации и укороченным интервалом PQ.
Motwani M, et al. [7] продемонстрировали улучшение морфологии и функции ЛЖ у пациентов с ГЛЖ с нормализацией коротких зубцов Р и интервалов PQ, длинных QTc при назначении ферментозаместительной терапии (ФЗТ). ФЗТ не может разрушить истинное фасцикуловентрикулярное волокно или влиять на скорость его проведения. Положительный эффект от ФЗТ свидетельствует о прямой взаимосвязи укороченного интервала PQ с БФ и позволяет исключить наличие истинного ДПЖС.
В настоящее время в НМИЦ ТПМ наблюдается четыре пациента с БФ с признаками ГЛЖ и укороченным интервалом PQ. Данное сочетание патогномоничных признаков может являться “красным флагом” в дифференциальной диагностике БФ [8].
Заключение
В данной статье представлен клинический случай пациентки с поздней диагностикой БФ, которой вследствие ЭКГ-картины предвозбуждения желудочков и ярко выраженных проявлений нарушений ритма сердца неоднократно проводилось хирургическое лечение.
Особенностью данного клинического случая является подтверждение того, что прогрессирование укорочения интервала PQ не свойственно для ДПЖС и в комбинации с фенокопией ГКМП является важным диагностическим критерием для подозрения болезней накопления. Ранняя диагностика заболевания позволяет своевременно начать специфическое лечение (ФЗТ) и улучшить прогноз и качество жизни.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Мясников Р. П., Андреенко Е. Ю., Кушунина Д. В. и др. Амилоидоз сердца: современные аспекты диагностики и лечения (клиническое наблюдение). Клиническая и экспериментальная хирургия. Журнал имени академика Б. В. Петровского. 2014;4(6):72-82.
2. Linhart A, Elliott PM. The heart in Anderson-Fabry disease and other lysosomal storage disorders. Heart. 2007;93(4):528-35. doi:10.1136/hrt.2005.063818.
3. Steare SE, Dubowitz V, Benatar A. Subclinical cardiomyopathy in Becker muscular dystrophy. Br Heart J. 1992;68(3):304-8. doi:10.1136/hrt.68.9.304.
4. Pieroni M, Moon JC, Arbustini E, et al. Cardiac Involvement in Fabry Disease: JACC Review Topic of the Week. J Am Coll Cardiol. 2021;77(7):922-36. doi:10.1016/j.jacc.2020.12.024.
5. Namdar M. Electrocardiographic Changes and Arrhythmia in Fabry Disease. Front Cardiovasc Med. 2016;3:7. doi:10.3389/fcvm.2016.00007.
6. Birket MJ, Raibaud S, Lettieri M, et al. A Human Stem Cell Model of Fabry Disease Implicates LIMP-2 Accumulation in Cardiomyocyte Pathology. Stem Cell Reports. 2019;13(2):380-93. doi:10.1016/j.stemcr.2019.07.004.
7. Motwani M, Banypersad S, Woolfson P, et al. Enzyme replacement therapy improves cardiac features and severity of Fabry disease. Mol Genet Metab. 2012;107(1-2):197-202. doi:10.1016/j.ymgme.2012.05.011.
8. Харлап М. С., Мясников Р. П., Павлунина Т. O. и др. Кардиологический фенотип болезни Фабри. Российский кардиологический журнал. 2018;(7):80-3. doi:10.15829/1560-4071-2018-7-80-83.
Об авторах
П. Д. ЗлобинаРоссия
Полина Дмитриевна Злобина — аспирант отдела нарушений сердечного ритма и проводимости сердца.
Москва
Конфликт интересов:
Конфликт интересов не заявляется
А. А. Калемберг
Россия
Андрей Анатольевич Калемберг — кандидат медицинских наук, руководитель отдела хирургического лечения сложных нарушений ритма сердца и электрокардиостимуляции ГБУЗ МО Московского областного научно-исследовательского клинического института им. М. Ф. Владимирского.
Москва
Конфликт интересов:
Конфликт интересов не заявляется
Р. П. Мясников
Россия
Роман Петрович Мясников — кандидат медицинских наук, ведущий научный сотрудник отдела клинической кардиологии.
Москва
Конфликт интересов:
Конфликт интересов не заявляется
М. С. Харлап
Россия
Мария Сергеевна Харлап — кандидат медицинских наук, старший научный сотрудник отдела нарушений сердечного ритма и проводимости сердца.
Москва
Конфликт интересов:
Конфликт интересов не заявляется
О. В. Куликова
Россия
Ольга Викторовна Куликова — научный сотрудник отдела клинической кардиологии.
Москва
Конфликт интересов:
Конфликт интересов не заявляется
Е. А. Мершина
Россия
Елена Александровна Мершина — кандидат медицинских наук, зав. отделением рентгенодиагностики, доцент кафедры лучевой диагностики, лучевой терапии и медицинской физики, Медицинский научно-образовательный центр.
Москва
Конфликт интересов:
Конфликт интересов не заявляется
А. В. Тарасов
Россия
Алексей Владимирович Тарасов — доктор медицинских наук, зав. отделением хирургического лечения сложных нарушений ритма сердца и электрокардиостимуляции.
Москва
Конфликт интересов:
Конфликт интересов не заявляется
К. В. Давтян
Россия
Карапет Воваевич Давтян — доктор медицинских наук, руководитель отдела нарушений сердечного ритма и проводимости.
Москва
Конфликт интересов:
Конфликт интересов не заявляется
Дополнительные файлы
Рецензия
Для цитирования:
Злобина П.Д., Калемберг А.А., Мясников Р.П., Харлап М.С., Куликова О.В., Мершина Е.А., Тарасов А.В., Давтян К.В. Укороченный интервал PQ в дифференциальной диагностике болезни Андерсона-Фабри. Российский кардиологический журнал. 2022;27(7):5123. https://doi.org/10.15829/1560-4071-2022-5123
For citation:
Zlobina P.D., Kalemberg A.A., Myasnikov R.P., Kharlap M.S., Kulikova O.V., Mershina E.A., Tarasov A.V., Davtyan K.V. Shortened PQ interval in the differential diagnosis of Anderson-Fabry disease: a case report. Russian Journal of Cardiology. 2022;27(7):5123. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5123
JATS XML

















































