Перейти к:
Оценка межжелудочковой электрической задержки при сердечной ресинхронизирующей терапии у пациентов с квадриполярными системами в долгосрочном послеоперационном наблюдении
https://doi.org/10.15829/1560-4071-2022-5121
Аннотация
Цель. Оценить связь между изменением межжелудочковой электрической задержки (МЖЭЗ) при естественном ритме и ответом на сердечную ресинхронизирующую терапию (СРТ) в течение 24 мес. послеоперационного периода у пациентов с квадриполярными левожелудочковыми (ЛЖ) электродами.
Материал и методы. В ретроспективное нерандомизированное исследование включены данные 48 пациентов с имплантированными СРТ устройствами с квадриполярными ЛЖ электродами, обследованных через 3, 6, 12, 24 мес. после операции. Респондерами на СРТ считались пациенты, у которых наблюдалось снижение конечно-систолического объема (КСО) более чем на 10% по сравнению с дооперационным. Для проверки гипотезы о целесообразности выбора максимальной МЖЭЗ при установке активного полюса ЛЖ электрода группа пациентов была разбита на две подгруппы: одна с максимальной МЖЭЗ (max МЖЭЗ, n=24), другая — при невыполнении этого условия (n=24).
Результаты. Обнаружена корреляция между изменениями МЖЭЗ и КСО, а также фракции выброса (ФВ) в сроке 6, 12 и 24 мес. после имплантации по сравнению с исходными значениями. В подгруппе с max МЖЭЗ при выборе активного ЛЖ полюса укорочение МЖЭЗ в послеоперационном периоде больше по абсолютной величине в каждый рассмотренный срок по сравнению со второй подгруппой, и в целом наблюдается более выраженное снижение МЖЭЗ за 24 мес. При этом в сроках 3, 6, 12 мес. после операции у пациентов c max МЖЭЗ наблюдается достоверно большее снижение КСО и, соответственно, больший прирост ФВ. Построены прогностические модели ответа на СРТ в отдаленных сроках после имплантации. Значимыми предикторами оказались исходная МЖЭЗ, изменение МЖЭЗ в ранний послеоперационный срок до 3 мес. и факт выбора max МЖЭЗ. При этом ни один признак, взятый по отдельности, не позволял разделить респондеров и нереспондеров.
Заключение. Большему укорочению МЖЭЗ соответствуют большее снижение КСО и конечно-диастолического объема ЛЖ, также большее увеличение ФВ в долгосрочном послеоперационном периоде. Выбор активного полюса квадриполярного ЛЖ электрода в соответствии с максимальной МЖЭЗ сопровождается снижением доли нереспондеров, более выраженным снижением электрической диссинхронии желудочков и улучшением функциональных показателей систолической функции пациентов.
Ключевые слова
Для цитирования:
Чумарная Т.В., Любимцева Т.А., Лебедева В.К., Гасымова Н.З., Лебедев Д.С., Соловьева О.Э. Оценка межжелудочковой электрической задержки при сердечной ресинхронизирующей терапии у пациентов с квадриполярными системами в долгосрочном послеоперационном наблюдении. Российский кардиологический журнал. 2022;27(7):5121. https://doi.org/10.15829/1560-4071-2022-5121
For citation:
Chumarnaya T.V., Lyubimtseva T.A., Lebedeva V.K., Gasimova N.Z., Lebedev D.S., Solovieva O.E. Evaluation of interventricular delay during cardiac resynchronization therapy in patients with quadripolar systems in long-term postoperative follow-up. Russian Journal of Cardiology. 2022;27(7):5121. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5121
Сердечная ресинхронизирующая терапия (СРТ) хорошо зарекомендовала себя в качестве помощи пациентам с хронической сердечной недостаточностью (ХСН), у которых наблюдается систолическая дисфункция левого желудочка (ЛЖ) и увеличение QRSкомплекса (>130 мс). Множество крупных проспективных рандомизированных исследований подтвердили потенциал СРТ для улучшения качества жизни, снижения госпитализаций и смертности от ХСН [1][2]. Несмотря на достижения в технологии СРТ, значительное число (20-50%) пациентов считается “не ответившим” или “частично ответившим”, в зависимости от критерия, применяемого для оценки успешности терапии [1][2].
Многочисленные исследования подтверждают, что частота ответа на СРТ связана с рядом факторов: отбор пациентов, программирование устройства, положения стимулирующих электродов [3][4]. Характеристики пациентов, связанные с лучшим ответом на СРТ, включают женский пол, более длинный QRS при собственном ритме и неишемическую этиологию ХСН [3]. Традиционно положение электрода в ЛЖ определяется анатомическими критериями и возможностью доступа к эпикардиальной поверхности свободной стенки ЛЖ через коронарный синус. Ретроспективные исследования ряда крупных клинических испытаний показали незначительный эффект от изменения положения ЛЖ электрода в пределах анатомически пригодных для установки мест, среди них выделялись лишь апикальные позиции, которые показывают худшие результаты СРТ [5]. Напротив, в других исследованиях было показано, что расположение ЛЖ электрода в зоне поздней активации ЛЖ, в частности, за счет выбора полюса ЛЖ электрода с самой длительной из возможных межжелудочковой задержкой электрической активации между правым желудочком (ПЖ) и ЛЖ при естественном ритме были связаны с лучшим ответом на СРТ в краткосрочном периоде [5-7]. Межжелудочковая электрическая задержка (МЖЭЗ) определяется как время между активацией ПЖ и ЛЖ электродов при естественном ритме без стимуляции желудочков или при стимуляции с ПЖ электрода во время программирования устройства СРТ после имплантации. МЖЭЗ характеризует электрическую диссинхронию между желудочками сердца при отсутствии его искусственной стимуляции.
Мультиполярные ЛЖ электроды входят в повседневную практику СРТ, обеспечивая больше возможных мест для стимуляции в зоне анатомического доступа. Изменение вектора электрода может быть достигнуто путем стимуляции от разных полюсов без физического изменения положения электрода. Первоначально такие электроды были разработаны, чтобы избежать стимуляции диафрагмального нерва и/или продлить срок службы батареи за счет выбора полюсов с более низкими порогами захвата [8].
Однако до настоящего времени имеются лишь ограниченные данные о влиянии квадриполярных электродов на электрофизиологическое ремоделирование желудочков [9]. В частности, мы не обнаружили работ, в которых ранее была проведена оценка взаимосвязи между изменением МЖЭЗ и обратным ремоделированием ЛЖ в долгосрочном послеоперационном периоде.
Цель настоящего исследования — оценить взаимосвязь между изменением МЖЭЗ и ответом на СРТ в течение 24 мес. послеоперационного периода у пациентов с квадриполярными электродами.
Материал и методы
В ретроспективное нерандомизированное исследование были включены 48 пациентов, которым были имплантированы устройства СРТ с квадриполярными электродами (Boston Scientific (75%); St.Jude Medical (19%); Medtronic (6%)) в период с декабря 2017 по декабрь 2018гг.
Критерии включения пациентов:
1. Пациенты с ХСН II-IV, функциональный класс (ФК) по классификации Нью-Йоркской ассоциации сердца,
2. Возраст ≥18 лет,
3. Фракция выброса (ФВ) ЛЖ ≤35%,
4. QRS >130 мс,
5. Оптимальная медикаментозная терапия в соответствии с текущими рекомендациями,
6. Стабильное состояние ≥30 дней,
7. Стабильная терапия ХСН ≥30 дней,
8. Пациент, подписавший форму информированного согласия, способный и готовый выполнять требования протокола, включая все исследования исходного уровня и последующего наблюдения.
Критерии невключения пациентов:
1. Острые заболевания (в настоящее время), либо наличие системной инфекции, либо сепсис,
2. Обратимые причины ХСН, например, заболевания щитовидной железы, острая алкогольная интоксикация, недавнее крупное хирургическое вмешательство или травма,
3. Недавние сердечные события, включая инфаркт миокарда, чрескожное коронарное вмешательство, либо операция на сердце (протезирование или реконструкция клапанов сердца; коронарное шунтирование) в течение предыдущих 3 мес.,
4. Декомпенсация сердечной недостаточности,
5. Механический протез трикуспидального клапана,
6. Медицинские состояния, ограничивающие ожидаемое выживание до <1 года,
7. Беременность.
Исследование было выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации и одобрено этическим комитетом.
Пациенты проходили обследование до СРТ, а также наблюдение через 3, 6, 12, 24 мес. после имплантации электрокардиостимулятора. Обратное ремоделирование ЛЖ оценивалось при каждом визите пациента с помощью эхокардиографии (ЭхоКГ) по изменению ФВ и конечно-систолического (КСО) и конечно-диастолического (КДО) объемов ЛЖ. Изменение КСО (∆КСО) и КДО (∆КДО) вычислялось как относительная разница между текущим значением объема и дооперационным показателем. Изменение ФВ ЛЖ (∆ФВ) рассчитывалось как абсолютная разница между текущим и дооперационным значением ФВ ЛЖ. Респондерами на СРТ считались пациенты, у которых наблюдалось снижение КСО ЛЖ более чем на 10% по сравнению с дооперационным периодом [10].
У всех пациентов наблюдалась задержка активации ЛЖ электрода вследствие блокады левой ножки пучка Гиса. Имплантированная система с квадриполярным электродом позволяет при настройке протокола стимуляции после имплантации электрокардиостимулятора считывать значения МЖЭЗ с каждого полюса на ЛЖ электроде и на основе этих данных выбирать активный полюс ЛЖ электрода для дальнейшей стимуляции. При интраоперационной настройке стимуляции и последующих визитах выбирался активный полюс ЛЖ электрода по следующим правилам: 1) должен быть обеспечен захват миокарда при оптимальных энергозатратах, т.е. при наиболее низком пороге стимуляции; 2) не должно быть стимуляции диафрагмы; 3) самая длительная МЖЭЗ. Для всех пациентов была зарегистрирована значительная МЖЭЗ на активном полюсе ЛЖ электрода при собственном ритме активации желудочков (117±43 мс). Изменение МЖЭЗ (∆МЖЭЗ) в послеоперационном периоде оценивалось при помощи относительной разницы между текущим значением МЖЭЗ при очередном визите пациента и исходным при установке стимулятора (нулевой срок после имплантации) по отношению к значению МЖЭЗ в нулевой срок после имплантации.
Для проверки гипотезы о целесообразности выбора максимальной МЖЭЗ при установке устройства и при последующих визитах группа пациентов была разбита на две подгруппы по выбору вектора стимуляции: в подгруппу с максимальной МЖЭЗ (n=24) отобраны пациенты, которым в первые 6 мес. после имплантации был выбран активный полюс ЛЖ электрода с максимальной МЖЭЗ по сравнению с другими полюсами; во вторую подгруппу попали пациенты (n=24), у которых по ряду причин (стимуляция диафрагмального нерва, отсутствие захвата) выбрать полюс с максимальной МЖЭЗ не представлялось возможным.
Дооперационные характеристики рассматриваемой группы приведены в таблице 1.
Статистический анализ и построение информационных прогностических моделей проведены с помощью программы IBM SPSS 23.0 (США). Для показателей, характеризующих качественные признаки, указано абсолютное значение и относительная величина в процентах, проверка статистических гипотез осуществлялась с использованием критерия хи-квадрат (χ2) и точного критерия Фишера (в случае значений ожидаемых частот <5). Для парных сравнений связанных качественных характеристик использовался критерий Мак-Немара, при множественном сравнении делалась поправка на множественные сравнения.
Для количественных переменных рассчитывались средние арифметические значения и стандартные отклонения (m±sd) в случае подтверждения нормальности распределения признака, или медиана и [25%; 75%] процентили в противном случае. Проверка нормального распределения признаков проводилась с помощью критерия Шапиро-Уилка.
Для величин, имеющих нормальное распределение, сравнение в двух независимых группах проводилось с помощью Т-критерия Стьюдента. Силу и направление связи измеряли с помощью коэффициента корреляции Пирсона (r). Корреляционные зависимости были распределены по силе связи: сильная (r=1,0-0,8), умеренная (r=0,79-0,6) и слабая (r=0,59-0,4).
Для параметров, не имеющих нормального распределения, сравнение двух независимых групп проводилось с помощью критерия Манна-Уитни (MannWhitney Test). Силу и направление связи измеряли с помощью коэффициента ранговой корреляции Спирмена. Коэффициент, равный 0-0,29, означал слабую связь между изучаемыми признаками, 0,3- 0,69 — среднюю, 0,7-1,0 — сильную связь.
Парные сравнения двух связных выборок проводилось с помощью критерия Вилкоксона. Парные сравнения для более двух связных выборок проводилось с помощью критерия Фридмана с последующим парным апостериорным сравнением групп, используя критерий Вилкоксона с поправкой на множественные сравнения.
Критический уровень статистической значимости был принят равным 0,05.
Прогностические модели ответа на СРТ строились с помощью логистической регрессии (метод пошаговый, критерий шагового отбора параметров: включение параметра в модель при значимости ≤0,05; исключение параметра из модели при значимости <0,10). Значимость модели оценивалась по критерию Хи-квадрат. Точность классификации модели оценивалась по ROC AUC (площадь под характеристической кривой) с последующей кросспроверкой. Для модели приведены значимые нестандартизированные коэффициенты (р<0,05), ROC AUC с доверительным интервалом, средняя точность кросс-проверки, порог отсечения для классификации нереспондер/респондер, чувствительность, специфичность.
Результаты
Изменение МЖЭЗ в послеоперационном периоде 24 мес.
Проведен анализ изменения МЖЭЗ (∆МЖЭЗ) у пациентов с квадриполярными ЛЖ электродами через 3, 6, 12, 24 мес. по сравнению со значением МЖЭЗ на выбранном активном полюсе ЛЖ электрода после имплантации СРТ устройства. Статистически значимых отличий средних значений МЖЭЗ в различные послеоперационные сроки не было установлено. Также не выявлено значимого отклонения средних значений ∆МЖЭЗ от нуля, хотя наблюдается тенденция к укорочению МЖЭЗ (∆МЖЭЗ <0) в течение времени. Так, в первые 3 мес. после операции ∆МЖЭЗ <0 наблюдалось у 57% пациентов, не было найдено значимого изменения МЖЭЗ у 12% и выявлено увеличение МЖЭЗ (∆МЖЭЗ >0) у 30% пациентов. Далее с увеличением послеоперационного срока доля пациентов со сниженным значением МЖЭЗ в распределении пациентов значительно увеличивается: 65%/6%/29% через 6 мес., 72%/2%/26% через 12 мес.; и 81%/2%/17% через 24 мес.
Исследована корреляционная связь между ∆МЖЭЗ и показателями ЭхоКГ ответа на терапию (∆КДО, ∆КСО, ∆ФВ). Во временных точках 6, 12 и 24 мес. после имплантации обнаружена значимая прямая связь между ∆МЖЭЗ и ∆КДО, ∆КСО (рис. 1). Видно, что большему укорочению МЖЭЗ (большим по абсолютной величине отрицательным значениям ∆МЖЭЗ) соответствует большее снижение объемов ЛЖ (большие по абсолютной величине отрицательные значения ∆КДО и ∆КСО). Связь между ∆МЖЭЗ и ∆ФВ — обратно пропорциональная, поскольку большему укорочению МЖЭЗ (большим по модулю отрицательным значениям ∆МЖЭЗ) соответствует больший прирост ФВ ЛЖ (большие положительные ∆ФВ, см. рисунок 1). Наибольшие коэффициенты корреляции между изменением МЖЭЗ и динамикой ЭхоКГ-параметров достигаются в срок 24 мес. после операции. Хотя значения коэффициентов корреляции указывают на умеренную связь между показателями, эта связь является значимой (p<0,05 для всех случаев).
Выбор полюса ЛЖ электрода в соответствии с максимальной МЖЭЗ
Рассмотренная группа пациентов была разбита на две подгруппы по выбору вектора стимуляции: в подгруппу с исходно максимальной МЖЭЗ (далее будет обозначена как max МЖЭЗ) отобраны пациенты, которым в первые 6 мес. после имплантации был выбран активный полюс ЛЖ электрода с максимальной МЖЭЗ по сравнению с другими полюсами (n=24); во вторую подгруппу попали пациенты, у которых по ряду причин (стимуляция диафрагмального нерва, отсутствие захвата) выбрать полюс с максимальной МЖЭЗ не представлялось возможным (n=24).
Дооперационные характеристики пациентов, включая ЭхоКГ-показатели ЛЖ, а также абсолютные значения МЖЭЗ для выбранного активного полюса ЛЖ электрода при настройке устройств СРТ сразу после операции статистически не отличались в данных подгруппах (табл. 1). В послеоперационном периоде динамика изменения МЖЭЗ и других показателей ремоделирования ЛЖ значимо отличается в выбранных подгруппах (рис. 2). В подгруппе с max МЖЭЗ укорочение ∆МЖЭЗ больше в каждый постоперационный срок (через 3 мес. — на 4 [ 1; 10]%; 6 мес. — на 6 [ 5; 10]%, 12 мес. — на 8 [ 3; 10]%, 24 мес. — на 7 [ 5; 12]%). В итоге за 24 мес. наблюдается более выраженное снижение МЖЭЗ вы подгруппе с исходной max МЖЭЗ. При этом в сроках 3, 6, 12 мес. после операции у пациентов c max МЖЭЗ наблюдается достоверно большее снижение КСО и, соответственно, больший прирост ФВ по сравнению с группой с немаксимальной МЖЭЗ. В частности, к 12 мес. после операции медианное значение ∆КСО составляет -47 [ -66; -32]% при выборе полюса с max МЖЭЗ по сравнению с -38 [ -52; -18]% при немаксимальной МЖЭЗ (p=0,032), а прирост ∆ФВ равен 20 [ 11; 23]% vs 12 [ 7; 19]% (p=0,001). Однако к послеоперационному сроку 24 мес. достоверные отличия между ЭхоКГпоказателями в подгруппах исчезают.
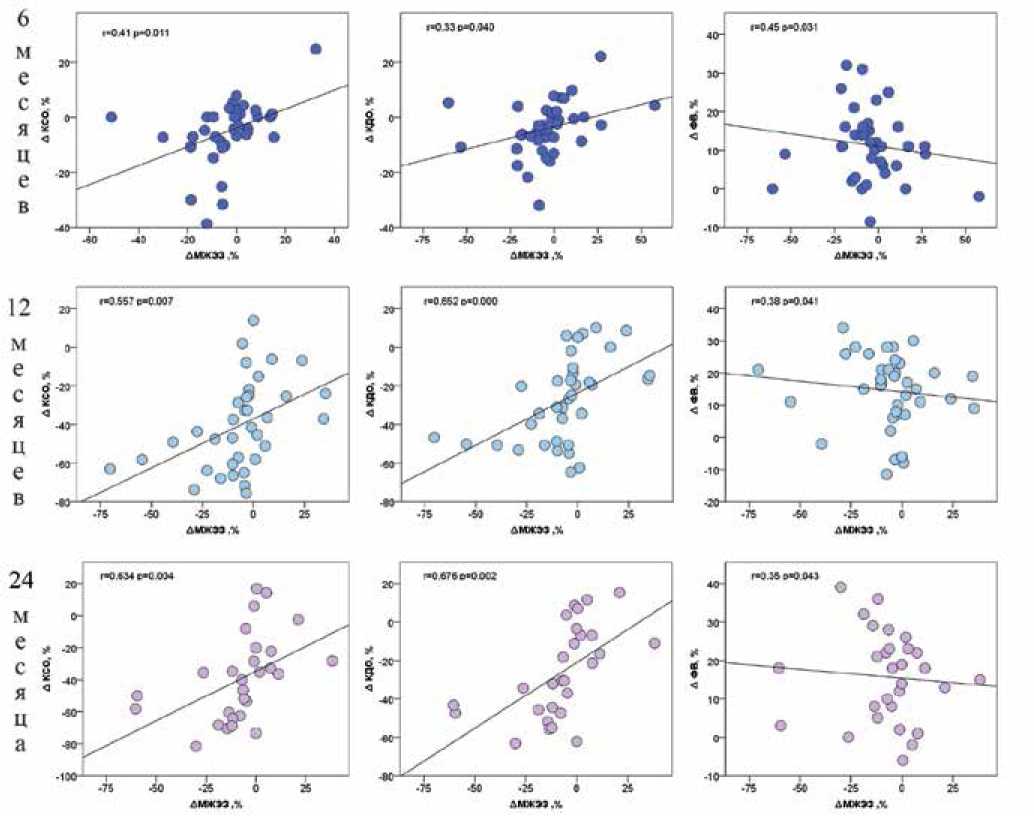
Рис. 1. Корреляционные зависимости между относительным изменением МЖЭЗ и параметрами гемодинамического ответа на СРТ через 6, 12, 24 мес. послеоперационного периода.
Сокращения: КДО — конечно-диастолический объем, КСО — конечно-систолический объем, МЖЭЗ — межжелудочковая электрическая задержка, ФВ — фракция выброса.
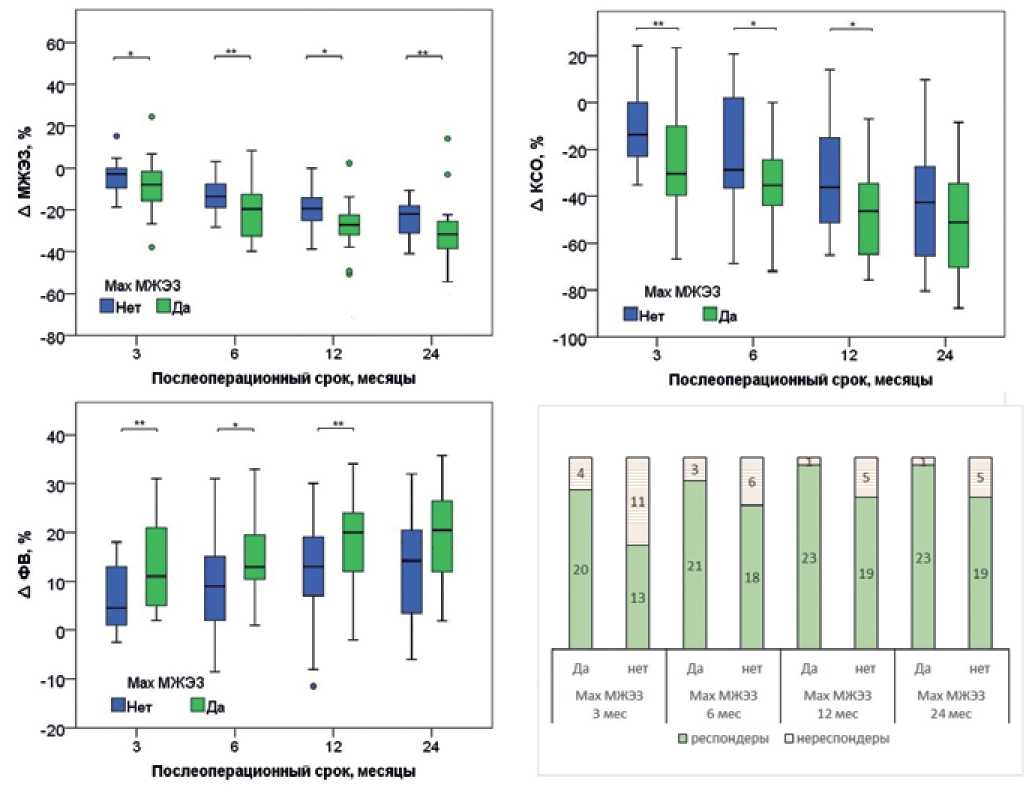
Рис. 2. Сравнение подгрупп по выбору вектора стимуляции относительно максимальной МЖЭЗ.
Сокращения: КСО — конечно-систолический объем, МЖЭЗ — межжелудочковая электрическая задержка, ФВ — фракция выброса.
Модели прогноза эффективности СРТ в отдаленный послеоперационный период
Мы разделили пациентов на респондеров и нереспондеров на СРТ в соответствии с ЭхоКГкритерием уменьшения КСО ЛЖ более чем на 10% (∆КСО <-10%) [10]. Количество респондеров прогрессивно увеличивалось, а нереспондеров, соответственно, снижалось в течение срока наблюдения с 69/31% респондеров/нереспондеров через 3 мес. после операции до 90/10% через 24 мес. При этом распределение и динамика изменения количества респондеров/нереспондеров существенно различались в подгруппах с различным типом выбора активного полюса ЛЖ электрода (рис. 2). В подгруппе c max MЖЭЗ число нереспондеров было меньшим в каждом сроке через 3, 12 и 24 мес. после операции по сравнению с группой с немаксимальной МЖЭЗ, и это число прогрессивно уменьшалось в течение первого года после операции, достигнув 1 пациента (4% от количества в подгруппе). В подгруппе с немаксимальной МЖЭЗ число нереспондеров практически не менялось, начиная с 6 мес., достигнув 5 пациентов (26% от количества в подгруппе).
При помощи методов машинного обучения с использованием логистической регрессии мы построили прогностические модели (классификаторы) ответа на СРТ в каждой временной точке, разметив наборы данных как респондеров и нереспондеров в соответствии с выбранным критерием изменения КСО ЛЖ. Сначала использовались только дооперационные характеристики пациентов, приведенные в таблице 1. На основе этих данных нам не удалось получить статистически значимые прогностические модели.
Тогда мы построили классификаторы для прогноза ответа на СРТ в отдаленные послеоперационные сроки 12 и 24 мес., использовав дооперационные показатели, а также величину МЖЭЗ на активном полюсе ЛЖ электрода при установке устройства СРТ, тип выбора активного полюса ЛЖ электрода (max MЖЭЗ: 1 (да) или 0 (нет)) и величины изменений параметров ∆МЖЭЗ, ∆КСО, ∆КДО, ∆ФВ в ранний послеоперационный период 3 мес. после имплантации. Значимые параметры и характеристики полученных моделей приведены в таблице 2. В прогностическую модель ответа на СРТ через 12 мес. входят ∆МЖЭЗ и ∆КСО в первые 3 мес. с отрицательными коэффициентами, т.е. более выраженные уменьшение КСО ЛЖ (∆КСО <0) и укорочение МЖЭЗ (∆МЖЭЗ <0) в первые 3 мес. предсказывают большую вероятность ответа на СРТ через 12 мес. после имплантации (табл. 2). Заметим, что в полученную модель не вошли ни тип выбора полюса электрода, ни значение исходной МЖЭЗ при установке устройства СРТ. В прогностическую модель ответа на СРТ через 24 мес. вошли исходная МЖЭЗ и тип выбора полюса электрода с исходно максимальной или немаксимальной МЖЭЗ с положительными коэффициентами (табл. 2). Здесь более высокое значение исходной МЖЭЗ и выбор полюса с максимально возможной МЖЭЗ для этого пациента прогнозируют большую вероятность ответа на СРТ через 24 мес.
Таблица 1
Дооперационные показатели для всей группы пациентов и подгрупп с максимальной и немаксимальной МЖЭЗ
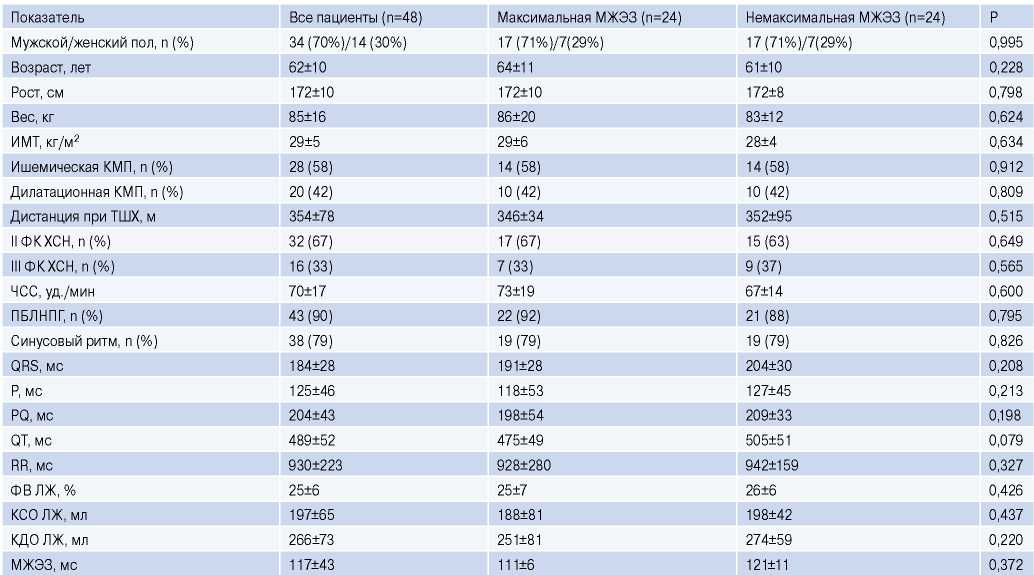
Сокращения: ИМТ — индекс массы тела, КДО — конечно-диастолический объем, КМП — кардиомиопатия, КСО — конечно-систолический объем, ЛЖ — левый желудочек, МЖЭЗ — межжелудочковая электрическая задержка на активном полюсе при установке СРТ устройств, ПБЛНПГ — полная блокада левой ножки пучка Гиса, ТШХ — тест шестиминутной ходьбы, ФВ — фракция выброса, ФК — функциональный класс, ХСН — хроническая сердечная недостаточность, ЧСС — частота сердечных сокращений.
Таблица 2
Информационные модели прогноза СРТ в отдаленный послеоперационный период
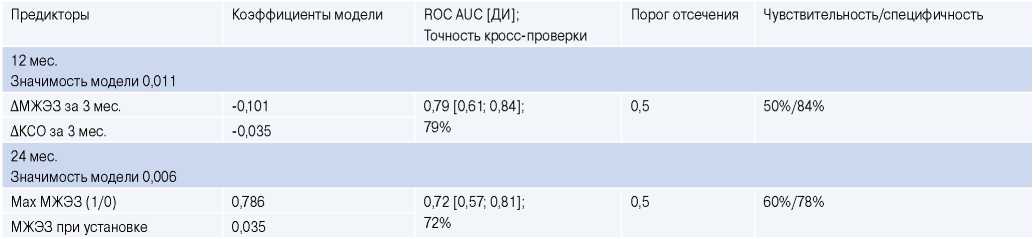
Сокращения: ДИ — доверительный интервал для ROC AUC, КСО — конечно-систолический объем, МЖЭЗ — межжелудочковая электрическая задержка
на активном полюсе при установке СРТ устройств.
Обсуждение
Несомненное преимущество использования квадриполярных ЛЖ электродов для имплантируемых СРТ устройств по сравнению с биполярными продемонстрировано в многочисленных исследованиях [11]. Установлено, что в группе пациентов с квадриполярным ЛЖ электродом значимо выше выживаемость и значимо ниже частота наступления неблагоприятных кардиологических событий, таких как необходимость ревизии ЛЖ электрода, либо репрограммирование параметров ЛЖ стимуляции, по сравнению с группой пациентов, имеющих биполярные ЛЖ электроды [11]. Установлено, что доля низкого ответа на СРТ с квадриполярными ЛЖ электродами — значимо ниже при сопоставлении с классическими устройствами СРТ. Более высокая эффективность применения квадриполярных электродов для кардиоресинхронизирующей терапии продемонстрирована также на основании данных об обратном ремоделировании ЛЖ и динамике ФК ХСН [12]. Тем не менее, имеются лишь немногочисленные исследования о влиянии квадриполярных электродов на электрофизиологические и механические характеристики миокарда ЛЖ [1][5]. При этом, насколько нам известно, связь между изменением МЖЭЗ и обратным ремоделированием ЛЖ в долгосрочном послеоперационном периоде ранее не исследовалась.
В данном исследовании нами проведена оценка связи между характеристиками электрофизиологического и функционального ремоделирования ЛЖ в течение 24 мес. послеоперационного периода у пациентов с имплантированной системой СРТ с квадриполярным ЛЖ электродом. Электрофизиологическое ремоделирование оценивалось по изменению МЖЭЗ. МЖЭЗ — это разница во времени активации желудочков сердца при естественном ритме, которая характеризует истинную электрическую диссинхронию активации желудочков. Она рассчитывается как время прохождения волны возбуждения по миокарду между ПЖ и ЛЖ электродами или, другими словами, МЖЭЗ определяет электрофизиологическое расстояние между полюсами стимулирующих электродов. Оно зависит от многих факторов, прежде всего, наличия полной или частичной блокады проводящей системы, а также фиброза и рубцовых повреждений, препятствующих проведению возбуждения по миокарду и замедляющих скорость возбуждения желудочков [13]. Несмотря на то что расстояние между полюсами квадриполярного ЛЖ электрода не превышает 47 мм [9], их анатомическое расположение в конкретном сердце и ориентация по отношению к зонам инфаркта могут существенно повлиять на время прохождения волны возбуждения до зоны того или иного полюса электрода. При стандартном выборе активного полюса квадриполярного электрода предполагается, что наиболее эффективным является полюс, обеспечивающий захват миокарда при минимальном стимуле и расположенный на наибольшем электрофизиологическом расстоянии от ПЖ электрода, т.е. полюс с исходно максимальной МЖЭЗ. В этом случае бивентрикулярная стимуляция может обеспечить наилучшую синхронизацию возбуждения желудочков [6].
Эффективная ресинхронизация активации желудочков приводит к более синхронному и эффективному сокращению сердца, что запускает каскад обратного ремоделирования ЛЖ, отражающееся в изменении геометрических параметров ЛЖ и увеличении ФВ. В частности, изменение последовательности активации миокарда желудочков и их региональной механической функции через каскады влияния на клеточные механизмы электромеханического сопряжения в кардиомиоцитах может приводить к ремоделированию клеточной функции кардиомиоцитов и проводимости в сохраненном миокарде желудочков [14]. В данной работе мы проверяем гипотезу, что такие изменения на микро- и макроуровнях организации миокарда должны проявиться в динамическом изменении МЖЭЗ, отражающем изменение скорости проведения волны возбуждения в миокарде, а также в наличии связей между изменением МЖЭЗ и ЭхоКГ-показателях ремоделирования ЛЖ в отсроченные периоды после операции.
Действительно, нами установлены корреляционные зависимости между параметрами электрофизиологического, геометрического и функционального ремоделирования ЛЖ, начиная с 6 мес. послеоперационного срока и весь последующий период наблюдения. Укорочение МЖЭЗ коррелирует с уменьшением объемов ЛЖ и увеличением ФВ (рис. 1). Наши результаты согласуются с результатами исследования [7] на 196 пациентах, где в послеоперационном сроке 7 мес. также была установлена корреляционная зависимость между изменением МЖЭЗ на собственном ритме и изменением КСО. В отличие от этого исследования, мы впервые пронаблюдали динамику изменения МЖЭЗ в различные послеоперационные периоды и установили, что степень взаимосвязи между изменением МЖЭЗ и изменением геометрических показателей ремоделирования ЛЖ усиливается со временем.
Связь между изменением МЖЭЗ и ЭхоКГ-показателей ремоделирования ЛЖ проявляется также в более высоких показателях обратного ремоделирования ЛЖ в группе респондеров (∆КСО <-10%) по сравнению с группой нереспондеров. В соответствии с критерием выбора респондеров, уменьшение КСО через 24 мес. в этой группе значимо превосходит ∆КСО у нереспондеров (-49 [ -56; -41]% vs 5 [ -7; 18]%, р=0,001). Увеличение ФВ у респондеров также больше (18 [ 13; 22]% vs 3 [ -6; 12]%, p=0,008). Эти отличия между респондерами и нереспондерами согласуются с более выраженным снижением МЖЭЗ (-29 [ -39; -23]% vs 4 [ -10; 7]%, р=0,016) и достижением через 24 мес. меньших величин МЖЭЗ на естественном ритме (95±23 мс vs 156±49 мс, р=0,050) в группе респондеров.
Мы предположили и получили подтверждение того, что изменения МЖЭЗ и ЭхоКГ-показателей в послеоперационном периоде более выражены при оптимизированном выборе активного полюса ЛЖ (т.е. при максимальной МЖЭЗ) сразу после имплантации устройств и в краткосрочный послеоперационный период. Так, в подгруппе с максимальной МЖЭЗ наблюдается статистически достоверная динамика уменьшения электрофизиологического расстояния между электродами (Р критерий Фридмана =0,009) в течение 24 мес. (рис. 2). Также в группе с максимальной МЖЭЗ в сроках 3, 6 и 12 мес. после имплантации наблюдаются более выраженное снижение объема ЛЖ и прирост ФВ ЛЖ по сравнению с подгруппой с немаксимальной МЖЭЗ (рис. 2). Заметим, что к послеоперационному сроку 24 мес. достоверные отличия в изменении объема и ФВ ЛЖ между подгруппами исчезают. Такой результат может быть связан с тем, что при выборе максимально возможной МЖЭЗ обеспечивается больший захват и синхронизация активации миокарда, что приводит к более быстрому обратному ремоделированию ЛЖ, в то время как при не оптимальном захвате миокарда процесс обратного ремоделирования замедлен и “догоняет” эффекты оптимального варианта стимуляции только к 24 мес. послеоперационного периода.
В пользу выбора активного полюса ЛЖ электрода с max МЖЭЗ свидетельствует также значимо большая доля респондеров в подгруппе с max МЖЭЗ в сроках 3, 12, 24 мес. по сравнению с подгруппой с немаксимальной МЖЭЗ (рис. 2). Более того, показатели ремоделирования у респондеров из подгруппы с max МЖЭЗ значимо превышают показатели респондеров во второй подгруппе: через 12 мес. ∆КСО -49 [ -67; -41]% vs -41 [ -50; -25]%, р=0,046; ∆ФВ 19 [ 13; 22]% vs 13 [ 6; 19]%, р=0,038.
Учитывая установленную нами связь между характеристиками электрофизиологического, геометрического и функционального ремоделирования ЛЖ, а также их зависимость от оптимальности выбора вектора стимуляции, мы использовали методы машинного обучения для оценки предиктивной способности МЖЭЗ в предсказании ответа на СРТ. Нам не удалось построить статистически значимые прогностические модели, использующие в качестве предикторов только дооперационные показатели стандартных ЭхоКГ и ЭКГ протоколов и клинико-демографические данные пациентов. Хотя в предыдущей работе на большей выборке пациентов с биполярными ЛЖ электродами (n=248) нам удалось построить статистически достоверную модель прогноза ответа на СРТ по дооперационным показателям, она все же не обладала высокой точностью прогноза [10]. В исследовании [6] на 1342 пациентах со стандартными биполярными ЛЖ электродами было показано, что МЖЭЗ, измеренная с помощью ЭКГ, является сильным независимым предиктором клинического ответа на СРТ, оценённого по изменению ФК ХСН. Однако на нашей выборке пациентов мы не получили достоверных связей между МЖЭЗ и изменением ФК ХСН. Также нам не удалось по дооперационным клиническим данным спрогнозировать изменение МЖЭЗ в рассматриваемые периоды, что согласуется с аналогичным результатом, полученным в исследовании [9]. В этой же работе авторам также не удалось построить статистически достоверную модель прогноза изменения МЖЭЗ в раннем послеоперационном периоде.
Тем не менее добавление в набор потенциальных предикторов величин исходной МЖЭЗ, а также изменений показателей ремоделирования ∆МЖЭЭ, ∆КСО, ∆КДО, ∆ФВ в первые 3 мес. после имплантации позволило нам построить статистически значимые классификаторы ответа на СРТ по критерию снижения КСО >10% в отдаленные послеоперационные сроки 12 и 24 мес. Исходная величина МЖЭЗ, ∆МЖЭЗ и факт выбора максимальной или немаксимальной МЖЭЗ оказались наиболее значимыми предикторами в построенных моделях логистической регрессии (табл. 2). Заметим, что ни один из отобранных для предиктивных моделей признаков по отдельности не разделял респондеров и нереспондеров. Построенные нами информационные модели показывают важную роль выбора оптимального расположения активного полюса для стимуляции ЛЖ и позволяют для пациента в ранние послеоперационные сроки дать прогноз динамики улучшения состояния на долгосрочный послеоперационный период. Важно, что величины МЖЭЗ и ∆МЖЭЗ возможно рассчитать при помощи персонифицированных математических моделей сердца еще до установки стимулятора и использовать для прогнозирования исходов СРТ вместе с другими дооперационными показателями. Такая технология разработана нашей группой и позволяет повысить точность предоперационного прогноза эффективности терапии по сравнению с другими известными классификаторами [15]. Более того, мы предполагаем использовать эту технологию для выбора оптимального положения для установки ЛЖ электрода и наиболее эффективного вектора стимуляции для имплантированного устройства СРТ.
Заключение
У пациентов с имплантированными устройствами СРТ с квадриполярными ЛЖ электродами установлена достоверная корреляция между изменением МЖЭЗ на естественном ритме и характеристиками геометрического и функционального ремоделирования ЛЖ в долгосрочном послеоперационном периоде. Продемонстрировано положительное влияние выбора активного полюса ЛЖ электрода с максимальной МЖЭЗ на частоту положительного ответа и его величину. Показано, что оптимизация вектора стимуляции является значимым предиктором успешности терапии.
Отношения и деятельность. Исследование поддержано грантом РНФ № 19-14-00134.
Список литературы
1. Gold MR, Rickard J, Daubert JC, et al. Redefining the classifications of response to cardiac resynchronization therapy: results from the REVERSE study. JACC: Clinical Electrophysiology. 2021;7(7):871-80. doi:10.1016/j.jacep.2020.11.010.
2. Резник Е. В., Солтис С. Ю., Устюжанин Д. В. и др. Сердечная ресинхронизирующая терапия у больных с хронической сердечной недостаточностью: взгляд терапевта, кардиолога. CardioСоматика. 2019;10(3):13-29. doi:10.26442/22217185.2019.3.190572.
3. Бокерия Л., Неминущий Н., Постол А. Сердечная ресинхронизирующая терапия. Формирование показаний и современные подходы к повышению эффективности метода. Комплексные проблемы сердечно-сосудистых заболеваний. 2018:7(3):102-16. doi:10.17802/2306-1278-2018-7-3-102-116.
4. Стукалова, О., Н. Миронова, М. Д. Уцумуеваи др. Эффективность сердечной ресинхронизирующей терапии у пациентов с хронической сердечной недостаточностью различной этиологии в зависимости от структурного поражения миокарда по данным магнитно-резонансной томографии сердца с контрастированием. Российский кардиологический журнал. 2019;(12):22-32. doi:10.15829/1560-40712019-12-22-32.
5. Thébault C, Donal E, Meunier C, et al. Sites of left and right ventricular lead implantation and response to cardiac resynchronization therapy observations from the REVERSE trial. European heart journal. 2012;33(21): 2662-71. doi:10.1093/eurheartj/ehr505.
6. Gold MR, Yu Y, Wold N, et al. The role of interventricular conduction delay to predict clinical response with cardiac resynchronization therapy. Heart Rhythm. 2017;14(12):1748-55. doi:10.1016/j.hrthm.2017.10.016.
7. Soejima K, Kondo Y, Sasaki S, et al. Intracardiac conduction time as a predictor of cardiac resynchronization therapy response: Results of the BIO| SELECT pilot study. Heart rhythm O2. 2021;2(6):588-96. doi:10.1016/j.hroo.2021.09.007.
8. Behar JM, Bostock J, Zhu Li AP, et al. Cardiac resynchronization therapy delivered via a multipolar left ventricular lead is associated with reduced mortality and elimination of phrenic nerve stimulation: long‐term follow‐up from a multicenter registry. Journal of Cardiovascular Electrophysiology. 2015;26(5):540-6. doi:10.1111/jce.12625.
9. Koerber SM, Field ME, Cobb DB, et al. Electrical delays in quadripolar leads with cardiac resynchronization therapy. Journal of Cardiovascular Electrophysiology. 2021;32(9):2498503. doi:10.1111/jce.15156.
10. Чумарная, Т.В., Т. Любимцева, С. И. Солодушкин и др. Оценка эффективности сердечной ресинхронизирующей терапии в отдаленном послеоперационном периоде. Российский кардиологический журнал. 2021;(7):4531. doi:10.15829/1560-4071-2021-4531.
11. Forleo GB, Di Biase L, Bharmi R, et al. Hospitalization rates and associated cost analysis of cardiac resynchronization therapy with an implantable defibrillator and quadripolar vs. bipolar left ventricular leads: a comparative effectiveness study. EP Europace. 2015;17(1):101-7. doi:10.1093/europace/euu290.
12. Asbach S, Hartmann M, Wengenmayer T, et al. Vector selection of a quadripolar left ventricular pacing lead affects acute hemodynamic response to cardiac resynchronization therapy: a randomized cross-over trial. PloS one. 2013;8(6):e67235. doi:10.1371/journal.pone.0067235.
13. Gold MR, Auricchio A, Leclercq C, et al. The rationale and design of the SMART CRT trial. Pacing and Clinical Electrophysiology. 2018;41(9):1212-6. doi:10.1111/pace.13459.
14. Solovyova O, Katsnelson LB, Kohl P, et al. Mechano-electric heterogeneity of the myocardium as a paradigm of its function. Progress in biophysics and molecular biology. 2016;120(1-3):249-54. doi:10.1016/j.pbiomolbio.2015.12.007.
15. Khamzin S, Dokuchaev A, Bazhutina A, et al. Machine Learning prediction of cardiac resynchronisation therapy response from combination of clinical and model-driven data. Frontiers in physiology. 2021:2283. doi:10.3389/fphys.2021.753282.
Об авторах
Т. В. ЧумарнаяРоссия
Татьяна Владиславовна Чумарная — кандидат биологических наук, старший научный сотрудник лаборатории математической физиологии им. Мархасина В. С., научный сотрудник научной лаборатории “Математическое моделирование в физиологии и медицине с использованием суперкомпьютерных технологий”.
Екатеринбург
Конфликт интересов:
нет
Т. Ал. Любимцева
Россия
Тамара Алексеевна Любимцева — кандидат медицинских наук, врачкардиолог отделения рентгенохирургического лечения сложных нарушений ритма сердца и электрокардиостимуляции, старший научный сотрудник НИЛ клинической аритмологии НИО аритмологии, старший научный сотрудник лаборатории математической физиологии им. Мархасина В. С..
Екатеринбург, Санкт-Петербург
Конфликт интересов:
нет
В. К. Лебедева
Россия
Виктория Кимовна Лебедева — доктор медицинских наук, ведущий научный сотрудник НИО аритмологии, врач-кардиолог отделения рентгенохирургического лечения сложных нарушений ритма сердца и электрокардиостимуляции.
Санкт-Петербург
Конфликт интересов:
нет
Н. З. Гасымова
Россия
Нигяр Закарьевна Гасымова— младший научный сотрудник НИЛ нейромодуляции.
Санкт-Петербург
Конфликт интересов:
нет
Д. С. Лебедев
Россия
Дмитрий Сергеевич Лебедев — доктор медицинских наук, профессор РАН, главный научный сотрудник, профессор кафедры хирургических болезней, врач-сердечно-сосудистый хирург, зав. НИО аритмологии, ведущий научный сотрудник лаборатории математической физиологии им. Мархасина В. С..
Екатеринбург, Санкт-Петербург
Конфликт интересов:
нет
О. Э. Соловьева
Россия
Ольга Эдуардовна Соловьева — доктор физико-математических наук, директор, зав. лабораторией математической физиологии им. Мархасина В. С., зав. научной лабораторией “Математическое моделирование в физиологии и медицине с использованием суперкомпьютерных технологий”, профессор кафедры вычислительной математики и компьютерных наук.
Екатеринбург
Конфликт интересов:
нет
Дополнительные файлы
Рецензия
Для цитирования:
Чумарная Т.В., Любимцева Т.А., Лебедева В.К., Гасымова Н.З., Лебедев Д.С., Соловьева О.Э. Оценка межжелудочковой электрической задержки при сердечной ресинхронизирующей терапии у пациентов с квадриполярными системами в долгосрочном послеоперационном наблюдении. Российский кардиологический журнал. 2022;27(7):5121. https://doi.org/10.15829/1560-4071-2022-5121
For citation:
Chumarnaya T.V., Lyubimtseva T.A., Lebedeva V.K., Gasimova N.Z., Lebedev D.S., Solovieva O.E. Evaluation of interventricular delay during cardiac resynchronization therapy in patients with quadripolar systems in long-term postoperative follow-up. Russian Journal of Cardiology. 2022;27(7):5121. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5121
JATS XML

















































