Перейти к:
Анализ электрокардиографических признаков при гипертрофической кардиомиопатии до и после септальной миоэктомии. Новый критерий проксимальной блокады левой ножки пучка Гиса
https://doi.org/10.15829/1560-4071-2022-5110
Аннотация
Цель. Проанализировать 20 электрокардиографических (ЭКГ) признаков блокады левой ножки пучка Гиса (БЛНПГ) до и после септальной миоэктомии у пациентов с гипертрофической кардиомиопатией (ГКМП) и разработать на основе отобранных признаков критерий проксимальной БЛНПГ.
Материал и методы. В ретроспективное нерандомизированное исследование были включены 50 пациентов с обструктивной формой ГКМП, которым была выполнена септальная миоэктомия. Критериями включения в исследование являлись: ширина комплекса QRS <120 мс до операции, трансаортальный доступ во время септальной миоэктомии и расширение комплекса QRS ≥120 мс в раннем послеоперационном периоде. Для каждого пациента были проанализированы ЭКГ до септальной миоэктомии и в первую неделю после операции. При этом независимо оценивали 20 ЭКГ-признаков, предложенных ранее в критериях БЛНПГ.
Результаты. Иссечение небольшого участка миокарда базальных отделов межжелудочковой перегородки весом в среднем 4,9±2 г приводило к статистически значимому увеличению ширины комплекса QRS (на 61±14,6 мс) и частоты встречаемости практически всех ЭКГ-признаков БЛНПГ. Среди признаков, продемонстрировавших статистически значимую динамику после операции, в 100% случаев (n=50) регистрировали: (1) наличие зазубрины/ сглаженности в середине QRS как минимум в двух отведениях из: I, aVL, V1-V2, V5-V6; (2) отсутствие зубца q в отведениях V5-V6 и (3) дискордантный зубец T как минимум в двух отведениях из: I, aVL, V5, V6. Учитывая дизайн исследования, дополнительно была включена (4) ширина комплекса QRS ≥120 мс. Эти ЭКГ-признаки были объединены в новый критерий проксимальной БЛНПГ.
Заключение. Впервые на патофизиологической модели ятрогенного блока проведения по левой ножке пучка Гиса был предложен критерий проксимальной БЛНПГ. Необходима дальнейшая оценка этого критерия на выборке пациентов с гетерогенным уровнем блока проведения по левой ножке пучка Гиса, являющихся кандидатами на сердечную ресинхронизирующую терапию.
Ключевые слова
Для цитирования:
Малишевский Л.М., Зубарев С.В., Гурщенков А.В., Лебедева В.К., Любимцева Т.А., Малишевская Д.С., Зайцев В.В., Гордеев М.Л., Лебедев Д.С. Анализ электрокардиографических признаков при гипертрофической кардиомиопатии до и после септальной миоэктомии. Новый критерий проксимальной блокады левой ножки пучка Гиса. Российский кардиологический журнал. 2022;27(7):5110. https://doi.org/10.15829/1560-4071-2022-5110
For citation:
Malishevsky L.M., Zubarev S.V., Gurshchenkov A.V., Lebedeva V.K., Lyubimtseva T.A., Malishevskaya D.S., Zaitsev V.V., Gordeev M.L., Lebedev D.S. Analysis of electrocardiographic signs in hypertrophic cardiomyopathy before and after septal myectomy. New criterion for proximal left bundle branch block. Russian Journal of Cardiology. 2022;27(7):5110. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5110
Согласно современным представлениям, блокада левой ножки пучка Гиса (БЛНПГ) является гетерогенной патологией проводящей системы сердца, при которой блок проведения может локализоваться на одном из трех уровней: внутри пучка Гиса (left intrahisian block), в левой ножке пучка Гиса (ЛНПГ) или более дистально при сохранном проведении по волокнам Пуркинье [1]. В исследовании Upadhyay GA, et al. было продемонстрировано, что от локализации блока проведения зависит вероятность скорректировать ширину комплекса QRS при стимуляции пучка Гиса (СПГ) с целью сердечной ресинхронизирующей терапии (СРТ) [1]. Так, при блоке проведения на уровне пучка Гиса коррекция ширины QRS была достигнута у 94% пациентов, при более дистальном (на уровне ЛНПГ) — у 28% пациентов, а при сохранном проведении по волокнам Пуркинье (несмотря на электрокардиографическую (ЭКГ) картину полной БЛНПГ) — ни в одном из случаев. Определение локализации блока проведения при ЭКГ-картине БЛНПГ имеет большое клиническое значение, учитывая включение СПГ в качестве альтернативы бивентрикулярной стимуляции при СРТ в клинические рекомендации Европейского общества кардиологов 2021г (IIa, B) [2].
Для выявления проксимальной БЛНПГ было предложено контактное активационное картирование межжелудочковой перегородки (МЖП) со стороны эндокарда левого желудочка (ЛЖ) [1]. Однако ряд авторов оспаривает диагностическую ценность такого подхода для определения локализации блока проведения при БЛНПГ [3]. Ранее нами было продемонстрировано, что при независимом анализе ЭКГпризнаков, включенных в существующие критерии БЛНПГ, возможно предсказать обратное ремоделирование миокарда ЛЖ на фоне СРТ [4]. Каждый ЭКГ-признак имеет фундаментальное электрокардиографическое обоснование и отражает характерные электрофизиологические изменения активации миокарда желудочков, наблюдаемые при БЛНПГ.
В связи с этим независимый анализ ЭКГ-признаков может быть использован и для определения локализации блока проведения ЛНПГ при исследовании ЭКГ пациентов, имеющих верифицированную проксимальную БЛНПГ.
В качестве патофизиологической модели проксимальной БЛНПГ может быть исследована ятрогенная БЛНПГ, формирующаяся после септальной миоэктомии по поводу гипертрофической кардиомиопатии (ГКМП) у пациентов с узким комплексом QRS до операции. Важно отметить, что при трансаортальном доступе формируется изолированное повреждение базальных отделов МЖП без формирования дополнительных ятрогенных линий блока проведения. Таким образом, независимый анализ ЭКГ-признаков у пациентов с БЛНПГ после септальной миоэктомии может позволить выявить характерные признаки проксимальной БЛНПГ и потенциально предсказать вероятность коррекции ширины комплекса QRS на фоне СПГ. Цель исследования: проанализировать ЭКГпризнаки БЛНПГ до и после септальной миоэктомии у пациентов с ГКМП и разработать на основе отобранных признаков критерий проксимальной БЛНПГ.
Материал и методы
В ретроспективное нерандомизированное исследование были включены 50 пациентов с обструктивной формой ГКМП (45,1% мужчин), которым была выполнена септальная миоэктомия (средний возраст на момент операции составил 55,7±10,7 лет). Критериями включения в исследование являлись: ширина комплекса QRS <120 мс до операции, трансаортальный доступ во время септальной миоэктомии и расширение комплекса QRS ≥120 мс в раннем послеоперационном периоде. Продолжительность операции составила 165 [ 140; 215] мин, время пережатия аорты — 46 [ 29; 74] мин. Средняя масса резецированного миокарда составила 4,9±2 г.
Для каждого пациента были проанализированы ЭКГ в 12 стандартных отведениях до септальной миоэктомии и в первую неделю после операции. Для исключения влияния обратимых причин нарушения проведения на морфологию комплекса QRS всем пациентам была выполнена и повторно оценена ЭКГ через 3 мес. после септальной миоэктомии. При этом независимо оценивали каждый из 20 ЭКГ-признаков, которые были предложены ранее в 10 критериях БЛНПГ: Европейского общества кардиологов (ESC) в 2006, 2013 и 2021гг, Американской ассоциации сердца (AHA) в 2009г, группы Strauss DG, et al., а также в крупных многоцентровых исследованиях, направленных на изучение влияния морфологии комплекса QRS на эффективность СРТ: MIRACLE, CARE-HF, MADIT-CRT, REVERSE и RAFT [5]. Список ЭКГ-признаков для каждого критерия был представлен ранее в работе Кузнецова В.А. и др. [5]. Для критерия ESC 2021 были использованы ЭКГ-признаки, описанные Calle S, et al. [6]. Зазубрина была определена при внезапном изменении направления восходящего или нисходящего колен зубца R под углом ≥900; сглаженность — при внезапном изменении направления под углом от 00 до 900. Определение БЛНПГ выполнялось при наличии всех ЭКГ-признаков, включенных в соответствующий критерий.
Эхокардиографическая характеристика пациентов до септальной миоэктомии и на 7 сут. после операции представлена в таблице 1. Все пациенты получали оптимальную медикаментозную терапию в соответствии с действующими на момент операции клиническими рекомендациями. Исследование было выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации. До включения в исследование у всех участников было получено письменное информированное согласие.
Таблица 1
Эхокардиографическая характеристика пациентов исходно и на 7 сут. после операции
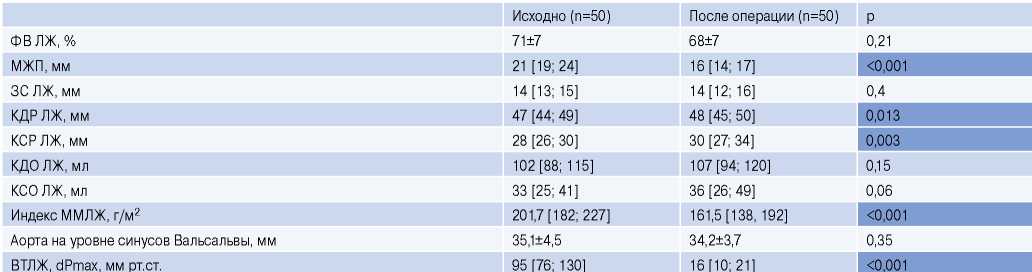
Сокращения: ВТЛЖ — выходной тракт левого желудочка, ЗС — задняя стенка, КДО — конечно-диастолический объем, КДР — конечно-диастолический размер, КСО — конечно-систолический объем, КСР — конечно-систолический размер, ЛЖ — левый желудочек, МЖП — межжелудочковая перегородка, ММЛЖ — масса миокарда левого желудочка, ФВ — фракция выброса, dPmax — максимальный градиент давления.
Статистический анализ был выполнен в программе IBM SPSS 28.0.1. Количественные переменные представлены в виде среднеарифметического значения со стандартным отклонением (M±SD) при нормальном распределении, оцененном с помощью критерия Шапиро-Уилка. При распределении, отличном от нормального — в виде медианы с интерквартильным размахом (Me [ 25; 75]). Для анализа связанных количественных переменных в зависимости от распределения использовали парный критерий Стьюдента или критерий Уилкоксона, для качественных — критерий Мак-Немара. За достоверность различий изучаемых параметров принимали уровень значимости p<0,05.
Результаты
У большинства пациентов после септальной миоэктомии была диагностирована БЛНПГ. В зависимости от выбранного критерия, БЛНПГ определялась у 92% (для критерия Strauss), 84% (ESC 2013г), 64% (ESC 2021г) или 54% (AHA) пациентов. При сравнении ЭКГ пациентов до и после септальной миоэктомии было установлено значимое увеличение ширины комплекса QRS на 61±14,6 мс (табл. 2).
Таблица 2
Сравнение ЭКГ-признаков до и после септальной миоэктомии
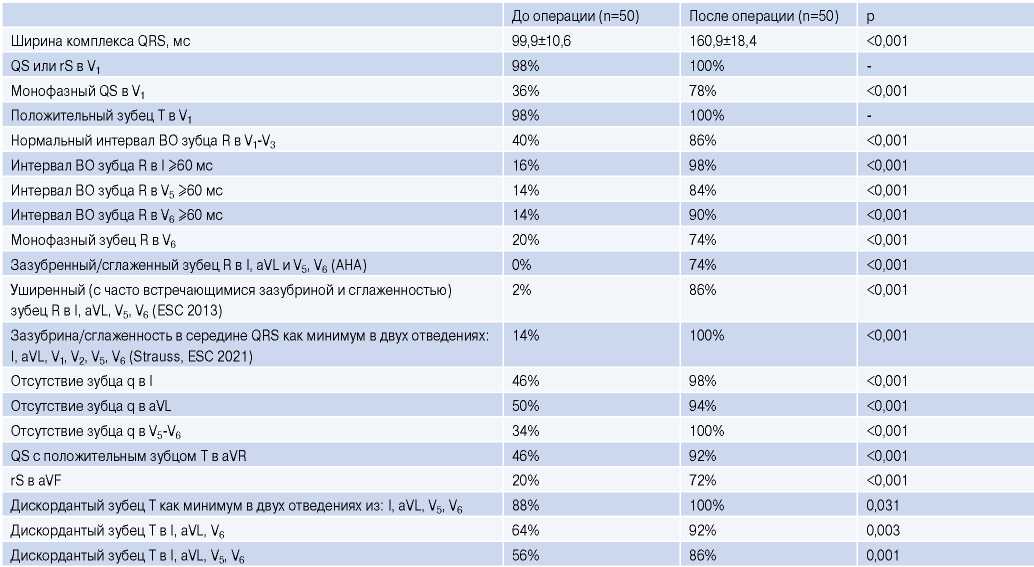
Сокращение: ВО — внутреннее отклонение.
Статистически значимые различия до и после операции продемонстрировали практически все ЭКГ-признаки (табл. 2). Среди значимых признаков во всех случаях регистрировали наличие зазубрины/сглаженности в середине QRS как минимум в двух отведениях из: I, aVL, V1-V2, V5-V6 (по Strauss); отсутствие зубца q в V5-V6 и дискордантный зубец T как минимум в двух отведениях из: I, aVL, V5, V6. Наибольшую динамику продемонстрировало наличие зазубрины, которая была предложена Strauss DG, et al. (+84%).
В новый критерий проксимальной БЛНПГ были отобраны ЭКГ-признаки, продемонстрировавшие статистически значимую динамику и наблюдаемые у 100% пациентов после септальной миоэктомии (наличие зазубрины по Strauss, отсутствие зубца q в отведениях V5-V6 и дискордантный зубец T как минимум в двух отведениях из: I, aVL, V5, V6). Учитывая дизайн исследования, в новый критерий БЛНПГ дополнительно была включена ширина комплекса QRS ≥120 мс.
На рисунках 1 и 2 представлены ЭКГ пациента до и на вторые сутки после септальной миоэктомии. После операции увеличилась ширина комплекса QRS и интервала внутреннего отклонения (ВО) зубца R в отведениях I, V5, V6; исчезли зубцы q в отведениях V5-V6, появилась зазубрина зубца R и изменилась морфология комплекса QRS в отведении aVF.
Стоит отметить, что до операции при узком исходном комплексе QRS у пациента отсутствовал зубец q в отведениях I и aVL, регистрировался QS в отведении V1, QS с положительным Т в aVR, а также дискордантный зубец T (рис. 1). Это свидетельствует о том, что многие ЭКГ-признаки отражают не только изменение активации сердца при БЛНПГ, но и связаны с гипертрофией миокарда ЛЖ (ГЛЖ). Практически у всех (98%) пациентов до операции регистрировали QS или rS, а также положительный зубец T в отведении V1. В то же время некоторые ЭКГпризнаки практически не встречались до операции. Так, наличие зазубренного/сглаженного зубца R в отведениях I, aVL, V5 и V6 не было зарегистрировано ни у одного пациента до септальной миоэктомии, что говорит о высокой специфичности (100%) этого признака для выявления истинной БЛНПГ. Таким образом, предложенная патофизиологическая модель дополнительно позволяет оценить диагностическую ценность различных ЭКГ-признаков БЛНПГ для дифференцирования истинной БЛНПГ от сочетания ГЛЖ и неполной БЛНПГ (табл. 2).
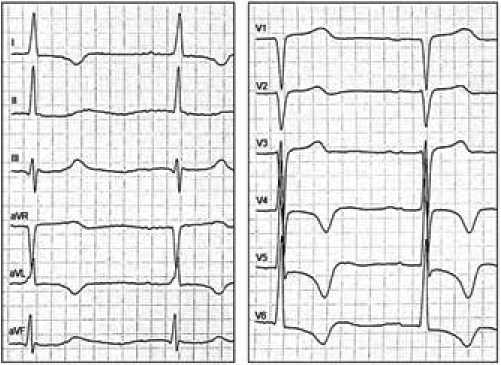
Рис. 1. Пациент П., до септальной миоэктомии, ЭКГ от 30.03.2017, (50 мм/с) QRS=98 мс, P=116 мс, PQ=234 мс, QTc=444 мс.
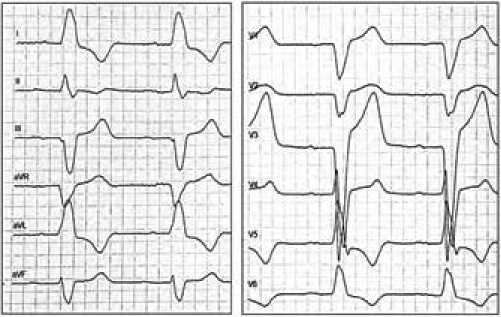
Рис. 2. Пациент П., после септальной миоэктомии, ЭКГ от 01.04.2017, (50 мм/с) QRS=150 мс, P=106 мс, PQ=210 мс, QTc=486 мс.
Обсуждение
В представленном исследовании впервые была проанализирована динамика ЭКГ-признаков при формировании ятрогенной проксимальной БЛНПГ после септальной миоэктомии трансаортальным доступом. Хирургическое прерывание волокон ЛНПГ при иссечении небольшого участка миокарда базальных отделов МЖП весом в среднем 4,9±2 г приводило к статистически значимому увеличению ширины комплекса QRS (61±14,6 мс) и частоты встречаемости практически всех ЭКГ-признаков БЛНПГ (табл. 2). На сегодняшний день широко распространены экспериментальные модели изолированной БЛНПГ на животных, при которых после радиочастотной аблации ЛНПГ также происходит существенное изменение ширины и морфологии комплекса QRS [7]. Однако оценка динамики ЭКГкартины при повреждении проксимальных волокон ЛНПГ у людей упрощает трансляцию результатов исследования в реальную клиническую практику. Другой патофизиологической моделью проксимальной БЛНПГ является ятрогенная блокада проведения, формируемая после транскатетерной имплантации аортального клапана [8]. Несмотря на более изолированное повреждение проводящих путей за счет использования эндоваскулярной техники, патогенез повреждения ЛНПГ при такой модели включает отек, воспаление и ишемию. При разрешении обратимых факторов проведение по волокнам ЛНПГ может восстанавливаться. Так, в 48% случаев послеоперационная БЛНПГ разрешается к моменту выписки из стационара [9]. У части пациентов с БЛНПГ может восстанавливаться частичное проведение по волокнам ЛНПГ, что влияет на итоговую морфологию комплекса QRS. Преимущество предлагаемой нами патофизиологической модели заключается в том, что при септальной миоэктомии формируется радикальное необратимое хирургическое прерывание всех волокон ЛНПГ на проксимальном уровне.
В ходе нашего исследования было установлено, что многие признаки, предложенные ранее в критериях БЛНПГ, регистрируются на ЭКГ не только после, но и до септальной миоэктомии при узком комплексе QRS. Это свидетельствует о том, что эти ЭКГпризнаки отражают не только изменение активации сердца при БЛНПГ, но и изменение направления векторов активации при ГЛЖ. По мнению ряда авторов при сочетании ГЛЖ и неполной БЛНПГ формируется ЭКГ-картина, похожая на полную БЛНПГ [10][11]. При этом отсутствует электромеханическая диссинхрония миокарда, что приводит к снижению вероятности ответа на СРТ [11]. В нашем исследовании до операции наиболее часто регистрировали QS/ rS и положительный зубец Т в V1 (98%), а также дискордантный зубец Т хотя бы в двух отведениях (88%). Наиболее редко при узком комплексе QRS регистрировали наличие зазубрины/сглаженности (0-14% в зависимости от выбранного ЭКГ-признака, табл. 2) и интервал ВО ≥60 мс в отведениях I, V5-V6 (14-16%). При этом зазубренный/сглаженный зубец R в I, aVL, V5 и V6 не был зарегистрирован ни у одного пациента до операции и, на наш взгляд, может быть использован для выявления сочетания ГЛЖ и неполной БЛНПГ при отборе пациентов на СРТ.
С другой стороны, ЭКГ-признаки, наблюдаемые после септальной миоэктомии трансаортальным доступом, отражают характерные изменения активации миокарда при проксимальном блоке проведения по ЛНПГ. В нашем исследовании только 3 из 20 анализируемых ЭКГ-признака продемонстрировали статистически значимую динамику и встречались у всех (100%) пациентов после операции. Для выявления блока проведения по проксимальным волокнам ЛНПГ Perrin M, et al. предложили новый ЭКГпризнак: зубец r <1 мм в отведении V1 и/или зубец q <1 мм в отведении aVL [12]. Однако в нашем исследовании монофазный QS в отведении V1 встречался у 36% пациентов, а зубец q в aVL отсутствовал у 50% пациентов с ГКМП до операции при сохранном проведении по проводящей системе сердца и узком QRS. На наш взгляд, это свидетельствует о том, что один изолированный ЭКГ-признак не способен с достаточной точностью определить наличие или отсутствие проксимальной БЛНПГ.
При исследуемой патофизиологической модели у всех пациентов (n=50) формировался блок проведения по ЛНПГ на уровне базальных отделов МЖП. Учитывая дизайн исследования, нами были отобраны ЭКГ-признаки, которые регистрировались в 100% случаев после операции и продемонстрировали статистически значимую динамику. Предлагаемый критерий проксимальной БЛНПГ включает четыре ЭКГ-признака:
1) Ширина комплекса QRS ≥120 мс;
2) Зазубрина/сглаженность в середине QRS как минимум в двух отведениях из: I, aVL, V1-V2, V5-V6;
3) Отсутствие зубца q в отведениях V5-V6;
4) Дискордантый зубец T как минимум в двух отведениях из: I, aVL, V5, V6.
Эти признаки связаны с направлением транссептальной активации, направлением реполяризации миокарда ЛЖ, а также с характерным U-образным паттерном активации ЛЖ, ассоциированным с наличием линейного блока проведения, ориентированного вдоль МЖП [13]. Интересно отметить, что три из четырех ЭКГ-признаков, включенных в критерий проксимальной БЛНПГ (ширина комплекса QRS, отсутствие зубца q в отведениях V5-V6 и дискордантный зубец Т), также являлись независимыми предикторами обратного ремоделирования миокарда ЛЖ на фоне СРТ в опубликованном нами ранее исследовании на пациентах с хронической сердечной недостаточностью [4]. Тем не менее, связь между уровнем поражения ЛНПГ и ответом на СРТ при бивентрикулярной электрокардиостимуляции на сегодняшний день недостаточно изучена.
Интерес также вызывают ЭКГ-признаки, которые в нашем исследовании встречались у 98% пациентов после септальной миоэктомии: интервал ВО ≥60 мс и отсутствие зубца q в I стандартном отведении. Эти признаки описывают направление и время транссептальной активации, однако определение целесообразности их включения в критерий проксимальной БЛНПГ возможно только при дальнейшей верификации этого критерия на кандидатах на СРТ.
Заключение
Таким образом, на патофизиологической модели хирургического повреждения ЛНПГ во время септальной миоэктомии был предложен новый комплексный критерий проксимальной БЛНПГ. Необходима дальнейшая оценка этого критерия на выборке пациентов с гетерогенным уровнем блока проведения по ЛНПГ, являющихся кандидатами на СРТ.
Отношения и деятельность. Работа выполнена при финансовой поддержке государственного задания Министерства здравоохранения России (номер регистрации ЕГИСУ НИОКТР 121031100306-6).
Список литературы
1. Upadhyay GA, Cherian T, Shatz DY, et al. Intracardiac Delineation of Septal Conduction in Left Bundle-Branch Block Patterns. Circulation. 2019;139(16):1876-88. doi:10.1161/CIRCULATIONAHA.118.038648.
2. Glikson M, Nielsen JC, Kronborg MB, et al.; ESC Scientific Document Group. 2021 ESC Guidelines on cardiac pacing and cardiac resynchronization therapy. Europace. 2021:euab232. doi:10.1093/europace/euab232.
3. Nayyar S, Fairley L. Letter by Nayyar and Fairley Regarding Article, “Intracardiac Delineation of Septal Conduction in Left Bundle Branch Block Patterns: Mechanistic Evidence of Left Intrahisian Block Circumvented by His Bundle Pacing”. Circulation. 2019;140(14):e711-e712. doi:10.1161/CIRCULATIONAHA.119.040675.
4. Малишевский Л. М., Кузнецов В. А., Тодосийчук В. В. и др. Анализ диагностической ценности электрокардиографических признаков блокады левой ножки пучка Гиса в предсказании обратного ремоделирования на фоне сердечной ресинхронизирующей терапии. Российский кардиологический журнал. 2021;26(9):4500. doi:10.15829/1560-4071-2021-4500.
5. Кузнецов В. А., Малишевский Л. М., Тодосийчук В. В. и др. Оценка взаимосвязи различных критериев блокады левой ножки пучка Гиса с ответом на сердечную ресинхронизирующую терапию при хронической сердечной недостаточности. Кардиология. 2020;60(7):7885. doi:10.18087/cardio.2020.7.n785.
6. Calle S, Timmermans F, De Pooter J. Defining left bundle branch block according to the new 2021 European Society of Cardiology criteria. Neth Heart J. 2022. doi:10.1007/s12471-022-01697-5.
7. Liu L, Tockman B, Girouard S, et al. Left ventricular resynchronization therapy in a canine model of left bundle branch block. Am J Physiol Heart Circ Physiol. 2002;282(6):H223844. doi:10.1152/ajpheart.00684.2001.
8. Jiefang Zhang, Yiwen Pan, Bei Wang, et al. Current Opinions on New-Onset Left Bundle Branch Block after Transcatheter Aortic Valve Replacement and the Search for Physiological Pacing. Rev. Cardiovasc. Med. 2022;23(3):90. doi:10.31083/j.rcm2303090.
9. Testa L, Latib A, De Marco F, et al. Clinical impact of persistent left bundle-branch block after transcatheter aortic valve implantation with CoreValve revalving system. Circulation. 2013;127:1300-7. doi:10.1161/CIRCULATIONAHA.112.001099.
10. Galeotti L, van Dam PM, Loring Z, et al. Evaluating strict and conventional left bundle branch block criteria using electrocardiographic simulations. Europace. 2013;15(12):1816-21. doi:10.1093/europace/eut132.
11. Strik M, Regoli F, Auricchio A, et al. Electrical and mechanical ventricular activation during left bundle branch block and resynchronization. J Cardiovasc Transl Res. 2012;5(2):11726. doi:10.1007/s12265-012-9351-1.
12. Perrin MJ, Green MS, Redpath CJ, et al. Greater response to cardiac resynchronization therapy in patients with true complete left bundle branch block: a PREDICT substudy. Europace. 2012;14(5):690-5. doi:10.1093/europace/eur381.
13. Strauss DG, Selvester RH, Wagner GS. Defining Left Bundle Branch Block in the Era of Cardiac Resynchronization Therapy. The American Journal of Cardiology. 2011;107(6):927-34. doi:10.1016/j.amjcard.2010.11.010.
Об авторах
Л. М. МалишевскийРоссия
Лев Михайлович Малишевский — научный сотрудник лаборатории инструментальной диагностики научного отдела инструментальных методов исследования.
Томск, Санкт-Петербург
Конфликт интересов:
нет
С. В. Зубарев
Россия
Степан Владимирович Зубарев — кандидат медицинских наук, врач-кардиолог, старший научный сотрудник научно-исследовательской лаборатории интервенционной аритмологии.
Санкт-Петербург
Конфликт интересов:
нет
А. В. Гурщенков
Россия
Александр Викторович Гурщенков — кандидат медицинских наук, доцент кафедры сердечно-сосудистой хирургии, врач сердечно-сосудистый хирург.
Санкт-Петербург
Конфликт интересов:
нет
В. К. Лебедева
Россия
Виктория Кимовна Лебедева — доктор медицинских наук, ведущий научный сотрудник, научно-исследовательская лаборатория интервенционной аритмологии НИО аритмологии, профессор кафедры кардиологии Института медицинского образования.
Санкт-Петербург
Конфликт интересов:
нет
Т. А. Любимцева
Россия
Тамара Алексеевна Любимцева — кандидат медицинских наук, врач-кардиолог отделения рентгенохирургического лечения сложных нарушений ритма сердца и электрокардиостимуляции, старший научный сотрудник НИЛ клинической аритмологии НИО аритмологии.
Санкт-Петербург
Конфликт интересов:
нет
Д. С. Малишевская
Россия
Диана Сергеевна Малишевская — ординатор кафедры кардиологии факультета подготовки кадров высшей квалификации Института медицинского образования.
Санкт-Петербург
Конфликт интересов:
нет
В. В. Зайцев
Россия
Вадим Витальевич Зайцев — врач-кардиолог, ассистент кафедры кардиологии факультета подготовки кадров высшей квалификации Института медицинского образования.
Санкт-Петербург
Конфликт интересов:
нет
М. Л. Гордеев
Россия
Михаил Леонидович Гордеев — профессор, доктор медицинских наук, главный научный сотрудник НИО кардиоторакальной хирургии.
Санкт-Петербург
Конфликт интересов:
нет
Д. С. Лебедев
Россия
Дмитрий Сергеевич Лебедев — доктор медицинских наук, профессор РАН, главный научный сотрудник научно-исследовательского отдела аритмологии.
Санкт-Петербург
Конфликт интересов:
нет
Дополнительные файлы
Рецензия
Для цитирования:
Малишевский Л.М., Зубарев С.В., Гурщенков А.В., Лебедева В.К., Любимцева Т.А., Малишевская Д.С., Зайцев В.В., Гордеев М.Л., Лебедев Д.С. Анализ электрокардиографических признаков при гипертрофической кардиомиопатии до и после септальной миоэктомии. Новый критерий проксимальной блокады левой ножки пучка Гиса. Российский кардиологический журнал. 2022;27(7):5110. https://doi.org/10.15829/1560-4071-2022-5110
For citation:
Malishevsky L.M., Zubarev S.V., Gurshchenkov A.V., Lebedeva V.K., Lyubimtseva T.A., Malishevskaya D.S., Zaitsev V.V., Gordeev M.L., Lebedev D.S. Analysis of electrocardiographic signs in hypertrophic cardiomyopathy before and after septal myectomy. New criterion for proximal left bundle branch block. Russian Journal of Cardiology. 2022;27(7):5110. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5110
JATS XML

















































