Перейти к:
Проблемные аспекты компенсации дефицита железа при хронической сердечной недостаточности
https://doi.org/10.15829/1560-4071-2023-5103
Аннотация
Выделены первоначальные противоречия в проблеме коррекции анемии у кардиологических пациентов. Подробно разобраны вопросы диагностики и лечения дефицита железа, представленные в обновленных Национальных клинических рекомендациях по хронической сердечной недостаточности. На их основе, привлекая при этом собственные исследования, автор ставит целью разработать лечебно-диагностическую программу при анемии.
Ключевые слова
Для цитирования:
Макарова Н.А. Проблемные аспекты компенсации дефицита железа при хронической сердечной недостаточности. Российский кардиологический журнал. 2023;28(2):5103. https://doi.org/10.15829/1560-4071-2023-5103
For citation:
Makarova N.A. Problematic aspects of iron deficiency compensation in heart failure. Russian Journal of Cardiology. 2023;28(2):5103. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5103
Как правило, развитие хронической патологии сопровождается снижением уровня гемоглобина в плазме крови (рис. 1). Наличие подобных изменений служит веским основанием для постановки диагноза — анемия.
Среди патологий, протекающих с хроническим воспалением, наиболее изучаемой является хроническая сердечная недостаточность (ХСН), при которой частота присоединения анемии может достигать 70% случаев [1]. К отличительным особенностям ее механизма (рис. 2) относят угнетение ингибиторами ангиотензинпревращающего фермента пролиферации эритроидных клеток-предшественников за счет образования тетрапептида Aс-SDKP (N-ацетил-серил-аспартил-лизил-пролина) и снижения почечной продукции эритропоэтина (ЭПО), мальабсорбцию, ишемическую дисфункцию костного мозга и ишемическое повреждение почечной ткани, а также гемодилюцию [2].
Сложность коррекции анемии у кардиологических пациентов вызвана противоречивыми задачами. Требуется повысить кислородную емкость крови для обеспечения должного уровня оксигенации тканей, в т.ч. и миокарда, прирост кислородной емкости крови и, соответственно, повышение вязкости крови способны оказывать негативное влияние в качестве дополнительной нагрузки на поврежденный миокард. Отдельно следует учитывать, что целенаправленность ингибиции эритропоэза при хронических заболеваниях является частью стандартной комплексной защитной реакции системы крови на неспецифические для нее сильные раздражители, названной гематологическим стресс-синдромом.
Цель работы: разработка лечебно-диагностической программы при анемии, ассоциированной с ХСН.
Для успешного достижения терапевтических целей необходимо разработать алгоритм решения следующих задач:
- выбор клинико-лабораторных критериев коррекции дыхательной функции крови;
- определение целесообразности вида лекарственной терапии на каждом из этапов основного заболевания;
- поиск промежуточных пределов уровней гемоглобина и ферритина (ФТ) в крови на пути к конечным точкам коррекции.
На стадии формирования дисфункции левого желудочка создаются предпосылки для преобладания ингибирующих влияний (в первую очередь фактора некроза опухолей α) на эритропоэз в костном мозге, поскольку у пациентов снижается выработка противовоспалительных цитокинов [3]. При стойком снижении сердечного выброса и недостаточном системном кислородном обеспечении тормозится основной обмен и двигательная активность, а между интенсивностью обменных процессов в организме и функционированием эритрона существует обратная связь. Даже у условно здоровых лиц пожилого и старческого возраста количество гемоглобина в плазме крови колеблется в пределах нижней границы нормы, выведенной для зрелого возраста. В отношении данных возрастных категорий, имеющих хроническую болезнь почек и находящихся на гемодиализе, предполагаемым оптимумом является его концентрация >90 г/л [4]. Следовательно, поддержание организмом эритроцитарных параметров на новом уровне при ХСН должно рассматриваться как проявление адаптации к условиям болезни. Зависимость системного транспорта кислорода от концентрации эритроцитов (гематокрита) имеет куполообразную форму с максимумом ~30% и наибольшим кислородтранспортным эффектом в диапазоне 30-40% [5]. Организм способен увеличить количество потребляемого кислорода резервными путями с меньшим диапазоном компенсирующих возможностей: повышением уровня дыхания, снижением сродства гемоглобина к кислороду, открытием дополнительных капилляров. В ранее проведенном исследовании на группе пациентов 54-89 лет с ХСН ишемического генеза и анемией только у части из них нами отмечены признаки мобилизации компенсаторных гемодинамических механизмов (увеличение частоты сердечных сокращений, ударного и минутных объемов) вне зависимости от степени снижения фракции выброса (ФВ). При этом не было получено статистически значимой корреляции указанных параметров с гемоглобином. Не исключено, что адаптация может быть связана не только с медленным развитием анемии на фоне основного заболевания, но и с мультифокальным атеросклерозом, которому свойственна гипоксемия. В ходе адаптации способны задействоваться резервные пути для поддержания гомеостаза железа. Наряду с двухвалентным транспортером металлов ДМТ-1, экспрессируемым энтероцитами двенадцатиперстной кишки (действует при pH 5,5), у человека обнаружен другой апикальный трансмембранный переносчик железа — Zrt-подобный белок 14 (Zip 14), для которого оптимальный рН составляет 7,5 [6]. Пока его функции, как и точная локализация в тонком кишечнике, не определены. На почечном уровне предполагается, что он участвует в реабсорбции не-трансферрин-связанного железа эпителием проксимальных канальцев и способен опосредовать остаточную активность эпителиоцитов дистальных канальцев [7]. Еще менее изученным механизмом является экспорт гемового железа через базолатеральную мембрану энтероцита переносчиком рецептора С вируса лейкемии (FLCR) или белком-транспортером ABCG2, которые могут компенсировать функциональную недостаточность ферропортина — главного базолатерального транспортера железа [6].
В Национальных клинических рекомендациях рекомендуется в качестве первичных тестов концентрация сывороточного ФТ и трансферрина [8]. Однако связь между состоянием насосной функции сердца, периферического отдела эритрона с его гуморальными регуляторами и обмена железа не может быть представлена в виде упрощенной модели с ограниченным числом факторов. Как показало собственное исследование, при ХСН возможны различные комбинации ведущих лабораторных параметров. Поэтому должны быть использованы дополнительные критерии — абсолютное количество ретикулоцитов в периферической крови, расчетная скорость клубочковой фильтрации, уровни сывороточного ЭПО и гепсидина. Кроме того, каждый организм имеет свою индивидуальную метаболическую потребность в кислороде и железе. Измерить ее крайне сложно, а именно она обязывает принимать во внимание возраст и степень физической активности. Рациональный подход к решению первой задачи подразумевает также установление повышенного риска или факта кровопотерь, различных дисфункциональных расстройств внутренних органов (в первую очередь желудочно-кишечного тракта) наряду с получением информации об общем статусе пациента, тяжести клинических проявлений ХСН и присутствии/отсутствии признаков тканевой сидеропении. Не всегда ориентиром служат и значения расчетной скорости клубочковой фильтрации, поскольку отсутствует выраженная зависимость выделительной и эритропоэтической функций почек [9].
Уровни ФТ <100 мкг/л у пациентов с нарушенной ФВ, ассоциирующиеся с дефицитом железа, являются показанием к внутривенному введению железа карбоксимальтозата [8]. Однако кроме указанного ориентира недостаточности железа в организме, имеется критерий Всемирной организации здравоохранения, дополнительно учитывающий наличие воспалительных или инфекционных процессов (ФТ <70 мкг/л для лиц 20-60 лет и старше). В то же время лабораторным признаком абсолютного железодефицита у условно здоровых взрослых лиц признан уровень сывороточного ФТ <15 мкг/л [10]. Это означает, что ФТ 70-100 мкг/л дает некую свободу выбора в отношении назначения парентеральных железосодержащих препаратов. Ее обоснованность подтверждается результатами исследований c использованием морфологического метода, где частота железодефицита при ХСН составила 24-78% [11]. Субъективные интегральные аргументы об эффективности такой терапии (FAIR-HF, CONFIRM-HF) не выглядят убедительными, поскольку оценка отдаленных результатов исследователями не проводилась. Подобные значения сывороточного ФТ наряду с диапазоном 100-299 мкг/л должны предполагать учет сатурации трансферрина перед назначением железа карбоксимальтозата (<20% [8]). Хотя известно, что данный показатель не относится к категории надежных на фоне воспаления [12]. Представляется необходимой оценка потребности эритропоэза в железе ввиду имеющего места угнетения эритроидного ростка костного мозга. По нашим результатам, действительно, ретикулоцитоз не характерен для пациентов ХСН с анемией [13]. Привлекает внимание еще одна особенность анемии при ХСН — гетерогенность уровней сывороточного ЭПО, поэтому мнение о сниженной выработке гипоксией индуцированного фактора 1 и 2 из-за повреждения в первую очередь ткани почек следует признать спорным. Организм способен отвечать на усугубление гипоксии (сочетание нарушенной ФВ и анемии) чрезмерно высокой продукцией гормона (до 532,2 мЕ/мл) в условиях хронического воспаления и ренальной дисфункции [9]. Важно отметить, что в данной ситуации преобладание дефицита железа становится главным фактором резистентности эритроидного ростка к стимуляции и закономерного появления у пациентов ХСН (особенно, на фоне постинфарктного кардиосклероза) клинических признаков сидеропении совместно со снижением эритроцитарных индексов, микроцитозом и гипохромией эритроцитов. Более того, уровень сывороточного ЭПО может рассматриваться в качестве обоснованного параметра повышенной потребности эритропоэза в железе (рис. 3). Другим показателем этой потребности служит гепсидин, который гипотетически должен испытывать негативное регуляторное влияние гипоксии индуцированного фактора и ЭПО [14]. В нашем исследовании доказано отсутствие устойчивой статистически значимой корреляционной взаимосвязи между концентрациями сывороточных интерлейкина 6 и прогепсидина, фактора некроза опухолей α и прогепсидина. Также была обнаружена тенденция к снижению его уровня (до 51,4 нг/мл) наряду со снижением сывороточного ФТ (до 42,2 нг/мл), что наглядно свидетельствовало об истощении запасов железа [15]. Следовательно, для указанной категории пациентов могут быть использованы индикаторные свойства прогормона и самого гормона. Все выбранные диагностические параметры, в т.ч. ЭПО и гепсидин, должны определяться и при решении вопросов коррекции железодефицита у пациентов ХСН с сохраненной ФВ. Среди них в 1/5 случаев нами была установлена средняя степень снижения концентрации гемоглобина. С другой стороны, нуждаются ли пациенты в интервенционном введении более высоких доз железа в прерывистом режиме, запускающем остро перестройку в регуляции баланса этого микроэлемента. В первую очередь оно будет вызывать снижение его всасывания из желудочно-кишечного тракта [16]. Основным способом лечения абсолютного дефицита железа у этих лиц должны стать оральные препараты — гидроксид-полимальтозный комплекс железа (III) или сукросомальное железо, поскольку нормальные значения ФВ подразумевают отсутствие значимых микроциркуляторных нарушений.
Что же касается комбинации значений сывороточного ФТ 100-299 мкг/л и сатурации трансферрина <20%, то здесь следует взвешенно подойти к решению о назначении железа карбоксимальтозата пациентам с нарушенной ФВ. Каждый организм имеет свою индивидуальную метаболическую потребность в кислороде и железе. Измерить ее, а тем более оценить, крайне сложно, однако именно она обязывает принимать во внимание возраст и степень физической активности. Содержание сывороточного ЭПО, незначительно превышающее физиологический диапазон или находящееся в его пределах, показывает новый уровень балансных отношений стимуляторов и ингибиторов эритропоэза [13], под который создается и новый уровень соотношения между содержанием железа в крови и его депо. Таким образом, в противоположность предыдущей ситуации имеет место преобладание патогенетического звена, связанного с модифицированной продукцией ЭПО. Введение парентерального железа при пониженных потребностях эритроидного ростка в микроэлементе вызывает накопление его в тканях. Перегрузка железом сама по себе может угнетать продукцию ЭПО [14], что замыкает порочный круг. Уровень сывороточного прогепсидина и, соответственно, сывороточного гепсидина у пациентов ХСН с анемией далеко не всегда регистрируется повышенным. Затруднения дифференциации между анемией хронических заболеваний (АХЗ) и сочетанной формой АХЗ-железодефицитная анемия позволяют начать пробную терапию (рис. 3). Отсутствие положительных лабораторных изменений (увеличения количества ретикулоцитов, уровня сатурации трансферрина и гемоглобина) является основанием для прекращения введения железа карбомальтозата и пересмотра генеза анемии. По результатам нашего исследования уровни сывороточного железа части пациентов ХСН с анемией принимают нормальные значения. При этом в физиологическом диапазоне находятся и уровни сывороточного прогепсидина, а сывороточный ФТ сохраняет чувствительность к воспалительным стимулам (до 284,8 нг/мл). В клинических рекомендациях не обращается отдельного внимания на необходимость уточнения диагноза ни перед началом лечения, ни в его процессе. Принципиальная с точки зрения врача информация сосредоточена в современном лабораторно-диагностическом алгоритме при АХЗ (рис. 4) [17]. Кроме первоочередной оценки запасов железа здесь присутствуют моменты, связанные с последовательной диагностикой почечной дисфункции, дефицита других кроветворных факторов и повреждений костного мозга.
Важным представляется мнение об использования парентеральных препаратов железа для коррекции анемии, ассоциированной с ХСН, только в рамках клинических исследований и при наличии добровольного согласия пациента [11]. Поэтому если нет необходимости в коррекции дефицита В12 и фолиевой кислоты, целесообразно в качестве дальнейших действий ограничиться выжидательной тактикой, основанной на мониторинге состояния обмена железа и показателей периферической крови (рис. 3). Стабильность параметров эритроцитов способны обеспечить сбалансированное питание и нутритивная поддержка, уменьшение объема ятрогенных воздействий (частых заборов крови и т.п.). Кроме того, стоит вернуться к разработке и развитию схем ранее предлагаемого сочетанного применения селективной деконтаминации, пробиотиков и статинов, нормализующих микрофлору толстой кишки и снижающих уровень провоспалительных цитокинов в плазме крови [18]. Примером служит снижение концентрации гепсидина, увеличение уровней железа и гемоглобина в плазме крови пациентов с хронической болезнью почек 3-4 стадии после 6 мес. приема аторвастатина [19]. Такая стратегия подходит и для пациентов с сохраненной ФВ. В лечении железодефицита следует отдать предпочтение оральным препаратам железа, а залогом позитивного ответа на терапию может служить нормальный уровень сывороточного гепсидина.
Условия и способы коррекции анемии при ХСН могут кардинальным образом отличаться от используемых при других хронических заболеваниях (рис. 5). Эти отличия связаны с расстройством деятельности сердца, трансформирующим все функции организма, в т.ч. и системы эритрона.
В вопросе определения показаний к ферротерапии у пациентов ХСН обязательно следует рассматривать результаты измерений ЭПО и гепсидина. На их основе необходимо разрабатывать долгосрочную программу лечебных и профилактических мероприятий, направленную на восполнение метаболических ресурсов (в первую очередь кроветворных факторов), увеличение всасывания железа из желудочно-кишечного тракта.
Отношения и деятельность: автор заявляет об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
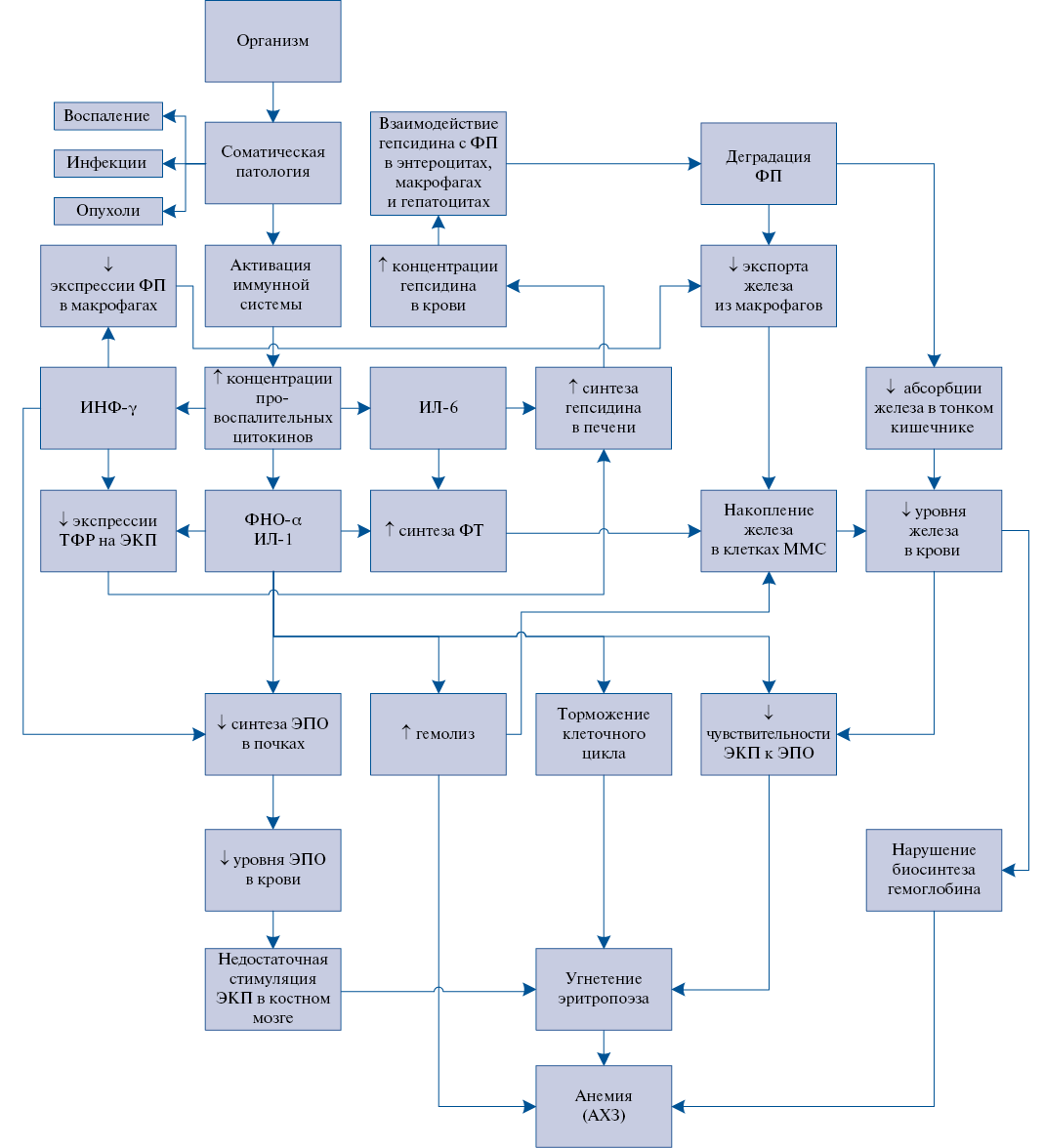
Рис. 1. Механизм АХЗ.
Сокращения: АХЗ — анемия хронических заболеваний, ИЛ — интерлейкин, ИНФ-γ — интерферон γ, ММС — моноцитарно-макрофагальная система, ТФР — трансферриновый рецептор, ФНО-α — фактор некроза опухолей α, ФП — ферропортин, ФТ — ферритин, ЭКП — эритроидные клетки-предшественники, ЭПО — эритропоэтин.

Рис. 2. Отличительные особенности анемии при ХСН.
Сокращения: иАПФ — ингибиторы ангиотензинпревращающего фермента, РААС — ренин-ангиотензин-альдостероновая система, ЭКП — эритроидные клетки-предшественники, ЭПО — эритропоэтин, A-cSDKP — N-ацетил-серил-аспартил-лизил-пролин.

Рис. 3. Диагностика и лечение железодефицита у пациентов ХСН.
Сокращения: ОАК — общий анализ крови, ФТ — ферритин, ХСНнФВ — хроническая сердечная недостаточность с низкой фракцией выброса, ЭПО — эритропоэтин.
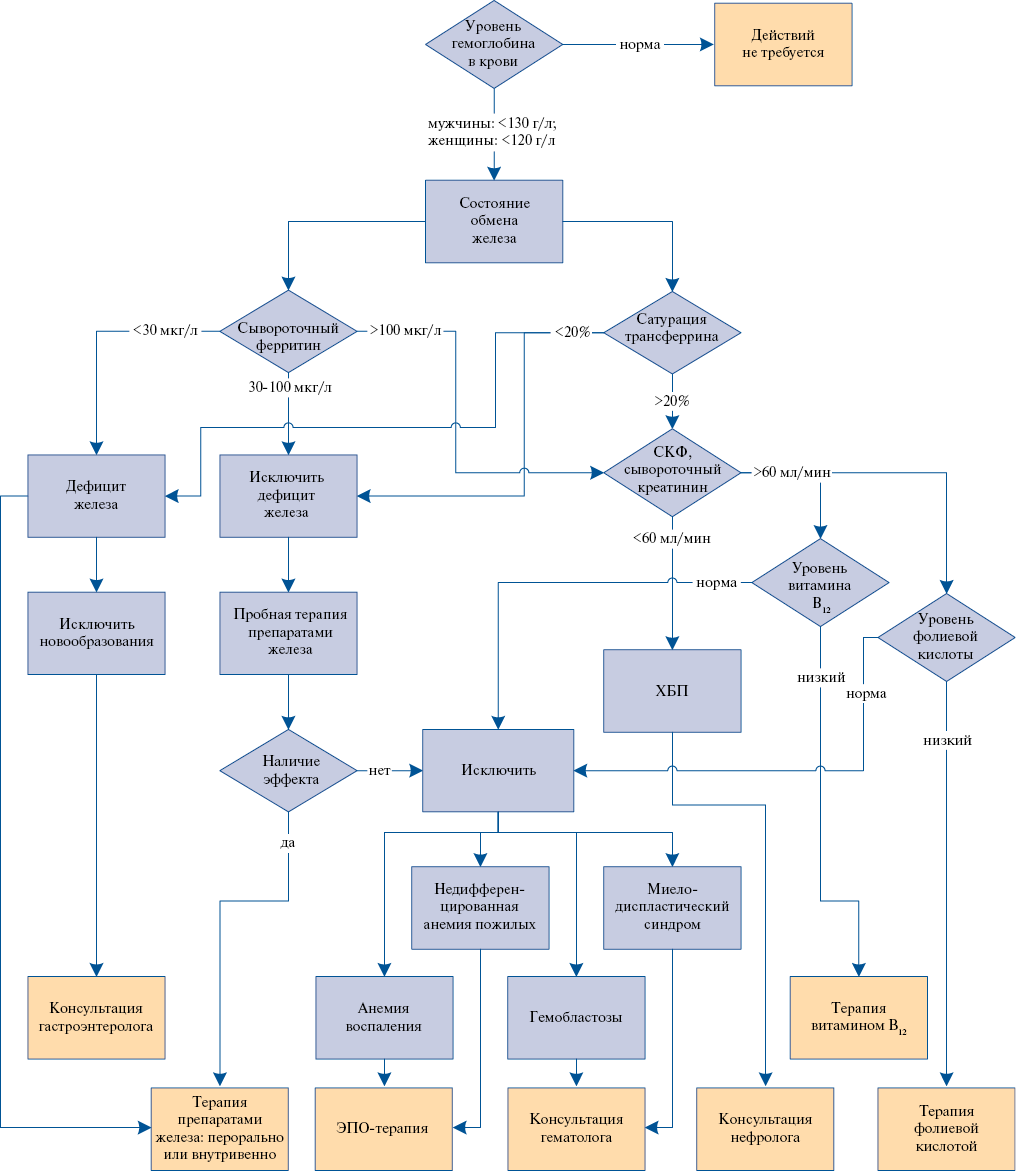
Рис. 4. Лечебно-диагностический алгоритм при анемии (мод. из [17]).
Сокращения: СКФ — скорость клубочковой фильтрации, ХБП — хроническая болезнь почек, ЭПО — эритропоэтин.

Рис. 5. Новые способы коррекции АХЗ.
Сокращения: АХЗ — анемия хронических заболеваний, ГИФ — гипоксией индуцированный фактор, ИЛ-6 — интерлейкин 6, ХСН — хроническая сердечная недостаточность, ФВ — фракция выброса, ФП — ферропортин, ФТ — ферритин, ЭКП — эритроидные клетки-предшественники, ЭПО — эритропоэтин.
Список литературы
1. Мареев В. Ю., Гиляревский С. Р., Мареев Ю. В. и др. Согласованное мнение экспертов по поводу роли дефицита железа у больных с хронической сердечной недостаточностью, а также о современных подходах к его коррекции. Кардиология. 2020;60(1):99-106. doi:10.18087/cardio.2020.1.n961.
2. Palazzuoli A, Ruocco G, Pellegrini M, et al. The role of erythropoietin stimulating agents in anemic patients with heart failure: solved and unresolved questions. Ther Сlin Risk Manag. 2014;10:641-50. doi:10.2147/TCRM.S61551.
3. Кравченко А. Я., Черняева Ю. М. Роль цитокинов в развитии и течении сердечной недостаточности. Клиническая медицина. 2013;91(10):11-6.
4. Kuragano T, Mizusaki K, Kimura T, et al. Anemia management considering the pathophysiology of elderly chronic kidney disease patients. Contrib Nephrol. 2019;198:135-43. doi:10.1159/000496528.
5. Mel’nikov AA, Vikulov AD. Rheological properties of blood in athletes. Yaroslavl’: YaGPU, 2008. p. 491. (In Russ.) Мельников А. А., Викулов А. Д. Реологические свойства крови у спортсменов. Ярославль: ЯГПУ, 2008. с. 491. ISBN 978-5-87555-460-7.
6. Ma Y, Okazaki Y, Glass J. A fluorescent metal-sensor study provides evidence for iron transport by transcytosis in the intestinal epithelial cells. J Clin Biochem Nutr. 2018;62(1):49-55. doi:10.3164/jcbn.17-74.
7. van Raaij SEG, Srai SKS, Swinkels DW. Iron uptake by ZIP8 and ZIP14 in human proximal tubular epithelian cells. Biometals. 2019;32:211-26. doi:10.1007/s10534-019-00183-7.
8. Хроническая сердечная недостаточность. Клинические рекомендации 2020. Российский кардиологический журнал. 2020;25(11):4083. doi:10.15829/1560-4071-2020-4083.
9. Макарова Н. А., Захаров Ю. М. Взаимосвязь нарушений выделительной функции почек и уровня сывороточного эритропоэтина при хронической сердечной недостаточности. Клиническая нефрология. 2015;1:43-7.
10. WHO guideline on use of ferritin concentrations to assess iron status in individuals and populations. Geneva: World Health Organization, 2020. p. 62. ISBN 972-92-4-000012-4.
11. Cтуклов Н. И. Дефицит железа и анемия у больных хронической сердечной недостаточностью. Рациональная фармакотерапия в кардиологии. 2017;13(5):651-60. doi:10.20996/1819-6446-2017-13-5-651-660.
12. Restrepo-Gallego M, Diaz LE, Rondo PHC. Classic and emergent indicators for the assessment of human iron status. Crit Rev Food Sci Nutr. 2021;61(17):2827-40. doi:10.1080/10408398.2020.1787326.
13. Макарова Н. А. Адаптивные ответы системы крови при хронической сердечной недостаточности. Уральский медицинский журнал. 2017;11:96-102.
14. Павлов А. Д., Морщакова Е. Ф., Румянцев А. Г. Эритропоэз, эритропоэтин, железо. М.: ГЭОТАР-Медиа, 2011 c. 304. ISBN 978-5-9704-1986-1.
15. Макарова Н. А., Шапошник И. И. Прогепсидин в диагностике дефицита железа у больных с хронической сердечной недостаточностью и анемией. Клиническая лабораторная диагностика. 2013;1:42-4.
16. Wicinski M, Liczner G, Cadelski K, et al. Anemia of Chronic Diseases: Wider Diagnostics — Better Treatment? Nutrients. 2020;1784:1-17. doi:10.3390/nu12061784.
17. Weiss G, Ganz T, Goodnough LT. Anemia of inflammation. Blood. 2019;133(1):40-50. doi:10.1182/blood-2018-06-856500.
18. Арутюнов Г. П. Морфофункциональные изменения кишечника как причина нарушений нутритивного статуса у пациентов с хронической сердечной недостаточностью. В кн.: Хроническая сердечная недостаточность. М.: ГЭОТАР-Медиа. 2010:166-99. ISBN 978-5-9704-1472-9.
19. Masajtis-Zagajewska A, Nowicki M. Effect of atorvastatin on iron metabolism regulation in patients with chronic kidney disease — a randomized double blind crossover study. Ren Fail. 2018;40(1):701-10. doi:10.1080/0886022X.2018.1535983.
Об авторе
Н. А. МакароваРоссия
Доктор медицинских наук, доцент, профессор кафедры пропедевтики внутренних болезней.
Челябинск
Конфликт интересов:
Конфликт интересов не заявляется
Дополнительные файлы
Рецензия
Для цитирования:
Макарова Н.А. Проблемные аспекты компенсации дефицита железа при хронической сердечной недостаточности. Российский кардиологический журнал. 2023;28(2):5103. https://doi.org/10.15829/1560-4071-2023-5103
For citation:
Makarova N.A. Problematic aspects of iron deficiency compensation in heart failure. Russian Journal of Cardiology. 2023;28(2):5103. (In Russ.) https://doi.org/10.15829/1560-4071-2023-5103
JATS XML

















































