Перейти к:
Клиническая эффективность персонализированной программы физических тренировок в реабилитации пациентов с фибрилляцией предсердий после операции радиочастотной аблации
https://doi.org/10.15829/1560-4071-2022-5098
Аннотация
Цель. Изучение клинической эффективности и безопасности персонализированной программы физических тренировок (ФТ) в реабилитации пациентов с пароксизмальной формой фибрилляции предсердий (ФП) после первичной радиочастотной аблации (РЧА) устьев легочных вен.
Материал и методы. Пациенты (n=48) с пароксизмальной формой ФП, перенесшие РЧА, были рандомизированы в две группы: основную (n=24) — с вовлечением в программу ФТ на фоне стандартной терапии (группа “ФТ”), и конт рольную (n=24) — с приемом стандартной терапии (группа “К”). Программа ФТ включала комплексы лечебной гимнастики с расчетом энерготрат каждого упражнения и в целом комплекса, степ-тренировку и дозированную ходьбу. Ее продолжительность составляла 6 мес., наблюдение в исследовании — 12 мес. Со всеми пациентами в исследовании проводилась образовательная индивидуальная беседа.
Результаты. Через 6 мес. ФТ по данным велоэргометрической пробы выросли длительность (на 18,6%, р<0,001) и мощность (на 24,8%, р<0,01) нагрузки при отсутствии их динамики в группе “К”. Позитивное последействие ФТ на эти параметры сохранялось и после завершения курса ФТ. Размер левого предсердия и конечно-диастолический размер левого желудочка оставались стабильными на фоне ФТ и достоверно увеличились в группе “К”. В отличие от группы “К” у тренировавшихся пациентов через 6 мес. достоверно уменьшились индекс массы тела на 2,8% (р<0,05), систолическое артериальное давление на 2,1% (р<0,05), частота сердечных сокращений на 12,1% (р<0,05), концентрации холестерина (ХС) липопротеидов низкой плотности на 18,8% (р<0,001), высокочувствительного С-реактивного белка на 22,9% (р<0,05), N-концевого промозгового натрийуретического пептида на 28,2% (p<0,05), альдостерона на 41,5% (р<0,001) и ангиотензина II на 41,3% (р<0,05), повысились уровень ХС липопротеидов высокой плотности на 20,6% (р<0,05) и уровень физической активности на 23,8% (p=0,001). В то же время в обеих группах отмечено достоверное снижение концентрации фибриногена и трансформирующего фактора роста-β1. Через 6 мес. в группе “ФТ” против группы “К” отмечалось снижение количества регистрируемых наджелудочковых экстрасистол (р<0,01), эпизодов наджелудочковой тахиаритмии (р<0,05), включая рецидивы ФП (р<0,05).
Заключение. Вовлечение пациентов с ФП после катетерной РЧА в программу кардиореабилитации, основу которой составляют аэробные ФТ умеренной интенсивности, способствует повышению переносимости физических нагрузок, улучшает параметры кардиальной функции, корректирует атеротромбогенные факторы и уменьшает вероятность возврата аритмий, включая ФП.
Ключевые слова
Для цитирования:
Бубнова М.Г., Аронов Д.М., Махинова М.М., Давтян К.В. Клиническая эффективность персонализированной программы физических тренировок в реабилитации пациентов с фибрилляцией предсердий после операции радиочастотной аблации. Российский кардиологический журнал. 2022;27(7):5098. https://doi.org/10.15829/1560-4071-2022-5098
For citation:
Bubnova M.G., Aronov D.M., Makhinova M.M., Davtyan K.V. Clinical efficacy of a personalized exercise program in the rehabilitation of patients with atrial fibrillation after radiofrequency ablation. Russian Journal of Cardiology. 2022;27(7):5098. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5098
Фибрилляция предсердий (ФП) — самая встречающаяся аритмия (примерно у 3% взрослого населения), распространенность которой увеличивается с возрастом и/или при сопутствующих заболеваниях [1]. Современное медикаментозное лечение ФП не всегда дает положительные результаты в удержании ритма сердца. После получения доказательств значимости фокусной высокочастотной электрической активности в муфтах легочных вен (ЛВ) в инициации ФП открылись новые возможности для устранения триггерного механизма аритмии посредством радиочастотного воздействия переменным электрическим током высокой частоты — катетерной радиочастотной аблации (РЧА) или введения сжиженного холодного агента в криобаллоне — криобаллонной аблации [2].
Несмотря на доказанную эффективность интервенций, проблема рецидива ФП остается: в течение года — у 25-50% пациентов (чаще у 47-74% пациентов при структурных поражениях сердца) и при трехлетнем наблюдении — у 56% больных [3][4]. Методики катетерной аблации подразумевают воздействие на большой объем ткани левого предсердия (ЛП), что сопряжено с заметным механическим повреждением миокарда (в т.ч. здорового): повышение уровня тропонина I встречается у 68-93% больных [5]. После катетерной аблации патологические процессы, протекающие при ФП (асептическое воспаление, оксидативный стресс, гиперактивность ренин-ангиотензин альдостероновой системы (РААС), апоптоз, фиброз, дисбаланс функций вегетативной нервной системы), нередко сохраняются [6, 7]. Это может поддерживать и даже усугублять электрическую и структурную перестройку ЛП, увеличивая вероятность возврата ФП.
ФП — мультифакторное заболевание, сочетающееся с разными кардиоваскулярными факторами риска, отрицательно влияющими на удержание синусового ритма через структурное и электрическое моделирование предсердий [1]. Поэтому их модификацию следует рассматривать в качестве актуальной стратегии первичной профилактики ФП и её рецидивов [8].
Многие проблемы пациентов с ФП можно решать через мультидисциплинарные программы кардиореабилитации (КР). Такие программы нуждаются в активной разработке, особенно, физический аспект КР. Сложность составления программ физической реабилитации при ФП связана с методологическими проблемами. Так, доказана J(U)-образная зависимость между уровнем физической активности (ФА) и риском развития ФП, в т.ч. у практически здоровых больных с “изолированной” ФП [9][10]. Число рандомизированных клинических исследований, оценивающих эффекты КР при ФП, ограничено. До настоящего времени не сформировано консолидированного мнения об оптимальных дозах и формах физических тренировок (ФТ) при ФП, не изучена их эффективность и безопасность.
Цель исследования — изучить клиническую эффективность и безопасность разработанной программы физической реабилитации на основе физических упражнений разной энергетической стоимости и дозированной ходьбы у пациентов с пароксизмальной формой ФП после первичной катетерной РЧА устьев ЛВ.
Материал и методы
В рандомизированное клиническое исследование включались пациенты (n=48) с пароксизмальной формой ФП, которым выполнялось плановая изоляция ЛВ методом РЧА. Критерии включения: мужчины в возрасте от 30 до 70 лет, наличие артериальной гипертонии 1 или 2 степени, плановая РЧА устьев ЛВ в связи с пароксизмальной формой ФП, подписание письменного информированного согласия до
включения в исследование. Критерии исключения: уровень артериального давления (АД) ≥180/110 мм рт.ст.; наличие пороков сердца; первые 6 мес. после инсульта, инфаркта миокарда; стенокардия напряжения IV функционального класса; тяжелые сопутствующие заболевания; риск по шкалам CHA2DS2-VASc и HAS-BLED >3 баллов; осложнения после процедуры РЧА; фракция выброса левого желудочка (ЛЖ) <40%; индекс массы тела (ИМТ) ≥40 кг/м2; общеизвестные противопоказания для физической реабилитации. Исследование выполнялось в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации, протокол его был одобрен Этическим комитетом. Исследование зарегистрировано в международной базе клинических исследований https://clinicaltrials.gov/ (NCT04511520).
После включения в исследования пациенты были рандомизированы (с использованием метода конвертов) в две группы: I группа контроля “К” (n=24), получавшая стандартную терапию; II группа “ФТ” (n=24) — участвующая в программе физической реабилитации и получавшая стандартную терапию. Продолжительность программы ФТ — 6 мес., общая продолжительность наблюдения в исследовании — 12 мес. В исследовании было 5 визитов: визит 0 — до РЧА, визит 1 — первый день после РЧА, рандомизация; визит 2 — через 1 мес., визит 3 — через 3 мес., визит 4 — через 6 мес., окончание курса ФТ; визит 5 — через 12 мес. (наблюдение от 6-го до 12-го мес. с целью оценки последействия ФТ).
Все пациенты в исследовании после операции РЧА принимали антикоагулянты (минимум 3 мес.) и антиаритмические препараты в течение первых 3-х мес. В дальнейшем при отсутствии частых и/или значимых (с выраженной симптоматикой) пароксизмов ФП антиаритмические препараты отменялись.
Методы вмешательства:
- беседа о факторах развития ФП, необходимости постоянного приема лекарственных препаратов, соблюдении принципов здорового питания и профилактики гиподинамии;
- выполнение РЧА изоляцией устьев ЛВ по классической методике с венозным доступом по методике Сельдингера и доступом в ЛП — транссептальной пункцией с применением внутрисердечного эхокардиографического датчика “AcuNav” (Siemens). Антральная изоляция устьев ЛВ выполнялась катетером с открытым ирригационным контуром при параметрах аблации: 440 С, 35 Вт, скорость орошения 17 мл/мин, продолжительность аппликации в каждой точке 40 с. Группы пациентов не различались по параметрам РЧА (продолжительности и мощности радиочастотного воздействия, величине сопротивления в ходе аблации).
Программа физической реабилитации состояла из 2-х этапов: I этап — стационарная КР и II этап — амбулаторная КР, переходящая в самостоятельные упражнения в домашних условиях. Выделялось 3 периода ФТ: подготовительный (3 занятия до выписки из стационара и до 25 занятий после выписки из стационара); основной (до 40 занятий) и поддерживающий (неограниченное количество занятий).
Принципы ФТ: раннее начало (на следующий день после РЧА), постепенное увеличение объёма и интенсивности ФТ, персонализированный подход к подбору физических упражнений в составе комплекса лечебной физической культуры (ЛФК) с расчетом энерготрат каждого упражнения, которые суммировались при составлении базового комплекса ЛФК для конкретного пациента с учетом его энерготрат, и функциональный класс, определяемый по результатам нагрузочных тестов.
Программа ФТ включала: методику “лечение положением”; упражнения для глаз (2 комплекса); дыхательную гимнастику с глубоким диафрагмальным дыханием и воздействием на моторно-висцеральные рефлексы сегментов спинного мозга на уровне C3-C4 и Т1-Т8, иннервирующих сердце (3 комплекса); комплексы ЛФК с расчетом энерготрат каждого упражнения (6 комплексов упражнений); комбинированные статико-динамические упражнения (2 комплекса); степ-тренировку и дозированную ходьбу (Патент на изобретение № 2700675 от 18.09.2019). Продолжительность одной ФТ — 45 мин.
Методы исследования: сбор анамнеза, физикальный осмотр; регистрация электрокардиограммы (ЭКГ) в 12 стандартных отведениях (аппарат фирмы “Shiller”, Германия); суточное мониторирование ЭКГ по Холтеру (ХМ-ЭКГ) на трехканальном аппарате фирмы “Astrocard” (Медитек, Россия) с регистрацией пароксизмов ФП длительностью >30 сек; эхокардиография (ЭхоКГ) по стандартной методике на аппарате фирмы “Agilent” (США); тест с 6-минутной ходьбой (ТШХ), выполняемый в раннем послеоперационном периоде РЧА, и велоэргометрическая нагрузочная (ВЭМ) проба на аппарате фирмы “General Electric” (США) с началом выполнения через 1 мес. после РЧА.
Биохимическое обследование с определением уровней — липидов (ммоль/л): общего холестерина (ХС), триглицеридов и ХС липопротеидов высокой плотности (ЛВП; аппарат “Cobas 501” фирмы “Roche”, Швейцария) с вычислением ХС липопротеидов низкой плотности (ЛНП) по формуле Friedwald WT, et al. (1972); — фибриногена (г/л) на коагулографе ACL (“Instrumentation Laboratory”, Италия); — высокочувствительного С-реактивного белка (вчСРБ, мг/л) высокочувствительным методом иммунонефелометрии (автоанализатор “Behring Nеphelometer Analyser”, Германия); — N-концевого промозгового натрийуретического пептида (NT-proBNP, пг/ мл) методом электрохемилюминесцентного иммуноанализа (аппарат “Cobas 501” фирмы “Roche”, Швейцария); остеопонтина (нг/мл) и трансформирующего фактора роста (ТФР-β1, нг/мл) на микропланшетном фотометре “Tecansunrise” (Австрия), коммерческие наборы для иммунофлюоресцентного анализа фирмы “Life Technologies-Novex”; альдостерона (пг/мл) методом радиоиммунологического анализа; ангиотензина II (АТII) (пг/мл) иммуноферментным методом наборами “Human Angiotensin II ELISA Kit” (фирма “Assay Pro LLC”, США) с определением абсорбции на спектрофотометре при длине волны 450 нм и последующим определением концентрации АТII по калибровочной кривой.
Диагностическое тестирование: — опросник повседневной ФА (ОДА23+), разработанный в ФГБУ “НМИЦ ТПМ” Минздрава России (Патент на изобретение № 2485895 от 27.06.2013): итоговая сумма <62 баллов — низкий уровень ФА, 62-84 балла — средний уровень ФА и >84 баллов — высокий уровень ФА [11]; — дневник пациента для контроля нарушений ритма сердца, способа их купирования, учета выполнения ФТ дома и оценки нежелательных явлений.
Статистический анализ проводился с помощью пакета прикладных статистических программ SAS (StatisticalAnalysisSystem, США) версия 6.12 — с применением параметрических и непараметрических алгоритмов вариационной статистики, учитывающих тип и шкалу измерений каждого изучаемого показателя. Для бинарных показателей достоверность (Р) различий частоты выявления некоторого фактора в двух сравниваемых группах система SAS оценивала по t-критерию Стьюдента с использованием арксинус-преобразования Фишера. Значимость внутригрупповой динамики (“дельты”) количественных показателей к последующим срокам регистрации вычислялась в соответствии с параметрическим t-критерием Стьюдента для парных измерений и с помощью непараметрического знаково-рангового критерия Вилкоксона. Различия, при которых р<0,05, считались статистически значимыми.
Результаты
Пациенты двух групп исходно достоверно не различались по основным клинико-функциональным характеристикам (табл. 1). Варфарин получали в группе “К” 33,3% и в группе “ФТ” — 25%, остальные принимали прямые пероральные антикоагулянты. Большинство пациентов в течение первых 3 мес. принимали соталол (группа “К” — 20,8% и группа “ФТ” — 25,0%) и бета-адреноблокаторы (33,3% и 41,7%, соответственно). К 6-му и 12-му мес. антиаритмические препараты принимали в группе “К” — 13,1% и 8,7%, соответственно, и в группе “ФТ” — 8,3% (р<0,05 к группе “К”) и 4,2% (р<0,05 к группе “К”), соответственно.
Динамика параметров физической работоспособности. Различий в показателях физической работоспособности (ФРС) исходно по данным ТШХ между
пациентами двух групп обнаружено не было (табл. 2).
Таблица 1
Исходная характеристика пациентов, включенных в исследование
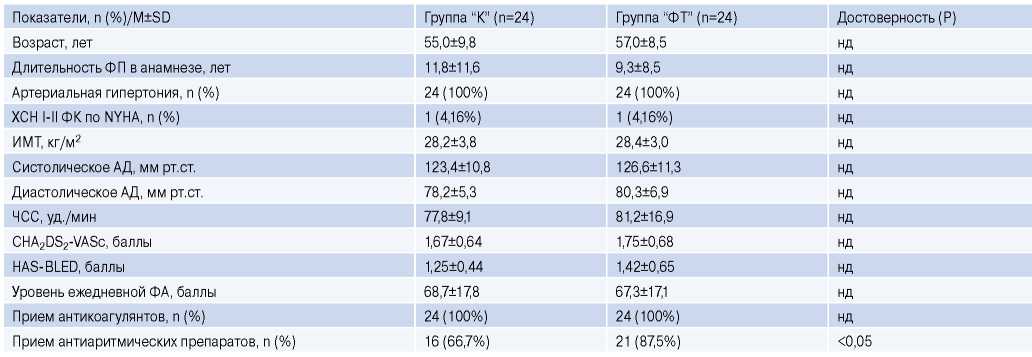
Сокращения: АД — артериальное давление, ИМТ — индекс массы тела, ФА — физическая активность, ФК — функциональный класс, ФП — фибрилляция предсердий, ФТ — физические тренировки, ХСН — хроническая сердечная недостаточность, ЧСС — частота сердечных сокращений, Р — достоверность.
Таблица 2
Показатели ФРС по данным ТШХ в течение 6 мес. ФТ и наблюдения
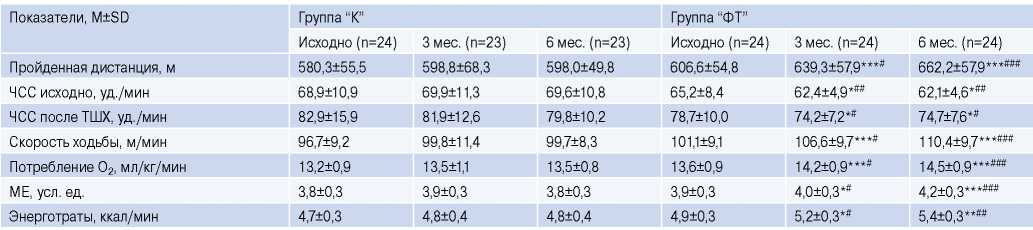
Примечание: * — р<0,05, ** — р<0,01, *** — р<0,001 — достоверность различий внутри групп к визиту “Исходно”; # — р<0,05, ## — р<0,01, ### — р<0,001 — достоверность различия между группами на визитах.
Сокращения: МЕ — метаболические единицы, ТШХ — тест 6-ти минутной ходьбы, ФТ — физические тренировки, ЧСС — частота сердечных сокращений.
По данным ТШХ у тренировавшихся пациентов отмечалось достоверное удлинение пройденной дистанции через 3 мес. (на 5,4%, р<0,01) и 6 мес. (на 9,2%, р<0,01), рост расчетного показателя потребления О2 (на 4,5%, р<0,001 и на 6,6%, р<0,001, соответственно), метаболических единиц (на 2,6%, р<0,05 и на 7,7%, р<0,001) и энерготрат в мин (на 6,1%, р<0,05 и на 10,2%, р<0,01) (табл. 2). На фоне ФТ снизилась частота сердечных сокращений (ЧСС) как в покое (перед ТШХ), так и после теста: к 3-му мес. на 4,3% (р<0,05) и 5,7% (р<0,05), соответственно, к 6-му мес. — на 4,7% (р<0,05) и 5,1% (р<0,05). В группе “К” показатели ФРС при ТШХ не изменялись (табл. 2).
К 1-му мес. после РЧА пациенты, включенные в исследование, имели среднюю толерантность к физической нагрузке по данным ВЭМ-пробы (табл. 3). Через 6 мес. длительность и мощность выполняемой нагрузки в группе “ФТ” увеличились на 18,6% (р<0,001) и на 24,8% (р<0,01), соответственно, как и общий объем выполненной физической работы (на 33,1%, р<0,05). В группе “К” эти параметры не изменялись.
После завершения курса ФТ (период с 7 мес. по 12 мес.) его позитивное последействие на показатели ФРС сохранялось: показатели длительности и мощности нагрузки по данным ВЭМ-пробы превышали исходные значения на 8,8% (р<0,05) и на 20,9% (р<0,05), соответственно (табл. 3).
Таблица 3
Показатели ФРС по данным ВЭМ-пробы в течение 12 мес. наблюдения
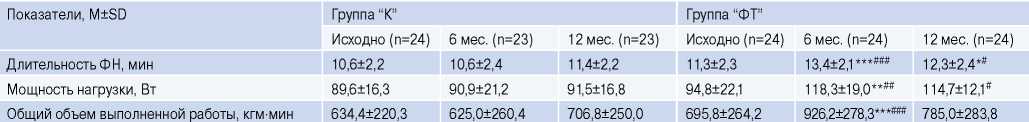
Примечание: * — р<0,05, ** — р<0,01, *** — р<0,001 — достоверность различий внутри групп к визиту “Исходно”; # — р<0,05, ## — р<0,01, ### — р<0,001 — достоверность различия между группами на визитах.
Сокращения: ФН — физическая нагрузка, ФТ — физические тренировки.
Таблица 4
Показатели ЭхоКГ в течение 12 мес. наблюдения

Примечание: * — р<0,05 — достоверность различий внутри групп к визиту “Исходно”; # — р<0,05 — достоверность различия между группами на визитах.
Сокращения: КДР — конечно-диастолический размер, КСР — конечно-систолический размер, ЛЖ — левый желудочек, ЛП — левое предсердие, ПЖ — правый желудочек, ПП — правое предсердие, ФВ — фракция выброса, ФТ — физические тренировки.
Динамика показателей ЭхоКГ. Пациенты обеих групп имели сохраненную фракцию выброса ЛЖ, хотя в группе “ФТ” она была несколько выше, чем в группе “К” как исходно (на 6,5%, р<0,05), так и через 12 мес. (на 10,1%, р<0,05) (табл. 4). Параметры ЭхоКГ оставались стабильными и в период ФТ, и их прекращения (вплоть до 12 мес.). Напротив, в группе “К” через 6 мес. произошло небольшое, но достоверное (р<0,05 для всех параметров) увеличение размера ЛП и конечно-диастолического размера ЛЖ, сохраняемое до 12 мес. наблюдения (табл. 4). В результате к 12-му мес. у ранее тренировавшихся пациентов при сравнении с группой “К” достоверно меньшими были значения медиально-латерального размера ЛП, конечно-систолического размера ЛЖ, верхне-нижнего размера правого предсердия и передне-заднего размера правого желудочка в диастолу.
Динамика атеротромбогенных факторов риска и маркеров воспаления, кардиальной дисфункции и фиброза. В исследовании все пациенты страдали артериальной гипертонией, но она была в стадии компенсации (табл. 1). В группе “К” через 6 и 12 мес. средние уровни офисного АД и ИМТ не изменились. Напротив, в группе “ФТ” через 6 мес. произошло достоверное снижение систолического АД (на 2,1%, р<0,05) и ИМТ (на 2,8%, р<0,05). В то же время после прекращения регулярных ФТ уровни этих параметров вернулись к первоначальным значениям.
Исходный уровень ежедневной ФА (по данным опросника ОДА23+) у пациентов двух групп соответствовал среднему значению (табл. 1). Однако в группе “К” уже к 3-му мес. он снижался (на 3,9%, р<0,05), тогда как в группе “ФТ” повышался и к 3-му мес. (на 8,9%, p=0,024), и к 6-му мес. (на 23,8%, p=0,001). После прекращения участия пациентов в программе ФТ произошел возврат (к 12-му мес.) уровня ФА к исходной величине.
Липидный спектр крови исходно был сопоставим в обеих группах пациентов и его нарушения характеризовались как гиперхолестеринемия (табл. 5). Под влиянием регулярных шестимесячных ФТ уровни общего ХС и ХС ЛНП снижались (на 11,2%, р<0,001 и на 18,8%, р<0,001, соответственно) при повышении концентрации ХС ЛВП (на 20,6%, р<0,05). Прекращение участия пациентов в программе ФТ привело к нивелированию позитивных изменений в липидном спектре крови (уровни липидов и липопротеидов крови вернулись к исходной величине). В группе “К” уровни липидов не изменялись.
Исходно у пациентов обеих групп концентрация фибриногена была повышена. После РЧА к 6-му мес. она достоверно снижалась и в группе “ФТ” (на 11,1%, p<0,05) и в группе “К” (на 11,4%, р<0,01) с нивелированием эффекта к 12-му мес. наблюдения.
У пациентов с ФП исходно регистрировался повышенный уровень вчСРБ (маркер воспаления превышал 3,0 мг/л) (табл. 5). Метаанализ Yo C-H, et al. (2014) продемонстрировал, что концентрация вчСРБ в отрезной точке 3 мг/л является предиктором рецидива ФП в раннем периоде РЧА, а 1,9 мг/л — отдаленном сроке РЧА [12]. Через 6 мес. на фоне ФТ уровень вчСРБ благоприятно снижался (на 22,9%, р<0,05) в отличие от группы “К”. После прекращения регулярных ФТ содержание вчСРБ возросло до исходного значения, а в группе “К” даже достоверно увеличилось, превышая первоначальный уровень на 35,4% (р<0,05).
Уровни NT-proBNP (маркер кардиальной дисфункции) исходно были сопоставимы в группах (табл. 5). Через 6 мес. содержание NT-proBNP снижалось на фоне ФТ (на 28,2%, p<0,05), но не в группе “К”. К 12 мес. у переставших тренироваться пациентов этот параметр вернулся к исходному значению, а у пациентов группы “К” значимо увеличился (на 26,7%, р<0,05), превысив первоначальную концентрацию.
Содержание альдостерона к 6-му мес. снизилось только на фоне ФТ (на 41,5%, р<0,001) с сохранением этого эффекта до 12 мес. (на 35,2%, р<0,01) (табл. 5). В группе “К” через 6 и 12 мес. концентрация альдостерона не изменялась. Уровни АТII у пациентов с ФП, перенесших РЧА, определяли исходно и через 6 мес. (табл. 5). Снижение этого показателя произошло только после систематических ФТ (на 41,3, р<0,05) при отсутствии его динамики в группе “К”.
Таблица 5
Уровни липидов и биохимических параметров крови в течение 12 мес. наблюдения
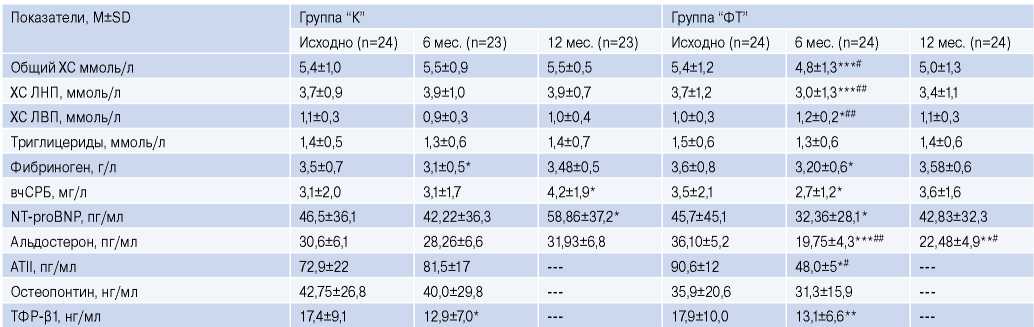
Примечание: * — р<0,05, ** — р<0,01, *** — р<0,001 — достоверность различий внутри групп к визиту “Исходно”; # — р<0,05, ## — р<0,01 — достоверность различия между группами на визитах, --- — показатель не определяли.
Сокращения: АТII — ангиотензин II, вчСРБ — высокочувствительный С-реактивный белок, ЛВП — липопротеиды высокой плотности, ЛНП — липопротеиды низкой плотности, ТФР-β1 — трансформирующий фактор роста-β1, ХС — холестерин, ФТ — физические тренировки, NT-proBNP — N-концевой промозговой натрийуретический пептид.
Важную роль в процессах структурного ремоделирования и развития фиброза в сердце играет повышенная выработка остепонтина и ТФР-β1. Уровень остеопонтина в крови оставался стабильным в течение 12 мес. наблюдения в двух группах. Напротив, концентрация ТФР-β1 через 6 мес. сопоставимо снижалась как в группе “ФТ” (на 26,9%, р<0,01), так и в группе “К” (на 23,6%, р<0,05).
Динамика клинического состояния. Клиническое течение ФП у пациентов после процедуры РЧА оценивалось разными методами: посредством дневника пациента, одномоментной регистрации ЭКГ и ХМ-ЭКГ. По данным дневника пациента симптомные рецидивы нарушений ритма сердца в группе “К” фиксировали через 1 мес. у 20,8% пациентов, 3 мес. — у 12,5%, 6 мес. — у 8,3% и 12 мес. — у 4,2%. В группе “ФТ” через 1 мес. после РЧА на симптомные рецидивы нарушений ритма сердца указывало 12,5% пациентов, через 3 и 6 мес. ни один из пациентов, а после прекращения ФТ (в период с 7 по 12 мес.) 8,3% пациентов.
По данным ХМ-ЭКГ исходно ЧСС максимальная и ЧСС средняя за сутки в группе “К” (через 3 дня после РЧА) были сопоставимы с таковыми в группе “ФТ” (табл. 6). В течение всего 12-мес. наблюдения ЧСС максимальная и ЧСС средняя не изменились в группе “К”, но достоверно снижалась на фоне систематических ФТ.
Исходно (через 3 дня после РЧА) количество наджелудочковых экстрасистол (НЖЭ) и эпизодов наджелудочковой тахиаритмии (НЖТ), регистрируемых по ХМ-ЭКГ, было сопоставимо в группах перенесших РЧА (табл. 6). Через 6 мес. систематических ФТ количество регистрируемых НЖЭ достоверно уменьшилось в 9,3 раза (р<0,001) с сохранением этого позитивного эффекта к 12 мес., тогда как в группе “К” оно достоверно не изменилось за весь период наблюдения.
Таблица 6
Динамика показателей ХМ-ЭКГ в течение 12 мес. наблюдения
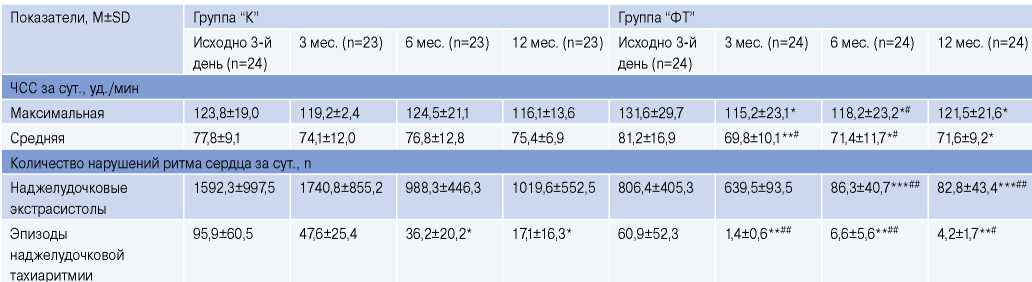
Примечание: * — р<0,05, ** — р<0,01, *** — р<0,001 — достоверность различий внутри групп к визиту “Исходно-3 дня”; # — р<0,05, ## — р<0,01 — достоверность различия между группами на визитах.
Сокращения: ЧСС — частота сердечных сокращений, ФТ — физические тренировки.
Количество эпизодов НЖТ, включая рецидивы ФП, после РЧА достоверно уменьшилось (от исходного) как в группе “К” (к 6-му мес. в 2,6 раза, р<0,05, и к 12-му мес. в 5,6 раза, р<0,05), так и в группе “ФТ” уже к 3-му мес. (в 43,5 раза, р<0,01) с сохранением подобного позитивного эффекта до 12 мес. после вмешательства. Следует отметить, что число регистрируемых эпизодов НЖТ в период от 3 до 12 мес. на фоне систематических ФТ было достоверно меньше, чем в группе “К”.
Пароксизмы ФП через 3 дня после одной катетерной изоляции устьев ЛВ (по данным ХМ-ЭКГ) сохранялись у 54,2% пациентов из группы “К” и у 54,1% пациентов из группы “ФТ” (p>0,05 между группами). Эффективность первичной РЧА — отсутствие рецидивов ФП — регистрировалась через 3 мес. в группе “К” у 69,6% пациентов и в группе “ФТ” — у 91,7% пациентов (р<0,01), через 6 мес. у большего числа пациентов — у 82,6% и у 95,7%, соответственно (р<0,01). К 12 мес. рецидивы ФП регистрировались у 37,3% пациентов из группы “К” и у 26,7% пациентов из группы “ФТ” (р<0,05; период с 7-го по 12-й мес. был без ФТ).
Обсуждение
В связи с ростом количества инвазивных процедур, применяемых для контроля ритма сердца, вовлечение пациентов с ФП в программы КР стало наиболее актуальным. В представленном исследовании изучалась клиническая эффективность и безопасность разработанной оригинальной 6-мес. программы физической реабилитации, особенностью которой явилось ее раннее начало (на следующий день после РЧА), применение персонифицированного подхода к подбору физических упражнений (и в целом тренировочного комплекса) с учетом расчета энерготрат пациента на основе результатов нагрузочных тестов (в раннем послеоперационном периоде в качестве “щадящего” метода определения порога переносимости нагрузки после РЧА использовался ТШХ, через 1 мес. после РЧА выполнялась ВЭМ-проба) и переходом на ФТ умеренной интенсивности (в виде степнагрузки и дозированной ходьбы).
Программа физической реабилитации пациентов с ФП после РЧА способствовала росту параметров ФРС, что подтверждали результаты ТШХ и ВЭМпробы: через 6 мес. после ТШХ пройденная дистанция увеличилась на 9,2% (р<0,01) и МЕ на 7,7% (р<0,001); при ВЭМ-пробе длительность нагрузки возросла на 18,6% (р<0,001) и ее мощность на 24,8% (р<0,01) в отличие от группы сравнения (n=24), в которой оценивался “чистый эффект РЧА” (у них параметры ФРС не изменились). Положительное влияние регулярных ФТ на показатели ФРС сохранялось и после их прекращения.
В исследовании Osbak PS, et al. (2012) у больных (n=49) с ФП после 12-мес. курса ФТ (на велотренажере с интенсивностью 70% от максимальной мощности в течение 30 мин, в виде степ-нагрузки и бега с напряжением 14-16 баллов по шкале Борга) мощность нагрузки при ВЭМ-пробе возрастала на 8,8% (р<0,001) и ЧСС в покое уменьшилась на 9,1% (р=0,049) [13]. В нашем исследовании после 6-мес. курса ФТ ЧСС покоя снизилась на 12,1% (или на -9,8 уд./мин, р<0,01). Известно, что улучшение кардиореспираторных параметров (рост ФРС и МЕ) под воздействием регулярных ФТ нормализует баланс между парасимпатическим и симпатическим отделами вегетативной нервной системы, что важно для регуляции работы сердца, снижения частоты сокращения желудочков и предупреждения появления новых эпизодов ФП.
По данным метаанализа Zhu W, et al. (2016), включавшего 6 исследований, 205094 человек и 15919 эпизодов ФП, на каждую единицу увеличения МЕ риск развития ФП снижался на 9% (р=0,05) [14]. Younis A, et al. (2018) у больных (n=292) с ФП подтвердили, что повышение ФРС (МЕ на >5%) на фоне 6-мес. программы КР приводило к достоверному снижению (на 27%, р=0,04) риска развития всех случаев смерти/госпитализаций по кардиологическим причинам [15].
С ростом параметров ФРС связывают и лучший контроль основных факторов риска у пациентов с ФП при разной стратегии контроля ритма сердца в реабилитационных программах [16]. Это доказывают и результаты нашего исследования: у тренировавшихся пациентов повседневная ФА увеличивалась (против ее снижения в группе “К”), а систолическое АД и ИМТ уменьшались (в группе “К” они не изменились). Повышение ФА (до умеренного уровня) в повседневной жизни пациента после РЧА имеет значение как для снижения вероятности появления ФП, так и для профилактики тромбоэмболических осложнений [9][16][17]. В проекте EORP-AF (EURObservational Research Programme Pilot Survey on Atrial Fibrillation; 2442 пациента с пароксизмальной ФП, год наблюдения) наименьший индекс CHA2DS2-VASc у пациентов с ФП был именно при высоком уровне повседневной ФА [17].
Стабильность размеров ЛП и ЛЖ на фоне регулярных ФТ рассматривается как благоприятный факт и указывает на сдерживание процессов структурного ремоделирования сердца при ФП. Это увеличивает вероятность удержания синусового ритма, что подтвердили и другие исследователи, доказавшие прямую связь уменьшения размера ЛП с успешным поддержанием синусового ритма сердца после РЧА [18]. Напротив, в группе “К” размеры ЛП и конечнодиастолический размер ЛЖ достоверно увеличились в период 12-мес. наблюдения.
На фоне ФТ достоверно снизились уровни общего ХС (на 11,2%, р<0,001) за счет ХС ЛНП (на 18,8%, р<0,001), и значимо повысилась концентрация ХС ЛВП (на 20,6%, р<0,05), чего не наблюдалось в группе “К”. Это согласуется с результатами других исследований, изучавших динамику липидов крови под воздействием ФТ у разных категорий кардиологических пациентов. Однако повышение ХС ЛВП у пациентов с ФП вызывает особый интерес, поскольку его высокая концентрация может быть связана с низким риском развития ФП, особенно, у женщин ≥50 лет, в первую очередь через возможность частиц ЛВП подавлять асептическое воспаление и оксидативный стресс [19][20].
Согласно данным многочисленных исследований, в основе возникновения ФП лежат процессы воспаления стенки ЛП и ЛВ, которые усиливаются при РЧА из-за механического воздействия и в ответ на временную гипоксию [21]. Вследствие ФТ у пациентов в исследовании после РЧА отмечалось снижение исходно повышенного уровня маркера воспаления — вчСРБ (на 22,9%, р<0,05) в противоположность его роста в группе “К”.
Положительным в работе явилось снижение после РЧА у пациентов обеих групп концентрации фибриногена (причем в равной степени). Это важно как для предупреждения развития инсульта у данной категории пациентов, так и для предотвращения процессов ремоделирования ЛП. Известно, что при ФП имеются определенные особенности гемодинамики, например, турбулентность крови в ЛП, и, в частности, в ушке ЛП, что увеличивает риск развития осложнений, связанных с тромбообразованием. Spronk HMH, et al. (2017) установили, что состояние гиперкоагуляции, в первую очередь, тромбин, за счет стимуляции протеаза-активируемых рецепторов провоцирует профибротический и провоспалительный ответы фибробластов ЛП у человека [22].
Нарушенная гемодинамика ЛП при ФП содействует его расширению и ремоделированию. В ответ на эти процессы активируется выработка NTproBNP и активность РААС с гиперсекрецией АТII и альдостерона. Это, в свою очередь, запускает процессы фиброза — избыточного образования соединительной ткани в ЛП [1]. По данным исследования Carballo D, et al. (2018) у пациентов с рецидивами ФП повышение уровня NT-proBNP с первых дней после РЧА ассоциируется с увеличением вероятности возврата ФП [23]. Также установлено, что повышенный уровень NT-proBNP может сохраняться в течение 6 мес. после РЧА. Известно, что уровень NT-proBNP в крови — отражатель дисфункции предсердий, которая рассматривается в качестве одного из факторов формирования тромбоза при ФП [24].
В нашем исследовании только на фоне регулярных ФТ выявлялось достоверное снижение уровней NT-proBNP (на 28,2%, p<0,05), альдостерона (на 41,5%, р<0,001) и АТII (на 41,3%, р<0,05). Снижение параметров РААС на фоне ФТ рассматривается как благоприятный фактор, поскольку по данным литературы у пациентов с ФП в тканях ЛП повышена экспрессия I типа рецепторов к АТII и уровень ангиотензинпревращающего фермента [25]. У пациентов группы “К”, напротив, произошел заметный рост NT-proBNP (на 26,7%, р<0,05) на фоне отсутствия снижения уровней альдостерона и АТII.
У пациентов, перенесших РЧА в связи с ФП, исследовались маркеры миофибробластной генерации и фиброза сердца — уровни ТФР-β1 и остеопонтина. Динамики уровня остеопонтина в крови в обеих группах обнаружено не было, тогда как содержание ТФР-β1 заметно уменьшалось и на фоне ФТ (на 26,9%, р<0,01), и в группе “К” (на 23,6%, р<0,05).
Клинический эффект физической реабилитации (через 6 мес.) выражался в уменьшении количества регистрируемых постаблационных предсердных аритмий: НЖЭ (в 9,3 раза vs отсутствия динамики в группе “К”) и эпизодов НЖТ (в 9,2 раза vs 2,6 раз в группе “К”). Снижение эпизодов НЖТ в группе “ФТ” регистрировалось уже к 3-му мес. в отличие от группы “К”.
Установлено, что количество НЖЭ, выявляемых в первые 6 мес. после РЧА, можно рассматривать в качестве предиктора рецидива ФП в более поздние сроки: при ежедневной регистрации на 6 мес. после РЧА НЖЭ в количестве ≥142 риск позднего возврата ФП повышался в 2,84 раза (р=0,01) [26]. При этом наибольший риск возврата ФП наблюдался при регистрации ≥783 НЖЭ за сут. в течение “слепого периода” (первых 3 мес. после РЧА) [27]. Рецидивы ФП после РЧА у тренировавшихся больных регистрировалась в 3,8 раза реже через 3 мес. (у 8,3% пациентов vs 30,4% из группы “К”) и в 3,9 раза реже — через 6 мес. (только у 4,5% vs 17,4% пациентов из группы “К”).
Заключение
Участие пациентов с пароксизмальной формой ФП после перенесенной РЧА устьев ЛВ в 6-мес. программе физической реабилитации, которую отличает ранний старт (на 2-е сут. после операции), этапность процесса и персонализированный подход к выбору формы и содержания комплекса физических упражнений, приводит к росту параметров ФРС, улучшает клиническое течение послеоперационного периода и повышает эффективность операционного вмешательства в предупреждении возврата постаблационных нарушений ритма сердца (снижает количество НЖЭ, эпизодов НЖТ, включая пароксизмы ФП). Среди возможных патофизиологических механизмов действия ФТ у пациентов с ФП следует выделить их способность улучшать работу кардиореспираторной системы, корректировать основные кардиоваскулярные факторов риска, поддерживать сократительную способность сердца и, по-видимому, предупреждать структурное ремоделирование предсердий, снижать уровни биомаркеров патологических процессов (воспаления, фиброза, кардиальной дисфункции, атеро- и тромбообразования), ассоциированных с развитием и прогрессированием ФП.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Hindricks G, Potpara T, Dagres N, et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with EACTS. Eur Heart J. 2020;42:373-498. doi:10.1093/eurheartj/ehaa612.
2. Calkins H, Hindricks G, Cappato R, et al. 2017 HRS/EHRA/ECAS/APHRS/SOLAECE expert consensus statement on catheter and surgical ablation of atrial fibrillation: Executive summary. Europace. 2018;20:e1-e160. doi:10.1093/europace/eux274.
3. Haegeli LM, Calkins H. Catheter ablation of atrial fibrillation: an update. Eur. Heart J. 2014;35:2454-9. doi:10.1093/eurheartj/ehu291.
4. Bottoni N, Bertaglia E, Donateo P, et al. Long-term clinical outcome of patients who failed catheter ablation of atrial fibrillation. Europace. 2015;17:403-38. doi:10.1093/europace/euu229.
5. Reichlin T, Lockwood SJ, Conrad MJ, et al. Early release of high-sensitive cardiac troponin during complex catheter ablation for ventricular tachycardia and atrial fibrillation. J Interv Card Electrophysiol. 2016;47(1):69-74. doi:10.1007/s10840.016-0125-6.
6. Harada M, VanWagoner DR, Nattel S. Role of inflammation in atrial fibrillation pathophysiology and management. Circulation J. 2015;79(3):495-502. doi:10.1253/circj.CJ-15-0138.
7. Sohns C, Marrouche NF. Atrial fibrillation and cardiac fibrosis. Eur Heart J. 2020;41:112331. doi:10.1093/eurheartj/ehz786.
8. Pathak RK, Middeldorp ME, Lau DH, et al. Aggressive risk factor reduction study for atrial fibrillation and implications for the outcome of ablation: the ARREST-AF cohort study. J Am Coll Cardiol. 2014;64:2222-31. doi:10.1016/j.jacc.2014.09.028.
9. Morseth B, Graff-Iversen S, Jacobsen BK, et al. Physical activity, resting heart rate, and atrial fibrillation: the Tromsø Study. Eur Heart J. 2016;37:2307-13. doi:10.1093/eurheartj/ehw059.
10. Calvo N, Ramos P, Montserrat S, et al. Emerging risk factors and the dose–response relationship between physical activity and lone atrial fibrillation: a prospective case-control study. Europace. 2015;18:57-63. doi:10.1093/europace/euv216.
11. Красницкий В. Б., Аронов Д. М., Джанхотов С. О. Изучение физической активности у больных ИБС с помощью специализированного Опросника Двигательной Активности “ОДА-23+”. Кардиоваскулярная терапия и профилактика. 2011;10(8):90-7.
12. Yo C-H, Lee S-H, Chang S-S, et al. Value of high-sensitivity C-reactive protein assays in predicting atrial fibrillation recurrence: a systematic review and meta-analysis. BMJ Open. 2014;4:e004418. doi:10.1136/bmjopen-2013-004418.
13. Osbak PS, Mourier M, Henriksen JH, et al. Effect of physical exercise training on muscle strength and body composition, and their association with functional capacity and quality of life in patients with atrial fibrillation: a randomized controlled trial. J. Rehabil Med. 2012;44:975-9. doi:10.2340/16501977-1039.
14. Zhu W, Shen Y, Zhou Q, et al. Association of Physical Fitness With the Risk of Atrial Fibrillation: A Systematic Review and Meta-Analysis. Clin. Cardiol. 2016;39(7):421-8. doi:10.1002/clc.22552.
15. Younis A, Shaviv E, Nof E, et al. The role and outcome of cardiac rehabilitation in patients with atrial fi brillation. Clin Cardiol. 2018;41:1170-6. doi:10.1002/clc.23001.
16. Elliott AD, Mahajan R, Pathak RK, et al. Exercise Training and Atrial Fibrillation Further Evidence for the Importance of Lifestyle Change. Circulation. 2016;133:457-9. doi:10.1161/CIRCULATIONAHA.115.020800.
17. Proietti M, Boriani G, Laroche C, et al. Self-reported physical activity and major adverse events in patients with atrial fibrillation: a report from the EURObservational Research Programme Pilot Survey on Atrial Fibrillation (EORP-AF) General Registry. Europace. 2017;19(4):535-43. doi:10.1093/europace/euw150.
18. Njoku A, Kannabhiran M, Arora R, et al. Left atrial volume predicts atrial fibrillation recurrence after radiofrequency ablation: a meta-analysis. Europace. 2018;20:33-42. doi:10.1093/europace/eux013.
19. Watanabe H, Tanabe N, Yagihara N, et al. Association between lipid profile and risk of atrial fibrillation. Circ J. 2011;75(12):2767-74. doi:10.1253/circj.CJ-11-0780.
20. Brandes A, Smit MD, Nguyen BO, et al. Risk Factor Management in Atrial Fibrillation. Arrhythmia & electrophysiology review. 2018;7(2):118-27. doi:10.15420/aer.2018.18.2.
21. Lau DH, Schotten U, Mahajan R, et al. Novel mechanisms in the pathogenesis of atrial fibrillation: practical applications. Eur Heart J. 2016;37:1573-81. doi:10.1093/eurheartj/ehv375.
22. Spronk HMH, De Jong AM, Verheule S, et al. Hypercoagulability causes atrial fibrosis and promotes atrial fibrillation. Eur Heart J. 2017;38:38-50. doi:10.1093/eurheartj/ehw119.
23. Carballo D, Noble S, Carballo S, et al. Biomarkers and arrhythmia recurrence following radiofrequency ablation of atrial fibrillation J. Int. Med. Res. 2018;46(12):5183-94. doi:10.117/03000605518793807.
24. Hijazi Z, Oldgren J, Siegbahn A, et al. Biomarkers in atrial fibrillation: a clinical review. Eur Heart J. 2013;34:475-80. doi:10.1093/eurheartj/eht024.
25. Boldt A, Wetzel U, Weigl J, et al. Expression of angiotensin II receptors in human left and right atrial tissue in atrial fibrillation with and without underlying mitral valve disease. J Am Coll Cardiol. 2003;42:1785-92. doi:10.1016/J.JACC.2004.03.026.
26. Gang UJO, Nalliah CJ, Lim TW, et al. Atrial ectopy predicts late recurrence of atrial fibrillation after pulmonary vein isolation. Circ Arrhythm Electrophysiol 2015;8:569-74. doi:10.1161/CIRCEP.114.002052.
27. Alhede C, Johannessen A, Dixen U, et al., Higher burden of supraventricular ectopic complexes early after catheter ablation for atrial fibrillation is associated with increased risk of recurrent atrial fibrillation. Europace. 2018;20:50-7. doi:10.1093/europace/euw329.
Об авторах
М. Г. БубноваРоссия
Доктор медицинских наук, профессор, руководитель отдела реабилитации и вторичной профилактики сердечно-сосудистых заболеваний.
Москва
Конфликт интересов:
нет
Д. М. Аронов
Россия
Доктор медицинских наук, профессор, заслуженный деятель науки РФ, главный научный сотрудник.
Москва
Конфликт интересов:
нет
М. М. Махинова
Россия
Кандидат медицинских наук, младший научный сотрудник отдела реабилитации и вторичной профилактики сердечно-сосудистых заболеваний.
Москва
Конфликт интересов:
нет
К. В. Давтян
Россия
Доктор медицинских наук, доцент, руководитель отдела нарушений ритма и проводимости.
Москва
Конфликт интересов:
нет
Дополнительные файлы
Рецензия
Для цитирования:
Бубнова М.Г., Аронов Д.М., Махинова М.М., Давтян К.В. Клиническая эффективность персонализированной программы физических тренировок в реабилитации пациентов с фибрилляцией предсердий после операции радиочастотной аблации. Российский кардиологический журнал. 2022;27(7):5098. https://doi.org/10.15829/1560-4071-2022-5098
For citation:
Bubnova M.G., Aronov D.M., Makhinova M.M., Davtyan K.V. Clinical efficacy of a personalized exercise program in the rehabilitation of patients with atrial fibrillation after radiofrequency ablation. Russian Journal of Cardiology. 2022;27(7):5098. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5098
JATS XML

















































