Перейти к:
Особенности ранней динамики эхокардиографических показателей у онкологических пациентов на фоне химиотерапии
https://doi.org/10.15829/1560-4071-2022-5093
Аннотация
Цель. Оценить раннее проявление кардиотоксичности после проведения первого курса полихимиотерапии (ПХТ) с помощью эхокардиографии (ЭхоКГ) с оценкой фракции выброса (ФВ) левого желудочка (ЛЖ) и глобальной продольной деформации миокарда (GLS)
Материал и методы. В исследование было включено 49 пациентов онкологического профиля с запланированной ПХТ.
Результаты. После первого введения терапевтической дозы химиопрепаратов продемонстрировано снижение ФВ ЛЖ ≥10 и GLS >15 более чем у 6,1% пациентов, а также субклиническое снижение ФВ ЛЖ ≥5% у 22,4% и снижение GLS ≥12% у 24,5%.
Заключение. У онкологических пациентов после первого курса ПХТ следует оценивать динамику GLS при ЭхоКГ в качестве маркера миокардиальной дисфункции.
Ключевые слова
Для цитирования:
Фашафша З.З., Чомахидзе П.Ш., Меситская Д.Ф., Суворов А.Ю., Секачева М.И., Поддубская Е.В., Тюканова Е.С., Санькова М.В., Озова М.А., Левина В.Д., Андреев Д.А., Копылов Ф.Ю. Особенности ранней динамики эхокардиографических показателей у онкологических пациентов на фоне химиотерапии. Российский кардиологический журнал. 2022;27(11):5093. https://doi.org/10.15829/1560-4071-2022-5093
For citation:
Fashafsha Z.Z., Chomakhidze P.Sh., Mesitskaya D.F., Suvorov A.Yu., Sekacheva M.I., Poddubskaya E.V., Tyukanova E.S., Sankova M.V., Ozova M.A., Levina V.D., Andreev D.А., Kopylov F.Yu. Early echocardiographic alterations in cancer patients during chemotherapy. Russian Journal of Cardiology. 2022;27(11):5093. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5093
Использование современных методов лечения онкологических заболеваний привело к улучшению выживаемости, в частности, благодаря появлению новых классов химиопрепаратов. Однако применение многих из них связано с повышенным риском возникновения сердечно-сосудистых осложнений, так называемой кардиотоксичностью. Примером может служить использование нескольких различных химиотерапевтических агентов с потенциалом кардиотоксичности и/или комбинации химиотерапии и лучевой терапии [1][2]. Высокие показатели заболеваемости и смертности, связанные с противоопухолевой лекарственной терапией рака, могут быть снижены при раннем выявлении кардиотоксичности.
Одним из методов раннего выявления кардиотоксичности является визуализация сердца, а именно трансторакальная эхокардиография (ЭхоКГ), которая играет важную роль в базовой оценке и последовательном наблюдении за пациентами с сердечно-онкологическими заболеваниями. Наиболее часто используемым параметром для мониторинга функции левого желудочка (ЛЖ) с помощью ЭхоКГ является фракция выброса (ФВ) ЛЖ. Согласно совместным рекомендациям Американского общества эхокардиографии (The American Society of Echocardiography — ASE) и Европейской ассоциации эхокардиографии (European Association of Echocardiography — EAE), методом выбора для количественного определения объемов ЛЖ и расчета ФВ ЛЖ является модифицированная бипланетарная методика Симпсона по (2D) с использованием трехмерной (3D) техники. Значимое снижение этого параметра является констатацией необратимого токсического повреждения миокарда [3][4].
Современным параметром мониторинга кардиотоксичности при ЭхоКГ является оценка глобальной продольной деформации миокарда (GLS) с помощью спекл-трекинг ЭхоКГ (speckle tracking echocardiography — STE), которая считается более чувствительным ЭхоКГ методом для выявления раннего повреждения миокарда [5][6].
Согласно экспертному консенсусу Американского общества эхокардиографии и Европейской ассоциации сердечно-сосудистой визуализации (European Association of Cardiovascular Imaging — ASE/EACVI) для разработки мультимодальной визуализации сердца у пациентов с раком, кардиотоксичность определяется как снижение сократительной функции миокарда, характеризующаяся уменьшением ФВ ЛЖ более чем на 10% от исходного значения или в абсолютном выражении менее чем 53% у бессимптомных пациентов и снижение ФВ ЛЖ ≥5% у симптомных пациентов, при исключении других причин, влияющих на сократительную функцию миокарда. Также оценивается относительное процентное снижение GLS; снижение >15% свидетельствует о субклинической дисфункции ЛЖ, в то время как относительное снижение GLS между 8% и 15% является "серой зоной" и требует дальнейшего контроля в динамике [7-9].
Согласно консенсусу Европейского общества медицинской онкологии (European Society for Medical Oncology — ESMO), а также российскому обществу клинической онкологии (RUSSCO), относительное снижение GLS >12% у бессимптомных пациентов оценивается как проявление субклинической кардиотоксичности [1][10].
Материал и методы
Наше исследование проводится в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации. Протокол исследования был одобрен локальным этическим комитетом, протокол № 34-20 от 09.12.2020г. До включения в исследование у всех участников было получено письменное информированное согласие.
Данная работа является аналитической частью открытого проспективного интервенционного научного исследования 49 пациентов онкологического профиля с запланированным проведением полихимиотерапии (ПХТ) (табл. 1-3).
Таблица 1
Общая характеристика пациентов до начала химиотерапии
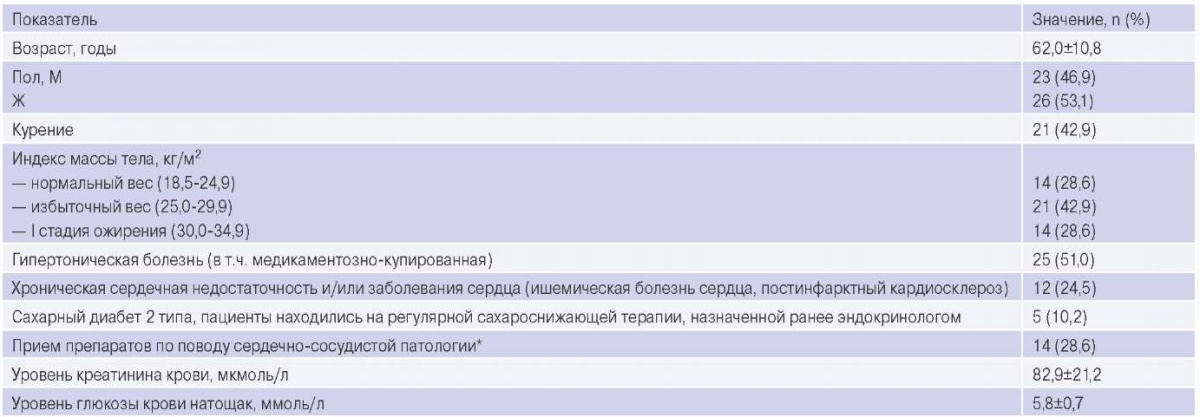
Примечание: * — терапия, получаемая пациентами, соответствовала стандартам кардиологических сообществ, врач-исследователь в нашей работе не вносил изменения в исходную полученную терапию; группы препаратов (ингибиторы ангиотензинпревращающего фермента, бета-блокаторы, БРАII, статины, антиагреганты, антикоагулянты) назначались в соответствии с клинической формой сердечно-сосудистой патологии пациентов.
Таблица 2
Локализация опухолевого процесса и схема проводимой ПХТ

Таблица 3
Процентное получение химиопрепаратов

Критерии включения
- возраст 18 лет и старше;
- подписанное информированное согласие;
- запланированное проведение ПХТ.
Критерии невключения
- пациенты, получавшие лучевую терапию;
- пациенты с исходно тяжелыми нарушениями ритма;
- пациенты с сердечной недостаточностью с промежуточной или низкой ФВ ЛЖ;
- пациенты с тяжелой печеночной и/или почечной недостаточностью;
- пациенты с минимальной ожидаемой продолжительностью жизни <2 мес.;
- беременность.
Критерии исключения
- отказ от продолжения участия в исследовании;
- неудовлетворительное качество ЭхоКГ;
- непереносимость ПХТ по внесердечной причине.
Конечная точка исследования — регистрация признаков кардиотоксичности. Проявления кардиотоксичности в данном исследовании были оценены как:
- снижение ФВ ЛЖ ≥10% от исходного уровня или снижение ФВ ЛЖ ≥5% с проявлением субклинической кардиотоксичности, включающее появление чувства нехватки воздуха (одышка) у пациентов при выполнении повседневной физической нагрузки и отеков нижних конечностей без явных функциональных и/или патологических причин (тромбоэмболическая болезнь нижних конечностей, метастатический лимфостаз, хроническая болезнь почек, токсическое проявление ПХТ, электролитный дисбаланс);
- снижение GLS ЛЖ >15%;
- снижение GLS ЛЖ >12%.
Проводилась оценка:
- ФВ ЛЖ по методу Симпсона, с применением методики BIPLANE из 4и 2-камерной апикальных позиций с записью кинопетли длительностью не <3 сердечных циклов.
- GLS по методу Speckle Tracking.
Также были исключены все стандартные параметры, в т.ч. значимые клапанные патологии, значимые органические и функциональные изменения сердца.
Статистическая обработка проведена с помощью языка программирования Python v3.8. Для количественных показателей определялся характер распределения (c помощью теста Шапиро-Уилка), среднее значение, стандартное отклонение, медиана, межквартильный интервал. Для категориальных и качественных признаков определялась доля и абсолютное количество значений.
Сравнительный анализ для нормально распределенных количественных признаков проводился на основании t-теста Уэлча (2 группы) или ANOVA (>2 групп) с последующим попарным сравнением групп; для ненормально распределенных количественных признаков — с помощью U-критерия Манна-Уитни (2 группы) или критерия Краскела-Уоллиса (>2 групп).
Сравнительный анализ категориальных и качественных признаков проведен с использованием точного теста Фишера.
Уровень значимости при проведении сравнительного анализа соответствует 0,05.
Дизайн исследования
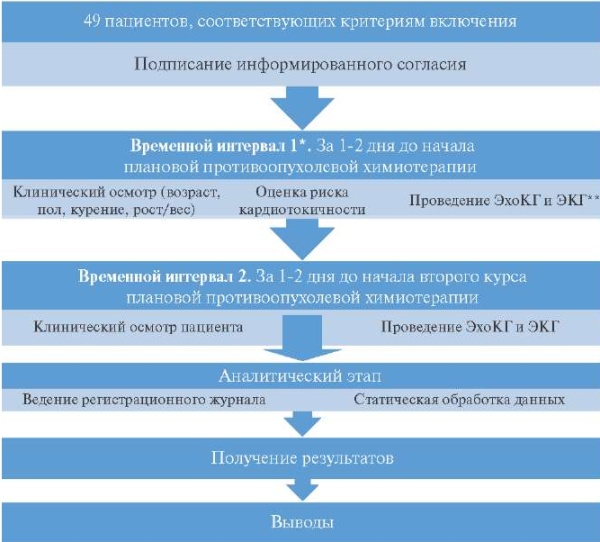
Примечание: * — временной интервал между курсами определен стандартом лечения онкологического процесса, рекомендуемым онкологическими обществами, и меняется в зависимости от схемы противоопухолевой терапии и в нашем исследовании занимал от 14-21 дня; ** — ЭхоКГ проводилась на сканере General Electric Vivid 7, двумя врачами функциональной диагностики.
Сокращения: ЭКГ — электрокардиография, ЭхоКГ — эхокардиография.
Результаты
Проведен анализ ЭхоКГ 49 пациентов с расчетом ФВ ЛЖ по Симпсону и GLS.
У 11 (22,4%) пациентов с субклиническим проявлением кардиотоксичности отмечалось снижение ФВ ЛЖ ≥5% от 60,73±7,09 до 54,82±6,71 в периоде после ПХТ, где среднее снижение составило >8% от исходной, p<0,017 (табл. 4).
Таблица 4
Результаты по снижению ФВ ЛЖ ≥5% по Симпсону и GLS >12% в периоде после ПХТ

Примечание: данные представлены в виде M±SD (М – среднее значение, SD – стандартное отклонение).
Сокращения: ЛЖ — левый желудочек, ПХТ — полихимиотерапия, ЭхоКГ — эхокардиография, ФВ — фракция выброса, ЧСС — частота сердечных сокращений, GLS — глобальная продольная деформация миокарда (global longitudinal strain).
В данной группе пациентов снижение GLS составило >10%; от 19,46±1,25 до 17,08±1,49 в периоде после ПХТ, p<0,001 (табл. 4). Обращает на себя внимание клинически значимое снижение ЭхоКГ у трех пациентов (27,3%) данной группы с раком пищевода, получавших трехкомпонентную схему TPF, p<0,05 (табл. 4). Пациенты данной группы получали следующие препараты в процентных значениях; доцетаксел (11,1%), цисплатин (18,5%), 5-фторурацил (18,5%), иринотекан (7,4%), оксалиплатин (11,1%), капецитабин (3,7%), этопозид (3,7%), гемцитабин (3,7%), доксорубицин (11,1%), циклофосфамид (7,4%), ифосфамид (3,7%).
Снижение ФВ ЛЖ >10% отмечалось у 3 (6,1%) пациентов, ФВ ЛЖ у этих пациентов составила после ПХТ 51,34±5,25 при исходной 60,66±1,35, р<0,05. У этой группы пациентов также отмечалось достоверное снижение GLS >15% (15,2±0,7) по сравнению с исходной (18,8±0,6), р<0,01. Пациенты данной группы получили следующие схемы терапии: TPF (33,3%), FOLFIRINOX (33,3%), XELOX (33,3%).
Снижение GLS >12% отмечалось у 12 пациентов до значений 17,68±2,13 в периоде после химиотерапии от исходной 20,67±2,05, p<0,05 (табл. 4). Однако снижение ФВ ЛЖ по Симпсону не показывало клинически достоверные значимые значения в периоде после ПХТ в данной группе; значение ФВ ЛЖ 59,08±7,91 после ПХТ, при исходных значениях 64,25±6,56, p=0,820 (табл. 4). Обращает на себя внимание клинически значимое снижение глобальной деформации у трех пациентов (25%) данной группы с раком пищевода, получавших трехкомпонентную схему TPF, p<0,05 (табл. 4). Пациенты данной группы получили следующие схемы терапии: TPF (25%), FOLFIRINOX (16,7%), XELOX (16,6%), FOLFIRI (8,3%), FOLFOX (8,3%), GemCis (8,3%), AC (16,7%).
Химиопрепараты, входящие в состав данных схем, в процентных значениях: доцетаксел (10,3%), цисплатин (13,8%), 5-фторурацил (24%), иринотекан (10,3%), оксалиплатин (17,2%), гемцитабин (3,4%), доксорубицин (6,8%), циклофосфамид (6,8%), капецитабин (6,8%).
Снижение GLS >15% отмечалось у трех пациентов мужского пола со средним возрастом 60,0±2,94 до значений 15,7±1,1 в период после ПХТ по сравнению с исходной GLS 19,4±0,5, p<0,01. У этих пациентов снижение ФВ ЛЖ составило >16% до значений 50,67±5,2 при исходных значениях 60,67±1,25, p<0,05. Пациенты данной группы получили следующие схемы терапии: TPF (33,3%), FOLFIRINOX (33,3%), XELOX (33,3%). Химиопрепараты, входящие в состав данных схем, в процентных значениях: капецитабин (12,5%), оксалиплатин (25%), 5-фторурацил (25%), иринотекан (12,5%), цисплатин (12,5%), доцетаксел (12,5%).
Исходные показатели наполнения ЛЖ были снижены у 4% пациентов. Этот критерий статистически не влиял на снижение систолической функции на фоне химиотерапии.
Обсуждение
В Российской и мировой литературе существуют многочисленные исследования, посвященные изучению кардиотоксичности, построенные на оценке параметров ЭхоКГ, однако эти исследования в основном изучают кардиотоксичность при проведении высокодозной химиотерапии, а также после окончания блока химиотерапии при достижении кумулятивной дозы. На основе данных этих исследований были предложены экспертные кардиоонкологические рекомендации по оценке риска, выявлению и ведению пациентов с кардиотоксичностью [1][2][7]. В настоящее время активно изучается эффект вводимой дозы химиопрепаратов. Так, опубликованы результаты клинического исследования по оценке субклинической кардиотоксичности антрациклин-содержащей химиотерапии рака молочной железы в зависимости от кумулятивной дозы доксорубицина и исходного уровня артериального давления [11]. В этом исследовании помимо оценки эффекта дозы химиопрепаратов на изменение уровня артериального давления были изучены параметры ЭхоКГ (ФВ ЛЖ и GLS), где было показано, что при использовании более высоких кумулятивных доз доксорубицина риск развития субклинической кардиотоксичности оказался выше, чем у пациентов, получивших более низкую кумулятивную дозу доксорубицина. Доксорубицин был использован в составе трехкомпонентной схемы химиопрепаратов (доксорубицин, цисплатин, паклитаксел).
В другом зарубежном исследовании представлены данные клинического исследования по оценке ранней субклинической кардиотоксичности с использованием параметров (2D) ЭхоКГ: ФВ ЛЖ и GLS. Параметры ЭхоКГ были получены до начала ПХТ, а также после первого курса ПХТ и в среднем в течение 2 мес. после достижения кумулятивной дозы 440 мг/м2 доксорубицина и 1560 мг/м2 трастузумаба. По результатам данного исследования было выявлено, что даже после первого ведения ПХТ отмечается снижение параметров ФВ ЛЖ ≥10 у 20% пациентов [12].
Полученные нами результаты по оценке эффективности ЭхоКГ после первого введения терапевтической дозы химиопрепаратов продемонстрировали снижение ФВ ЛЖ ≥10 и GLS >15% более чем у 6,1% пациентов, а также субклиническое снижение ФВ ЛЖ ≥5% у 22,4% и снижение GLS >12% у 24,5%, что соответствует результатам исследований в мировой литературе [2][4][13].
Тем не менее снижение ФВ ЛЖ ≥5% с субклиническим проявлением кардиотоксичности коррелировало со снижением GLS >10% в периоде после ПХТ. Эти данные подтверждают факт наличия относительного снижения GLS между 8% и 15% после ПХТ, так называемая "серая зона", требующая дальнейшего контроля в динамике согласно мировой литературе [4][8].
Однако было отмечено, что у ряда пациентов с проявлениями кардиотоксичности параметр GLS снижался на ≥12% при отсутствии значимого снижения ФВ ≥5%, что соответствует данным литературы о более высокой чувствительности и объективности параметров деформации миокарда при оценке миокардиальной дисфункции [14].
Снижение параметров систолической функции при ЭхоКГ достоверно чаще было выявлено у пациентов с раком пищевода, получивших трехкомпонентную дозу химиопрепаратов по схемам TPF (доцетаксел, цисплатин, 5-ФУ). Данные о высокой токсичности и высокой эффективности схемы химиотерапии TPF, содержащей препараты таксанового ряда, были продемонстрированы в исследовании Peng H, et al. (2021). В нем изучалась 10-летняя выживаемость при проведении индукционной химиотерапии по схеме TPF, при этом у пациентов, получивших схему терапии в режим TPF, развивался в 3-5 раз более высокий эффект токсичности в отношении системы крови по сравнению с двухкомпонентными схемами химиотерапии. Таким образом, была выдвинута теория, что добавление доцетаксела к схеме PF (цисплатин, 5-ФУ) приводит к большей токсичности [6][15].
Ограничения исследования. В нашей выборке не оказалось пациентов с промежуточной и низкой ФВ ЛЖ, поскольку основной акцент был сделан на влияние комбинированной ПХТ в свете сохраненной ФВ ЛЖ с включением пациентов с минимальными сердечно-сосудистыми поражениями, что могло стать ограничением нашего исследования.
Заключение
После первого курса ПХТ следует оценивать GLS, т.к. показатель GLS >12% оказался более объективным параметром оценки миокардиальной дисфункции при помощи ЭхоКГ. Проявления субклинической кардиотоксичности после первого курса ПХТ встречались достоверно чаще при раке пищевода у пациентов на терапии TPF. Другие клинические факторы не влияли на частоту развития кардиотоксичности.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Curigliano G, Lenihan D, Fradley M, et al. Management of cardiac disease in cancer patients throughout oncological treatment: ESMO consensus recommendations. Ann Oncol. 2020;31(2):171-90. doi:10.1016/j.annonc.2019.10.023.
2. Zamorano JL, Lancellotti P, Muñozet DR, et al. ESC Position Paper on cancer treatments and cardiovascular toxicity developed under the auspices of the ESC Committee for Practice Guidelines. European Heart Journal. 2016;37:2768-801. doi:10.1093/eurheartj/ehw211.
3. Thakur A, Witteles RM. Cancer therapy-induced left ventricular dysfunction: interventions and prognosis. J Card Fail. 2014;20(3):155-8. doi:10.1016/j.cardfail.2013.12.018.
4. Plana JC, Galderisi M, Barac A, et al. Expert consensus for multimodality imaging evaluation of adult patients during and after cancer therapy. J Am Soc Echocardiogr. 2014;27(9):911-39. doi:10.1016/j.echo.2014.07.012.
5. Armenian SH, Lacchetti C, Barac A, et al. Prevention and monitoring of cardiac dysfunction in sur vivors of adult cancers: American society of clinical oncology clinical practice guideline. J Clin Oncol. 2017;35:893-911. doi:10.1200/JCO.2016.70.5400.
6. Sawaya H, Sebag IA, Plana JC, et al. Assessment of echocardiography and biomarkers for the extended prediction of cardiotoxicity in patients treated with anthracyclines, taxanes, and trastuzumabCirc Cardiovasc Imaging. 2012;5(5):596-603. doi:10.1161/ CIRCIMAGING.112.973321.
7. Curigliano G, Cardinale D, Suter T, et al. ESMO Guidelines Working Group. Cardiovascular toxicity induced by chemotherapy, targeted agents and radiotherapy: ESMO Clinical Practice Guidelines Ann Oncol. 2012;23 Suppl 7:vii155-66. doi:10.1093/annonc/mds293.
8. Larsen CM, Mulvagh SL. Cardio-oncology: what you need to know now for clinical practice and echocardiography. Echo Res Praf. 2017;4(1):R33-R41. doi.10.1530/ERP-17-0013.
9. Voigt JU, Pedrizzetti G, Lysyansky P, et al. Definitions for a common standard for 2D speckle tracking echocardiography: Consensus document of the EACVI/ASE/Industry Task Force to standardize deformation imaging. J Am Soc Echocardiogr. 2015;28(2):183-93. doi:10.1016/j.echo.2014.11.003.
10. Vicenya MV, Ageev FT, Gilyarov MY, et al. Practical recommendations for the correction of cardiovascular toxicity of anticancer drug therapy. Malignant Tumors. 2019;9(3S2):609-27. (In Russ.) Виценя М. В., Агеев Ф. Т., Гиляров М. Ю. и др. Практические рекомендации по коррекции кардиоваскулярной токсичности противоопухолевой лекарственной терапии. Злокачественные опухоли. 2019;9(3S2):609-27. doi:10.18027/2224-5057-2019-9-3s2-609-627. EDN VAVDJO.
11. Авалян А. А., Ощепкова Е. В., Саидова М. А. и др. Оценка субклинической кардиотоксичности антрациклинсодержащей химиотерапии рака молочной железы в зависимости от кумулятивной дозы доксорубицина и исходного уровня артериального давления. Системные гипертензии. 2018;15(4):59-64. doi:10.26442/2075082X.2018.4.000021.
12. Calle MC, Sandhu NP, Xia H, et al. Two-dimensional speckle tracking echocardiography predicts early subclinical cardiotoxicity associated with anthracycline-trastuzumab chemotherapy in patients with breast cancer. BMC Cancer. 2018;18:1037. doi:10.1186/s12885-018-4935-z.
13. Васюк Ю. А., Гендлин Г. Е., Емелина Е. И. и др. Согласованное мнение российских экспертов по профилактике, диагностике и лечению сердечно-сосудистой токсичности противоопухолевой терапии. Российский кардиологический журнал. 2021;26(9):4703. doi:10.15829/1560-4071-2021-4703.
14. Stanton T, Leano R, Marwick T. Prediction of all-cause mortality from global longitudinal speckle strain: comparison with ejection fraction and wall motion scoring. Circ Cardiovasc Imaging. 2009;2(5):356-64. doi:10.1161/CIRCIMAGING.109.862334.
15. Peng H, Chen B, He S, et al. Efficacy and Toxicity of Three Induction Chemotherapy Regimens in Locoregionally Advanced Nasopharyngeal Carcinoma: Outcomes of 10-Year Follow-Up. Front. Oncol. 2021;11:765378. doi:10.3389/fonc.2021.765378.
Об авторах
З. З.А. ФашафшаРоссия
Аспирант кафедры кардиологии, функциональной и ультразвуковой диагностики Института клинической медицины им. Н. В. Склифосовского, научный сотрудник научно-исследовательского центра мирового уровня "Цифровой биодизайн и персонализированное здравоохранение".
Москва
Конфликт интересов:
Конфликта интересов нет.
П. Ш. Чомахидзе
Россия
Доктор медицинских наук, профессор кафедры кардиологии, функциональной и ультразвуковой диагностики Института клинической медицины им. Н. В. Склифосовского, главный научный сотрудник научно-исследовательского центра мирового уровня "Цифровой биодизайн и персонализированное здравоохранение".
Москва. Телефон: +79166740369; SPIN: 6230-56104 Scopus ID: 56037717000; Web of Science Researcher ID: AAJ-1217-2020; РИНЦ ID: 891996
Конфликт интересов:
нет конфликта интересов.
Д. Ф. Меситская
Россия
Кандидат медицинских наук, доцент кафедры кардиологии, функциональной и ультразвуковой диагностики Института клинической медицины им. Н. В. Склифосовского.
Москва. SPIN: 2758-3152; Scopus ID 56528511200; Web of Science Researcher ID M-7706-2018; РИНЦ ID 861782
Конфликт интересов:
нет конфликта интересов.
А. Ю. Суворов
Россия
Кандидат медицинских наук, главный статистик Центра анализа сложных систем Центра "Цифрового биодизайна и персонализированного здравоохранения".
Москва. Телефон: +7-916-264-13-70; Scopus: 57213827983; WoS: AGS-7105-2022
Конфликт интересов:
нет конфликта интересов
М. И. Секачева
Россия
Доктор медицинских наук, профессор кафедры онкологии, радиотерапии и пластической хирургии Института клинической медицины им. Н. В. Склифосовского, директор Института персонализированной онкологии Центра "Цифровой биодизайн и персонализированное здравоохранение".
Москва. Телефон +7 916 513-45-77; WOS Research ID AAP-7426-2020; Scopus Author ID 24342526600; ID РИНЦ SPIN-код: 4801-3742, AuthorID: 631044
Конфликт интересов:
нет конфликта интересов.
Е. В. Поддубская
Россия
Кандидат медицинских наук, старший научный сотрудник Научно-исследовательского отдела "Центр персонализированной онкологии" Института персонализированной медицины Научно-технологического парка биомедицины, зам. директора Клинического центра по онкологии.
Москва. Тел. +79857695758; SPIN 8492-3712; Web of Science AAK-7600-2021; Scopus 56089215700
Конфликт интересов:
нет конфликта интересов
Е. С. Тюканова
Россия
Клинический ординатор по специальности онкология Академии постдипломного образования, ФГБУ ФНКЦ ФМБА России.
Москва. Тел. +79686819977
Конфликт интересов:
нет конфликта интересов
М. В. Санькова
Россия
Студентка 4 курса лечебного факультета, Международная школа "Медицина будущего".
Москва. Тел: 8(916)280-81-90
Конфликт интересов:
нет конфликта интересов
М. А. Озова
Россия
Аспирант кафедры кардиологии, функциональной и ультразвуковой диагностики Института клинической медицины им. Н. В. Склифосовского.
Москва. SPIN: 7545-6611
Конфликт интересов:
нет конфликта интересов.
В. Д. Левина
Россия
Аспирант кафедры кардиологии, функциональной и ультразвуковой диагностики Института клинической медицины им. Н. В. Склифосовского, врач-кардиолог клинико-диагностического отделения ГКБ им. С. С. Юдина.
Москва. Тел. 89257061869
Конфликт интересов:
нет конфликта интересов
Д. А. Андреев
Россия
Андреев Д. А. — доктор медицинских наук, профессор, заведующий кафедрой кардиологии, функциональной и ультразвуковой диагностики Института клинической медицины им. Н. В. Склифосовского.
Москва. Тел. +7 985 222-45-85; SPIN-код 8790-8834
Конфликт интересов:
нет конфликта интересов
Ф. Ю. Копылов
Россия
Доктор медицинских наук, профессор кафедры кардиологии, функциональной и ультразвуковой диагностики Института клинической медицины им. Н. В. Склифосовского, директор Института персонализированной кардиологии научно-исследовательского центра мирового уровня "Цифровой биодизайн и персонализированное здравоохранение".
119991, Москва, ул. Большая Пироговская, д.2, стр.4, каб.106. Отдел делопроизводства. Телефон: 8-903-687-72-64; Индекс Хирша: 11; Идентификатор в системе SCOPUS (SCOPUS ID): 6507736224; SPIN-код: 8287-6897; AuthorID: 2481664 Web of Science ResearcherID Y-8275-2018
Конфликт интересов:
нет конфликта интересов
Дополнительные файлы
Рецензия
Для цитирования:
Фашафша З.З., Чомахидзе П.Ш., Меситская Д.Ф., Суворов А.Ю., Секачева М.И., Поддубская Е.В., Тюканова Е.С., Санькова М.В., Озова М.А., Левина В.Д., Андреев Д.А., Копылов Ф.Ю. Особенности ранней динамики эхокардиографических показателей у онкологических пациентов на фоне химиотерапии. Российский кардиологический журнал. 2022;27(11):5093. https://doi.org/10.15829/1560-4071-2022-5093
For citation:
Fashafsha Z.Z., Chomakhidze P.Sh., Mesitskaya D.F., Suvorov A.Yu., Sekacheva M.I., Poddubskaya E.V., Tyukanova E.S., Sankova M.V., Ozova M.A., Levina V.D., Andreev D.А., Kopylov F.Yu. Early echocardiographic alterations in cancer patients during chemotherapy. Russian Journal of Cardiology. 2022;27(11):5093. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5093
JATS XML

















































