Перейти к:
Влияние CPAP терапии на ремоделирование левого предсердия у пациентов с пароксизмальной фибрилляцией предсердий и обструктивным апноэ сна, перенесших катетерную изоляцию легочных вен
https://doi.org/10.15829/1560-4071-2022-5084
Аннотация
Цель. Изучить изолированное влияние обструктивного апноэ сна (ОАС) на процессы анатомического ремоделирования левого предсердия (ЛП) у пациентов с пароксизмальной формой фибрилляции предсердий (ФП), перенесших катетерную аблацию лёгочных вен (ЛВ), и сопутствующим ОАС тяжелой и средней степени тяжести.
Материал и методы. Выполнен субанализ эхокардиографических данных 50 пациентов с пароксизмальной формой ФП и ОАС средней/тяжелой степени тяжести, перенесших катетерную изоляцию устья ЛВ и наблюдавшихся в течение 12 мес. (основная группа — 33 и группа контроля — 17). Клиническая эффективность катетерной аблации оценивалась после окончания трёхмесячного слепого периода. В субанализ были включены следующие эхокардиографические показатели — переднезадний размер ЛП, объём ЛП, индексированный объём ЛП (ИОЛП), систолическое давление в легочной артерии (СДЛА).
Результаты. Через 12 мес. в группе контроля отмечалось статистически значимое увеличение переднезаднего размера ЛП (40,5 (40-42) мм vs 42 (40-45) мм, p=0,037), объема ЛП (68,5 (58-74,5) мл vs 69 (63-89) мл, p=0,006), ИОЛП (35,0 (29-37) мл/м2 vs 35,5 (32-41,5) мл/м2, p=0,005) и СДЛА (27 (25-30) vs 30 (29-33); p=0,004) при сравнении с исходными значениями в момент включения в исследование. По данным внутригруппового анализа показателей в подгруппе пациентов, не получающих терапию CPAP (Continuous Positive Airway Pressure), но без рецидива ФП, статистически достоверных изменений размеров ЛП не было выявлено (переднезадний размер ЛП — 40 (40-42) мм vs 40 (40-41) мм, p=0,317; объем ЛП — 63 (58-71) мл vs 64 (61-69) мл, p=0,509; ИОЛП — 32 (29-36) мл/м2 vs 33 (31-34) мл2, p=0,509).
Заключение. У пациентов с пароксизмальной формой ФП и сопутствующим ОАС средней и тяжелой степени, перенесших катетерное лечение ФП, отсутствие корригирующей CPAP терапии не сопряжено со значимым увеличением линейного и объемных размеров ЛП в условиях отсутствия рецидива ФП.
Ключевые слова
Для цитирования:
Давтян К.В., Топчян А.Г., Арутюнян Г.Г., Агальцов М.В., Драпкина О.М. Влияние CPAP терапии на ремоделирование левого предсердия у пациентов с пароксизмальной фибрилляцией предсердий и обструктивным апноэ сна, перенесших катетерную изоляцию легочных вен. Российский кардиологический журнал. 2022;27(7):5084. https://doi.org/10.15829/1560-4071-2022-5084
For citation:
Topchyan A.G., Davtyan K.V., Arutyunyan G.G., Agaltsov M.V., Drapkina O.M. Effect of CPAP therapy on left atrial remodeling in patients with paroxysmal atrial fibrillation and obstructive sleep apnea undergoing pulmonary vein isolation. Russian Journal of Cardiology. 2022;27(7):5084. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5084
Фибрилляция предсердий (ФП) — наджелудочковая тахиаритмия, характеризующаяся быстрой, нерегулярной и хаотической предсердной активностью с последующим ухудшением механической функции предсердий [1]. Центральную роль в патогенезе ФП играют высокочастотные электрические очаги мышечных муфт лёгочных вен (ЛВ) [2], радиочастотная и криобаллонная аблация которых в настоящее время является основным методом устранения ФП у симптомных, резистентных к антиаритмической терапии пациентов [3]. Для повышения клинической эффективности катетерного лечения ФП критическое значение имеет ранняя диагностика и коррекция сопутствующих заболеваний и факторов риска, среди которых отдельное место имеет обструктивное апноэ сна (ОАС). ОАС — это заболевание, характеризующееся эпизодической частичной или полной окклюзией верхних дыхательных путей во сне, приводящей к возникновению храпа, гипоксемии, активации коры головного мозга и избыточной дневной сонливости [4]. По данным метаанализа 6 исследований по изучению роли ОАС в отношении рецидива ФП после катетерной аблации [5], пациенты с ОАС имеют на 25% больше риск возврата аритмии при сравнении с больными без ОАС. Повреждающее действие ОАС на сердечно-сосудистую систему комплексное и включает в себя компоненты механического воздействия, чрезмерной активации вегетативной нервной системы, активации процессов окисления и воспаления, аритмогенного воздействия [6]. Все указанные механизмы могут усугублять процессы ремоделирования левого предсердия (ЛП), увеличивая риск возникновения рецидива аритмии. В 2020г были опубликованы результаты нашего рандомизированного исследования, которое показало, что корригирование ОАС средней/тяжелой степени тяжести методом создания положительного давления в верхних дыхательных путях (CPAP — аббревиатура словосочетания Continuous Positive Airway Pressure) у пациентов с симптомной пароксизмальной формой ФП значимо повышает клиническую эффективность катетерного лечения ФП [7]. Однако важно помнить, что при ФП имеет место сложное взаимодействие запускающих и поддерживающих механизмов аритмии, также влияющих на прогресс ремоделирования. Для уточнения изолированного влияния ОАС на процессы анатомического ремоделирования ЛП у пациентов с пароксизмальной формой ФП, перенесших катетерную аблацию ЛВ, мы выполнили субанализ эхокардиографических показателей пациентов, включенных в исследование.
Материал и методы
Исследование проспективное, рандомизированное, выполнялось на базе ФГБУ “НМИЦ ТПМ” в 2016-2019гг. Исследование было выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации. Протокол исследования был одобрен независимым этическим комитетом НМИЦ ТПМ. До включения в исследование у всех участников было получено письменное информированное согласие. В субанализ были включены 50 пациентов с пароксизмальной формой ФП и сопутствующим ОАС средней и тяжелой степени, которым проводилась процедура катетерной аблации ЛВ и которые завершили 12-мес. клинико инструментальное наблюдение (основная группа — 33 пациента, группа контроля — 17 пациентов).
Кардиореспираторное мониторирование сна проводилось через 5-10 дней после катетерной изоляции ЛВ с помощью портативного прибора кардиореспираторного мониторирования нарушения дыхания во сне (Астрокард, Медитек, Москва). Данный регистратор является прибором третьего диагностического уровня, одобренным и рекомендованным Европейским респираторным обществом для объективной диагностики ОАС. Данные обследований сохранялись с помощью программного обеспечения Астрокард Медитек и были просмотрены специалистом по медицине сна в ручном режиме. Нарушения дыхания во сне были классифицированы согласно рекомендациям по диагностике ОАС Американской академии медицины сна [8].
Для проведения CPAP терапии пациентам основной группы, в дополнение к стандартному лечению, были выданы аппараты с автоматическим подбором лечебного давления Autoset S9 (ResMed, Австралия). Срок наблюдения составил 12 мес. с контрольными визитами через 3, 6 и 12 мес. Для оценки клинической эффективности катетерной аблации применялись результаты электрокардиограммы покоя, электрокардиографии мониторирования по Холтеру, опроса пациентов. При каждом визите также проводилась трансторакальная эхокардиография (ТТЭхоКГ). Дополнительно у пациентов основной группы проводилась оценка данных аппарата и, при необходимости, коррекция CPAP терапии.
ТТЭхоКГ выполнялась c помощью ультразвукового аппарата PHILIPS iE-33 (PHILIPS, Medical Systems, Нидерланды) секторным датчиком S5-1 с частотой излучения 5 МГц. Определялись следующие показатели: линейные и объемные параметры полостей сердца; толщина межжелудочковой перегородки и толщина задней стенки левого желудочка (ЛЖ), масса миокарда и индекс массы миокарда; показатели диастолической функции ЛЖ; систолическое давление в легочной артерии (СДЛА), состояние клапанного аппарата.
Статистический анализ. Проводился на персональном компьютере с использованием пакета статистического анализа данных Statistica 10 for Windows (StatSoft Inc., США), Stata (версия 15). Для количественных переменных проводился анализ соответствия распределения нормальному закону по Колмогорову-Смирнову. Для описания количественных переменных применялись число пациентов (n), среднее значение (М) со стандартным отклонением (δ), медиана (Ме) с интерквартильным размахом (ИКР). Для сравнения количественных переменных в зависимости от распределения выборки применялись t критерий Стьюдента, критерий Манна-Уитни, критерий Вилкоксона. Качественные переменные описывались абсолютными и относительными частотами (процентами). При сравнении качественных показателей использовались χ2-критерий Пирсона, точный критерий Фишера. Для оценки клинической эффективности катетерной аблации применялся метод Каплана-Майера с критерием лог-ранк. Различия считались статистически достоверными при значениях двухстороннего p<0,05.
Результаты
В субанализ были включены 50 пациентов (средний возраст 59,5±8,5 лет, 28 мужчин, медиана длительности анамнеза ФП 36 (24-72) мес.) с пароксизмальной формой ФП и ОАС средней/тяжелой степени тяжести, перенесших катетерную изоляцию устья ЛВ и наблюдавшихся в течение 12 мес. В основную группу были включены 33 пациента (18 мужчин и 15 женщин), в контрольную группу были включены 17 пациентов (10 мужчин и 7 женщин). Медиана возраста пациентов в обеих группах составила 61 год, медиана длительности анамнеза аритмии у больных основной группы составила 42 мес., в контрольной группе 27 мес. Доля пациентов с тяжелой степенью ОАС в основной группе и группе контроля составила 43,7% и 42,1%, соответственно. Из сопутствующих патологий в обеих группах наиболее часто встречались гипертоническая болезнь, ожирение I и II степени (табл. 1). С учетом бета адреноблокаторов, антиаритмические препараты принимали 85% пациентов основной группы и 90% пациентов группы контроля. Статистически достоверной разницы приема антиаритмических препаратов между группами не было (p=0,704). В таблице 1 представлена общая клинико-демографическая характеристика пациентов.
Клиническая эффективность катетерного лечения ФП была оценена после окончания так называемого трехмесячного “слепого” периода. У пациентов основной группы частота свободы рецидивов от аритмии была достоверно больше при сравнении с пациентами группы контроля и составила 82,9% (82,9% vs 47,5%; p=0,032).
Результаты ТТЭхоКГ. По результатам анализа эхокардиографических данных медиана исходного переднезаднего размера ЛП в основной группе составила 42 мм с ИКР 40-44 мм, в группе контроля 40,5 (40-42) мм. Медианы объемов ЛП и индексированный объем ЛП (ИОЛП) составили 74 мл и 35 мл/ м2 в основной группе и 68,5 мл, 35,5 мл/м2 в группе контроля, соответственно. Как видно из таблицы 2, по исходным данным ТТЭхоКГ группы были сопоставимы.
Как видно из таблицы, в целом в группе контроля прослеживалась тенденция увеличения линейного и объемных показателей ЛП и СДЛА, в то время как в основной группе подобной тенденции не отмечалось. Однако по данным заключительного сравнительного межгруппового анализа эхокардиографических показателей выявляемые различия не достигли уровня статистической достоверности. С другой стороны, внутригрупповой анализ в группе контроля показал статистически значимое увеличение значений всех показателей ЛП (табл. 3).
Таблица 1
Клинико-демографическая характеристика пациентов
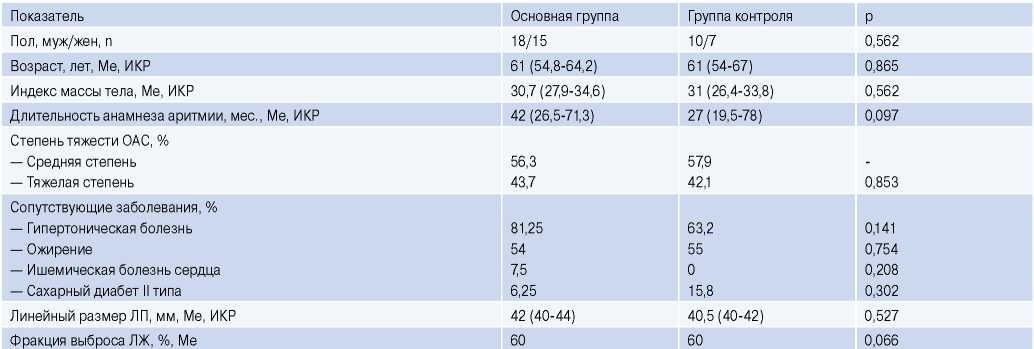
Сокращения: ИКР — интерквартильный размах, ОАС — обструктивное апноэ сна, ЛП — левое предсердие, ЛЖ — левый желудочек, Ме — медиана.
Таблица 2
Сравнительный анализ эхокардиографических показателей в начале исследования и через 12 мес., Me (ИКР)
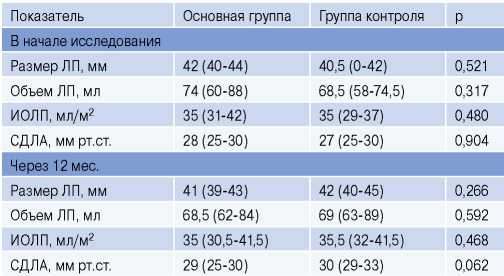
Сокращения: ИОЛП — индексированный объем левого предсердия, ЛП — левое предсердие, СДЛА — систолическое давление в лёгочной артерии.
Таблица 3
Данные исходной и заключительной ТТЭхоКГ у пациентов группы контроля, Me (ИКР)
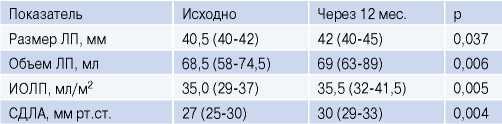
Сокращения: ИОЛП — индексированный объем левого предсердия, ЛП — левое предсердие, СДЛА — систолическое давление в лёгочной артерии.
На рисунке 1 графически представлена тенденция увеличения линейного и объемного показателей ЛП у пациентов группы контроля.
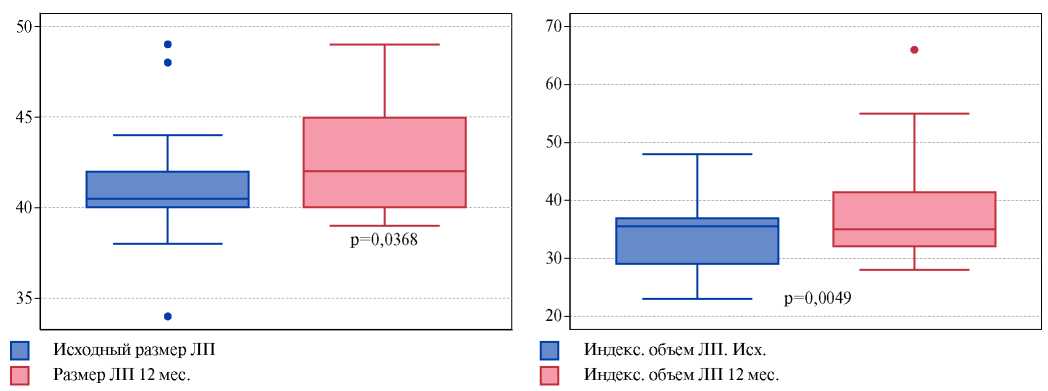
Рис. 1. Переднезадний размер и ИОЛП у пациентов группы контроля в начале исследования и через 12 мес.
Для уточнения изолированного влияния ОАС на процессы анатомического ремоделирования ЛП мы выполнили внутригрупповой анализ динамических показателей эхокардиографических данных у пациентов (n=9), не получающих CPAP терапию, но без рецидивов ФП после катетерного вмешательства. Анализ не выявил статистически достоверных изменений размеров ЛП (табл. 4), что, на наш взгляд, указывает на критическую роль удержания синусового ритма для замедления/остановки процессов ремоделирования.
В основной группе изменения, наблюдаемые в ходе исследования, были незначимы (табл. 5, 6).
Таблица 4
Данные исходной и заключительной ТТЭхоКГ у пациентов группы контроля без рецидива ФП, Me (ИКР)
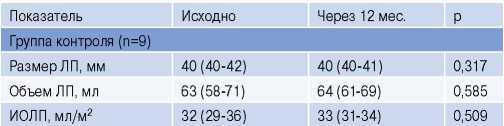
Сокращения: ИОЛП — индексированный объем левого предсердия, ЛП — левое предсердие.
Таблица 5
Данные исходной и заключительной ТТЭхоКГ у пациентов основной группы, Me (ИКР)

Сокращения: ИОЛП — индексированный объем левого предсердия, ЛП — левое предсердие, СДЛА — систолическое давление в лёгочной артерии.
Таблица 6
Данные исходной и заключительной ТТЭхоКГ у пациентов основной группы без рецидива аритмии, Me (ИКР)
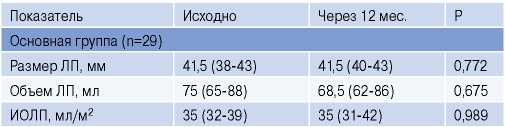
Сокращения: ИОЛП — индексированный объем левого предсердия, ЛП — левое предсердие.
Обсуждение
С момента внедрения в клиническую практику методики катетерной аблации ФП прошло около 20 лет. Несмотря на значительное улучшение инструментально-технологического обеспечения процедуры, накопление опыта выполнения процедуры, клиническая эффективность катетерного лечения пароксизмальной формы ФП остаётся на уровне ~80% вне зависимости от методики изоляции [9]. Лечение сопутствующих заболеваний и коррекция модифицируемых факторов риска остаётся крайне важным для уменьшения частоты возникновения рецидивов, замедления процессов ремоделирования и в целом увеличения частоты свободы от аритмии [10]. ОАС является важным фактором риска возникновения и дальнейшего прогрессирования ФП [11], своевременное выявление и коррекция которого даст возможность улучшить эффективность антиаритмической терапии ФП.
Для более объективного понимания взаимосвязи между проведением/отсутствием CPAP терапии и процессами ремоделирования миокарда ЛП были анализированы данные ТТЭхоКГ. По данным нашего анализа, несмотря на прослеживающуюся значимую тенденцию увеличения линейного и объемных показателей ЛП в группе контроля без терапии CPAP (в частности, ИОЛП в группе контроля — 35 (29-37) vs 35,5 (32-41,5), p=0,005), межгрупповое различие не достигло уровня статистической достоверности в конце 12-мес. срока наблюдения. Возможной причиной этого наблюдения являются относительно короткий срок наблюдения — процессы электроанатомического ремоделирования ЛП даже в условиях отсутствия корригирующей CPAP терапии у пациентов со средним/тяжелым ОАС могут протекать относительно медленно и не достигнуть статистически значимого уровня доказательности. В исследовании Colish J, et al. [12], в которое были включены 47 пациентов с ОАС (средний возраст 51±10 лет), на фоне регулярного применения CPAP терапии в течение года ИОЛП уменьшилась на 14 мл/м2 (45±4 vs 31±3, p<0,05), что указывает на возможность обратного ремоделирования предсердия. Для оценки состояния сердца применялись результаты стандартной ТТЭхоКГ и магнитно-резонансной томографии, что обеспечило хорошее качество визуализации. Однако отсутствие группы контроля является серьезным ограничением данного исследования. Кроме того, обращает на себя внимание исходно большой ИОЛП (45 мл/м2) в сравнении с нашими данными (35 мл/м2). Учитывая, что по протоколу исследования все пациенты с артериальной гипертензией, ФП, клапанной патологией, фракцией выброса ЛЖ <50% не были включены в исследование, вероятной причиной выраженной дилатации ЛП являлось именно ОАС, адекватная коррекция которого привела к стремительному сокращению объема ЛП. У больных ФП в основе ремоделирования лежат взаимоусиливающие негативные воздействия аритмии и ОАС. Однако отсутствие прогрессирования расширения ЛП у пациентов без рецидива ФП, даже в условиях отсутствия коррекции ОАС, на наш взгляд, свидетельствует именно о критической роли предупреждения рецидивов ФП для замедления/ остановки процессов ремоделирования ЛП. С другой стороны, применение CPAP терапии сопряжено с увеличением клинической эффективности катетерного лечения ФП [7]. Исходя из этого, можно заключить, что ранняя диагностика и коррекция нарушений дыхания во сне у пациентов с ФП является одним из важных звеньев для предупреждения рецидивов ФП, что даёт возможность повернуть назад процессы электроанатомического ремоделирования сердца. На наш взгляд, подобное разделение важно, т.к. позволяет более объективно расставить акценты и сформулировать вопросы для будущих научных исследований.
Ограничения исследования. Это одноцентровое исследование с маленьким объемом выборки, ограниченным сроком наблюдения у пациентов только с пароксизмальной формой ФП.
Заключение
У пациентов с пароксизмальной формой ФП и сопутствующим ОАС средней и тяжелой степени, перенесших катетерное лечение ФП, отсутствие корригирующей CPAP терапии не сопряжено с достоверным увеличением линейного и объемных размеров ЛП в условиях отсутствия возврата рецидива ФП.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Диагностика и лечение фибрилляции предсердий. В кн: Клинические рекомендации ВНОА по проведению электрофизиологических исследований, катетерной абляции и применению имплантируемых антиаритмических устройств. 2017, сс. 463-597. ISBN: 978-5-9500922-0-6.
2. Haïssaguerre M, Jaïs P, Shah DC, et al. Spontaneous Initiation of Atrial Fibrillation by Ectopic Beats Originating in the Pulmonary Veins. New England Journal of Medicine. 1998;339(10):659-66. doi:10.1056/NEJM199809033391003.
3. Calkins H, Hindricks G, Cappato R, et al. HRS/EHRA/ECAS/APHRS/SOLAECE expert consensus statement on catheter and surgical ablation of atrial fibrillation. Heart Rhythm. 2017;14(10):e275-e444. doi:10.1016/j.hrthm.2017.05.012.
4. Thorpy MJ. Classification of Sleep Disorders. Neurotherapeutics. 2012;9(4):687-701. doi:10.1007/s13311-012-0145-6.
5. Ng CY, Liu T, Shehata M, et al. Meta-Analysis of Obstructive Sleep Apnea as Predictor of Atrial Fibrillation Recurrence After Catheter Ablation. Am J Cardiol. 2011;108(1):47-51. doi:10.1016/j.amjcard.2011.02.343.
6. Kasai T, Douglas B, Toronto T, et al. Obstructive Sleep Apnea and Heart Failure Pathophysiologic and Therapeutic Implications. Am J Cardiol. 2011;57(2):119-27. doi:10.1016/j.jacc.2010.08.627.
7. Давтян К. В., Арутюнян Г. Г., Топчян А. Г., Драпкина О. М. Эффективность катетерного лечения пароксизмальной формы фибрилляции предсердий у больных с сопутствующим обструктивным апноэ сна с проведением и без проведения СИПАП-терапии: результаты 12-месячного наблюдения. Кардиоваскулярная терапия и профилактика. 2020;19(2):2427. doi:10.15829/1728-8800-2020-2427.
8. Kapur VK, Auckley DH, Chowdhuri S, et al. Clinical Practice Guideline for Diagnostic Testing for Adult Obstructive Sleep Apnea: An American Academy of Sleep Medicine Clinical Practice Guideline. J Clin Sleep Med. 2017;13(3):479-504. doi:10.5664/JCSM.6506.
9. Providencia R, Defaye P, Lambiase PD, et al. Results from a multicentre comparison of cryoballoon vs. radiofrequency ablation for paroxysmal atrial fibrillation: is cryoablation more reproducible? Europace. 2017;19(1):48-57. doi:10.1093/europace/euw080.
10. Lau DH, Nattel S, Kalman JM, et al. Modifiable Risk Factors and Atrial Fibrillation. Circulation. 2017;136(6):583-96. doi:10.1161/CIRCULATIONAHA.116.023163.
11. Zhang L, Hou Y, Po SS. Obstructive Sleep Apnoea and Atrial Fibrillation. Arrhythmia & Electrophysiology Review. 2015:4(1):14-8. doi:10.15420/aer.2015.4.1.14.
12. Colish J, Walker JR, Elmayergi N, et al. Obstructive Sleep Apnea: Effects of Continuous Positive Airway Pressure on Cardiac Remodeling as Assessed by Cardiac Biomarkers, Echocardiography, and Cardiac MRI. Chest. 2012;141(3):674-81. doi:10.1378/CHEST.110615.
Об авторах
К. В. ДавтянРоссия
Карапет Воваевич Давтян — доктор медицинских наук, руководитель отдела нарушений ритма сердца и проводимости.
Москва
Конфликт интересов:
Является проктором компании Medtronic и Abbott
А. Г. Топчян
Россия
Арпи Грайровна Топчян — кандидат медицинских наук, научный сотрудник отдела нарушений ритма сердца и проводимости.
Москва
Конфликт интересов:
Отсутствие конфликта интересов
Г. Г. Арутюнян
Россия
Грайр Гагикович Арутюнян — врач-анестезиолог-реаниматолог, абитуриент отдела нарушений сердечного ритма и проводимости.
Москва
Конфликт интересов:
Отсутствие конфликта интересов
М. В. Агальцов
Россия
Михаил Викторович Агальцов — кандидат медицинских наук, старший научный сотрудник лаборатории кардиовизуализации, вегетативной регуляции и сомнологии.
Москва
Конфликт интересов:
Отсутствие конфликта интересов
О. М. Драпкина
Россия
Оксана Михайловна Драпкина — академик РАН, профессор, доктор медицинских наук, директор.
Москва
Конфликт интересов:
Отсутствие конфликта интересов
Дополнительные файлы
Рецензия
Для цитирования:
Давтян К.В., Топчян А.Г., Арутюнян Г.Г., Агальцов М.В., Драпкина О.М. Влияние CPAP терапии на ремоделирование левого предсердия у пациентов с пароксизмальной фибрилляцией предсердий и обструктивным апноэ сна, перенесших катетерную изоляцию легочных вен. Российский кардиологический журнал. 2022;27(7):5084. https://doi.org/10.15829/1560-4071-2022-5084
For citation:
Topchyan A.G., Davtyan K.V., Arutyunyan G.G., Agaltsov M.V., Drapkina O.M. Effect of CPAP therapy on left atrial remodeling in patients with paroxysmal atrial fibrillation and obstructive sleep apnea undergoing pulmonary vein isolation. Russian Journal of Cardiology. 2022;27(7):5084. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5084
JATS XML

















































