Перейти к:
Тромбоэмболия легочной артерии и фибрилляция предсердий: анализ данных Российского регистра “СИРЕНА”
https://doi.org/10.15829/1560-4071-2022-5035
Аннотация
Цель. Представить клиническую характеристику и госпитальный прогноз у пациентов с тромбоэмболией легочной артерии (ТЭЛА) и фибрилляцией предсердий (ФП).
Материал и методы. По инициативе рабочей группы врачей разработаны основные принципы наблюдательного проспективного исследования — регистра “СИРЕНА”.
Результаты. Среди включенных в регистр 660 пациентов, ФП диагностирована практически у каждого четвертого пациента — в 22,9% случаев (n=151), что отражает высокую частоту данной аритмии применительно к ТЭЛА. Распространенность ФП соответствовала частоте таких состояний, как хроническая сердечная недостаточность (ХСН) (23,2%; n=153), сахарный диабет (15,6%; n=103), артериальная гипертензия (АГ) (65,7%; n=400). Диагноз ФП у большинства пациентов основан на данных анамнеза (n=144; 95,4%), впервые зарегистрированный пароксизм ФП верифицирован у 7 пациентов (4,6%). Пациенты с ФП характеризовались более старшим возрастом, значимо более высокой представленностью ХСН (51,2%), АГ (80,8%), хронической болезни почек (18,5%), перенесенного инсульта или транзиторной ишемической атаки (23,2%). Важно отметить низкую частоту антикоагулянтной терапии (15,3%) в группе пациентов с ранее диагностированной ФП (n=144). Частота тромболитической терапии в группе пациентов с ФП была значимо ниже 13,9% vs 25,8% среди пациентов без ФП (р=0,026), что обусловлено наличием противопоказаний, гиподиагностикой ТЭЛА. Учитывая преимущественно старческий возраст, высокую коморбидность пациентов с ФП, а также отсутствие амбулаторной антикоагулянтной терапии, госпитальная летальность у пациентов с ТЭЛА и ФП равнялась 31,1% и достоверно отличалась от таковой в группе без ФП 12,6% (р=0,001). В общей группе посмертная диагностика ТЭЛА отмечена в 7,7% случаев (n=51), из них доля пациентов с ФП составила 54,9% (n=28). Возможным объяснением недооценки вероятности ТЭЛА у лиц с ФП было ошибочное объяснение проявлений ТЭЛА (тахипноэ, тахикардия, отеки нижних конечностей) за счет сопутствующей ХСН.
Заключение. Существование настороженности по наличию вероятной ТЭЛА у пожилых пациентов с ФП и проявлениями декомпенсации ХСН, своевременное назначение антикоагулянтной терапии позволят предотвратить как артериальную, так и венозную эмболию.
Ключевые слова
Для цитирования:
Алиева Э.Х., Сыромятникова Л.И., Эрлих А.Д., Шелудько В.С. Тромбоэмболия легочной артерии и фибрилляция предсердий: анализ данных Российского регистра “СИРЕНА”. Российский кардиологический журнал. 2022;27(7):5035. https://doi.org/10.15829/1560-4071-2022-5035
For citation:
Alieva E.Kh., Syromyatnikova L.I., Erlikh A.D., Sheludko V.S. Pulmonary embolism and atrial fibrillation: analysis of data from the SIRENA Russian registry. Russian Journal of Cardiology. 2022;27(7):5035. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5035
Тромбоэмболия легочной артерии (ТЭЛА) является одной из наиболее распространенных причин сердечно-сосудистой смертности. В эпидемиологических зарубежных исследованиях ежегодная заболеваемость ТЭЛА составляет до 39-115 человек на 100 тыс. населения [1][2], что несколько выше в сравнении с отечественными данными 35-40 человек на 100 тыс. [3]. При этом среди всех умерших прижизненный диагноз ТЭЛА установлен в 7% случаев vs 59% встречаемости данного диагноза по данным аутопсии [1][2], что требует изучения провоцирующих факторов развития ТЭЛА, установления причин, которые определяют гиподиагностику и неблагоприятный прогноз.
В последние годы уделяется повышенное внимание сосуществованию ТЭЛА и фибрилляции предсердий (ФП), т.к. развитие аритмии ассоциировано с двукратным увеличением риска возникновения венозных тромбоэмболических осложнений (ВТЭО), а наличие ВТЭО с почти 2-кратным увеличением риска формирования ФП [4][5]. Распространенность ФП у больных ТЭЛА составляет >18 тыс. на 100 тыс. человек [6]. Доказательства двунаправленной связи между возникновением ФП и ВТЭО получены в когортных исследованиях [6-12]. Оба состояния включают общие факторы риска, такие как пожилой возраст, ожирение, сердечную недостаточность [7][12-14]. Легочная эмболия определяет развитие ФП за счет перегрузки правых камер давлением на фоне обструкции легочных артерий, а также за счет высвобождения вазоконстрикторных медиаторов и воспалительных цитокинов. ФП, в свою очередь, может привести к тромбообразованию в ушке правого предсердия и как следствие к ТЭЛА [7][13][14]. При этом риск развития ФП или ВТЭО максимален в течение первых 5-6 мес. с момента постановки диагноза [7]. Наличие ФП в анамнезе или выявление данной аритмии на момент поступления пациента с ТЭЛА связано с увеличением риска смерти в течение одного и шести месяцев [6, 8].
Изложенное выше определило цель настоящей работы на примере данных регистра больных ТЭЛА “СИРЕНА” представить современную оценку взаимоотношения ТЭЛА и ФП.
Материал и методы
Исследование проведено на основании наблюдательного проспективного исследования — регистра “СИРЕНА”. Продолжительность включения пациентов составила 12 мес. — с 15.02.2018 по 15.04.2019 годов. Принципы организации регистра, критерии включения и невключения, основные анамнестические и клинические характеристики пациентов опубликованы ранее [15]. Протокол исследования одобрен Этическим комитетом участвующих клинических центров. В регистр включались пациенты, госпитализированные с подозрением на ТЭЛА либо на другое заболевание, “маскирующее” ТЭЛА; а также умершие в стационаре, у которых ТЭЛА установлена при проведении патологоанатомического исследования. Основанием для исключения случая из регистра являлась смерть пациента с заключительным клиническим диагнозом “ТЭЛА”, при отсутствии объективных признаков, подтверждающих данный диагноз, и невыполнении патологоанатомического исследования. Прижизненное включение пациента в регистр осуществлялось на основании его письменного добровольного информированного согласия.
Статистическая обработка данных выполнена с помощью встроенного пакета анализа табличного процессора Excel 2016 MSO, авторского пакета прикладных электронных таблиц “Stat2015”. При оценке статистической достоверности различий (р) в независимых выборках для количественных признаков (при нормальном распределении) применяли сравнение средних (M) с помощью параметрических критериев — двухвыборочный t-критерий, при отсутствии нормального распределения применялся U-критерий Манна-Уитни (U). Для анализа качественных признаков применяли абсолютные частоты встречаемости, показатели распределения (%) и стандартную ошибку относительных долей (m). При оценке статистической достоверности различий (р) использовали критерий хи-квадрат (χ2). Различия считались достоверными при уровне значимости р<0,05.
Результаты
Среди включенных в регистр 660 пациентов ФП диагностирована практически у каждого четвертого пациента — в 22,9% случаев (n=151), что отражает высокую частоту аритмии применительно к ТЭЛА. Распространенность ФП соответствовала частоте таких состояний, как хроническая сердечная недостаточность (ХСН) (23,2%; n=153), сахарный диабет (СД) (15,6%; n=103), артериальная гипертензия (АГ) (65,7%; n=400). Диагноз ФП у большинства пациентов основан на данных анамнеза (n=144; 95,4%) и подтверждался на основании исходной электрокардиографии у 10 пациентов с ТЭЛА (6,6%). Впервые зарегистрированный пароксизм ФП, возможно, как осложнение ТЭЛА, верифицирован у 7 пациентов (4,6%) (рис. 1).

Рис. 1. Распределение пациентов группы ФП в зависимости от количества баллов по шкале CHA2DS2-VASc (абсолютное количество).
В зависимости от наличия/отсутствия ФП сравнение двух групп различий по полу, анамнезу ранее перенесенной ТЭЛА не выявило (табл. 1). При этом пациенты с ФП характеризовались более старшим возрастом 73,0 vs 63,0 лет (р=0,0001), представленностью коморбидной патологии, такой как ХСН, АГ (80,8%), хроническая болезнь почек (ХБП) (18,5%), перенесенный инсульт или транзиторная ишемическая атака (ТИА) (23,2%), иные атеросклероз ассоциированные сердечно-сосудистые заболевания (21,2%) при сопоставимой частоте СД, хроническая обструктивная болезнь легких, варикозной болезни и хирургических вмешательств. Пациентов с ФП характеризовала более высокая частота иммобилизации в течение последнего года, что может быть проявлением старческой астении у лиц более старшей возрастной категории с высоким процентом коморбидности. Таким образом, высокая частота сочетания ФП и ВТЭО, с одной стороны, отражает патогенез ФП как возраст-ассоциированного состояния, а с другой — возможный вклад аритмии в патогенез ВТЭО.
По клиническим признакам пациенты с ТЭЛА в зависимости от наличия/отсутствия ФП не различались (табл. 2). При объективном обследовании пациенты с аритмией имели проявления, характерные для декомпенсации ХСН, в виде наличия симметричного отека нижних конечностей (p=0,005), тахикардии (p=0,0001), тахипноэ (р=0,03), влажных хрипов в проекции нижних отделов легких (p=0,005) при сопоставимых значениях гемодинамики (табл. 3).
Различий лабораторных показателей по параметрам общего анализа крови не выявлено. Значимый вклад ФП в формирование почечной дисфункции проявился ростом значений креатинина (р=0,001) и медианы скорости клубочковой фильтрации, что соответствовало 3а стадии ХБП (р=0,001) (табл. 4). Сравниваемые группы были сопоставимы по выраженности миокардиального повреждения; доля лиц с повышенным уровнем тропонина не превышала 33%. Гипертромбинемия по показателю D-димера установлена у 9 из 10 пациентов с ТЭЛА вне зависимости от наличия ФП. Однако необходимо отметить, что исследование тропонина и D-димера проведено не во всей группе, а в 57,4 и 47,5% случаев, соответственно.
По данным электрокардиографии нарушения проводимости в виде полной блокады левой ножки пучка Гиса чаще встречались у пациентов с ФП 11,3% vs 4,1% (р=0,022), как и нарушение процессов реполяризации в виде смещения сегмента ST 23,2% vs 11,2% (р=0,025), при отсутствии различий по полярности зубца Т, а также по доле лиц с деполяризацией желудочков в виде характерного комплекса SIQIII 20,5% и 25,3% (р=0,37), соответственно.
Анализ ультразвукового исследования, которое выполнено в 85,3% случаев, выявил достоверное снижение фракции выброса левого желудочка у лиц с ФП 53% vs 59% (р=0,0001), более выраженные признаки патологического ремоделирования правых камер сердца в виде атриомегалии, роста среднего систолического давления в легочной артерии 54,0 vs 48,0 мм рт.ст. (р=0,003) (табл. 5).
Таблица 1
Характеристики пациентов с ТЭЛА в зависимости от наличия/отсутствия ФП

Примечание: показатели указаны в форме числа пациентов и доли от общего числа в каждой группе.
Сокращения: АГ — артериальная гипертензия, ЗНО — злокачественное новообразование, СД — сахарный диабет, ССЗ — другие сердечно-сосудистые заболевания в анамнезе (стенокардия, стеноз), ТГВ — тромбоз глубоких вен, ТИА — транзиторная ишемическая атака, ТЭЛА — тромбоэмболия легочной артерии, ФП — фибрилляция предсердий, ХБП — хроническая болезнь почек, ХСН — хроническая сердечная недостаточность, ХОБЛ — хроническая обструктивная болезнь легких.
Таблица 2
Клинические признаки на момент госпитализации в сравниваемых группах

Сокращения: ТЭЛА — тромбоэмболия легочной артерии, ФП — фибрилляция предсердий.
Таблица 3
Результаты объективного обследования пациентов с ТЭЛА в зависимости от наличия ФП

Сокращения: АД — артериальное давление, ТЭЛА — тромбоэмболия легочной артерии, ФП — фибрилляция предсердий, ЧДД — частота дыхательных движений в минуту, ЧСС — частота сердечных сокращений в минуту.
Таблица 4
Результаты лабораторных исследований у пациентов с ТЭЛА в зависимости от наличия ФП

Сокращения: МНО — международное нормализованное отношение, СКФ — скорость клубочковой фильтрации, ТЭЛА — тромбоэмболия легочной артерии, ФП — фибрилляция предсердий.
Таблица 5
Данные эхокардиографических исследований в группах
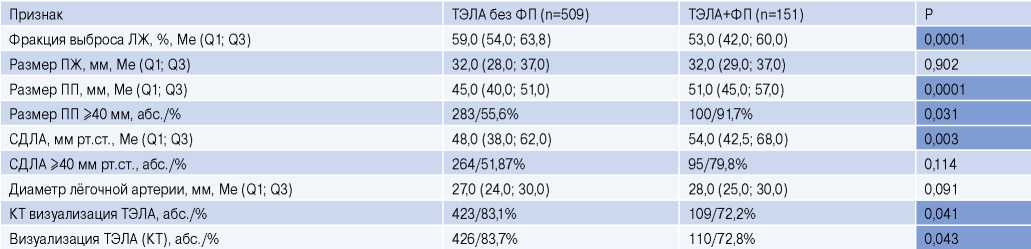
Сокращения: КТ — компьютерная томография, ЛЖ — левый желудочек, ПЖ — правый желудочек, ПП — правое предсердие, СДЛА — систолическое давление в легочной артерии, ТЭЛА — тромбоэмболия легочной артерии, ФП — фибрилляция предсердий.
Таблица 6
Медикаментозная терапия, проводимая в группах

Сокращения: ИВЛ — искуственная вентиляция легких, МНО — международное нормализованное отношение, НМГ — низкомолекулярный гепарин, НОАК — новые оральные антикоагулянты, НФГ — нефракционированный гепарин, ТЛТ — тромболитическая терапия, ТЭЛА — тромбоэмболия легочной артерии, ФП — фибрилляция предсердий.
Таблица 7
Подекадное распределение частоты ТЭЛА, летальности, посмертной диагностики ТЭЛА в анализируемых группах

Примечание: * — доля от общей группы, ** — летальность в исследуемых группах, *** — доля лиц с посмертной диагностикой ТЭЛА среди умерших.
Сокращения: ТЭЛА — тромбоэмболия легочной артерии, ФП — фибрилляция предсердий.
В группе ТЭЛА без ФП антитромботическая терапия до поступления в стационар имела место среди 87 человек из 509 пациентов (17,0%). Важно отметить, что антитромботическая терапия из 37 пациентов с перенесенным инсультом/ТИА проводилась в 24,3% случаев (9 человек). Так, прямой пероральный антикоагулянт (ПОАК) принимал 1 человек, ацетилсалициловую кислоту — 7, клопидогрел — 1. На догоспитальном этапе в группе ТЭЛА и ФП антикоагулянт или антиагрегант принимал 51 пациент из 144 человек с подтвержденной ранее ФП, что соответствовало 35,4%, а применительно к антикоагулянтной терапии — 22 человека (15,3%) (!). В группе с ФП перенесенный инсульт/ТИА диагностированы у 35 больных (23,2%), что повышало вероятность назначения антикоагулянтной поддержки. Однако только 4 человека (14,2%) принимали ПОАК (ривароксабан или дабигатрана этексилат) или парентеральный антикоагулянт (n=1). Ацетилсалициловую кислоту или клопидогрел принимали 7 пациентов с ФП и перенесенными ранее инсультом/ТИА (20%).
При поступлении в стационар частота проведения тромболитической терапии (ТЛТ) в группе пациентов без аритмии равнялась 25,8% (n=131) vs 13,9% (n=21) (р=0,026) в группе с ФП, при более высокой потребности в инсуфляции кислорода 63% vs 50% случаев (р=0,012) (табл. 6). Различие по частоте использования ТЛТ может быть объяснено наличием противопоказаний для ТЛТ у возрастной категории пациентов при наличии коморбидной патологии, а также гиподиагностикой ТЭЛА. За исключением различий по ТЛТ иные варианты антитромботической поддержки (нефракционированный/низкомолекулярный гепарин, варфарин, ПОАК) в рассматриваемых группах были сопоставимы.
Особенностью группы пациентов с ФП была низкая частота прижизненной диагностики ВТЭО. В общей группе посмертная диагностика ТЭЛА имела место в 7,7% случаев (n=51), из них доля пациентов с ФП составила 54,9% (n=28). Умершие пациенты с ТЭЛА и ФП имели старший возраст 81,1±9,5 лет (min-max — 55-94 года) vs 69,8±13,2 лет (min-max — 37-92 года) в группе без аритмии (р=0,006). Возможно утверждать, что гиподиагностика ТЭЛА у лиц с ФП не может быть объяснена атипичным течением заболевания, т.к. по представленности клинических проявлений группы были сопоставимы (табл. 2). С другой стороны, возможным объяснением недооценки вероятности ТЭЛА у лиц с ФП было ошибочное объяснение клинических проявлений ТЭЛА за счет коморбидной патологии, такой как ХСН, АГ. Малую специфичность проявлений ТЭЛА при наличии ФП как маркера коморбидной патологии отражает тот факт, что совпадение заключительного и патологоанатомических диагнозов зафиксировано в 62,5% vs 43,7% случаев (р=0,001) в группе без нарушенного ритма в сравнении с группой с ФП, соответственно.
Учитывая представленные выше характеристики пациентов с ФП, а также отсутствие амбулаторной антикоагулянтной терапии, госпитальная летальность у пациентов с ТЭЛА и ФП была высокой, равняясь 31,1%, достоверно отличалась от таковой в группе без ФП 12,6% (р=0,001). В зависимости от наличия/отсутствия ФП проведена оценка частоты ТЭЛА по возрастным декадам, а также летальности в группах, доли случаев с посмертной диагностикой ТЭЛА (табл. 7).
Обсуждение
Подтверждение факта двунаправленной взаимосвязи между ТЭЛА и ФП в регистре “СИРЕНА” представлено высокой распространенностью аритмии среди пациентов с ТЭЛА, равной 22,9%, что согласуется с данными других авторов [7][13]. Частота развития ФП среди больных ТЭЛА значимо выше данного показателя в общей популяции, варьирующего в интервале 0,4-3,0% [5][6]. В проспективном исследовании в Тромсё в течение 16 лет наблюдения обнаружено, что случай ВТЭО связан с будущим риском ФП (отношение рисков 1,63; 95% доверительный интервал 1,22-2,17) [15], что подтверждает гипотезу о ТЭЛА как драйвере развития ФП с максимально высоким риском возникновения аритмии в первые 6 мес. после индексного события ВТЭО.
Необходимо отметить, что если в общей популяции пациентов с ФП пропорция женщин и мужчин составляет 1,5 к 1, то применительно к популяции больных ТЭЛА данное соотношение равняется 1:1. Ряд клинических признаков, таких как одышка, боль в груди, кровохарканье, синкопальное состояние, десатурация и тахикардия, являются проявлениями как ТЭЛА, так и декомпенсации ХСН на фоне ФП. Схожая клиническая картина определяла гиподиагностику ТЭЛА у больных с ФП, так частота госпитализаций с подозрением на ТЭЛА на 18,1% была выше в группе без сопутствующей ФП (62,5% vs 44,4%). Ошибочное ограничение диагностического поиска у пациента с ФП и проявлениями ХСН ведет к поздней диагностике ТЭЛА. Посмертное включение в регистр чаще отмечалось в группе пациентов при наличии ФП 61,7% vs 35,9%.
Интересно отметить, что имеются данные о более низкой частоте тромбозов глубоких вен у пациентов ФП [7][11], эти результаты согласуются с представлением о том, что тромбы могут возникать не только в системе глубоких вен, но, возможно, и в правых отделах сердца или образовываться de novo в крупных артериях легких. Однако в нашей работе различий по частоте тромбоза глубоких вен в группах в зависимости от наличия/отсутствия ФП не выявлено. Другим заслуживающим внимания предположением, требующим дополнительного исследования, является то, что система оценки CHA2DS2-VASc может быть более чувствительной для прогнозирования риска и стратификации ВТЭО у пациентов с ФП [11], а риск ТЭЛА следует учитывать у пациентов с впервые возникшей ФП или с ФП в анамнезе.
Наличие ФП у пациентов с ТЭЛА является независимым предиктором летальности [8]. Данный факт отражает клиническую значимость понимания взаимосвязи между ФП и ТЭЛА. В данной работе продемонстрировано, что наличие ФП при таких сопутствующих факторах, как пожилой и старческий возраст, ХСН, АГ, инсульт и/или ТИА, ХБП, является дополнительным маркером и фактором риска развития ТЭЛА. По данным регистра “СИРЕНА”, сочетание ФП и ТЭЛА определяет неблагоприятный жизненный прогноз на госпитальном этапе у каждого третьего пациента (31,3%). Данная ситуация может быть оптимизирована за счет своевременного назначения адекватной антитромботической поддержки. Можно утверждать, что неблагоприятный прогноз у больных с ФП и развившейся ТЭЛА обусловлен крайне низкой частотой амбулаторной антикоагулянтной терапии, равной 15,3%, при наличии к ней абсолютных показаний. Амбулаторная антитромботическая терапия (антиагрегант/ПОАК) у пациентов с перенесенным инсультом/ ТИА при отсутствии ФП проводилась только в 24,3% случаев, при наличии ФП в 31,4% случаев. Однако доля лиц с назначенной антикоагулянтной терапией при наличии ФП и инсульта в анамнезе не превышала 15% (!), другая половина пациентов с ФП находилась на неэффективной антиагрегантной терапии.
Ограничения исследования. Регистровый характер исследования с включением разнородной категории пациентов, ограничением периода наблюдения госпитальным этапом. Дополнительными ограничениями являлись отсутствие количественной оценки D-димера и тропонина в 100% случаев, а также облигатной у всех пациентов более развернутой ультразвуковой характеристики дисфункции правых камер (TAPSE, скоростные характеристики кровотока и т.д.), что позволило бы более точно детализировать взаимосвязь патогенеза ТЭЛА и ФП.
Заключение
Причинно-следственная связь между ТЭЛА и ФП обусловлена развитием перегрузки правых камер, высвобождением вазоконстрикторных медиаторов и воспалительных цитокинов, возникновением замедленного кровотока в правом предсердии на фоне аритмии, ведущего к тромбообразованию в правом предсердии с последующей легочной эмболией. Наличие ФП ассоциировано с более старшим возрастом, высоким уровнем коморбидности пациентов, низкой частотой амбулаторной антикоагулянтной терапии, гиподиагностикой ТЭЛА и как следствие неблагоприятным госпитальным исходом в 31,3% случаев. Необходимо формирование настороженности по развитию вероятной ТЭЛА у пожилых пациентов с ФП и проявлениями декомпенсации ХСН, а также усилить работу по своевременному назначению антикоагулянтной терапии при выявлении ФП. У пациентов с ФП своевременное назначение антикоагулянтной терапии и поддержание высокой приверженности к ней позволит улучшить прогноз по риску развития как артериальной, так и венозной эмболии.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Konstantinides SV, Meyer G, Becattini C, et al. Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020;41(4):543-603. doi:10.1093/eurheartj/ehz405.
2. Чазова И. Е., Мартынюк Т. В., Валиева З. С. и др. Евразийские рекомендации по диагностике и лечению хронической тромбоэмболической легочной гипертензии (2020). Евразийский Кардиологический Журнал. 2021;(1):6-43. doi:10.38109/2225-16852021-1-6-43.
3. Никулина Н. Н., Тереховская Ю. В. Эпидемиология тромбоэмболии легочной артерии в современном мире: анализ заболеваемости, смертности и проблем их изучения. Российский кардиологический журнал. 2019;(6):103-8. doi:10.15829/1560-4071-2019-6-103-108.
4. Bikdeli B, Jiménez D. Atrial fibrillation in the course of pulmonary embolism: just a little smoke, or fuel to the fire? J Intern Med. 2020;287:114-6. doi:10.1111/joim.12999.
5. Waleed KB, Guan X, Li X, et al. Atrial fibrillation is related to lower incidence of deep venous thrombosis in patients with pulmonary embolism. J Thorac Dis. 2018;10(3):1476-82. doi:10.21037/jtd.2018.01.177.
6. Lohani S, Tachamo N, Timilsina B, Nazir S. Pulmonary embolism and atrial fibrillation: A complicated relationship. Int J Case Rep Images. 2017;8(6):376-9. doi:10.5348%2fijcri201751-CR-10790.
7. Lutsey PL, Norby FL, Alonso A, et al. Atrial fibrillation and venous thromboembolism: evidence of bidirectionality in the Atherosclerosis Risk in Communities Study. Journal of Thrombosis and Haemostasis. 2018;16:670-9. doi:10.1111/jth.13974.
8. Enga KF, Rye-Holmboe I, Hald EM, et al. Atrial fibrillation and future risk of venous thromboembolism: The Tromso study. J Thromb Haemost. 2015;13(1):10-6. doi:10.1111/jth.12762.
9. Ptaszynska-Kopczynska K, Kiluk I, Sobkowicz B. Atrial Fibrillation in Patients with Acute Pulmonary Embolism: Clinical Significance and Impact on Prognosis. Biomed Res Int. 2019;2019:7846291. doi:10.1155/2019/7846291.
10. Bai Y, Yue QM, Sun H, et al. Prevalence and sex- and age-related risk of pulmonary embolism in in-hospital patients with atrial fibrillation: a multicenter retrospective study from China. Ann Transl Med. 2020;8(23):1558. doi:10.21037/atm-20-2718.
11. Liu D, Shi S, Liu X, et al. Retrospective cohort study of new-onset atrial fibrillation in acute pulmonary embolism on prognosis. BMJ Open. 2021;11:e047658. doi:10.1136/ bmjopen-2020-047658.
12. Bikdeli B, Abou Ziki MD, Lip GYH. Pulmonary Embolism and Atrial Fibrillation: Two Sides of the Same Coin? A Systematic Review. Semin Thromb Hemost. 2017;43:849-63. doi:10.1055/s-0036-1598005.
13. Lin Y-S, Lin M-S, Wu VC-C, et al. Differential Presentations of Arterial Thromboembolic Events Between Venous Thromboembolism and Atrial Fibrillation Patients. Frontiers in cardiovascular medicine. 2021;8:775564. doi:10.3389%2Ffcvm.2021.775564.
14. Krajewska A, Ptaszynska-Kopczynska K, Kiluk I, et al. Paroxysmal atrial fibrillation in the course of acute pulmonary embolism: clinical significance and impact on prognosis. BioMed Research International. 2017;2017:5049802. doi:10.1155/2017/5049802.
15. Эрлих А. Д., Атаканова А. Н., Дупляков Д. В. и др. Российский регистр острой тромбоэмболии лёгочной артерии СИРЕНА: характеристика пациентов и лечение в стационаре. Российский кардиологический журнал. 2020;25(10):3849. doi:10.15829/1560-4071-2020-3849.
Об авторах
Э. Х. АлиеваРоссия
Эльза Халеддиновна Алиева — врач-кардиолог, соискатель.
Пермь
Конфликт интересов:
нет
Л. И. Сыромятникова
Россия
Людмила Илариевна Сыромятникова — доктор медицинских наук, профессор кафедры пропедевтики внутренних болезней, врач-кардиолог высшей квалификационной категории; руководитель сосудистого центра регионального сосудистого центра.
Пермь
Конфликт интересов:
нет
А. Д. Эрлих
Россия
Алексей Дмитриевич Эрлих — доктор медицинских наук, профессор кафедры факультетской терапии лечебного факультета; зав. отделением реанимации и интенсивной терапии, врач анестезиолог-реаниматолог высшей категории.
Москва
Конфликт интересов:
нет
В. С. Шелудько
Валерий Степанович Шелудько — научный сотрудник, специалист по статистике.
Пермь
Конфликт интересов:
нет
Дополнительные файлы
Рецензия
Для цитирования:
Алиева Э.Х., Сыромятникова Л.И., Эрлих А.Д., Шелудько В.С. Тромбоэмболия легочной артерии и фибрилляция предсердий: анализ данных Российского регистра “СИРЕНА”. Российский кардиологический журнал. 2022;27(7):5035. https://doi.org/10.15829/1560-4071-2022-5035
For citation:
Alieva E.Kh., Syromyatnikova L.I., Erlikh A.D., Sheludko V.S. Pulmonary embolism and atrial fibrillation: analysis of data from the SIRENA Russian registry. Russian Journal of Cardiology. 2022;27(7):5035. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5035
JATS XML

















































