Перейти к:
Первый опыт применения технологии спекл-трекинг эхокардиографии в двумерном режиме для оценки связи нарушения деформации левого предсердия с фибрилляцией предсердий после коронарного шунтирования
https://doi.org/10.15829/1560-4071-2022-5026
Аннотация
Цель. Изучить деформационные показатели левого предсердия (ЛП) у кандидатов на коронарное шунтирование (КШ) и оценить их возможную связь с фибрилляцией предсердий (ФП), возникшей впервые после изолированного КШ.
Материал и методы. Включено 70 больных без зарегистрированной ФП в анамнезе, средний возраст 65±8 лет, 80% мужчин. Проведена предоперационная эхокардиография (ЭхоКГ) с оценкой деформации ЛП, используя технологию спекл-трекинг ЭхоКГ (СТЭ) с оценкой деформации ЛП в фазы: резервуара — PALS, кондуита — ALS early и насоса — ALS late. Рассмотрены 2 группы: без послеоперационной ФП (ПОФП) (n=50) — больные без зарегистрированного пароксизма ФП после КШ, и с ПОФП (n=20) — больные с выявленной ФП в послеоперационном периоде. Послеоперационная оценка ритма: ежедневная регистрация электрокардиограммы (ЭКГ), непрерывное прикроватное мониторирование ЭКГ до 3 сут., холтеровское мониторирование (ЭКГ) — на 4-5-е сут. после КШ. Медиана наблюдения составила 9 (7; 11) сут.
Результаты. ПОФП развилась у 20/70 (29%) больных. Клинико-демографические и интраоперационные параметры КШ в группах без ПОФП и с ПОФП были сопоставимы. ЭхоКГ параметры в исследуемых группах также равнозначны; объем ЛП (57,0±8,7 vs 60,0±12,1, соответственно), размер ЛП (3,9±0,3 vs 3,9±0,2, соответственно). Анализ параметров деформации показал достоверное их снижение в группе с ПОФП по сравнению с группой без ПОФП: PALS (20,4±3,1 vs 27,8±3,0, соответственно), ALS early (8,50±1,5 vs 11,8±1,7, соответственно), ALS late (-0,2±0,7 vs -1,0±1,0). ROC-анализа установил прогностическую ценность параметра PALS: значение ≤23,0% с чувствительностью 90% и специфичностью 78% явилось предиктором ПОФП.
Заключение. Традиционные ЭхоКГ предикторы (размер и объем ЛП), указывающие на высокий риск возникновения ПОФП, не могут корректно оценивать риск впервые возникшей послеоперационной аритмии. ФП после КШ, вероятно, связана с имеющейся субклинической дисфункцией ЛП как следствие структурных изменений на фоне хронической ишемической болезни сердца. В нашем исследовании показано, что снижение параметров деформации ЛП по данным СТЭ ассоциировано с развитием ПОФП. Необходимы дальнейшие исследования для оценки эффективности метода СТЭ; такая оценка внесет существенный вклад в возможности прогнозирования ПОФП.
Ключевые слова
Для цитирования:
Ганаев К.Г., Власова Э.Е., Авалян А.А., Саидова М.А., Акчурин Р.С. Первый опыт применения технологии спекл-трекинг эхокардиографии в двумерном режиме для оценки связи нарушения деформации левого предсердия с фибрилляцией предсердий после коронарного шунтирования. Российский кардиологический журнал. 2022;27(7):5026. https://doi.org/10.15829/1560-4071-2022-5026
For citation:
Ganaev K.G., Vlasova E.E., Avalyan A.A., Saidova M.A., Akchurin R.S. First experience of using two-dimensional speckle-tracking echocardiography to assess the association of left atrial strain with atrial fibrillation after coronary artery bypass grafting. Russian Journal of Cardiology. 2022;27(7):5026. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5026
Послеоперационная фибрилляция предсердий (ПОФП) является наиболее распространенной аритмией после операции коронарного шунтирования (КШ): частота варьирует от 20 до 40% [1]. Заболеваемость ПОФП возросла за последние два десятилетия [2]. Рост частоты аритмии в послеоперационном периоде, возможно, в значительной степени связан с увеличением общей продолжительности жизни населения: пациент в клинике и в операционной становится более коморбидным. ПОФП в большинстве случаев протекает доброкачественно: бессимптомный пароксизм спонтанно купируется в течение ≤24 ч. Однако аритмия в раннем периоде после операции приводит к дополнительному медицинскому уходу, что нередко удлиняет пребывание больного в стационаре и увеличивает затраты. Фибрилляция предсердий (ФП) после КШ повышает риск гемодинамической нестабильности, тромбоэмболических событий и закономерно увеличивает общую заболеваемость и смертность после операции КШ [3]. Большинство эпизодов ФП происходит в течение первой послеоперационной недели с пиком заболеваемости на 2-4-е сут. послеоперационного периода [2]. Среди множества факторов риска возникновения ПОФП можно выделить: пожилой возраст, эпизод мерцательной аритмии в анамнезе, снижение функции левого желудочка, увеличение левого предсердия (ЛП), сахарный диабет и ожирение [4][7]. Выявление пациентов с высоким риском ПОФП остается сложной задачей. Клиническая полезность большинства общепринятых факторов, например,
возраста, эхокардиографических (ЭхоКГ) и электрокардиографических (ЭКГ) предикторов или сопутствующей патологии, увеличивающих вероятность возникновения аритмии, низкая. Попытки построить логистические регрессионные модели на основе до- и интраоперационных переменных также не смогли предоставить надежные предикторы для прогнозирования риска развития ПОФП. Из относительно новых предикторов следует выделить нарушение деформации ЛП [8]. Наиболее современным методом изучения параметров деформации предсердий и желудочков является технология спекл-трекинг ЭхоКГ (СТЭ), которая позволяет быстро и воспроизводимо дать оценку параметрам деформации камер сердца. Хорошо известно об использовании СТЭ при оценке состояния желудочков сердца у больных ишемической болезнью сердца [9], хронической сердечной недостаточностью [10], а также при оценке деформации предсердий после катетерной деструкции аритмогенных зон у больных с ФП [11][12].
Настоящее исследование предпринято в связи с предположением, что деформационные свойства предсердий сопряжены с развитием ПОФП. Продемонстрирован первый опыт использования технологии СТЭ в нашей стране как метода оценки деформации — фактора, ассоциированного с развитием ФП после КШ.
Цель исследования — изучить деформационные показатели ЛП у кандидатов на КШ и оценить их возможную связь с ФП, возникшей впервые после изолированного КШ.
Материал и методы
Исследование являлось проспективным. Включены больные, прооперированные в ОССХ ФГБУ “НМИЦК им. акад. Е. И. Чазова” Минздрава России в период с 2020 по 2021гг. Критерии включения — изолированное КШ с достижением полной реваскуляризации. Критерии исключения — документированное наличие ФП в анамнезе, клапанная дисфункция умеренной и тяжелой степени, гормональная дисфункция щитовидной железы, исходная хроническая сердечная недостаточность, развитие периоперационных осложнений (инфаркт миокарда, острая сердечная и дыхательная недостаточность, значимая кровопотеря), умершие в течение первых 5 сут. послеоперационного периода без зарегистрированного пароксизма ФП. Таким образом, в исследование включено 70 больных. Исследование было выполнено в соответствии со стандартами надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации. Протокол исследования был одобрен локальным этическим комитетом “НМИЦ кардиологии им. акад. Е.И. Чазова”. До включения в исследование у всех участников было получено письменное информированное добровольное согласие. Показаниями к операции являлись наличие “стволового” и/или многососудистого поражения коронарных артерий, Syntax-score >22, стенокардия напряжения или доказанная безболевая ишемия миокарда (по данным визуализирующих методов исследования). Все операции КШ выполнялись on-pump в условиях кардиоплегии и гипотермии. Периоперационное ведение было стандартным у всех больных; в послеоперационном периоде все больные получали бета-блокатор (бисопролол) 1,25-5 мг в сут., начиная с 1-х сут. после операции. Послеоперационное наблюдение за ритмом происходило путем непрерывного прикроватного мониторирования ЭКГ в течение 4 сут., ежедневной плановой регистрации ЭКГ, 24-ч холтеровского мониторирования ЭКГ на 5-6 сут. после КШ, а также дополнительных регистраций ЭКГ при симптомах аритмии. ПОФП определялась как эпизод неправильного ритма в отсутствии зубцов P, зарегистрированная на 12-канальной ЭКГ, продолжительностью ≥30 сек. Длительность наблюдения — послеоперационный госпитальный период.
Определена частота развития впервые выявленной ФП после КШ. Был проведен анализ по двум группам — с документально подтвержденной ПОФП (1 группа) и без возникновения ПОФП (2 группа). Оценены: дооперационные клинико-лабораторные показатели, наличие сопутствующих заболеваний, показатели ЭхоКГ, в т.ч. деформационные характеристики. Все полученные данные сопоставлены с частотой развития ПОФП (рис. 1).
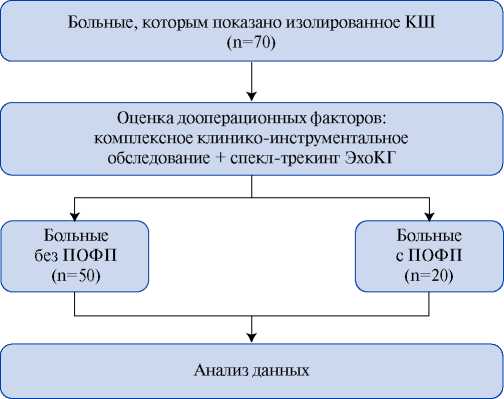
Рис. 1. Представлен дизайн исследования.
Сокращения: КШ — коронарное шунтирование, ПОФП — послеоперационная фибрилляция предсердий, ЭхоКГ — эхокардиография.
Для анализа деформационных свойств ЛП больным на предоперационном этапе выполнялась СТЭ. Всем участникам исследования трансторакальная ЭхоКГ проводилась на ультразвуковом приборе экспертного класса Vivid E9 (GE Healthcare, США) с использованием датчика M5S-D для регистрации изображений в 2D режиме. Для определения фаз сердечного цикла во время исследования выполнялась синхронная запись ЭКГ. Исследование проводилось с использованием стандартных эхокардиографических доступов и режимов по стандартной методике: определялись качественные и количественные показатели, согласно рекомендациям по оценке структуры и функции камер сердца [13]. В последующем изображения обрабатывались с помощью программы EchoPAC PC (GE Healthcare, США). C этой целью выполнялась запись цифровых кинопетель из апикального доступа в 4- и 2-камерной позициях на CD-R носитель с последующим переносом данных на компьютерную станцию обработки. Всем участникам исследования проводился анализ продольной деформации ЛП в трех фазах — кондуитная, резервуарная и контрактильная. В качестве исходной точки для регистрации данных деформации ЛП принимался зубец R на ЭКГ (рис. 2).
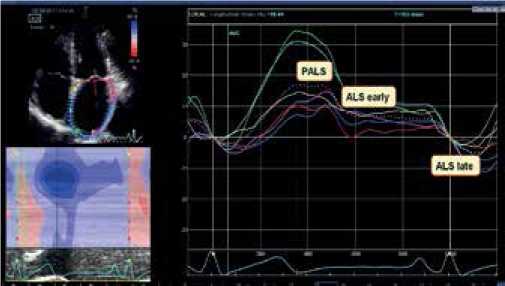
Рис. 2. Технология СТЭ в двумерном режиме ЛП в оценки показателей деформации.
Примечание: PALS — деформация ЛП в фазу резервуара, ALS early — деформация ЛП в фазу кондуита, ALS late — деформация ЛП в насосную фазу.
Сокращение: ЛП — левое предсердие.
Статистический анализ. Статистическая обработка данных выполнена с использованием программы Statistica 10. Перед началом анализа количественных данных проведена их проверка на нормальность распределения (визуальный анализ гистограммы, асимметрия, эксцесс, коэффициент вариации, критерий Колмогорова-Смирнова). Количественные переменные представлены в виде среднего арифметического (M) и стандартного отклонения (SD). Частота выявления признака представлена в виде абсолютного (n) и относительного значения (%). При сравнении двух независимых групп по количественным признакам использован параметрический критерий Стьюдента. Анализ сопряженности качественных признаков в группах проведен с помощью критерия χ2. Различия считали статистически значимыми при p<0,05. Для оценки прогностической значимости параметров СТЭ применялся ROC-анализ.
Результаты
Исходная характеристика больных групп без ПОФП и с ПОФП представлены в таблицах 1 и 2. Впервые выявленная ПОФП была зарегистрирована в 29% (n=20) случаев. Большинство в обеих группах составили мужчины: 84% (42 из 50) в группе без ПОФП и 70% (14 из 20) в группе с ПОФП. Средний возраст составил 63,2±8,4 лет среди больных без ПОФП и 66,9±7,7 лет у больных с ПОФП.
Таблица 1
Клинико-демографическая характеристика исследуемых групп
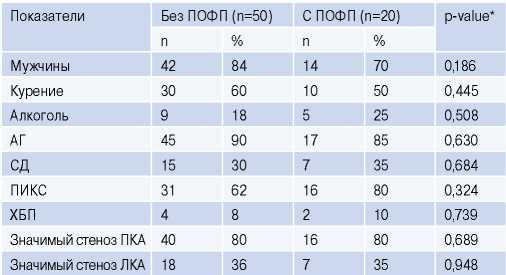
Примечание: * — различия считались достоверными при уровне статистической значимости p<0,05.
Сокращения: АГ — артериальная гипертензия, ЛКА — левая коронарная артерия, ПИКС — постинфарктный кардиосклероз, ПКА — правая коронарная артерия, ПОФП — послеоперационная фибрилляция предсердий, СД — сахарный диабет, ХБП — хроническая болезнь почек.
Таблица 2
Клинико-инструментальная характеристика включенных больных
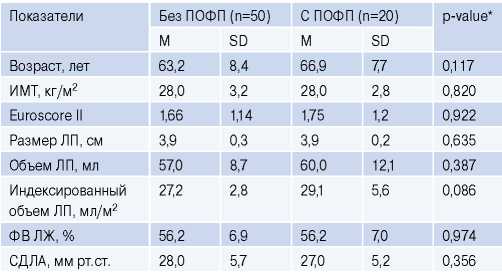
Сокращения: ИМТ — индекс массы тела, ЛП — левое предсердие, ПОФП — послеоперационная фибрилляция предсердий, СДЛА — систолическое давление в легочной артерии, ФВ ЛЖ — фракция выброса левого желудочка, EuroSCORE (European System for Cardiac Operative Risk Evaluation) — шкала оценки риска кардиохирургических операций, M — среднее значение, SD — стандартное отклонение.
Общепринятые факторы риска развития ишемической болезни сердца (курение, артериальная гипертензия и сахарный диабет) встречались в группах с сопоставимой частотой; также не наблюдалось значительных различий между двумя группами в отношении наличия хронической болезни почек, ранее перенесенного инфаркта миокарда и другими сопутствующим заболеваниями.
В исследовании анализу также подвергались интраоперациоонные параметры (индекс реваскуляризации, время ишемии и длительность искусственного кровообращения) в группах без и с ПОФП, результаты подробно представлены в нашей предыдущей публикации [14].
Статистических значимых различий по показателям ЭхоКГ (размер и объем ЛП, фракция выброса левого желудочка, систолическое давление в легочной артерии) при сравнении обеих групп не выявлено.
Анализ параметров СТЭ выявил, что у больных с ПОФП отмечалось достоверное снижение дооперационных показателей деформации ЛП по сравнению с показателями деформации ЛП в группе без ПОФП (табл. 3, рис. 3).
Таблица 3
Показатели деформации в группах с ПОФП и без ПОФП
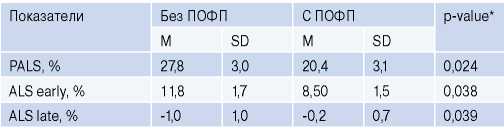
Примечание: * — различия считались достоверными при уровне статистической значимости p<0,05.
Сокращения: ПОФП — послеоперационная фибрилляция предсердий, ALS early — деформация левого предсердия в фазу кондуита, ALS late — деформация левого предсердия в насосную фазу, PALS — деформация левого предсердия в фазу резервуара.
Для определения чувствительности и специфичности параметров деформации по данным СТЭ в двумерном режиме выполнен ROC-анализ (рис. 4).
Установлено прогностическое значение в определении риска ПОФП параметра PALS ≤23,0% (чувствительность 90% и специфичность 78%; площадь под ROC кривой составила 0,820±0,050 с 95% доверительным интервалом: 0,710-0,902).
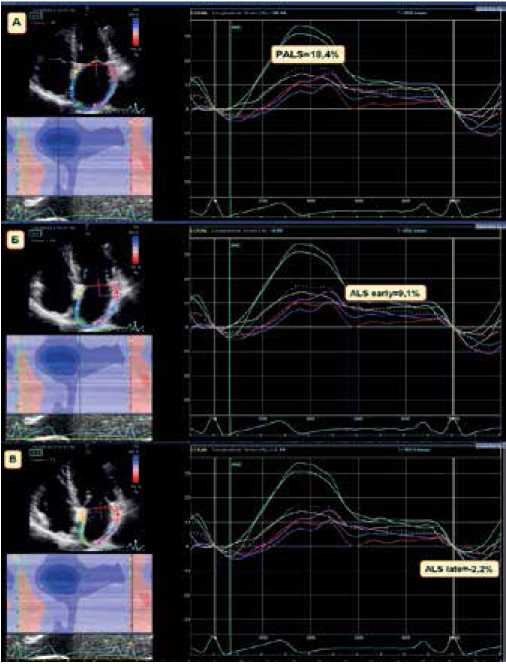
Рис. 3. Анализ параметров деформации ЛП, с использованием технологии СТЭ. (А) PALS — деформации ЛП в фазу резервуара; (Б) ALS early — деформации ЛП в фазу кондуита; (В) ALS late — деформации ЛП в фазу насоса.
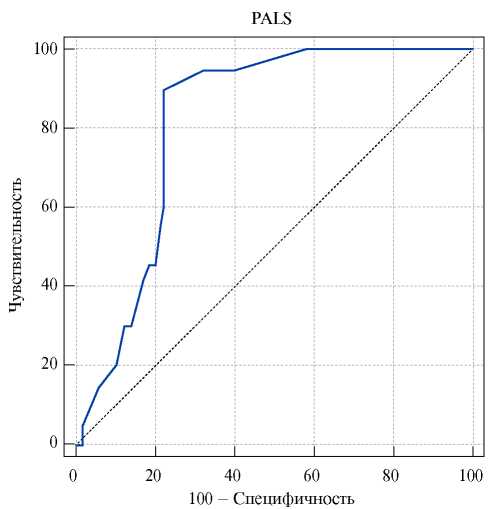
Рис. 4. Диагностическая значимость PALS по данным СТЭ в двумерном режиме как прогностического фактора развития ФП после КШ.
Обсуждение
ПОФП — самое частое осложнение всех кардиохирургических вмешательств; по данным литературы частота распространения после изолированного КШ составляет от 20% до 40% [1]. Несмотря на улучшение анестезиологического пособия, методов защиты миокарда и модернизацию хирургической техники, в т.ч. применение малоинвазивных способов открытой реваскуляризации, не отмечено существенного снижения заболеваемости ПОФП. Напротив, его частота парадоксальным образом увеличилась в последние десятилетия, скорее это связано с увеличением продолжительности жизни населения, большим количеством сопутствующих заболеваний у хирургических пациентов, совершенствованием технологий непрерывного мониторинга ритма сердца.
Принято рассматривать ПОФП не как самостоятельное заболевание, а как временное доброкачественное и хорошо переносимое клиническое состояние. Однако существует немало исследований, показывающих, что ФП, возникшая после кардиохирургического вмешательства, является более “злокачественной”, чем принято считать, и ассоциирована с более длительным пребыванием в отделении реанимации, увеличением койко-дня госпитализации, увеличением финансовых затрат. Сообщается также о двукратном повышении риска сердечно-сосудистой смерти у пациентов с ПОФП после КШ [15][16].
Генез ПОФП до конца не ясен. Текущие данные свидетельствуют о том, что комбинация нескольких факторов связана с возникновением ПОФП, и что аритмия, вероятно, имеет многофакторный характер. К основным факторам можно отнести: возраст, фиброз и расширение предсердий, системный воспалительный ответ, эффект катехоламинов, дисбаланс вегетативного тонуса [17-20]. Определение факторов риска ПОФП после КШ является важной задачей, поскольку улучшение стратификации риска возникновения аритмии способствует планированию и реализации стратегий профилактики.
В нашем исследовании частота ПОФП составила 29%. Сравнительный анализ показал сопоставимость частоты ПОФП с данными научной литературы.
Группы больных без ПОФП и с ПОФП не различались по клинико-демографическим показателям, а также по наличию сопутствующих заболеваний. Предоперационная механическая дисфункция предсердий может прогнозировать развитие ФП после КШ. Определение предсердной функции может быть клинически полезным для выявления пациентов с высоким риском ПОФП. Отметим, что в нашем исследовании отсутствовала связь между традиционными ЭхоКГ параметрами, такими как размер и объем ЛП, с развитием послеоперационной аритмии. Влияние данных показателей на возникновение ПОФП было продемонстрировано во многих исследованиях [21]. Считаем, что в большинстве исследований увеличенное ЛП являлось отражением ремоделирования, как следствие мерцательной аритмии в анамнезе, задачей текущего исследования был анализ впервые выявленной ПОФП путем исключения больных с указаниями на мерцательную аритмию в прошлом.
Увеличенное ЛП можно рассматривать как клинико-инструментальный “маркер” имеющейся механической дисфункции ЛП. Возможно ли выявить признаки субклинической дисфункции ЛП в условиях нормы стандартных ЭхоКГ показателей и определить риски послеоперационной аритмии? Скорее всего, да. Такой опыт уже есть: ранее сообщалось о влиянии деформации ЛП на возникновение ПОФП, однако многие исследователи не изучали особенности деформации трех фаз ЛП: роль деформационных характеристик в возникновении ПОФП оценивалась путем определения деформации, как правило, в фазу резервуара ЛП [8]. Нами в исследовании проанализированы предоперационные характеристики деформации ЛП, показано, что у больных с зарегистрированной ПОФП отмечается статистически достоверное снижение деформации ЛП на дооперационном этапе в фазы: резервуара, кондуита и насоса. Выполненный ROC-анализ позволил определить, что пороговое значение деформации ЛП в фазу резервуара ≤23% прогнозировало ПОФП (чувствительность и специфичность модели 90% и 78%, соответственно).
Это первое исследование в нашей клинике и в Российской Федерации, демонстрирующее связь ФП после КШ с дооперационными деформационными характеристиками ЛП, определенными с помощью технологии СТЭ.
Заключение
У больных с ПОФП отмечаются худшие параметры деформации ЛП на дооперационном этапе по сравнению с больными без ПОФП. Прогностическое значение в определении риска ПОФП параметра PALS ≤23,0% (чувствительность 90%, специфичность 78%).
Мы предполагаем, что ФП после КШ является ассоциированным с уже имеющейся субклинической дисфункцией ЛП как следствие структурных изменений на фоне хронической ишемической болезни сердца. Необходимы дальнейшие исследования для оценки эффективности метода СТЭ; такая оценка внесет существенный вклад в возможности прогнозирование развития ПОФП.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Siebert J, Rogowski J, Jagielak D, et al. Atrial fibrillation after coronary artery bypass grafting without cardiopulmonary bypass. Eur J Cardiothorac Surg. 2000;17:520-3. doi:10.1016/s1010-7940(00)00368-7.
2. Aranki SF, Shaw DP, Adams DH, et al. Predictors of atrial fibrillation after coronary artery surgery. Current trends and impact on hospital resources. Circulation. 1996;94:390-7. doi:10.1161/01.cir.94.3.390.
3. El-Chami MF, Kilgo P, Thourani V, et al. 2010. New-onset atrial fibrillation predicts longterm mortality after coronary artery bypass graft. J Am Coll Cardiol 55:1370-6. doi:10.1016/j.jacc.2009.10.058.
4. Filardo G, Ailawadi G, Pollock BD, et al. Sex differences in the epidemiology of newonset in-hospital post-coronary artery bypass graft surgery AF: a large multicenter study. Circulation. Cardiovascular Quality and Outcomes. 2016;9(6):723-30. doi:10.1161/CIRCOUTCOMES.116.003023.
5. Mathew JP, Fontes ML, Tudor IC, et al. Investigators of the Ischemia Research and Education Foundation; Multicenter Study of Perioperative Ischemia Research Group. A multicenter risk index for atrial fibrillation after cardiac surgery. JAMA. 2004;14;291(14):1720-9. doi:10.1001/jama.291.14.1720.
6. Melby SJ, George JF, Picone DJ, et al. A time-related parametric risk factor analysis for postoperative atrial fibrillation after heart surgery. The Journal of Thoracic and Cardiovascular Surgery. 2015;149(3):886-92. doi:10.1016/j.jtcvs.2014.11.032
7. Ревишвили А. Ш., Попов В. А., Коростелев А. Н. и др. Предикторы развития фибрилляции предсердий после операции аортокоронарного шунтирования. Вестник аритмологии. 2018;(94):11-6. doi:10.25760/VA-2018-94-11-16.
8. Gabrielli L, Corbalan R, Córdova S, et al. Left atrial dysfunction is a predictor of postcoronary artery bypass atrial fibrillation: Association of left atrial strain and strain rate assessed by speckle tracking. Echocardiography. 2011;28(10):1104-8. doi:10.1111/j.1540-8175.2011.01518.
9. Moustafa S, Elrabat K, Swailem F, et al. The correlation between speckle tracking echocardiography and coronary artery disease in patients with suspected stable angina pectoris. Indian Heart J. 2018;70(3):379-86. doi:10.1016/j.ihj.2017.09.220.
10. Hiebert JB, Vacek J, Shah Z, et al. Use of speckle tracking to assess heart failure with preserved ejection fraction. J Cardiol. 2019;74(5):397-402. doi:10.1016/j.jjcc.2019.06.004.
11. Nielsen AB, Skaarup KG, Lassen MCH, et al. Usefulness of left atrial speckle tracking echocardiography in predicting recurrence of atrial fibrillation after radiofrequency ablation: a systematic review and meta-analysis. Int J Cardiovasc Imaging. 2020;36(7):1293-309. doi:10.1007/s10554-020-01828-2.
12. Мусин Т. И., Багманова З. А., Гареев Д. А. и др. Прогнозирование контроля синусового ритма после радиочастотной аблации у больных с фибрилляцией предсердий с помощью технологии спеклтрекинг и динамика структурно-функциональных показателей левого предсердия. Российский кардиологический журнал. 2021;26(S2):4256. doi:10.15829/1560-40712021-4256.
13. Mitchell C, Rahko PS, Blauwet LA, et al. Guidelines for Performing a Comprehensive Transthoracic Echocardiographic Examination in Adults: Recommendations from the American Society of Echocardiography. J Am Soc Echocardiogr. 2019;32(1):1-64. doi:10.1016/j.echo.2018.06.004.
14. Ганаев К. Г., Власова Э. Е., Ширяев А. А. и др. Фибрилляция предсердий после коронарного шунтирования у больных с локальным и диффузным поражением коронарного русла. Кардиологический вестник. 2021;16(2):59-64. doi:10.17116/Cardiobulletin20211602159.
15. Wu ZK, Iivainen T, Pehkonen E, et al. Fibrillation in patients subjected to coronary artery bypass grafting. J Thorac Cardiovasc Surg. 2003;126:1477-82. doi:10.1016/s00225223(03)00749-9.
16. Ahlsson A, Bodin L, Fengsrud E, et al. Patients with postoperative atrial fibrillation have a doubled cardiovascular mortality. Scand Cardiovasc J. 2009;43:330-6. doi:10.1080/14017430802702291.
17. Auer J, Weber T, Berent R, et al. Risk factors of postoperative atrial fibrillation after cardiac surgery. J Card Surg 2005;20(5):425-31. doi:10.1111/j.1540-8191.2005.2004123.x.
18. Hogue CW Jr, Creswell LL, Gutterman DD, et al, American College of Chest Physicians. Epidemiology, mechanisms, and risks: American College of Chest Physicians guidelines for the prevention and management of postoperative atrial fibrillation after cardiac surgery. Chest. 2005;128(Suppl 2):9S-16S. doi:10.1378/chest.128.2_suppl.9s.
19. Phan K, Ha HS, Phan S, et al. New-onset atrial fibrillation following coronary bypass surgery predicts long-term mortality: a systematic review and meta-analysis. Eur J Cardiothorac Surg. 2015;48:817-24. doi:10.1093/ejcts/ezu551.
20. Erdil N, Gedik E, Donmez K, et al. Predictors of postoperative atrial fibrillation after on-pump coronary artery bypass grafting: is duration of mechanical ventilation time a risk factor? Ann Thorac Cardiovasc Surg. 2014;20:135-42. doi:10.5761/atcs.oa.12.02104.
21. Schnabel RB, Yin X, Gona P, et al. 50 year trends in atrial fibrillation prevalence, incidence, risk factors, and mortality in the Framingham Heart Study: a cohort study. Lancet. 2015;386(9989):154-62. doi:10.1016/S01406736(14)61774-8.
Об авторах
К. Г. ГанаевРоссия
Аспирант отдела сердечно-сосудистой хирургии НИИ Клинической кардиологии им. А. Л. Мясникова.
Москва
Конфликт интересов:
нет
Э. Е. Власова
Россия
Кандидат медицинских наук, старший научный сотрудник отдела сердечно-сосудистой хирургии НИИ Клинической кардиологии им. А. Л. Мясникова.
Москва
Конфликт интересов:
нет
А. А. Авалян
Россия
Младший научный сотрудник, отдел ультразвуковых методов исследования НИИ Клинической кардиологии им. А. Л. Мясникова.
Москва
Конфликт интересов:
нет
М. А. Саидова
Россия
Доктор медицинских наук, профессор, руководитель отдела ультразвуковых методов исследования НИИ Клинической кардиологии им. А. Л. Мясникова.
Москва
Конфликт интересов:
нет
Р. С. Акчурин
Россия
Академик РАН, профессор, зам. генерального директора по хирургии, руководитель отдела сердечно-сосудистой хирургии НИИ Клинической кардиологии им. А. Л. Мясникова.
Москва
Конфликт интересов:
нет
Дополнительные файлы
Рецензия
Для цитирования:
Ганаев К.Г., Власова Э.Е., Авалян А.А., Саидова М.А., Акчурин Р.С. Первый опыт применения технологии спекл-трекинг эхокардиографии в двумерном режиме для оценки связи нарушения деформации левого предсердия с фибрилляцией предсердий после коронарного шунтирования. Российский кардиологический журнал. 2022;27(7):5026. https://doi.org/10.15829/1560-4071-2022-5026
For citation:
Ganaev K.G., Vlasova E.E., Avalyan A.A., Saidova M.A., Akchurin R.S. First experience of using two-dimensional speckle-tracking echocardiography to assess the association of left atrial strain with atrial fibrillation after coronary artery bypass grafting. Russian Journal of Cardiology. 2022;27(7):5026. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5026

















































