Перейти к:
Уровень и связи стимулирующего фактора роста, кодируемого геном 2, с клиниколабораторными и инструментальными характеристиками больных хронической сердечной недостаточностью
https://doi.org/10.15829/1560-4071-2022-5009
Аннотация
Цель. Определить связи стимулирующего фактора роста, кодируемого геном 2 (sST2), и N-терминального фрагмента промозгового натрийуретического пептида (NT-proBNP) с некоторыми клинико-лабораторными и инструментальными характеристиками пациентов с хронической сердечной недостаточностью (ХСН).
Материал и методы. В исследование были включены 130 пациентов с ХСН (из них 54 мужчины и 76 женщин, средний возраст 64,3±8,3 года) из регионального регистра больных ХСН Воронежской области. Всем пациентам было проведено эхокардиографическое исследование, общеклинические методы обследования, а также определены уровни sST2 и NT-proBNP сыворотки крови и изучены их корреляционные связи с другими показателями.
Результаты. Уровень sST2 в крови больных ХСН составил 3,7 [3,1;4,2] нг/мл. В исследуемой выборке пациентов с ХСН уровни sST2 коррелировали с размерами правого предсердия (r=0,49), правого желудочка (r=0,32), конечнодиастолическим размером левого желудочка (ЛЖ) (r=0,34), конечно-диастолическим объемом ЛЖ (r=0,33), скоростью раннего диастолического наполнения ЛЖ (r=-0,35), кальцием крови (r=-0,55) и функциональным классом стабильной стенокардии напряжения (r=-0,37).
Заключение. Полученные данные могут указывать на патогенетическую связь sST2 с систолической и диастолической дисфункцией ЛЖ, а также нарушением функции правых отделов сердца.
Для цитирования:
Кравченко А.Я., Будневский А.В., Концевая А.В., Черник Т.А., Токмачев Р.Е. Уровень и связи стимулирующего фактора роста, кодируемого геном 2, с клиниколабораторными и инструментальными характеристиками больных хронической сердечной недостаточностью. Российский кардиологический журнал. 2022;27(5):5009. https://doi.org/10.15829/1560-4071-2022-5009
For citation:
Kravchenko A.Ya., Budnevsky A.V., Kontsevaya A.V., Chernik T.A., Tokmachev R.E. Level and correlations of soluble suppression of tumorigenicity 2 protein in heart failure and its relationship with clinical and paraclinical characteristics of patients. Russian Journal of Cardiology. 2022;27(5):5009. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5009
Актуальность мониторинга эпидемиологических показателей хронической сердечной недостаточности (ХСН) не уменьшилась за все годы изучения заболевания по причине их сохраняющейся негативной динамики. Наряду с первичной диагностикой ХСН, интерес представляет контроль течения, эффективности назначенной терапии и оценка прогноза неблагоприятных сердечно-сосудистых событий [1].
Несмотря на очевидное повышение качества ведения пациентов с ХСН при использовании эхокардиографии, следует учитывать низкую эффективность ультразвуковой диагностики на ранних этапах развития заболевания, в группах риска, а также для прогнозирования обострений. Применение биомаркеров ХСН, в т.ч. в комбинации с физикальными и инструментальными данными, позволяет достичь улучшения качества первичной диагностики и контроля течения рассматриваемой патологии [2].
Самым распространенным на данный момент биомаркером в клинической практике является N-терминальный фрагмент промозгового натрийуретического пептида (NT-proBNP). Его применение позволяет оптимизировать лечение, контролировать его эффективность и тем самым сократить количество госпитализаций по причине декомпенсации состояния пациентов [3][4]. Данный биомаркер, отражающий главным образом растяжение кардиомиоцитов левого желудочка (ЛЖ), также имеет для своего повышения ряд других кардиальных и некардиальных причин, влияющих на его уровень в периферической крови, а у пациентов с ХСН с сохраненной фракцией выброса (ХСНсФВ) более чем в половине случаев не превышает пороговых значений [2][5].
Указанные ограничения формировали потребность поиска других биомаркеров, в связи с чем в последние годы продолжается изучение ряда биохимических соединений, позволяющих повысить диагностические возможности в отношении ХСН [6]. Одним из таких соединений является стимулирующий фактор роста, кодируемый геном 2 (ST2), который ассоциирован с процессами воспаления, апоптоза и фиброза в сердечной мышце [7]. Антиапоптотическое и антифибротическое действие осуществляется при взаимодействии трансмембранной формы биомаркера (LST2) с интерлейкином (ИЛ) 33, при этом растворимая форма (sST2) выполняет функцию рецептора-ловушки, ингибируя кардиопротективный эффект. Взаимодействие ST2/ ИЛ33 является первой биомеханической системой, активируемой при растяжении кардиомиоцитов, что обеспечивает интерес исследователей к её изучению.
Цель: определить связи NT-proBNP и sST2 некоторыми клинико-лабораторными и инструментальными характеристиками пациентов с ХСН.
Материал и методы
Исследование являлось наблюдательным и одномоментным. Протокол исследования был одобрен локальным этическим комитетом ВГМУ им. Н. Н. Бурденко (протокол № 7 от 22.10.2020). Было получено информированное добровольное согласие всех участников исследования. Набор пациентов проводился с использованием регионального регистра больных ХСН Воронежской области. Регистр содержит данные о 2000 больных. На первом этапе были отобраны 1452 пациента с ишемической этиологией заболевания, из которых путем рандомизации была создана случайная выборка, составляющая 10% от общего числа (n=145).
Критериями включения являлись возраст пациента от 45 до 90 лет и наличие ХСН, подтвержденного клинико-инструментальными данными.
Критериями исключения были хроническая болезнь почек стадии С3б и более тяжелых, цирроз печени, хроническая обструктивная болезнь легких стадий C и D по классификации Global Initiative for Chronic Obstructive Lung Disease, стабильная стенокардия напряжения IV функционального класса (ФК), злокачественные новообразования.
Итоговая выборка была сформирована на основании получения информированного добровольного согласия, а также соответствия пациента критериям включения и исключения, и составила 130 человек (из них 54 мужчины и 76 женщин, средний возраст 64,3±8,3 года). ФК ХСН, согласно Нью-Йоркской классификации, определялся с использованием теста шестиминутной ходьбы. Постановка диагноза и назначение лечения проводилось в соответствии с клиническими рекомендациями Министерства Здравоохранение Российской Федерации по ХСН 2020г.
Всем пациентам было проведено эхокардиографическое исследование, общеклинические методы обследования, а также определены уровни sST2 и NT-proBNP сыворотки крови. Для проведения эхокардиографического исследования была использована ультразвуковая диагностическая система EPIQ5 с определением следующих параметров: размеры аорты, левого (ЛП) и правого предсердия (ПП), конечно-диастолический объем (КДО) ЛЖ, конечнодиастолический размер (КДР) ЛЖ, конечно-систолический объем (КСО) ЛЖ, конечно-систолический размер (КСР) ЛЖ, фракция выброса (ФВ) ЛЖ по Симпсону, масса миокарда ЛЖ (ММЛЖ), индекс массы миокарда ЛЖ (ИММЛЖ), а также толщина межжелудочковой перегородки и толщина задней стенки ЛЖ. Кроме того, оценивались признаки стеноза и недостаточности клапанов, а также показатели диастолической функции сердца: время изоволюмической релаксации, время замедления кровотока раннего диастолического наполнения, скорость раннего диастолического наполнения ЛЖ, отношение скорости трансмитрального кровотока в фазу раннего наполнения к скорости движения фиброзного кольца митрального клапана, отношение раннего и позднего трансмитрального потоков, амплитуда систолического движения кольца трикуспидального клапана (TAPSE ПЖ).
Уровни sST2 и NT-proBNP определялись с помощью иммуноферментного анализа с использованием набора реактивов ELISA Kit for Interleukin 1 Receptor Like Protein 1 (IL1RL1), 96Т, USA и NTproBNP-ИФАБЕСТ (Вектор-Бест, Россия), соответственно.
Определение показателей биохимического анализа крови проводилось с использованием наборов реактивов и автоматического анализатора MINDRAY BS-200E, КНР, общего анализа крови — с использованием автоматического анализатора MINDRAY BC-5300 (КНР).
Статистическая обработка данных была выполнена с помощью программы Statistica 12, Dell Technologies (США). Применялись стандартные методы описательной статистики с представлением результатов в виде среднего (M) и стандартного отклонения (SD) при нормальном распределении данных и в виде медианы (Ме) и интерквартильного размаха (IQR) между 25 и 75 квартилями при распределении результатов, отличном от нормального. Проверка статистической гипотезы о нормальности распределения осуществлялась с использованием критерия Колмогорова-Смирнова. Для оценки корреляционной зависимости между переменными производился расчет коэффициента ранговой корреляции Спирмена. Для описания силы корреляционной связи была использована шкала Чеддока. Статистически значимыми считались значения p<0,05.
Результаты
Характеристика изучаемой выборки пациентов представлена в таблице 1.
Таблица 1
Характеристика изучаемой выборки
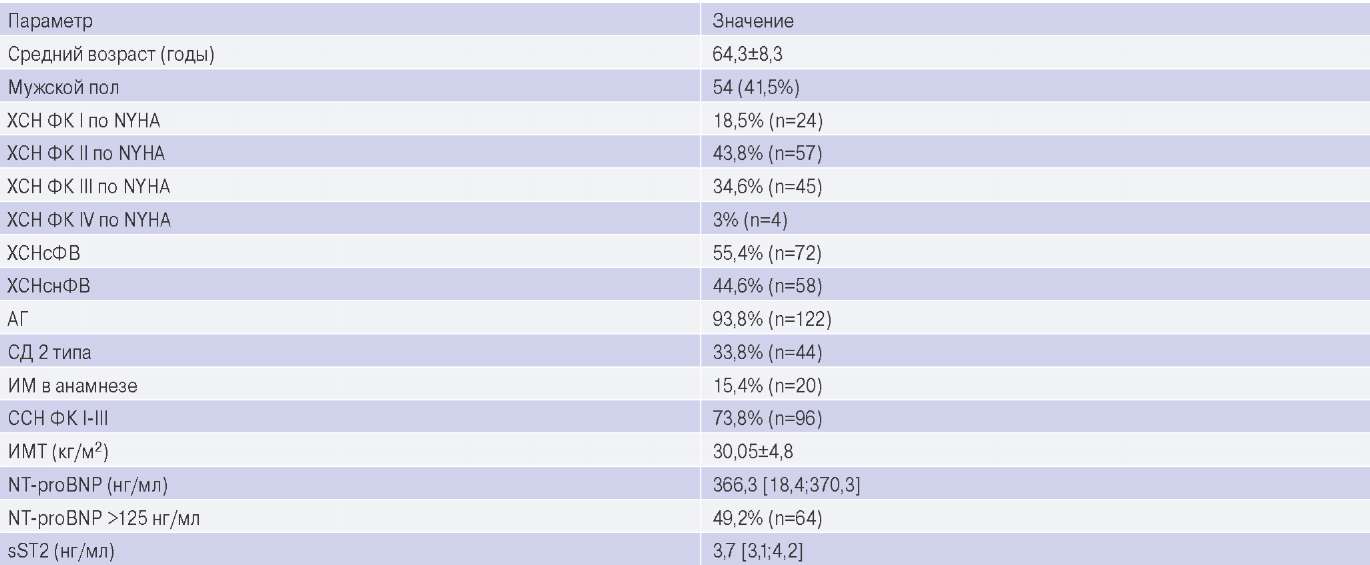
Сокращения: АГ — артериальная гипертензия, ИМ — инфаркт миокарда, ИМТ — индекс массы тела, СД — сахарных диабет, ССН — стабильная стенокардия напряжения, ФК — функциональный класс, ХСН — хроническая сердечная недостаточность, ХСНснФВ — хроническая сердечная недостаточность со сниженной фракцией выброса, ХСНсФВ — хроническая сердечная недостаточность с сохраненной фракцией выброса, NT-proBNP — N-терминальный фрагмент промозгового натрийуретического пептида, NYHA — классификация Нью-Йоркской ассоциации сердца, sST2 — стимулирующий фактор роста, кодируемый геном 2.
Была выявлена прямая сильная корреляционная связь уровней sST2 и билирубина крови (r=0,72), прямая связь средней силы между уровнями sST и размерами ЛП (r=0,57), ПП (r=0,49). Прямая связь слабой силы определялась между уровнями sST2 и КДР (r=0,34), КДО (r=0,33), степенью недостаточности митрального клапана (r=0,3), размерами ПЖ (r=0,32).
Обратная корреляционная связь средней силы была установлена между уровнями sST2 и кальция крови (r=-0,55), обратная связь слабой силы между уровнями sST2 и E (r=-0,35), ФК стабильной стенокардии напряжения (r=-0,37).
При исключении из корреляционного анализа пациентов с индексом массы тела (ИМТ) <25 кг/м2 наблюдалась тенденция к обратной связи ИМТ с sST2 (r=-0,25).
Уровни NT-proBNP сформировали прямую корреляционную связь средней силы с количеством тромбоцитов в гемограмме (r=0,55) и тромбокритом (r=0,63), степенью недостаточности трикуспидального (r=0,54) и митрального клапанов (r=0,69), ММЛЖ (r=0,58), ИММЛЖ (r=0,55), частотой сердечных сокращений (ЧСС) (r=0,54). Прямая корреляционная связь слабой силы была получена между уровнями NT-proBNP и уровнями креатинина (r=0,48), КСР (r=0,33), КСО (r=0,32), ФК ХСН (r=0,34), размерами ЛП (r=0,44).
Уровни NT-proBNP имели обратную сильную корреляцию с уровнями общей креатинфосфокиназы (r=-0,79), корреляцию средней силы с уровнями альбумина (r=-0,51) и слабой силы с уровнями общего белка (r=-0,31), общего холестерина (r=-0,37), высокочувствительного С-реактивного белка (r=-0,39), TAPSE ПЖ (r=-0,44) и ФВ ЛЖ (r=-0,33).
При этом не было установлено наличия статистически значимой корреляции между sST2 и NTproBNP.
Обсуждение
На данный момент sST2 является одним из наиболее перспективных биомаркеров ХСН за счёт его связи с большинством патогенетических процессов, лежащих в основе развития патологии, начиная от ранних проявлений в виде воспаления, растяжения и апоптоза кардиомиоцитов и заканчивая ремоделированием и фиброзом миокарда [8]. Наиболее важна роль рассматриваемого белка-рецептора в диагностике ХСНсФВ, т.к. значимую роль в развитии данной формы заболевания играет системное воспаление, индуцируемое сопутствующими патологиями, такими как сахарный диабет, ожирение и артериальная гипертензия [9,][10]. Отдельный интерес представляет роль ожирения в вопросах использования sST2 и NT-proBNP с диагностической целью. У пациентов с ИМТ ≥30 кг/м2 уровни NT-proBNP, как правило, снижены и необъективно отражают состояние сердечной мышцы [2]. Напротив, по причине того, что адипоциты являются некардиальным источником ИЛ33 и sST2, при ожирении наблюдается повышение данного биомаркера.
Применительно к выяснению роли фиброза миокарда в развитии миокардиальной дисфункции, использование sST2, в сравнении с NT-proBNP, увеличение которого характеризует значительное нарастание миокардиального стресса и ремоделирования, позволяет зафиксировать патологические изменения на более ранних стадиях развития [11]. Этим можно объяснить слабые корреляционные связи или отсутствие таковых между NT-proBNP и sST2 в ряде работ, как и в представленных нами данных [11]. При этом важно заметить, что экспрессия sST2 сохраняется как при декомпенсации ХСН, так и при острой сердечной недостаточности и повышает прогностическую способность стандартных клинико-биохимических моделей, включающих NT-proBNP [6].
Полученные данные о связи sST2 и размеров ПП и ПЖ могут указывать на ассоциацию данного биомаркера с систолической дисфункцией правых отделов сердца. Подобные результаты можно наблюдать в первую очередь в работах, включающих пациентов с ХСНсФВ, в которых sST2 характеризуется как предиктор системного воспаления, обусловливающего дисфункции правых отделов сердца [12].
Определение ассоциации уровней sST2 с показателями систолической и диастолической функций ЛЖ подтверждено в ряде исследований и согласуется с нашими данными [13][14]. Это характеризует рассматриваемый белок как валидный биомаркер для выявления пациентов не только с ХСНсФВ, но и с ХСНснФВ, у которых уровни sST2 приобретают корреляцию с уровнями NT-proBNP [6].
Провоцируемые взаимодействием LST2/ИЛ33 биохимические каскады подавляют развитие атеросклероза, при этом sST2 предотвращает их антиатеросклеротический эффект, способствуя прогрессированию, в т.ч. ишемической болезни сердца [15]. Соответственно, ожидаемым результатом была прямая корреляция уровней sST2 и ФК стабильной стенокардии напряжения. Полученную обратную корреляцию можно объяснить возможным изменением ФК в ответ на длительное эффективное лечение при отсутствии выраженного регресса атеросклеротического процесса.
Выявленная нами обратная связь уровней sST2 и кальция крови представляет определенный интерес. Имеются единичные сообщения о том, что в процессе осуществления своей физиологической роли LST2/ИЛ33 обеспечивает выраженную мобилизацию внеклеточного и внутриклеточного кальция [16]. Поэтому, возможно, имеется некоторая связь между снижением кальция крови и повышением антагониста данной биомеханической системы — sST2.
Полученные данные служат основой для формирования направления последующих исследований патогенеза ХСН и характера взаимодействия между биомаркерами и другими исследуемыми характеристиками пациентов.
Ограничениями исследования являются его одномоментный характер, который не позволяет оценить динамику исследуемых параметров, а также оценить их влияние на прогноз пациентов. Кроме того, выборка не включала ХСН, сформированную по причине кардиомиопатий, клапанных пороков и др.
Необходимы дальнейшие исследования, которые позволят изучить клинико-лабораторные и инструментальные характеристики при ХСН неишемической этиологии. Представляет интерес проведение исследований с проспективным дизайном и большим объемом выборки, что позволит оценить динамику изученных параметров и установить их влияние на прогноз.
Заключение
В исследуемой выборке пациентов с ХСН уровни sST2 коррелировали с размерами правых отделов сердца, КДР, КДО, скоростью раннего диастолического наполнения ЛЖ и ФК стабильной стенокардии. Уровни NT-proBNP коррелировали с количеством тромбоцитов в гемограмме, тромбокритом, уровнями альбумина, общего белка, общего холестерина, высокочувствительного С-реактивного белка, креатинфосфокиназы, степенью недостаточности трикуспидального и митрального клапанов, ММЛЖ, ИММЛЖ, КСР, КСО, TAPSE ПЖ, размерами ЛП, ЧСС, ФК ХСН и ФВ ЛЖ.
Полученные данные могут указывать на патогенетическую связь sST2 с систолической и диастолической дисфункцией ЛЖ, а также нарушением функции правых отделов сердца.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Bozkurt B, Coats AJ, Tsutsui H, et al. Universal Definition and Classification of Heart Failure: A Report of the Heart Failure Society of America, Heart Failure Association of the European Society of Cardiology, Japanese Heart Failure Society and Writing Committee of the Universal Definition of Heart Failure. J Card Fail. 2021;23(3):352-80. doi:10.1002/ejhf.2115.
2. Кожевникова М.В., Беленков Ю.Н. Биомаркеры сердечной недостаточности: настоящее и будущее. Кардиология. 2021;61(5):4- 16. doi:10.18087/cardio.2021.5.n1530.
3. Dini FL, Carluccio E, Montecucco F, et al. Combining echo and natriuretic peptides to guide heart failure care in the outpatient setting: A position paper. Eur J Clin Invest. 2017;47(12). doi:10.1111/eci.12846.
4. Будневский А.В., Шурупова А.Д., Кравченко А.Я. и др. Клиническая эффективность профилактики острых респираторных вирусных инфекций у больных хронической сердечной недостаточностью. Терапевтический Архив. 2019;91(3):36- 41. doi:10.26442/00403660.2019.03.000111.
5. Токмачев Р.Е., Будневский А.В., Кравченко А.Я. Роль воспаления в патогенезе хронической сердечной недостаточности. Терапевтический архив. 2016;88(9):106-10. doi:10.17116/terarkh2016889106-110.
6. Скворцов А.А., Протасов В.Н., Нарусов О.Ю. и др. Растворимый рецептор подавления туморогенности 2-го типа против копептина: прямое сравнение значения определения новых биомаркеров для прогноза у больных с декомпенсированной сердечной недостаточностью. Кардиология. 2017;57(9):20-33. doi:10.18087/cardio.2017.9.10028.
7. Vianello E, Dozio E, Tacchini L, et al. ST2/IL-33 signaling in cardiac fibrosis. Int J Biochem Cell Biol. 2019;116:105619. doi:10.1016/j.biocel.2019.105619.
8. Aimo A, Januzzi JL Jr, Bayes-Genis A, et al. Clinical and Prognostic Significance of sST2 in Heart Failure: JACC Review Topic of the Week. J Am Coll Cardiol. 2019;74(17):2193-203. doi:10.1016/j.jacc.2019.08.1039.
9. Song Y, Li F, Xu Y, et al. Prognostic value of sST2 in patients with heart failure with reduced, mid-range and preserved ejection fraction. Int J Cardiol. 2020;304:95-100. doi:10.1016/j.ijcard.2020.01.039.
10. Токмачев Р.Е., Мухортова М.С., Будневский А.В. и др. Коморбидность хронической сердечной недостаточности и хронической обструктивной болезни легких: особенности патогенеза, клиники и диагностики. Кардиоваскулярная терапия и профилактика. 2018;17(6):62-8. doi:10.15829/1728-8800-2018-6-62-68.
11. Sánchez-Más J, Lax A, Asensio-López Mdel C, et al. Modulation of IL-33/ST2 system in postinfarction heart failure: correlation with cardiac remodelling markers. Eur J Clin Invest. 2014;44(7):643-51. doi:10.1111/eci.12282.
12. AbouEzzeddine OF, McKie PM, Dunlay SM, et al. Suppression of Tumorigenicity 2 in Heart Failure With Preserved Ejection Fraction. J Am Heart Assoc. 2017;6(2):e004382. doi:10.1161/JAHA.116.004382.
13. Печерина Т.Б., Герман А.И., Чернобай А.Г. и др. Связь биологических маркеров с эхокардиографическими показателями у больных инфарктом миокарда с подъемом сегмента ST и сохранной систолической функцией левого желудочка. Кардиология. 2018;58(S3):9-18. doi:10.18087/cardio.2409.
14. Miñana G, Núñez J, Bayés-Genís A, et al. ST2 and left ventricular remodeling after ST-segment elevation myocardial infarction: A cardiac magnetic resonance study. Int J Cardiol. 2018;270:336-42. doi:10.1016/j.ijcard.2018.06.073.
15. Oh J, Park S, Yu HT, et al. Lack of Superiority for Soluble ST2 over High Sensitive C-Reactive Protein in Predicting High Risk Coronary Artery Calcium Score in a Community Cohort. Yonsei Med J. 2016;57(6):1347-53. doi:10.3349/ymj.2016.57.6.1347.
16. Ball DH, Al-Riyami L, Harnett W, et al. IL-33/ST2 signalling and crosstalk with FcεRI and TLR4 is targeted by the parasitic worm product, ES-62. Sci Rep. 2018;8(1):4497. doi:10.1038/s41598-018-22716-9.
Об авторах
А. Я. КравченкоРоссия
Кравченко Андрей Яковлевич — доктор медицинских наук, профессор, профессор кафедры факультетской терапии
Воронеж
А. В. Будневский
Россия
Будневский Андрей Валериевич — доктор медицинских наук, профессор, заведующий кафедрой факультетской терапии
Воронеж
А. В. Концевая
Россия
Концевая Анна Васильевна — доктор медицинских наук, заместитель директора по научной и аналитической работе
Москва
Т. А. Черник
Россия
Черник Татьяна Александровна — аспирант кафедры факультетской терапии
Воронеж
Р. Е. Токмачев
Россия
Токмачев Роман Евгеньевич — кандидат медицинских наук, доцент кафедры факультетской терапии
Воронеж
Дополнительные файлы
Рецензия
Для цитирования:
Кравченко А.Я., Будневский А.В., Концевая А.В., Черник Т.А., Токмачев Р.Е. Уровень и связи стимулирующего фактора роста, кодируемого геном 2, с клиниколабораторными и инструментальными характеристиками больных хронической сердечной недостаточностью. Российский кардиологический журнал. 2022;27(5):5009. https://doi.org/10.15829/1560-4071-2022-5009
For citation:
Kravchenko A.Ya., Budnevsky A.V., Kontsevaya A.V., Chernik T.A., Tokmachev R.E. Level and correlations of soluble suppression of tumorigenicity 2 protein in heart failure and its relationship with clinical and paraclinical characteristics of patients. Russian Journal of Cardiology. 2022;27(5):5009. (In Russ.) https://doi.org/10.15829/1560-4071-2022-5009
JATS XML

















































