Перейти к:
Изменение в течение двадцати лет клинико-эхокардиографических характеристик больных с ранним постинфарктным ремоделированием после первичного инфаркта миокарда с подъемом сегмента ST
https://doi.org/10.15829/1560-4071-2022-4951
Аннотация
Цель. Сравнить результаты структурно-функциональных изменений левого желудочка (ЛЖ) в раннем периоде инфаркта миокарда (ИМ) за 20 лет деятельности отделения неотложной кардиологии НИИ кардиологии г. Томска.
Материал и методы. В исследование включено две группы пациентов, находившихся на лечении в ОНК в разные периоды времени с интервалом 20 лет. 1 группа — 83 пациента, перенесшие ИМ с подъемом сегмента ST (ИМпST) в 1997-1999гг, 2 группа — 83 пациента с ИМпST от 2019-2020гг. Эхокардиографию выполняли первые 72 ч от момента госпитализации и на 7-10 сут. болезни. По приросту конечно-диастолический объем (КДО) ЛЖ на >15% к 7-10 сут. постинфарктного периода больные были разделены на 2 подгруппы: с ремоделированием (ЛЖР+) и без ремоделирования (ЛЖР-).
Результаты. Пациенты 2 группы были старше, с большей долей лиц женского пола в половой структуре и с высокой частотой встречаемости факторов риска ишемической болезни сердца по сравнению с пациентами 1 группы. В раннем постинфарктном периоде среди больных 2 группы реже развивалась острая аневризма ЛЖ, ранняя постинфарктная стенокардия и синдром Дресслера. Доля неблагоприятного ремоделирования ЛЖ у пациентов 1 группы была больше (32,8% vs 17%), а процент обратного — меньше (10% vs 24%), p<0,05. При сравнении абсолютных значений КДО, конечно-систолического объема (КСО) ЛЖ и фракции выброса (ФВ) ЛЖ исходно и через 7 дней, а также степени их прироста показано, что интенсивность постинфарктного ремоделирования была более выражена у пациентов 1 группы. Анализ динамики объемов и ФВ ЛЖ показал, что у больных 1 группы отмечается прогрессирование ремоделирования ЛЖ (Me ΔКДО 12,2%) с ухудшением сократимости ЛЖ к 7 сут. (Me ΔКСО 14%), тогда как у пациентов 2 группы на протяжении первых 7 сут. ИМ сохранялись более стабильные величины КДО и КСО ЛЖ, р>0,05 и увеличение ФВ ЛЖ (p=0,03) перед выпиской.
Заключение. В нынешнюю эпоху первичного чрескожного коронарного вмешательства и медикаментозных методов лечения ИМ раннее неблагоприятное ремоделирование ЛЖ развивается реже и отличается менее выраженной дилатацией левых отделов сердца. Ранний постинфарктный период протекает более гладко с меньшим количеством осложнений.
Для цитирования:
Николаева А.М., Рябова Т.Р., Соколов А.А., Рябов В.В. Изменение в течение двадцати лет клинико-эхокардиографических характеристик больных с ранним постинфарктным ремоделированием после первичного инфаркта миокарда с подъемом сегмента ST. Российский кардиологический журнал. 2022;27(12):4951. https://doi.org/10.15829/1560-4071-2022-4951
For citation:
Nikolaeva A.M., Ryabova T.R., Sokolov A.A., Ryabov V.V. Twenty-year changes in the clinical and echocardiographic characteristics of patients with early postinfarction remodeling after primary ST-segment elevation myocardial infarction. Russian Journal of Cardiology. 2022;27(12):4951. (In Russ.) https://doi.org/10.15829/1560-4071-2022-4951
Изучение постинфарктного ремоделирования ле - вого желудочка (ЛЖ) сердца несмотря на то, что является зрелым направлением среди исследовательских тематик в кардиологии, не является закрытым, в котором исследованы все аспекты изменения структуры и функции сердца после инфаркта миокарда (ИМ). В отделении неотложной кардиологии (ОНК) НИИ Кардиологии Томского НИМЦ проблема постинфарктного ремоделирования сердца изучается с 1997г, протокол клинико-инструментальной и лабораторной оценки раннего постинфарктного ремоделирования разработан и внедрен в работу отделения в 1999г [1]. Вместе с тем последние 20 лет лечение больных с ИМ с подъемом сегмента ST (ИМпST), равно как первичная профилактика ишемической болезни сердца, значимо изменились [2][3]. Широкое внедрение методов своевременного экстренного восстановления кровотока в коронарных артериях в рутинную клиническую практику в развитых странах, в т.ч. в России, создание сети медицинских организаций, включающих первичные и региональные сосудистые центры, снизило госпитальную летальность при данной нозологии и изменило клинический портрет больных c ИМ [4-6]. Однако проблема постинфарктного ремоделирования сердца, учитывая высокое распространение на сегодняшний день ишемической сердечной недостаточности (СН), все еще сохраняет свою актуальность [7][8].
Исследования, в которых изучено изменение клинико-эхокардиографических (ЭхоКГ) характеристик пациентов с ранним постинфарктным ремоделированием сердца после первичного ИМпST в течение нескольких десятков лет в условиях одной научной группы, отсутствуют. Целью настоящей работы является изучение динамики клинико-инструментальных характеристик пациентов и структурно-функциональных изменений ЛЖ в раннем периоде первичного ИМпST в 20-летнем интервале деятельности ОНК НИИ кардиологии г. Томска.
Материал и методы
В исследование включено 2 группы пациентов, находившихся на лечении в ОНК в разные периоды с интервалом 20 лет. Первую группу составили 83 пациента, перенесшие ИМпST в 1997-1999гг, вторую группу — 83 пациента, госпитализированные в ОНК с 2019-2020гг. Для решения поставленной цели была создана единая база данных, содержащая информацию о клинико-ЭхоКГ портрете всех пациентов. Клиническая характеристика пациентов 1 группы описана подробно ранее [1]. Критерии включения и исследовательский протокол в обеих группах были едиными. В исследование включали пациентов с ИМпST, последовательно поступавших в ОНК в течение 24 ч от начала острой ишемии миокарда. Критериями исключения были пациенты с тяжелыми клапанными пороками, кардиогенным шоком, терминальной стадией хронической почечной недостаточности (скорость клубочковой фильтрации <15 мл/мин), фибрилляцией предсердий, ранее перенесенным ИМ и выраженными когнитивными нарушениями. Необходимо отметить, что в 1 группу не включались пациенты с отеком легких. Обе работы одобрены локальным этическим комитетом НИИ Кардиологии Томского НИМЦ, всеми пациентами было подписано добровольное информированное согласие на участие в исследовании.
Трансторакальная 2D, допплер-ЭхоКГ в обеих группах проводилась одним и тем же специалистом на разных ультразвуковых системах. Исследование у больных 1 группы было выполнено на аппарате Acuson 128 XP/10 (США), а у 2 группы на аппарате GE Vivid E9 с использованием матричного датчика с частотой 1,7-4,6 МГц (М5S). Объемные параметры и фракцию выброса (ФВ) ЛЖ измеряли в четырехкамерном сечении с использованием формулы "площадь-длина" (1 группа) и модифицированным методом Симпсона (2 группа). Сравнительный анализ основных ультразвуковых показателей проведен по данным ЭхоКГ, выполненным в первые сутки болезни и в подострую фазу (7-10 сут.) ИМ. По приросту конечно-диастолического объема (КДО) ЛЖ >15% к 7-10 сут. постинфарктного периода больные были разделены на две подгруппы: с ремоделированием (ЛЖР+) и без ремоделирования (ЛЖР-) [9][10].
Анализ полученных данных проводили при помощи пакета STATISTICA 10.0. Полученные данные представлены в виде М±SD, где М — среднее значение, SD — стандартное отклонение и Me (Q25-Q75), где Me — медиана, Q25 и Q75 — нижний и верхний квартили, соответственно. Проверка согласия количественных переменных с нормальным законом проводилась с помощью критерия КолмогороваСмирнова с поправкой Шапиро-Уилка. При отсутствии согласия с нормальным распределением статистическая значимость различий между двумя независимыми количественными переменными проводилась с использованием непараметрического критерия Манна-Уитни, а в случае нормального распределения использовали t-критерия Стьюдента для независимых переменных. Оценка достоверности динамики количественных показателей в зависимых выборках проводилась с использованием критерия Вилкоксона. Категориальные переменные представлены в виде относительных величин, статистическую значимость между ними оценивали с помощью критерия хи-квадрат (χ2). Различия переменных между группами считались достоверными при уровне значимости p<0,05.
Результаты
Основные клинико-анамнестические характеристики пациентов, частота встречаемости ранних осложнений ИМ, стратегии реперфузионной и консервативной терапии в группах приведены в таблице 1. Медиана возраста пациентов в 1 и 2 группах составила 55±10,2 и 61±10,7 лет, соответственно. Согласно представленным данным видно, что за 20 лет существенно возросла встречаемость ожирения, сахарного диабета, гипертонической болезни. Кроме того, увеличился средний возраст пациентов и доля женщин с первичным ИМпST. Различия в стратегиях экстренной реперфузионной терапии, как и ожидалось, были существенными в виде полной реализации экстренной реваскуляризации в острую фазу болезни у пациентов 2 группы. Уменьшилось время от начала клиники ИМ до восстановления просвета инфаркт-связанной артерии (ИСКА). Общее время ишемии миокарда 267,5 (215; 320) мин в 1 группе и 240 (180; 320) мин во 2 группе (p=0,04), а в подгруппе больных с ЛЖР+ разницы во времени реперфузии миокарда не выявлено.
При сравнении абсолютных значений стандартных параметров, отражающих ремоделирование сердца, выявлена разница в объемных показателях ЛЖ. У пациентов 1 группы КДО ЛЖ исходно и через 7 дней был значимо больше. Подобные отличия получены и в показателях контрактильной функции ЛЖ в виде низких значений ФВ ЛЖ, большего конечно-систолического объема (КСО) ЛЖ и индекса нарушения локальной сократимости (ИНЛС). Анализ динамики объемов и ФВ ЛЖ показал, что у больных 1 группы отмечается прогрессирование ремоделирования ЛЖ (ΔКДО 12,2%), p<0,0001 с ухудшением сократимости ЛЖ в подостром периоде ИМ (ΔКСО 14%), тогда как у пациентов 2 группы на протяжении первых 7 сут. ИМ сохранялись более стабильные величины КДО и КСО ЛЖ, р>0,05 и к концу острой фазы болезни улучшение контрактильной функции ЛЖ в виде увеличения ФВ ЛЖ, p=0,03. Межгрупповое различие абсолютных значений сравниваемых показателей ЛЖ и их статистическая значимость представлены в таблице 2.
При сравнении 1 и 2 групп больных с ранним дезадаптивным ремоделированием исходно объемы и сократительная функция ЛЖ не различались, тогда как в подостром периоде наблюдалась более выраженная дилатация ЛЖ в 1 группе (табл. 2).
Во 2 группе лица как женского, так и мужского пола в течение всего госпитального периода показали более сохранные структурно-функциональные показатели сердца (табл. 2).
Кроме того, для более полной и объективной оценки изменения характера ремоделирования ЛЖ дополнительно сравнили степень прироста объемных показателей и ФВ ЛЖ в группах. По данным, представленным в таблице 3, видно, что достоверная разница сохраняется также при сравнении степени прироста объемных параметров. При этом такая закономерность распространяется у пациентов с ЛЖР+ и в подгруппе в зависимости от пола. Значимой разницы ΔФВ ЛЖ не выявлено.
Таблица 1
Сравнение клинико-анамнестической характеристики пациентов и стратегии лечения острого ИМпST в двух группах

Сокращения: АРА — антагонист рецептора ангиотензина II, иАПФ — ингибитор ангиотензинпревращающего фермента, ЛЖ — левый желудочек, ЛЖР — ремоделирование левого желудочка, ОСН — острая сердечная недостаточность, ЧКВ — чрескожное коронарное вмешательство, р — уровень значимости.
Таблица 2
Сравнение стандартных ультразвуковых параметров у всех пациентов, в подгруппе дезадаптивного ремоделирования и в зависимости от пола
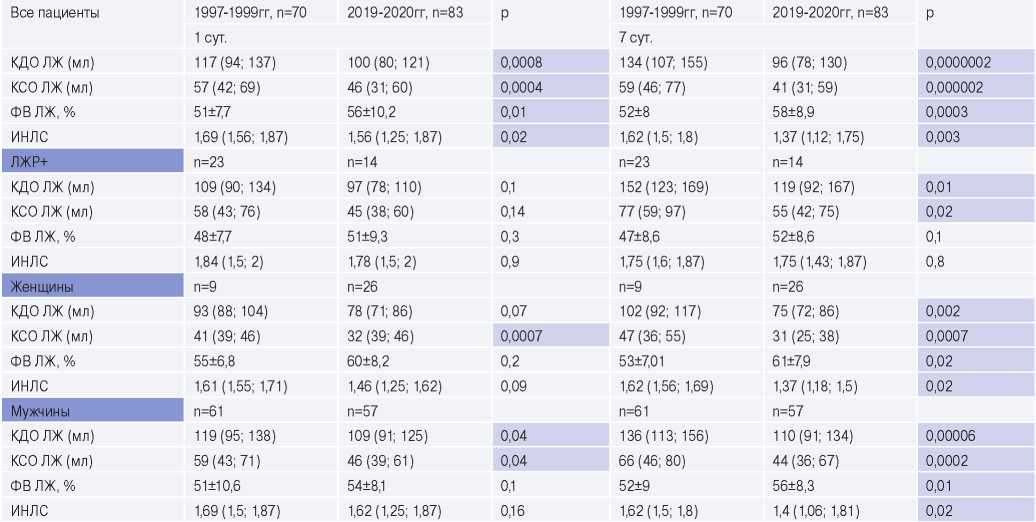
Сокращения: ИНЛС — индекс нарушения локальной сократимости, КДО — конечно-диастолический объем, КСО — конечно-систолический объем, ЛЖ — левый желудочек, ЛЖР — ремоделирование левого желудочка, ФВ — фракция выброса, p — уровень значимости.
Таблица 3
Сравнение динамики стандартных ультразвуковых параметров у всех пациентов с ИМпST, в подгруппе дезадаптивного ремоделирования и в зависимости пола
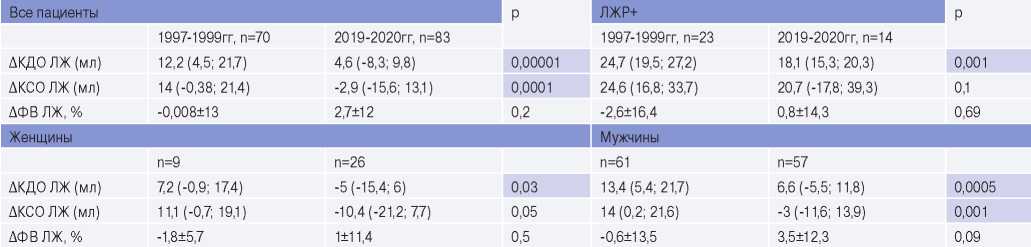
Сокращения: КДО — конечно-диастолический объем, КСО — конечно-систолический объем, ЛЖ — левый желудочек, ЛЖР — ремоделирование левого желудочка, ФВ — фракция выброса, p — уровень значимости.
На основании динамики КДО и КСО ЛЖ к 7 сут. ИМ выделено 3 типа постинфарктного ремоделирования сердца: обратное (при уменьшении КСО ЛЖ на ≥15% и более от исходного значения) [10][11], без динамики (при уменьшении или увеличении КДО ЛЖ не >15%) и неблагоприятное (при приросте КДО ЛЖ на 15% и более). В 1 группе — обратное развитие миокарда ЛЖ выявлено у 10% пациентов, стабильные значения КДО ЛЖ у 53% и неблагоприятное у 32,8%, во 2 группе 24%, 67% и 17%, соответственно (p<0,05).
На сегодняшний день, скорее всего, благодаря успешному восстановлению кровотока в ИСКА, раннего назначения ингибиторов ангиотензинпревращающего фермента (иАПФ), бета-блокаторов и статинов в структуре осложнений ИМ уменьшилась частота развития острой аневризмы ЛЖ, постинфарктной стенокардии (р<0,001) и синдрома Дресслера (р=0,052).
Медикаментозная терапия и частота назначения соответствующих групп препаратов для лечения острого ИМ (ОИМ) представлены в таблице 1, следует отметить высокий уровень внедрения рекомендаций по медикаментозному лечению больных ИМ: иАПФ/антагонисты рецептора ангиотензина II, бета-блокаторов и статинов с одновременным снижением частоты назначения пролонгированных нитратов, сердечных гликозидов.
Проведен корреляционный анализ прироста КДО ЛЖ с факторами, ассоциированными с постинфарктным ремоделированием ЛЖ. Во 2 группе ΔКДО ЛЖ была связана с пиковым уровнем кардиоспецифических ферментов: с креатинфосфокиназой (КФК) (r=0,40, p=0,0023), КФК МВ (r=0,42, p=0,00008) и тропонином I (r=0,46, p=0,0085), при этом связь со временем ишемии миокарда отсутствовала (r=0,04, p=0,71). В 1 группе получена взаимосвязь ΔКДО ЛЖ со временем реперфузии ИСКА (r=0,39, p=0,003), c амплитудой пика КФК (r=0,38, p=0,003).
В 1 группе выявленная корреляция прироста КДО ЛЖ с показателями объема повреждения миокарда подтверждается множественной линейной регрессией с пошаговым включением факторов, ассоциированных с неблагоприятным ремоделированием ЛЖ: КФК, время реперфузии, ИНЛС в первые сутки ИМ, исходная ЧСС (КДО ЛЖ adjusted R=0,26, КФК b*=0,32, ИНЛС b=0,52, p=0,002). Во 2 группе взаимосвязь прироста КДО ЛЖ с пиковыми значениями кардиоспецифических ферментов, общим временем ишемии миокарда в условиях множественных сравнений теряется.
Обсуждение
Согласно результатам исследования глобального бремени болезней (Global Burden of Disease) ~17,3 млн человек умерло от заболеваний системы кровообращения в 2013г, что на 41% больше, чем количество смертей в 1990г [12]. Хроническая СН является исходом большинства сердечно-сосудистых заболеваний и ассоциируется высокой смертностью, инвалидизацией, также частыми госпитализациями, что определяет ее как одну из приоритетных проблем здравоохранения во всем мире [6][13]. Анализ отечественного регистра ЭПОХА-ХСН показывает, что в нашей стране ИМ является причиной ХСН примерно на 10% чаще, чем 20 лет назад, что, несомненно, связано с улучшением выживаемости этой категории больных [6]. Доказано, что в основе развития и прогрессирования ишемической СН лежит постинфарктное ремоделирование ЛЖ, которое характеризуется злокачественным расширением камер сердца и нарушением его насосной функции. В ранее опубликованных работах сообщается, что оно развивается в среднем у 30% больных после ИМпST [1, 13, 14].
В последние годы данные регистровых исследований сообщают изменение клинического портрета пациента с ОИМ [15-17]. Проведенный сравнительный анализ показал, что на сегодняшний день пациент с первичным ИМпST, поступивший в палату интенсивной терапии, старше, с увеличением доли женщин и высокой частотой встречаемости таких фоновых состояний, как гипертоническая болезнь, ожирение и сахарный диабет 2 типа. Широкая встречаемость модифицируемых факторов риска в настоящее время находит объяснение в повышении качества жизни современного пациента, научно-техническом прогрессе, малоподвижном образе жизни, потреблении доступных высококалорийных продуктов питания и постарении населения. При этом одной из основных причин роста гипертонии и сахарного диабета 2 типа является высокое распространение ожирения, которое в наше время приняло форму эпидемии [12-18]. На естественное течение ишемической болезни сердца также оказало влияние внедрение современных лекарственных препаратов и высокотехнологичной медицинской помощи. Данный тренд в виде характерной динамики описанных факторов риска, существенного увеличения количества интервенционных вмешательств и широкого внедрения в рутинную практику ингибиторов P2Y12, низкомолекулярных гепаринов, статинов, блокаторов ренин-ангиотензивной системы и бета-блокаторов в нашем центре за 20 лет согласуется с результатами как зарубежных (KAMIR (доля ИМпST 56,6%), SHWEDEHEART), так и отечественных регистров [2][16][17][19]. Отличием является то, что в обоих регистрах показано постепенное увеличение доли мужчин, помимо этого, в шведском регистре показано уменьшение среднего возраста ИМ. Необходимо отметить, что исходно доля женщин в обоих регистрах была больше, в частности, в шведском регистре составляет 34,1%, что, вероятно, объясняется высоким средним возрастом больных 20 лет назад. Так, ранее проведенный исследователями ОНК сравнительный анализ клинико-анамнестической характеристики пациентов ИМпST с данными европейского регистра EHS ACS подтверждает меньшую долю мужчин относительно зарубежных стран [20]. Кроме того, в отечественном регистре РЕКОРД-3 средний возраст пациентов и процент женщин в структуре ИМпST сопоставим с результатами данного анализа. Безусловно, основным отличием является и то, что реализация первичного чрескожного коронарного вмешательства (ЧКВ) в нашей стране не достигает абсолютных значений в сравнении с западными странами, что связано с территориальными проблемами, большой долей сельского населения и недоступностью для них инвазивной помощи [19]. В связи с этим примерно у половины пациентов проводится тромболитическая терапия в рамках фармако-инвазивной реперфузии ИСКА.
Таким образом, исходя из вышеизложенного, на сегодняшний день ЭхоКГ портрет пациента с ИМпST отличается меньшей степенью дилатации ЛЖ, а также лучшим восстановлением контрактильной функции ЛЖ к концу острой фазы ИМ, чем у когорты больных, перенесших ИМ в 1997-1999гг. Выявленная разница распространяется и при делении на подгруппы в зависимости от гендерной принадлежности и у больных с дезадаптивным постинфарктным ремоделированием ЛЖ. Кроме того, изменилось соотношение типов ремоделирования сердца. На основании полученных данных можно предположить, что в наше время ремоделирование по дилатационному типу развивается реже, а процент больных с обратным ремоделированием ЛЖ к моменту выписки из стационара существенно увеличился. Иными словами, в нынешнюю эпоху первичного ЧКВ и систематического приема "антиремоделирующих" препаратов частота и степень выраженности ремоделирования после ОИМ изменилась.
Отдельное внимание требует обсуждение острой СН (ОСН) при ИМ. Из данного анализа конкретный вывод касательно динамики встречаемости ОСН у пациентов с ранним постинфарктным ремоделированием при ИМпST за 20 лет невозможно сделать, учитывая, что в обоих исследованиях критериям исключения явился кардиогенный шок, притом в первую группу не были включены пациенты с отеком легких. Тем не менее представленные здесь данные показывают уменьшение частоты развития ОСН II класса по Killip, которая, более вероятно, обусловлена ранним поступлением пациентов в ЧКВ-центр и проведением своевременного инвазивного вмешательства. Подобные результаты показаны также в шведском регистре ИМпST [2]. Некоторые литературные данные сообщают, напротив, увеличение доли пациентов с тяжелой ОСН при ИМ (с 4% в 1992-1996гг до 12-14% в 2001-2014гг) [13]. Последнее объясняется увеличением в возрастной группе больных пожилого возраста, с их более тяжелым клинико-анамнестическим фоном и полиморбидностью.
В данном анализе ранее установленные факторы, ассоциирующиеся с неблагоприятным течением ИМ, не показали связи с развитием дезадаптивного постинфарктного ремоделирования ЛЖ. Возможно, это свидетельствует о том, что новые методы лечения ИМ полностью реализовали свои возможности, и развитие дезадаптивного ремоделирования ЛЖ обусловлено действием других факторов, к примеру, особенностями асептического воспаления, процессами восстановительной регенерации, а также генетической предрасположенностью.
Ограничения исследования. В сравнительном анализе отсутствуют пациенты с кардиогенным шоком (в обеих группах) и отеком легких (в 1 группе), которые, как правило, являются проявлением более ярко выраженного ремоделирования сердца после ОИМ. Категория больных с кардиогенным шоком представляет наиболее гетерогенную и сложную группу пациентов, что значительно ограничивает исследовательскую деятельность в данном направлении.
Кроме того, были использованы разные методики расчета объемов ЛЖ. В исследовании 1997-1999гг применяли формулу "площадь-длина", в настоящее время — биплановый метод дисков, согласно последним рекомендациям по количественной оценке камер сердца [21]. Общепринято, что метод "дисков" более предпочтителен для расчета объемов ЛЖ, т.к. лучше учитывает изменение геометрии ЛЖ, однако 20 лет назад не все ультразвуковые сканеры имели соответствующую опцию. В связи с этим при сравнении процессов ремоделирования ЛЖ у исторической и современной групп акцент делали не на абсолютные величины объемов ЛЖ, а на их динамику, более того, при использовании разных алгоритмов определения объемов ЛЖ разница может нивелироваться небольшой величиной выборки и относительно сохранной геометрией ЛЖ в обеих группах больных [22].
Заключение
Сравнительный анализ результатов двух исследований, полученных в условиях одного лечебного учреждения и исследовательской группы, показал, что на сегодняшний день клинический портрет пациента ИМпST старше в среднем на 5 лет, с высоким индексом коморбидности и большей долей лиц женского пола, чем 20 лет назад.
В нынешнюю эпоху первичного ЧКВ и медикаментозных методов лечения ИМ раннее неблагоприятное ремоделирование ЛЖ развивается реже и отличается менее выраженной дилатацией левых отделов сердца. Несмотря на широкую встречаемость вышеперечисленных традиционных факторов риска коронарной болезни сердца, ранний постинфарктный период протекает более гладко с меньшим количеством осложнений.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Рябова Т. Р., Рябов В. В., Соколов А. А., Марков В. A. Роль раннего ремоделирования левого желу дочка в формировании ХСН у больных острым передним инфарктом миокарда. Сер дечная недостаточность. 2003;3:130-4.
2. Szummer K, Wallentin L, Lindhagen L, et al. Improved outcomes in patients with ST-elevation myocardial infarction during the last 20 years are to implementation of evidencebased treatments: experiences from the SWEDEHEART registry 1995-2014. Eur Heart J. 2017;38(41):3056-65. doi:10.1093/eurheartj/ehx515.
3. van der Bijl P, Abou R, Goedemans L, et al. Left Ventricular Post-Infarct Remodeling: Implications for Systolic Function Improvement and Outcomes in the Modern Era. JACC: Heart Failure. 2020;8(2):131-40. doi:10.1016/j.jchf.2019.08.014.
4. Grant WR, Rossi JE, Cannon CP. Acute myocardial infarction. Lancet. 2017;389(10065): 156. doi:10.1016/S0140-6736(17)30007-7.
5. Johansson S, Rosengren A, Young K, et al. Mortality and morbidity trends after the first year in survivors of acute myocardial infarction: a systematic review. BMC Cardiovasc Disord. 2017;17:53. doi:10.1186/s12872-017-0482-9.
6. Фомин И. В. Хроническая сердечная недостаточность в Российской Федерации: что сегодня мы знаем и что должны делать. Российский кардиологический журнал. 2016;(8):7-13. doi:10.15829/1560-4071-2016-8-7-13.
7. Jenča D, Melenovský V, Stehlik S, et al. Heart failure after myocardial infarction: inci dence and predictors. ESC Heart Fail. 2021;8(1):222-37. doi:10.1002/ehf2.13144.
8. Im MS, Kim HL, Kim SH, et al. Different prognostic factors according to left ventricular systolic function in patients with acute myocardial infarction. In J Cardiol. 2016;221:90-6. doi:10.1016/j.ijcard.2016.06.100.
9. Pezel Th, Besseure des Horts T, Schaaf M, et al. Predictive value of early cardiac magnetic resonance imaging functional and geometric indexes for adverse left ventricular remodeling in patients with anterior ST-segment elevation myocardial infarction: A report from the CIRCUS study. Arch Cadriovasc. Dis. 2020;113(11):710-20. doi:10.1016/j.acvd.2020.05.024.
10. Reindl M, Reinstadler SJ, Tiller Ch, et al. Prognosis-based definition of left ventricular remodeling after ST-elevation myocardial infarction. Eur Radiol. 2019;29(5):2330-9. doi:10.1007/s00330-018-5875-3.
11. Huttin O, Coiro S, Selton-Suty C, et al. Prediction of Left Ventricular Remodeling after a Myocardial Infarction: Role of Myocardial Deformation: A Systematic Review and MetaAnalysis. PLoS One. 2016;11(12):e0168349. doi:10.1371/journal.pone.0168349.
12. Bragazzi NL, Zhong WZ, Shu JS, et al. Burden of heart failure and underlying causes in 195 countries and territories from 1990 to 2017. European Journal of Preventive Cardiology. 2020;28(15):1682-90. doi:10.1093/eurjpc/zwaa147.
13. Dunlay SM, Roger VL, Redfield MM. Epidemiology of heart failure with preserved ejec tion fraction. Nat Rev Cardiol. 2017;14(10):591-602. doi:10.1038/nrcardio.2017.
14. Galli A, Lombardi F. Postinfarction Left Ventricular Remodeling: A Prevailing Cause of Heart Failure. Cardiol Res Pract. 2016;2016:2579832. doi:10.1155/2016/2579832.
15. Parto P, Lavie JK. Obesity and Cardiovascular Diseases. Curr Probl Cardiol. 2017;42(11): 376-94. doi:10.1016/j.cpcardiol.2017.04.004.
16. Kim Y, Ahn Y, Chan Cho M, et al. Current status of acute myocardial infarction in Korea. Korean J Intern Med. 2019;34(1):1-10. doi:10.3904/kjim.2018.381.
17. Belle L, Cayla G, Cottin Y, et al. French Registry on Acute ST-elevation and non-STelevation Myocardial Infarction 2015 (FAST-MI 2015). Design and baseline data. Arch Cardiovasc Dis. 2017;110(6-7):366-78. doi:10.1016/j.acvd.2017.05.001.
18. Cunningham JW, Vaduganathan M, Claggett BL, et al. Myocardial Infarction in Heart Failure With Preserved Ejection Fraction: Pooled Analysis of 3 Clinical Trials. JACC Heart Fail. 2020;8(8):618-26. doi:10.1016/j.jchf.2020.02.007.
19. Эрлих А. Д., Грацианский Н. А. Российский регистр острого коронарного синдрома "РЕКОРД-3". Характеристика пациентов и лечение до выписки из стационара. Кардиология. 2016;56(4):16-24. doi:10.18565/cardio.2016. 4.16-24.
20. Марков В. А., Вышлов Е. В., Карпов Р. С. Коронарная реперфузия при инфарк те миокарда с подъемом сегмента ST: проблемы и решения. Российский кардио логический журнал. 2015;(1):53-8. doi:10.15829/1560-4071-2015-01-53-58.
21. Lang RM, Badano LP, Mor-Av IV, et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. J Am Soc Echocardiogr. 2015;28(1):1-39. doi:10.1016/j.echo.2014.10.003.
22. Шиллер Н. Б., Осипов М. А. Клиническая эхокардиография. М.: МЕДпрессинформ, 2018. р.344. ISBN: 978-5-00030-525-6.
Об авторах
А. М. НиколаеваРоссия
Антонина Михайловна Николаева — младший научный сотрудник отделения неотложной кардиологии.
Конфликт интересов:
все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
Т. Р. Рябова
Россия
Тамара Ростиславовна Рябова — кандидат медицинских наук, старший научный сотрудник лаборатории ультразвуковой и функциональной диагностики.
Томск
Конфликт интересов:
все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
А. А. Соколов
Россия
Александр Анатольевич Соколов — доктор медицинских наук, заведующий лабораторией ультразвуковых и функциональных методов исследования.
Томск
Конфликт интересов:
все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
В. В. Рябов
Россия
Вячеслав Валерьевич Рябов — доктор медицинских наук, руководитель отделения неотложной кардиологии, ведущий научный сотрудник.
Томск
Конфликт интересов:
все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье
Дополнительные файлы
Рецензия
Для цитирования:
Николаева А.М., Рябова Т.Р., Соколов А.А., Рябов В.В. Изменение в течение двадцати лет клинико-эхокардиографических характеристик больных с ранним постинфарктным ремоделированием после первичного инфаркта миокарда с подъемом сегмента ST. Российский кардиологический журнал. 2022;27(12):4951. https://doi.org/10.15829/1560-4071-2022-4951
For citation:
Nikolaeva A.M., Ryabova T.R., Sokolov A.A., Ryabov V.V. Twenty-year changes in the clinical and echocardiographic characteristics of patients with early postinfarction remodeling after primary ST-segment elevation myocardial infarction. Russian Journal of Cardiology. 2022;27(12):4951. (In Russ.) https://doi.org/10.15829/1560-4071-2022-4951

















































