Перейти к:
Инфекционный и небактериальный тромбоэндокардит у больных с постковидным вирусно-иммунным миокардитом
https://doi.org/10.15829/1560-4071-2022-4827
Аннотация
Возможность воспалительного поражения сердца (как мио-, так и эндокарда) спустя месяцы после новой коронавирусной инфекции (COVID-19) практически не изучена, тем более не разработаны подходы к лечению миокардита в сочетании с различными формами эндокардита.
Цель. Изучить частоту и механизмы коронавируса (SARS-Cov-2)-ассоциированного поражения эндокарда у больных с морфологически верифицированным постковидным миокардитом, разработать подходы к комплексной терапии.
Материал и методы. В исследование включены 18 больных с тяжелым морфологически верифицированным постковидным миокардитом (9 мужчин, 51,1±9,4 лет, от 35 до 66 лет). Исключались больные с верифицированным миокардитом/инфарктом миокарда в анамнезе, ревматическими пороками сердца и системными иммунными заболеваниями. Средний срок после COVID-19 составил 6,5 [3,5; 10] мес. Диагноз миокардита подтвержден с помощью эндомиокардиальной биопсии (включая иммуногистохимическое исследование с антителами к CD3, CD20, CD45, CD68, к антигенам SARS-Cov-2; полимеразной цепной реакции на РНК SARS-Cov-2, ДНК кардиотропных вирусов). Уровень антикардиальных антител в крови определяли методом непрямой иммунофлюоресценции, проводили эхокардиографию, магнитно-резонансную томографию (n=8), мультиспиральную томографию сердца (n=1), коронарографию (n=14).
Результаты. По данным биопсии выявлены активный (n=12) и пограничный (n=3) лимфоцитарный миокардит, эозинофильный (n=2) и гигантоклеточный (n=1) миокардит. У 4 больных диагностирован небактериальный тромбоэндокардит (НБТЭ) с париетальным и внутрисосудистым тромбозом, у одного – инфекционный эндокардит (ИЭ) двустворчатого аортального клапана. Персистенция SARS-Cov-2 в миокарде выявлена в 72% случаев (у 3 больных с НБТЭ, 1 с ИЭ и 9 без эндокардита). Титры антикардиальных антител повышены в 3-4 раза у 94% больных. Пациентов с эндокардитом отличали бóльшие размеры камер сердца, более низкая фракция выброса (27,5±6,6% vs 36,0±13,4%), более выраженная легочная гипертензия и регургитация на клапанах. Внутрижелудочкового тромбоза по данным эхокардиографии/магнитно-резонансной томографии и кардиоэмболий не отмечено. Лечение у всех больных включало метилпреднизолон в средней дозе 24 мг/сут., у 10 из них результат отслежен в срок не ˂3 мес.: фракция выброса составила 46,0±12,7% у больных с эндокардитом и 44,3±7,3% без него.
Заключение. Эндокардит у больных с постковидным миокардитом выявлен в 28% (один случай ИЭ и 4 НБТЭ). Основными механизмами постковидного миокардита и НБТЭ являются длительная (до 18 мес.) персистенция SARS-Cov-2 в миокарде и развитие аутоиммунной реакции. Эндокардит диагностирован у более тяжелых больных, в т.ч. с гигантоклеточным и эозинофильным миокардитом. Требует дальнейшего изучения эффективность стероидной терапии в сочетании с антикоагулянтами у больных с НБТЭ, при развитии ИЭ стероиды также могут рассматриваться как препараты выбора в лечении миокардита (в сочетании с антибиотиками и иммуноглобулином).
Ключевые слова
Для цитирования:
Благова О.В., Айнетдинова Д.Х., Коган Е.А., Лутохина Ю.А., Новосадов В.М., Савина П.О., Зайцев А.Ю., Куклева А.Д., Рубцова С.Е., Кривцова С.Н., Недоступ А.В. Инфекционный и небактериальный тромбоэндокардит у больных с постковидным вирусно-иммунным миокардитом. Российский кардиологический журнал. 2022;27(9):4827. https://doi.org/10.15829/1560-4071-2022-4827
For citation:
Blagova O.V., Ainetdinova D.Kh., Kogan E.A., Lutokhina Yu.A., Novosadov V.M., Savina P.O., Zaitsev A.Yu., Kukleva A.D., Rubtsova S.E., Krivtsova S.N., Nedostup A.V. Infective and nonbacterial thrombotic endocarditis in patients with post-COVID-19 viral-immune myocarditis. Russian Journal of Cardiology. 2022;27(9):4827. (In Russ.) https://doi.org/10.15829/1560-4071-2022-4827
Пандемия новой коронавирусной инфекции (Coronavirus-induced disease 2019, COVID-19) уже почти 2 года привлекает пристальное внимание к различным вариантам воспалительного поражения сердца. Если вначале возможность развития собственно миокардита, в т.ч. вследствие прямого воздействия коронавируса (Severe acute respiratory syndrome-related coronavirus 2, SARS-Cov-2) на миокард, вызывала сомнения, то к настоящему времени она хорошо доказана, в т.ч. в отечественных работах [1]. Миокардит является, как правило, лимфоцитарным, имеет ряд морфологических особенностей, может сопровождаться или не сопровождаться персистенцией SARS-Cov-2 в миокарде и является по своей природе типичным инфекционно-иммунным миокардитом. При этом спектр повреждений миокарда в рамках COVID-19 выходит за рамки воспаления — ведущие эксперты по болезням миокарда выделяют до 6 различных механизмов, включая воздействие цитокинового шторма и аутоантител [2].
Следует отметить, что вал публикаций на тему "миокардит и COVID-19" (>1100 в базе данных Medline) в большинстве случаев носит умозрительный и предположительный характер — у авторов отсутствуют необходимые инструменты для дифференцировки повреждений миокарда (в первую очередь эндомиокардиальная биопсия (ЭМБ)). Вместе с тем применение ЭМБ говорит о возможности длительного воспалительного поражения сердца, индуцированного SARS-Cov-2. Наряду с миокардитом в рамках острой COVID-19 нами впервые описаны случаи морфологически подтвержденного постковидного миокардита с длительной (до 9 мес.) персистенцией вируса в миокарде [3]. Ранее сообщалось лишь о кратковременной (1 мес.) персистенции с быстрым регрессом миокардита и элиминацией вируса [4].
Публикаций касательно эндокардита при COVID-19 существенно меньше. Прежде всего, инфекционный эндокардит (ИЭ) рассматривается как одно из возможных бактериальных осложнений COVID-19. По некоторым данным, SARS-Cov-2 способен вызывать функциональное истощение CD4/CD8 лимфоцитов с развитием стойкой стафиллококковой бактериемии и, как следствие, эндокардита [5]. Случаи типичного ИЭ привлекают особое внимание ввиду предполагаемого взаимного неблагоприятного влияния вирусной и бактериальной инфекции и описаны как в острый период COVID-19 [6], так и в ранние сроки после [7].
Вместе с тем важной особенностью эндокардита, ассоциированного с инфекцией SARS-Cov-2, может быть высокая частота его сочетания с повреждением миокарда (в т.ч. миокардитом). Патогенетическая связь миокардита и эндокардита при COVID-19 не ясна — одновременное или последовательное развитие этих воспалительных заболеваний сердца до сих пор определенно не описано в литературе. Это сочетание в принципе является достаточно редким и обусловлено, как правило, двумя факторами — либо прямым инфекционным поражением (бактериальным, в т.ч. туберкулезным, грибковым, вирусным) либо аутоиммунным процессом (ревматизм, системные васкулиты, системная красная волчанка, гиперэозинофильные синдромы).
При COVID-19, как уже хорошо известно, агрессивны оба фактора (вирусно-бактериальный и аутоиммунный). Однако результаты их взаимодействия на уровне сердца практически не изучены. Тем более отсутствуют в доступной литературе описания случаев успешного одномоментного лечения эндокардита и миокардита у больных с COVID-19. Подходы к терапии таких больных совершенно не разработаны.
Целью настоящего исследования было изучить частоту и механизмы SARS-Cov-2-ассоциированного поражения эндокарда у больных с морфологически верифицированным постковидным миокардитом, разработать подходы к комплексной терапии.
Материал и методы
В исследование включены 18 больных с морфологически верифицированным постковидным миокардитом (9 мужчин и 9 женщин, средний возраст 51,1±9,4 лет, от 35 до 66 лет). Исследование проводилось на базе кардиологического отделения Факультетской терапевтической клиники им. В. Н. Виноградова Сеченовского университета.
Критериями включения стали перенесенная и верифицированная серологически COVID-19 в анамнезе, появление или заметное прогрессирование хронической сердечной недостаточности после COVID-19, наличие далласских морфологических критериев миокардита согласно рекомендациям Европейского общества кардиологов 2013г. Критериями исключения были наличие верифицированного при магнитно-резонансной томографии (МРТ) и/или ЭМБ миокардита в анамнезе, проведение иммуносупрессивной терапии (ИСТ) на момент биопсии или ранее, инфаркт миокарда в анамнезе, ревматические пороки сердца, диффузные заболевания соединительной ткани, системные васкулиты, саркоидоз.
Острая COVID-19 у большинства пациентов протекала нетяжело и лишь у 4 больных потребовала госпитализации (двоим из них проводилась стероидная терапия); ни в одном случае не возникло потребности в неинвазивной или инвазивной вентиляции легких. Во время COVID-19 исследование назофарингеальных мазков на SARS-Cov-2 методом полимеразной цепной реакции (ПЦР) проведено 11 больным и дало положительный результат у 5 из них; в последующем у всех больных выявлено диагностически значимое повышение уровня IgG к SARSCov-2. У двоих пациенток кардиальные симптомы развились после вакцинации, проведенной вслед за перенесенной COVID-19. В первый месяц от появления симптомов COVID-19 компьютерная томография (КТ) выполнена 6 пациентам, выявлена картина двусторонней вирусной пневмонии (КТ-1 у 4 и КТ-2 у 2 больных).
У одного из пациентов в детстве был диагностирован двустворчатый аортальный клапан (АК), у 3 больных до развития COVID-19 имелись нарушения ритма неясного генеза без значимой систолической дисфункции, еще у 3 выявлялась умеренная дисфункция левого желудочка (ЛЖ), которая ретроспективно могла расцениваться как дебют миокардита. После COVID-19 отмечено появление/быстрое нарастание симптомов хронической сердечной недостаточности, в т.ч. бивентрикулярной у 14 больных (78%). Непосредственно во время COVID-19 диагноз миокардита не был поставлен ни разу.
Среднее время обращения в клинику после COVID-19 составило 6,5 [ 3,5; 10] мес., срок появления симптомов после COVID-19 — от 3 нед. до 5 мес. Длительность наблюдения после включения в исследование варьирует на сегодня от 1 до 14 мес.
Методы обследования. Диагноз миокардита подтвержден с помощью ЭМБ правого желудочка (ПЖ) у 17 больных и интраоперационной биопсии ПЖ у одной (в ходе операции протезирования трикуспидального клапана). Исследование биоптатов миокарда проводилось на кафедре патологической анатомии им. акад. А.И. Струкова Сеченовского университета с применением окрасок гематоксилин-эозином, по Ван Гизону, иммуногистохимического (ИГХ) исследования с антителами к CD3, CD20, CD45, CD68, а также к антигенам SARS-Cov-2 (нуклеокапсидному и Spike-антигену). Последнее исследование выполнено в рамках гранта РФФИ № 20-315-90021/20.
Дополнительно проводилось исследование миокарда методом ПЦР на ДНК парвовируса В19, вирусов герпеса 1, 2, 6, 8 типов, герпеса зостер, вируса Эпштейна-Барр, цитомегаловируса, аденовирусов, а также РНК SARS-Cov-2. ПЦР с обратной транскрипцией в реальном времени (РТ-ПЦР) применялась для выявления вирусной РНК в миокарде. Фиксированный в парафине материал обрабатывали RNeasy FFPE Kit (Qiagen, Hilden, Германия) для выделения тотальной РНК. Для выявления SARSCoV-2 20 мкл реакционной смеси, содержащей 2 × Master Mix и RT из набора QuantiTect probe RT-PCR (Qiagen, Hilden, Германия), набор праймеров/зондов N2 (праймер NIID_2019-nCoV_N_F2, праймер NIID_2019-nCoV_N_R2 и зонд NIID_2019-nCoV_N_ P2) и 5 мкл РНК, экстрагированной из миокарда, подвергали ПЦР в амплификаторе QuantStudio 5 (Thermo Scientific, США). Для проведения реакции применялись условия 500C в течение 30 мин, 950С в течение 15 мин, и 45 циклов 950C в течение 15 с и 600C в течение 1 мин. Для всех образцов, положительных по РТ-ПЦР, были получены значения Ct. Значения Ct образцов сравнивались со значениями Ct контрольных позитивных и негативных образцов. В одном случае выполнены также посев крови и ПЦР миокарда и крови на ДНК различных бактериальных возбудителей.
Всем больным определяли уровень антикардиальных антител (АКА) в крови методом непрямой иммунофлюоресценции, проводили эхокардиографию (ЭхоКГ) и Холтеровское мониторирование электрокардиограммы (ЭКГ). Дополнительно выполнены чреспищеводная ЭхоКГ (n=3), МРТ (n=8) и мультиспиральная КТ (МСКТ) сердца (n=1), коронарография (n=14).
Статистический анализ. Анализ проведен с использованием программы IBM SPSS v.22. Дискретные данные представлены в виде абсолютного значения и процентов, непрерывные данные — в виде среднего арифметического ± среднеквадратичное отклонение в случае нормального распределения или в виде квартилей 50 [ 25; 75], если распределение отличается от нормального.
Этический комитет. Все пациенты подписывали формы информированного согласия на биопсию миокарда и последующую ИСТ, одобренные локальным этическим комитетом Сеченовского университета.
Результаты
Диагноз миокардита по данным биопсии миокарда и вирусологического исследования
При анализе биоптатов миокарда диагностированы следующие формы миокардита: активный лимфоцитарный (n=12, рис. 1 г), пограничный лимфоцитарный (n=3, рис. 1 а), эозинофильный (n=2, рис. 1 б; в отсутствие значимой эозинофилии крови его активность подтверждена 2-3-кратным повышением уровня эозинофильного катионного протеина в крови) и гигантоклеточный (n=1, рис. 1 в). Особенностями миокардита были высокая частота лизиса цитоплазмы кардиомиоцитов (n=16), эндотелиит (n=14) c признаками тромбоза микрососудов в отдельных случаях (n=5), набухание (отек) интерстиция в 77,8% случаев при отсутствии крупноочагового и слабой выраженности периваскулярного/перимускулярного кардиосклероза (признак небольшой давности процесса). В 55,6% (n=10) случаев выявлен субэндокардиальный липоматоз разной степени выраженности.
Во всех случаях лимфоцитарный характер миокардита подтвержден с помощью ИГХ исследования: количество CD3-позитивных лимфоцитов превышало 7 на 1 мм2 (в среднем составило 11 клеток при увеличении х200), количество CD45-позитивных лимфоцитов превышало 14 на 1 мм2 (в среднем составило 27 клеток). Чисто CD68-позитивных клеток (макрофагов) было невелико и составило в среднем 11 клеток при увеличении х100. СD-20 позитивные клетки (В-лимфоциты) выявлены в единичном количестве у 7 больных.
В 15 случаях из 18 (83,3%) подтверждена персистенция SARS-Cov-2 в миокарде. С этой целью параллельно использовались ПЦР на РНК вируса и ИГХ исследование на белки SARS-Cov-2 (рис. 1 г); во всех случаях результаты обеих методик совпали. Отсутствие вируса в миокарде коррелировало с меньшей активностью миокардита (пограничный у 2/3 вируснегативных больных). У двоих SARS-Cov2-позитивных пациенток (с активным лимфоцитарным и гигантоклеточным миокардитом) методом ПЦР выявлена также ДНК парвовируса В19 в миокарде.

Рис. 1. Морфологическая картина НБТЭ у больных с различными формами постковидного миокардита.
Примечание: эндомиокардиальные биоптаты правого желудочка, А-В, Д-Ж — окраска гематоксилин-эозином, Д, З — ИГХ исследование на нуклеокапсидный белок SARS-Cov-2. Прилежащие к утолщенному эндокарду тромботические массы с лимфоцитарно-лейкоцитарной инфильтрацией у больных с лимфоцитарным (А, Д), эозинофильным (Б, Е) и гигантоклеточным (В, Ж) миокардитом (указаны стрелками). Положительная реакция на нуклеокапсидный белок SARS-Cov-2 в клетках инфильтрата, отдельных кардиомиоцитах и периваскулярно (Г, стрелки), негативный контроль (З).
Сокращение: ИГХ — иммуногистохимическое.
Небактериальный тромбоэндокардит
Диагноз небактериального тромбоэндокардита (НБТЭ) поставлен на основании морфологического исследования эндомиокардиальных биоптатов ПЖ у 4 больных (22,2%). Его признаками были склероз
и утолщение эндокарда в сочетании с лимфоцитарными инфильтратами в нем; в одном случае в составе инфильтрата обнаруживались также эозинофилы. Во всех 4 случаях при микроскопическом исследовании выявлены пристеночные (париетальные) тромбы (рис. 1 а-в), которые не были диагностированы при ЭхоКГ и/или МРТ сердца. Отсутствовали также очевидные клинические проявления кардиоэмболического синдрома.
С целью выявления возможных клинических особенностей постковидного миокардита, протекающего с НБТЭ, проведено сопоставление больных с наличием и отсутствием НБТЭ (табл. 1). Небольшое количество пациентов с НБТЭ не позволяет оценивать достоверность выявленных различий, однако очевидной была более выраженная тяжесть течения болезни при наличии НБТЭ: эти больные имели больше размеры ЛЖ и всех остальных камер сердца, заметно более низкую фракцию выброса (ФВ) ЛЖ, более выраженную легочную гипертензию и регургитацию на митральном и трикуспидальном клапанах, нарушение диастолической функции по рестриктивному типу. Единственный случай внутрипредсердного тромбоза отмечен у больного с НБТЭ и мерцательной аритмией.
Таблица 1
Сопоставление клинических, ЭхоКГ-параметров и результатов лечения у больных с НБТЭ и без него
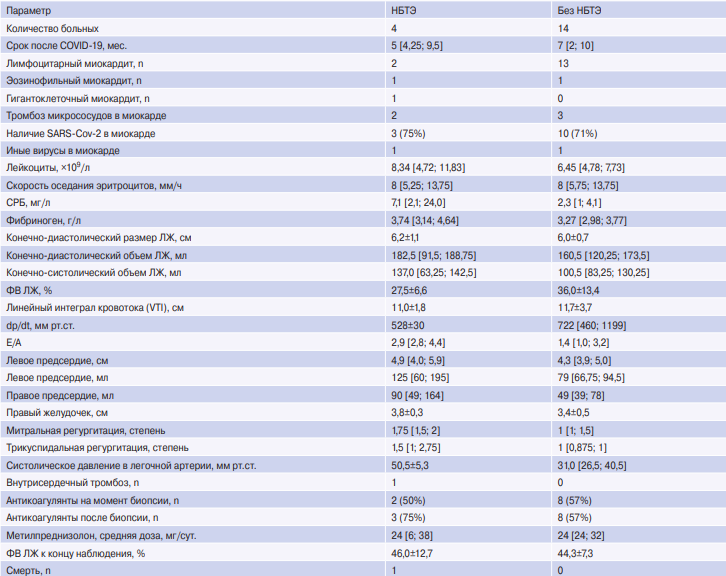
Сокращения: ЛЖ — левый желудочек, НБТЭ — небактериальный тромбоэндокардит, СРБ — С-реактивный белок, ФВ — фракция выброса, COVID-19 — новая коронавирусная инфекция, SARS-Cov-2 — Severe acute respiratory syndrome-related coronavirus 2.
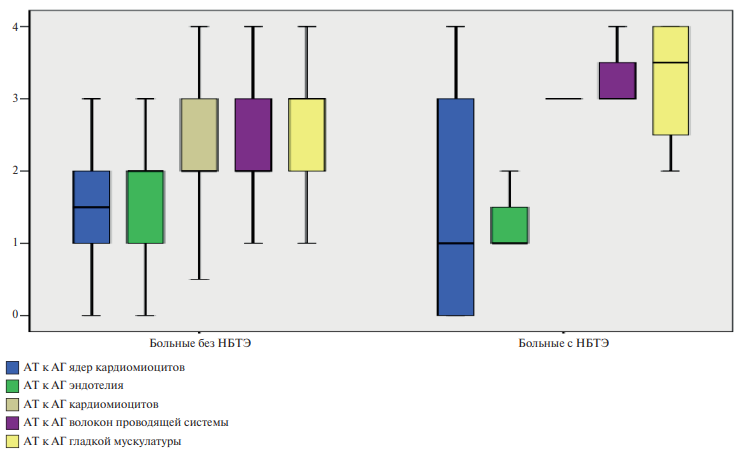
Рис. 2. Сопоставление уровня АКА у больных с НБТЭ и без него.
Примечание: по оси ординат отложен уровень АКА (степень повышения в разах по отношению к норме): 1 — 1:40, 2 — 1:80, 3 — 1:160, 4 — 1:320. Цветное изображение доступно в электронной версии журнала.
Сокращения: АГ — антигены, АКА — антикардиальные антитела, АТ — антитела.
При сравнении спектра АКА (рис. 2) у больных с НБТЭ обратил на себя внимание более низкий титр антител к антигенам эндотелия, что обычно отражает их активное отложение в составе иммунных комплексов. В то же время оказались выше титры антител к антигенам кардиомиоцитов, гладкой мускулатуры и волокон проводящей системы, отражающих большую тяжесть повреждения различных структур миокарда в рамках иммунного воспаления.
НБТЭ диагностирован у пациентов с наиболее тяжелыми морфологическими вариантами миокардита — гигантоклеточным и эозинофильным (при втором случае эозинофильного миокардита НБТЭ найдено не было), у половины больных он сочетался с тромбозом микрососудов в миокарде. Не отмечено различий по частоте обнаружения SARS-Cov-2 в миокарде, приема антикоагулянтов к моменту проведения биопсии (примерно по 50%, во всех случаях непосредственно перед процедурой они временно отменялись). Результаты ЭМБ стали основанием для назначения антикоагулянтов пациенту с эозинофильным миокардитом, ранее их не получавшему. Ни в одном случае НБТЭ новых случаев эмболии, а также ИЭ, не отмечено.
Всем пациентам (за исключением погибшей) проводилась пероральная кортикостероидная терапия метилпреднизолоном, средняя доза в обеих подгруппах составила 24 мг/сут. Результаты лечения прослежены не <3 мес. у 10 больных, у которых отмечено достоверное возрастание ФВ в соответствии с отчетливым клиническим улучшением (табл. 1). Внезапная смерть (единственная) развилась у больной с гигантоклеточным миокардитом и НБТЭ.
ИЭ
Диагноз ИЭ поставлен на основании комплекса клинико-инструментальных данных одному пациенту. Приводим описание данного клинического случая.
Больной 39 лет поступил в клинику 05.03.2021 с жалобами на одышку при минимальных физических нагрузках, учащенное сердцебиение, колющие боли в области сердца, выраженную слабость, ноющие боли в конечностях, которые требуют приема нестероидных противовоспалительных препаратов (НПВП); потерю в весе около 20 кг в течение полугода.
Брат страдает сахарным диабетом 1 типа, родители страдали диабетом 2 типа. Живет в Чечне, до болезни работал персональным водителем; вредных привычек нет. В детстве выявлен двустворчатый АК, физические нагрузки переносил хорошо. В июле 2020г в течение недели отмечал повышение температуры до 380С, общую слабость, ломоту, что расценил как острую респираторную вирусную инфекцию. Не лечился, ко врачу не обращался. С конца августа — подъемы температуры до 38,50С с ознобом, потливость, слабость, преходящие боли в крупных суставах, отечность голеней и стоп. На фоне приема парацетамола, НПВП сохранялся субфебрилитет. С октября — устойчивая лихорадка, одышка при умеренной нагрузке, мелкоточечная сыпь в области обеих голеней. Госпитализирован в Красногорскую больницу. При ЭхоКГ ФВ 60%, камеры сердца не расширены, выраженный кальциноз створок АК, регургитация 1 ст., гемоглобин 97 г/л, лейкоциты 11×109/л, скорость оседания эритроцитов 54 мм/ч, С-реактивный белок (СРБ) 118 мг/л, аланинаминотрансфераза 61 ед/л, аспартатаминотрансфераза 71 ед/л, РФ 49 ед/л, антитела к циклическому цитруллин-содержащему пептиду отр.; данных за пневмонию (КТ), эндокардит не получено. Состояние расценено как ревматоидный артрит, начата терапия сульфасалазином 1,0 г/сут., препаратами железа. В течение 2 нед. сыпь регрессировала.
С декабря самостоятельно отменил лечение изза отсутствия эффекта; потерял в весе около 20 кг. В конце декабря с нарастанием одышки и кашлем госпитализирован в г. Грозный. При КТ-признаки интерстициального отека легких, двустороннего плеврального выпота, лимфаденопатия; проведена пункция справа, эвакуировано 1200 мл. При ЭхоКГ от 25.12.2020 ФВ 33%, полость ЛЖ расширена, на
створках АК гиперэхогенные округлые наложения. В течение 2 нед. проводилась антибактериальная терапия (цефтриаксон, метрогил) с регрессом лихорадки, инфузии преднизолона 60 мг, далее метипред 4 мг/сут. Выписан с некоторым улучшением. В январе 2021г нарастание одышки; при повторной плевральной пункции эвакуировано 1850 мл жидкости. Проведено лечение преднизолоном 60 мг № 6, цефазолином, фуросемидом, верошпироном, карведилолом 6,25 мг/сут. с положительной динамикой. В феврале обследован в НИИ ревматологии, данных за системное заболевание соединительной ткани не получено. Самостоятельно обратился в кардиологическое отделение ФТК им. В. Н. Виноградова, немедленно госпитализирован в клинику.
При поступлении состояние тяжелое. Температура 36,60С. Индекс массы тела 20,07 кг/м2. Кожные покровы бледные, с землистым оттенком. Отеков нет. Частота дыхательных движений 19 в мин, в легких дыхание жесткое, ослаблено в базальных отделах, хрипов нет. Тоны сердца ослаблены, выслушиваются систолический шум с эпицентром над аортой, диастолический шум в точке Боткина. Частота сердечных сокращений 102 в мин, ритм правильный, артериальное давление 80/60 мм рт.ст. Печень выступает из-под края реберной дуги на 5 см, пальпируется нижний полюс селезенки.
На следующий день (на фоне отмены НПВП) отмечена лихорадка до 390С с ознобом и усугублением гипотонии. В анализах крови — гипохромная анемия (гемоглобин 84-99 г/л, цветовой показатель 0,75, сывороточное железо 15,8 мкмоль/л, ферритин 1832,1 мкг/л), воспалительная диспротеинемия, нарастание нейтрофильного лейкоцитоза (12,3-19,4 тыс.), уровня СРБ (17,5-177,3 мг/л), Д-димера (1,18-3,99 мкг/л), признаков цитолиза и холестаза (аспартатаминотрансфераза до 5016 ед/л, аланинаминотрансфераза до 3993 ед/л, гамма-ГТ до 210 ед/л, щелочная фосфатаза до 591 ед/л, общий билирубин до 27,8 мкмоль/л) при отсутствии печено-клеточной и почечной недостаточности. Уровень тропонина в пределах нормы. В анализах мочи — небольшая протеинурия и лейкоцитурия. Переведен в отделение реанимации, где проводилась вазопрессорная поддержка.
На ЭКГ — синусовая тахикардия без признаков ишемии и гипертрофии миокарда (рис. 3 а). При Холтеровском мониторировании ЭКГ значимых нарушений ритма не выявлено. По данным ЭхоКГ левые камеры увеличены (конечно-диастолический размер ЛЖ 6,4 см, 3,72 см/м2, конечно-диастолический объем 204 мл, конечно-систолический объем 136 мл, левое предсердие 78 мл), систолическая функция резко снижена (ФВ 25%, VTI 14 см, dp/dt 909 мм рт.ст.), систолическое давление в легочной артерии 40 мм рт.ст. Створки двустворчатого АК уплотнены, аортальный стеноз, аортальная регургитация II степени (рис. 3 в), митральная и тиркуспидальная I степени. При чреспищеводной ЭхоКГ площадь аортального отверстия 1,1 см2, в области правой комиссуры визуализируется эхопозитивное подвижное образование 0,3×0,5 см (рис. 2 б), скорость на АК 441 см/с, максимальный и средний градиент 77 и 42 мм рт.ст. (тяжелый аортальный стеноз с недостаточностью II степени).
При посеве крови на высоте лихорадки роста микрофлоры не получено, однако значительно повышен уровень прокальцитонина (1,94 нг/мл при норме <0,07). На основании большого и не менее 4 малых критериев (фебрильная лихорадка, гипохромная анемия, воспалительные изменения в крови, увеличение селезенки, артрит/артралгии) диагностирован ИЭ двустворчатого АК. В течение 4 нед. проводилась в/в эмпирическая антибактериальная терапия ванкомицином 2 г/сут. и цефтриаксоном 2 г/сут., в результате которой температура тела стойко нормализовалась, уровень прокальцитонина снизился до нормы, СРБ — до 15,75 мг/л; постепенно регрессировали явления цитолиза и холестаза, однако сохранялись анемия (до 80 г/л), которая приобрела черты железодефицитной, нейтрофильный лейкоцитоз (11,5 тыс.).
Одновременно высоковероятным представлялось наличие тяжелого миокардита: в его пользу говорили, помимо анамнеза и тяжелой дисфункции миокарда, повышение уровня АКА (к антигенам ядер кардиомиоцитов и вставочных дисков 1:160, волокон проводящей системы — 1:320) и данные МРТ сердца: признаки отёка миокарда по заднеперегородочному сегменту ЛЖ и субэпикардиальное отсроченное накопление, удлинение времени Т1 релаксации "нативного" миокарда по всем сегментам ЛЖ на среднем уровне (2 основных критерия Lake Louise 2018г, рис. 4 Г, Е). Подтверждено развитие тяжелого аортального порока (площадь отверстия 0,9 см2, рис. 4 Д), ФВ составила 26%. Маркеров ВИЧ, вирусных гепатитов, а также ДНК вирусов герпетической группы, способных индуцировать миокардит с гепатитом, в крови не выявлено. Эпизод тяжелого гепатита в клинике расценен как ишемический. Проведено в в вливание 50 г иммуноглобулина с целью воздействия как на инфекционный, так и на иммунный компонент болезни.
Природа миокардита оставалась не вполне ясной. Несмотря на подавление активности ИЭ, тяжелая систолическая дисфункция сохранялась (ФВ 29% через 3 нед. лечения), стойкая гипотония не позволяла начать адекватную кардиотропную терапию. Сохранялась одышка на уровне 3 функционального класса. Можно было думать о миокардите в рамках ИЭ (как иммунном, так и бактериальном), COVID-19 (вирус-позитивном или аутоиммунном), а также о вирусном миокардите иной этиологии и тяжелых формах аутоиммунного миокардита (гигантоклеточном, например). При МСКТ органов грудной клетки наряду с поствоспалительными изменениями в легких отмечена внутригрудная лимфаденопатия. С целью верификации миокардита и, главным образом, уточнения его природы и показаний к лечению, выполнена ЭМБ.
При исследовании биоптатов ПЖ данных за активный эндокардит не получено (рис. 4 Б). Методом ПЦР в миокарде и крови не обнаружено ДНК кардиотропных вирусов (аденовирусов, парвовируса В19, герпетических вирусов), 26 потенциальных бактериальных возбудителей ИЭ. При посеве биоптата эндомиокарда роста микрофлоры также не было. В миокарде выявлены несомненные признаки миокардита (кардиомиоциты с фокусами лизиса цитоплазмы и ядер, интерстиций отечен, лимфогистиоцитарные элементы >14 при большом увеличении, эндотелиит и продуктивный васкулит, слабо выраженный перимускулярный склероз, рис. 4 А), подтвержденного результатами ИГХ исследования (рис. 4 В, Г). Кроме того, обнаружены спайк-белок и нуклеокапсидный белок SARS-Cov-2 преимущественно в клетках инфильтратов и эндотелия сосудов, методом ПЦР выявлена РНК SARS-Cov-2 в миокарде.
Таким образом, миокардит идентифицирован как SARS-Cov-2-позитивный активный лимфоцитарный, что в совокупности с титрами АКА свидетельствовало о высокой иммунной активности болезни. Повышения уровня антител к цитоплазме нейтрофилов не отмечено, фтизиатром не выявлено данных за активный туберкулез. С учетом этих данных, а также резистентной к лечению систолической дисфункции и невозможности хирургического лечения порока в этих условиях (как и трансплантации сердца у больного с ИЭ) с 1 апреля начата ИСТ метилпреднизолоном в стартовой дозе 32 мг/сут. В течение недели продолжена терапия цефтриаксоном, далее — линезолидом 1200 мг/сут. внутрь (отменен в связи с развитием тромбоцитопении через неделю). Лихорадка не рецидивировала. Проводилась также терапия спиронолактоном 50 мг, фуросемидом 80 мг, карведилолом 3,125 мг (с постепенным увеличением до 12,5 мг), фебуксостатом, феринжектом, пантопразолом, флюконазолом, в связи с манифестацией сахарного диабета (гликемия после еды до 26 ммоль/л) начата терапия инсулином.
Состояние больного улучшилось, заметно уменьшилась одышка, регрессировали воспалительные изменения в крови (СРБ 0 мг/л). Через 3 мес. ФВ возросла до 42% и сохранялась на этом уровне, пациент вернулся к привычному образу жизни и умеренным нагрузкам, прибавил в весе 5 кг. В связи с сохранением тяжелого аортального порока, который препятствовал дальнейшему улучшению, 29 сентября (на фоне постепенного снижения дозы метилпреднизолона до 4 мг/сут.) в РНЦХ им. акад. Б.В. Петровского выполнено протезирование АК механическим протезом SJM Regent 21 (хирург Е. П. Евсеев). При ревизии АК моностворчатый (сращения между створками), фиброзирован, в области комиссур массивные конгломераты кальция, кальцинированные вегетации на створках до 5 мм, в области митрально-аортального перехода вскрывшаяся полость абсцесса с участками кальциноза. При посеве удаленного клапана роста не получено, послеоперационный период протекал без лихорадки и осложнений. В интраоперационных биоптатах — несомненные признаки бактериального эндокардита клапана (рис. 4 Д), сохраняющаяся лимфоцитарная инфильтрация в миокарде (рис. 4 Е). Методом ПЦР не выявлено РНК SARS-Cov-2 в миокарде. Продолжена терапия метилпреднизолном 4 мг/сут. В ноябре 2021г пациент уехал из России, самочувствие полностью нормализовалось, нагрузки переносит хорошо, приступил к регулярным спортивным тренировкам (бег по пересеченной местности).
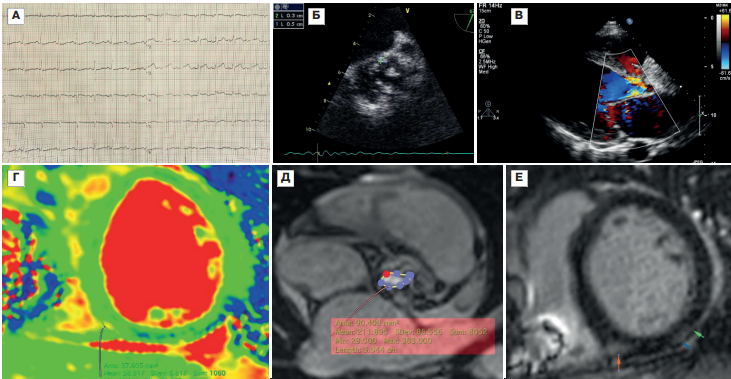
Рис. 3. Результаты инструментального обследования больного с сочетанием постковидного миокардита и ИЭ.
Примечание: А — ЭКГ, скорость записи 25 мм/с (синусовая тахикардия); Б, В — ЭхоКГ, вегетация на створке двустворчатого аортального клапана (Б), поток аортальной регургитации (В); Г-Е — МРТ сердца с контрастированием, отек по заднеперегородочному сегменту ЛЖ (Г, Т2) и субэпикардиальное отсроченное контрастирование по заднему сегменту ЛЖ на базальном уровне с распространением на средний (Е, стрелки), выраженное сужение аортального отверстия (Д).
Сокращения: ЛЖ — левый желудочек, МРТ — магнитно-резонансная томография, ЭКГ — электрокардиография, ЭхоКГ — эхокардиография.
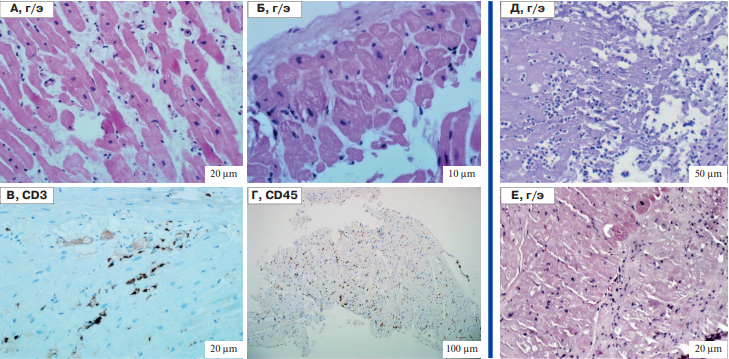
Рис. 4. Результаты морфологического исследования сердца по данным эндомиокардиальной и интраоперационной биопсии.
Примечание: А-Г — эндомиокардиальные биоптаты правого желудочка; дистрофия и гибель кардиомиоцитов в сочетании с лимфогистиоцитарной инфильтрацией в миокарде (А), склероз и утолщение эндокарда без признаков воспаления (Б), наличие >7 CD3-позитивных клеток (В) и >14 CD45-позитивных клеток (Г) на 1 мм2 при ИГХ исследовании подтверждает диагноз лимфоцитарного миокардита; Д и Е — интраоперационные биоптаты эндокарда удаленного аортального клапана (Д, диффузная нейтрофильная инфильтрация) и миокарда левого предсердия (Е, лимфоцитарная инфильтрация); г/э — гематоксилин-эозин. Пояснения в тексте.
Сокращение: ИГХ — иммуногистохимическое.
Обсуждение
В настоящей работе впервые, насколько удалось установить, предпринята попытка анализа различного по механизмам эндокардита у больных с постковидным миокардитом. Во всех случаях диагноз как мио-, так и эндокардита был подтвержден морфологически (с помощью прижизненной ЭМБ, в одном случае — с повторной интраоперационной биопсией и в еще в одном — с аутопсией, которая сопоставлялась с данными ЭМБ).
На сегодня эти данные сами по себе уникальны. Если возможность развития миокардита в рамках острой COVID-19 неоднократно доказана с по - мощью ЭМБ и исследований аутопсийного материала [1][8], то исследований морфологически верифицированного постковидного миокардита практически нет. Несмотря на широкое обсуждение в литературе последнего года таких понятий, как long-COVID, постковидный синдром [9], частота миокардита как компонента этого синдрома оценивается лишь в единичных работах и на очень низком уровне (0,4% в течение года после болезни, вместе с перикардитом [10]), причем ни о какой морфологической диагностике речи не идет. Самый поздний срок после COVID-19, в который диагноз миокардита был подтвержден с помощью ЭМБ, составляет всего 1 мес. [4].
Ранее нами опубликован анализ первых 15 случаев постковидного миокардита, который был диагностирован на основании данных ЭМБ и/или МРТ сердца; показано, что клинически он проявляется в двух основных формах — аритмической и декомпенсированной [3]. Максимальная длительность персистенции SARS-Cov-2 в миокарде составила на тот момент 9 мес. Настоящая работа продолжает это исследование — в ней представлено 18 случаев только декомпенсированного и морфологически подтвержденного постковидного миокардита. В большинстве случаев (у 3/4 больных) он оказался SARS-Cov-2-позитивным, срок персистенции вируса в миокарде достигал 18 мес. после острой COVID-19, у 6 больных он составил 10 мес. и более (в среднем 6,5 [ 3,5; 10] мес.). Длительность персистенции вируса после ЭМБ нам неизвестна.
Наши данные позволяют говорить о персистенции SARS-Cov-2 в миокарде как об одном из ведущих механизмов хронического постковидного миокардита. Максимальный срок персистенции после COVID-19 (полтора года) отмечен у больной, которая в течение года после COVID-19 чувствовала себя удовлетворительно, через год была вакцинирована препаратом "Спутник V", а еще через 2 мес. развились симптомы тяжелого миокардита. Аналогичная ситуация (но при более сжатых сроках) отмечена у другой больной, которая не знала о перенесенной ранее COVID-19 (вакцинация проведена на фоне значимого повышения IgG к SARS-CoV-2). У нее также выявлена персистенция вируса в миокарде, что является неблагоприятным фоном для вакцинации и, по всей видимости, одним из важных факторов аутоиммунного ответа на последнюю.
Значение аутоиммунного механизма, наряду с персистенцией вируса, не вызывает сомнений практически у всех больных, включенных в исследование (уровень АКА был повышен в 3-4 раза у 17 из 18 больных). Единственный пациент без значимого повышения титров антител имел пограничный вируснегативный лимфоцитарный миокардит, ЭМБ проводилась через полгода после болезни. Можно предполагать, что оба механизма постковидного миокардита тесно взаимосвязаны — персистенция вируса является одним из важных условий поддержания напряженного аутоиммунного ответа, направленного против тканей сердца. В пользу этой гипотезы говорит также высокая частота гипериммунных форм миокардита (гигантоклеточного и эозинофильного, суммарно в 17%), частота которых в доковидный период была существенно ниже. Считалось также, что эти формы миокардита являются исключительно аутоиммунными, вируснегативными, но SARS-Cov-2 опровергает и это устойчивое представление.
Специальным предметом настоящего исследования стали частота и механизмы эндокардита у больных с постковидным миокардитом. Основной формой эндокардита у таких пациентов стал НБТЭ, диагностированный только при биопсии миокарда — ни ЭхоКГ, ни МРТ не выявляли вегетаций на клапанах (при наличии значимой регургитации, которая клинически рассматривалась как следствие дилатации желудочков) и пристеночного тромбоза, лишь один пациент имел внутрипредсердный тромбоз на фоне устойчивой мерцательной аритмии (несмотря на антикоагулянты). Подобное субклиническое течение весьма характерно для НБТЭ, который может никак себя не проявлять либо становиться фоном для развития ИЭ. Отсутствие видимых наложений на клапанах и тромбоэмболического синдрома могло быть результатом применения антикоагулянтов (у половины больных — до биопсии), которые широко используются при COVID-19 и могут сглаживать течение НБТЭ. Однако морфологически его диагноз не вызывает сомнений.
Вирусные эндокардиты тоже известны, однако их клиническая диагностика крайне затруднена. Полвека назад в эксперименте описан прямой Коксаки-вирусный эндокардит [11]; при ВИЧинфекции эндокардит чаще обусловлен вторичной бактериальной флорой; другие ассоциированные с иммунодефицитом вирусы (цитомегаловирус) сами могут вызывать эндокардит [12]. Вероятно, SARSCov-2 реализует все три механизма: прямое воздействие на эндокард с развитием лимфоцитарного воспаления, аутоиммунная реакция (с эозинофилией и тромбообразованием у ряда больных) и активация вторичной флоры вследствие иммунодефицита. Благоприятным фоном служит общий протромботический статус организма. Тем не менее описания различных форм эндокардита, ассоциированного с инфекцией SARS-Cov-2, немногочисленны, а случаи сочетания мио- и эндокардита при COVID-19 до сих пор не описаны. Уже в начале пандемии высказывалось предположение о том, что частота ИЭ может возрасти — вследствие как истинного роста заболеваемости, так и затрудненной и запоздалой диагностики у лихорадящих больных. Однако проведенное в Дании эпидемиологическое исследование показало, что частота ИЭ в первом квартале 2020г соответствовала этому показателю за период 2018-2019гг [13]. Более поздние исследования подобного рода нам не известны.
Из отдельных описаний эндокардита у больных с COVID-19 особый интерес представляют несколько случаев, в которых можно думать об одновременном поражении эндо- и миокарда (хотя сами авторы об этом не говорят). Так, описан пациент с двустворчатым АК и SARS-Cov-2 пневмонией, у которого, наряду с вегетациями на АК, выраженной аортальной регургитацией и абсцессом аортального кольца, развились атриовентрикулярная блокада I степени, депрессия сегмента ST, повышение уровня тропонина T и выраженная систолическая дисфункция; во время проведения КТ легких возникла полная атриовентрикулярная блокада с последующей асистолией, рефрактерной к адреналину и попыткам кардиостимуляции; результаты аутопсии не сообщаются [6].
В другом случае у больного 24 лет с протезированным по поводу ревматического порока сердца митральным клапаном была диагностирована COVID-19 с пневмонией, при ЭхоКГ определялся нормально функционирующий протез, ФВ 45%; 3 нед. спустя развились лихорадка с ознобом и анорексия, при чреспищеводной ЭхоКГ выявлена типичная вегетация на задней стенке митрального протеза, из крови получен рост Staphylococcus aureus [7]. Исходная терапия включала, наряду с азитромицином, гидроксихлорохин и кортикостероиды. Авторы отмечают, что роль стероидов в развитии ИЭ не ясна. Наш пациент с ИЭ также длительно получал мягкую ИСТ по поводу предполагаемого ревматоидного артрита (сульфасалазин, затем 4 мг метилпреднизолона), что могло способствовать прогрессированию ИЭ, но все же не было решающим фактором в его развитии. Эта коллизия не нова: по данным клиники им. Е.М. Тареева, у 56% больных ИЭ было ошибочно диагностировано системное иммунное заболевание либо ревматизм/миокардит [14]. Однако в последний год кортикостероиды заняли прочное место в лечении самой COVID-19, и оценить влияние такого лечения на частоту развития ИЭ еще, вероятно, предстоит.
Наконец, упомянем единственный случай прижизненной диагностики эндокардита с помощью ЭМБ, показанием для которой стало подозрение на миокардит через 3 мес. после COVID-19: достоверных критериев миокардита в биоптатах выявлено не было, но обнаружены утолщение эндокарда, нейтрофильная инфильтрация (позитивное ИГХ-исследование с антителами к миелопероксидазе); состояние расценено авторами как небактериальный эндокардит. На наш взгляд, клиническая картина заболевания (значительное повышение уровня тропонина, нарушение сократимости передней стенки ЛЖ при отсутствии тромбов и вегетаций, отсроченное контрастирование той же области при МСКТ и признаки повреждения миокарда по данным сцинтиграфии) в совокупности с умеренным интерстициальным фиброзом в миокарде по данным ЭМБ позволяют все же думать о сочетанном миокардите. Несмотря на нейтрофильный состав инфильтратов, эндокардит в данном случае не отвечает критериям ИЭ.
Описаны и типичные случаи тяжелого НБТЭ в рамках COVID-19 — к примеру, с развитием повторных ишемических инфарктов головного мозга, инфарктов почки и селезенки у пожилой больной с вегетациями на митральном и АК при отсутствии дефектов самих клапанов, тромбоза мозговых артерий, нарушений ритма сердца, отрицательных посевах крови и тестах на гиперкоагуляцию [15]. В пользу диагноза НБТЭ говорила также эффективность терапии гепарином в отсутствие антибиотиков. У наших пациентов с НБТЭ столь яркая клиническая картина не встретилась ни разу, однако стоит напомнить, что речь идет о хроническом постковидном эндокардите, давность развития которого неизвестна; к моменту его диагностики активность болезни отличалась от острой COVID-19, терапия антикоагулянтами также оказала свой эффект.
Случай истинного ИЭ у одного из наших пациентов наиболее сложен для понимания, хотя на первый взгляд соответствует всем критериям "классического" ИЭ. Ввиду негативной гемокультуры осталась неясной этиология ИЭ — можно предполагать участие особых, редких возбудителей на фоне вызванной персистирующим SARS-Cov-2 иммуносупрессии. Нельзя исключать роль прямого SARS-Cov-2 поражения эндокарда клапана (хотя нейтрофильный состав инфильтратов и формирование абсцесса заставляют все же думать о бактериальной флоре), а также предшествующего инфицированию НБТЭ. Можно предполагать и двойственную природу миокардита — иммунного в рамках ИЭ и SARS-Cov-2- аутоиммунного. О значимости иммунных механизмов миокардита говорят и результаты повторной биопсии миокарда (через полгода) — отмечена элиминация SARS-Cov-2 (на фоне стероидной терапии!) с сохранением миокардита.
Миокардит как иммунокомплексное осложнение ИЭ и его лечение — особая тема, которую нет возможности подробно обсуждать в данной публикации. Отметим лишь эволюцию взглядов на применение стероидов в этой ситуации: если в монографии 1978г А.А. Демин и Ал. А. Демин говорят о том, что "примерно у 90% умерших от бактериального эндокардита можно найти умеренный или выраженный миокардит" и рекомендуют средние дозы преднизолона (20-30 мг в сут.) "во вторую, иммуновоспалительную, стадию" или "во время бактериального шока с системными реакциями на эндотоксин" на протяжении 1-2 мес. [16], через 20 лет (1997) О.М. Буткевич и Т.Л. Виноградова сообщают о 3-кратном росте числа рецидивов ИЭ после лечения кортикостероидами и рекомендуют при иммунологическом варианте ИЭ 15-20 мг преднизолона только после получения эффекта от антибиотиков [17], то уже в 2013г В. П. Тюрин называет стероиды при ИЭ "терапией отчаяния" и считает единственным оправданным показанием к их назначению быстропрогрессирующий гломерулонефрит с угрозой развития почечной недостаточности [18]. Отметим, что в Европейских рекомендациях 2015г эта тема вообще обходится стороной.
Постковидный эндомиокардит вновь поставил на повестку дня вопрос о применении стероидов. Когда речь идет о сочетании вирусно-иммунного миокардита с НБТЭ, назначение стероидов в сочетании с антикоагулянтами представляется логичным. Однако сочетание миокардита с ИЭ создает серьезные трудности в лечении, с которыми редко приходится сталкиваться при "классическом" ИЭ. Миокардит в рамках постковидных иммунных осложнений протекает тяжело и требует проведения активной базисной терапии, которая выглядит очень рискованной на фоне сопутствующего бактериального (по сути, септического) процесса. Тем не менее наш опыт последовательного применения антибиотиков, в/в иммуноглобулина и лечебной (но все же не максимальной) дозы кортикостероидов с продолжением антибактериальной терапии говорит о несомненной эффективности такого лечения, которому в данной ситуации практически нет альтернатив.
Заключение
У больных, перенесших COVID-19, может развиваться тяжелый постковидный миокардит, независимо от тяжести острой COVID-19. Его основными механизмами являются длительная персистенция SARS-Cov-2 в миокарде (в среднем 6,5 [ 3,5; 10], до 18 мес. в настоящем исследовании) и развитие аутоиммунной реакции (повышение титров АКА отмечено у 94% больных), которая поддерживает воспаление и после элиминации вируса из миокарда. Отражением высокой иммунной активности является, по всей видимости, развитие, наряду с лимфоцитарным, таких форм миокардита, как гигантоклеточный и эозинофильный (суммарно в 17% представленных случаев, у всех 3 больных в сочетании с персистенцией вируса). Частота развития эндокардита у больных с морфологически верифицированным постковидным миокардитом составила 28%, в т.ч. один случай ИЭ и 4 — НБТЭ. При отсутствии ярких клинических проявлений последнего, всех больных с эндокардитом отличали существенно более выраженная дисфункция миокарда и большая частота тромбоза микрососудов в миокарде, а также большая частота наиболее тяжелых морфологических вариантов аутоиммунного миокардита (в сочетании с персистенцией SARS-Cov-2). Требует дальнейшего изучения эффективность и безопасность кортикостероидной терапии в сочетании с антикоагулянтами у больных с НБТЭ, и даже при развитии ИЭ стероиды могут рассматриваться как препараты выбора в лечении миокардита (в сочетании с антибиотиками и иммуноглобулином).
Благодарности. Авторы выражают благодарность сотрудникам 52-й городской клинической больницы г. Москвы и МОНИКИ им. М.Ф. Владимирского В.А. Зайденову и А. Г. Куприяновой (выполнявшим исследование крови на АКА), сотрудникам ООО "ДНК-диагностика" В.В. Кадочниковой и А. Е. Донникову, а также сотруднику ФГБНУ НИИ нормальной физиологии им. П.К. Анохина П.В. Никитину, проводившим исследования биоптатов миокарда на ДНК кардиотропных вирусов и РНК SARS-Cov-2.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Коган Е.А., Куклева А.Д., Березовский Ю.С. и др. Клинико-морфологическая характеристика SARS-CoV-2-ассоциированного миокардита, подтвержденного наличием РНК и белков вируса в ткани миокарда. Архив патологии, 2021;83(4):5-13. doi:10.17116/patol2021830415.
2. Van Linthout S, Klingel K, Tschöpe C. SARS-CoV-2-related myocarditis-like syndromes Shakespeare’s question: what’s in a name? Eur J Heart Fail. 2020;22(6):922-5. doi:10.1002/ejhf.1899.
3. Благова О.В., Коган Е.А., Лутохина Ю.А. и др. Постковидный миоэндокардит подострого и хронического течения: клинические формы, роль персистенции коронавируса и аутоиммунных механизмов. Кардиология. 2021;61(6):11-27. doi:10.18087/cardio.2021.6.n1659.
4. Pietsch H, Escher F, Aleshcheva G, et al. Proof of SARS-CoV-2 genomes in endomyocardial biopsy with latency after acute infection. Int J Infect Dis. 2021;102:70-2. doi:10.1016/j.ijid.2020.10.012.
5. Choudhury I, Han H, Manthani K, et al. COVID-19 as a Possible Cause of Functional Exhaustion of CD4 and CD8 T-cells and Persistent Cause of Methicillin-Sensitive Staphylococcus aureus Bacteremia. Cureus. 2020;12(7):e9000. doi:10.7759/cureus.9000.
6. Toth E, Dancy L, Amin-Youssef G, et al. Collateral implications of the COVID-19 pandemic: belated presentation of infective endocarditis in a young patient. Eur Heart J. 2020;41(45):4365. doi:10.1093/eurheartj/ehaa633.
7. Alizadehasl A, Salehi P, Roudbari S, Peighambari MM. Infectious endocarditis of the prosthetic mitral valve after COVID-19 infection. Eur Heart J. 2020;41(48):4604. doi:10.1093/eurheartj/ehaa852.
8. Escher F, Pietsch H, Aleshcheva G, et al. Detection of viral SARS-CoV-2 genomes and histopathological changes in endomyocardial biopsies. ESC Heart Fail. 2020;7(5):2440-7. doi:10.1002/ehf2.12805.
9. Doykov I, Hällqvist J, Gilmour KC, et al. ‘The long tail of Covid-19’ — The detection of a prolonged inflammatory response after a SARS-CoV-2 infection in asymptomatic and mildly affected patients. F1000Res. 2020;9:1349. doi:10.12688/f1000research.27287.2.
10. Maestre-Muñiz MM, Arias Á, Mata-Vázquez E, et al. Long-Term Outcomes of Patients with Coronavirus Disease 2019 at One Year after Hospital Discharge. J Clin Med. 2021;10(13):2945. doi:10.3390/jcm10132945.
11. Burch GE, Tsui CY. Evolution of Coxsackie viral valvular and mural endocarditis in mice. Br J Exp Pathol. 1971;52(4):360-4.
12. Stear TJ, Shersher D, Kim GJ, Smego DR. Valvular Cytomegalovirus Endocarditis. Ann Thorac Surg. 2016;102(2):e105-7. doi:10.1016/j.athoracsur.2016.01.074.
13. Havers-Borgersen E, Fosbøl EL, Butt JH, et al. Incidence of infective endocarditis during the coronavirus disease 2019 pandemic: A nationwide study. Int J Cardiol Heart Vasc. 2020;31:100675. doi:10.1016/j.ijcha.2020.100675.
14. Таранова M.B., Белокриницкая O.A., Козловская Л.В., Мухин H.A. "Маски" подострого инфекционного эндокардита. Терапевтический архив. 1999;(1):47-50.
15. Balata D, Mellergård J, Ekqvist D, et al. Non-Bacterial Thrombotic Endocarditis: A Presentation of COVID-19. Eur J Case Rep Intern Med. 2020;7(8):001811. doi:10.12890/2020_001811.
16. Демин А.А., Демин Ал.А. Бактериальные эндокардиты. М., 1978.
17. Буткевич О.М., Виноградова Т.Л. Инфекционный эндокардит. М. СТАР`Ко, 1997, 94 с.
18. Тюрин В.П. Инфекционные эндокардиты. Москва ГЭОТАР-Медиа, 2013. 368 с.
Об авторах
О. В. БлаговаРоссия
Доктор медицинских наук, профессор кафедры факультетской терапии № 1 института клинической медицины им. Н.В. Склифосовского
Москва
Д. Х. Айнетдинова
Россия
Кандидат медицинских наук, врач отделения кардиологии № 2 Факультетской терапевтической клиники им. В. Н. Виноградова Университетской клинической больницы № 1
Москва
Е. А. Коган
Россия
Доктор медицинских наук, профессор, заведующая кафедрой патологической анатомии им. акад. А.И. Струкова института клинической медицины им. Н. В. Склифосовского
Москва
Ю. А. Лутохина
Россия
Кандидат медицинских наук, доцент кафедры факультетской терапии № 1 института клинической медицины им. Н. В. Склифосовского
Москва
В. М. Новосадов
Россия
Аспирант кафедры факультетской терапии № 1 института клинической медицины им. Н.В. Склифосовского
Москва
Конфликт интересов:
аспирант
П. О. Савина
Россия
Аспирант кафедры факультетской терапии № 1 института клинической медицины им. Н.В. Склифосовского
Москва
А. Ю. Зайцев
Россия
Кандидат медицинских наук, врач рентгенодиагностического отделения ангиографии Университетской клинической больницы № 1
Москва
А. Д. Куклева
Россия
Ассистент кафедры патологической анатомии им. акад. А.И. Струкова института клинической медицины им. Н.В. Склифосовского
Москва
С. Е. Рубцова
Россия
Врач отделения ультразвуковой диагностики Университетской клинической больницы № 1
Москва
С. Н. Кривцова
Россия
Врач отделения ультразвуковой диагностики Университетской клинической больницы № 1
Москва
А. В. Недоступ
Россия
Доктор медицинских наук, профессор, профессор кафедры кардиологии, функциональной и ультразвуковой диагностики института клинической медицины им. Н.В. Склифосовского
Москва
Дополнительные файлы
Рецензия
Для цитирования:
Благова О.В., Айнетдинова Д.Х., Коган Е.А., Лутохина Ю.А., Новосадов В.М., Савина П.О., Зайцев А.Ю., Куклева А.Д., Рубцова С.Е., Кривцова С.Н., Недоступ А.В. Инфекционный и небактериальный тромбоэндокардит у больных с постковидным вирусно-иммунным миокардитом. Российский кардиологический журнал. 2022;27(9):4827. https://doi.org/10.15829/1560-4071-2022-4827
For citation:
Blagova O.V., Ainetdinova D.Kh., Kogan E.A., Lutokhina Yu.A., Novosadov V.M., Savina P.O., Zaitsev A.Yu., Kukleva A.D., Rubtsova S.E., Krivtsova S.N., Nedostup A.V. Infective and nonbacterial thrombotic endocarditis in patients with post-COVID-19 viral-immune myocarditis. Russian Journal of Cardiology. 2022;27(9):4827. (In Russ.) https://doi.org/10.15829/1560-4071-2022-4827

















































